抑制扩展青霉的方法及其应用与流程
本发明涉及青霉抑制方法,具体地,涉及一种抑制扩展青霉的方法及其应用。
背景技术:
扩展靑霉是发生靑霉病害的主要菌类,易于寄生于水果和蔬菜,扩展靑霉可以产生多种真菌毒素,如展青霉素,又称展青霉毒素、棒曲霉素、珊瑚青霉毒素,可以引起动物的胃肠道功能紊乱和不同器官的水肿和出血,导致腹泻、中毒等症状的发生;高剂量的甚至会致癌,致畸。据联合国粮农组织统计每年全世界有25%的食品受到霉菌毒素的污染,由此造成的经济损失达数千亿美元。因此,寻找有效抑制真菌生长和毒素的降解、去除技术显得尤为重要。水果蔬菜是人们日常生活中必需品,必须引起相当的重视。传统的抑菌主要包括化学药物方法、生物防治技术、物理防治技术,具体如下:
传统的抑菌一般采用化学药物方法(范宇,叶淑红.银杏黄酮对苹果扩展青霉的抑制机理[a].中国食品科学技术学会.中国食品科学技术学会第十三届年会论文摘要集[c].中国食品科学技术学会:2016:2;吴京平.新型植物源天然食品防腐剂及其抑菌性能[j].中国食品添加剂,2009,03:61-64;张腾霄,王斌,魏雅冬.15种药材脂溶性提取物对青霉孢子的抑制效果[j].山西农业科学,2016,09:1351-1355),其效果明显,杀菌快速,但是毒性大,污染强。
生物防治技术对抑制霉菌的生长具有良好的效果,污染小,但是其过程复杂,资金耗费大,其实际应用还有一定距离(付瑞敏;邢文会;张红;张丽琴;陈五岭.扩展青霉拮抗菌的选育及抑菌机制初探[j].食品工业科技,2016,(05):154-158;牛梦天.黄瓜枯萎病拮抗微生物的筛选及发酵[d].河北科技大学,2016)。
物理防治技术是利用辐射:γ射线(张莹,朱加进.电子束辐照技术及其在食品工业中的应用研究[j].食品与机械,2013,01:236-239+258.;范林林,韩鹏祥,冯叙桥,段小明,李萌萌,张蓓,蔡茜彤.电子束辐照技术在食品工业中应用的研究与进展[j].食品工业科技,2014,14:374-380.;liu,r.,etal.,degradationofafb1inaqueousmediumbyelectronbeamirradiation:kinetics,pathwayandtoxicology.foodcontrol,2016.66:p.151-157)、紫外线(张小勇,倪芳妍,方晓璞,蒋敏.uva紫外灯辐照连续降解食用植物油中黄曲霉毒素b1的设备[j].中国油脂,2015,12:99-101.;赵建超,黄廷林,文刚,任崴,朱红.紫外-氯顺序灭活地下水源水中真菌的效能[j].环境工程学报,2016,12:6867-6872.),脉冲强光(南楠,袁勇军,戚向阳,孙智达,庄吟潮.脉冲强光技术及其在食品杀菌中的应用[j].食品工业科技,2010,12:405-408)、脉冲磁场(钱静亚,马海乐,李树君,刘斌,宋健宇,郭丹钊.脉冲磁场对枯草芽孢杆菌细胞膜流动性的影响[j].农业机械学报,2013,11:202-207.;钱静亚,马海乐,李树君,刘斌,张弨.温度、超声、nisin协同脉冲磁场杀灭枯草芽孢杆菌的研究[j].现代食品科技,2013,12:2970-2974)、红外辐射、微波辐射(basaran,p.;
近几年出现协同防治技术(姜雪,于鹏,肖杨,任璐,蔡涛,王辉,张均叶.天然抑菌剂与超高压协同作用的研究进展[j].食品科技,2016,02:296-299)。
目前的γ射线、脉冲强光、脉冲磁场、红外辐射、微波辐射、紫外等物理防治技术设备要求高或处理成本高,且具有一定的辐射污染风险,不适合于大规模的工业应用。
因此,如何提供一种无辐射污染风险、成本低廉、操作简单的抑制展青霉的方法是目前亟待解决的问题。
技术实现要素:
本发明的目的是提供一种抑制扩展青霉的方法及其应用,该方法无辐射污染风险、成本低廉、操作简单、无二次污染,具有较高的推广应用价值。特别适合在食品及其他需要抑制扩展青霉的场合中对扩展青霉的生长进行抑制。
为了实现上述目的,本发明提供了一种抑制扩展青霉的方法,所述方法包括在扩展青霉生长过程中,用光照射扩展青霉的步骤,其中,所述光为蓝光、绿光、红光和黄光中的一种或多种。
本发明还提供一种如前文所述的抑制扩展青霉的方法在需要抑制扩展青霉的场合中的应用。
通过上述技术方案,本发明在扩展青霉生长过程中,应用蓝光、绿光、红光和黄光中的一种或多种照射扩展青霉,即可实现对扩展青霉的抑制效果,该方法无辐射污染风险、成本低廉、操作简单、无二次污染,具有较高的推广应用价值,特别适合在食品及其他需要抑制扩展青霉的场合中对扩展青霉的生长进行抑制。
本发明的其他特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
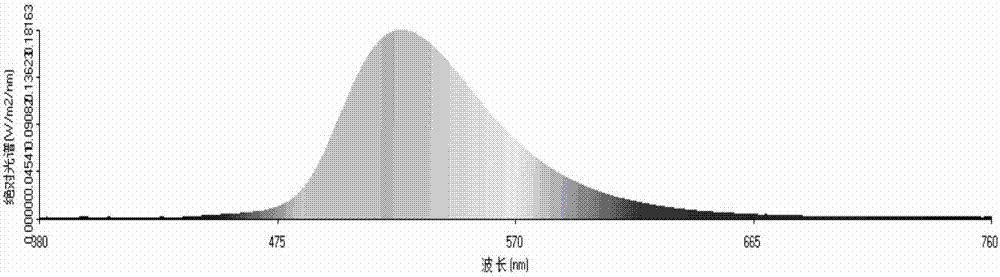
图1是本发明实施例中应用的蓝led灯的光谱曲线;
图2是本发明实施例中应用的绿led灯的光谱曲线;
图3是本发明实施例中应用的红led灯的光谱曲线;
图4是本发明实施例中应用的黄led灯的光谱曲线;
图5是本发明检测例1中分析的菌落的生长情况。
具体实施方式
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
本发明提供了一种抑制扩展青霉的方法,所述方法包括在扩展青霉生长过程中,用光照射扩展青霉的步骤,其中,所述光为蓝光、绿光、红光和黄光中的一种或多种。
通过上述技术方案,本发明在扩展青霉生长过程中,应用蓝光、绿光、红光和黄光中的一种或多种照射扩展青霉,即可实现对展青霉的抑制效果,该方法无辐射污染风险、成本低廉、操作简单,具有较高的推广应用价值。特别适合在食品及其他需要抑制扩展青霉的场合中对扩展青霉的生长进行抑制。
在上述技术方案中,扩展青霉的生长基体可以为食品或食品原料,也可以是其他需要抑制扩展青霉生长的基体,生长基体的改变不会影响本发明的技术效果。在后文的实施例中,以培养基进行说明。
在后文的实施例中,使用的培养基为pda固体培养基,所述培养基的配方为:葡萄糖20g,琼脂15g,水1000ml,按培养基配方称取去皮土豆新鲜马铃薯200g,土豆切成小块放入锅中,加水1000ml,在加热器上加热至沸腾,维持20-30min,用可用2层纱布趁热在量杯上过滤,滤渣弃取,滤液补充水分到1000ml,加热溶解,把滤液放入锅中,加入葡萄糖20g,琼脂150g,小火加热,并用玻棒不断搅拌,以防琼脂糊底或溢出,待琼脂完全溶解后,再补充水分至所需量,趁热将配制的培养基各取25ml分装入平板培养皿中,于121℃高温高压灭菌,待用。
然后取出4℃冰箱保存的扩展靑霉菌株接种于pda固体培养基上,即在扩展青霉生长过程中,用光照射扩展青霉。
在本发明中,所述蓝光的光照强度可以在宽的范围内选择,但是为了使扩展青霉能够更好地被抑制,优选地,所述蓝光的光照强度为750-1550lx。
其中,为了进一步地提高抑制效果,更优选地,所述蓝光的光照强度为1000-1550lx。
在本发明中,所述绿光的光照强度可以在宽的范围内选择,但是为了使扩展青霉能够更好地被抑制,优选地,所述绿光的光照强度为3000-6680lx。
其中,为了进一步地提高抑制效果,更优选地,所述绿光的光照强度为5000-6680lx。
在本发明中,所述红光的光照强度可以在宽的范围内选择,但是为了使扩展青霉能够更好地被抑制,优选地,所述红光的光照强度为900-1930lx。
其中,为了进一步地提高抑制效果,更优选地,所述红光的光照强度为1500-1930lx。
在本发明中,所述黄光的光照强度可以在宽的范围内选择,但是为了使扩展青霉能够更好地被抑制,优选地,所述黄光的光照强度为7500-15300lx。
其中,为了进一步地提高抑制效果,更优选地,所述黄光的光照强度为12000-15300lx。
在本发明一种更优选的实施方式中,为了进一步地提高扩展青霉的抑制效果,所述光的辐射照度(ee)为12-48w/m2。
在上述技术方案中,光照时间可在较宽范围内进行调整,为了提高扩展青霉的抑制效果,优选地,光照时间不小于40h。
为了节约成本并提高工作效率,更优选地,光照时间为40-60h。
在上述技术方案中,光照温度可在较宽范围内进行调整,为了提高扩展青霉的抑制效果,优选地,光照温度为20-37℃。
在上述技术方案中,对于光照强度的选择,可根据设备情况进行调节或设定。对于所述光的光照强度可选择特定具有调节光强的设备,再选择对应的光照强度,对于未知光强的设备,为了设定上述技术方案的光照强度,优选地,所述方法还包括对光进行光谱分析,筛选所述光的光照强度的步骤。
在上述技术方案中,光源可在较宽范围内进行选择,为了节约设备成本,优选地,所述光通过led光源提供。
本发明还提供一种如前文所述的抑制扩展青霉的方法在需要抑制扩展青霉的场合中的应用。
通过上述技术方案,本发明在扩展青霉生长过程中,应用蓝光、绿光、红光和黄光中的一种或多种照射扩展青霉,即可实现对扩展青霉的抑制效果,该方法无辐射污染风险、成本低廉、操作简单、无二次污染,具有较高的推广应用价值,特别适合在在食品及其它需要抑制扩展青霉的场合中对扩展青霉的生长进行抑制。
不仅如此,本发明提供的如前文所述的抑制扩展青霉的方法特别适合在食品中对扩展青霉进行抑制。该方法无辐射污染风险、成本低廉、操作简单、无二次污染,具有较高的推广应用价值。
以下将通过实施例对本发明进行详细描述。以下实施例中,蓝led灯、绿led灯、红led灯、黄led灯均购自绿米科技公司,型号为30cm*30cm面板灯,其他为常规市售品。
1、光照强度的分析
光谱分析蓝led灯、绿led灯、红led灯、黄led灯发出的对应光,结果分别对应图1、图2、图3、图4,可见,选择的上述led灯能够满足本发明的技术要求。
实施例1
第一步:配制pda固体培养基:葡萄糖20g,琼脂15g,水1000ml,按培养基配方称取去皮土豆新鲜马铃薯200g,土豆切成小块放入锅中,加水1000ml,在加热器上加热至沸腾,维持20-30min,用可用2层纱布趁热在量杯上过滤,滤渣弃取,滤液补充水分到1000ml,加热溶解,把滤液放入锅中,加入葡萄糖20g,琼脂150g,小火加热,并用玻棒不断搅拌,以防琼脂糊底或溢出,待琼脂完全溶解后,再补充水分至所需量,趁热将配制的培养基各25ml分装入平板培养皿中,于121℃高温高压灭菌,待用;
第二步:取出4℃冰箱保存的扩展靑霉菌株接种于pda固体培养基上;
第三步:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将蓝led灯的蓝光调至光照强度1504lx,于30℃照射48小时,此时辐射照度为辐射照度为46w/m2。
实施例2
按照实施例1的方法实施第一步和第二步,不同的是,第三步如此实施:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将蓝led灯的蓝光调至光照强度750lx,于37℃照射60小时。
实施例3
按照实施例1的方法实施第一步和第二步,不同的是,第三步如此实施:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将蓝led灯的蓝光调至光照强度1000lx,于20℃照射40小时。
实施例4
按照实施例1的方法实施第一步和第二步,不同的是,第三步如此实施:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将绿led灯的绿光调至光照强度6676lx,于30℃照射48小时,此时辐射照度为辐射照度为13.9w/m2。
实施例5
按照实施例1的方法实施第一步和第二步,不同的是,第三步如此实施:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将绿led灯的绿光调至光照强度3000lx,于37℃照射60小时。
实施例6
按照实施例1的方法实施第一步和第二步,不同的是,第三步如此实施:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将绿led灯的绿光调至光照强度5000lx,于20℃照射40小时。
实施例7
按照实施例1的方法实施第一步和第二步,不同的是,第三步如此实施:第三步:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将红led灯的红光调至光照强度1921lx,于30℃照射48小时,此时辐射照度为辐射照度为17.4w/m2。
实施例8
按照实施例1的方法实施第一步和第二步,不同的是,第三步如此实施:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将红led灯的红光调至光照强度900lx,于37℃照射60小时。
实施例9
按照实施例1的方法实施第一步和第二步,不同的是,第三步如此实施:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将红led灯的红光调至光照强度1500lx,于20℃照射40小时。
实施例10
按照实施例1的方法实施第一步和第二步,不同的是,第三步如此实施:第三步:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将黄led灯的黄光调至光照强度15281lx,于30℃照射48小时,此时辐射照度为辐射照度为34.6w/m2。
实施例11
按照实施例1的方法实施第一步和第二步,不同的是,第三步如此实施:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将黄led灯的黄光调至光照强度7500lx,于37℃照射60小时。
实施例12
按照实施例1的方法实施第一步和第二步,不同的是,第三步如此实施:将接种扩展靑霉菌株的pda固体培养基置于智能培养箱内培养,将黄led灯的黄光调至光照强度12000lx,于20℃照射40小时。
对比例1
按照实施例1的方法进行第一步和第二步,所不同的是,第三步为:在自然光条件下于智能培养箱内培养,30℃培养,48小时。
检测例1
观察各实施例1-12以及对比例1中菌落的生长情况,发现,实施例1-实施例12中对应的绿光、红光、黄光、蓝光照射的培养基中菌落与对比例1相比,菌落的生长均受到抑制,并且,随着光照时间的延长,光照强度的增大,菌落生长被抑制情况越明显。其中绿光、红光组的抑制作用基本一致,黄光、蓝光组抑制能力强于绿光、红光组,蓝光组抑菌能力最强。结果如图5所示,图中b对应实施例1,y对应实施例10、g对应实施例4、r对应实施例7,c对应对比例1。由图5可见,对比例1中的菌落生长良好,呈现绿色粉粒状,菌落面积大。
检测例2
用平板计数法确定每组的菌落数,用spss13.0软件分析显著性差异。发现实施例1-12中的菌落萌发数与对比例1相比,均有不同程度减少,经spss分析,实施例1-12中的菌落萌发数与对比例1相比,均有显著差异,并且,随着光照时间的延长,光照强度的增大,菌落生长被抑制情况越明显。实施例1、实施例4、实施例7和实施例10及对比例1中的结果如表1所示,可见,实施例与对比例之间呈显著性差异。其中,对青霉的抑制效果:蓝光>黄光>绿光>红光。
表1
检测例3
将实施例1-12中的菌落萌发数与对比例1培养的菌分别倒入100ml的离心管中(倒入之前离心管的质量m1),1000rpm,离心15min,弃上清液,放置到65℃烘箱烘干(12h)称其质量m2,则菌的干重为:m2-m1,用spss13.0软件分析显著性差异。
发现实施例1-12中的菌落干重与对比例1相比,均有不同程度减少,经spss分析,实施例1-12中的菌落萌发数与对比例1相比,均有显著差异,并且,随着光照时间的延长,光照强度的增大,菌落生长被抑制情况越明显。实施例1、实施例4、实施例7和实施例10及对比例1中的结果如表2所示,可见实施例与对比例之间呈显著性差异,各实施例之间不存在显著性差异。其中,蓝光、黄光、绿光、红光均对扩展青霉具有抑制效果。
表2
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
- 还没有人留言评论。精彩留言会获得点赞!