一种数字PCR引物及其定量检测副干酪乳杆菌含量的用途的制作方法
本发明涉及基因工程
技术领域:
,尤其涉及一种定量检测副干酪乳杆菌含量的数字pcr引物及其检测技术方法。
背景技术:
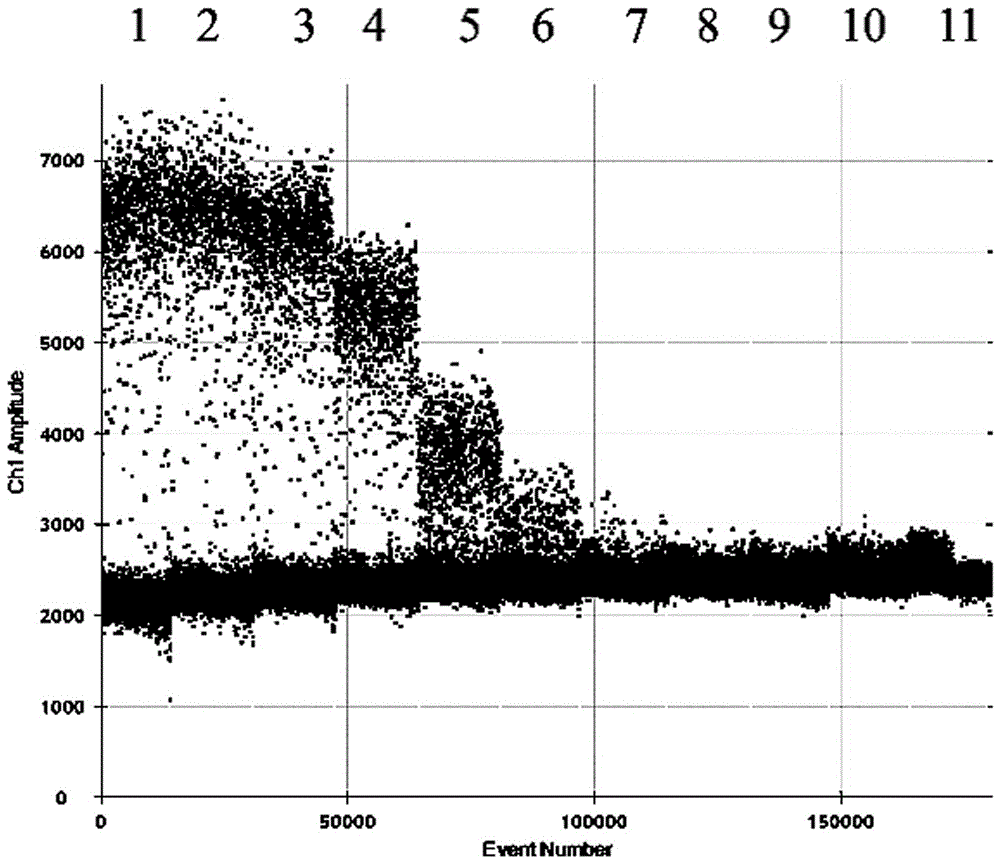
:副干酪乳杆菌(lactobacillusparacasei)为乳杆菌属干酪乳杆菌(lactobacilluscasei)的一个亚种,常被用作酸奶和干酪等乳制品的发酵剂或辅助发酵剂,是近年来研究较多的一种益生乳酸菌。副干酪乳杆菌菌数作为一个重要的数据需要反复的检测,然而传统的菌数检测方法繁琐检测周期较长难以满足现代工业生产的需求。数字pcr(digitalpcr,d的pcr)作为第三代pcr的技术代表,由vogelstein等提出。ddpcr是把一个样本的反应体系均匀分配到大量反应单元中,每个反应单元中不包含或包含一个到多个目的核酸序列,独立地进行pcr扩增,检测每个反应单元的荧光信号,最终根据泊松分布以及荧光信号阳性的反应单元数量占所有反应单元的比例,来计算目的核酸序列的拷贝数,ddpcr反应中荧光信号的产生过程基本与qpcr相同。目前,该技术已经在稀有突变检测、cnv分析和复杂样本基因表达检测等方面有着广泛的应用。目前尚未见利用微滴式数字pcr法定量检测副干酪乳杆菌的报道。技术实现要素:本发明要解决的技术问题是提供一种数字pcr引物及利用该引物定量检测副干酪乳杆菌含量的方法体系。为解决上述技术问题,本发明所采取的技术方案是:一种数字pcr引物,包含:上游引物如seqidno:1所示、下游引物如seqidno:2所示。本发明还涉及包含上述数字pcr引物的检测试剂盒。本发明还涉及上述数字pcr引物用于定量检测副干酪乳杆菌含量的用途。以上述数字pcr引物为基础,采用微滴式数字pcr方法定量检测副干酪乳杆菌的含量。作为本发明的一种优选技术方案,上述微滴式数字pcr方法包含如下步骤:a、dna的提取:取待测样品并提取其中的dna,保存备用;b、引物设计:引物对于检测结果的准度、精度、专一度起决定作用,直接采用权利要求1记载的引物;c、ddpcr反应体系的建立:2-50μl2×混合液,引物稀释到5-50μmol/l,上游引物和下游引物各加入0.5-5.0μl,将模板dna加入2-10μl,用ddh2o补至10-50μl;d、ddpcr检测方法的建立:将充分混匀的pcr反应体系转移到微滴发生卡中,并向微滴发生卡中加入10-100μldropletgenera-tionoil,将微滴发生卡放到微滴发生器中进行反应;随后将生成的微滴转移到ddpcr的96孔中,用封膜仪对96孔板封膜,准备进行pcr反应;ddpcr的反应程序:95℃预变性,10min;94℃变性,1min;56℃退火,45s;进行40个循环,98℃10min;e、检测结果的获取:ddpcr反应结束后将96孔板放入qx200dropletreader,依次录入样品信息,检测开始后仪器会按顺序自动识别每个样品的微滴,在微滴读取油的配合下微滴依次通过双色检测器,根据微滴发出的荧光信号的强度判定阳性和阴性结果,并记录下每个样品的阳性和阴性的微滴数;信号采集完毕后,软件quantasoft将计算出最终结果并以图像的形式给出。作为本发明的一种优选技术方案,步骤a中,dna提取的具体操作方法为:取0.5μl浓度为10mg/ml的pma溶液加入到1ml菌悬液中,pma终浓度为5μg/ml,充分混匀后,室温避光5min;用500w卤素灯曝光5min,且光源距离心管的垂直距离为20cm;曝光期间离心管置于冰上并持续摇晃离心管,避免局部过热和保证反应充分;曝光结束后12000r/min离心5min,弃上清,无菌水洗涤2次后重悬备用;使用细菌基因组dna提取试剂盒对上述菌体dna进行提取后-20℃保存备用。作为本发明的一种优选技术方案,步骤c中,所述模板dna用量为4μl;上游引物和下游引物的用量为1.2μl,引物稀释到10μmol/l。作为本发明的一种优选技术方案,步骤c中,所述2×混合液为2×evagreenqpcrmastermix,用量为10μl;所述ddh2o补齐至20μl。作为本发明的一种优选技术方案,步骤d中,所述dropletgenera-tionoil的用量为70μl。作为本发明的一种优选技术方案,检测完成后,利用微滴检测仪验证ddpcr对副干酪乳杆菌检测的特异性和灵敏度进行验证。采用上述技术方案所产生的有益效果在于:本发明构建了微滴式数字pcr技术应用到定量检测副干酪乳杆菌的体系方法,利用死细菌去除方法,结合ddpcr技术的精准定量,开发出定量检测方法,为生产企业的过程控制提供必要的技术保障,也为dpcr技术在其它污染菌和致病菌的检测推广奠定基础。附图说明图1为实施例5所得数字pcr扩增中的退火温度筛选的结果;图中,1:50.0℃;2:50.2℃;3:50.7℃;4:51.6℃;5:52.7℃;6:54.0℃;7:55.4℃;8:56.8℃;9:58.1℃;10:59.2℃;11:60.0℃;可见,数字pcr的退火温度最佳温度为50.2℃。图2为实施例6所得微滴检测仪生成得到结果;图中,1:副干酪乳杆菌(atcc4356),2:副干酪乳杆菌(cicc20241),3:副干酪乳杆菌(cicc20296),4:干酪乳杆菌(cicc6117)、5:鼠李糖乳杆菌(atcc7469)、6:植物乳杆菌(atcc8014),7:金黄色葡萄球菌(cicc10001),8:福氏志贺氏菌(cicc21534),9:氧化葡萄糖杆菌(cgmcc1.0637),10:醋化醋杆菌(cicc22519),11:汉氏葡糖醋杆菌(cgmcc1.811),12:瑞士乳杆菌(cicc6024),13:德氏乳杆菌(cicc6077),14:嗜热链球菌(cicc6223),15:肠炎沙门氏菌(cicc21482),16:科氏葡萄球菌(cicc23431),17:乙型溶血性链球菌(cicc10373),18:蜡样芽胞杆菌(cicc10041);由图可见没有基因扩增,可见本发明所设计引物的检出专一度优良。图3为实施例8所得不同浓度的副干酪乳杆菌进行ddpcr检测;图中,1:活菌培养物的平板计数浓度为3.3×106cfu/g;2:活菌培养物的平板计数浓度为3.3×105cfu/g;3:活菌培养物的平板计数浓度为3.3×104cfu/g;4:活菌培养物的平板计数浓度为3.3×103cfu/g;5:活菌培养物的平板计数浓度为3.3×102cfu/g;6:活菌培养物的平板计数浓度为3.3×101cfu/g;从图可知,金黄色葡萄球菌的活菌培养物的平板计数浓度为3.3×106cfu/g,灵敏度检测结果,因反应的原始模板浓度太高,无阴性微滴,数据无效;当原始模板浓度为3.3×101cfu/g时,检测出的拷贝数为0.20cpies/μl,所以,ddpcr方法检测金黄色葡萄球菌的计数灵敏度为3.3×101cfu/g。图4为实施例8中由不同微滴检测仪生成得到结果所制成的标准曲线;图中,为了验证ddpcr检测方法的可行性,将不同浓度副干酪乳杆菌进行ddpcr检测,分析计数结果与ddpcr检测结果的线性关系;可见,标准曲线显示r2大于0.99,说明ddpcr检测副干酪乳杆菌的灵敏度线性关系良好,也为ddpcr的进行绝对定量检测实际应用的范围进行了保障;ddpcr的实测灵敏度与计数灵敏度偏差率均低于25%,保证了ddpcr的进行绝对定量检测实际应用的可行性。具体实施方式下面结合附图和具体实施方式对本发明作进一步详细的说明。本发明各实施例中所使用的实验方法如无特殊说明,均为常规方法。并且各实施例中所用的材料及试剂等,如无特殊说明,均可从商业途径得到。本发明各实施例中部分材料为:引物(正向引物,反向引物)由上海生物工程公司合成;ezup柱式细菌基因组dna抽提试剂盒购自天根生物有限公司;2×evagreenqpcrmastermix、dropletgenerationoil、dropletreaderoil购自德国bio-rad品牌。本发明各实施例中部分仪器为:qx200dropletreader、dg8cartridge微滴生成卡、holder微滴发生器、pcr基因扩增仪均购自伯乐生命医学产品有限公司;nanodrop2000、全自动dna提取仪均购自美国thermo公司;超净工作台为苏州净化集团产品;高速离心机为thermo公司生产;高压灭菌锅为上海博迅公司生产;恒温培养箱为上海博迅公司生产;水浴锅、电子分析天平、显微镜、ph计、移液枪及其它辅助设备均为国内生产厂家生产。实施例1、食品中dna的提取。dna提取的具体操作方法为:取0.5μl浓度为10mg/ml的pma溶液加入到1ml菌悬液中(pma终浓度为5μg/ml),充分混匀后,室温避光5min。用500w卤素灯曝光5min,且光源距离心管的垂直距离为20cm。曝光期间离心管置于冰上并持续摇晃离心管,避免局部过热和保证反应充分。曝光结束后12000r/min离心5min,弃上清,无菌水洗涤2次后重悬备用。使用细菌基因组dna提取试剂盒对上述菌体dna进行提取后-20℃保存备用。实施例2、引物设计。引物的设计对于检测结果的准度、精度、专一度起决定作用。首先筛选出几十条副干酪乳杆菌基因组中保守性极强的特异性基因片段,最终选用phes基因,因为乳杆菌属的phes基因具有较大差异,种间差异一般高10%,以此为依据利用副干酪乳杆菌的phes基因设计出满足荧光定量实验要求的副干酪乳杆菌特异性引物,以其作为引物设计靶标序列,通过反复的设计、比对、分析、验证和修改,最终最终确定了最优的检测引物序列,如下表所示:组别引物序列(5'-3')扩增长度(bp)上游引物ttcaccagatggaaggactc(seqidno、1)274下游引物tcaatgttcgctgcctgt(seqidno、2)274实施例3、ddpcr反应体系的建立。ddpcr反应体系包括:2-50μl2×混合液,引物稀释到5-50μmol/l,上游引物和下游引物各加入0.5-5.0μl,将模板dna加入2-10μl,用ddh2o补至10-50μl。进过实验验证,2×混合液为2×evagreenqpcrmastermix,用量为10μl,将引物稀释到10μmol/l,上游引物和下游引物的用量为1.2μl,模板dna的用量为4μl,ddh2o补齐至20μl,微滴检测仪生成得到结果最好。实施例4、ddpcr检测方法的建立。将充分混匀的pcr反应体系转移到微滴发生卡中,并向微滴发生卡中加入10-100μldropletgenera-tionoil,将微滴发生卡放到微滴发生器中进行反应。随后将生成的微滴转移到ddpcr的96孔中,用封膜仪对96孔板封膜,准备进行pcr反应。ddpcr的反应程序:95℃预变性,10min;94℃变性,1min;56℃退火,45s;进行40个循环,98℃10min。ddpcr反应结束后将96孔板放入qx200dropletreader,依次录入样品信息,检测开始后仪器会按顺序自动识别每个样品的微滴,在微滴读取油的配合下微滴依次通过双色检测器,根据微滴发出的荧光信号的强度判定阳性和阴性结果,并记录下每个样品的阳性和阴性的微滴数。信号采集完毕后,软件quantasoft将计算出最终结果并以图像的形式给出。进过实验验证,dropletgenera-tionoil的用量为70μl,微滴检测仪生成得到结果最好。实施例5、ddpcr检测方法的温度优化。在设计ddpcr扩增的反应程序时,对ddpcr的退火温度进行优化。进过实验验证,ddpcr的退火温度最佳温度为50.2℃,所得图谱如附图1所示。图中,1:50.0℃;2:50.2℃;3:50.7℃;4:51.6℃;5:52.7℃;6:54.0℃;7:55.4℃;8:56.8℃;9:58.1℃;10:59.2℃;11:60.0℃;可见,数字pcr的退火温度最佳温度为50.2℃。实施例6、ddpcr对副干酪乳杆菌特异性检测验证。利用不同的菌株来验证副干酪乳杆菌特异性。其中,1:副干酪乳杆菌(atcc4356),2:副干酪乳杆菌(cicc20241),3:副干酪乳杆菌(cicc20296),4:干酪乳杆菌(cicc6117)、5:鼠李糖乳杆菌(atcc7469)、6:植物乳杆菌(atcc8014),7:金黄色葡萄球菌(cicc10001),8:福氏志贺氏菌(cicc21534),9:氧化葡萄糖杆菌(cgmcc1.0637),10:醋化醋杆菌(cicc22519),11:汉氏葡糖醋杆菌(cgmcc1.811),12:瑞士乳杆菌(cicc6024),13:德氏乳杆菌(cicc6077),14:嗜热链球菌(cicc6223),15:肠炎沙门氏菌(cicc21482),16:科氏葡萄球菌(cicc23431),17:乙型溶血性链球菌(cicc10373),18:蜡样芽胞杆菌(cicc10041)。将提取的dna分别稀释到浓度为103拷贝数,按照实施例1-5的方法的进行副干酪乳杆菌的特异性验证试验,所得图谱如附图2所示。图中,1:副干酪乳杆菌(atcc4356),2:副干酪乳杆菌(cicc20241),3:副干酪乳杆菌(cicc20296),4:干酪乳杆菌(cicc6117)、5:鼠李糖乳杆菌(atcc7469)、6:植物乳杆菌(atcc8014),7:金黄色葡萄球菌(cicc10001),8:福氏志贺氏菌(cicc21534),9:氧化葡萄糖杆菌(cgmcc1.0637),10:醋化醋杆菌(cicc22519),11:汉氏葡糖醋杆菌(cgmcc1.811),12:瑞士乳杆菌(cicc6024),13:德氏乳杆菌(cicc6077),14:嗜热链球菌(cicc6223),15:肠炎沙门氏菌(cicc21482),16:科氏葡萄球菌(cicc23431),17:乙型溶血性链球菌(cicc10373),18:蜡样芽胞杆菌(cicc10041);由图可见没有基因扩增,可见本发明所设计引物的检出专一度优良。实施例7、ddpcr对副干酪乳杆菌的绝对定量研究。根据从ncbi上查找出副干酪乳杆菌相应的靶基因在该菌的全基因组中存在的理论拷贝数,根据ddpcr得出金黄色葡萄球菌的实测拷贝数的结果,可计算出20μl的体系中存在的拷贝数,最终的实测灵敏度和偏差率的计算公式如下:实测灵敏度=20μl拷贝数×18.18(即:提取dna的体积/体系中模板体积)÷理论拷贝数;偏差率=(实测灵敏度-计数灵敏度)/计数灵敏度×100%。副干酪乳杆菌的理论拷贝数和实际检测结果拷贝数计算出实测灵敏度如下表所示。比较实测灵敏度和计数灵敏度的差值,当实测灵敏度大于计数灵敏度时,偏差率为正偏差;当实测灵敏度小于计数灵敏度时,偏差率为负偏差。结果显示,副干酪乳杆菌的实测灵敏度均略高于计数灵敏度,且经过偏差率计算,ddpcr的实测灵敏度与计数灵敏度偏差率均低于25%,保证了ddpcr的进行绝对定量检测实际应用的可行性。实施例8、ddpcr对副干酪乳杆菌的灵敏度研究。为了验证ddpcr检测方法的可行性,将不同浓度的副干酪乳杆菌进行ddpcr检测,分析计数结果与ddpcr检测结果的线性关系,所得图谱如附图3,4所示。图3中,1:活菌培养物的平板计数浓度为3.3×106cfu/g;2:活菌培养物的平板计数浓度为3.3×105cfu/g;3:活菌培养物的平板计数浓度为3.3×104cfu/g;4:活菌培养物的平板计数浓度为3.3×103cfu/g;5:活菌培养物的平板计数浓度为3.3×102cfu/g;6:活菌培养物的平板计数浓度为3.3×101cfu/g;从图可知,金黄色葡萄球菌的活菌培养物的平板计数浓度为3.3×106cfu/g,灵敏度检测结果,因反应的原始模板浓度太高,无阴性微滴,数据无效;当原始模板浓度为3.3×101cfu/g时,检测出的拷贝数为0.20cpies/μl,所以,ddpcr方法检测金黄色葡萄球菌的计数灵敏度为3.3×101cfu/g。图4中,为了验证ddpcr检测方法的可行性,将不同浓度副干酪乳杆菌进行ddpcr检测,分析计数结果与ddpcr检测结果的线性关系;可见,标准曲线显示r2大于0.99,说明ddpcr检测副干酪乳杆菌的灵敏度线性关系良好,也为ddpcr的进行绝对定量检测实际应用的范围进行了保障;ddpcr的实测灵敏度与计数灵敏度偏差率均低于25%,保证了ddpcr的进行绝对定量检测实际应用的可行性。综上可见,本发明构建了微滴式数字pcr技术应用到定量检测副干酪乳杆菌的体系方法,利用死细菌去除方法,结合ddpcr技术的精准定量,开发出定量检测方法,为生产企业的过程控制提供必要的技术保障,也为ddpcr技术在其它污染菌和致病菌的检测推广奠定基础。上述描述仅作为本发明可实施的技术方案提出,不作为对其技术方案本身的单一限制条件。序列表<110>河北省食品检验研究院河北农业大学<120>一种数字pcr引物及其定量检测副干酪乳杆菌含量的用途<160>2<170>siposequencelisting1.0<210>1<211>20<212>dna<213>人工序列(artificialsequence)<400>1ttcaccagatggaaggactc20<210>2<211>18<212>dna<213>人工序列(artificialsequence)<400>2tcaatgttcgctgcctgt18当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用