一种用于生产重组猪胰蛋白酶的发酵培养基的制作方法
本发明涉及生物技术工程领域,特别涉及一种用于生产重组猪胰蛋白酶的发酵培养基。
背景技术:
胰蛋白酶是一种丝氨酸蛋白酶,可于赖氨酸及精氨酸c末端剪切肽键,也可作为细胞消化液,用于细胞的分散。在基因工程领域,胰蛋白酶广泛应用于重组人胰岛素和胰岛素类似物的生产中,其酶活高低是影响胰岛素原活化收率的重要参数之一。
牛胰蛋白酶氨基酸残基有223个,分子量为23.8kd,猪胰蛋白酶的化学结构与牛胰蛋白酶十分相似,在氨基酸残基排列顺序中,只有41个氨基酸残基不同。
目前,胰蛋白酶主要有两种来源,第一种是从动物(猪、牛等)的胰脏中提取得到,其缺点是提取工艺复杂且价格昂贵,所提取得到的胰酶不纯,可能存在有糜蛋白酶、羧肽酶a等酶的污染,较大程度的限制了胰蛋白酶的应用。第二种是使用基因重组技术,利用微生物进行表达胰蛋白酶。本发明采用第二种方法,使用毕赤酵母表达系统表达重组猪胰蛋白酶,发酵表达的重组猪胰蛋白酶原酶活可达7851u/ml。
活性胰蛋白酶的形成对于细胞是有毒性的,活性胰蛋白酶水解周质中的蛋白质致使细胞溶解,所以大多使用大肠杆菌表达重组胰蛋白酶,以包涵体形式表达,中国专利cn105483104a公布了一种牛胰蛋白酶的生产工艺,利用大肠杆菌表达牛胰蛋白酶,酸化处理将包涵体蛋白变、复性,阳离子交换等步骤进行纯化得到牛胰蛋白酶。中国专利cn101967469a公布了一种高稳定性的重组胰蛋白酶的生产及应用,利用大肠杆菌实现了胰蛋白酶的可溶性表达,可获得高活性、高稳定性的胰蛋白酶。中国专利cn1545553a公布了生产重组胰蛋白酶的方法,采用巴斯德毕氏酵母表达猪胰蛋白酶,可溶性表达且分泌到培养基中,其中在ph3.0-4.0的表达防止了胰蛋白酶原到β胰蛋白酶的活化和β胰蛋白酶由胰蛋白酶自溶为ε胰蛋白酶及由此变为失活的肽。
胰蛋白酶含有6对二硫键,在使用大肠杆菌系统表达时由于系统自身的缺陷,不能对二硫键进行正确的折叠,往往是以包涵体的形式表达,而包涵体表达需要面临变性复性等纯化难题,且包涵体的复性率低。
利用毕赤酵母表达时,胰蛋白酶原有较低的活性,会进行自切割,从酶原转化成有活性的胰蛋白酶,而较低活性的胰蛋白酶即能对菌体造成损伤,导致发酵溶氧水平波动小,菌体出现死亡,甚至会出现蛋白降解而导致胰蛋白酶纯度低,进而导致胰蛋白酶酶活表达量低。
另外,重组胰蛋白酶酶活测定激活时需加入氯化钙,氯化钙起到稳定酶活的作用。一般培养基中含有磷酸,而氯化钙与磷酸盐会产生沉淀,影响酶活测定的准确性。
技术实现要素:
本发明要解决的技术问题是提供一种能使胰蛋白酶原更为稳定、不容易出现自切割的问题、酶活测定激活时避免出现白色沉淀、而在胰蛋白酶产生活性时,有机氮源可有效降低胰酶对菌体的损伤、避免发酵过程溶氧波动小、从而提高胰蛋白酶的表达水平和酶原纯度的用于生产重组猪胰蛋白酶的发酵培养基。
为了解决上述技术问题,本发明的技术方案为:
一种用于生产重组猪胰蛋白酶的发酵培养基,包含发酵培养基及补料培养基,所述发酵培养基包含碳源、有机氮源、无机氮源、无机盐和水,所述碳源包括甘油,所述有机氮源包括酵母浸粉和酵母蛋白胨,所述无机氮源包括硫酸铵,所述无机盐包括七水合硫酸镁、氯化钾和二水合氯化钙,所述补料培养基包括酵母浸粉和酵母蛋白胨。
优选的,所述培养基不含有磷酸或磷酸盐。
优选的,所述甘油在所述发酵培养基的含量为40g/l。
优选的,所述有机氮源在所述发酵培养基的含量为20g/l-80g/l,其中酵母浸粉含量为20g/l-40g/l,酵母蛋白胨含量为40g/l-80g/l,优选配比为:酵母浸粉含量为30g/l,酵母蛋白胨含量为60g/l。
优选的,所述硫酸铵在所述发酵培养基的含量为16g/l。
优选的,所述七水合硫酸镁、氯化钾和二水合氯化钙在所述发酵培养基的含量为:七水合硫酸镁10g/l、氯化钾10g/l、二水合氯化钙0.3g/l。
优选的,所述补料培养基中酵母浸粉含量为10g/l-50g/l,酵母蛋白胨含量20g/l-150g/l,优选配比为:酵母浸粉含量为50g/l,酵母蛋白胨含量为100g/l。
采用本发明通过在培养基中加入有机氮源和发酵过程流加氮源,避免发酵过程溶氧波动小的出现,避免菌体死亡,避免目的蛋白降解而导致胰蛋白酶纯度低,通过去除培养基中的磷酸,避免胰蛋白酶酶活测定时加入的氯化钙与磷酸盐产生白色沉淀而影响酶活测定;通过在培养基中加入有机氮源和发酵过程流加氮源,能有效提高重组猪胰蛋白酶酶活表达。
附图说明
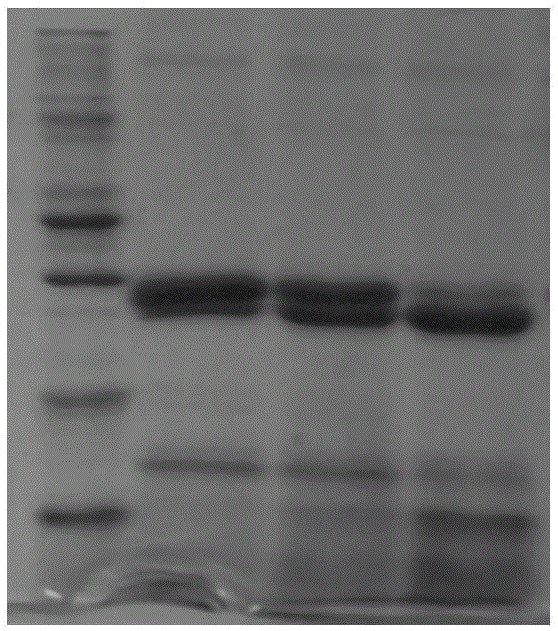
图1为实施例一中重组猪胰蛋白酶基因工程菌在20l发酵罐中培养时上清液的sds-page分析图;
图2为实施例六中重组猪胰蛋白酶基因工程菌在20l发酵罐中培养时上清液的sds-page分析图;
图3为实施例一中重组猪胰蛋白酶溶氧曲线图;
图4为实施例六中重组猪胰蛋白酶基因工程菌发酵过程溶氧水平波动图;
图5为实施例六中重组猪胰蛋白酶基因工程菌发酵表达曲线图;
图6为普通培养基与本发明培养基表达的重组猪胰蛋白酶在未激活前酶活表达对比分析图。
具体实施方式
下面结合具体实施例对发明作进一步说明:
实施例一
重组猪胰蛋白酶菌种在发酵培养基(40g/l甘油、0.93g/lcaso4·2h2o、14.9g/lmgso4·7h2o、18.2g/lk2so4、26.7ml/l磷酸、4.13g/lkoh、4ml/l微量元素ptm1)下培养,加入甲醇诱导表达。发酵培养29h出现溶氧波动小,发酵上清激活时出现白色沉淀,重组猪胰蛋白酶酶活表达量为2758u/ml。
实施例二
重组猪胰蛋白酶菌种在培养基(40g/l甘油、20g/l酵母浸粉、40g/l酵母蛋白胨、16g/l硫酸铵、10g/l七水合硫酸镁、10g/l氯化钾、0.3g/l二水合氯化钙、4ml/l微量元素ptm1)下培养,加入甲醇诱导表达。发酵培养10h出现溶氧波动小的情况,酶活测定激活时没有出现白色沉淀,重组猪胰蛋白酶酶活表达量为3215u/ml。
实施例三
重组猪胰蛋白酶菌种在培养基(40g/l甘油、30g/l酵母浸粉、60g/l酵母蛋白胨、16g/l硫酸铵、10g/l七水合硫酸镁、10g/l氯化钾、0.3g/l二水合氯化钙、4ml/l微量元素ptm1)下培养,加入甲醇诱导表达。发酵培养8h出现溶氧波动小的情况,酶活测定激活时没有出现白色沉淀,重组猪胰蛋白酶酶活表达量为3620u/ml。
实施例四
重组猪胰蛋白酶菌种在培养基(40g/l甘油、40g/l酵母浸粉、80g/l酵母蛋白胨、16g/l硫酸铵、10g/l七水合硫酸镁、10g/l氯化钾、0.3g/l二水合氯化钙、4ml/l微量元素ptm1)下培养,加入甲醇诱导表达。发酵培养8h出现溶氧波动小的情况,酶活测定激活时没有出现白色沉淀,重组猪胰蛋白酶酶活表达量为3560u/ml。
实施例五
重组猪胰蛋白酶菌种在培养基(40g/l甘油、30g/l酵母浸粉、60g/l酵母蛋白胨、16g/l硫酸铵、10g/l七水合硫酸镁、10g/l氯化钾、0.3g/l二水合氯化钙、4ml/l微量元素ptm1)下培养,培养8h开始流加补料培养基(10g/l酵母浸粉、20g/l酵母蛋白胨,其余为水)。加入甲醇诱导表达。发酵过程溶氧呈周期性波动,酶活测定激活时没有出现白色沉淀,重组猪胰蛋白酶酶活表达量为5400u/ml。
实施例六
重组猪胰蛋白酶菌种在培养基(40g/l甘油、30g/l酵母浸粉、60g/l酵母蛋白胨、16g/l硫酸铵、10g/l七水合硫酸镁、10g/l氯化钾、0.3g/l二水合氯化钙、4ml/l微量元素ptm1)下培养,培养8h开始流加补料培养基(50g/l酵母浸粉、100g/l酵母蛋白胨,其余为水)。加入甲醇诱导表达。发酵过程溶氧呈周期性波动,酶活测定激活时没有出现白色沉淀,重组猪胰蛋白酶酶活表达量为7851u/ml。
实施例七
重组猪胰蛋白酶菌种在培养基(40g/l甘油、30g/l酵母浸粉、60g/l酵母蛋白胨、16g/l硫酸铵、10g/l七水合硫酸镁、10g/l氯化钾、0.3g/l二水合氯化钙、4ml/l微量元素ptm1)下培养,培养8h开始流加补料培养基(60g/l酵母浸粉、120g/l酵母蛋白胨,其余为水)。加入甲醇诱导表达。发酵过程溶氧呈周期性波动,酶活测定激活时没有出现白色沉淀,重组猪胰蛋白酶酶活表达量为6650u/ml。
实施例八
重组猪胰蛋白酶菌种在培养基(40g/l甘油、30g/l酵母浸粉、60g/l酵母蛋白胨、16g/l硫酸铵、10g/l七水合硫酸镁、10g/l氯化钾、0.3g/l二水合氯化钙、4ml/l微量元素ptm1)下培养,培养8h开始流加补料培养基(50g/l酵母浸粉、75g/l酵母蛋白胨,其余为水)。加入甲醇诱导表达。发酵过程溶氧呈周期性波动,酶活测定激活时没有出现白色沉淀,重组猪胰蛋白酶酶活表达量为6840u/ml。
实施例九
重组猪胰蛋白酶菌种在培养基(40g/l甘油、30g/l酵母浸粉、60g/l酵母蛋白胨、16g/l硫酸铵、10g/l七水合硫酸镁、10g/l氯化钾、0.3g/l二水合氯化钙、4ml/l微量元素ptm1)下培养,培养8h开始流加补料培养基(50g/l酵母浸粉、150g/l酵母蛋白胨,其余为水)。加入甲醇诱导表达。发酵过程溶氧呈周期性波动,酶活测定激活时没有出现白色沉淀,重组猪胰蛋白酶酶活表达量为6950u/ml。
实施例一为普通培养基,实施例二至实施例九为本发明不同配比的培养基。
重组猪胰蛋白酶基因工程菌在20l发酵罐中培养时上清液的sds-page分析图如图1所示,其中,条带1为蛋白质标准品,从上到下分子量依次为:
94.0kd,66.2kd,45.0kd,33.0kd,26.0kd,20.0kd,14.4kd,条带2-条带5分别为诱导32h、60h和88h样品。
重组猪胰蛋白酶基因工程菌在20l发酵罐中培养时上清液的sds-page分析图如图2所示,其中,条带5为蛋白质标准品,从上至下分子量依次为:
94.0kd,66.2kd,45.0kd,33.0kd,26.0kd,20.0kd,14.4kd,条带1-条带4分别为诱导15h、27h和39h样品,条带6-9分别为诱导51h、63h、75h、和放罐样品随着发酵诱导时间的进行,目的蛋白没有出现降解,胰蛋白酶原纯度达到84.2%(使用gelproanalyzer软件计算)
重组猪胰蛋白酶溶氧曲线图如图3所示,溶氧波动小,溶氧范围在40%-50%。
重组猪胰蛋白酶基因工程菌发酵过程溶氧水平波动如图4所示,溶氧呈规律性波动,溶氧范围在5%-40%,说明重组猪胰蛋白酶基因工程菌在本发明培养基及发酵方法下发酵过程溶氧水平波动正常。
重组猪胰蛋白酶基因工程菌在本发明培养基及发酵方法下发酵表达曲线如图5所示,随着发酵诱导时间的进行,胰蛋白酶原表达量逐渐增加。
实施例一为未优化的普通培养基,发酵上清未激活进行酶活测定,酶活水平较高。而使用本发明的培养基(选用实施例六作为对比),未激活前酶活测定活性低,从而得出的胰蛋白酶原更为稳定,不容易出现自切割的情况。
本发明通过在培养基中加入有机氮源和发酵过程流加氮源解决了:发酵过程中胰蛋白酶原会自动激活为胰蛋白酶,进而导致菌体死亡、发酵过程中胰蛋白酶原会发生严重降解,从而导致胰蛋白酶原纯度低、发酵过程溶氧波动小,无法准确进行补料、传统培养基中含磷酸,导致酶活检测激活时产生白色沉淀,进而影响酶活检测的准确性、胰蛋白酶酶活表达水平过低的问题。通过去除培养基中的磷酸,避免胰蛋白酶酶活激活时加入的氯化钙与磷酸盐产生白色沉淀而影响酶活测定。
结合实施例一与实施例二至九的对比,在发酵培养过程中流加有机氮源,包括1%-3%酵母浸粉和2%-6%酵母蛋白胨,酵母浸粉含量为2%,酵母蛋白胨含量为4%,其余为水。本发明在发酵培养过程中流加有机氮源,进行重组猪胰蛋白酶发酵表达,胰蛋白酶原表达量可达7851u/ml以上,较对比发酵培养基表达酶活提高了184%。
以上结合附图对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!