一种短乳杆菌的转化方法与流程
本发明涉及一种短乳杆菌的转化方法,属于食品微生物
技术领域:
。
背景技术:
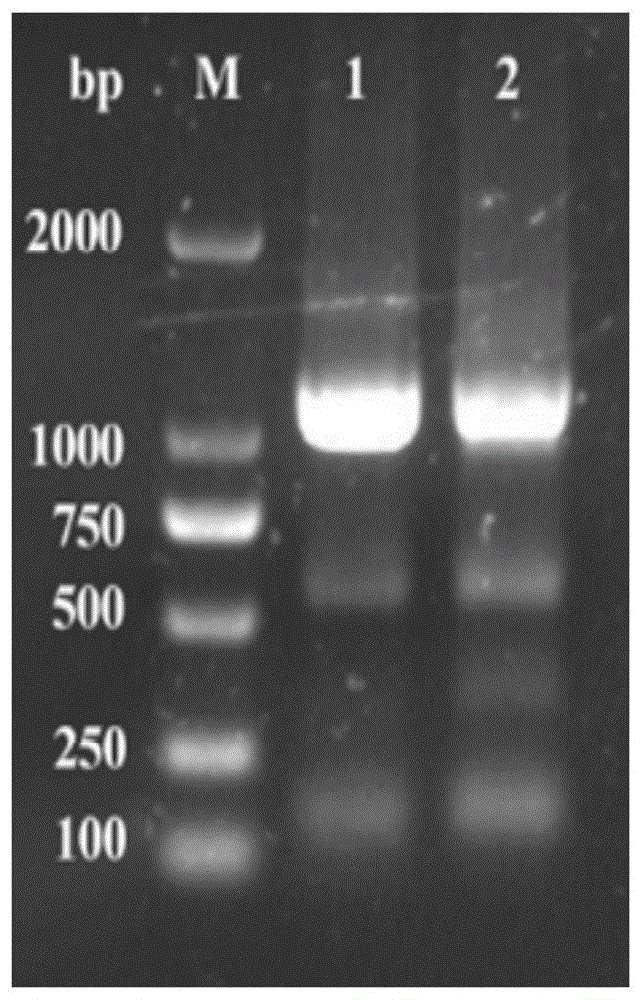
:乳酸菌是一类以同型发酵或异型发酵的方式产生乳酸、乙醇、二氧化碳等副产物的革兰氏阳性细菌的总称,在食品工业如葡萄酒、酱油、香肠等发酵食品和酒精饮料生产中起着重要的有益作用,如调节ph值、保持和改善酿造微生态环境、促进糖化和发酵、促进风味物质及其前驱物质生成等。其中,主要以植物乳杆菌、短乳杆菌、发酵乳杆菌等为优势菌种。但乳酸菌发酵后也会产生一些有毒害作用的代谢产物,如d-乳酸、亚硝酸盐、生物胺类、吲哚等,这类物质如果在畜禽及人体内蓄积过多,将会引起不同的疾病甚至癌症。分子生物学技术的发展有助于人类从本质上了解乳酸菌的进化、功能特点及其与环境之间的关系,进而使乳酸菌在食品和饲料行业中得到合理应用。尽管迄今已有数十种乳酸菌的全基因组获得了测序数据,但其中存在许多未知功能的基因,尽管有时表现出某些酶的活性,但却不易识别其完整的生理功能。因此,从基因水平来揭示乳酸菌的具体代谢机制,有助于加速菌株选育和改造,优化食品、饲料发酵条件,实现乳酸菌的安全生产,使工业乳酸菌的风险降低至零。由于乳酸菌种属多,不同种属之间菌株的生化特性、分子构成和免疫特性均不相同,不同宿主菌株需要采用不同的外源基因片段转化方法,才能成功构建重组工程菌。目前,仅乳酸乳球菌、植物乳杆菌等少数种属具有成熟的转化方法。2016年,杨涓等人以质粒pmg36e、pnz8148、pnz9530和无内源质粒的短乳杆菌cgmcc1306为材料,通过对短乳杆菌感受态制备及电转化过程中各影响因素的考察,建立了一种电转化实验条件(参考文献:杨涓,吕常江,罗麦琪,等.一株无内源质粒短乳杆菌的电转化条件[j].食品与生物技术学报,2016,35(6):584-590)。然而,经发明人验证,该电转化方法不适用于其他短乳杆菌。因此,提供一种适用范围较广且效率较高的短乳杆菌转化方法,对于短乳杆菌的进一步应用具有重要的应用价值。技术实现要素:本发明的目的之一是提供一种短乳杆菌转化方法,所述方法包括:(1)活化短乳杆菌;(2)培养活化后的短乳杆菌至od600为0.8-1.0;(3)收集菌体,制备感受态细胞;(4)感受态细胞内加入外源dna片段后经电击、电转化短乳杆菌感受态细胞,电压设置为2.4-2.6kv,电击时间为2-4ms;(5)感受态细胞复苏,涂布mrs平板,筛选转化子;(6)提取转化子质粒,并根据外源dna片段特异引物进行pcr,通过电泳检测扩增产物,进一步验证阳性转化子。在本发明的一种实施方式中,短乳杆菌包括短乳杆菌2-34、短乳杆菌atcc367或短乳杆菌tmw1.2112。在本发明的一种实施方式中,步骤(1)具体为:将短乳杆菌按1-5%接种量接种于mrs液体培养基活化,35-38℃静置培养10-14h;按1-5%接种量将培养液转接于含1%甘氨酸的mrs液体培养基,35-38℃继续活化20-30h。在本发明的一种实施方式中,步骤(2)具体为:按1-5%接种量将活化后的短乳杆菌接种于含1%甘氨酸的mrs液体培养基,35-38℃静置培养至od600为0.8-1.0。在本发明的一种实施方式中,步骤(3)具体为:将步骤(2)得到的菌体离心,收集菌体,用washingbuffer洗涤菌体细胞,用electroporationbuffer重悬菌体,即得感受态细胞。在本发明的一种实施方式中,步骤(4)所述电击方法具体是:取外源质粒dna与感受态细胞混匀后于冰上静置5min,移入电击杯,电压设置为2.4-2.6kv,电击时间为2-4ms,使外源质粒dna转化入感受态细胞内。进一步地,电压设置为2.4kv,电击时间为3.5ms。在本发明的一种实施方式中,外源质粒dna与感受态细胞的比例为400-500:50(ng/μl)。在本发明的一种实施方式中,步骤(5)具体包括:电击结束后立即向电击杯中加入mrs液体培养基,将细胞重悬并转移至新的离心管,于冰上静置5-10min,在35-38℃培养箱中静置培养1.5-2h进行复苏,离心菌液,弃部分上清,菌体重悬后涂布于mrs固体培养基,35-38℃静置培养4-5d。在本发明的一种实施方式中,所述washingbuffer为:0.5mol/l蔗糖,0.5mmol/lmgcl2,5mmol/lkh2po4,调ph为7.4-7.5,115℃高压灭菌20min。在本发明的一种实施方式中,所述electroporationbuffer为:0.5mol/l蔗糖,115℃高压灭菌20min。本发明的另一个目的是提供上述方法在生产短乳杆菌内源蛋白或外源蛋白中的应用。本发明的有益效果:本发明提供了一种短乳杆菌的转化方法,在已有乳酸乳球菌以及不含内源性质粒短乳杆菌电转化方法的基础上进行了改进,将短乳杆菌分别用mrs培养基和含1%甘氨酸的mrs培养基连续活化两次,继续培养至菌体达到较高浓度时收集并制备感受态细胞,以增加感受态细胞浓度和活性。将电转化外源dna片段时电击条件由2.0kv、3.5ms改为2.4kv、3.5ms,增加电转化效率。经检验,外源基因成功转化感受态细胞,解决了野生型短乳杆菌电转化感受态制备和转化的难题。附图说明图1:实施例1中的阳性转化子pcr扩增产物琼脂糖凝胶电泳图谱。图2:实施例2中的阳性转化子pcr扩增产物琼脂糖凝胶电泳图谱。图3:实施例3中的阳性转化子pcr扩增产物琼脂糖凝胶电泳图谱。具体实施方式以下实施例所涉及实验材料如下:短乳杆菌:实施例中所用到的短乳杆菌2-34(lactobacillusbrevis2-34)为本课题组从黄酒前酵发酵液中分离所得,已于2017年3月23日保藏于中国典型培养物保藏中心,保藏地址为中国武汉大学,保藏编号为cctccno:m2017140,该菌株已在公开号为cn106978371a的专利申请中公开。试剂与试剂盒:牛肉膏、氯化钠、琼脂粉、柠檬酸、k2hpo4﹒3h2o、mgso4﹒7h2o、mnso4﹒h2o、tween-80、乙酸钠、无水葡萄糖、乙酸、蔗糖、mgcl2等试剂购自国药集团化学试剂有限公司。蛋白胨、酵母粉购自oxoid公司。dnamarker、primestarmaxpremix2×、琼脂糖购自上海生工生物工程有限公司。gold-view核酸染料购自北京赛百盛有限公司。质粒提取试剂盒e.z.n.a.plasmiddnaminikitid6943-02200prepsv-spin购自omega公司。washingbuffer:0.5mol/l蔗糖,0.5mmol/lmgcl2,5mmol/lkh2po4,调ph=7.4,115℃高压灭菌20min。electroporationbuffer:0.5mol/l蔗糖,115℃高压灭菌20min。实施例1质粒pnz5319转化短乳杆菌2-34(一)质粒pnz5319电转化短乳杆菌2-341.短乳杆菌2-34(lactobacillusbrevis2-34)感受态细胞制备将甘油管保藏的短乳杆菌2-34按2%接种量接种于mrs液体培养基中,37℃静置培养12h;按2%接种量转接于含1%甘氨酸的mrs液体培养基中,37℃静置培养24h;按2%接种量转接于含1%甘氨酸的mrs液体培养基中,37℃静置培养至od600为0.8-1.0。将培养液冰浴15min,5000rpm,4℃下离心10min,收集菌体;菌体细胞用预冷的washingsolution(wb)洗涤2次,6000rpm,4℃下离心10min,收集菌体;菌体细胞用预冷的electroporationbuffer(eb)洗涤1次,8000rpm,4℃下离心10min;菌体细胞用1mleb重悬,即得感受态细胞,50μl/管分装,-80℃保存备用或立即用于电转化。2.质粒pnz5913电转化短乳杆菌2-34感受态细胞取450ng质粒pnz5913,加入50μl短乳杆菌感受态细胞中,混合均匀后冰浴5min,移入预冷的电击杯(0.2cm间距)并电击,电击条件2.4kv、3.5ms;立即加入450μl预冷的mrs液体培养基至电击杯,与感受态细胞混合均匀,移入1.5ml的ep管,冰浴10min后37℃静置培养2h以使感受态细胞复苏,8000rpm室温离心10min,小心倾倒上清液,留取约50μl菌液,涂布于含30μg/μl红霉素的mrs平板,37℃静置培养4-5d,至出现单克隆菌落。3.阳性转化子的鉴定挑取转化子至含红霉素的mrs液体培养基,37℃静置培养2d,按照细菌质粒提取试剂盒说明提取质粒。配制pcr扩增体系10μl,其中质粒dna0.5μl,上下游引物(f/r)各0.1μl,primstarmaxpremix2×5μl,无菌水4.3μl。pcr扩增程序为:98℃预变性10min,98℃变性10s,55℃退火5s,72℃延伸10s,30个循环,72℃延伸10min。引物序列如表1所示。表1引物序列编号引物名称序列(5'→3')序列编号fpnftgagcgaggaagcggaataseqidno.1rpnrataacctaactctccgtcgcseqidno.2如图1所示,扩增产物经1%琼脂糖凝胶电泳鉴定,其大小均为1000bp,与预期大小相符,切胶回收后经dna测序分析,其序列与pnz5913上f/r引物间可扩增序列完全吻合,证明均为阳性转化子。(二)电转化效率的评估3μl(150ng/μl)质粒pnz5319转化50μl感受态细胞,反应液加450μlmrs培养基复苏2h后除去上清液,取50μl涂布,培养4-5天后产生4个菌落。依据电转化效率计算公式:电转化效率(cfu/μg)=产生的菌落数/铺板dna总量,pnz5319转化短乳杆菌2-34的电转化效率为8.9cfu/μg,而按照参考文献给出的方法,无法得到转化子。实施例2质粒pnz5319转化短乳杆菌atcc367(一)质粒pnz5319电转化短乳杆菌atcc367按照实施例1中的方法制备短乳杆菌atcc367的感受态细胞,取450ng质粒pnz5913,加入50μl短乳杆菌atcc367感受态细胞中,按照实施例1的步骤进行电转化、电转化后复苏、菌液涂布、阳性转化子挑选以及阳性转化子鉴定,pcr扩增鉴定所用引物仍为表1中引物序列。阳性转化子鉴定结果如图2所示,扩增产物经1%琼脂糖凝胶电泳鉴定,其大小均为1000bp,与预期大小相符,切胶回收后经dna测序分析,其序列与pnz5913上f/r引物间可扩增序列完全吻合,证明均为阳性转化子。(二)电转化效率的评估3μl(150ng/μl)质粒pnz5319转化50μl感受态细胞,反应液加450μlmrs培养基复苏2h后除去上清液,取50μl涂布,培养4-5天后产生7个菌落。依据电转化效率计算公式:电转化效率(cfu/μg)=产生的菌落数/铺板dna总量,pnz5319转化短乳杆菌atcc367的电转化效率为15.56cfu/μg,而按照参考文献给出的方法,无法得到转化子。实施例3质粒pnz5319转化短乳杆菌tmw1.2112(一)质粒pnz5319电转化短乳杆菌tmw1.2112按照实施例1中的方法制备短乳杆菌tmw1.2112的感受态细胞,取450ng质粒pnz5913,加入50μl短乳杆菌tmw1.2112感受态细胞中,按照实施例1的步骤进行电转化、电转化后复苏、菌液涂布、阳性转化子挑选以及阳性转化子鉴定,pcr扩增鉴定所用引物仍为表1中引物序列。阳性转化子鉴定结果如图3所示,扩增产物经1%琼脂糖凝胶电泳鉴定,其大小均为1000bp,与预期大小相符,切胶回收后经dna测序分析,其序列与pnz5913上f/r引物间可扩增序列完全吻合,证明均为阳性转化子。(二)电转化效率的评估3μl(150ng/μl)质粒pnz5319转化50μl感受态细胞,反应液加450μlmrs培养基复苏2h后除去上清液,取50μl涂布,培养4-5天后产生5个菌落。依据电转化效率计算公式:电转化效率(cfu/μg)=产生的菌落数/铺板dna总量,pnz5319转化短乳杆菌tmw1.2112的电转化效率为11.11cfu/μg,而按照参考文献给出的方法,无法得到转化子。本发明通过改进已有乳酸菌的电转化方法,建立了野生型短乳杆菌的电转化方法,该方法实现了外源dna片段成功转化入野生型短乳杆菌。利用本发明方法构建野生型短乳杆菌重组菌株,具有良好的应用前景。对比例1将实施例1中中电击缓冲液成分由1m蔗糖改为参考文献中的1m蔗糖、3mmmgcl2,其余条件同实施例1。mgcl2具有除去细胞壁外多聚糖的作用,在复苏过程中mgcl2的存在不利于细胞壁的恢复,且导致在电击过程中细菌被击穿。对比例2将实施例1中感受态细胞制备时收集菌体的时机从od600达0.8-1.2改为0.4-0.6,其余条件同实施例1。因菌种之间细胞壁结构不同导致不同生长时期细菌对电击的敏感程度差异较大,大部分细菌在对数生长中期电转化效率最高,而部分革兰氏阳性菌在对数生长末期适于电转化。而短乳杆菌2-34在细胞生长早期阶段对电击不敏感,电转化效率极低。对比例3将实施例1中电转化时的电击电压2.4kv改为2.0kv,其余条件同实施例1。结果表明,2.0kv的电击电压对于短乳杆菌2-34较低,细胞膜修复速度相对较快,导致外源质粒未能及时进入细胞内。对比例4将实施例1中复苏培养基mrs培养基改为添加0.3m蔗糖的mrs培养基,其余条件同实施例1。结果表明,添加0.3m蔗糖对短乳杆菌2-34的转化无明显作用。虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。sequencelisting<110>江南大学<120>一种短乳杆菌的转化方法<160>2<170>patentinversion3.3<210>1<211>19<212>dna<213>人工序列<400>1tgagcgaggaagcggaata19<210>2<211>20<212>dna<213>人工序列<400>2ataacctaactctccgtcgc20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1