小分子化合物QW24在制备治疗结直肠癌疾病药物中的应用的制作方法
本发明涉及医药技术领域,具体涉及小分子化合物qw24在制备治疗结直肠癌疾病的药物中的应用。
背景技术:
结直肠癌(colorectalcancer)在全球是发病率和致死率均排名第三的癌症,占所有癌症病例的10%,其致死率达50%。在2012年有140万例新病例和694000人死于结直肠癌,其中在发达国家更常见,约占65%的病例总数。我国结直肠癌发病率和死亡率日益上升,严重危害人们健康严重,对于结直肠癌的研究也越来越成为热点。
随着结直肠癌的发展,不同时期的癌症其主要治疗方法也存在差异,在结直肠癌ⅰ期和ⅱ期肿瘤只处于肠壁时主要通过手术切除的方式治疗癌症,当癌症发展为ⅲ期和ⅳ期时,肿瘤已经广泛扩散转移,手术切除疗法已难以治愈,必须结合放疗或化疗的方式。随着癌症的发展恶化,结直肠癌患者的生存率也逐渐降低,ⅳ期时其五年生存率仅为低于5%。在癌症晚期手术切除存在一定的难度,化疗或放疗成为主要的治疗手段。然而,晚期结直肠癌患者依然存在很严重的复发问题,初次治愈后的幸存者在结肠和直肠部位依然存在形成二次原发性肿瘤的风险,病人的生存率仍然很低。
肿瘤干细胞(cancerstemcells,cscs)已被证实是比非肿瘤干细胞更加抵抗传统的癌症疗法,结直肠癌的复发与结直肠癌肿瘤干细胞密切相关,临床数据表明,如果化疗药物能够靶向肿瘤干细胞,能显著提高病人的存活率。因此,肿瘤干细胞目前已成为癌症治疗的研究热点。bmi-1是维持肿瘤干细胞自我更新能力的关键调控因子,能够维持肿瘤干细胞的多能性,促进细胞增殖、抑制细胞衰老和凋亡,进而导致癌症的耐药和复发。bmi-1在结直肠癌患者中高表达,并且与患者的低生存率密切相关。因此,靶向bmi-1被认为是治疗结直肠癌的一种新的方法。
因此,结合结直肠癌形成机制的最新基础研究成果,开发治疗结直肠癌的新型小分子药物、特别是具有我国自主知识产权的药物,并阐明其作用的分子机制,为后续新药研发奠定基础,具有重要的理论意义和广阔的应用前景。
技术实现要素:
本发明提出了一种qw24小分子化合物或其水合物或药学上可接受的盐,其结构如式(i)所示:
式(i)所示qw24是一种小分子化合物,其分子式为c27h28n2o4,分子量为444.52。
本发明还提出了一种药物组合物,其包括如式(i)所示的qw24小分子化合物或其水合物或药学上可接受的盐,以及药学上可接受的载体。
本发明还提出了式(i)所示的qw24小分子化合物或其水合物或药学上可接受的盐、或药物组合物在制备治疗结直肠癌癌疾病的药物中的应用。
本发明应用中,式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物在体外和体内具有如下作用:通过自噬-溶酶体蛋白降解途径显著下调bmi-1的蛋白质水平而不影响其mrna水平。对结直肠癌细胞株具有显著的抑制增殖效果,而对正常细胞杀伤很小。在具有干细胞样性质的结直肠癌细胞株中,显著降低结直肠癌肿瘤干细胞的自我更新能力,进而抑制肿瘤细胞的增殖和迁移。在小鼠皮下荷瘤模型中,显著抑制肿瘤的生长,在结直肠癌肝转移动物模型中,显著抑制肿瘤的转移,并且给药过程中未显示明显的毒性。
本发明应用中,式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物显著下调bmi-1蛋白的表达。
本发明应用中,式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物用于在体外和/或体内抑制抑制结直肠癌的增殖、生长、转移、迁移,促进结直肠癌的调亡。
其中,所述结直肠癌包括抑制结直肠癌细胞株hct116、ht29、hct8、hct15、ls174t、lovo和ct26。
本发明应用中,式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物可以显著降低结直肠癌肿瘤干细胞的自我更新能力、减少直肠癌肿瘤干细胞的数目。
本发明应用中,式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物抑制具有干细胞性质的结直肠癌细胞株hct116的自我更新能力,减少hct116的数目。
本发明应用中,式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物可以在体外抑制结直肠癌细胞的迁移并且影响细胞形态。
本发明应用中,式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物可以在体外和/或体内抑制结直肠癌细胞ct26的肝转移。
本发明应用中,式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物可以在体外和/或体内下调bmi-1的蛋白水平而不影响其mrna水平,并降低bmi-1蛋白的稳定性。
本发明应用中,式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物通过自噬-溶酶体途径降解bmi-1蛋白质。
本发明应用中,式(i)所示的qw24化合物的水合物或药学上可接受的盐或药学上可接受的载体等同样具有与式(i)所示的qw24相同的抑制效果。
本发明应用中,式(i)所示的qw24化合物可单独使用或者与其他药物联合使用。
本发明还提出了式(i)所示的qw24化合物或其水合物或药学上可接受的盐、或药物组合物在体外和/或体内下调bmi-1表达的方法。如式(i)所示的qw24可以浓度依赖的下调bmi-1的表达。
本发明还提出了式(i)所示的qw24化合物或其水合物或药学上可接受的盐、或药物组合物抑制结直肠癌肿瘤干细胞自我更新方法。
式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物显著抑制结直肠癌stem-like细胞hct116球体形成的频率,即抑制肿瘤起始细胞(肿瘤干细胞)的自我更新的能力。
本发明提出了式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物在体外和/或体内抑制结直肠癌细胞转移的方法。如式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物可以体外抑制结直肠癌细胞系hct116、hct8和ct26细胞迁移及ct26细胞的肝转移。
本发明提出了式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物通过自噬-溶酶体途径降解bmi-1蛋白质的方法。如式(i)所示的qw24或其水合物或药学上可接受的盐、或药物组合物处理hct116细胞,有明显自噬小体的形成,并且westernblotting检测lc3ⅱ条带表达量升高。
本发明提出了式(i)所示的qw24化合物或其水合物或药学上可接受的盐、或药物组合物在制备预防和/或治疗与bmi-1过表达相关的恶性肿瘤疾病的药物中的应用。
所述恶性肿瘤为bmi-1过表达的恶性肿瘤,包括结肠癌、胶质瘤、前列腺癌、乳腺癌、肺癌、肝癌、白血病等。
本发明的有益效果在于:本发明通过srb(sulforhodamine,磺酰罗丹明b)比色法和蛋白质免疫印迹筛选得到小分子化合物式(i)qw24,该化合物能够在体外和体内强烈抑制结直肠癌细胞的增殖,并且通过自噬-溶酶体蛋白降解途径显著下调bmi-1的蛋白质水平。在具有干细胞样性质的结直肠癌细胞株中,显著降低结直肠癌肿瘤干细胞的自我更新能力,进而抑制肿瘤细胞的增殖和迁移。在结直肠癌肝转移动物模型中,显著抑制肿瘤的转移,并且给药过程中未显示明显的毒性。结直肠癌转移是导致患者晚期死亡的重要原因,而本发明在结直肠癌治疗方面取得的新突破,为结直肠癌治疗提供了一种潜在的新型药物。
附图说明
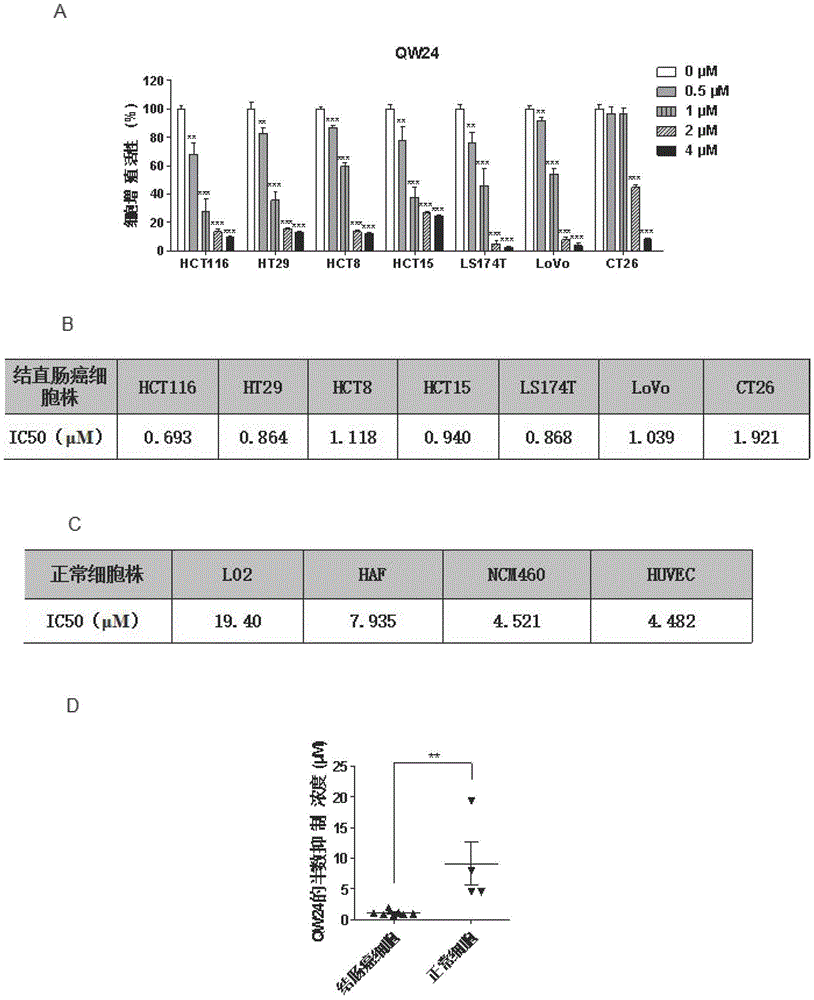
图1所示为式(i)所示的qw24抑制各种结直肠癌细胞株的增殖并且下调bmi-1的表达。图1(a)表示不同浓度的式(i)所示的qw24在hct116、ht29、hct8、hct15、ls174t、lovo和ct26的结直肠癌细胞株中的抑制效果(纵坐标为细胞增殖活性(%));图1(b)为式(i)所示的qw24在不同的结直肠癌细胞株中的ic50;图1(c)为式(i)所示的qw24在正常细胞株中的ic50;图1(d)表示式(i)所示的qw24在结直肠癌细胞和正常细胞中的ic50具有显著性差异(纵坐标为qw24的半数抑制浓度(μm));图1(e)表示式(i)所示的qw24对具有干性的结直肠癌细胞hct116的抑制效果要优于阳性化合物ptc209,其中ptc209为已发表的bmi-1抑制剂(纵坐标为细胞增殖活性(%));图1(f)表示式(i)所示的qw24对bmi-1的下调作用比阳性化合物ptc209更显著;图1(g)表示式(i)所示的qw24在不同结直肠癌细胞中对bmi-1及bmi-1的下游蛋白ub-h2a水平的影响。
图2所示为式(i)所示的qw24抑制结直肠癌肿瘤干细胞的自我更新能力,并减少结直肠癌肿瘤干细胞的数目。图2(a,b,c)表示式(i)所示的qw24减少hct116细胞球体形成的数目和大小;图2(d)表示根据体外有限稀释分析法;图2(e)表示式(i)所示的qw24抑制结直肠癌肿瘤干细胞的自我更新能力。
图3所示为式(i)所示的qw24体外抑制结直肠癌细胞的迁移并且影响细胞形态。图3(a)表示式(i)所示的qw24抑制结直肠癌细胞hct116,hct8和ct26的迁移;图3(b)表示式(i)所示的qw24影响细胞形态。
图4所示为式(i)所示的qw24在结直肠癌皮下荷瘤模型中抑制肿瘤的生长并在体内下调bmi-1的蛋白表达水平。图4(a,b,c)表示式(i)所示的qw24和阳性化合物ptc209在结直肠癌皮下荷瘤模型中抑制hct116肿瘤生长的效果且qw24效果比ptc209更显著;图4(d)表示式(i)所示的qw24和阳性化合物ptc209对小鼠体重无明显影响;图4(e)表示式(i)所示的qw24和阳性化合物ptc209下调肿瘤内bmi-1的蛋白表达水平;图4(f)表示式(i)所示的qw24在组织切片中对肿瘤增值及瘤内bmi-1的抑制效果。
图5所示为式(i)所示的qw24体内抑制结直肠癌的肝转移并延长小鼠的生存期。图5(a)表示式(i)所示的qw24和阳性化合物ptc209在小鼠模型中抑制结直肠癌细胞ct26肝转移,且qw24效果比ptc209更显著;图5(b)表示式(i)所示的qw24和阳性化合物ptc209在小鼠模型中抑制结直肠癌细胞ct26肝转移的统计图;图5(c)表示式(i)所示的qw24和阳性化合物ptc209对小鼠体重无明显影响;图5(d)表示式(i)所示的qw24有效延长小鼠的生存期且效果优于ptc-209;图5(e)表示式(i)所示的qw24和阳性化合物ptc209对转移至肝脏中的肿瘤的抑制效果及相应统计图;图5(f)表示式(i)所示的qw24和阳性化合物ptc209抑制肝脏结节形成的效果及相应统计图。
图6所示为式(i)所示的qw24主要通过溶酶体-自噬途径降解bmi-1蛋白质。图6(a,b)表示式(i)所示的qw24对bmi-1mrna水平没有显著的影响;图6(c)表示式(i)所示的qw24降低了bmi-1蛋白质的稳定性;图6(d)表示式(i)所示的qw24通过诱导细胞的自噬-溶酶体途径导致bmi-1蛋白降解;图6(e,f,g,h)表示式(i)所示的qw24显著诱导自噬的发生。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明,本发明的保护内容不局限于以下实施例。在不背离发明构思的精神和范围下,本领域技术人员能够想到的变化和优点都被包括在本发明中,并且以所附的权利要求书为保护范围。实施本发明的过程、条件、试剂、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
实施例1:式(i)所示的qw24体外抑制多株结直肠癌细胞的增殖
技术方法:
1.细胞的培养
本发明中所使用的结直肠癌细胞株hct116、ht29、hct8、hct15、ls174t、lovo及ct26均来源于atcc;人正常结肠上皮细胞ncm460、人正常肝细胞l02和人表皮成纤维细胞haf细胞来源于atcc,人脐静脉内皮细胞huvec购自sciencell公司。hct116、ht29、hct8、hct15、lovo、ct26、ncm460、l02、haf使用rpmi-1640培养基,ls174t使用高糖dmem培养基,huvec使用ecm培养基。培养基含10%fbs和1%青霉素-链霉素双抗,细胞培养于37℃恒温培养箱(湿度95%,co2浓度5%)中。
2.srb(磺酰罗丹明)法测定细胞增殖
不同的细胞株以密度5×103-8×103个/孔接种至96孔板(corning),24h后,加入不同浓度qw24化合物,对照组加入等量的dmso,各组设3个复孔,继续培养72h后,加预冷却的tca(三氯乙酸,50%,w/v)4℃孵育60min以上固定细胞。固定后,流水冲5遍,风干。每孔加入50μlsrb染液(4%,w/v),室温孵育10min染色。后将染液吸出,每孔加入1%醋酸100μl洗5遍,除去未结合染料。风干后,每孔加入浓度为10mmtris溶液100μl,震荡溶解结合的srb染料。将96孔板置于酶标仪(spectramax190)中,在515nm波长下测定od值。实验独立重复3次。细胞存活率(%)=加药物od值/对照组od值×100%。
3.免疫印迹(westernblot)实验
细胞经不同浓度药物处理后,细胞经裂解提取蛋白,在100℃恒温水浴锅中将蛋白煮10min至完全变性。使用sds-page电泳分离蛋白质样品。将蛋白转移至nc膜上,将膜用5%的脱脂牛奶或bsa室温摇床上封闭2个小时。用相应的抗体(一抗)室温孵育两小时或4℃孵育过夜。用带有荧光标记的二抗孵育一小时,最后用扫膜仪odyssey检测目的蛋白的表达。
实验结果如图1a所示,式(i)qw24对各株结直肠癌细胞都有显著的抑制效果,且具有浓度依赖性。qw24对各株结直肠癌细胞增殖的最大半抑制浓度(ic50)均为0.6μm至2μm之间(图1b)。而qw24对正常细胞的毒性较低,如图1c所示为qw24在人正常肝细胞l02、人皮肤成纤维细胞haf、人正常结肠上皮细胞ncm460和人脐静脉内皮细胞huvec中的ic50。qw24对结直肠癌细胞和正常细胞的杀伤作用具有显著的选择性(图1d)。
本发明将qw24与ptc-209的作用进行对比,使用同样的浓度和时间处理hct116细胞,结果显示qw24具有和ptc-209同样良好的抗增殖活性,而且在2μm和4μm处理浓度时,qw24具有更好的抗肿瘤细胞增殖活性,且与ptc-209相比具有差异显著性(图1e),对bmi-1蛋白水平的下调作用也比ptc-209更为显著(图1f)。因此,qw24具有比ptc-209更好的抗结直肠癌细胞增殖能力和下调bmi-1蛋白质水平的能力。
bmi-1作为prc1的重要元件之一,prc1能够使组蛋白h2a的第119位的赖氨酸单泛素化(h2ak119ub),于是本发明检测了bmi-1的直接下游的泛素化h2a(ub-h2a)的表达水平,结果(图1g)显示qw24通过下调bmi-1进而下调ub-h2a的表达,且对本底的h2a并没有影响,进一步表明了qw24对于bmi-1的作用具有一定的特异性及有效性。
实施例2:qw24抑制结直肠癌肿瘤干细胞的自我更新
技术方法:
1.球体形成实验
使用具有干细胞性质的结直肠癌细胞株hct116进行球体形成实验,首先使用不同浓度的qw24预处理hct116,处理浓度分别为0、1、2、4μm,处理时间为12h,然后收集细胞使用pbs清洗充分去除残留的血清,按每孔1000个细胞的密度接种于使细胞不能贴壁的96孔板(96wellclearflatbottomultralowattachmentmicroplate,corning#3474)中进行悬浮培养(n=8),一周后即可观察球体形成的情况,使用倒置相差显微镜进行观察和拍照,scarbar=100μm。使用有限稀释分析法(lda)结合球体培养技术检测qw24在体外对结直肠癌肿瘤干细胞自我更新能力的影响,将hct116细胞按照不同的细胞密度接种于96孔板中:10000(n=8)、1000(n=8)、100(n=8)、10(n=12)、1(n=12)。
2.流式细胞术
使用流式细胞术及结直肠癌csc的标记物cd133+/cd44+检测不同浓度的qw24对结直肠癌csc数目的影响,hct116细胞经过qw24预处理12h后,收集并使用cd133-apc(带有apc荧光标记的cd133抗体)和cd44-pe(带有pe荧光标记的cd44抗体)避光孵育10min,然后于流式细胞仪上进行分析检测,其中右上角象限代表cd133+/cd44+,即肿瘤干细胞的数目区域,百分百数值代表csc占全体细胞的比例。
实验结果如图2a所示,qw24显著抑制结直肠癌stem-like细胞hct116球体形成的频率(sphere-initiatingcellfrequency),即抑制肿瘤起始细胞(肿瘤干细胞)的自我更新的能力。在2μm和4μm浓度处理下,与对照组相比呈现显著差异性,肿瘤起始细胞起始频率由1/5降至1/26和1/149(图2d),而且,随着化合物处理浓度的增大,每个孔中球体的数目也逐渐减少,球体的直径(即大小)也逐渐减小(图2a,b,c)。
为了进一步检测qw24对肿瘤干细胞(csc)数目的影响,我们运用流式细胞术进行肿瘤干细胞的分析,使用结直肠癌csc的标记物cd133+/cd44+进行染色,结果显示随着qw24处理浓度的增加,肿瘤干细胞的数目逐渐减少且具有浓度依赖性(图2e)。因此得出结论,qw24显著降低结直肠癌肿瘤干细胞的数目,降低其自我更新的能力。
实施例3:式(i)qw24抑制结直肠癌细胞的转移
技术方法:
1.transwell小室迁移实验
使用transwell方法检测qw24对结直肠癌细胞转移的影响,化合物处理浓度分别为0、1、2、4μm,细胞使用hct116、hct8、ct26,首先过夜饥饿处理细胞,然后细胞重悬在无血清并溶有不同浓度qw24的基础培养基中,细胞以6×104个/孔密度(各200μl)接种至transwell小室的上室中。下室中则加入600μl含有对应浓度qw24的完全培养基。置于细胞培养箱中培养12h-24h。取出transwell小室用棉签轻轻除去小室上表面未迁移的细胞,并用4%的多聚甲醛固定小室下表面细胞15分钟,接着用2‰结晶紫染液处理细胞3分钟,清洗小室,除去未结合于细胞的结晶紫,用棉签轻轻擦拭小室的上侧,将非特异性结合于小室上表面的染料擦掉,以便后续镜检。将自然干燥后的小室置于显微镜下拍照,统计多个视野的细胞数目。细胞迁移率(%)=加药物细胞迁移数/对照组细胞迁移数×100%。
2.药物影响细胞形态实验
使用2μm的qw24按时间梯度0、2、4、6、8h处理细胞,使用倒置相差显微镜观察细胞的形态变化。
实验结果如图3所示,qw24显著抑制结直肠癌细胞的迁移,并呈现浓度依赖性:在药物浓度为1μm时,发生迁移的细胞数目已显著减少;在2μm时,细胞的迁移率已降至20%左右;在4μm时,只有极少数的细胞发生迁移,迁移率已不及5%(图3a)。而且qw24处理后细胞的形态也发生了显著变化(图3b)。因此,qw24显著抑制结直肠癌肿瘤细胞的迁移,在低剂量时就已呈现显著抑制效果。
实施例4:式(i)qw24体内抑制结直肠癌肿瘤的生长和转移
技术方法:
1.小鼠皮下荷瘤模型
选择人结直肠癌细胞株hct116(具有干细胞性质)进行实验,使用6-8周的具有免疫缺陷型的雄性balb/c-nude小鼠(购自上海斯莱克公司)。具体步骤如下:
(1)大量扩增培养hct116细胞以保证足够的荷瘤实验用量,每只小鼠使用300×104细胞量,为保证荷瘤的成功率需保证细胞状态为最佳。
(2)待细胞数量足够时,使用胰酶消化细胞,离心去上清,用pbs洗两遍以去除培养基中的血清以减少免疫排斥反应。将细胞用pbs悬浮即可并放置于冰上以降低细胞的新陈代谢作用。
(3)将300×104个结直肠癌细胞hct116(100μl)皮下注射到6-8周免疫缺陷雄性小鼠背部。
(4)约一周后测量肿瘤的长和宽,按照公式:体积=长×宽2×0.52计算肿瘤体积。待肿瘤长到100mm3左右时,将小鼠随机分为四组:空白对照组(dmso)、阳性对照组(ptc209-30mg/kg)和实验药物组(qw24-15mg/kg和qw24-30mg/kg),10只一组,每4天测量并记录小鼠体重以及肿瘤的长与宽的变化用于后续统计,给药频率为每天一次,每次50μl,待实验结束后剥离肿瘤,拍照,并进行h&e染色、免疫组化实验和wb实验。
2.小鼠结直肠癌肝转移模型
使用表达荧光素酶的结直肠癌细胞株ct26,以及6-8周的balb/c雄性小鼠,采用脾脏注射的方法,使肿瘤细胞通过血液循环系统由脾脏转移至肝脏。操流程如下:
(1)构建稳定表达荧光素酶(luciferase)的结直肠癌细胞株ct26-luc。将表达萤火虫荧光素酶(luciferase)的质粒(该质粒带有g418抗性筛选标记)转入ct26细胞株,加入g418筛选稳转细胞系,稳转细胞可以表达荧光素酶,荧光素酶会与其底物荧光素发生反应发出荧光,进而用小动物活体成像系统ivis检测肿瘤细胞的数目和位置(荧光的强度和位置)。
(2)稳转细胞株构建好后,扩增至所需数量,扩增时期依然需要继续加入g418维持筛选稳定表达荧光素酶的细胞。
(3)细胞量足够后可以取一部分验证细胞是否稳定表达荧光素酶,若是阳性结果则可以使用胰酶消化细胞,离心去上清,pbs洗两遍,并使细胞密度为1000×104/ml。将细胞用pbs悬浮即可并放置于冰上以降低细胞的新陈代谢作用。
(4)在解剖小鼠前先注射阿氟丁使小鼠麻醉,使用剃毛机剃除小鼠左侧肋骨下方脾脏部位的毛,用酒精棉球擦拭待解剖处,然后在脾脏外的皮肤处剪一个小口,用镊子拉着脾脏周围的结缔组织顺势将脾脏拉出,顺着脾脏注射含有100×104个细胞的100μl细胞悬液,再将脾脏塞入体内,缝合伤口,用酒精棉球擦拭开口处。使用小动物活体成像仪ivis拍照。
(5)待肿瘤发生转移后,将小鼠的脾脏去除以免对后续结果造成干扰。
(6)脾脏去除后第二天,开始对小鼠给药,同样对小鼠进行随机分组,分3组:空白对照组(dmso)、阳性对照组(ptc209-30mg/kg)和实验药物组(qw24-30mg/kg),并每3天对小鼠进行ivis活体成像拍照观察肿瘤生长和转移情况。
(7)最后用ivis成像系统软件分析处理拍照数据。
实验结果如图4所示,经过连续24天给药,qw24有效抑制肿瘤的生长,且在相同剂量下qw24的效果要显著优于ptc-209,且具有浓度依赖效应(图4a,b,c)。在给药过程中,30mg/kg的qw24组的肿瘤增殖非常缓慢。在连续给药过程中,qw24处理组小鼠体重与空白对照组相比并没有明显变化(图4d),也并未发现小鼠异常行为和不良反应,表明药物并没有明显毒性,其毒副作用比较低。在体内,qw24依然显著下调bmi-1的蛋白质水平,且其作用比ptc-209更明显(图4e)。免疫组化的方法也表明在肿瘤内,qw24依然能发挥其对bmi-1蛋白的下调作用,并且显著降低肿瘤增殖的标志物ki67和pcna的表达(图4f),因此,可以得出结论,在体内动物模型中,qw24有效抑制肿瘤的生长并显著下调bmi-1的蛋白水平,其效果优于ptc-209,而且并没有呈现明显的毒性。
在肝转移模型中,qw24有效抑制结直肠癌的肝转移,且其效果要明显优于ptc-209(图5a,b),在给药过程中,对小鼠的体重无明显影响(图5c),小鼠的生存状态也良好。为了检测qw24能否延长小鼠的生存期,我们进一步做了生存率曲线实验,结果表明,qw24有效延长小鼠的生存期且效果优于ptc-209(图5d)。最后,将小鼠的肝脏解剖出,可以看到在qw24给药组的小鼠肝脏中,肿瘤结节数目非常少,相比空白对照组作用极显著,且比ptc-209具有更好的抗肿瘤转移效果(图5e,f)。
实施例5:式(i)qw24主要通过溶酶体-自噬途径降解bmi-1蛋白质。
技术方法:
1.聚合酶链式反应(polymerasechainreaction,pcr)实验
细胞经不同浓度药物处理后,用trizol分离提取rna,rna经反转录后得到cdna,用不同的bmi-1特异性引物通过实时定量pcr(q-pcr)检测其mrna的表达水平。
2.放线菌酮(chx)检测蛋白稳定性实验
放线菌酮(chx)可以抑制核糖体并阻断蛋白质的合成。先用放线菌酮处理结直肠癌细胞,阻断其蛋白质合成,再同时加入qw24处理,然后用免疫印迹实验检测bmi-1蛋白表达水平;比较放线菌酮和qw24同时处理组与单独用放线菌酮处理组的bmi-1蛋白表达水平以检测该药物对蛋白质稳定性的影响。
3.蛋白酶体抑制剂mg132检测蛋白泛素化降解实验
mg132是一种可逆的醛基肽类特异性蛋白酶体抑制剂,它能抑制26s蛋白酶体对泛素化靶蛋白的降解。分别加入qw24、mg132和同时加入qw24和mg132处理结直肠癌细胞,然后用免疫印迹实验检测bmi-1蛋白表达水平;比较mg132和qw24同时处理组与单独用qw24、mg132处理组的bmi-1蛋白表达水平以检测该药物是否通过泛素化途径降解bmi-1蛋白。
4.氯喹(chloroquine)检测蛋白自噬实验
溶酶体抑制剂氯喹可以阻断自噬,加入氯喹检测蛋白质是否通过自噬-溶酶体途径降解蛋白。分别加入qw24、氯喹和同时加入qw24和氯喹处理结直肠癌细胞,然后用免疫印迹实验检测bmi-1蛋白表达水平;比较氯喹和qw24同时处理组与单独用qw24、氯喹处理组的bmi-1蛋白表达水平以检测该药物是否通过自噬-溶酶体途径降解bmi-1蛋白。
实验结果如图6所示,qw24对bmi-1转录水平,即mrna水平并没有显著的影响,没有浓度及时间依赖性,即使增大化合物处理浓度和延长化合物处理时间,qw24对bmi-1的mrna依然没有明显的变化(图6a,b)。
本发明加入放线菌酮(chx)检测bmi-1蛋白的稳定性是否受到影响。实验结果显示(图6c),当加入chx抑制蛋白质的合成后,在qw24的作用下bmi-1的蛋白水平依然可以继续下降,也就是说,qw24使得bmi-1蛋白的半衰期缩短,降低了bmi-1蛋白的稳定性。
本发明又加入了溶酶体抑制剂chloroquine检测蛋白质是否通过溶酶体-自噬途径发生降解,令人惊喜的是,当同时加入chloroquine和qw24时,bmi-1的蛋白水平要显著高于qw24单独处理时(图6d),即溶酶体抑制剂chloroquine阻止bmi-1的蛋白降解过程,为了进一步验证这个结论,我们使用自噬的标志物lc3检测是否有自噬的发生。首先本发明在hct116细胞中转染了gfp-lc3质粒,实验结果显示在2μm的qw24短时间处理4个小时后,就明显有许多自噬小体的形成(图6h)。进一步地,westernblotting的方法检测结果表明lc3ⅱ条带表达量升高(图6e,f,g),因此表明qw24诱导自噬的发生,并且本发明使用了ptc-209作为对照化合物,ptc-209并没有诱导自噬的发生,而qw24引起的自噬现象非常明显(图6e)。因此,从以上结果可以得出,qw24主要是通过自噬-溶酶体途径使bmi-1蛋白质发生降解。
上述实施例仅为了说明本发明的技术构思及特点,其目的在于让本领域技术人员能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡是根据本发明内容的实质所作出的等效变化或修饰,都应涵盖在本发明保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 能够与配体偶联的单甲基缬氨酸化合物的制造方法与工艺
- 烟梗纤维微波降解制备烟用料液方法及应用与流程
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 小分子共价抑制剂的计算机筛选方法及其在筛选S-腺苷甲硫氨酸脱羧酶的共价抑制剂的应用与制造工艺
- 一种合成抗原的分子量检测方法及应用与制造工艺
- 一种用于MALDI‑TOF‑MS分析小分子的氧化锌沸石复合材料及其制备方法与制造工艺
- 用于原位收集根系挥发物的试验装置及方法与制造工艺
- 一种核壳型纳米香精胶囊的制备方法与制造工艺
- 小分子共价抑制剂在制备抑制S-腺苷甲硫氨酸脱羧酶的药物上的应用及其筛选方法与制造工艺
- Linderolide H在制备治疗鼻炎药物中的应用的制造方法与工艺