检测磷酸化蛋白的荧光探针系统、探针合成方法及应用与流程
本发明属于分析化学领域,具体涉及检测磷酸化蛋白的荧光探针系统、其合成方法及应用。
背景技术:
蛋白质磷酸化是蛋白质翻译后修饰中最广泛的共价修饰方式之一,是所有生物中进行的最广泛、最独特,并且亦是最具效率的一类蛋白质翻译后修饰进程。蛋白磷酸化是通过ATP的γ位磷酸基团经磷酸化激酶催化转移到蛋白质特定位点上,而其反向过程即去磷酸化是由蛋白磷酸酶催化去除相应磷酸基团。
磷酸化后的蛋白质氨基酸侧链引入一个带有非常强的负电荷磷酸基基团,改变了蛋白质的构型、活性以及与其他小分子作用的性能,从而在信号传递、基因表达、细胞分裂的调控中起重要作用。异常的蛋白磷酸化通常与许多疾病有关,如癌症、糖尿病、神经退行性疾病、免疫疾病、心脏病等。它调控着大约30%的真核细胞蛋白质组,世界上有25%的药物将磷酸化激酶作为靶标,由此可见对蛋白质磷酸化的研究具有重大意义。
目前对磷酸化蛋白的研究主要针对于三种蛋白,即磷酸化蛋白、激酶和磷酸酯酶。小分子荧光探针一般都是用金属络合物识别磷酸根离子引起荧光官能团荧光性质发生变化从而达到检测目的。常用的金属配合物包括有Zn2+、Mg2+、Tb3+,而将芘作为荧光响应基团。大部分小分子荧光探针只能单纯的识别磷酸蛋白的磷酸基团,而不能区分磷酸化蛋白磷酸化位点的空间距离远近,同时也不能够跟踪蛋白的磷酸化过程及去磷酸化过程。
基于以上,在本发明中我们构建一种能识别磷酸化蛋白的荧光探针系统,能区分磷酸化蛋白磷酸化位点的空间距离远近,同时能够跟踪蛋白的磷酸化过程及去磷酸化过程。
技术实现要素:
本发明的目的是提供检测磷酸化蛋白的荧光探针系统、其合成方法及应用。该探针具有对磷酸化蛋白选择性好、灵敏度高的特点,并且能识别蛋白磷酸化位点的空间距离,还能够对激酶的磷酸化过程和磷酸酯酶的去磷酸化过程进行跟踪。该探针系统制备简单,适合放大合成和实际应用。
本发明提供了一种检测磷酸化蛋白的荧光探针系统,该系类荧光探针结构通式及代表性探针1-3结构如下:
其中探针1、探针2为已发表化合物,本发明提供了荧光探针3的合成方法:
该方法具体步骤如下:
(1)1-(3-溴丙基)芘的合成
(2)溴取代芘在无水无氧条件下加入无水乙醚溶解,在冰浴条件下注入n-BuLi,搅拌0.5-2h后,滴入1,3-二溴丙烷,冰浴下继续搅拌0.5-2h后,升温至室温搅拌过夜,即可得到1-(3-溴丙基)芘。3-(芘基-1)-N,N-2-吡啶基亚甲基正丙氨的合成
第一步产物与KI在氮气保护条件下,用DIPEA溶解。将DPA(双-(吡啶基-2-亚甲基)胺)溶于无水乙腈中,再加入到反应器中。升温至80-90℃,搅拌回流,反应12-48h即可得到3-(芘基-1)-N,N-2-吡啶基亚甲基正丙氨。
(3)探针3的合成
CHCl3/CH3CN溶液(CHCl3/CH3CN=20:1~1:1,体积比),溶解第二步产物。将用甲醇助溶的ZnClO4﹒6H2O加入反应器中,在室温条件下搅拌0.5-2小时后,将乙醚加入,搅拌过夜后析出探针3.
本发明的探针3的制备方法,步骤(1)中溴取代芘与无水乙醚的质量/体积比为1:50-70(g/mL),溴取代芘与n-BuLi的质量/体积比为1:1.6-2(g/mL),溴取代芘与1,3-二溴丙烷的质量/体积比为1:1.6-2(g/mL);步骤(2)中第一步产物与 KI的摩尔比为1:0.5-0.7,第一步产物与DIPEA的质量/体积比为1:9-11(g/mL),第一步产物与DPA的质量/体积比为1:0.4-0.6(g/mL),第一步产物与无水乙腈的质量/体积比为1:0.2-0.4(g/L);步骤(3)中第二步产物与CHCl3/CH3CN混合溶液的质量/体积比为1:50-70(g/mL),第二步产物与ZnClO4﹒6H2O的摩尔比为1:0.5-2,第二步产物与乙醚的质量/体积比为1:1-2(g/mL)。
本发明的3-芘基-N,N-2-吡啶基亚甲基正丙氨的合成用的碱是DIPEA。
本发明的检测磷酸化蛋白的荧光探针系统在检测磷酸化蛋白、检测磷酸化蛋白磷酸化位点的距离或检测蛋白磷酸化过程和磷酸化蛋白去磷酸化过程中的应用。
本发明所述的磷酸化蛋白的荧光探针系统能区分磷酸化位点不同间距的磷酸化蛋白。先利用A(探针1或2)与磷酸化蛋白作用,再利用B(探针3)与该磷酸化蛋白作用,若A、B均有响应则为临位磷酸化蛋白,若A无响应、B有响应则为磷酸化位点间隔一定距离的磷酸化蛋白。
本发明所述的芘类荧光化合物系统能对磷酸化过程进行跟踪,通过对ALP(碱性磷酸酶)、激酶与磷酸化蛋白的作用研究蛋白的磷酸化过程和去磷酸化过程。
附图说明
图1溴取代丙基芘的氢谱
图2 3-芘基-N,N-2-吡啶基亚甲基正丙氨的氢谱
图3 3-芘基-N,N-2-吡啶基亚甲基正丙氨的碳谱
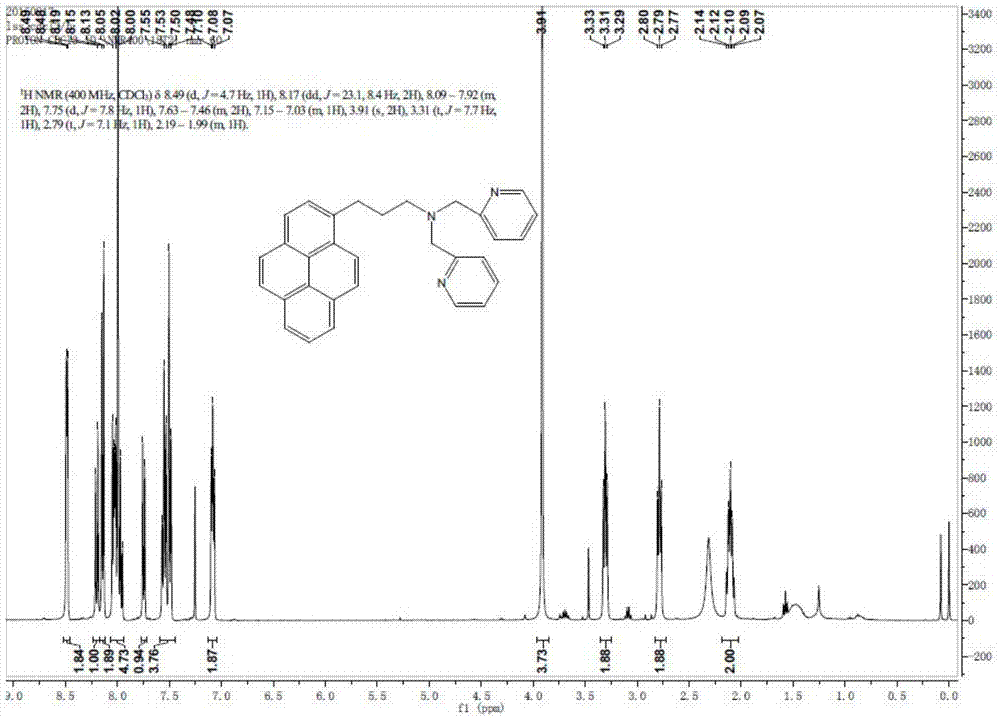
图4探针3的氢谱
图5探针3的碳谱
图6探针1对焦磷酸跟离子的荧光滴定
图7探针2对焦磷酸跟离子的荧光滴定
图8探针3对焦磷酸跟离子的荧光滴定
图9探针1对a-casein蛋白的荧光滴定
图10探针2对a-casein蛋白的荧光滴定
图11探针3对a-casein蛋白的荧光滴定
图12探针1对β-casein蛋白的荧光滴定
图13探针2对β-casein蛋白的荧光滴定
图14探针3对β-casein蛋白的荧光滴定
图15探针1对BSA和a-casein蛋白选择性
图16探针3对BSA、a-casein和β-casein凝胶电泳
图17探针1对ALP与a-casein作用研究
图18探针2对ALP与a-casein作用研究
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明,但不限于此。
实施例1
1、1-(3-溴丙基)芘的合成
溴取代芘500mg(1.79mmol)置于25mL单口烧瓶中,将反应器放在冰浴中,在无水无氧条件下加入30mL无水乙醚,在冰浴条件下用注射器注入0.9mLn-BuLi,搅拌0.5h后,滴入0.92mL 1,3-二溴丙烷,冰浴下继续搅拌0.5h后,升温至室温搅拌过夜(24h)。减压旋干溶剂,柱层析分离(湿法固体上样法,石油醚装柱、石油醚洗涤)得到米白色产物,103mg,收率为18%,洗脱剂为石油醚;
1H NMR(400MHz,CDCl3):δ8.48–7.71(m,1H),3.70–3.25(m,1H),2.53–2.17(m,1H).
2、3-(芘基-1)-N,N-2-吡啶基亚甲基正丙氨的合成
取51mg 1-(3-溴丙基)芘和15mg KI置于干燥的25mL两口烧瓶中,在氮气保护条件下,用注射器注入500ul DIPEA于烧瓶中。将25ul DPA(双-(吡啶基-2-亚甲基)胺)溶于15mL无水乙腈中,再用注射器加入到反应器中。升温至80℃,搅拌回流,反应12h。减压旋干溶剂,柱层析分离(湿法固体上样法,先石油醚装柱,石油醚、乙酸乙酯洗涤,再二氯甲烷装柱,二氯甲烷、甲醇洗涤)得到黄色油状产物,55mg,收率为78.5%,洗脱剂为石油醚、乙酸乙酯、二氯甲烷和甲醇(梯度洗脱,先用石油醚:乙酸乙酯=0-0.1洗涤,共2h,再二氯甲烷:甲醇=0-0.2洗涤,共3h);1H NMR(400MHz,CDCl3):δ8.49(d,J=4.7Hz,1H),8.17(dd,J=23.1,8.4Hz,2H),8.09–7.92(m,2H),7.75(d,J=7.8Hz,1H),7.63–7.46(m,2H),7.15–7.03(m,1H),3.91(s,2H),3.31(t,J=7.7Hz,1H),2.79(t,J=7.1Hz,1H),2.19–1.99(m,1H).
13C NMR(101MHz,CDCl3):δ159.23,148.99,136.46,131.41,130.89,129.78,128.56,127.51,127.23,127.14,126.57,125.82,125.06,125.01,124.86,124.78,124.70,123.36,123.03,122.04,60.43,54.12,31.10,29.12.
3、探针3的合成
在50mL圆底烧瓶中加入10mL CHCl3/CH3CN溶液中(CHCl3/CH3CN=20:1,体积比),加入133.7mg 3-(芘基-1)-N,N-2-吡啶基亚甲基正丙氨溶解。称504mg ZnClO4﹒6H2O溶于1mL甲醇配制锌离子母液,取其中0.4mL缓慢加入烧瓶中,在室温条件下搅拌0.5小时后,将50mL乙醚缓慢加入圆底烧瓶中,搅拌过夜(24h)后析出米黄色固体,过滤并干燥后制得探针3,138mg,收率为90%。
1H NMR(400MHz,DMSO):δ8.56(d,J=5.0Hz,1H),8.39(d,J=9.3Hz,1H),8.35–8.19(m,2H),8.09(t,J=7.6Hz,1H),7.98(t,J=8.4Hz,1H),7.61–7.51(m,1H),7.47(d,J=7.9Hz,1H),4.26(d,J=16.2Hz,1H),3.95(d,J=16.2Hz,1H),3.32(t,J=7.4Hz,1H),2.92–2.78(m,1H),2.20(s,1H).
13C NMR(101MHz,DMSO):δ155.12,147.33(m),140.82,136.30,131.35,130.86,129.83,128.79,127.86,127.77,127.12,126.72,125.54,125.42,125.34,125.01,124.75,124.67,124.55,123.96,57.09,55.15,30.26,24.64.
实施例2
分别称取来源实验室已知的探针15.06mg、探针21.24mg,以上实施例制备的探针35.22mg分别溶于5.27mL、1.26mL、5.22mL的DMSO中,制备母液浓度为2mM。取3根EP管,分别标记为1,2,3,用5000uL移液枪,分别移取3980uL 20mM HEPES(20mM,pH=7.4)溶液于3支EP管中,再用20uL移液枪分别移取20uL三种探针母液分别于3支EP管中,探针浓度为10-5mol/L。每支EP管中逐步滴加4n(n=1、2、3….10)uL的PPi溶液,其中PPi的浓度为0.01mol/L。用荧光分光光度计测定三种探针的荧光光谱,激发波长为345nm。
从图6、图7、图8中可以看出当用345nm的波长激发,三种探针都在478nm处产生一个芘激基复合物的荧光峰,三种探针对焦磷酸根离子都能选择性结合,并随碳原子数增加,络合峰的强度越大。
实施例3
取3根EP管,分别标记为1,2,3,用5000uL移液枪,分别移取3980uL20mM HEPES(20mM,pH=7.4)溶液于3支EP管中,再用20uL移液枪分别移取20uL三种探针母液(2mM)分别于3支EP管中,探针浓度为10-5mol/L。每支EP管中逐步滴加4n(n=1、2、3….10)uL的a-casein蛋白溶液,其中a-casein蛋白的浓度为0.1mM。用荧光分光光度计测定三种探针的荧光光谱,激发波长为345nm。
从图9、图10、图11中可以看出当用345nm的波长激发,三种探针都在478nm处产生一个芘激基复合物的荧光峰,三种探针对a-casein蛋白都能选择性 结合,并随碳原子数增加,络合峰的强度越大。
实施例4
取3根EP管,分别标记为1,2,3,用5000uL移液枪,分别移取3980uL 20mM HEPES(20mM,pH=7.4)溶液于3支EP管中,再用20uL移液分别枪移取20uL三种探针母液(2mM)分别于3支EP管中,探针浓度为10-5mol/L。每支EP管中逐步滴加4n(n=1、2、3….10)uL的β-casein蛋白溶液,其中β-casein蛋白的浓度为0.1mM。用荧光分光光度计测定三种探针的荧光光谱,激发波长为345nm。
从图13、图14、图15中可以看出当用345nm的波长激发,三种探针都在478nm处产生一个芘激基复合物的荧光峰,三种探针对β-casein蛋白都能选择性结合,并随碳原子数增加,络合峰的强度越大。
通过图9、图10、图11、图12、图13、图14中各种探针对a-casein、β-casein蛋白的滴定中可以看出,该系统对a-casein蛋白的作用效果更强,而a-casein和β-casein蛋白比较,a-casein磷酸化位点多,空间距离近,β-casein磷酸化位点少,空间距离相对远一些。因此,该探针系统能够用于识别磷酸化蛋白磷酸位点的空间距离,进而利用该系统探针能区分磷酸化位点不同间距的磷酸化蛋白。
实施例5
取3根EP管,分别标记为1,2,3,用5000uL移液枪,分别移取3980uL20mM HEPES(20mM,pH=7.4)溶液于3支EP管中,再用20uL移液枪分别移取20uL三种探针母液(2mM)分别于3支EP管中,探针浓度为10-5mol/L。每支EP管中逐步滴加4n(n=1、2、3….10)uL的a-casein、BSA、BSA+a-casein蛋白溶液,第三支EP管中的V(BSA:a-casein)=1:1,其中各蛋白的浓度为0.1mM。激发波长为345nm。从图15中可以看出激基复合物的荧光峰的强度随a-casein浓度的变化而变化,而受BSA浓度变化影响不大,因此该系统探针能很好识别磷酸化蛋白。
实施例6
配制10%的Native-PAGE分离胶,分别将BSA、a-casein、B-casein三种蛋白加入1、2、3、4、5、6通道内,在V=200v、I=20mA、P=50W条件下跑电泳,三种蛋白加入12uL,其中蛋白的浓度为5ug/12uL。1h后1、2、3通道用考马斯亮蓝染色,4、5、6通道用探针3染色,其中探针3的浓度为2mg/10mL。从图16可以看出,marker、BSA都没有与探针3结合,只有磷酸化的蛋白结合,图中1、2、3、4、5、6分别代表PAGE电泳的BSA、a-casein、β-casein和探针作用后的BSA、a-casein、β-casein电泳图。
实施例7
称取6.5mg a-casein蛋白,用650uL PH=7.8,0.5mM的Tris-HCl-Mg缓冲溶液溶解,再加入ALP 2uL(ALP为100U/uL)使蛋白去磷酸化,即生成去磷酸化蛋白。取3根EP管,分别标记为1,2,3。用5000uL移液枪,分别移取3980uL 20mM HEPES溶液于3支EP管中,再用20uL移液枪分别移取20uL探针1母液分别于3支EP管中,探针浓度为10-5mol/L。分别加入12uL a-casein 蛋白溶液和、D-a-casein蛋白溶液于2、3号EP管中,其中各蛋白的浓度为0.1mM。激发波长为345nm。
再取3根EP管,分别标记为4,5,6。用5000uL移液枪,分别移取3980uL 20mM HEPES溶液于3支EP管中,再用20uL移液枪分别移取20uL探针2母液分别于3支EP管中。分别加入12uL a-casein蛋白溶液和D-a-casein蛋白溶液于5、6号EP管中,其中各蛋白的浓度为0.1mM。激发波长为345nm。从图17、图18可以看出该系统探针能够很好区分磷酸化蛋白和去磷酸化蛋白。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!