以GLUT1为靶点的计算机药物筛选方法及其应用与流程
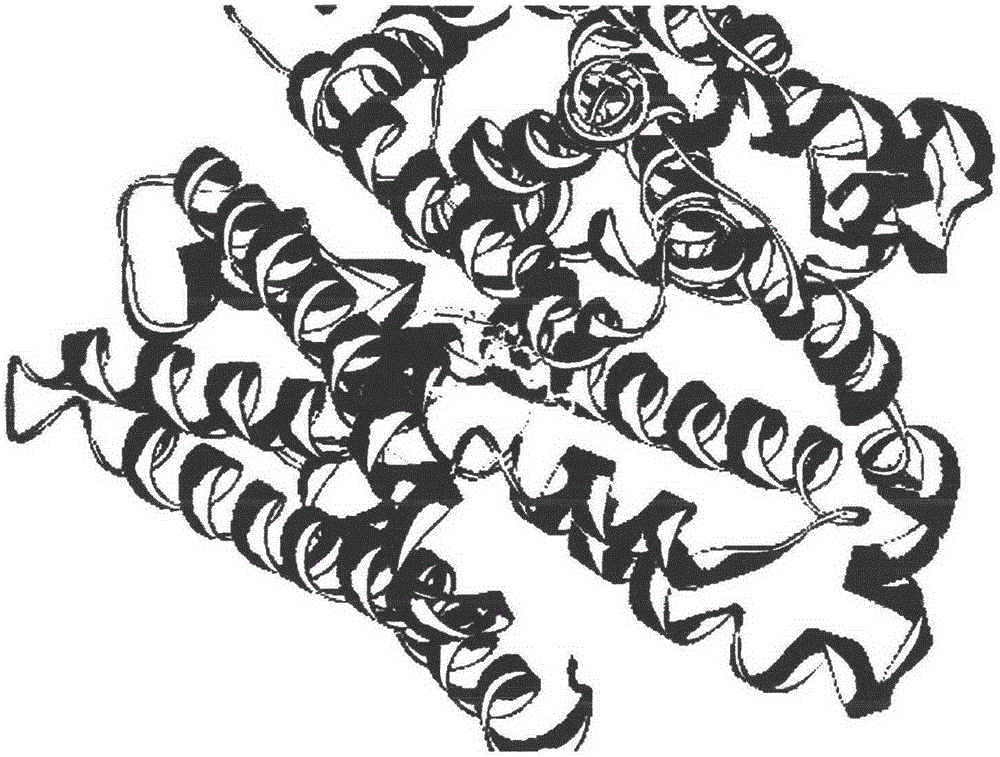
本发明属于高通量虚拟筛选领域,计算机辅助药物设计范畴,特别涉及一种多精度计算机药物筛选方法及其在筛选有生物活性的先导化合物上的应用。技术背景新药的研究有三个决定阶段:先导化合物的发现,新药物的优化研究,临床与开发研究。计算机辅助药物设计的主要任务就是先导化合物的发现与优化。合理药物设计(rationaldrugdesign)是依据与药物作用的靶点,即广义上的受体,如酶、受体、离子通道、病毒、核酸、多糖等,寻找和设计合理的药物分子。通过对药物和受体的结构在分子水平甚至电子水平的全面准确了解进行基于结构的药物设计和通过对靶点的结构、功能、与药物作用方式及产生生理活性的机理的药物设计。CADD通过内源性物质或外源性小分子作为效应子作用于机体的靶点,考察其形状互补,性质互补(包括氢键、疏水性、静电等),溶剂效应及运动协调性等进行分子设计。葡萄糖(D-glucose)是地球上包括从细菌到人类各种生物已知最重要、最基本的能量来源,也是人脑和神经系统最主要的供能物质;据估算,大脑平均每天消耗约120克葡萄糖,占人体葡萄糖总消耗量的一半以上。葡萄糖代谢的第一步就是进入细胞:亲水的葡萄糖不能自由穿透疏水的细胞膜,其进出细胞需要通过镶嵌于细胞膜上的葡萄糖转运蛋白完成。其中一类属于主要协同转运蛋白超家族(MajorFacilitatorSuperfamily,简称MFS)的转运蛋白是大脑、神经系统、肌肉、红细胞等组织器官中最重要的葡萄糖转运蛋白(glucosetransporters,简称GLUTs)。在人体的14个GLUTs中,GLUT1、2、3、4这四种蛋白生理功能最重要,研究最广泛,其中GLUT1因发现最早而得名。GLUT1几乎存在于人体每一个细胞中,是红细胞和血脑屏障等上皮细胞的主要葡萄糖转运蛋白,对于维持血糖浓度的稳定和大脑供能起关键作用。在已知的人类遗传疾病中,导致GLUT1功能异常的突变会影响葡萄糖的正常吸收,导致大脑萎缩、智力低下、发育迟缓、癫痫等一系列疾病(GLUT1Deficiencysyndrome,又称DeVivosyndrome)。另一方面,当发生癌变时,葡萄糖是肿瘤细胞最主要的能量来源,但是肿瘤细胞由于缺乏氧气供应而只能对葡萄糖进行无氧代谢,同质量葡萄糖所提供的能量不到正常细胞的10%,因而对葡萄糖的需求剧增(这是被称为WarburgEffect的肿瘤细胞代谢现象),在很多种类的肿瘤细胞中都观察到GLUT1的超量表达,以大量摄入葡萄糖维持肿瘤细胞的生长扩增,这使得GLUT1的表达量可能作为检测癌变的一个指标,抑制GLUT1活性的抑制剂的开发也是成为治疗癌症的重要方法之一。葡萄糖跨膜转运的研究历史基本上代表了人类理解物质跨膜运输的历史。将近100年前,就观测到红细胞对葡萄糖的饱和性吸收;起初认为葡萄糖是通过自由跨膜扩散进入细胞的,随着实验证据的积累,1948年,LeFevre等首次提出葡萄糖的进入红细胞的跨膜扩散需要细胞膜上的特定组分(蛋白质)参与;1952 年,Widdas等通过对人体红细胞转运葡萄糖的动力学研究提出了饱和运载体机制(saturablecarriermechanism),理论上揭示了细胞膜上运载体(carrier)的存在(尽管之后的研究并不再支持这转运模型,但至今许多跨膜转运蛋白仍然以carrier命名,转运蛋白家族以SLC分类);1977年,Kasahara和Hinkle从人体红细胞提纯分离出了参与葡萄糖转运的膜蛋白,并实现了脂质体重构功能实验,证实了葡萄糖转运蛋白的存在;1985年,HarveyLodish实验室首次鉴定出了人体GLUT1蛋白的基因序列,并根据氨基酸序列预测了其具有12次跨膜区的拓扑结构;1991年,DeVivo等首次报道了与GLUT1突变体相关的疾病症状,并将这一大类与GLUT1突变相关的疾病命名为DeVivo综合症,展示了GLUT1与人类健康的紧密关联。自从获得了大量生理、病理、细胞、生化信息之后,获取GLUT1的三维结构就变成了该领域最期待的下一个突破。为了结构生物学研究,科学家尝试了从红细胞中、动物组织中直接提取GLUT1或者通过重组表达的方法获取;同时还尝试通过研究GLUT1-4的同源蛋白结构信息来间接理解这些重要的人源转运蛋白。上个世纪80年代,Henderson等报道了数个与GLUT具有序列同源性的细菌糖转运蛋白;90年代,一系列工作报道了GLUT1蛋白在多种表达体系中的重组表达;真正的结构生物学突破发生于2012年,颜宁研究组首次解析了GLUTs的大肠杆菌同源蛋白XylE与葡萄糖结合的高分辨率晶体结构,并利用同源建模预测了GLUT1-4的三维结构;时至今日,人源GLUT1蛋白的晶体结构的捕获为理解这个具有历史研究意义的转运蛋白掀开了新的一章。技术实现要素:本发明目的在于开发一种以分子对接、虚拟筛选及细胞实验技术为基础的高精准计算机药物筛选方法,能够适用于合理的药物设计。本发明的首要目的是通过计算机Glide虚拟筛选方式得到GLUT的先导药物。该先导化合物有对GLUT有抑制活性的潜力。本发明的第二个目的是通过DiscoveryStudio\Glide程序精确地选中靶点GLUT的绑定口袋。以供分子对接和虚拟筛选使用。本发明第三个目的是对分子对接区分GLUT1抑制剂和非抑制剂的能力进行评估。本发明第四个目的是用REOS规则对前期筛选的1500个小分子进行优化处理。本发明的第五个目的是通过细胞生物学实验验证虚拟筛选得倒的先导化合物的活性。为实现上述发明目的,本发明采用如下技术方案:一种以GLUT1为靶点的计算机药物筛选方法,其特征在于以分子对接及多精准度虚拟筛选技术为基础进行计算机药物筛选设计,包含以下五个步骤:(1)GLUT1晶体结构进行评估;(2)使用分子对接分子对接区分GLUT1抑制剂和非抑制剂的能力进行评估;(3)根据评估的结果挑选最佳的晶体结构作为分子对接的模板;(4)利用ACD/ADME软件包计算这些分子的分子性质并保存;(5)虚拟筛选;(6)将第一轮筛选结果用REOS规则进行处理;(7)基于细胞 生物学实验的先导化合物分子活性测试。本发明还采用了如下方案:以GLUT1为靶点的计算机药物筛选方法在以GLUT1为靶点的先导化合物计算机筛选的应用。本发明还采用了如下方案:以GLUT1为靶点的计算机药物筛选方法在分子对接软件Glide分子对接平台的应用。本发明还采用了如下方案:以GLUT1为靶点的计算机药物筛选方法在高通量虚拟筛选(HTVS)平台的应用。本发明还采用了如下方案:以GLUT1为靶点的计算机药物筛选方法在标准筛选(SP)平台上的应用。本发明还采用了如下方案:以GLUT1为靶点的计算机药物筛选方法在附加筛选(XP)平台的应用。本发明还采用了如下方案:以GLUT1为靶点的计算机药物筛选方法在Specs数据库的应用。本发明还采用了如下方案:以GLUT1为靶点的计算机药物筛选方法在Chembridge数据库的应用。本发明还采用了如下方案:以GLUT1为靶点的计算机药物筛选方法筛选出的小分子化合物在抑制GLUT1酶活性的应用。附图说明图1是GLUT1晶体评估得倒的受体与小分子抑制剂相互作用的重要残基。主要涉及Gln283、Gln282、Glu380。图2是对分子对接区分GLUT1抑制剂和非抑制剂的能力进行评估时及进行虚拟筛选时小分子与受体的结合口袋,直接为5埃。图3是三个有较高细胞抑制活性的小分子化学结构式。四个小分子分别为化合物1:5-溴乙基-2-羟甲基-6-甲基-四氢吡喃-3,4-二醇;化合物2:4-(4-羟丁基)-2-羟甲基-3-羟基6-甲基-四氢吡喃;化合物3:2,3,4,-三羟基-5-氯-甲醇;化合物4:2,3-羟基-4-溴-5-氯-甲醇。图4是三个有较高细胞抑制活性的小分子活性曲线。其中途中标识1、2、3、4分别代表化合物1、化合物2、化合物3、化合物4。图5是所述计算机高精度合理药物筛选设计方法的流程图。具体实施方式具体来说,请参阅图1~图5及附表1和附表3所示,本发明提供一种通过合理药物设计的方法来定义来对GLUT1蛋白进行基于结构的虚拟药物筛选并验证其生物活性。步骤如下:GLUT1晶体结构进行评估。使用分子对接分子对接区分GLUT1抑制剂和非抑制剂的能力进行评估。根据评估的结果挑选最佳的晶体结构作为分子对接的模板。利用ACD/ADME软件包计算这些分子的分子性质并保存。虚拟筛选将第一轮筛选结果用REOS规则进行处理。基于细胞生物学实验的先导化合物分子活性测试。下面我们针对本发明进行具体描述:1.基于计算机的虚拟筛选方法(1)在进行虚拟筛选前,先对现有的GLUT1的复合物晶体结构进行评估(PDB:4PYP)。采用Glide对接的方法将晶体结构中的化合物取出再重新对接到结合口袋中,并将对接打分最好的分子构象作为其结合构象,再将分子对接得到的构象与晶体结构中的构象进行叠合,比较分子对接的效果。主要涉及Gln283、Gln282、Glu380。(2)对分子对接区分GLUT1抑制剂和非抑制剂的能力进行评估。BindingDB数据库中的GLUT1抑制剂共有45个,非抑制剂分子数据集则采用DiscoveryStudio2.5中的FindDiverseMolecules模块从Chembridge化合物数据库中选取10000结构差异最大的化合物组成。采用Glide分子对接方法把抑制剂和非抑制剂数据集中的分子对接到活性位点。(3)根据评估的结果挑选最佳的晶体结构作为分子对接的模板,采用Glide筛选Chembridge化合物数据库,采用GlideHTVS、SP打分模式进行评价,保留对接得分最好的10万个化合物进行XP打分模式的筛选;对于Specs化合物数据库,也先用GlideSP打分模式进行分子对接和打分,然后保留得分最好的5万个化合物进行XP打分模式的筛选。经过XP打分模式的筛选后,对于Chembridge化合物数据库,保存得分最好的前3000位的分子,对于Specs化合物数据库,保存前1500位的分子,然后二者合并在一起并除去重复的分子。(4)利用ACD/ADME软件包计算这些分子的分子性质并保存;采用MOE计算分子结构中是否包含易反应基团,把包含反应基团的分子去掉;剔除logD和logP都大于6.5的化合物;剔除违反1条及以上五规则的分子以及违反3条及以上Opera规则的化合物。最后,保存得分靠前的前1500个分子。(5)将这1500个分子用REOS规则10进行处理,删除可能含毒性、具有反应活性以及其他不理想组分的分子,最后得到536个分子,然后再聚类分析分为124类(使用DiscoveryStudio2.5中的FindDiverseMolecules模块),最终挑选并购买了10个最有潜力的化合物进行生物学实验。(6)我们利用MTT比色法测试其细胞活性以作进一步的筛选。MTT即3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐。该方法的原理是活细胞线粒体中的琥珀酸脱氢酶将外源性的MTT还原成不溶于水的蓝紫色结晶甲瓒并沉积在细胞中,而死细胞没有这样的功能。二甲亚砜(DMSO)可以溶解甲瓒,用酶联免疫检测仪在570nm波长处测定其光吸收值,可以间接地反映出活细胞的数量。在一定范围细胞数内,MTT结晶形成的量与细胞数成正比。主要的实验流程如下:(6.1)细胞铺板,将癌细胞稀释到适当浓度(10000个/mL),向96孔板中加95μL细胞悬液,并置于 培养箱中培养24小时。(6.2)向各孔中加入5μL浓度为25μg/mL的化合物,继续培养48小时。(6.3)向已铺板的各孔中,加15μL5mg/mL的MTT溶液,培养4小时。(6.4)将各孔中的溶液抽滤干净,然后各加100μLDMSO。(6.5)用酶标仪在570nm处测试OD值,并换算出小分子的IC50值,其中发现有三个小分子化合物IC50达到μM级别。附表1实验材料和试剂名称生产厂家KinaseAssayKitInvitrogen,PV4532细胞株MGC80-3中国科学院上海细胞库细胞株PANC-1中国科学院上海细胞库改良型RPMI-1640培养基ThermoScientificDMEM/HighGlucose培养基ThermoScientific胎牛血清BioseraMTTSigma-Aldrich二甲亚砜国药集团化学试剂有限公司(上海)附表2实验仪器设备名称生产厂家96孔细胞培养板Corning384孔低缘不透明黑色微孔板Corning微量移液器Eppendorf多功能酶标仪ThermoScientificMicroplateReaderBIO-RAD,680洁净工作台上海博讯实业有限公司医疗设备厂高压蒸汽灭菌器三洋电机株式会社电热恒温鼓风干燥箱上海精宏实验设备有限公司CO2培养箱ThermoScientific微孔板恒温振荡器杭州奥盛仪器有限公司,AS-MB-1181当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1