锂电池负极用阴阳离子双掺杂锡基氧化物及其制备方法与流程
本发明涉及锂离子电池技术领域,尤其涉及一种锂电池负极用阴阳离子双掺杂锡基氧化物及其制备方法。
背景技术:
随着现代科技的发展,高能锂离子电池已经在家用电子产品、电动车以及大型固定蓄电池中扮演重要的角色。正如预期的,通过提高电化学性能的方式来使锂离子电池获得更高的能量密度、更长的循环寿命以及更好的安全性的需求日益上升。由于它们注重实际应用和安全问题、能量密度和循环寿命,所以更加关注近年来的电池研究,并且将这些因素考虑到下一代的高性能锂离子电池当中。如今,碳/石墨被普遍用作商业锂离子电池负极材料。但是,由于碳的电极电位与锂的电位很接近,当电池过充电时,会有部分锂离子在碳电极表面沉积,形成锂枝晶而引发安全性问题。另一方面,由于碳/石墨第一次充放电时,会在碳表面形成固体电解质中间相(solidelectrolyteinterfacefilm,简称sei膜),造成较大的不可逆容量损失,并且sei膜的产生增加了电极/电解液界面阻抗,不利于li+的可逆嵌入和脱出。相比较其它候选的负极材料,碳/石墨的明显不足是容量低(与晶体/无定型硅相比较),倍率性能差(与尖晶石li4ti5o12相比较),以及缺乏其它所不具备的好的性能优势。寻找安全性能更好、比容量更高、循环寿命更长的新型负极材料,已成为锂离子电池研究的焦点。
根据各类的报道,金属氧化物负极材料通过有效的改性之后已证明具有很好的性能。尤其是sno2,它的首周相转变反应通过li-sn合金化反应可以释放1494mah/g;理论比容量的锂存储机制已经被广泛的研究
一种提高sno2电极电化学性能的有效方法是抑制其体积的变化与提高电极材料的电子电导率,使锂离子更加有效的插入/脱出。为了达到这个目的,将元素掺杂到sno2晶格中是一种行之有效的方法。最近,金属元素已成功掺杂到sno2晶格中,并且研究发现掺杂后的样品具有体积缓冲和电子导电性提高的作用。另一方面,已经证实氮掺杂sno2表现出优越的电学和光学性能,并且可能更好的提高电子电导率。因此,金属元素和氮元素共掺杂sno2样品应该充分利用其增加体积的缓冲效果和提高电子导电率的作用,使sno2电极更有利于li+的可逆嵌入和脱出。然而,金属元素和氮元素共掺杂sno2样品的电化学性能尚未见报道。
技术实现要素:
基于背景技术存在的技术问题,本发明提出了一种锂电池负极用阴阳离子双掺杂锡基氧化物及其制备方法,铁和氮元素的协同掺杂作用,使sno2的电子和离子电导率得到提高,降低了首周的不可逆容量损失,而且由于铁和氮元素的掺杂缓和了sno2电极材料在循环过程中体积的膨胀效应,进一步改善了sno2的循环稳定性,同时增加了结晶化有序度、比表面积、孔径和电导率,从而促进了锂离子的扩散,进而能够提高电极材料的倍率性能;并且制备方法简单,很有希望成为新一代商业化的锂离子电池负极材料。
本发明提出的一种锂电池负极用阴阳离子双掺杂锡基氧化物的制备方法,包括如下步骤:
s1、将锡盐和铁盐进行一步水热法制备fe/sno2纳米复合材料;
s2、将fe/sno2纳米复合材料置于氮气气氛或氨气气氛中烧结得到锂电池负极用阴阳离子双掺杂锡基氧化物。
优选地,s1的具体操作如下:将锡盐和铁盐溶于水中得到溶液a;将氢氧化钠溶于水中得到溶液b;将溶液a滴加至溶液b中得到溶液c;将溶液c进行水热反应,离心,洗涤得到fe/sno2纳米复合材料。
优选地,s1中,锡盐为四氯化锡、氯化亚锡、硫酸亚锡、锡酸钠、亚锡酸钠中一种或两种以上组合物。
优选地,s1中,铁盐为氯化亚铁、硫酸亚铁、硝酸亚铁、氯化铁、硫酸铁、硝酸铁中一种或两种以上组合物。
优选地,s1中,锡元素、铁元素和氢氧化钠的摩尔比为1:60:7;该摩尔比为理论值,是由最终产物推导出来的,但实际生产过程中往往加入过量锡盐、铁盐和/或氢氧化钠,使三者的比例不为1:60:7,以促使锡盐、铁盐或氢氧化钠尽可能反应完毕。
优选地,s1中,将溶液a滴加至溶液b中得到溶液c,滴加速度为15-20滴/min,滴加过程中持续搅拌。
优选地,s1中,溶液c与水热反应釜内容积的体积比为2-3:4。
优选地,s1中,水热反应的温度为180-200℃,水热反应的时间为12-24h。
优选地,s1中,离心转速为3500-4500r/min。
优选地,s1中,采用乙醇和去离子水分别进行洗涤。
优选地,s2中,烧结温度为450-550℃,烧结时间为8-12h。
本发明还提出一种锂电池负极用阴阳离子双掺杂锡基氧化物,采用上述锂电池负极用阴阳离子双掺杂锡基氧化物的制备方法制得。
优选地,具有分级结构,其一次颗粒粒径为30-40nm。
本发明采用材料结构的设计和协调组合成具有优势的锂离子电池的电极材料,并且其制备工艺简单,易于实现规模生产。
本发明利用水热反应制备得到阳离子掺杂sno2纳米颗粒(即fe/sno2纳米复合材料),并在氮气或氨气氛围下进一步的烧结后制备得到锂电池负极用阴阳离子双掺杂锡基氧化物。储锂性能测试表明,本发明所得电极材料在0.005-3.0v之间循环时的可逆容量远高于sno2和fe/sno2电极材料的可逆容量,三者的充电曲线也有明显差别,这可能归因于铁和氮元素的协同作用,使sno2的电子和离子电导率得到提高,降低了首周的不可逆容量损失,同时由于铁和氮元素的掺杂缓和了sno2电极材料在循环过程中体积的膨胀效应,进一步改善了sno2的循环稳定性。
本发明所得锂电池负极用阴阳离子双掺杂锡基氧化物由于较小的颗粒尺寸,在一定程度上缓和了材料在循环过程中体积的改变,可以更好的提高循环性能;其次,本发明方法增加了结晶化有序度、比表面积、孔径和电导率,从而促进了锂离子的扩散,进而能够提高电极材料的倍率性能。
总而言之,本发明所得锂电池负极用阴阳离子双掺杂锡基氧化物证明了具有好的循环性能和倍率性能。与原始的sno2材料相比,锂电池负极用阴阳离子双掺杂锡基氧化物大大改善了材料的电化学性能,并且易于制备,很有希望成为新一代商业化的锂离子电池负极材料。
本发明所得锂电池负极用阴阳离子双掺杂锡基氧化物首次嵌锂容量可达1960mah/g,可逆脱锂容量可达1167mah/g,首次库仑效率可达60%,比容量在50次反复充放电循环后仍可达645mah/g。
附图说明
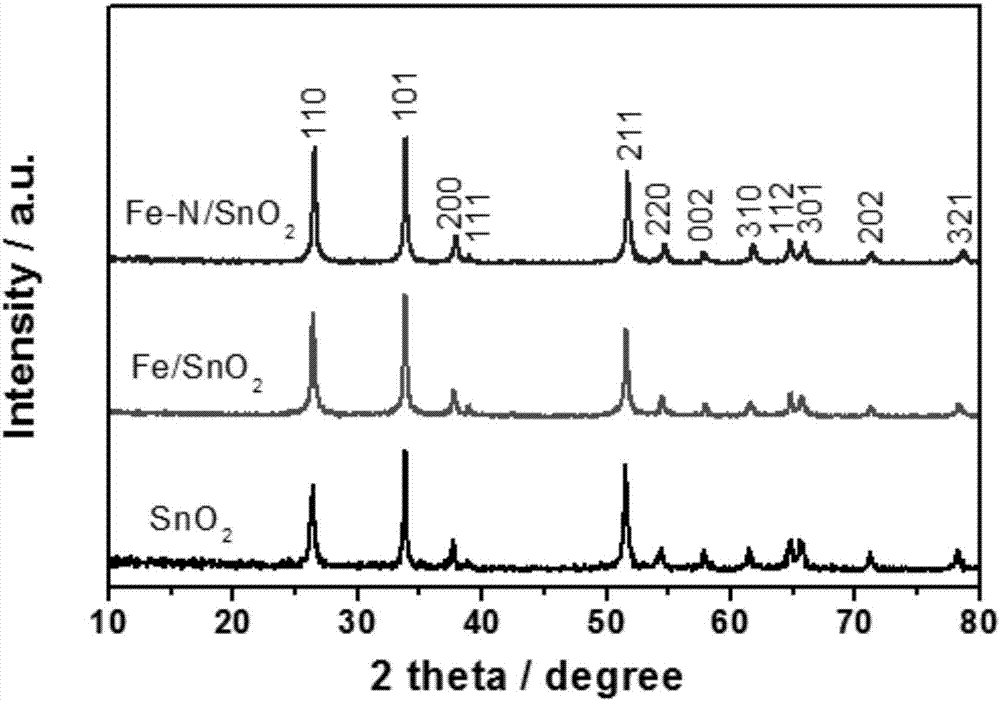
图1为实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物与fe/sno2纳米复合材料、纯相sno2的x射线衍射图。
图2为实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物与fe/sno2纳米复合材料、纯相sno2的fesem图;其中图2a1和图2a2为纯相sno2的fesem图,图2b1和图2b2为实施例8所得fe/sno2纳米复合材料的fesem图,图2c1和图2c2为实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物的fesem图。
图3为实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物与fe/sno2纳米复合材料、纯相sno2的hrtem图与saed图;其中图3a为纯相sno2的hrtem图与saed图,图3b为实施例8所得fe/sno2纳米复合材料的hrtem图与saed图,图3c为实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物的hrtem图与saed图,图3d为金红石sno2晶格结构模型(2d)。
图4为分别以实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物、fe/sno2纳米复合材料和纯相sno2为活性材料所得负电极在电压为0.005-3v、电流密度为0.1c的首周充放电曲线。
图5为分别以实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物、fe/sno2纳米复合材料和纯相sno2为活性材料所得负电极在电流密度0.1c循环特性图。
图6为分别以实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物、fe/sno2纳米复合材料和纯相sno2为活性材料所得负电极经50周循环后进行倍率性能的测试图。
上述图中,puresno2为纯相sno2,fe/sno2为本发明实施例8所得fe/sno2纳米复合材料,fe-n/sno2为本发明实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物,dis代表放电(discharge),cha代表充电(charge)。
具体实施方式
下面,通过具体实施例对本发明的技术方案进行详细说明。
实施例1
本发明提出的一种锂电池负极用阴阳离子双掺杂锡基氧化物的制备方法,包括如下步骤:
s1、将锡盐和铁盐进行一步水热法制备fe/sno2纳米复合材料;
s2、将fe/sno2纳米复合材料置于氮气气氛或氨气气氛中烧结得到锂电池负极用阴阳离子双掺杂锡基氧化物。
实施例2
本发明提出的一种锂电池负极用阴阳离子双掺杂锡基氧化物的制备方法,包括如下步骤:
s1、将四氯化锡和硝酸铁溶于水中得到溶液a;将氢氧化钠溶于水中得到溶液b;锡离子、铁离子和氢氧化钠的摩尔比为1:60:7;将溶液a滴加至溶液b中得到溶液c,滴加速度为15-20滴/min,滴加过程中持续搅拌;将溶液c进行水热反应,水热反应的温度为180℃,水热反应的时间为24h,离心,离心转速为3500r/min,采用乙醇和去离子水分别进行洗涤得到fe/sno2纳米复合材料;
s2、将fe/sno2纳米复合材料置于氮气气氛或氨气气氛中烧结,烧结温度为450℃,烧结时间为12h得到锂电池负极用阴阳离子双掺杂锡基氧化物。
实施例3
本发明提出的一种锂电池负极用阴阳离子双掺杂锡基氧化物的制备方法,包括如下步骤:
s1、将四氯化锡和硝酸铁溶于水中得到溶液a;将氢氧化钠溶于水中得到溶液b;锡离子、铁离子和氢氧化钠的摩尔比为1:60:7;将溶液a滴加至溶液b中得到溶液c,滴加速度为15-20滴/min,滴加过程中持续搅拌;将溶液c进行水热反应,水热反应的温度为200℃,水热反应的时间为12h,离心,离心转速为4500r/min,采用乙醇和去离子水分别进行洗涤得到fe/sno2纳米复合材料;
s2、将fe/sno2纳米复合材料置于氮气气氛或氨气气氛中烧结,烧结温度为550℃,烧结时间为8h得到锂电池负极用阴阳离子双掺杂锡基氧化物。
实施例4
本发明提出的一种锂电池负极用阴阳离子双掺杂锡基氧化物的制备方法,包括如下步骤:
s1、将2.80gsncl4·5h2o和0.48mmolfe(no3)3·9h2o溶于40ml去离子水中,搅拌得到透明溶液a(搅拌速度为700r/min);将2.24gnaoh溶于40ml去离子水中,搅拌得到透明溶液b(搅拌速度为700r/min);将溶液a缓慢滴加到溶液b中,滴速为15-20滴/min,滴加过程中持续搅拌,搅拌速度为720r/min,得到透明溶液c;将透明溶液c置于反应釜内,在180℃下水热反应24h后得到沉淀物,离心,用去离子水与无水乙醇反复洗涤沉淀物,70℃烘干后得到fe/sno2纳米复合材料;
s2、将fe/sno2纳米复合材料在氮气氛围下500℃退火10h得到锂电池负极用阴阳离子双掺杂锡基氧化物。
实施例5
本发明提出的一种锂电池负极用阴阳离子双掺杂锡基氧化物的制备方法,包括如下步骤:
s1、将1.40gsncl4·5h2o和0.24mmolfe(no3)3·9h2o溶于20ml去离子水中,搅拌得到透明溶液a(搅拌速度为700r/min);将1.12gnaoh溶于20ml去离子水中,搅拌得到透明溶液b(搅拌速度为700r/min);将溶液a缓慢滴加到溶液b中,滴速为15-20滴/min,滴加过程中持续搅拌,搅拌速度为720r/min,得到透明溶液c;将透明溶液c置于反应釜内,在180℃下水热反应16h后得到沉淀物,离心,用去离子水与无水乙醇反复洗涤沉淀物,70℃烘干后得到fe/sno2纳米复合材料;
s2、将fe/sno2纳米复合材料在氮气氛围下500℃退火10h得到锂电池负极用阴阳离子双掺杂锡基氧化物。
实施例6
本发明提出的一种锂电池负极用阴阳离子双掺杂锡基氧化物的制备方法,包括如下步骤:
s1、将1.40gsncl4·5h2o和0.24mmolfe(no3)3·9h2o溶于20ml去离子水中,搅拌得到透明溶液a(搅拌速度为700r/min);将1.12gnaoh溶于20ml去离子水中,搅拌得到透明溶液b(搅拌速度为700r/min);将溶液a缓慢滴加到溶液b中,滴速为15-20滴/min,滴加过程中持续搅拌,搅拌速度为720r/min,得到透明溶液c;将透明溶液c置于反应釜内,在180℃下水热反应12h后得到沉淀物,离心,用去离子水与无水乙醇反复洗涤沉淀物,70℃烘干后得到fe/sno2纳米复合材料;
s2、将fe/sno2纳米复合材料在氮气氛围下450℃退火12h得到锂电池负极用阴阳离子双掺杂锡基氧化物。
实施例7
本发明提出的一种锂电池负极用阴阳离子双掺杂锡基氧化物的制备方法,包括如下步骤:
s1、将2.80gsncl4·5h2o和0.48mmolfe(no3)3·9h2o溶于40ml去离子水中,搅拌得到透明溶液a(搅拌速度为700r/min);将2.24gnaoh溶于40ml去离子水中,搅拌得到透明溶液b(搅拌速度为700r/min);将溶液a缓慢滴加到溶液b中,滴速为15-20滴/min,滴加过程中持续搅拌,搅拌速度为720r/min,得到透明溶液c;将透明溶液c置于反应釜内,在180℃下水热反应24h后得到沉淀物,离心,用去离子水与无水乙醇反复洗涤沉淀物,70℃烘干后得到fe/sno2纳米复合材料;
s2、将fe/sno2纳米复合材料在氮气氛围下550℃退火8h得到锂电池负极用阴阳离子双掺杂锡基氧化物。
实施例8
本发明提出的一种锂电池负极用阴阳离子双掺杂锡基氧化物的制备方法,包括如下步骤:
s1、将1.40gsncl4·5h2o和0.24mmolfe(no3)3·9h2o溶于20ml去离子水中,搅拌得到透明溶液a(搅拌速度为700r/min);将1.12gnaoh溶于20ml去离子水中,搅拌得到透明溶液b(搅拌速度为700r/min);将溶液a缓慢滴加到溶液b中,滴速为15-20滴/min,滴加过程中持续搅拌,搅拌速度为720r/min,得到透明溶液c;将透明溶液c置于反应釜内,在180℃下水热反应12h后得到沉淀物,离心,用去离子水与无水乙醇反复洗涤沉淀物,70℃烘干后得到fe/sno2纳米复合材料;
s2、将fe/sno2纳米复合材料在氮气氛围下500℃退火12h得到锂电池负极用阴阳离子双掺杂锡基氧化物。
将实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物进行测试,其结果如下:
1、对其进行x射线衍射,如图1所示,图1为实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物与fe/sno2纳米复合材料、纯相sno2的x射线衍射图;由图1可知:实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物的结晶性比较好,锂电池负极用阴阳离子双掺杂锡基氧化物与fe/sno2纳米复合材料、纯相sno2均为四方相金红石sno2(jcpds卡号:01-0657),即掺杂后没有杂质的衍射峰出现,说明掺杂并未改变sno2的相结构;
2、对其进行场发射扫描电子显微镜扫描,如图2所示,图2为实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物与fe/sno2纳米复合材料、纯相sno2的fesem图;由图2可知:三种材料均由尺寸小于100nm的纳米sno2颗粒组成;其中纯相sno2是一个平均尺寸为500nm的分级结构球体,由边长为80nm的纳米立方体组成;而铁元素掺杂以及铁、氮元素共掺杂之后,明显改变了sno2的形貌,在图2b1、图2b2、图2c1和图2c2中,fe/sno2纳米复合材料和锂电池负极用阴阳离子双掺杂锡基氧化物是由30-40nm的纳米颗粒团聚而成,相比于纯相sno2的一次粒径(80nm)要小很多;改性之后样品的颗粒尺寸将有效的缩短了锂离子在充放电过程中的扩散距离,以及加快了充放电的速度,因此更小尺寸的颗粒更有利于释放sno2内部的压力,以及有效的缓和了脱嵌锂过程中体积的改变;
3、对其进行高分辨率的透射电镜透射,如图3所示,图3为实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物与fe/sno2纳米复合材料、纯相sno2的hrtem图与选区saed图;由图3可知:sno2晶粒呈现出相似的颗粒尺寸以及清晰规整的晶格条纹;在图3a、图3b、图3c中,(001)晶带轴上显示出一个均匀的、清晰的d间距为0.335nm、0.337nm和0.338nm的(110)晶格条纹;而图3d为金红石sno2晶格结构模型(2d),清楚的显示出(110)晶面间距;即无其它的晶面或d间距出现说明:实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物无杂相存在;通过右上角的saed图更进一步的证明,纯相/掺杂的sno2对应的电子衍射斑点在[001]*晶带轴上,可以看出铁和氮元素共掺杂后的sno2和纯相的金红石sno2并无不同,并且在所有的颗粒表面没有发现杂相的出现,这很好的印证了图1的xrd结果。
制备负电极:分别将实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物、fe/sno2纳米复合材料、纯相sno2作为活性材料,将活性材料与乙炔黑、粘接剂按质量比为7:2:1混合,研磨均匀,加入适当的1-甲基-2-吡咯烷酮制成浆料,将浆料均匀地涂在铜箔上,红外灯烘干后,120℃真空干燥24h,然后裁出8mm×8mm的电极片,用电子分析天平称其质量,并计算出活性材料的质量。
电极性能测试:在扣式锂离子电池中进行性能测试;电池组装方式如下:以锂片作为对电极,celgard2300作为隔膜,电解液采用浓度为1mol/l的六氟磷酸锂的碳酸乙烯酯-碳酸甲基乙基酯(1:1)溶液。测试时,温度为室温,采用恒流充放电,电流密度为76.6ma/g,电压控制范围是0.005-3.0v。
电极性能测试结果如图4、图5和图6所示,图4为分别以实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物、fe/sno2纳米复合材料和纯相sno2为活性材料所得负电极在电压为0.005-3v、电流密度为0.1c的首周充放电曲线。图5为分别以实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物、fe/sno2纳米复合材料和纯相sno2为活性材料所得负电极在电压为0.005-3v、电流密度为0.1c循环特性图。图6为分别以实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物、fe/sno2纳米复合材料和纯相sno2为活性材料所得负电极经50周循环后进行倍率性能的测试图。
由图4可知:氮元素掺杂增加了fe/sno2纳米复合材料首周的充放电容量,这可能归因于提高了结晶度和电导率。同时实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物、fe/sno2纳米复合材料和纯相sno2所得负电极的不可逆转容量依次为554mah/g、702mah/g和728mah/g;由于在掺杂过程中比表面积相继的增加,这将必然导致在sno2电极表面形成的固体电解质膜(sei膜)的增加,这就更好的解释了掺杂之后不可逆容量的增加。
三种材料的首周放电曲线非常相似。锂电池负极用阴阳离子双掺杂锡基氧化物呈现出两个不同的放电平台,分别为0.94v和0.23v;这可能对应于sno2的分解并还原成sn和li2o,以及li-sn合金化反应。这些过程很好的和锂电池负极用阴阳离子双掺杂锡基氧化物的cv中还原峰部分0.90v和0.21v还原电位相吻合。sn0氧化成sn2+(sno)和更高的sn4+,这将从恒流充电曲线和cv曲线部分得到解释。
由图5可知:以实施例8所得锂电池负极用阴阳离子双掺杂锡基氧化物为活性材料所得负电极显示出最好的循环稳定性。纯相sno2所得负电极容量随着循环的进行急剧衰减。50周循环后的容量从1215mah/g衰减到118mah/g。相比之下,铁元素掺杂和铁氮元素掺杂提高了sno2的循环稳定性。锂电池负极用阴阳离子双掺杂锡基氧化物所得负电极提供了高的首周电荷容量(1167mah/g),并在前30周循环过程中容量缓慢的降低。经过50周的循环,它几乎保持不变,维持在一个较高的容量(680mah/g)。
由图6可知:当电极材料在不同的电流密度从0.1c到5c进行测试,可以发现锂电池负极用阴阳离子双掺杂锡基氧化物所得负电极的倍率性能最优。在更高的电流密度0.2c、1c和5c下,锂电池负极用阴阳离子双掺杂锡基氧化物所得负电极仍然保持较高的容量,分别为668mah/g、615mah/g和577mah/g,这明显要高于商业炭材料的理论容量。在不同的电流密度下经过90周的循环之后,再次将电流密度降到0.1c时,锂电池负极用阴阳离子双掺杂锡基氧化物所得负电极在100周的容量还能达到659mah/g,接近96.9%的库伦效率。
根据上述的结论,我们可以看出铁元素和氮元素共掺杂提高了sno2的电化学性能,这可能归因于在循环过程中缩短了锂离子的扩散通道距离、好的结晶性以及高的电导率,更有可能是受掺杂离子的影响。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!