一种虫草菌丝体胞外多糖功能饮料及制备方法与流程
本发明涉及一种功能饮料,特别涉及一种虫草菌丝体胞外多糖功能饮料及制备方法。
(二)
背景技术:
冬虫夏草(Cordyceps sinensis(Berk.)Sacc)是由麦角菌科植物冬虫夏草菌的子座及其寄主蝙蝠蛾科昆虫虫草蝙蝠蛾等的幼虫尸体的复合体,是中国传统的名贵中药。中国被毛孢(Hirsutella sinensis),是冬虫夏草的分生孢子阶段即无性型阶段(刘锡琎,郭英兰,俞永信,曾纬.冬虫夏草无性阶段的分离和鉴定.真菌学报,1989,8(1):35-40.)。
天然冬虫夏草生长环境苛刻,产率极低,市场供不应求。沈晓云等(沈晓云,李兆兰,田军.冬虫夏草与虫草菌丝有效成分分析比较.陕西大学学报,1998,21(1):80-85.)研究表明,液体发酵培养得到的虫草菌丝体,其有效成分和天然冬虫夏草相近,市场上已有许多以虫草菌丝体为原料制成的虫草保健产品,如百令胶囊、极草含片、东阳光鲜草等。随着菌丝体的大量应用,含有大量胞外多糖的发酵液目前并未被充分利用,而是被当作废液排弃,每年数百万吨的发酵液不仅造成了原料的大量浪费,而且额外增加了污水处理费用。因此,虫草发酵液的产品开发不仅实现了环境友好,而且满足经济环保。
中国专利CN 103130907 A公开了一种中国被毛孢蛋白多糖及其制备和用途,从中国被毛孢深层发酵上清液中分离纯化出中国被毛孢蛋白多糖,并对其进行了成分分析、结构鉴定及免疫功能研究,表明该蛋白多糖是潜在的免疫增强物质;该实验过程中采用了Sevag法对游离蛋白进行脱除,不仅使用了有机溶剂,而且造成了活性蛋白成分的严重流失。赵萍等人(赵萍,王聪,夏闻旭,等.蝙蝠蛾被毛孢菌丝体发酵液口服制剂的研发.中国酿造,2016,35(4):171-175.)利用蝙蝠蛾被毛孢菌丝体发酵液研制出一种口服制剂;该实验以蝙蝠蛾被毛孢菌丝体发酵液为研究对象,将其直接进行浓缩,澄清等步骤调配成口服制剂,菌丝体发酵液成分复杂,除了含有大量菌丝体等悬浮固形物外,还含有一些小分子的苦味物质和培养基的被代谢产物,不进行去除不仅影响产品风味和稳定性,并且这些小分子物质浓缩后被人体大量摄入会造成潜在的健康风险。方苏等人(方苏、黄久常、倪志婧.冬虫夏草发酵液营养饮料研制.安徽农业科学,2009,37(8):3762-3764.)以冬虫夏草C-30菌丝发酵滤液为原料研制出一种冬虫夏草发酵液饮料,风味独特,品质稳定;该实验所使用的菌丝发酵滤液只是通过离心技术将菌丝体等固形悬浮物进行固液分离,并未能有效脱除小分子的苦味物质,且蝙蝠蛾被毛孢作为冬虫夏草唯一的无性型菌种,其菌丝体基因组DNA指纹图谱与天然冬虫夏草相似度高达99.39%,药用价值极高,是其他虫草菌种无法超越的。中国专利CN 105876405 A公开了一种发酵冬虫夏草胞外多糖口服液及其制备方法;该实验利用人工发酵冬虫夏草方式生产冬虫夏草菌丝体后的发酵液生产冬虫夏草胞外多糖口服液,将发酵液用外加热式三效浓缩器浓缩,操作过程中并未脱除杂质,且设备要求较高,对所得浓缩液需再进行提纯干燥,操作复杂,并不适合工业生产。
本发明采用华东医药集团有限公司制备百令胶囊的蝙蝠蛾被毛孢的发酵滤液为原料,使用三氯蔗糖、β-环糊精及柠檬酸进行调配,并对产品进行稳定性考察和免疫活性研究。
(三)
技术实现要素:
本发明目的是提供一种虫草菌丝体胞外多糖功能饮料及制备方法。本发明以中国被毛孢发酵滤液为原料,使用三氯蔗糖、β-环糊精及柠檬酸进行调配,制备成一种口感好、食用方便、稳定性好且可以提高机体免疫功能的虫草菌丝体胞外多糖功能饮料。
本发明采用的技术方案是:
本发明提供一种虫草菌丝体胞外多糖功能饮料,所述饮料由虫草菌丝体胞外多糖溶液、β-环糊精、三氯蔗糖和柠檬酸组成;所述β-环糊精用量以虫草菌丝体胞外多糖溶液体积计为15-50g/30L,所述三氯蔗糖用量以虫草菌丝体胞外多糖溶液体积计为5-30g/30L,所述柠檬酸用量以虫草菌丝体胞外多糖溶液体积计为5-40g/30L;
所述虫草菌丝体胞外多糖溶液中多糖质量含量为85-95%,蛋白质量含量为3-7%,按如下方法制备:将中国被毛孢(Hirsutella sinensis)经发酵培养获得的发酵液离心,上清液经膜孔径为0.1μm-0.45μm的膜(优选陶瓷管式膜)预过滤,除去微米级悬浮物,得到滤液A;滤液A采用孔径为0.001μm-0.005μm的膜(优选卷式膜)过滤,除去大部分具有苦味的小分子物质,得到含小分子物质的滤液B和含虫草菌丝体胞外多糖的截留液C,将滤液B通过仅允许水分子透过的反渗透膜(优选孔径为0.0001μm二级反渗透膜)进行回水利用,截留液C即得虫草菌丝体胞外多糖溶液。
进一步,所述虫草菌丝体胞外多糖溶液按如下方法制备:将中国被毛孢(Hirsutella sinensis)经发酵培养获得的发酵液离心,上清液经膜孔径为0.1μm-0.45μm的陶瓷管式膜预过滤,再将滤液经过孔径为0.01-0.1μm中空纤维膜进行二次过滤,获得滤液A1,滤液A1采用膜孔径为0.001μm-0.005μm的卷式膜过滤,得到滤液B和含虫草菌丝体胞外多糖的截留液C,将滤液B通过仅允许水分子透过的二级反渗透膜(孔径为0.0001μm)进行回水利用,截留液C即得虫草菌丝体胞外多糖溶液。
进一步,所述陶瓷管式膜、中空纤维膜、卷式膜和二级反渗透膜的过滤条件均为:40-60psi,流速为30-50mL/min。
进一步,所述陶瓷管式膜孔径为0.22μm,中空纤维膜孔径为0.1μm,卷式膜孔径为0.005μm。
进一步,优选所述虫草菌丝体胞外多糖功能饮料中β-环糊精用量以虫草菌丝体胞外多糖溶液体积计为15-45g/30L,所述三氯蔗糖用量以虫草菌丝体胞外多糖溶液体积计为5-25g/30L,所述柠檬酸用量以虫草菌丝体胞外多糖溶液体积计为5-35g/30L。
更进一步,优选所述虫草菌丝体胞外多糖功能饮料中β-环糊精用量以虫草菌丝体胞外多糖溶液体积计为15-45g/30L,所述三氯蔗糖用量以虫草菌丝体胞外多糖溶液体积计为5-15g/30L,所述柠檬酸用量以虫草菌丝体胞外多糖溶液体积计为10-25g/30L。
本发明所述离心是在10-20℃下,3000-5000rpm,离心5-10min,优选在18℃下,4500rpm,离心5min。
本发明还提供一种所述虫草菌丝体胞外多糖功能饮料的制备方法,所述方法为:将虫草菌丝体胞外多糖溶液加热至40-50℃,加入配方量的β-环糊精,搅拌5-10min,室温下静置冷却30min,依次加入配方量的三氯蔗糖和配方量的柠檬酸,搅拌均匀,罐装,在110℃-121℃下灭菌20-30min,即得虫草菌丝体胞外多糖功能饮料。
本发明所述发酵液的制备方法参照孙秀萍等人(孙秀萍、赵冰、王晓东.中国被毛孢液体发酵培养条件优化.食品研究与开发,2015,36(23):158-163),具体为:将中国被毛孢(Hirsutella sinensis)培养72h的种子液,以体积浓度5%的接种量接种至发酵培养基,在初始pH6.5,装液量100ml/500ml,温度为16℃,摇床转速150r/min的条件下发酵培养24h,获得发酵液;所述发酵培养基质量组成为:葡萄糖3%,蚕蛹粉2%,土豆20%,KH2PO4 0.2%,MgSO4 0.1%,水解酪蛋白0.1%,复合维生素0.07%,溶剂为去离子水。
与现有技术相比,本发明有益效果主要体现在:
(1)本发明提供的虫草菌丝体胞外多糖功能饮料以虫草发酵滤液为原料,利用膜分离技术去除发酵液中大部分含有苦味的小分子物质,不仅改善了虫草菌丝体多糖功能饮料的风味和稳定性,并且将通过纳滤得到的小分子物质再次通过二级反渗透膜进行回水利用,既充分利用了虫草资源,又减少了原料成本和废水排放量,实现了资源节约和环境友好。
(2)本发明提供的虫草菌丝体胞外多糖功能饮料充分开发了虫草发酵液中主要免疫活性物质——虫草多糖,提高了虫草饮料的保健价值。
(3)本发明提供的虫草菌丝体胞外多糖功能饮料稳定性好,保质期长,加速破坏实验观察三个月,无沉淀和涨罐现象出现,也并未产生异味。
(4)本发明对得到的虫草菌丝体胞外多糖功能饮料固形物进行了小鼠脾淋巴细胞转化实验和小鼠脾NK细胞杀伤活性测定。结果表明虫草菌丝体胞外多糖功能饮料具有潜在的提高机体免疫力价值。
(四)附图说明
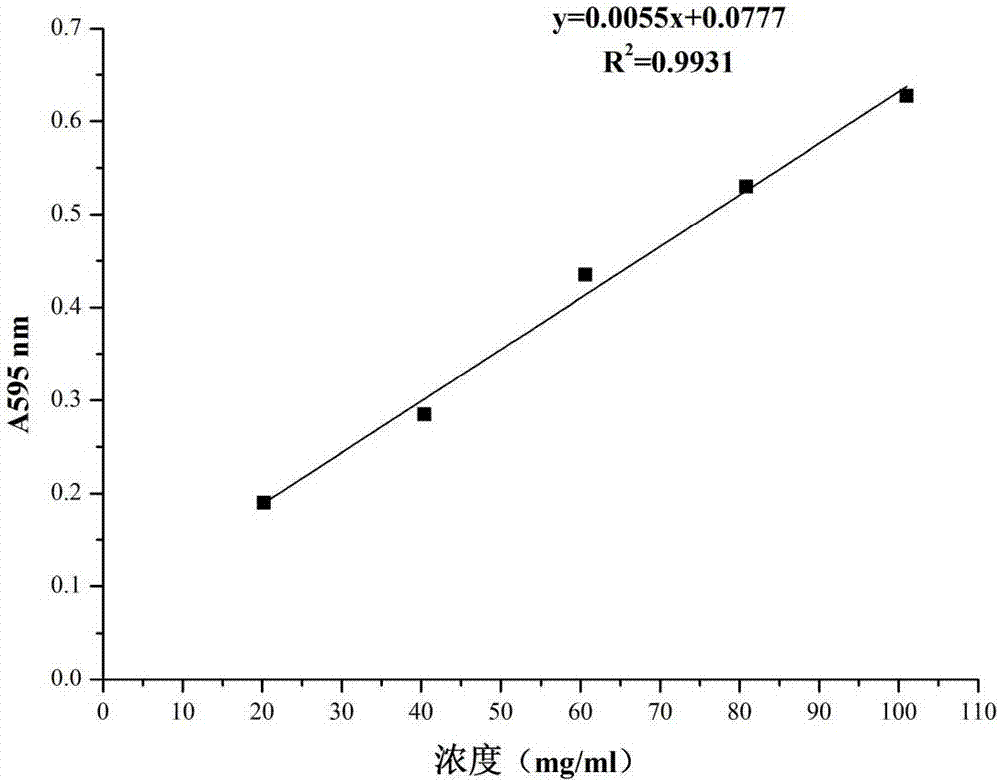
图1多糖标准曲线。
图2蛋白质标准曲线。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
本发明所述室温是指25-30℃。
一、本发明中多糖含量测定方法:多糖含量采用苯酚硫酸法进行测定,以D-葡萄糖作为标准品。
(1)标准曲线的绘制:精密称取葡萄糖标准品10mg,加蒸馏水溶解,并定容至100mL,振荡均匀,分别从中吸取0mL、0.3mL、0.5mL、0.6mL、0.7mL、0.8mL置于试管中,以蒸馏水补至1mL作为标准品溶液,然后加入1mL 5%苯酚溶液,振荡均匀后立即加入5mL浓硫酸(质量分数98%),摇匀后置于40℃水浴中保温15min,冷却至室温,以1mL蒸馏水组作为空白组,用紫外分光光度计测定490nm处吸光度。以葡萄糖质量(mg)为横坐标,吸光度为纵坐标,绘制标准曲线,即得线性回归方程,结果见图1所示。
(2)样品中多糖含量测定:虫草菌丝体胞外多糖1g以适量去离子水溶解后,加入无水乙醇,使乙醇体积终浓度达80%,室温静置4h,弃去上清液,沉淀经真空冷冻干燥后取10mg用水溶解,配制成0.2mg/ml的样品溶液,取1mL样品溶液,然后加入1mL5%苯酚溶液,振荡均匀后立即加入5mL浓硫酸(质量分数98%),摇匀后置于40℃水浴中保温15min,冷却至室温,以1mL蒸馏水组作为空白组,用紫外分光光度计测定490nm处吸光度,平行三组实验,并根据步骤(1)线性回归方程计算样品中葡萄糖含量,即为多糖含量。
二、本发明中蛋白质含量测定方法:蛋白质含量采用考马斯亮蓝法进行测定,以牛血清蛋白作为标准品。
(1)考马斯亮蓝试剂的配制:
精密称取10mg考马斯亮蓝G250溶于5mL 95%乙醇(v/v,以水为溶剂)中,加入10mL 85%磷酸(v/v,以水为溶剂),以蒸馏水稀释至100mL,过滤,备用。
(2)标准曲线的绘制:
精密称取牛血清蛋白标准品10mg,加蒸馏水溶解,并定容至10mL,摇晃均匀,分别从中吸取0mL、0.02mL、0.04mL、0.06mL、0.08mL、0.1mL于试管中,加蒸馏水补至1mL作为标准品溶液,加入5mL考马斯亮蓝试剂,摇匀,室温下静置5min,以1mL蒸馏水组作为空白组,用紫外分光光度计测定595nm处吸光度。以牛血清蛋白含量(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线,即得线性回归方程,见图2所示。
(3)样品中蛋白质含量的测定:虫草菌丝体胞外多糖1g以适量水溶解后,加入无水乙醇,使乙醇体积终浓度达80%,室温静置4h,弃去上清液,沉淀经真空冷冻干燥后取10mg用水溶解,配制成1mg/ml样品溶液,取1mL样品溶液,加入5mL考马斯亮蓝试剂,摇匀,室温下静置5min,以1mL蒸馏水组作为空白组,用紫外分光光度计测定595nm处吸光度,平行三组实验,并根据步骤(2)线性回归方程计算样品中蛋白质含量。
实施例1:
(1)虫草发酵液:参照孙秀萍等人(孙秀萍、赵冰、王晓东.中国被毛孢液体发酵培养条件优化.食品研究与开发,2015,36(23):158-163),具体为:将中国被毛孢(Hirsutella sinensis)培养72h的种子液,以体积浓度5%的接种量接种至发酵培养基,在初始pH6.5,装液量100ml/500ml,温度为16℃,摇床转速150r/min的条件下发酵培养24h,获得发酵液;所述发酵培养基质量组成为:葡萄糖3%,蚕蛹粉2%,土豆20%,KH2PO4 0.2%,MgSO40.1%,水解酪蛋白0.1%,复合维生素0.07%,溶剂为去离子水。
(2)原料预处理:将虫草发酵液煮沸30min脱蛋白后,离心,上清液经膜孔径为0.22μm的陶瓷管式膜预过滤,除去微米级悬浮物,得到滤液A;滤液A采用膜孔径为0.005μm的卷式膜过滤,除去大部分具有苦味的小分子物质,得到含小分子物质的滤液B和含虫草菌丝体胞外多糖的截留液C,将滤液B用膜孔径为0.0001μm的二级反渗透膜进行回水利用,截留液C(即为虫草菌丝体胞外多糖溶液)经冷冻干燥后即得虫草菌丝体胞外多糖,虫草菌丝体胞外多糖经苯酚硫酸法测定多糖含量为86.42%,经考马斯亮蓝法检测蛋白含量为6.34%。
(3)虫草菌丝体胞外多糖饮料的制备:将30L截留液C加热至45℃,加入15gβ-环糊精,搅拌10min,室温下静置冷却30min,依次加入5g三氯蔗糖和10g柠檬酸,搅拌均匀,罐装于300mL玻璃瓶中,在121℃下灭菌30min,即得虫草菌丝体胞外多糖功能饮料。
步骤(2)中经孔径为0.22μm的微滤膜过滤后的滤液中无可见悬浮物,但会加深后续纳滤膜的浓差极化程度,影响过滤效率;对步骤(3)中获得的虫草菌丝体胞外多糖功能饮料进行稳定性和风味考察,放置于温度为37℃,湿度为75%的恒温恒湿箱中加速破坏,观察三月后无可见悬浮物和涨罐,开罐后无异味但略有苦味。
实施例2:
(1)原料预处理:将虫草发酵液(制备方法同实施例1)煮沸30min脱蛋白后,离心,上清液经膜孔径为0.22μm的陶瓷管式膜预过滤后,再将滤液经过孔径为0.1μm中空纤维膜进行二次过滤,得到滤液A除去微米级悬浮物,得到滤液A;滤液A采用膜孔径为0.005μm的卷式膜,过滤,除去大部分具有苦味的小分子物质,得到含小分子物质的滤液B和含虫草菌丝体胞外多糖的截留液C,将滤液B通过膜孔径为0.0001μm的二级反渗透膜进行回水利用,截留液C(即虫草菌丝体胞外多糖溶液)经冷冻干燥后即得虫草菌丝体胞外多糖,虫草菌丝体胞外多糖经苯酚硫酸法测定多糖含量为87.42%,经考马斯亮蓝法检测蛋白含量为5.28%;
(2)虫草菌丝体胞外多糖饮料的制备:将30L截留液C加热至45℃,加入45gβ-环糊精,搅拌10min,室温下静置冷却30min,依次加入10g三氯蔗糖和5g柠檬酸,搅拌均匀,罐装于300mL玻璃瓶中,在121℃下灭菌30min,即得虫草菌丝体胞外多糖功能饮料。
在步骤(1)中经分级过膜后对微米级悬浮物能达到有效分离,且能充分提高后续纳滤膜过滤效率;对步骤(2)中获得的虫草菌丝体胞外多糖功能饮料进行稳定性和风味考察,放置于温度为37℃,湿度为75%的恒温恒湿箱中加速破坏,观察三月后无可见悬浮物和涨罐,开罐后有环糊精的杂味。
实施例3:
(1)原料预处理:将虫草发酵液(制备方法同实施例1)煮沸30min脱蛋白后,离心,上清液经膜孔径为0.22μm的陶瓷管式膜预过滤后,再将滤液经过孔径为0.1μm中空纤维膜进行二次过滤,得到滤液A除去微米级悬浮物,得到滤液A;滤液A采用膜孔径为0.001μm的卷式膜,过滤,除去大部分具有苦味的小分子物质,得到含小分子物质的滤液B和含虫草菌丝体胞外多糖的截留液C,将滤液B通过膜孔径为0.0001μm的二级反渗透膜进行回水利用,截留液C(即虫草菌丝体胞外多糖溶液)经冷冻干燥后即得虫草菌丝体胞外多糖,虫草菌丝体胞外多糖经苯酚硫酸法测定多糖含量为92.81%,经考马斯亮蓝法检测蛋白含量为3.52%;
(2)虫草菌丝体胞外多糖饮料的制备:将30L截留液C加热至45℃,加入35gβ-环糊精,搅拌10min,室温下静置冷却30min,依次加入10g三氯蔗糖和5g柠檬酸,搅拌均匀,罐装于300mL玻璃瓶中,在121℃下灭菌30min,即得虫草菌丝体胞外多糖功能饮料。
对步骤(1)中纳滤孔径减小后得到虫草菌丝体胞外多糖含量大大提高;对步骤(3)中得到的虫草菌丝体胞外多糖功能饮料饮料进行稳定性和风味考察,放置于温度为37℃,湿度为75%的恒温恒湿箱中加速破坏,观察三月后无可见悬浮物和涨罐,开罐后无异味,但酸甜感稍有分离,口味较淡。
实施例4:
(1)原料预处理:将虫草发酵液(制备方法同实施例1)煮沸30min脱蛋白后,离心,上清液经膜孔径为0.22μm的陶瓷管式膜预过滤后,再将滤液经过孔径为0.1μm中空纤维膜进行二次过滤,得到滤液A除去微米级悬浮物,得到滤液A;滤液A采用膜孔径为0.001μm的卷式膜,过滤,除去大部分具有苦味的小分子物质,得到含小分子物质的滤液B和含虫草菌丝体胞外多糖的截留液C,将滤液B通过膜孔径为0.0001μm的二级反渗透膜进行回水利用,截留液C(即虫草菌丝体胞外多糖溶液)经冷冻干燥后即得虫草菌丝体胞外多糖,虫草菌丝体胞外多糖经苯酚硫酸法测定多糖含量为92.81%,经考马斯亮蓝法检测蛋白含量为3.52%;
(2)虫草菌丝体胞外多糖饮料的制备:将30L截留液C加热至45℃,加入35gβ-环糊精,搅拌10min,室温下静置冷却30min,依次加入10g三氯蔗糖和35g柠檬酸,搅拌均匀,罐装于300mL玻璃瓶中,在121℃下灭菌30min,即得虫草菌丝体胞外多糖功能饮料。
对步骤(2)中虫草菌丝体胞外多糖功能饮料进行稳定性和风味考察,放置于温度为37℃,湿度为75%的恒温恒湿箱中加速破坏,观察三月后无可见悬浮物和涨罐,开罐后无异味,但酸味稍明显。
实施例5:
(1)原料预处理:将虫草发酵液(制备方法同实施例1)煮沸30min脱蛋白后,离心,上清液经膜孔径为0.22μm的陶瓷管式膜预过滤后,再将滤液经过孔径为0.1μm中空纤维膜进行二次过滤,得到滤液A除去微米级悬浮物,得到滤液A;滤液A采用膜孔径为0.001μm的卷式膜,过滤,除去大部分具有苦味的小分子物质,得到含小分子物质的滤液B和含虫草菌丝体胞外多糖的截留液C,将滤液B通过膜孔径为0.0001μm的二级反渗透膜进行回水利用,截留液C(即虫草菌丝体胞外多糖溶液)经冷冻干燥后即得虫草菌丝体胞外多糖,虫草菌丝体胞外多糖经苯酚硫酸法测定多糖含量为92.81%,经考马斯亮蓝法检测蛋白含量为3.52%;
(2)虫草菌丝体胞外多糖饮料的制备:将30L截留液C加热至45℃,加入35gβ-环糊精,搅拌10min,室温下静置冷却30min,依次加入25g三氯蔗糖和25g柠檬酸,搅拌均匀,罐装于300mL玻璃瓶中,在121℃下灭菌30min,即得虫草菌丝体胞外多糖功能饮料。
对步骤(2)中获得的虫草菌丝体胞外多糖功能饮料进行稳定性和风味考察,放置于温度为37℃,湿度为75%的恒温恒湿箱中加速破坏,观察三月后无可见悬浮物和涨罐,开罐后无异味,风味适宜,保留原有虫草香味,酸甜适中。
本发明对实施例5经纳滤膜过滤得到的小分子杂质进行回水利用的工艺考察,结果表明本发明采用的二级反渗透膜进行的回水工艺可将78%的废水进行重复利用。
实施例6
1、样品液:将实施例5中得到的虫草胞外多糖功能饮料真空冷冻干燥制成固形物,用RPMI1640基本培养液溶解,分别制成25μg/mL、50μg/mL、100μg/mL的样品液。
2、小鼠脾淋巴细胞增殖能力测定实验步骤
Hank’s液、RPMI1640基本培养液、PBS缓冲液购自吉诺生物医药有限公司,Con A、MTT购于上海泽衡生物技术有限公司,胎牛血清购于浙江生物技术有限公司。
(1)脾淋巴细胞制备
小鼠颈椎脱臼处死,无菌取脾,置于盛有适量无菌Hank’s液的平皿中,用研磨梳进行研磨,制成单细胞悬液。经200目筛网过滤,1000r/min转速离心10min,弃去上清,重复洗涤两次。将细胞沉淀重悬于1ml含10%(v/v)胎牛血清的RPMI1640完全培养液中,用细胞计数板计算细胞数量,调整细胞浓度至3×106个/ml,即为脾淋巴细胞悬液。
(2)脾淋巴细胞增殖
取步骤(1)脾淋巴细胞悬液加入96孔培养板中,每孔100μL。设置空白组和样品组,空白组每孔加入RPMI1640完全培养液100μL,样品组分为低、中、高剂量组,每孔分别加入25μg/mL、50μg/mL、100μg/mL的样品液100μL,每组设5个复孔,置于37℃、5%CO2培养箱中培养68h。弃去培养液,加入不含胎牛血清的RPMI164基本培养液180μL和浓度为5mg/mL的MTT液20μL,继续培养4h。培养结束后弃去上清液,加入DMSO(二甲基亚砜)200μL,摇匀,用酶标仪测定570nm处的吸光度,结果见表1所示。
(3)T淋巴细胞增殖
取步骤(1)中制得的脾细胞悬液加入96孔培养板中,每孔100μL。设置对照组和样品组(分为低、中、高剂量组),对照组每孔加入RPMI1640完全培养液80μL及浓度为10μg/mL的Con A(刀豆蛋白)溶液(溶剂为RPMI1640基本培养液)20μL,样品组的低、中、高剂量组每孔分别加入25μg/mL、50μg/mL、100μg/mL样品液80μL及浓度为10μg/mL的Con A溶液20μL,每组设5个复孔,置于37℃、5%CO2培养箱中培养68h。弃去培养液,加入不含胎牛血清的RPMI164基本培养液180μL和浓度为5mg/mL的MTT液20μL,继续培养4h。培养结束后弃去上清液,加入DMSO 200μL,摇匀,用酶标仪测定570nm处的吸光度,结果见表1所示。
表1表明,三种剂量的虫草菌丝体胞外多糖饮料固形物均能提高小鼠脾淋巴细胞的体外增殖,且呈剂量依赖性,对协同Con A诱导的T淋巴细胞也有明显增殖,说明本发明提供的虫草菌丝体胞外多糖饮料固形物主要是通过诱导T淋巴细胞增殖来增强小鼠脾细胞增殖,从而提高机体免疫能力。本发明提供的虫草菌丝体胞外多糖功能饮料具有良好的免疫增强效果,符合增强免疫力的功能食品检测要求。
表1虫草菌丝体胞外多糖多糖饮料固形物对小鼠脾淋巴细胞转化的影响
3、小鼠脾NK细胞活性测定
小鼠脾NK细胞活性测定实验步骤:
(1)效应细胞(脾淋巴细胞)制备
小鼠颈椎脱臼处死,无菌取脾,置于盛有适量无菌Hank’s液的平皿中,用研磨梳进行研磨,制成单细胞悬液。经200目筛网过滤,1000r/min转速离心10min,弃去上清,重复洗涤两次。将细胞沉淀重悬于1ml含10%(v/v)胎牛血清的RPMI1640完全培养液中,用细胞计数板计算细胞数量,调整细胞浓度至2×106个/ml,作为效应细胞悬液。
(2)靶细胞(YAC-1细胞)制备
取生长情况良好的的YAC-1细胞以1000r/min转速离心5min,弃去上清,重复洗涤两次。将细胞沉淀重悬于1ml含10%(v/v)胎牛血清的RPMI1640完全培养液中,用细胞计数板计算细胞数量,调整细胞浓度至2×105个/ml,作为靶细胞悬液。
(3)NK细胞杀伤活性测定
取一块96孔板,分别设置实验组、靶细胞对照组、效应细胞对照组、空白对照组。其中实验组分为低、中、高剂量组,低剂量组加入终浓度25μg/mL样品液+靶细胞悬液100μL+效应细胞悬液100μL,中剂量组加入终浓度50μg/mL样品液+靶细胞悬液100μL+效应细胞悬液100μL,高剂量组加入终浓度50μg/mL样品液+靶细胞悬液100μL+效应细胞悬液100μL,靶细胞对照组加入靶细胞悬液100μL和1640培养液100μL,效应细胞对照组加入效应细胞悬液100μL和1640培养液100μL,空白对照组加入1640培养液200μL,每组置3个复孔,置于37℃、5%CO2培养箱中培养2h,加入5mg/mL MTT继续孵育2h。培养结束后弃去上清液,加入DMSO 200μL,摇匀,用酶标仪测定570nm处的吸光度,结果见表2所示。
NK细胞活性为X,计算公式为
表2虫草菌丝体胞外多糖多糖饮料固形物对小鼠脾NK细胞活性的影响
表2表明,三种剂量的虫草菌丝体胞外多糖多糖饮料固形物的NK细胞活性均显著高于对照组的NK细胞活性,且呈剂量依赖性,说明本发明提供的虫草菌丝体胞外多糖多糖饮料固形物可显著提高小鼠脾NK细胞的杀伤活性,从而提高机体免疫能力。
- 还没有人留言评论。精彩留言会获得点赞!