用于β-葡聚糖免疫疗法的组合物和方法与流程
本申请要求2012年5月1日提交的美国临时专利申请序列号61/640,834和2012年4月30日提交的美国临时专利申请序列号61/640,397的优先权,每一篇都通过引用并入本文。
概述
一方面,本公开内容描述了包括β-葡聚糖组分和特异性结合β-葡聚糖的抗体组分的组合物。在一些实施方案中,β-葡聚糖可以来源于酵母。在一些实施方案中,β-葡聚糖可以包括β-1,3/1,6 葡聚糖例如β(1,6)-[聚-(1,3)-D-吡喃葡糖基]-聚β(1,3)-D-吡喃葡萄糖。
在一些实施方案中,抗体组分可以包括特异性结合β-葡聚糖的单克隆抗体。在一些实施方案中,单克隆抗体可以包括BfD I、BfD II、BfD III或BfD IV。
在一些实施方案中,β-葡聚糖组分和抗体组分可以在单一制剂中提供。在其他实施方案中,β-葡聚糖组分与抗体组分可以在分开的制剂中提供。
在另一方面,本公开内容描述了一种方法,通常包括给对象联合施用β-葡聚糖和特异性结合β-葡聚糖的抗体制剂。在一些实施方案中,所述方法可以进一步包括给对象施用抗肿瘤抗体。
在另一方面,本公开内容描述了增加对象对β-葡聚糖免疫疗法的应答的方法。一般而言,所述方法包括给对象联合施用包含β-葡聚糖和特异性结合β-葡聚糖的抗体制剂的组合物。在一些实施方案中,所述方法可以进一步包括鉴定对象为低结合者,并施用包含β-葡聚糖和特异性结合β-葡聚糖的抗体制剂的组合物。
在任一这些方法的一些实施方案中,β-葡聚糖和抗体制剂可以同时联合施用。在任一所述方法的其他实施方案中,抗体制剂可以在不同的时间联合施用。在任一所述方法的一些实施方案中,β-葡聚糖和抗体制剂可以在不同部位联合施用。
在这些方法的一些实施方案中,β-葡聚糖可以来源于酵母。在这些方法的一些实施方案中,β-葡聚糖可以包括β-1,3-/1,6 葡聚糖例如β(1,6)-[聚-(1,3)-D-吡喃葡糖基]-聚β(1,3)-D-吡喃葡萄糖。
在这些方法的一些实施方案中,所述抗体组分可以包括特异性结合β-葡聚糖的单克隆抗体,例如BfD I、BfD II、BfD III或BfD IV。
在另一方面,本公开内容描述了增加对象对涉及抗体的β-葡聚糖免疫疗法的应答的方法。一般而言,所述方法包括给对象施用包含缀合到抗体上的β-葡聚糖部分的组合物。在一些实施方案中,β-葡聚糖部分可以被缀合到治疗性抗体上,例如抗肿瘤抗体。在一些实施方案中,所述方法进一步包括鉴定对象为β-葡聚糖的低结合者。
在一些实施方案中,β-葡聚糖部分可以来源于酵母。在一些实施方案中,β-葡聚糖部分可以是,或者来源于,β-1,3/1,6 葡聚糖,例如β(1,6)-[聚(1,3)-D-吡喃葡糖基]–聚-β(1,3)-D-吡喃葡萄糖。
在一些实施方案中,β-葡聚糖疗法可以包括给对象施用β-葡聚糖、特异性结合β-葡聚糖的抗体、以及治疗性抗体。在一些情况下,治疗性抗体可以包括抗肿瘤抗体。
本发明的上述概述并非意图描述本发明每个披露的实施方案或每种实施。下面的描述更具体地举例说明阐述性的实施方案。在整个申请的几个地方,通过例子的列举提供引导,这些例子可以以不同的组合使用。在每种情况下,所述的列表仅作为代表性的组,且不应被解释为排他性的列表。
附图简要说明
图1。显示了对健康人全血中的多形核白细胞的差异性β-葡聚糖 (PGG) 结合的流式细胞仪数据。
图2。显示了对健康人全血中的中性粒细胞的差异性β-葡聚糖结合的数据。
图3。显示了对健康人全血中的单核细胞的差异性β-葡聚糖结合的数据。
图4。比较了低结合者和高结合者的抗β-葡聚糖抗体效价的数据。
图5。显示了高结合者血清可以增加β-葡聚糖对获自低结合者的PMNs的结合的数据。
图6。显示了抗β-葡聚糖抗体可以增加β-葡聚糖对来自低结合者PMNNs的结合的数据。
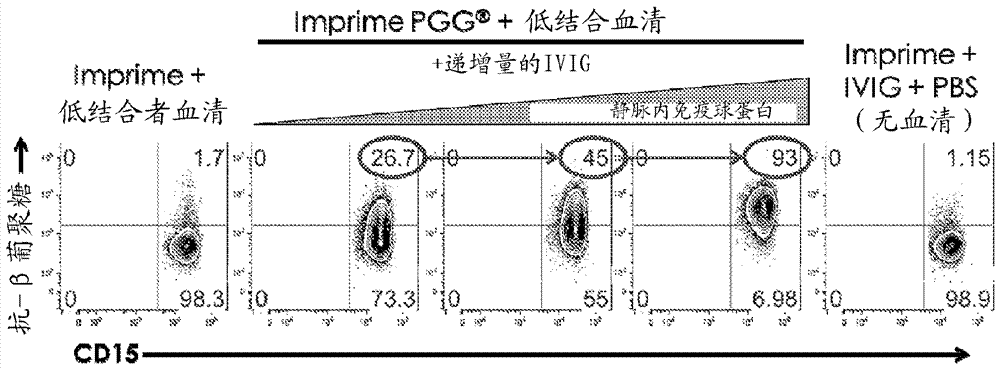
图7。显示了静脉内免疫球蛋白可以增加β-葡聚糖对来自低结合者PMNNs的结合的数据。
图8。显示了通过用包括β-葡聚糖和抗β-葡聚糖抗体的静脉内免疫球蛋白的治疗而由低结合者到高结合者的转变的数据。
图9。两组开放标记的、随机多中心研究的对照组和研究组(invetigational arms)中的患者的治疗平均天数的比较。
图10。显示了PGG-抗体缀合物对PMNs的结合数据。
图11。显示了PGG-IVIG缀合物对PMNs的结合数据。
阐述性实施方案的详细描述
本公开内容描述了与使用β-葡聚糖作为免疫疗法组分相关的方法。本文描述的组合物和方法利用了β-葡聚糖在健康人不同群体中通过免疫细胞的差异性结合的观察结果。令人惊奇的是,β-葡聚糖的“高结合者”显示出了比“低结合者”更高效价的抗β-葡聚糖抗体。因此,本公开内容描述了包括β-葡聚糖组分和特异性结合β-葡聚糖的抗体组分的组合物。本公开内容还描述了这样的方法,通常包括联合施用β-葡聚糖和特异性结合β-葡聚糖的抗体或抗体组分,或者缀合到抗体或抗体片段上的β-葡聚糖部分。这样的方法可以将“低结合者”转变为“高结合者”,以及由此增加了基于β-葡聚糖的免疫疗法可以有效的人群。
β-葡聚糖是葡萄糖的多聚物,其来源于各种微生物及植物源,包括例如酵母、细菌、藻类、海藻、蘑菇、燕麦和大麦。其中,已经广泛评价了酵母β-葡聚糖的免疫调节性质。酵母β-葡聚糖可以以各种形式存在诸如,例如完整的酵母、酵母聚糖 (zymosan)、纯化的全葡聚糖颗粒、溶解的酵母聚糖多糖,或不同分子量的高度纯化的可溶性β-葡聚糖。在结构上,酵母β-葡聚糖是由葡萄糖单体构成的,结构组织为β-(1,3)-连接的吡喃葡萄糖主链与通过β-(1,6)-糖苷键连接到主链上的重复性β-(1,3)-吡喃葡萄糖支链。不同形式的酵母β-葡聚糖的功能可以彼此不同。酵母β-葡聚糖发挥其免疫调节效应的机制可能受到不同形式β-葡聚糖之间的结构差异的影响诸如,例如它的微粒或可溶性质、三级构象、主链长度、侧链长度以及侧链频率。酵母β-葡聚糖的免疫刺激功能还取决于涉及不同物种的不同细胞类型中的受体,这又取决于β葡聚糖的结构性质。
一方面,本公开内容描述了通常包括β-葡聚糖组分和特异性结合β-葡聚糖的抗体组分的组合物。
β-葡聚糖组分可以包括任意合适形式的β-葡聚糖或者两种或更多种形式的β-葡聚糖的任意组合。来自其天然来源的合适的β-葡聚糖和合适的β-葡聚糖制剂描述于例如美国专利申请公开No. US2008/0103112 Al中。在一些实施方案中,β-葡聚糖可以来源于酵母,例如酿酒酵母 (Saccharomyces cerevisiae)。在某些具体实施方案中,β-葡聚糖可以是,或者来源于,β-(1,6)-[聚-(1,3)-D-吡喃葡糖基]-聚-β-(1,3)-D-吡喃葡萄糖,本文也称为PGG (IMPRIME PGG, Biothera, Inc., Eagan, MN),它是酵母来源的β-葡聚糖的高度纯化的且充分表征的形式。因此,β-葡聚糖组分可以包括例如修饰的和/或衍生化的β-葡聚糖,例如国际专利申请No. PCT/US12/36795中描述的那些。在其他实施方案中,β-葡聚糖组分可以包括例如颗粒状的可溶性β-葡聚糖或颗粒状的可溶性β-葡聚糖制剂,它们中的每一种都在例如美国专利No. 7,981,447中描述了。
组合物的抗体组分可以包括特异性结合组合物中的β-葡聚糖组分的任何抗体制剂。本文所使用的“特异性”及其变型是指对于特定目标具有任意程度的差异性或非一般性(即非特异性)的亲和力。因此,抗体组分可以包括多克隆抗体制剂(例如来源于血清)、单克隆抗体制剂、或任意抗体片段(例如Fc部分)。特异性结合β-葡聚糖的示例性单克隆抗体包括例如被鉴定为BfD I、BfD II、BfD III和/或BfD IV (Biothera, Inc., Eagan, MN) 的单克隆抗体,其中的每一个都在美国专利No. 6,294,321中描述了。
缀合到β-葡聚糖组分上的抗体或抗体片段(例如Fc部分)可以是可与β-葡聚糖组分连接的任意合适的抗体或抗体片段。
β-葡聚糖组分、抗体组分、和/或这两种组分的组合可以与“载体”一起配制到组合物中。本文所使用的“载体”包括任意溶剂、分散介质、媒介物、包衣、稀释剂、抗菌剂和/或抗真菌剂、等渗剂、吸收延迟剂、缓冲液、载体溶液、悬浮液、胶体等。这类介质和/或试剂用于药学活性物质的用途是本领域所熟知的。除了与β-葡聚糖或抗体不相容的这个范围内的任意常规介质或试剂,它在治疗性组合物中的使用都是想得到的。补充的活性成分也可以掺入到组合物中。
通过“药学上可接受的”意指不是生物学上或其他所不希望的材料,也就是说该材料可以与β-葡聚糖和/或抗体一起施用给个体,而不会引起任意不希望的生物效应或者与任意包含该材料的药物组合物中的其他成分以有害方式相互作用。
β-葡聚糖组分、抗体组分、和/或这两种组分的组合可以被配制到药物组合物中。在一些实施方案中,组合物中的β-葡聚糖组分和组合物中的抗体组分可以在单一制剂中提供。在其他实施方案中,β-葡聚糖组分和抗体组分可以在分开的制剂中提供。组合物可以被配制成适应一个或多个优选施用途径的各种各样的和/或多种形式。因此,组合物可以通过一种或多种已知途径施用,包括例如口服、肠胃外(例如皮内、经皮、皮下、肌内、静脉内、腹膜内等)、或局部(例如鼻内、肺内、乳房内、阴道内、子宫内、皮内、经皮、经直肠等)。组合物或其部分可以施用到粘膜表面,例如通过施用到鼻或呼吸道粘膜(例如通过喷雾或气溶胶)。组合物或其部分也可通过持续或延迟释放进行施用。
制剂可以方便地以单位剂量形式提供,并且可以通过药学领域中熟知的方法来制备。用药学上可接受的载体制备组合物的方法包括将β-葡聚糖和/或抗体与载体结合的步骤,所述载体构成一种或多种辅助组分。一般而言,制剂的制备可以通过将活性化合物均匀地和/或紧密地结合到液体载体或细碎的固体载体或两者上,然后,如果必要的话,将产物成型为需要的制剂。
β-葡聚糖组分、抗体组分、和/或这两种组分的组合可以以任意合适的形式提供,包括但不限于溶液、悬浮液、乳剂、喷雾剂、气溶胶、或任意的混合物形式。组合物可以在带有任意药学上可接受的赋形剂、载体或媒介物的制剂中递送。例如,制剂可以以常规的局部剂量形式递送,例如乳膏、软膏、气溶胶制剂、非气溶胶喷雾剂、凝胶剂、洗剂等。制剂可以进一步包括一种或更多种添加剂,包括例如佐剂、皮肤渗透增强剂、着色剂、芳香剂、调味剂、增湿剂、增稠剂等。
在另一方面,本发明提供了一种方法,该方法通常包括给对象以彼此有效的量施用β-葡聚糖和特异性结合β-葡聚糖的抗体制剂。本文所使用的“联合施用”是指施用两种或更多种组分的组合,使得组合的治疗或预防效果可以大于单独施用任一组分的治疗或预防效果。两种组分可以同时或顺序联合施用。同时联合施用的组分可以在一种或更多种药物组合物中提供。顺序联合施用两种或更多种组分包括这样的情况,其中施用组分是为了两种组分在两者施用后能够同时进行生物利用。不论组分是同时或顺序联合施用,组分都可以在同一部位或不同部位联合施用。还如本文所使用的“有效量”是指β-葡聚糖和特异性结合β-葡聚糖的抗体的量有效增加β-葡聚糖对免疫细胞(例如多形核白细胞 (PMNs)、单核细胞、或中性粒细胞)的结合,或者有效增加与β-葡聚糖结合相关联的细胞因子和/或趋化因子(例如IL-8)的产生。
适用于所述方法中的β-葡聚糖包括一种或更多种被描述为适用于作为上述组合物中的β-葡聚糖组分的那些。此外,抗体制剂可以包括一种或更多种被描述为适用于作为上述组合物中的抗体组分的抗体。
β-葡聚糖和抗体有效诱导一种或更多种所需效果的量随各种因素而变化,包括但不限于体重、身体状况、和/或对象的年龄、和/或施用途径。因此,包括在给定单位剂量形式中的β-葡聚糖和特异性结合β-葡聚糖的抗体的绝对量可以在很大程度上变化,并取决于因素,例如对象物种、年龄、体重和身体状况以及施用方法。因此,设置通用的量来构成对所有可能的应用都有效的β-葡聚糖和抗体的量是不实际的。然而,本领域普通技术人员可以通过适当考虑这些因素而容易地确定合适的量。
在一些实施方案中,所述方法可以包括给对象施用足够的β-葡聚糖以提供例如约100 ng/kg至约50 mg/kg的剂量,尽管在一些实施方案中,所述方法可以通过施用该范围之外剂量的β-葡聚糖而进行。在一些实施方案中,所述方法包括给对象施用足够的β-葡聚糖以提供约10 µg/kg至约10 mg/kg的剂量诸如,例如约1 mg/kg、约2 mg/kg、约3 mg/kg、约4 mg/kg、约5 mg/ kg、约6 mg/kg、约7 mg/kg、约8 mg/kg、约9 mg/kg或约10 mg/kg的剂量。在一个具体实施方案中,所述方法包括施用足够的β-葡聚糖以提供4 mg/kg的剂量。
可选地,剂量可以使用正好在开始疗程之前获得的实际体重来计算。对于这种方式计算的剂量而言,体表面积 (m2) 是在疗程开始之前使用Dubois方法计算的:m2 = (wt kg0.425 × 高度 cm0.725) × 0.007184。因此,在一些实施方案中,所述方法可以包括施用足够的β-葡聚糖以提供例如约0.01 mg/m2至约10 mg/m2的剂量。
在一些实施方案中,所述方法可以包括给对象施用足够的特异性结合β-葡聚糖的抗体以提供例如约100 ng/kg至约50 mg/kg的剂量,尽管在一些实施方案中,所述方法可以通过施用该范围之外剂量的抗体而进行。在一些实施方案中,所述方法包括给对象施用足够的抗体以提供约10 µg/kg至约5 mg/kg的剂量,例如约100 μg/kg至约1 mg/kg的剂量。在一些实施方案中,特异性结合β-葡聚糖的抗体可以以静脉内免疫球蛋白 (IVIG) 的形式施用,IVIG是含有来自许多供体(通常为数百甚至数千供体,并因此天然含有抗β-葡聚糖抗体)的含混合多价IgG的血液产品。在这样的实施方案中, IVIG可以以约0.1 g/kg至 约2.0 g/kg的剂量施用诸如,例如0.1 g/kg、 0.2 g/kg、 0.3 g/kg、 0.4 g/kg、 0.5 g/kg、 0.6 g/kg、 0.7 g/kg、 0.8 g/kg、 0.9 g/kg、 1.0 g/kg、 1.1 g/kg、 1.2 g/kg、 1.3 g/kg、 1.4 g/kg、 1.5 g/kg、 1.6 g/kg、 1.7 g/kg、 1.8 g/kg、 1.9 g/kg、 或2.0 g/kg。在某些实施方案中,可以施用IVIG以提供约0.4 g/kg至约1.0 g/kg的剂量。
可选地,剂量可以使用正好在开始疗程之前获得的实际体重来计算。对于这种方式计算的剂量而言,体表面积 (m2) 是在疗程开始之前使用Dubois方法计算的:m2 = (wt kg0.425 × 高度 cm0.725) × 0.007184。因此,在一些实施方案中,所述方法可以包括施用足够的抗体以提供例如约0.01 mg/m2至约10 mg/m2的剂量。
在一些实施方案中,β-葡聚糖和抗体可以联合施用,例如从每周单一剂量至多剂量,尽管在一些实施方案中,所述方法可以通过以该范围之外的频率联合施用β-葡聚糖和抗体来进行。在某些实施方案中,β-葡聚糖和抗体可以约每年一次至每周一次进行施用。
如上所述,人们已经广泛评价了酵母β-葡聚糖的免疫调节性质。然而,我们发现了截然不同的个体群体的存在:一个群体表现出β-葡聚糖对全血中先天免疫细胞相对高能力的结合;另一群体表现出β-葡聚糖对全血中先天免疫细胞相对低能力的结合。基于涉及分离的人免疫细胞的小鼠免疫模型和研究的数据,这个观察结果是完全预料不到的。许多个体表现出β-葡聚糖对免疫细胞一定水平的结合,所述免疫细胞来自天然的对β-葡聚糖的低水平暴露。(例如图1,“从头开始”)。当施用外源β-葡聚糖时,“低结合者”表现出与β-葡聚糖结合的先天免疫细胞的百分比的适度增加,而“高结合者”表现出与β-葡聚糖结合的先天免疫细胞的百分比的显著增加。(图1,“+外源PGG”)。图1和图2显示了反映β-葡聚糖对多形核白细胞 (PMNs) 结合的数据,以及图3(单核细胞)显示了差异结合适用于其他免疫细胞群体。此外,“高结合者”也往往会产生更多的细胞因子和/或趋化因子诸如,例如IL-8、MCP、MIP-1等。
本文所使用的“高结合者”状态是指显示出预定百分比的与外源提供的β-葡聚糖结合的特定免疫细胞群体的个体。用于确定个体是“高结合者”还是“低结合者”的免疫细胞群体可以是例如多形核淋巴细胞 (PMNs) 或单核细胞。如果来自个体的血样中至少10%的PMNs或单核细胞与外源提供的β-葡聚糖结合,则该个体可以被认为是“高结合者”。因此,如果来自个体的血样中至少10%、至少12%、至少15%、至少20%、至少15%、或至少40%的PMNs或单核细胞与外源提供的β-葡聚糖结合,则该个体可以是“高结合者”。(参见例如图2和图3)。在一些情况下,外源提供的β-葡聚糖可以包括提供了终浓度为10 µg/mL至100 µg/mL的PGG。如“低结合者”的状态是指没有表现出“高结合者”状态的个体。
而且,“高结合者”可以表现出比“低结合者”更高效价的β-葡聚糖抗体。(图4)。“高结合者”的典型抗β-葡聚糖抗体效价可以是至少25,000诸如,例如至少30,000、至少35,000、至少40,000、至少45,000、至少50,000、至少55,000、或者至少60,000。(参见例如图4)。抗β-葡聚糖的抗体效价通常是指IgG。然而,在一些情况下, IgM抗体的存在可以补偿更低IgG效价以帮助建立“高结合者”状态。
已知β-葡聚糖结合白细胞补体受体3的CD 11b亚基的COOH-末端区域中的凝集素样结构域 (CR3; CD11b/CD18, aMh2整合素, Mac-1; refs.Thorton 等, J Immunol 156:1235-46, Xia 等, J Immunol 162:2281-90)。β-葡聚糖可以引发嗜中性粒细胞、巨噬细胞和自然杀伤细胞对用iC3b调理的肿瘤的细胞毒性。被I-结构域配体iC3b和凝集素样结构域配体β-葡聚糖对白细胞CR3的双占据可能导致了去粒 (degranulation) 和细胞毒性应答。(Li 等, J Immunol 177:1661-9; Tsikitis 等, J Immunol 173:1284-91)。因此,人们可能推测“低结合者”个体可能具有更高的天然抗β-葡聚糖抗体效价,这可以破坏β-葡聚糖和CR3之间的结合。
然而,我们发现是恰恰相反的。“高结合者”表现出比“低结合者”更高效价的抗β-葡聚糖抗体。(图4)。因此,更高效价的抗β-葡聚糖抗体是与β-葡聚糖对免疫细胞上的CR3的增强结合相关联的。
而且,结果是可以转变的。“高结合者”血清可以增加β-葡聚糖对“低结合者”免疫细胞(例如PMNs)的结合。(图5)。增加抗β-葡聚糖单克隆抗体的量也可以增加β-葡聚糖对“低结合者”血清中的免疫细胞(例如PMNs)的结合。(图6)。而且,静脉内免疫球蛋白,含有来自许多供体(通常为数百甚至数千的供体)的混合多价IgG的血液制品和高的天然抗β-葡聚糖效价也可以增加β-葡聚糖对“低结合者”免疫细胞(例如PMNs)的结合。(图7)
结果也可以体内 (in vivo) 证实。复发的转移性结直肠癌对象在包括施用β-葡聚糖治疗5个周期后表现出“低结合者”状态。对象表现出β-葡聚糖对PMNs和单核细胞<5%的结合,以及抗β-葡聚糖抗体效价在健康个体分布曲线的底部10% (1:1600至1:3200)。对象用静脉免疫球蛋白 (IVIG) (0.4 g/kg-1 g/kg)多次治疗。治疗前和治疗后样品是在第二次治疗之前和之后获得的。图8显示,对象表现出β-葡聚糖在治疗前样品中对PMNs和单核细胞的低结合能力(图8,输注前周期7),但IVIG治疗后的样品中结合β-葡聚糖的能力有显著增加(图8,输注后周期7)。在治疗后样品中,对象的抗β-葡聚糖抗体的效价也增加到1:25600,证实了用IVIG治疗的抗β-葡聚糖抗体的转移。
另外,在两组开放标记的随机多中心研究中,795名患有复发/进行性结直肠癌的对象在至少两次在先化疗后被分为对照组和研究组。对照组中的对象接受西妥昔单抗 (cetuximab) 的治疗。研究组中的对象接受西妥昔单抗 + 4 mg/kg PGG β-葡聚糖的治疗。图9显示,尽管接受β-葡聚糖作为其免疫疗法一部分的对象比仅接受西妥昔单抗的对象保持了更长的平均治疗期,在那些“高结合者”的对象中的效果是最大的。在该背景下,治疗的持续期间是治疗成功的指示,因此更长的治疗时间表示了积极的治疗结果,而更短的治疗持续期间表示了更差的结果。因此,“高结合者”状态相对于“低结合者”状态存在临床后果。
因此,在另一方面,本公开内容描述了免疫疗法,其包括给对象施用β-葡聚糖,并与特异性结合β-葡聚糖的抗体以及另外的抗肿瘤抗体联合施用。本文所使用的“抗肿瘤”抗体是指特异性结合肿瘤细胞的抗体,不管肿瘤细胞是否形成实体瘤或者包括白血病细胞或淋巴瘤细胞。β-葡聚糖和特异性结合β-葡聚糖的抗体可以按上文详述进行施用。抗肿瘤抗体可以是按照制造商或健康专家所指导施用的任意合适的抗肿瘤抗体。在该背景下,β-葡聚糖和抗体制剂的联合施用可以增加免疫疗法的效果。例如,当PGG-β-葡聚糖与抗肿瘤单克隆抗体 (mAbs) 组合施用时,已经证实了针对各种各样癌症类型的临床前期活性。示例性癌症类型及其相关联的抗肿瘤mAbs包括例如T细胞淋巴瘤(抗MUCl,抗GD2)、非霍奇金淋巴瘤(利妥昔单抗 (rituximab))、慢性淋巴细胞白血病(利妥昔单抗)、肺癌(抗MUCl)、乳腺癌(抗MMTV)、卵巢癌(贝伐单抗 (bevacizumab))、非小细胞肺癌(贝伐单抗,西妥昔单抗)、结直肠癌(西妥昔单抗)和胰腺癌(西妥昔单抗,抗MUCl)。对于一些对象来说,PGG β-葡聚糖的免疫刺激效果可以通过联合施用特异性结合β-葡聚糖的抗体来增强。
从“低结合者”到“高结合者”状态的类似转变可以通过给对象施用组合物而发生,所述组合物包括缀合到任意抗体或抗体部分上的β-葡聚糖部分。图10显示数据阐明了通过缀合PGG到BTH1704(抗-MUC1,美国专利No. 6,204,366,Biothera, Inc., Eagan, MN, 第三小图)或ERBITUX (Eli Lilly and Co., Indianapolis, IN, 第四小图) 抗肿瘤抗体上而将全血中PMNs的相对低的PGG结合 (Imp Ref, 第二小图) 转变为高结合状态。图11还阐明了通过缀合PGG到静脉内免疫球蛋白 (IVIG, Biolegend, San Diego, CA) 上而将全血中PMNs的相对低的PGG结合 (Imp Ref, 第二小图) 转变为高结合状态。
因此,在另一方面,本公开内容描述了免疫疗法,其包括给对象施用组合物,所述组合物包括缀合到抗体、治疗性抗体、抗肿瘤抗体、或抗体片段(例如抗体的Fc部分)的β-葡聚糖部分的组合物。修饰的和/或衍生化的PGG包括PGG部分和抗体的PGG缀合物,描述于国际专利申请No. PCT/US12/36795,它们也可以应用于抗体片段的缀合物。PGG部分可以是,或者来源于,β-1,3/1,6 葡聚糖。在该背景下,“来源于”要理解为缀合物可能必然是通过替换PGG β-葡聚糖中一个或更多个原子而形成共价键来制备的。本文所使用的“来源于β-1,3/1,6 葡聚糖”是指PGG β-葡聚糖的一部分,在替换PGG的一个或更多个原子以形成缀合物的共价键之后,作为缀合物的一部分而保留。
治疗性抗体可以是能够与用于免疫疗法的β-葡聚糖组合的任意治疗性抗体。因此,治疗性抗体也可以包括任意的抗肿瘤抗体——上述的与本公开内容其他方面相关的——以便提供免疫疗法对抗各种形式的癌症。
本文所使用的术语“和/或”是指所列元素的一个或全部或者所列元素的任意两个或两个以上的组合;当术语“包含”及其变型出现在说明书和权利要求中时,这些术语不具有限制性意思;除非另有规定,“一(a)”、“一个(an)”、“该(the)”和“至少一个”是可以互换使用的,且意指一个或一个以上;并且通过端点记载的数值范围包括该范围内所包含的所有数字(例如1到5包括1、1.5、2、2.75、3、3.80、4、5,等等)。
在前面的描述中,为了清楚,具体实施例可以分开描述。除非另有明确规定具体实施方案的特征与另一个实施方案的相容,某些实施方案可以包括本文所述的与一个或更多个实施方案相关的相容性特征的组合。
对于本文公开的包括不连续步骤的任意方法,所述步骤可以以任意可行的顺序进行。并且,情况允许时,两个或更多个步骤的任意组合可以同时进行。
本发明通过下面的实施方案阐明。可以理解的是,具体的例子、材料、数量和程序要根据本文所述的本发明的范围和精神进行广义解释。
实施例
实施例1
材料
提供了Imprime PGG (Biothera, Inc., Eagan, MN) 作为无防腐剂的可溶性β-葡聚糖制剂,它是在0.8%氯化钠和0.2%柠檬酸二氢钠中以1 mg/ml的浓度于pH 6.4下制备的。将化合物储存于4-8℃下直至使用。
样品制备
全血。新鲜全血 (WB) 获自捐赠前已经提供知情同意的健康志愿者 (New England Institutional Review Board,2007年5月)。血液被收集在含有158 USP单位的冻干肝素钠的Vacutainer®中 (BD Biosciences; San Jose, CA)。
血清和血浆。通过Vacutainer®管 (BD Biosciences; San Jose, CA) 将全血加工成血清或血浆,用血清分离器(红顶)或肝素钠(绿顶)管收集。将管充分混合,在室温下孵育30分钟,然后以2000 rpm(~1150×g)离心10分钟。然后将上清液(血清或血浆)转移到新鲜的聚碳酸酯储存圆锥管中。
抗BG的ELISA方法
使用修改自猴抗β-葡聚糖方法 (Noss 等, 2012 Int. Arch.Allergy Immunol., 157:98-108) 的初步ELISA法测试人血清样品。用50 μL的在纯水中稀释到1 μg/ml纯化β-葡聚糖的β-葡聚糖包被Costar通用结合板,并在37ºC下孵育30分钟。然后将包被的板在室温下暴露于>1500 μW/cm2的高强度紫外光五分钟,并放置在50ºC强风箱里直至干燥为止,然后在室温下第二次暴露于>1500 μW/cm2紫外光五分钟。在用洗涤缓冲液(含0.05% Tween-20的磷酸盐缓冲盐水[PBS])洗涤前将板用0.5%牛血清白蛋白溶液封闭>30分钟。将人血清样品稀释入添加到板上的洗涤缓冲液中,并随后在板上的洗涤缓冲液中连续稀释。将1:400稀释的测试样品吸移到测试板上进行七次另外的连续1:2稀释(1:400和1:12,800之间的血清稀释)的。将样品在室温下孵育30分钟以使得人IgG结合到板结合的β-葡聚糖抗原上。在孵育后用洗涤缓冲液洗涤各孔,并将酶标记的第二抗体(辣根过氧化物酶缀合的亲和纯化的山羊抗人IgG,Fcγ特异性的)在孔中孵育以与结合到β-葡聚糖抗原上的人IgG结合。在洗涤前用洗涤缓冲液使第二抗体孵育30分钟。在将全部洗涤缓冲液从孔中去除后,将过氧化物酶底物在孔中孵育,并在五分钟显色时用~1 M磷酸淬灭显色。在450 nm处用微孔板读数器测量光密度 (OD)。
确定抗β-葡聚糖Ab效价
将来自重复孔的所得OD值进行平均,并减去平均测定背景值。给出背景调整的OD值大于或等于0.100的最大稀释被认为是样品效价,并表达为稀释度的倒数。为定义测定性能,将值赋予给标准参考血清并在每个测定板上构建参考曲线。例如在稀释度为1:12,800时给出背景调整的OD值0.100的测试样品被认为具有12,800的效价。在对样品进行了多次测试并且它们的平均效价落在来自1:400的连续1:2效价水平之间的情况下,将下一最低效价水平报告为它的效价。例如,对来自四次捐献的一个供体的血清在五个独立测定中进行测试,得到平均效价28,160;将它的效价报告为25,600。
测定标准曲线。将160任意单位/mL的值 (AU / mL) 赋予给标准人抗β-葡聚糖抗体。因此,测定方法中1:400的稀释产生了400 mAU/ml的值作为标准稀释曲线的最高点,在测定板上制备了另外的连续1:2稀释物。将测定对照在ELISA洗涤缓冲液中1:100稀释用于测试。此外,独立制备了每个对照水平的两个稀释度用于每个板的平行测试。
统计分析。对标准浓度 (mAU/ mL) 相对平均背景调整的光密度绘图形成标准参考曲线。使用ELISA软件从标准剂量应答曲线计算出4-参数拟合来确定样品、对照和测试血清的未知值。使用落在标准曲线(线性部分)上下拐点之间的测定应答值来确定样品测试值。为计算变异系数 (%CV);将一组值的标准偏差除以同组值的平均值并将结果乘以100。
PGG结合到全血细胞 (WB)
将来自健康供体的一百微升的WB等分至5 mL聚苯乙烯荧光激活细胞分类仪 (FACS) 管中。用Imprime PGG(10 µg/mL或100 µg/mL)或柠檬酸盐缓冲液(媒介物对照)刺激这些WB样品。将含有样品的FACS管用相应的盖子不严密地盖住,并在37℃的增湿培养箱 (5% CO2) 中孵育30分钟或两小时。
表1。用于染色全血样品的抗体混合物。
孵育后,通过添加2 ml的1×Dulbecco氏磷酸盐缓冲盐水 (DPBS) 洗涤所有样品并在4℃下于1500-1700 rpm离心五分钟。经过两轮的洗涤和吸出后,将5 μL抗β-葡聚糖抗体BfD IV (~100 μg/mL) 混合到每根管中,并在室温下孵育30分钟。将该第一抗体用上述1×DPBS洗脱两次,且添加含有第二抗体以及特异性细胞表面标志物的抗体混合物(表1),并在室温下于暗处孵育30分钟。为裂解红细胞,将2 ml的1×BD裂解液 (BD Biosciences; San Jose, CA) 添加到每个样品中并轻轻涡旋。在室温下孵育一小时的时间后,将样品在4℃下于1500-1700 rpm离心五分钟。将BD裂解液吸出,并用1×DPBS洗涤细胞一次且如上所述吸出。为了固定,将300-400 μL的1%多聚甲醛添加到每个样品中。在固定20小时内于LSR II (BD Biosciences; San Jose, CA) 上获取样品。使用FlowJo软件 (Tree Star, Ashland, OR) 分析数据。
实施例2
材料
提供了Imprime PGG (Biothera, Inc., Eagan, MN) 作为无防腐剂的可溶性β-葡聚糖制剂,它是在0.8%氯化钠和0.2%柠檬酸二氢钠中以1 mg/ml的浓度于pH 6.4下制备的。将化合物储存于4-8℃下直至使用。
全血 (WB) 结合测定
新鲜WB获自捐赠前已经提供知情同意的健康志愿者 (New England Institutional Review Board. Blood Donation Protocol No. 07-124)。血液被收集在含有158 USP单位的冻干肝素钠的Vacutainer® (BD Biosciences; San Jose, CA) 中。将血清收集在含有基于凝血酶的促凝剂 (clot activator) 的Vacutainer®管 (BD Biosciences; San Jose, CA)中。收集后约20分钟,在室温下将小瓶于2000 rpm离心10分钟。从小瓶中收获血清,并对于8小时内使用储存于4℃或对于8小时后使用储存于-80℃。
全血结合测定是通过将全血样品与Imprime PGG在37℃的增湿培养箱中孵育30分钟或两小时而进行的。用l×Dulbecco氏磷酸盐缓冲盐水 (DPBS) 洗涤后,添加BfD IV (小鼠抗β-葡聚糖抗体),并与WB在室温下孵育30分钟。经过更多轮洗涤后,再添加包括山羊抗小鼠检测抗体和抗表面分子抗体的抗体混合物,并在室温下于暗处孵育30分钟。用BD裂解液裂解红细胞,并将样品重悬浮在1%的多聚甲醛中。在流式细胞计数仪上获取样品,并使用FlowJo软件 (Ashland, OR) 进行分析。
WB和血清交叉研究
对于血清交叉研究,将全血细胞在1200 rpm离心10分钟,并除去血浆。将血细胞用1×DPBS洗涤1-2次以除去残留的血浆。添加50 µL的血清,并在添加Imprime前进行混合。
对于与抗β-葡聚糖IgG (BioSupplies, Australia) 孵育,将冻干的抗体用1×DPBS重悬浮成1 mg/mL,并作为原液 (stock solution) 储存在-80℃或4℃下。在添加到血液样品之前,将原液1:10稀释至100 μg/mL,并将10 μL该溶液添加到100 μL血液中。对于与IVIG孵育,将10% IVIG (100mg/ml) (PRIVIGEN, CSL Behrling, King of Prussia, PA) 以指示的终浓度添加到全血样品中。
实施例3
新鲜全血获自捐赠前已经提供知情同意的健康志愿者。血液被收集在含有158 USP单位冻干肝素钠的Vacutainer® (BD Biosciences; San Jose, CA) 中。来自健康供体的100 µL全血被等分至5 ml聚苯乙烯FACS管中。将样品用媒介物对照、或PGG参考标准、或PGG-Mucl缀合物 (Imp-BTH1704)、PGG-Erbitux缀合物 (10 μg/mL) 或PGG-IVIG缀合物进行刺激。PGG-抗肿瘤抗体缀合物按照国际专利申请No. PCT/US12/36795所述进行制备。
将含有样品的管子用封口膜不严密地盖上,并在37℃的增湿培养箱 (5% CO2) 中孵育30分钟。孵育后,将所有样品用2 mL的1×DPBS洗涤两次,并在4℃下于1500-1700 rpm离心五分钟。吸出后,将5 μL的抗β-葡聚糖抗体BfD IV (Biothera, Inc., Eagan, MN;美国专利No. 6,294,321) 混合进每个管中,并在室温孵育30分钟。洗涤该抗体两次,并添加含有第二抗体FITC缀合的山羊抗小鼠IgM (Southern Biotech; Birmingham, AL)以及特异性细胞表面标志物CD15、CD14、CD19、CD3和CD45 (Biolegend, San Diego, CA) 的抗体混合物,并在室温下于暗处孵育30分钟。为裂解红血细胞,将2 mL的1×BD裂解液 (BD Biosciences; San Jose, CA) 添加到每个样品中并涡旋。在室温下孵育30分钟后,将样品如上所述进行离心,并用2 mL的l×DPBS洗涤沉淀物。用300 μL的1%多聚甲醛固定细胞,并在LSR II (BD Biosciences, San Jose, CA) 上获取。用FlowJo软件 (Tree Star, Ashland, OR) 分析数据。细胞结合PGG的能力是通过对比用BfD IV染色的细胞的中位荧光强度 (MFI) 以及相对于媒介物治疗的对照组的BfD IV 阳性细胞百分比来评估的。
示例性实施方案
实施方案1. 组合物,所述组合物包含:
可溶性β-葡聚糖组分:和
特异性结合可溶性β-葡聚糖的抗体组分。
实施方案2. 根据实施方案1所述的的组合物,其中所述的可溶性β-葡聚糖来源于酵母。
实施方案3. 根据实施方案1或实施方案2所述的组合物,其中所述的可溶性β-葡聚糖包含β-1,3/1,6 葡聚糖。
实施方案4. 根据前述任一项实施方案所述的组合物,其中所述的可溶性β-葡聚糖包含β(1,6)-[聚(1,3)-D-吡喃葡糖基]-聚-β(1,3)-D-吡喃葡萄糖。
实施方案5. 根据前述任一实施方案所述的组合物,其中所述的抗体组分包含特异性结合可溶性β-葡聚糖的单克隆抗体。
实施方案6.根据实施方案5所述的组合物,其中所述的单克隆抗体包含BfD I、BfD II、BfD III或BfD IV 。
实施方案7. 根据前述任一项实施方案所述的组合物,其中所述的可溶性β-葡聚糖组分和抗体组分是在单一制剂中提供的。
实施方案8. 根据前述任一项实施方案所述的组合物,其中所述的可溶性β-葡聚糖组分和抗体组分是在分开的制剂中提供的。
实施方案9. 根据前述任一项实施方案所述的组合物,进一步包含抗肿瘤抗体。
实施方案10. 方法,所述方法包含给对象联合施用可溶性β-葡聚糖和特异性结合β-葡聚糖的抗体制剂或抗体组分。
实施方案11. 增加对象对可溶性β-葡聚糖免疫疗法的应答的方法,所述方法包含给对象联合施用含有可溶性β-葡聚糖和特异性结合可溶性β-葡聚糖的抗体制剂的组合物。
实施方案12. 根据实施方案11所述的方法,进一步包含鉴定对象为β-葡聚糖的低结合者。
实施方案13. 根据实施方案10-12中任一项所述的方法,其中所述的可溶性β-葡聚糖和抗体制剂是同时联合施用的。
实施方案14. 根据实施方案10-12中任一项所述的方法,其中所述的可溶性β-葡聚糖和抗体制剂是在不同时间联合施用的。
实施方案15. 根据实施方案10-12中任一项所述的方法,其中所述的可溶性β-葡聚糖和抗体制剂是在不同部位联合施用的。
实施方案16. 根据实施方案10-15中任一项所述的方法,其中所述的可溶性β-葡聚糖来源于酵母。
实施方案17. 根据实施方案10-16中任一项所述的方法,其中所述的可溶性β-葡聚糖包含β-1,3/1,6 葡聚糖。
实施方案18. 根据实施方案10-17中任一项所述的方法,其中所述的可溶性β-葡聚糖包含β(1,6)-[聚(1,3)-D-吡喃葡糖基]-聚-β(1,3)-D-吡喃葡萄糖。
实施方案19. 根据实施方案10-18中任一项所述的方法,其中所述的抗体组分包含特异性结合可溶性β-葡聚糖的单克隆抗体。
实施方案20. 根据实施方案19所述的方法,其中所述的单克隆抗体包含BfD I、BfD II、BfD III或BfD IV 。
实施方案21. 增加对象对可溶性β-葡聚糖免疫疗法的应答的方法,所述方法包含给对象施用包含缀合到抗体或抗体片段上的可溶性β-葡聚糖部分的组合物。
实施方案22. 根据实施方案21所述的方法,进一步包含鉴定对象为可溶性β-葡聚糖的低结合者。
实施方案23. 根据实施方案21或实施方案22所述的方法,其中所述的可溶性β-葡聚糖部分来源于酵母。
实施方案24. 根据实施方案21-23中所述的方法,其中所述的可溶性β-葡聚糖部分包含或者来源于β-1,3/1,6 葡聚糖。
实施方案25. 根据实施方案21-24中任一项所述的方法,其中所述的可溶性β-葡聚糖部分包含或者来源于β(1,6)-[聚(1,3)-D-吡喃葡糖基]-聚-β(1,3)-D-吡喃葡萄糖。
实施方案26. 根据实施方案21-25中任一项所述的方法,其中所述的抗体包含治疗性抗体。
实施方案27. 根据实施方案21-26中任一项所述的方法,进一步包含施用抗肿瘤抗体。
实施方案28. 根据实施方案27所述的方法,其中所述的抗肿瘤抗体特异性结合白血病细胞或淋巴细胞。
实施方案29. 根据实施方案27所述的方法,其中所述的抗肿瘤抗体结合到实体瘤细胞上。
实施方案30. 治疗肿瘤的方法,所述方法包含给患肿瘤的对象联合施用组合物,所述组合物包含:
可溶性β-葡聚糖;
特异性结合可溶性β-葡聚糖的抗体制剂;以及
抗肿瘤的抗体制剂。
实施方案31. 根据实施方案30所述的方法,进一步包含鉴定对象为可溶性β-葡聚糖的低结合者。
本文引用的所有专利、专利申请和出版物以及可电子获取的材料(包括例如提交在GenBank和RefSeq.中的核苷酸序列,和提交在例如SwissProt、PIR、PRF、PDB中的氨基酸序列以及来自GenBank和RefSeq.中的注解编码区的翻译)的完整公开内容都通过引用以其整体并入。如果本申请的公开内容和通过引用并入本文的任意文献的公开内容之间存在任何不一致的情况,都应当以本申请的公开内容为准。前述详细说明和实施例仅仅是为了理解的清楚性而给出的。不会从中理解出不必要的限制。本发明并不限于所显示和描述的确切细节,对本领域技术人员而言显而易见的改变将被包括在由权利要求所定义的本发明中。
除非另有说明,用于说明书和权利要求中表示组分的量、分子量等的所有数字都要被理解为在所有情况下都被 “约”所修饰。因此,除非另有相反的说明,在说明书和权利要求中所述的数值参数都是近似值,它们可以根据本发明试图获得的期望性质而变化。至少,以及不会试图对权利要求范围等同的教导进行限制,每个数值参数至少都应按照所报告的有效数字的数值并通过应用常规舍入技术来解释。
尽管本发明的广范围中所述的数值范围和参数是近似值,但在具体实施例中所述的数值要尽可能精确地报告。然而,所有的数值本身就包含了由于在其分别的测试测量中所发现的标准偏差所导致的必要范围。
所有的标题只是为了读者方便且不应被用来限制标题后面的文字的含义,除非特别这样说明了。
- 还没有人留言评论。精彩留言会获得点赞!