一种具有镇痛作用的药物的制作方法
本发明涉及医药领域中一种具有镇痛作用的药物。
背景技术:
阿片类镇痛药是目前临床应用最广泛的镇痛药,其代表性药物为吗啡、可待因(甲基吗啡)、哌替啶(杜冷丁)、曲马多等。阿片类镇痛药的镇痛作用强大,但它引发的不良反应较多,如产生便秘、恶心、呼吸抑制及中枢神经毒性反应等。此外,在反复应用阿片类镇痛药后会使使用者产生耐受性及依赖性,从而易造成该类药物的滥用,故又称为成瘾性镇痛药。阿片类镇痛药的上述毒副作用大大限制了此类药物在临床上的使用。因此,研发不具有耐受性和成瘾性的镇痛药是迫切需要的。目前国内外研究机构和制药公司正努力研发新型不具有耐受性和成瘾性的镇痛药。
曲古抑素A(trichostatin-A,简称TSA;分子式:C17H22N2O3,分子量:302.4,CAS:58880-19-6,别名:曲古柳菌素A),源自链霉菌代谢产物,具有明显的抑制组蛋白去乙酰化酶活性,对肝癌、胃癌、口腔癌及神经母细胞瘤等具有明显的细胞毒性作用。
5-氮杂胞嘧啶核苷(5-azacytidine,简称5-Aza;分子式:C8H12N4O5,分子量:244.20,CAS:320-67-2,别名:5-氮胞苷;5-氮杂胞苷;阿托胞苷;阿扎胞苷;氮胞苷;氮杂胞苷),可掺入DNA,抑制DNA甲基化,影响基因的表达,临床上用于治疗乳腺癌、肠癌、黑色素瘤、急性粒细胞性白血病等。
技术实现要素:
本发明所要解决的技术问题是如何更有效地预防和/或治疗临床的各类疼痛。
为解决上述技术问题,本发明首先提供了预防和/或治疗临床的各类疼痛的药物。
本发明所提供的预防和/或治疗临床的各类疼痛的药物,其活性成分由组分A和组分B组成,所述组分A为5-氮杂胞嘧啶核苷,所述组分B为曲古抑素A。
上述药物中,所述组分A和所述组分B可以按照一定的比例混和在一起使用;所述组分A和所述组分B也可以独立包装,使用时,可先给予所述组分A,然后再给予所述组分B,也可先给予所述组分B,然后再给予所述组分A。
上述药物中,所述活性成分中所述组分A和所述组分B的质量比可为10:(1-8),如10:1,10:2.5,10:3,10:5或10:8。
上述药物中,所述预防和/或治疗临床的各类疼痛可体现为抑制和/或缓解临床的各类疼痛;所述抑制和/或缓解临床的各类疼痛可为抑制和/或缓解临床的各类急性和/或慢性痛;所述抑制和/或缓解临床的各类急性和/或慢性痛可体现为抑制和/或缓解临床的各类急慢性炎性痛、临床的各类急慢性神经性痛、临床的各类急慢性内脏痛和临床的各类癌症痛中的任一种。
上述药物中,所述药物可为注射液、皮下埋植剂、片剂、粉剂、颗粒剂、胶囊、缓释剂或口服液。上述各种剂型的药物均可以按照药学领域的常规方法制备。
需要的时候,在上述药物中还可以加入一种或多种药学上可接受的辅料,所述辅料包括药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、缓释剂、润滑剂等。
本发明所提供的组合物在制备用于预防和/或治疗临床的各类疼痛药物中的应用也属于本发明保护的范围;所述组合物由所述组分A和所述组分B组成,所述组分A为5-氮杂胞嘧啶核苷,所述组分B为曲古抑素A。
上述应用中,所述组合物中,所述组分A和所述组分B可以按照一定的比例混和在一起使用;所述组分A和所述组分B也可以独立包装,使用时,可先给予所述组分A,然后再给予所述组分B,也可先给予所述组分B,然后再给予所述组分A。
上述应用中,所述组合物中,所述组分A和所述组分B的质量比可为10:(1-8),如10:1,10:2.5,10:3,10:5或10:8。
上述应用中,所述预防和/或治疗临床的各类疼痛可体现为抑制和/或缓解临床的各类疼痛;所述抑制和/或缓解临床的各类疼痛可为抑制和/或缓解临床的各类急性和/或慢性痛;所述抑制和/或缓解临床的各类急性和/或慢性痛可体现为抑制和/或缓解临床的各类急慢性炎性痛、临床的各类急慢性神经性痛、临床的各类急慢性内脏痛和临床的各类癌症痛中的任一种。
实验证明,由5-氮杂胞嘧啶核苷和曲古抑素A组成的组合物对预防和/或治疗临床的各类疼痛具有协同增效的作用,显示出明显的镇痛效果,与阿片类镇痛药的代表性药物吗啡的镇痛作用相似,而且多次使用后没有产生耐受性与成瘾性,并且不影响动物的运动能力;由5-氮杂胞嘧啶核苷和曲古抑素A组成的组合物对于急性痛、神经性痛和炎症痛均具有与吗啡相似的镇痛效果,具体实验结果如下:
1)急性痛大鼠实验证明,5-Aza和TSA组合在一起对急性痛产生了协同作用。在联合注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA 30min时,大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为100%-110%;在单独注射剂量为1mg/kg体重5-Aza30min时,大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为40%;在单独注射剂量为0.25mg/kg体重TSA 30min时,大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为30%。在联合注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA 30min时,大鼠对伤害性热刺激的反应潜伏期升高幅度最大为90%-100%;在单独注射剂量为1mg/kg体重5-Aza 30min时,大鼠对伤害性热刺激的反应潜伏期升高幅度最大为40%;在单独注射剂量为0.25mg/kg体重TSA 30min时,大鼠对伤害性热刺激的反应潜伏期升高幅度最大为30%。腹腔注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA和注射剂量为 1mg/kg体重吗啡均能够产生明显的镇痛作用,但是二者的镇痛效果没有明显差异。
2)神经性痛实验证明,联合注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA使神经性痛大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为102.21±14.43%,注射剂量为1mg/kg体重吗啡使神经性痛大鼠对伤害性机械刺激的反应潜伏期升高幅度为123.15±26.07%;联合注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA使神经性痛大鼠对伤害性热刺激的反应潜伏期升高幅度最大为150.43±13.78%,注射剂量为1mg/kg体重吗啡使神经性痛大鼠对伤害性热刺激的反应潜伏期升高幅度为148.78±24.53%。
3)炎症痛实验证明,联合注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA使炎症痛大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为156.08±16.39%,注射剂量为1mg/kg体重吗啡使炎症痛大鼠对伤害性机械刺激的反应潜伏期升高幅度为72.05±10.24%;联合注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA使炎症痛大鼠对伤害性热刺激的反应潜伏期升高幅度最大为136.00±11.67%,注射剂量为1mg/kg体重吗啡使炎症痛大鼠对伤害性热刺激的反应潜伏期升高幅度为109.68±9.06%。
附图说明
图1为在大鼠腹腔内注射5-氮杂胞嘧啶核苷(5-Aza)的镇痛效果。5-Aza的注射剂量分别为0.1mg/kg体重,0.5mg/kg体重,1mg/kg体重,2mg/kg体重的实验结果。其中图1中A(左侧HWL)和B(右侧HWL)为注射后10、30和60min时间点的压板测试结果,腹腔注射各个剂量的5-Aza溶液后60min内,大鼠对伤害性机械刺激的反应潜伏期(HWL)最大升高了约40%(注射剂量为1mg/kg体重5-Aza)。图1中C(左侧HWL)和D(右侧HWL)为注射后10、30和60min时间点的热板测试的实验结果,腹腔注射各个剂量的5-Aza溶液后60min内,大鼠对伤害性热刺激的反应潜伏期(HWL)最大升高了约40%(注射剂量为1mg/kg体重5-Aza)。
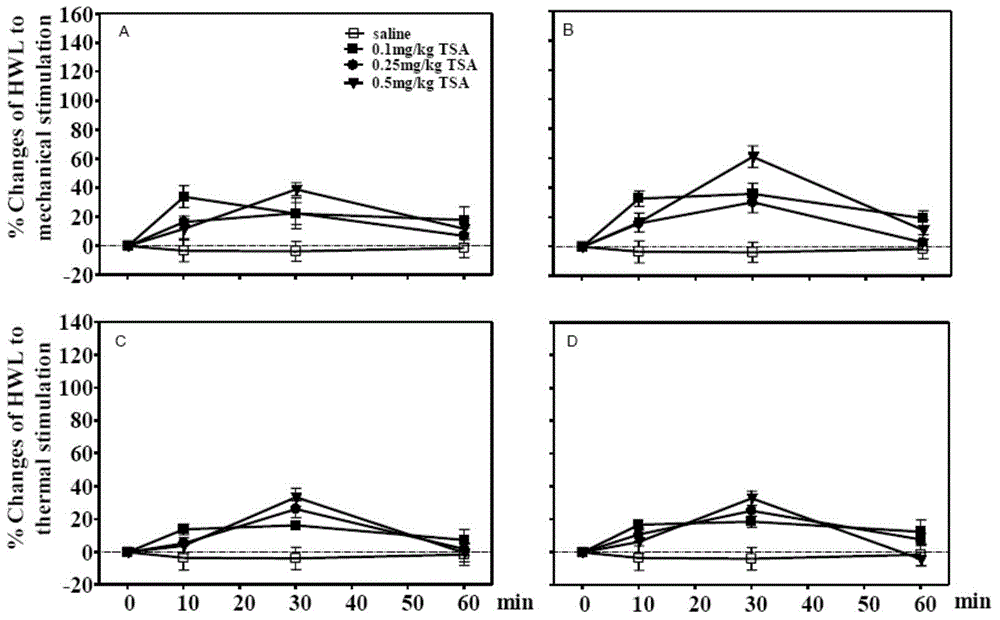
图2为在大鼠腹腔内注射曲古抑素A(TSA)的镇痛效果。TSA的注射剂量为0.1mg/kg体重,0.25mg/kg体重,0.5mg/kg体重的实验结果。其中图2中A(左侧HWL)和B(右侧HWL)为注射后10、30和60min时间点的压板测试结果,腹腔注射各个剂量的TSA溶液后60min内,大鼠对伤害性机械刺激的反应潜伏期最大升高了约40%-60%(注射剂量为0.5mg/kg体重TSA)。图2中C(左侧HWL)和D(右侧HWL)为注射后10、30和60min时间点的热板测试的实验结果,腹腔注射各个剂量的TSA溶液后60min内,大鼠对伤害性热刺激的反应潜伏期最大升高了约36%(注射剂量为0.5mg/kg体重TSA)。
图3为在大鼠腹腔内联合注射5-氮杂胞嘧啶核苷(5-Aza)和曲古抑素A(TSA)组成的组合物的镇痛效果。图3中A(左侧HWL)和B(右侧HWL)为注射后10、30 和60min时间点的压板测试结果,结果发现,腹腔注射各个剂量的5-Aza+TSA后60min内,大鼠对伤害性机械刺激的反应潜伏期最大升高了约90%-100%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA),100%-110%(注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA)或80%-90%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA)。图3中C(左侧HWL)和D(右侧HWL)为注射后10、30和60min时间点的热板测试的实验结果,结果发现,腹腔注射各个剂量的5-Aza+TSA后60min内,大鼠对伤害性热刺激的反应潜伏期最大升高了约80%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA),90%-100%(注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA)或60%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA)。
图4为5-氮杂胞嘧啶核苷(5-Aza)和曲古抑素A(TSA)组成的组合物与吗啡镇痛效果的比较。包括在大鼠腹腔内注射生理盐水组(对照组)的实验结果,腹腔注射吗啡(注射剂量为1mg/kg体重)组的实验结果,腹腔注射5-Aza+TSA(注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA)组的实验结果。图4中A(左侧HWL)和B(右侧HWL)为注射后10、30和60min时间点的压板测试结果,图4中C(左侧HWL)和D(右侧HWL)为注射后10、30和60min时间点的热板测试的实验结果。结果发现,腹腔注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA和注射剂量为1mg/kg体重吗啡对急性痛大鼠的镇痛效果没有明显差异。
图5为在大鼠腹腔内联合注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA后的斜板测试,检测药物对动物运动功能的影响。在大鼠腹腔内给予实验中所用最高剂量5-Aza(1mg/kg体重)+最高剂量TSA(0.5mg/kg体重)注射前和注射后30min时对大鼠进行斜板测试,发现联合注射5-Aza(1mg/kg体重)+TSA(0.5mg/kg体重)后对大鼠的运动功能(肌张力和后爪收缩力)没有明显的影响。
图6为在神经性痛大鼠腹腔内联合注射5-氮杂胞嘧啶核苷(5-Aza)和曲古抑素A(TSA)组成的组合物的镇痛效果。图6中A为注射后30min时压板测试结果,结果发现,腹腔注射各个剂量的5-Aza+TSA后30min时,神经性痛大鼠对伤害性机械刺激的反应潜伏期升高了约72.12±13.12%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA),102.21±14.43%(注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA)和95.43±5.23%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA);神经性痛大鼠注射吗啡后30min时对伤害性机械刺激的反应潜伏期升高了123.15±26.07%(注射剂量为1mg/kg体重吗啡)。
图6中B为注射后30min时热板测试结果,结果发现,腹腔注射各个剂量的5-Aza+TSA后30min时,神经性痛大鼠对伤害性热刺激的反应潜伏期升高了约115.52±
14.59%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA),130.20±19.03%(注 射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA)和150.43±13.78%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA);神经性痛大鼠注射吗啡后30min时对伤害性热刺激的反应潜伏期升高了148.78±24.53%(注射剂量为1mg/kg体重吗啡)。
图7为在炎症痛大鼠腹腔内联合注射5-氮杂胞嘧啶核苷(5-Aza)和曲古抑素A(TSA)组成的组合物的镇痛效果。图7中A为注射后30min时压板测试结果,结果发现,腹腔注射各个剂量的5-Aza+TSA后30min时,炎症痛大鼠对伤害性机械刺激的反应潜伏期升高了约106.80±12.68%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA),156.08±16.39%(注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA)和107.36±21.37%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA);炎症痛大鼠注射吗啡后30min时对伤害性机械刺激的反应潜伏期升高了72.05±10.24%(注射剂量为1mg/kg体重吗啡)。
图7中B为注射后30min时的热板测试结果,结果发现,腹腔注射各个剂量的5-Aza+TSA后30min时,炎症痛大鼠对伤害性热刺激的反应潜伏期升高了114.29±17.31%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA),136.00±11.67%(注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA)和111.75±12.95%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA);炎症痛大鼠注射吗啡后30min时对伤害性热刺激的反应潜伏期升高了109.68±9.06%(注射剂量为1mg/kg体重吗啡)。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中大鼠为SD雄性大鼠(体重在240-300g范围内),为中国军事医学科学院实验动物中心的产品。
下述实施中的盐酸吗啡注射液(沈阳第一制药厂生产,原液浓度为10mg/mL,使用时用无菌生理盐水稀释到所需浓度的溶液),5-Aza(Sigma,使用时用无菌生理盐水稀释到所需浓度,得到5-Aza溶液),TSA(Cell signaling technology,使用时先用50μL无水酒精溶解后再用无菌生理盐水稀释到所需浓度,得到TSA溶液)。
实验采用压力测痛仪(Randall Selitto Test)和热板测痛仪分别测量大鼠对伤害性机械刺激和伤害性热刺激的反应潜伏期,作为衡量痛觉水平的指标。在进行行为药理实验前,首先对受试实验大鼠进行热板和压板测试训练,使受试实验大鼠熟悉测试环境和实验方法,从而避免因紧张造成的实验误差。热板和压板测试训练共进行4天,每天训练3轮,每轮3次。
热板测试:使用热板(XZC-2B,山东医学科学院设备供应维修站)测量受试实验大鼠对伤害性热刺激反应的潜伏期,热板温度维持在52℃。实验者一手抓握大鼠,另一手控制大鼠后肢使其足底面与热板表面充分接触,从开始接触时开始计时,后爪回缩离开热板表面时停止计时,作为其对伤害性热刺激的后爪的缩爪反应潜伏期(Hindpaw withdrawal latency,HWL)。
压板测试(Randall Selitto Test):使用压力测痛仪(UGO Basile,Type 7200,Italy)测量受试实验大鼠对伤害性机械刺激反应的潜伏期。实验者一手抓握大鼠,另一手控制大鼠后肢保证其足底稳定地置于压力测痛仪的小楔形有机玻璃与小平面之间,使小楔形有机玻璃压在大鼠的足背上,然后以30克/秒的速度增加压力,从开始接触时开始计时,后爪回缩离开小平面时停止计时,作为其对伤害性机械刺激的后爪的缩爪反应潜伏期(Hindpaw withdrawal latency,HWL)。
训练后受试实验大鼠对伤害性热刺激的HWL多在4-5秒之间,对伤害性机械刺激的HWL多在4-6秒之间。使用训练的受试实验大鼠进行药物镇痛实验,注射药物前测试受试实验大鼠的HWL,作为基础值;注射药物后各时间点测的HWL以相对于基础值的变化百分比表示。为了避免对组织的损伤,设定HWL最大测定时间在20秒以内。
下述实施例中的大鼠为受试实验大鼠的简称。
下述实施例中的实验结果采用平均值±标准误的方式表示;行为学实验的统计方法采用方差分析(two-way ANOVA),并用Bonferroni post-tests进行检验,或t-test检验,以p<0.05作为在统计学上有显著性差异的标准。
下述实施例中的F是方差分析得到的统计值,Fleft/left为给药组与对照组左侧后肢缩爪反应潜伏期经方差分析得到的F值,同样Fright/right为给药组与对照组右侧后肢缩爪反应潜伏期经方差分析得到的F值。
实施例1、由5-氮杂胞嘧啶核苷(5-Aza)和曲古抑素A(TSA)组成的组合物在急性痛大鼠的镇痛效果
一、大鼠腹腔注射不同剂量的5-氮杂胞嘧啶核苷(5-Aza)溶液的镇痛作用
给正常大鼠腹腔注射等体积的不同剂量的5-Aza溶液,分别获得注射剂量为0.1mg/kg体重、0.5mg/kg体重、1mg/kg体重和2mg/kg体重的四组大鼠(图1中分别标记为0.1mg/kg 5-Aza、0.5mg/kg 5-Aza、1mg/kg 5-Aza和2mg/kg 5-Aza),对照组注射等体积的无菌生理盐水(图1中标记为saline),每组大鼠8只。实验测试方法同上述热板测试和压板测试的操作方法,注射药物前测试受试大鼠的HWL值作为基础值,在注射各剂量的5-Aza溶液后的10、30和60min时间点测定各个实验组的大鼠左右两侧后爪对伤害性机械刺激和伤害性热刺激的缩爪反应潜伏期(Hindpawwithdrawal latency,HWL)。HWL的变化的计算公式为:HWL的变化(%)=(注射药物 后测量的HWL值-注射药物前测量的HWL值)/(注射药物前测量的HWL值)×100%。
实验结果如图1所示,其中图1中A(左侧HWL)和B(右侧HWL)为注射后10、30和60min时间点的压板测试结果,腹腔注射各个剂量的5-Aza溶液后60min内,大鼠对伤害性机械刺激的反应潜伏期(HWL)最大升高了约40%(注射剂量为1mg/kg体重5-Aza),在注射剂量为1mg/kg体重5-Aza 30min时,大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为40%。图1中C(左侧HWL)和D(右侧HWL)为注射后10、30和60min时间点的热板测试的实验结果,腹腔注射各个剂量的5-Aza溶液后60min内,大鼠对伤害性热刺激的反应潜伏期(HWL)最大升高了约40%(注射剂量为1mg/kg体重5-Aza),在注射剂量为1mg/kg体重5-Aza 30min时,大鼠对伤害性热刺激的反应潜伏期升高幅度最大为40%。
与对照组相比,腹腔注射剂量为0.1mg/kg体重的5-Aza溶液后大鼠左侧后爪对机械性刺激和热刺激引起的HWL升高较明显(压板测试:Fleft/left=4.97,P<0.05;热板测试:Fleft/left=21.09,P<0.001);腹腔注射剂量为0.1mg/kg体重的5-Aza溶液后大鼠右侧后爪对机械性刺激和热刺激引起的HWL没有变化(压板测试:Fright/right=2.99,P=0.11;热板测试:Fright/right=4.13,P=0.07)。
与对照组相比,腹腔注射剂量为0.5mg/kg体重的5-Aza溶液后大鼠左侧后爪对机械性刺激和热刺激引起的HWL升高较明显(压板测试:Fleft/left=6.37,P<0.05;热板测试:Fleft/left=17.43,P<0.05);腹腔注射剂量为0.5mg/kg体重的5-Aza溶液后大鼠右侧后爪对机械性刺激和热刺激引起的HWL没有变化(压板测试:Fright/right=6.35,P=0.29;热板测试:Fright/right=3.91,P=0.07)。
与对照组相比,腹腔注射剂量为1mg/kg体重的5-Aza溶液后大鼠后爪对机械性刺激和热刺激引起的HWL显著升高(压板测试:Fleft/left=10.73,P<0.01;Fright/right=5.98,P<0.05;热板测试:Fleft/left=40.04,P<0.001;Fright/right=16.73,P<0.01)。
与对照组相比,腹腔注射剂量为2mg/kg体重的5-Aza溶液后大鼠后爪对机械性刺激和热刺激引起的HWL显著升高(压板测试:Fleft/left=4.99,P<0.05;Fright/right=5.63,P<0.05;热板测试:Fleft/left=43.20,P<0.001;Fright/right=26.04,P<0.01)。
二、腹腔注射不同剂量的曲古抑素A(TSA)溶液的镇痛作用
给正常大鼠腹腔注射等体积的不同剂量的TSA溶液,分别获得注射剂量为0.1mg/kg体重,0.25mg/kg体重和0.5mg/kg体重的三组大鼠(在图2中分别标记为0.1mg/kg TSA、0.25mg/kg TSA和0.5mg/kg TSA),对照组注射等体积的无菌生理盐水(图2中标记为saline),每组大鼠8只。实验测试方法同上述热板测试和压板测试的操作方法,注射药物前测试受试大鼠的HWL值作为基础值,在注射各剂量的TSA溶液后的10、30和60min时间点测定各个实验组的大鼠左右两侧后爪对伤害性机械刺激 和伤害性热刺激的缩爪反应潜伏期(Hindpaw withdrawal latency,HWL)。HWL的变化的计算公式为:HWL的变化(%)=(注射药物后测量的HWL值-注射药物前测量的HWL值)/(注射药物前测量的HWL值)×100%。
实验结果如图2所示,其中图2中A(左侧HWL)和B(右侧HWL)为注射后10、30和60min时间点的压板测试结果,腹腔注射各个剂量的TSA溶液后60min内,大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为40%-60%(注射剂量为0.5mg/kg体重TSA),在注射剂量为0.25mg/kg体重TSA 30min时,大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为30%。图2中C(左侧HWL)和D(右侧HWL)为注射后10、30和60min时间点的热板测试的实验结果,腹腔注射各个剂量的TSA溶液后60min内,大鼠对伤害性热刺激的反应潜伏期升高幅度最大为36%(注射剂量为0.5mg/kg体重TSA),在注射剂量为0.25mg/kg体重TSA 30min时,大鼠对伤害性热刺激的反应潜伏期升高幅度最大为30%。
与对照组相比,腹腔注射剂量为0.1mg/kg体重的TSA溶液后大鼠后爪对机械性刺激和热刺激引起的HWL显著升高(压板测试:Fleft/left=7.87,P<0.05;Fright/right=12.57,P<0.001;热板测试:Fleft/left=29.75,P<0.001;Fright/right=10.88,P<0.01)。
与对照组相比,腹腔注射剂量为0.25mg/kg体重的TSA溶液后大鼠左侧后爪对机械性刺激和热刺激引起的HWL升高较明显(压板测试:Fleft/left=4.53,P=0.057;热板测试:Fleft/left=27.45,P<0.001);腹腔注射剂量为0.25mg/kg体重TSA溶液后大鼠右侧后爪对机械性刺激和热刺激引起的HWL有显著性变化(压板测试:Fright/right=11.20,P<0.05;热板测试:Fright/right=11.24,P<0.01)。
与对照组相比,腹腔注射剂量为0.5mg/kg体重的TSA溶液后大鼠后爪对机械性刺激和热刺激引起的HWL显著升高(压板测试:Fleft/left=11.20,P<0.01;Fright/right=17.32,P<0.01;热板测试:Fleft/left=20.38,P<0.001;Fright/right=7.89,P<0.05)。
三、腹腔注射不同剂量的5-氮杂胞嘧啶核苷(5-Aza)和曲古抑素A(TSA)组成的组合物的镇痛作用
给正常大鼠腹腔注射剂量为1mg/kg体重的5-Aza溶液和分别注射等体积的不同剂量的TSA溶液,分别获得注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA,1mg/kg体重5-Aza+0.25mg/kg体重TSA和1mg/kg体重5-Aza+0.5mg/kg体重TSA的三组大鼠(图3中分别标记为5-Aza 1mg+TSA 0.1mg、5-Aza 1mg+TSA 0.25mg和5-Aza 1mg+TSA 0.5mg),对照组注射等体积的无菌生理盐水(图3中标记为saline),每组大鼠8只。实验测试方法同上述热板测试和压板测试的操作方法,注射药物前测试受试大鼠的HWL值作为基础值,在注射各个剂量的5-Aza+TSA后的10、30和60min时间点测定各个实验组的大鼠左右两侧后爪对伤害性机械刺激和伤害性热刺激的缩爪反应潜伏期 (Hindpaw withdrawal latency,HWL)。HWL的变化的计算公式为:HWL的变化(%)=(注射药物后测量的HWL值-注射药物前测量的HWL值)/(注射药物前测量的HWL值)×100%。
实验结果如图3所示,图3中A(左侧HWL)和B(右侧HWL)为注射后10、30和60min时间点的压板测试结果,结果发现,腹腔注射各个剂量的5-Aza+TSA后60min内,大鼠对伤害性机械刺激的反应潜伏期最大升高了约90%-100%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA),100%-110%(注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA)或80%-90%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA)。图3中C(左侧HWL)和D(右侧HWL)为注射后10、30和60min时间点的热板测试的实验结果,结果发现,腹腔注射各个剂量的5-Aza+TSA后60min内,大鼠对伤害性热刺激的反应潜伏期最大升高了约80%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA),90%-100%(注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA)或60%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA)。
与对照组相比,腹腔注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA后大鼠后爪对机械性刺激和热刺激引起的HWL显著升高(压板测试:Fleft/left=69.93,P<0.001;Fright/right=59.54,P<0.001;热板测试:Fleft/left=46.65,P<0.001;Fright/right=41.69,P<0.001)。
与对照组相比,腹腔注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA后大鼠后爪对机械性刺激和热刺激引起的HWL显著升高(压板测试:Fleft/left=76.17,P<0.001;Fright/right=93.30,P<0.001;热板测试:Fleft/left=44.31,P<0.001;Fright/right=60.57,P<0.001)。
与对照组相比,腹腔注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA后大鼠后爪对机械性刺激和热刺激引起的HWL显著升高(压板测试:Fleft/left=146.50,P<0.001;Fright/right=60.68,P<0.001;热板测试:Fleft/left=65.25,P<0.001;Fright/right=105.10,P<0.001)。
上述实验结果表明,5-Aza和TSA组合在一起对急性痛产生了协同镇痛作用。在联合注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA 30min时,大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为100%-110%;在单独注射剂量为1mg/kg体重5-Aza30min时,大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为40%;在单独注射剂量为0.25mg/kg体重TSA 30min时,大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为30%。在联合注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA 30min时,大鼠对伤害性热刺激的反应潜伏期升高幅度最大为90%-100%;在单独注射剂量为1mg/kg体重5-Aza 30min时,大鼠对伤害性热刺激的反应潜伏期升高幅度最大为40%;在单独 注射剂量为0.25mg/kg体重TSA 30min时,大鼠对伤害性热刺激的反应潜伏期升高幅度最大为30%。
四、由5-氮杂胞嘧啶核苷(5-Aza)和曲古抑素A(TSA)组成的组合物与吗啡镇痛效果的比较
给正常大鼠腹腔注射剂量为1mg/kg体重的5-Aza溶液后注射TSA溶液,获得注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA的实验组大鼠(图4中标记为5-Aza1mg+TSA 0.25mg),给正常大鼠腹腔注射等体积的盐酸吗啡注射液,获得注射剂量为1mg/kg体重吗啡的阳性药物对照组(图4中标记为morphine 1mg),对照组注射等体积的无菌生理盐水(图4中标记为saline),每组大鼠8只。实验测试方法同上述热板测试和压板测试的操作方法,注射药物前测试受试大鼠的HWL值作为基础值,在注射药物后的10、30和60min时间点测定各个实验组的大鼠左右两侧后爪对伤害性机械刺激和伤害性热刺激的缩爪反应潜伏期(Hindpaw withdrawal latency,HWL)。HWL的变化的计算公式为:HWL的变化(%)=(注射药物后测量的HWL值-注射药物前测量的HWL值)/(注射药物前测量的HWL值)×100%。
实验结果如图4所示,图4中A(左侧HWL)和B(右侧HWL)为注射后10、30和60min时间点的压板测试结果,图4中C(左侧HWL)和D(右侧HWL)为注射后10、30和60min时间点的热板测试的实验结果。
与对照组相比,腹腔注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA后大鼠后爪对机械性刺激或热刺激引起的HWL显著升高(压板测试:Fleft/left=76.17,P<0.001;Fright/right=93.30,P<0.001;热板测试:Fleft/left=44.31,P<0.001;Fright/right=60.57,P<0.001)。与对照组相比,腹腔注射剂量为1mg/kg体重的吗啡后大鼠后爪对机械性刺激或热刺激引起的HWL显著升高(压板测试:Fleft/left=58.82,P<0.001;Fright/right=10.02,P<0.01;热板测试:Fleft/left=11.63,P<0.01;Fright/right=14.14,P<0.01)。
以上结果表明,腹腔注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA和注射剂量为1mg/kg体重吗啡均能够产生明显的镇痛作用,但是二者的镇痛效果没有明显差异。
五、由5-氮杂胞嘧啶核苷(5-Aza)和曲古抑素A(TSA)组成的组合物的耐药性实验
给正常大鼠连续腹腔注射本发明的剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA一周以上,经过压板测试和热板测试没有发现由5-Aza和TSA组成的组合物的镇痛作用有明显下降。
六、由5-氮杂胞嘧啶核苷(5-Aza)和曲古抑素A(TSA)组成的组合物的成瘾性实验
本发明注射的药物(5-Aza和TSA)在人体已经使用,没有报道有成瘾性。
七、大鼠运动功能实验
利用斜板实验测量大鼠在腹腔给予实验室中所用最高剂量5-Aza(注射剂量为1mg/kg体重)后注射最高剂量TSA(注射剂量为0.5mg/kg体重)30min后,临界角度没有明显变化(图5)(Paired t-test,P=0.8733,N=6),说明5-Aza和TSA并不影响大鼠的运动功能(肌张力和后爪所缩力)。
实施例2、由5-氮杂胞嘧啶核苷(5-Aza)和曲古抑素A(TSA)组成的组合物在神经性痛大鼠的镇痛效果
实验采用坐骨神经轻度结扎制作大鼠神经性痛模型,具体步骤参照Bennett和Xie的方法(Bennett&Xie 1988)。大鼠在用戊巴比妥钠(50mg/kg体重)完全麻醉后侧卧,结扎侧(左侧)在上。剃去结扎侧大腿至股部鼠毛,充分暴露大腿外侧皮肤并用碘酒消毒,酒精脱碘。沿股骨外轮廓后方切开皮肤和皮下组织。将股筋膜扩延暴露内收肌,将内收肌向后方牵拉暴露深层的坐骨神经。坐骨神经为白色粗大的神经,用玻璃分针将周围结缔组织剥离以游离坐骨神经。用4号丝线自坐骨神经自中枢端向外周端每隔约1毫米做一外科结结扎,共四次结扎。保证结扎强度为仅令神经有轻度缩窄,结扎时可以看到胫部肌肉轻微颤动。轻度结扎只为减缓而不是截断神经表面的血流造成有髓神经纤维的髓鞘变性。结扎完成后将神经复位,并常规缝合肌肉和皮肤。手术后对大鼠腹腔注射16万单位青霉素钠以预防感染。术后7-28天大鼠表现出较稳定的神经性痛,在此期间实验组通过腹腔注射剂量分别为1mg/kg体重5-Aza+0.1mg/kg体重TSA、1mg/kg体重5-Aza+0.25mg/kg体重TSA和1mg/kg体重5-Aza+0.5mg/kg体重TSA的组合物(图6中分别标记为1mg 5-Aza+0.1mg TSA、1mg 5-Aza+0.25mg TSA和1mg5-Aza+0.5mg TSA);阳性对照组注射等体积的盐酸吗啡注射液,注射剂量为1mg/kg体重(图6中标记为morphine);对照组注射等体积的无菌生理盐水(图6中标记为saline),每组大鼠为8只。实验测试方法同上述热板测试和压板测试的操作方法,注射药物前测试受试大鼠的HWL值作为基础值,在注射药物组溶液后的30min时测定各个实验组的大鼠左右两侧后爪对伤害性机械刺激和伤害性热刺激的缩爪反应潜伏期(Hindpaw withdrawal latency,HWL)。HWL的变化的计算公式为:HWL的变化(%)=(注射药物后测量的HWL值-注射药物前测量的HWL值)/(注射药物前测量的HWL值)×100%。
实验结果如图6所示,图6中A为注射后30min时压板测试的结果,结果发现,与对照组相比,腹腔注射各个剂量的5-Aza+TSA后30min时,神经性痛大鼠对伤害性机械刺激的反应潜伏期显著升高,分别升高了约72.12±13.12%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA,t=3.65,P<0.01),102.21±14.43%(注射剂量为1mg/kg 体重5-Aza+0.25mg/kg体重TSA,t=4.97,P<0.001)和95.43±5.23%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA,t=8.41,P<0.0001);与对照组相比,神经性痛大鼠注射吗啡后30min时对伤害性机械刺激的反应潜伏期也显著升高,升高了123.15±26.07%(注射剂量为1mg/kg体重吗啡,t=3.94,P<0.01)。
图6中B为注射后30min时热板测试结果,结果发现,与对照组相比,腹腔注射各个剂量的5-Aza+TSA后30min时,神经性痛大鼠对伤害性热刺激的反应潜伏期显著升高,分别升高了约115.52±14.59%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA,t=5.73,P<0.001),130.20±19.03%(注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA,t=5.24,P<0.001)和150.43±13.78%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA,t=7.69,P<0.001);与对照组相比,神经性痛大鼠注射吗啡后30min时对伤害性热刺激的反应潜伏期也显著升高,升高了148.78±24.53%(1mg/kg体重吗啡,t=5.02,P<0.001)。
以上结果表明,由5-Aza和TSA组成的组合物对神经性痛大鼠具有明显的镇痛效果。联合注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA使神经性痛大鼠对伤害性机械刺激的反应潜伏期升高幅度最大为102.21±14.43%,注射剂量为1mg/kg体重吗啡使神经性痛大鼠对伤害性机械刺激的反应潜伏期升高幅度为123.15±26.07%,两者的镇痛效果相当。联合注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA使神经性痛大鼠对伤害性热刺激的反应潜伏期升高幅度为150.43±13.78%,注射剂量为1mg/kg体重吗啡使神经性痛大鼠对伤害性热刺激的反应潜伏期升高幅度为148.78±24.53%,两者的镇痛效果相当。
实施例3、由5-氮杂胞嘧啶核苷(5-Aza)和曲古抑素A(TSA)组成的组合物在炎症痛大鼠的镇痛效果
首先制作大鼠炎症痛模型。将大鼠左侧后肢固定,快速向大鼠左侧足底肉垫中注射新配置的2%的carrgeenan 0.1ml诱发局部炎症,对照组注射同体积生理盐水。一小时后能够观察到由炎症引发的局部水肿。在注射致炎剂后,大鼠后足明显红肿,局部皮温升高,大鼠反复舔舐后足,对伤害性热刺激和伤害性机械刺激呈现痛敏症状。局部炎症反应可以持续8-10小时,在3-4小时表现得最严重,因此给药和测痛实验在大鼠足垫中注射carrgeenan后3小时开始进行实验。实验组通过腹腔注射剂量分别为1mg/kg体重5-Aza+0.1mg/kg体重TSA、1mg/kg体重5-Aza+0.25mg/kg体重TSA和1mg/kg体重5-Aza+0.5mg/kg体重TSA的组合物(图7中分别标记为1mg 5-Aza+0.1mg TSA、1mg 5-Aza+0.25mg TSA和1mg 5-Aza+0.5mg TSA),阳性对照组注射等体积的盐酸吗啡注射液,注射吗啡剂量为1mg/kg体重(图7中标记为morphine),对照组注射等体积的无菌生理盐水(图7中标记为saline),每组大鼠为8只。实验测试方法同 上述热板测试和压板测试的操作方法,注射药物前测试受试大鼠的HWL值作为基础值,在注射药物组溶液后的30min时测定各个实验组的大鼠左右两侧后爪对伤害性机械刺激和伤害性热刺激的缩爪反应潜伏期(Hindpaw withdrawal latency,HWL)。HWL的变化的计算公式为:HWL的变化(%)=(注射药物后测量的HWL值-注射药物前测量的HWL值)/(注射药物前测量的HWL值)×100%。
实验结果如图7所示,图7中A为注射后30min时的压板测试的结果,结果发现,与对照组相比,腹腔注射各个剂量的5-Aza+TSA后30min时,炎症痛大鼠对伤害性机械刺激的反应潜伏期显著升高,升高了约106.80±12.68%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA,t=6.71,P<0.0001),156.08±16.39%(注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA,t=8.21,P<0.0001)和107.36±21.37%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA,t=4.50,P<0.001);与对照组相比,炎症痛大鼠注射吗啡后30min时对伤害性机械刺激的反应潜伏期显著升高,升高了72.05±10.24%(注射剂量为1mg/kg体重吗啡,t=5.09,P<0.001)。
图7中B为注射后30min时的热板测试结果,结果发现,与对照组相比,腹腔注射各个剂量的5-Aza+TSA后30min时,炎症痛大鼠对伤害性热刺激的反应潜伏期显著升高,升高了114.29±17.31%(注射剂量为1mg/kg体重5-Aza+0.1mg/kg体重TSA,t=6.71,P<0.0001),136.00±11.67%(注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA,t=11.05,P<0.0001)和111.75±12.95%(注射剂量为1mg/kg体重5-Aza+0.5mg/kg体重TSA,t=8.23,P<0.0001);与对照组相比,炎症痛大鼠注射吗啡后30min时对伤害性热刺激的反应潜伏期显著升高,升高了109.68±9.06%(注射剂量为1mg/kg体重吗啡,t=14.42,P<0.0001)。
结果表明,由5-Aza和TSA组成的组合物对炎症痛大鼠具有明显的镇痛效果。联合注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA使炎症痛大鼠对伤害性机械刺激的反应潜伏期升高幅度为156.08±16.39%,注射剂量为1mg/kg体重吗啡使炎症痛大鼠对伤害性机械刺激的反应潜伏期升高幅度为72.05±10.24%,前者高于吗啡的镇痛效果。联合注射剂量为1mg/kg体重5-Aza+0.25mg/kg体重TSA使炎症痛大鼠对伤害性热刺激的反应潜伏期升高幅度为136.00±11.67%,注射剂量为1mg/kg体重吗啡使炎症痛大鼠对伤害性热刺激的反应潜伏期升高幅度为109.68±9.06%,两者的镇痛效果相当。
- 还没有人留言评论。精彩留言会获得点赞!