含岩藻甾醇的皮肤美白或皮肤保湿用组合物的制作方法
本发明在韩国海洋水产部的支援下由项目编号D10906112H320000170完成,上述项目的研究管理专业机构为韩国海洋研究院,研究业务名为“海外海洋生物资源开发及应用基础构建”,研究项目名为“印度尼西亚海洋生物资源的保障及基础生理活性分析”,主管机构为延世大学产学协力团,研究期间为2009年11月01日至2012年06月30日。
本专利申请主张于2014年1月23日向韩国专利局提交的韩国申请权利第10-2014-0008415号及第10-2014-0008430号的优选权,该专利申请的公开事项引入本说明书作为参考。
本发明涉及岩藻甾醇(fucosterol)的新用途,更具体地,涉及将包含岩藻甾醇为特征的皮肤美白或保湿用组合物。
背景技术:
人体的肤色由生成黑色素(melanin)色素的黑素细胞(melanocyte)的活动性、血管的分布、皮肤的厚度及类胡罗卜素(carotenoid)、血红蛋白(hemoglobin)等人体内外的色素含有与否等的多种因素决定。黑色素色素的形成受到与遗传因素、激素分泌、压力等相关的生理因素及紫外线照射等的环境因素的影响(Annu.Rev.Genet.37:67-90,2003)。
在黑色素的生成原理中起到重要影响的是被称为酪氨酸酶(tyrosinase)的酶,其在黑素细胞内的黑素体(melanosome)中参与酪氨酸(tyrosine)的氧化过程。通过紫外线暴露等使上述酪氨酸酶活性化,从而作用于酪氨酸,进而借助生成多巴(DOPA;3,4-二羟苯丙氨酸多巴(3,4-dihydroxyphenylalanine))及多巴醌(DOPAquinone)的氧化过程来合成黑色素聚合物(J.Environ.Sci.Health.23(2):105-161,2005)。
黑色素存在于作为外皮的表皮层,从而从紫外线等保护真皮以下的皮肤器官,并且起到保留在皮肤生物体内生成的自由基等的作用,由此起到保护皮肤内蛋白质和基因的重要功能。但众所周知,若生成过多的黑色素,则不仅形成蝴蝶斑、雀斑等,还会促进皮肤老化,而且引发皮肤癌(FASEB J.21(4):976-994,2007)。
为了治疗及减轻如蝴蝶斑、雀斑、色素沉着等皮肤色素异常沉着症状和因紫外线暴露而产生的过度的黑色素色素沉着,从以前就将抗坏血酸、曲酸(kojic acid)、熊果苷(arbutin)、对苯二酚(hydroquinone)、谷胱甘肽(glutathione)或它们的衍生物、具有酪氨酸酶抑制活性的物质与化妆品或药品配合来使用。但是,由于这些物质的不充分的美白效果、对皮肤的安全性问题、与化妆品配合时的剂型及稳定性问题等而被限制使用(Dermatol.Ther.20(5):308-313,2007)。因此,为了解决上述有效成分的问题,对已证实安全性和稳定性的天然物来源的有效成分提出了要求。
皮肤的角质层(Stratum corneum)存在于皮肤的最外层,由于上述角质层直接与外部环境相接触,从而在从外部的物理和化学压力保护我们的身体的方面起到重要的屏障功能(barrier function)。通过表皮的稳态(homeostasis)来维持这些屏障功能。表皮稳态通过基底层的角质形成细胞(keratinocytes)的生长分裂和细胞移动等分化过程,并经过终末分化(terminal differentiation)来形成被称为角质层的皮肤屏障,由此维持持续的皮肤屏障功能(Korean J.Food.Sci.Technol.43:458-463,2011)。
角质形成细胞随着分化而生成对保湿产生影响的2种因素。第一,角质形成细胞在分化的过程中,其细胞膜由被称为编码角质化包膜(cornified envelope)的结构物代替。编码角质化包膜作为由包括兜甲蛋白(loricrin)、外皮蛋白(involucrin)、丝聚合蛋白(filaggrin)在内的多种结构蛋白质借助被称为转谷氨酰胺酶(transglutaminases)的酶形成交联的膜结构物,对外部环境起到皮肤保护功能的同时,抑制角质细胞内的水分蒸发(Nat.Rev.Mol.Cell Biol.6(4):328-340,2005)。由于编码角质化包膜结构蛋白质和转谷氨酰胺酶随着角质形成细胞的分化而开始表达,从而可作为分化因子(differentiation marker)使用(Nat.Rev.Mol.Cell Biol.6(4):328-340,2005)。因此,编码角质化包膜和分化因子可作为保湿的指标使用。
并且,在角质细胞的分化过程中,角质形成细胞生成天然保湿因子(Natural Moisturizing Factor,NMF),并具有作为皮肤屏障(skinbarrier)的功能。生成天然保湿因子的过程中成为重要来源的蛋白质为丝聚合蛋白,丝聚合蛋白因半胱天冬酶14(caspase 14)被分解成亲水性氨基酸,从而形成天然保湿因子。天然保湿因子提供持水能力(waterholdingcapacity)和对空气中的水分的吸湿力(moisture absorption),从而起到维持皮肤内的保湿力的功能(J.Cell Sci.122:1285-1294,2009)。因此,维持对皮肤适当的水平的天然保湿因子是通过皮肤屏障功能的对皮肤健康非常重要的因素。
岩藻甾醇作为主要包含在海藻类的物质,大多数发现于栖息在韩国、中国、日本等亚洲地区的海岸的海藻类。目前为止,岩藻甾醇的活性被报道为具有抗癌(Pharmacogn.Mag.8(29):60-64,2012)、抗糖尿病(Arch.Pharm.Res.27(11):1120-1122,2004),抗氧化(Bioorg.Med.Chem.17(5):1963-1973,2009),改善血脂成分(Biochem.Biophys.Res.Commun.369(2):363-368,2008),改善胆固醇代谢(New Phytol.183(2):291-300,2009),抗菌(J.Pharm.Biomed.Anal.51(2):450-4555,2010),抗真菌(Nat.Prod.Res.24(15):1481-1487,2010),抗老化(Photochem.Photobiol.89(4):911-918,2013)等效果。但目前为止针对岩藻甾醇的皮肤美白活性及保湿活性未进行任何报道。
在本说明书全文中,参照了多篇论文及专利文献,并表示了其引用。所引用的论文及专利文献的公开内容全部引入本说明书作为参照,从而更加明确说明本发明所属技术领域的水平及本发明的内容。
技术实现要素:
技术问题
对此,本发明人在探索具有天然物来源的美白活性或保湿功能的物质的过程中,证明了包含在海藻类的岩藻甾醇具有优秀的美白活性及保湿功能,由此完成为了本发明。
并且,本发明的目的在于,提供皮肤美白用化妆品组合物,其特征在于,包含由以下化学式1表示的岩藻甾醇作为有效成分:
本发明的再一目的在于,提供皮肤美白用食品组合物,其特征在于,包含由上述化学式1表示的岩藻甾醇作为有效成分。
本发明的还有一目的在于,提供皮肤美白用药学组合物,其特征在于,包含由上述化学式1表示的岩藻甾醇作为有效成分。
本发明的另一目的在于,提供皮肤保湿用化妆品组合物,其特征在于,包含由上述化学式1表示的岩藻甾醇作为有效成分。
本发明的又一目的在于,提供皮肤保湿用食品组合物,其特征在于,包含由上述化学式1表示的岩藻甾醇作为有效成分。
本发明又一目的在于,提供皮肤保湿用药学组合物,其特征在于,包含由上述化学式1表示的岩藻甾醇作为有效成分。
通过以下发明的详细说明及发明要求保护范围,更加明确本发明的其他目的及优点。
解决问题的手段
本发明涉及美白功效优秀的皮肤美白用组合物,更详细地,涉及将由化学式1表示的岩藻甾醇作为有效成分包含的皮肤美白用化妆品、食品及药学组合物。
根据本发明的另一实施方式,本发明涉及保湿功能优秀的皮肤保湿用组合物,更详细地,涉及将由以下化学式1表示的岩藻甾醇作为有效成分包含的皮肤保湿用化妆品、食品及药学组合物。
以下,进一步详细说明本发明的内容。
在本发明的皮肤美白或皮肤保湿用化妆品、食品及药学组合物中,可从海藻类等天然原料提取并通过分离或化学合成方法来合成由上述化学式1表示的岩藻甾醇。
在本发明的组合物中,上述岩藻甾醇可以从鹿角菜(Silvetia siliquosa)、海带(Saccharina japonica)、厚叶解曼藻(Kjellmaniella crassifolia)、裙带菜(Undaria pinnatifida)、冈村枝管藻(Cladosiphon okamuranus)、金鱼藻(Ceratophyllum demersum)、腔昆布(Ecklonia cava)、羊栖菜(Hizikia fusiformis)、爱森藻(Eisenia bicyclis)、育叶网翼藻(Dictyopteris prolifera)、铁钉菜(Ishige okamurae)、萱藻(Scytosiphon lomentaria)、囊藻(Colpomenia sinuosa)、微劳马尾藻(Sargassum fulvellum)、马尾藻属(Sargassum coreanum)、铜藻(Sargassum horneri)、鼠尾藻(Sargassum thunbergii)、链状节荚藻(Cystoseirahakodatensis)等的海藻类提取并分离。
并且,上述岩藻甾醇可以从虾夷葱(Allium schoenoprasum)、大叶桃花心木(Swietenia macrophylla)、欧洲榛(Corylus avellana)、印度苦楝树(Azadirachta indica)、丹桂(Osmanthus fragrans var.aurantiacus),楮实子(Fructus broussonetiae)、甘蔗(Saccharum officinarum)、小米(Setaria italica)等植物提取并分离。
本发明的岩藻甾醇可以从鹿角菜提取(参照实施例1)。
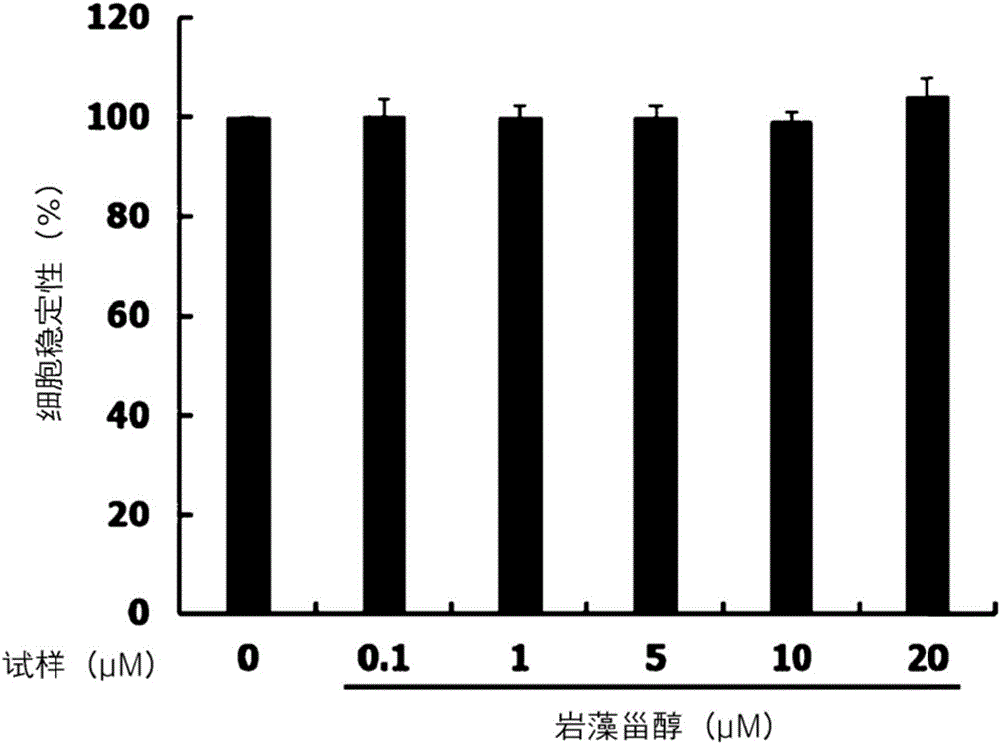
本发明的岩藻甾醇的分离及纯化方法可单独或并行使用填充有硅胶(silica gel)或活性氧化铝(alumina)等的各种合成树脂的柱色谱法及高效液相色谱法(HPLC)等,但提取及分离纯化方法并不一定限定于上述方法。在本发明的一实施例中,为了了解岩藻甾醇的细胞毒性,利用岩藻甾醇处理B16F10黑色素瘤细胞后,通过3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT,3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide)分析检测细胞安全性。其结果发现,本发明的岩藻甾醇在0~20μM的浓度中未显示对B16F10黑色素瘤细胞的毒性(参照实施例2)。
在本发明的再一实施例中,在B16F10黑色素瘤细胞中利用α-黑素细胞刺激素(α-melanocyte stimulating hormone,α-MSH)促进色素生成后,通过给药本发明的岩藻甾醇来检测是否抑制黑色素生成。其结果确认,本发明的岩藻甾醇有效地抑制黑色素的生成(参照实施例3、实施例4)。
在本发明的还有一实施例中,在B16F10黑色素瘤细胞中利用α-黑素细胞刺激素增加酪氨酸酶活性后,通过给药本发明的岩藻甾醇来检测是否抑制酪氨酸酶活性。其结果确认,本发明的岩藻甾醇有效地抑制酪氨酸酶的活性(参照实施例5)。
在本发明的另一实施例中,在B16F10黑色素瘤细胞中利用α-黑素细胞刺激素增加酪氨酸酶的蛋白质表达后,通过给药本发明的岩藻甾醇来检测是否抑制酪氨酸酶的蛋白质表达。其结果确认,本发明的岩藻甾醇有效地抑制酪氨酸酶的蛋白质表达(参照实施例6)。
在本发明的又一实施例中,在B16F10黑色素瘤细胞中利用α-黑素细胞刺激素增加酪氨酸酶相关蛋白-1(TRP-1)和酪氨酸酶相关蛋白-2(TRP-2)的蛋白质表达后,通过给药本发明的岩藻甾醇来检测是否抑制酪氨酸酶相关蛋白-1、酪氨酸酶相关蛋白-2的蛋白质表达。其结果确认,本发明的岩藻甾醇有效地抑制酪氨酸酶相关蛋白-1、酪氨酸酶相关蛋白-2的蛋白质表达(参照实施例7)。
在本发明的又一实施例中,在B16F10黑色素瘤细胞中利用α-黑素细胞刺激素增加小眼畸形相关转录因子(MITF)的蛋白质表达后,通过给药本发明的岩藻甾醇来检测是否抑制小眼畸形相关转录因子的信使RNA(mRNA)表达。其结果确认,本发明的岩藻甾醇有效地抑制小眼畸形相关转录因子的信使RNA表达(参照实施例8)。
并且,由于上述岩藻甾醇的美白活性优秀,因此可用作化妆品组合物、食品组合物或药学组合物的有效成分。
本发明的岩藻甾醇促进编码角质化包膜的形成,促进角质细胞分化,形成天然保湿因子,从而提供卓越的皮肤保湿功效。
在本发明的一实施例中,利用本发明的岩藻甾醇处理角质形成细胞后,检测是否形成编码角质化包膜。其结果确认,本发明的岩藻甾醇有效地促进编码角质化包膜形成(参照实施例9)。
在本发明的再一实施例中,利用本发明的岩藻甾醇处理角质形成细胞,并检测是否在角质形成细胞中增加包含兜甲蛋白、外皮蛋白、转谷氨酰胺酶的分化因子的表达。其结果确认,本发明的岩藻甾醇有效地增加与兜甲蛋白、外皮蛋白、转谷氨酰胺酶等的皮肤保湿相关的分化因子的表达(参照实施例10、实施例11)。
在本发明的还有一实施例中,利用本发明的岩藻甾醇处理角质形成细胞,并检测是否在角质形成细胞中增加丝聚合蛋白和半胱天冬酶14的表达。其结果确认,本发明的岩藻甾醇有效地增加丝聚合蛋白和半胱天冬酶14的表达(参照实施例12、实施例13)。
因此,上述岩藻甾醇的保湿功能优秀,因而可用作化妆品组合物、食品组合物或药学组合物的有效成分。
岩藻甾醇可包含于本发明的皮肤美白用化妆品组合物及皮肤保湿用化妆品组合物作为有效成分,其含量可以是为了达到美白作用或保湿功能的有效量,因此不特别限制其含量,但相对于整个组合物的总重量,优选地,可包含0.001至10重量百分比的上述岩藻甾醇,更优选地,可包含0.01至5重量百分比的上述岩藻甾醇。当含量小于0.001重量百分比时,则无法期待所要求的美白效果或保湿效果,当含量大于10重量百分比时,则很难实现安全性或剂型上的制备。
对于将本发明的岩藻甾醇作为有效成分包含的皮肤美白用化妆品组合物及皮肤保湿用化妆品组合物的剂型,并不进行特别限制,例如,可制成柔软化妆水、收敛化妆水、营养化妆水、营养霜、按摩霜、精华素、眼霜、眼部精华素、洁面霜、洗面奶、卸妆水、面膜、凝胶、粉、润肤液、润肤霜,身体护理油,美肌精华液等的化妆品剂型。
并且,为了提升美白效果,除了上述的岩藻甾醇以外,本发明的皮肤美白用化妆品组合物还可含有其它现有的美白成分,例如,熊果苷、抗坏血酸衍生物等的美白成分,这些现有的美白成分的种类及含量已被本技术领域的普通技术人员所公知。
为了提升保湿功能,除了上述的岩藻甾醇以外,本发明的皮肤保湿用化妆品组合物还可包含其它现有的保湿成分,这些现有的保湿成分的种类及含量已被本技术领域的普通技术人员所公知。
而且,本发明的岩藻甾醇为了美白或保湿的目的能够以食品组合物的形态提供。本发明的食品组合物包括普通食品(conventional foods)、营养补充品(nutritional supplements)、健康功能食品(health function foods)、食品添加剂(food additives)及饲料等的所有形态,将包括人类或家畜在内的动物作为就餐对象。上述类型的食品组合物可根据本技术领域公知的普通方法制备成多种形态。
例如,作为普通食品,虽然不对其进行限制,但可向饮料(包括酒精饮料)、果实及其加工食品(例如:水果罐头、瓶罐头、果酱、果子酱等)、鱼类、肉类及其加工食品(例如:火腿、香肠、咸牛肉等)、面包类及面类(例如:乌冬面、荞麦面条、拉面、意大利面,通心粉等)、果汁、各种饮料、饼干、饴糖、乳制品(例如:黄油、奶酪等)、食用植物乳脂、人造黄油、植物性蛋白质、曲颈瓶食品、冷冻食品、各种调味料(例如:大酱、酱油、酱等)等添加上述岩藻甾醇来制备。并且,作为营养补充品,虽然未对其进行限制,但可向胶囊、药片、药丸等添加上述岩藻甾醇来制备。并且,作为健康功能食品,虽然未对其进行限制,但能够以液化、颗粒化、胶囊化及粉末化的方式摄取,例如,可将上述岩藻甾醇自身制备成茶、果汁及饮料的形态饮用。并且,为了以食品添加剂的形态使用,能够将上述岩藻甾醇制备成粉末或浓缩液的形态来使用。并且,可将上述岩藻甾醇和具有美白效果或保湿效果的公知的活性成分混合来制备成组合物的形态。
岩藻甾醇可包含于皮肤美白用食品组合物及皮肤保湿用食品组合物作为有效成分,其含量可以是为了达到美白作用或保湿功能的有效量,因此不特别限制其含量,但相对于整个组合物的总重量,优选地,可包含0.001至10重量百分比的上述岩藻甾醇。可将岩藻甾醇和具有美白效果或保湿效果的公知的其它活性成分一同混合来制备本发明的食品组合物。本发明的岩藻甾醇能够以其自身、盐或药学上可接受的盐的形态使用。在上述内容中,“药学上可接受的”是指生理学上可接受且在向人类给药时通常不产生过敏反应或与其类似的反应,优选地,上述盐为借助药学上可接受的游离酸(free acid)形成的酸加成盐。作为上述游离酸,可使用有机酸和无机酸。虽然未对上述有机酸进行限定,但上述有机酸包括柠檬酸、乙酸、乳酸、酒石酸、马来酸、富马酸、甲酸、丙酸、乙二酸、三氟乙酸、苯酸、葡萄糖酸、甲磺酸、乙醇酸、琥珀酸、4-甲苯磺酸、谷氨酸及天冬氨酸。并且,虽然未对上述无机酸进行限定,但上述无机酸包括盐酸、溴酸、硫酸及磷酸。
另一方面,上述本发明的药学组合物可单独地包含上述岩藻甾醇或者还可包含一种以上的药学上可接受的载体、赋形剂或稀释剂。作为药学上可接受的载体,例如,还可包括口服给药用载体或非口服给药用载体。口服给药用载体可包括乳糖、淀粉、纤维素酶衍生物、硬脂酸镁、硬脂酸等。并且,非口服给药用载体可包括水、适合的油、食盐水、水溶性葡萄糖及二羟基醇等,而且可额外的包括稳定剂及保鲜剂。作为合适的稳定剂,存在亚硫酸氢钠、亚硫酸钠或抗坏血酸等的抗酸化剂。作为合适的保鲜剂,存在苯扎氯铵、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯及氯丁醇。除此之外的药学上可接受的载体可参照如下的文献(Remington's Pharmaceutical Sciences,19th ed.,Mack P ublishing Company,Easton,PA,1995)。
能够以任何方法向包括人类在内的哺乳动物给药本发明的药学组合物。例如,能够以口服或非口服的方法进行给药。虽然未对非口服的给药方法进行限定,但可以为静脉内、肌肉内、动脉内、骨髓内、硬膜内、心脏内、硬皮、皮下、腹腔内、鼻腔内、肠道、身体局部、舌下或直肠内给药。
本发明的药学组合物可根据如上所述的给药途径制成口服给药用制剂或非口服给药用制剂剂型。在口服给药用制剂的情况下,可利用本技术领域公知的方法,将本发明的组合物制成粉末、颗粒、片剂、丸剂,糖衣片剂、胶囊剂、液体药剂、凝胶剂、糖浆剂、浆料剂、悬浮液等剂型。例如,在口服用制剂中,在配合活性成分和固体赋形剂之后,对其进行粉碎,并添加适合的助剂,然后加工成颗粒混合物,从而获取片剂或糖衣片剂。作为适合的赋形剂的例子,可包括糖类、淀粉类、纤维素类及填充剂,上述糖类包括乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、木糖醇、赤藓糖醇及麦芽糖醇等,上述淀粉类包括玉米淀粉、小麦淀粉、大米淀粉及马铃薯淀粉等,上述纤维素类包括纤维素,甲基纤维素、羧甲基纤维素钠及羟丙基甲基纤维素等,上述填充剂为明胶、聚乙烯吡咯烷酮等。并且,根据情况可将交联键聚乙烯吡咯烷酮、琼脂、褐藻酸或海藻酸钠等作为崩解剂添加。
而且,本发明的药学组合物还可包含抗凝集剂、润滑剂、润湿剂、香料、乳化剂及防腐剂等。在非口服给药用制剂的情况下,可通过本技术领域公知的方法制成注射剂、霜剂、乳剂、外用软膏剂、油剂、保湿剂、凝胶剂、气溶胶及鼻吸入剂形态的剂型。这些剂型记载于作为所有制药化学中通常公知的诊断书的文献(Remington's Pharmaceutical Science,15th Edition,1975.Mack Publishing Company,Easton,Pennsylvania 18042,Chapter 87:Blaug,Seymour)。
可将本发明的药学组合物的总有效量作为单次给药量(single dose)向患者给药,也可通过按多次给药量(multiple dose)长时间给药的分次治疗方法(fractionated treatment protocol)给药。本发明的药学组合物可根据疾病的程度使用不同的有效成分的含量。当非口服给药时,以上述岩藻甾醇为基准,优选地,可一天按每1kg的体重给药0.01至50mg,更优选地,以0.1至30mg的量给药,而且,当口服给药时,以上述岩藻甾醇为基准,优选地,一天可按每1kg的体重给药0.01至100mg,更优选地,以0.1至50mg的量给药的方式分1次至数次给药。但是,由于上述岩藻甾醇的用量是不仅考虑药学组合物的给药途径及治疗次数,还需要考虑患者的年龄、体重、健康状态、性别、疾病的重度、饮食及排泄率等多种因素来决定的对患者的有效给药量,因此当考虑到这些方面时,本技术领域的普通技术人员可根据用于美白的特定用途来决定上述岩藻甾醇的有效给药量。只要能使本发明的药学组合物实现本发明的效果,则不特别限定其剂型、给药途径及给药方法。
发明的效果
如上所述,本发明的岩藻甾醇可通过抑制黑色素生成及酪氨酸酶活性来实现卓越的美白效果,从而可用作美白用化妆品组合物、食品组合物或药学组合物的有效成分。
并且,本发明的岩藻甾醇形成编码角质化包膜,促进角质形成细胞的分化,并且生成天然保湿因子,从而具有卓越的保湿功能,因而可用作保湿用化妆品组合物、食品组合物或药学组合物的有效成分。
附图说明
图1为检测在B16F10黑色素瘤细胞中随着岩藻甾醇处理的细胞毒性的结果。
图2为定量检测在B16F10黑色素瘤细胞中随着岩藻甾醇处理的黑色素生成抑制效果的结果。
图3为利用显微镜观察在B16F10黑色素瘤细胞中随着岩藻甾醇处理的黑色素生成抑制效果的结果。
图4为检测在B16F10黑色素瘤细胞中随着岩藻甾醇处理的酪氨酸酶活性抑制效果的结果。
图5为检测在B16F10黑色素瘤细胞中随着岩藻甾醇处理而酪氨酸酶的蛋白质表达量减少的结果。
图6为检测在B16F10黑色素瘤细胞中随着岩藻甾醇处理而酪氨酸酶相关蛋白-1和酪氨酸酶相关蛋白-2的蛋白质表达量减少的结果。
图7为检测在B16F10黑色素瘤细胞中随着岩藻甾醇处理而小眼畸形相关转录因子的信使RNA表达量减少的结果。
图8为检测在HaCaT人类角质形成细胞中随着岩藻甾醇处理的编码角质化包膜形成效果的结果。
图9为检测在HaCaT人类角质形成细胞中随着岩藻甾醇处理而分化因子、兜甲蛋白、外皮蛋白、转谷氨酰胺酶的信使RNA表达量增加的结果。
图10为检测在HaCaT人类角质形成细胞中随着岩藻甾醇处理而分化因子、兜甲蛋白、外皮蛋白、转谷氨酰胺酶的蛋白质表达量增加的结果。
图11为检测在HaCaT人类角质形成细胞中随着岩藻甾醇处理而丝聚合蛋白和半胱天冬酶14的信使RNA表达量增加的结果。
图12为检测在HaCaT人类角质形成细胞中随着岩藻甾醇处理后而丝聚合蛋白和半胱天冬酶14的蛋白质表达量增加的结果。
具体实施方式
以下,通过实施例对本发明进行详细的说明。但下述实施例仅是为了使他人容易地理解本发明而提供,本发明的范围并不局限于这些实施例。
在以下的所有实验结果中,活性分析反复进行3次以上,其结果以平均±标准偏差表示。统计分析使用方差分析法(ANOVA)(Scheff test),需要注意的是,当*P值小于0.05或者##P值与**P值小于0.01时,则以统计学的方式进行判定。
实施例1岩藻甾醇的提取及分离纯化
利用搅拌器粉碎500g的干燥鹿角菜后,向4倍容积的n-正己烷投入粉碎的鹿角菜试样,在常温中冷浸48小时并进行提取。利用沃特曼(Whatman)2号滤纸对所提取的试样进行过滤,利用真空旋转浓缩器浓缩所过滤的提取液,除去溶剂成分后,获取约15.0g的鹿角菜n-正己烷提取物。将15g的n-正己烷易熔提取物装载于硅胶空心柱(70-230mesh,Merck&Co.,Whitehouse Station,NJ,USA),并利用混合核酸及乙酸乙酯的溶剂体系进行分取。在根据上述分取顺序按浓度梯度分成40个下部分馏物后,其中,从10号与和30号之间的分馏物分离出作为如下的化学式1的化合物的岩藻甾醇(210mg)。
实施例2在黑色素瘤细胞中随着岩藻甾醇处理的安全性效果
在含有10%的胎牛血清(fetal bovine serum)的达尔伯克氏改良伊格尔氏(DMEM,dulbecco's modified eagle's media)培养基中培养B16F10黑色素瘤细胞后,按2.5×104cell/mL(最终体积为1mL)投入24-孔板(24-well plat)。分别利用0.1μM、1μM、5μM、10μM、20μM的岩藻甾醇处理B16F10黑色素瘤细胞。在处理48小时后,除去培养基,将0.5mg/mL的3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐溶液按0.3mL分别投入各孔后,在培养器中培养4小时。4小时后,除去3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐溶液,添加二甲基亚砜(DMSO,dimetyl sulfoxide)溶解所生成的甲腊(formazan)后,在570nm中检测吸光度,其结果示出在图1。
如图1所示,利用岩藻甾醇处理B16F10黑色素瘤细胞的结果,在0~20μM的浓度中未显示细胞毒性。
实施例3在黑色素瘤细胞中随着岩藻甾醇处理的黑色素生成抑制效果
在含有10%的胎牛血清的达尔伯克氏改良伊格尔氏培养基中培养B16F10黑色素瘤细胞后,以2×105cell/mL(最终体积为3mL)投入6-孔板(6-well plate)。培养24小时后,除去培养基,利用浓度分别为5μM、10μM、20μM的溶解的岩藻甾醇处理添加有200nM的α-黑素细胞刺激素的达尔伯克氏改良伊格尔氏培养基。经过72小时,从6-孔板除去所培养的培养基,利用0.25%的胰蛋白酶-乙二胺四乙酸(trypsin-EDTA)溶液进行处理来回收细胞颗粒(pellet),并移动至1.5mL的管(tube),以10000rpm离心分离10分钟来除去上清液。在60℃的温度中对所获取的颗粒进行干燥后,投入100μL的1N NaOH,从而使细胞内的黑色素溶解。利用磷酸盐缓冲盐水(PBS,phosphate buffered saline)稀释上述溶液后,利用酶标仪(Versa max,Sunnyvale,CA,USA)在405nm中检测吸光度,从而求出试样处理组的黑色素含量。此时,将未添加有岩藻甾醇的细胞作为对照组,来检测对照组和利用岩藻甾醇处理的细胞的黑色素生成程度。根据如下的数学式1计算相对于对照组的黑色素含量,并将其结果显示在图2。
数学式1
如图2所示,岩藻甾醇呈现非常优秀的黑色素生成抑制效果(**:P<0.01)。
实施例4利用显微镜观察在黑色素瘤细胞中随着岩藻甾醇处理的黑色素生成抑制效果
在含有10%的胎牛血清的达尔伯克氏改良伊格尔氏培养基中培养B16F10黑色素瘤细胞后,按2×105cell/mL(最终体积为3mL)投入6-孔板。培养24小时后,除去培养基,利用浓度分别为5μM、20μM的溶解的岩藻甾醇处理添加有200nM的α-黑素细胞刺激素的达尔伯克氏改良伊格尔氏培养基。经过72小时后,从6-孔板除去所培养的培养基,利用显微镜(Olympus IX71 Model)拍摄B16F10黑色素瘤细胞,其结果显示在图3。
如图3所示,岩藻甾醇大大抑制利用α-黑素细胞刺激素诱导的B16F10黑色素瘤细胞的黑色素生成。
实施例5在黑色素瘤细胞中随着岩藻甾醇处理的酪氨酸酶活性抑制效果
在含有10%的胎牛血清的达尔伯克氏改良伊格尔氏培养基中培养B16F10黑色素瘤细胞后,按2×105cell/mL(最终体积为3mL)投入6-孔板。培养24小时后,除去培养基,利用浓度分别为5μM、10μM、20μM的溶解的岩藻甾醇处理添加有200nM的α-黑素细胞刺激素的达尔伯克氏改良伊格尔氏培养基。经过48小时后,从6-孔板除去所培养的培养基,通过添加含有1%的曲通X-100(Triton X-100)的磷酸盐缓冲盐水来回收细胞。以10000rpm离心分离所回收的细胞10分钟,向96-孔板(96-wellplate)投入150μL的上清液,并添加50μL的L-多巴(L-3,4-dihydroxyphenylalanine,L-DOPA)。在37℃的温度中培养30分钟后,利用酶标仪(microplate reader)(Versa max,Sunnyvale,CA,USA)在475nm中检测所生成的多巴铬的量的吸光度。此时,将未添加有岩藻甾醇的细胞作为对照组,来检测对照组和利用岩藻甾醇处理的细胞的酪氨酸酶活性程度。根据如下的数学式2计算相对于对照组的酪氨酸酶活性,并将其结果显示在图4。
数学式2
如图4所示,岩藻甾醇呈现非常优秀的酪氨酸酶抑制效果(**:P<0.01)。
实施例6在黑色素瘤细胞中随着岩藻甾醇处理的酪氨酸酶蛋白质表达的减少效果
在含有10%的胎牛血清的达尔伯克氏改良伊格尔氏培养基中培养B16F10黑色素瘤细胞后,按2×105cell/mL(最终体积为3mL)投入6-孔板。培养24小时后,除去培养基,利用浓度分别为5μM、20μM的溶解的岩藻甾醇处理添加有200nM的α-黑素细胞刺激素的达尔伯克氏改良伊格尔氏培养基。经过24小时后,利用含有蛋白酶抑制剂混合物(proteinase inhibitor cocktail)的乙基苯基聚乙二醇(NP40)缓冲液来溶解细胞,并且利用考马斯亮蓝(Bio-Rad proein assay dye reag ent,Bradford)试剂对从细胞提取的蛋白质量进行定量。在煮沸5分钟所定量的蛋白质后,利用10%的聚丙烯酰胺凝胶电泳(SDS-PAGE)进行电泳,从而完成分离,并利用硝酸纤维素膜(nitrocellular membr ane)传递所分离的蛋白质。将酪氨酸酶的第一抗体以1:1000的比率稀释于2.5%的牛血清白蛋白(bovine serum albumin),并在常温中与传递至硝酸纤维素膜的蛋白质进行20小时左右的反应。在使第一抗体完成反应之后,利用TBST(tris-buffer saline tween20)以每次10分钟的方式清洗3次硝酸纤维素膜。完成清洗后,将识别第一抗体的第二抗体(anti-goat horseradish)以1:5000的比率稀释于2.5%的牛血清白蛋白,并在常温中与硝酸纤维素膜反应2小时左右,利用TBST以每次10分钟的方式清洗3次。通过使用ECL免疫印迹检测试剂(western blotting detection reagents)(Amersham,Tokyo,Japan)来使蛋白条带(Protein band)显色,并利用G;BOX EF成象系统(G;BOX EF imaging system)(Syngene,Cambridge,UK)确认所显色的蛋白条带。检测结果,确认了酪氨酸酶的蛋白质表达,并且通过α-微管蛋白(α-tubulin)确认蛋白质的负荷剂量为规定量。
如图5所示,岩藻甾醇在B16F10黑色素瘤细胞中使作为黑色素生成酶的酪氨酸酶的蛋白质表达减少。
实施例7在黑色素瘤细胞中随着岩藻甾醇处理的与酪氨酸酶相关的酪氨酸酶相关蛋白-1和酪氨酸酶相关蛋白-2的蛋白质表达减少效果
在含有10%的胎牛血清的达尔伯克氏改良伊格尔氏培养基中培养B16F10黑色素瘤细胞后,按2×105cell/mL(最终体积为3mL)投入6-孔板。培养24小时后,除去培养基,利用浓度分别为5μM、20μM的溶解的岩藻甾醇处理添加有200nM的α-黑素细胞刺激素的达尔伯克氏改良伊格尔氏培养基。经过24小时后,利用含有蛋白酶抑制剂混合物的乙基苯基聚乙二醇缓冲液溶解细胞,并且利用考马斯亮蓝试剂对从细胞提取的蛋白质量进行定量。在煮沸5分钟所定量的蛋白质后,利用10%的聚丙烯酰胺凝胶电泳进行电泳,从而完成分离,并利用硝酸纤维素膜传递所分离的蛋白质。将酪氨酸酶相关蛋白-1和酪氨酸酶相关蛋白-2的第一抗体以1:1000的比率稀释于2.5%的牛血清白蛋白,并在常温中与传递至硝酸纤维素膜的蛋白质进行20小时左右的反应。在使第一抗体完成反应后,利用TBST以每次10分钟的方式清洗3次硝酸纤维素膜。完成清洗后,将识别第一抗体的第二抗体(anti-goat horseradish)以1:5000的比率稀释于2.5%的牛血清白蛋白,并在常温中与硝酸纤维素膜反应2小时左右,利用TBST以每次10分钟的方式清洗3次。通过使用ECL免疫印迹检测试剂(Amersham,Tokyo,Japan)来使蛋白条带显色,并利用G;BOX EF成象系统(Syngene,Cambridge,UK)确认所显色的蛋白条带。检测结果,确认了酪氨酸酶相关蛋白-1和酪氨酸酶相关蛋白-2的表达,通过α-微管蛋白确认蛋白质的负荷剂量为规定量。
如图6所示,岩藻甾醇在B16F10黑色素瘤细胞中使作为黑色素生成酶的酪氨酸酶相关蛋白-1和酪氨酸酶相关蛋白-2的蛋白质表达减少。
实施例8在黑色素瘤细胞中随着岩藻甾醇处理的小眼畸形相关转录因子的信使RNA表达减少效果
在含有10%的胎牛血清的达尔伯克氏改良伊格尔氏培养基中培养B16F10黑色素瘤细胞后,按2×105cell/mL(最终体积为3mL)投入6-孔板。培养24小时后,除去培养基,利用浓度分别为5μM、20μM的溶解的岩藻甾醇处理添加有200nM的α-黑素细胞刺激素的达尔伯克氏改良伊格尔氏培养基。经过24小时后,使用TRIzol试剂(Invitrogen,Carlsbad,CA,USA)分离总RNA。所分离的总RNA可利用分光光度计(nano-drop,ND-1000)进行定量。利用逆转录酶(reverse transcriptase)和聚合酶链反应(PCR)仪(Applied biosystems,Foster city,CA,USA)将所定量的RNA合成为互补DNA(cDNA)后,利用如下的特定引物进行聚合酶链反应。
磷酸甘油醛脱氢酶(GAPDH)
正向引物(Forward primer):5’-ACCACAGTCCATGCCATCAC-3’(序列1)
反向引物(Reverse primer):5’-CCACCCGAGCCACATCGCTC-3’(序列2)
小眼畸形相关转录因子
正向引物:5’-AGTCAACCTCTGAAGAGCA-3’(序列3)
反向引物:5’-CGTGTTCATACCTGGGCACT-3’(序列4)
聚合酶链反应结果,利用1.5%的琼脂糖凝胶(agarose gel)进行电泳并分离所扩增的互补DNA,而且利用G;BOX EF成象系统(Syngene,Cambridge,UK)确认互补DNA条带(cDNA band),并将其结果显示在图7。
如图7所示,岩藻甾醇在B16F10黑色素瘤细胞中使调节酪氨酸酶、酪氨酸酶相关蛋白-1、酪氨酸酶相关蛋白-2的蛋白质表达的小眼畸形相关转录因子的信使RNA量减少。
实施例9在HaCaT人类角质形成细胞中随着岩藻甾醇处理的编码角质化包膜形成效果
在含有10%的胎牛血清的达尔伯克氏改良伊格尔氏培养基中培养HaCaT人类角质形成细胞后,按2×105cell/ml(最终体积为3ml)投入6-孔板。培养24小时后,除去培养基,利用浓度分别为5μM、10μM、20μM的溶解的岩藻甾醇处理达尔伯克氏改良伊格尔氏培养基。培养96小时后,从6-孔板除去所培养的培养基,回收细胞的颗粒,并移动至1.5ml的管,以10000rpm离心分离10分钟来除去上清液。在添加含有2%的十二烷基硫酸钠(Sodium Dodecyl Sulfate,SDS)和20mM浓度的二硫苏糖醇(Dithiothreitol,DTT)的三羟甲基氨基甲烷缓冲液后,煮沸所获取的颗粒,在340nm中检测吸光度,从而评价编码角质化包膜形成效果。根据如下的数学式3计算相对于对照组的编码角质化包膜的形成程度,并将其结果显示在图8。
数学式3
如图8所示,可知,岩藻甾醇的编码角质化包膜形成效果优秀,从而具有优秀的保湿效果(*:p<0.05)。
实施例10在HaCaT人类角质形成细胞中随着岩藻甾醇处理的兜甲蛋白、外皮蛋白、转谷氨酰胺酶的信使RNA表达增加效果
在含有10%的胎牛血清的达尔伯克氏改良伊格尔氏培养基中培养HaCaT人类角质形成细胞后,按2×105cell/ml(最终体积为3ml)投入6-孔板。培养24小时后,除去培养基,利用浓度分别为5μM、10μM、20μM的溶解的岩藻甾醇处理达尔伯克氏改良伊格尔氏培养基。经过24小时后,使用TRIzol试剂(Invitrogen,Carlsbad,CA,USA)来获取总RNA并进行逆转录后,以如下方式进行逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)分析。首先,为了合成互补DNA,而将上述RNA逆转录成逆转录酶。利用如下的特定引物进行逆转录聚合酶链式反应,其结果显示在图9。
磷酸甘油醛脱氢酶
正向引物:5’-TGACCTTGGCCAGGGGTGCT-3’(序列5)
反向引物:5’-CCACCCGAGCCACATCGCTC-3’(序列6)
兜甲蛋白
正向引物:5’-GGGTACCACGGAGGCGAAGGA-3’(序列7)
反向引物:5’-ACTGAGGCACTGGGGTTGGGA-3’(序列8)
外皮蛋白
正向引物:5’-GGGGCAGCTGAAGCACCTGG-3’(序列9)
反向引物:5’-GAGACGGGCCACCTAGCGGA-3’(序列10)
转谷氨酰胺酶
正向引物:5’CTTCCGTCTGCGCACCCCAG-3’(序列11)
反向引物:5’-AGGCACAAACGACTGGCGCA-3’(序列12)
如图9所示,可确认随着岩藻甾醇处理,在HaCaT人类角质形成细胞中兜甲蛋白、外皮蛋白、转谷氨酰胺酶的信使RNA表达增加。因此,可知,岩藻甾醇在角质形成细胞中促进分化,从而具有优秀的保湿效果(*:p<0.05,**:p<0.01)。
实施例11在HaCaT人类角质形成细胞中随着岩藻甾醇处理的兜甲蛋白、外皮蛋白、转谷氨酰胺酶的蛋白质表达增加效果
在含有10%的胎牛血清的达尔伯克氏改良伊格尔氏培养基中培养HaCaT人类角质形成细胞后,按2×105cell/ml(最终体积为3ml)投入6-孔板。培养24小时后,除去培养基,利用浓度分别为5μM、10μM、20μM的溶解的岩藻甾醇处理达尔伯克氏改良伊格尔氏培养基。经过24小时后,利用含有蛋白酶抑制剂混合物的乙基苯基聚乙二醇缓冲液溶解HaCaT人类角质细胞。利用考马斯亮蓝法对从HaCaT人类角质细胞提取的蛋白质量进行定量。煮沸5分钟上述试样后,利用10%的聚丙烯酰胺凝胶电泳进行电泳,从而分离同量的蛋白质(20g)。完成电泳后,将所分离的蛋白质传递至硝酸纤维素膜,并执行蛋白质印迹法(western blot)。在使第一抗体完成反应之后,利用TBST以每次10分钟的方式清洗3次。此时,在本发明中使用的第一抗体的种类和稀释率为1:1000。第二抗体反应如下,即,向完成上述第一抗体反应的膜投入第二抗体,并在常温中反应2小时左右。此时,第二抗体的稀释率为1:5000。通过使用ECL免疫印迹检测试剂(Amersham,Tokyo,Japan)来使蛋白条带显色。由此,确认了兜甲蛋白、外皮蛋白、转谷氨酰胺酶的蛋白质表达,且通过α-微管蛋白确认蛋白质的负荷剂量为规定量。
如图10所示,可知,随着岩藻甾醇处理,在HaCaT人类角质细胞中兜甲蛋白、外皮蛋白、转谷氨酰胺酶的蛋白质表达增加。因此,可知,岩藻甾醇在人类角质形成细胞中促进分化,从而具有优秀的保湿功能。
实施例12在HaCaT人类角质形成细胞中随着岩藻甾醇处理的丝聚合蛋白和半胱天冬酶14的信使RNA表达增加效果
在含有10%的胎牛血清的达尔伯克氏改良伊格尔氏培养基中培养HaCaT人类角质形成细胞后,按2×105cell/ml(最终体积为3ml)投入6-孔板。培养24小时后,除去培养基,利用浓度分别为5μM、10μM、20μM的溶解的岩藻甾醇处理达尔伯克氏改良伊格尔氏培养基。经过24小时后,使用TRIzol试剂(Invitrogen,Carlsbad,CA,USA)来获取总RNA并进行逆转录后,以如下的方式进行进行逆转录聚合酶链反应分析。首先,为了合成互补DNA,而将上述RNA逆转录成逆转录酶。利用如下的特定引物进行逆转录聚合酶链式反应,其结果显示在图11。
磷酸甘油醛脱氢酶
正向引物:5’-TGACCTTGGCCAGGGGTGCT-3’(序列5)
反向引物:5’-CCACCCGAGCCACATCGCTC-3’(序列6)
丝聚合蛋白
正向引物:5’-AGTGCACTCAGGGGGCTCACA-3’(序列13)
反向引物:5’-CCGGCTTGGCCGTAATGTGT-3’(序列14)
半胱天冬酶14
正向引物:5’-CGGGACTCACAACCAAAGGA-3’(序列15)
反向引物:5’-GGGTCCCTTTGTTCTCCTCG-3’(序列16)
如图11所示,可确认随着岩藻甾醇处理,在HaCaT人类角质形成细胞中丝聚合蛋白、半胱天冬酶14的信使RNA表达增加。因此,可知,岩藻甾醇在角质形成细胞中通过增加丝聚合蛋白和半胱天冬酶14的表达量来生成天然保湿因子,从而具有优秀的保湿效果(*:p<0.05,**:p<0.01)。
实施例13在HaCaT人类角质形成细胞中随着岩藻甾醇处理的丝聚合蛋白和半胱天冬酶14的蛋白质表达增加效果
在含有10%的胎牛血清的达尔伯克氏改良伊格尔氏培养基中培养HaCaT人类角质形成细胞后,按2×105cell/ml(最终体积为3ml)投入6-孔板。培养24小时后,除去培养基,利用浓度分别为5μM、10μM、20μM的溶解的岩藻甾醇处理达尔伯克氏改良伊格尔氏培养基。经过24小时后,利用包含蛋白酶抑制剂混合物的乙基苯基聚乙二醇缓冲液溶解HaCaT人类角质细胞。利用考马斯亮蓝法对从HaCaT人类角质细胞提取的蛋白质量进行定量。煮在沸5分钟上述试样后,利用10%的聚丙烯酰胺凝胶电泳进行电泳,从而分离同量的蛋白质(20g)。完成电泳后,将所分离的蛋白质传递至硝酸纤维素膜,并执行蛋白质印迹法。在使第一抗体进行反应后,利用TBST以每次10分钟的方式清洗3次。此时,在本发明中使用的第一抗体的种类和稀释率为1:1000。第二抗体反应如下,即,向完成上述第一抗体反应的膜投入第二抗体,并在常温中反应2小时左右。此时,第二抗体的稀释率为1:5000。通过使用ECL免疫印迹检测试剂(Amersham,Tokyo,Japan)来使蛋白条带显色。由此,确认了丝聚合蛋白和半胱天冬酶14的蛋白质表达,且通过α-微管蛋白确认蛋白质的负荷剂量为规定量。
如图12所示,可知,随着岩藻甾醇处理,在HaCaT人类角质细胞中丝聚合蛋白、半胱天冬酶14的蛋白质表达增加。因此,可知,岩藻甾醇在角质形成细胞中通过增加丝聚合蛋白和半胱天冬酶14的表达量来生成天然保湿因子,从而具有优秀的保湿效果。
如上的对将本发明的岩藻甾醇作为有效成分包含的皮肤美白用化妆品的剂型例进行了说明,但上述实施例并不用于限定本发明,而是用于具体地说明本发明。根据常规方法制备具有上述皮肤美白效果优秀的岩藻甾醇且按照如下的组分及组成比例的剂型例1至剂型例6的皮肤美白用化妆品组合物。
剂型例1-化妆品
1-1营养化妆水(奶质爽肤水)
将上述实施例1的岩藻甾醇按照如下的表1的营养化妆水剂型比率且通过常规方法来制备成营养化妆水。
表1
1-2柔软化妆水(润肤液)
将上述实施例1的岩藻甾醇按照如下的表2的柔软化妆水剂型比率且通过常规方法来制备成柔软化妆水。
表2
1-3营养霜
将上述实施例1的岩藻甾醇按照如下的表3的营养霜剂型比率且通过常规方法来制备成营养霜。
表3
1-4按摩霜
上述实施例1的岩藻甾醇按照如下的表4的按摩霜剂型比率且通过常规方法来制备成按摩霜。
表4
1-5营养面膜
上述实施例1的岩藻甾醇按照如下的表5的面膜剂型比率且通过常规方法来制备成面膜。
表5
1-6凝胶
上述实施例1的岩藻甾醇按照如下的表6的凝胶剂型比率且通过常规方法来制备成凝胶。
表6
剂型例2-食品
2-1健康食品的制备
可混合1000mg的上述实施例1的岩藻甾醇、70ug的维生素A醋酸酯、1.0mg的维生素E、0.13mg的维生素B1、0.15mg的维生素B2、0.5mg的维生素B6、0.2ug的维生素B12、10mg的维生素C、10ug的生物素、1.7mg的烟酰胺、50ug的叶酸、0.5mg的泛酸钙、1.75mg的硫酸亚铁、0.82mg的氧化锌、25.3mg的碳酸镁,15mg的磷酸一钾、55mg的磷酸二钾、90mg的柠檬酸钾、100mg的碳酸钙、24.8mg的氯化镁来制备,即使任意变形实施其配合比也无妨,在根据普通的健康食品制备方法混合上述成分后,制备成颗粒,可根据常规方法适用于健康食品组合物的制备。
2-2健康饮料的制备
向1000mg的上述实施例1的岩藻甾醇、1000mg的柠檬酸、100g的低聚糖、2g的梅子浓缩液、1g的牛黄酸添加纯化水,在根据整体900mL的常规健康饮料制备方法混合上述成分之后,在85℃的温度中搅拌加热约1小时后,过滤所制备的溶液,并放置于灭菌的2L的容器,密封灭菌后,经过冷藏保管,可适用于健康饮料组合物的制备。
2-3口香糖
配合20重量百分比的胶基、76.9重量百分比的糖、1重量百分比的香料、2重量百分比的水和0.1重量百分比的上述实施例1的岩藻甾醇,并以常规方法制备口香糖。
2-4糖块
配合60重量百分比的糖、39.8重量百分比的糖稀、0.1重量百分比的香料和0.1重量百分比的上述实施例1的岩藻甾醇,并以常规方法制备糖块。
2-5饼干
配合25.59重量百分比的低筋面粉、22.22重量百分比的中筋面粉、4.80重量百分比的冰糖、0.73重量百分比的食盐、0.78重量百分比的葡萄糖、11.78重量百分比的棕榈硬化油、1.54重量百分比的铵、0.17重量百分比的小苏打、0.16重量百分比的亚硫酸氢钠、1.45重量百分比的米面、0.0001重量百分比的维生素B、0.04重量百分比的牛奶香精、20.6998重量百分比的水、1.16重量百分比的全脂奶粉、0.29重量百分比的代乳粉、0.03重量百分比的磷酸一钙、0.29重量百分比的撒布盐、7.27重量百分比的喷油和重量百分比的上述实施例1的岩藻甾醇,并以常规方法制备饼干。
剂型例3-药品
3-1粉剂
混合50mg的上述实施例1的岩藻甾醇和2g的结晶纤维素酶后,根据常规粉剂制备方法填充于气密布来制备粉剂。
3-2片剂
混合50mg的上述实施例1的岩藻甾醇、400mg的结晶纤维素酶、5mg的硬脂酸镁后,根据常规片剂制备方法进行压片来制备片剂。
3-3胶囊剂
混合30mg的上述实施例1的岩藻甾醇、100mg的乳清蛋白质、400mg的结晶纤维素酶、6mg的硬脂酸镁后,根据常规胶囊剂制备方法填充于明胶胶囊来制备胶囊剂。
3-4注射剂
根据常规注射剂制备方法将活性成分溶解于注射用蒸馏水,在将pH调节为约7.5之后,混合100mg的上述实施例1的岩藻甾醇、注射用蒸馏水、pH调节剂并填充于2mL的用量的安瓿,进行灭菌,由此制备注射剂。
产业上的可利用性
上述化学式1的岩藻甾醇可抑制黑色素生成及酪氨酸酶活性,从而具有卓越的美白效果,因此可制备成美白用化妆品组合物、食品组合物或药学组合物,由此产业上的可利用性高。
并且,上述化学式1的岩藻甾醇具有形成编码角质化包膜、促进角质形成细胞分化以及生成天然保湿因子的功能,从而具有卓越的保湿功能,因此可制备成保湿用化妆品组合物、食品组合物或药学组合物,由此产业上的可利用性高。
- 还没有人留言评论。精彩留言会获得点赞!