一种靶向多功能聚合类脂质体的制备方法与流程
本发明属于高分子药物载体和聚合物制备领域,具体涉及一种靶向多功能聚合类脂质体的制备方法。
背景技术:
聚合物类脂质体作为一种新型的抗癌药物载体,由于其良好的稳定性和对药物高的包封率在药物传递和控缓释领域受到了广泛关注。随着新兴物理药剂学的逐步成熟,药物制剂在系统理论、工艺技术及应用研究等方面都进入了一个新的阶段,第三代制剂(即控释制剂)和第四代制剂(即靶向制剂)己经成为制剂研究的焦点。具有双重靶向给药系统,如磁响应药物载体系统,该系统到达靶部位后,利用磁热产生高温触发可降解性载体来靶向控制药物释放奠定了基础,为肿瘤热疗提供了新途径和新思路。双乳化-超声分散法是制备可生物降解的高分子聚合物类脂体的主要方法,其基本原理是将高分子聚合物溶解于有机溶剂中,与药物溶液在一定条件下(搅拌、超声、振动)形成初乳液,再加入乳化剂继续乳化形成复乳液,亲水性药物分散包裹在乳液的内部,随着乳液中有机溶剂的不断挥发,类脂体表面固化,通过真空冷冻干燥后使内部水溶液升华后即可形成亲水首基部分载亲水性磁纳米粒子和亲水性药物以及亲脂部分包载疏水性或两亲性的药物的聚合类脂质体,而且弥补了脂质体在稳定性和控释性能上的不足。
理想的化疗药物应该是只对宿主的特定靶细胞发挥作用,而不对宿主的正常细胞产生效应,或者引起的毒副作用微不足道。但目前的抗癌药物大多存在对肿瘤组织的选择性较差、疗效低、毒性大的缺点。为增加抗癌效果,减少毒副作用,各国都竞相研发最新型的纳米药物载体材料和技术,包括最初期的癌症诊断、准确地指出它在身体内的位置、向恶性细胞准确投递抗癌药物等,以便从根本上改变目前癌症诊断、治疗和预防的状况。在众多的化疗药物中,从红豆杉属植物紫衫的树干和树皮中提取开发得到的天然抗癌药物紫杉醇(Paclitaxel)。由于其化学结构新颖,作用机理独特,也是目前唯一的具有独特抗微管作用机制的抗癌新药,其作用机制为:促使微管蛋白二聚体装配成微管(microtubules),并阻止其解聚而稳定微管,使癌细胞被固定在有丝分裂的过程中,无法继续进行分裂而死亡(通常细胞分裂时会形成大量管状构造,并在染色体正确分布至两子细胞后,这些微管系统会分解,进而完成分裂),从而起到了抗肿瘤作用,但不影响DNA、RNA和蛋白质的合成。有望成为新一代化疗药物中不可替代的新型光谱抗癌一线药物。但其水中的溶解性很差,提高紫杉醇的水中溶解度,人们首先考虑到在紫杉醇上连接一些水溶性基团制成紫杉醇的前药,以提高紫杉醇的水溶性。紫杉醇的前药在生理条件下水解释放出紫杉醇。但水溶性前药一般不稳定,在一定程度上还会影响紫杉醇的药效,因而还没有正式商品化。基于此,制备类脂体给药系统,增加药物的溶解性和保护紫杉醇活性基团在体内环境不被降解,还可延长药物在血液中的循环时间,提高药物的生物利用度,降低全身毒副作用。同时聚乙丙交酯(PGAL)具有优异的生物降解性和相容性。因此,近年有关聚合类脂质体药物载体的研究越来越受到国内外科学工作者的关注,已成为本领域研究的热点和难点。美国FDA也已批准包括紫杉醇在内的多个抗癌药的脂质体制剂进行临床试验。
聚合物类脂质体通过薄膜分散法、逆向蒸发法、pH 梯度法、注入法、乳化分散法、熔融法、表面活性剂处理法、离心法、冷冻干燥法等。不同的制备方法会对聚合类脂质体粒径造成比较大的影响,而粒径的大小对脂质体的性质和应用影响很大。目前国内外对给药系统的研究有很多,其中主要是对乳剂、胶束、微球、纳米粒药质体以及脂质体。这几种给药体系体都可以达到良好的粒径控制和药物控缓释性。虽然乳剂、胶束、微球、纳米粒、药质体以及脂质体都得以成功的制备,但类脂质体的稳定性和多功能性有很大发展前景。并且以上这几种给药体系不具有同时载亲水性和疏水性药物,这就大大的影响了治疗效果。
技术实现要素:
本发明的目的是提供一种靶向多功能聚合类脂质体的制备方法。本发明中制备得类脂质体粒径可控、稳定、具有可控性和选择性药物释放的部位、速度、方式,能保护药物活性基团在体内环境不被降解,还可延长药物在血液中的循环时间,提高了药物在靶部位的浓度,降低全身毒副作用,有望发展成为一类新型、高效的药物输送和基因治疗载体。
为实现上述目的,本发明是通过以下技术方案实现的:
一种磁靶向聚合类脂质体的制备方法,以改性聚乙丙交酯、支化聚乙烯亚胺或端氨基聚乙二醇以及四氧化三铁纳米粒为主要原料,采用双乳化-超声分散法和真空干燥技术,将聚乙丙交酯用马来酸酐通过本体反应改性,改性后的聚乙丙交酯经酰胺化反应进一步与支化聚乙烯亚胺或端氨基聚乙二醇的氨基反应,制备两亲性的嵌段共聚物,后经双乳化-超声分散法和真空干燥技术制备成的磁靶向聚合类脂质体,最后在真空干燥箱内干燥,具体步骤如下:
(1)将1.0-20 g聚乙丙交酯、0.4-3.0 g马来酸酐和5-70 mg偶氮二异丁腈加入到反应釜中,升温至100 ℃,保温24 h,冷却至室温,滴至于10-160 mL冰乙醇中反复沉析3-5次,40 ℃真空干燥至恒重;
(2)称取0.1-2.5 g步骤(1)得到的固体加入至6-20 mL二甲基亚砜中,搅拌至其完全溶解后,加入3.4-32 mg EDC和1.0-9.5 mg NHS,室温下磁搅拌4 h,按照羧基和氨基摩尔比1:1加入支化聚乙烯亚胺或端氨基聚乙二醇,继续搅拌6 h;将所得混合液滴至于10-100 mL冰甲醇中反复沉析过夜,真空抽干,备用;
(3)称取40-800 mg步骤(2)得到的固体和0-10 mg 的紫杉醇加入至3-25 mL 二甲基亚砜中,超声1 min后,加入超声分散好的四氧化三铁纳米粒和0-10 mg的阿霉素溶液,继续超声2 min,将反应液逐滴加入至24-200 mL 2wt%或2.5wt%聚乙烯醇中超声自组装;
(4)将步骤(3)的产物通过磁分离,然后分别用蒸馏水、乙醇、蒸馏水清洗三次,最后在真空干燥箱内干燥4 h,得到磁靶向聚合类脂质体。
一种具有磁靶向和叶酸靶向的聚合类脂质体的制备方法,其特征在于:该类脂质体是以改性聚乙丙交酯、支化聚乙烯亚胺或端氨基聚乙二醇、叶酸以及四氧化三铁纳米粒为主要原料,采用双乳化-超声分散法、真空干燥技术制得;具体步骤如下:
(1)将1.0-20 g聚乙丙交酯、0.4-3.0 g马来酸酐和5-70 mg偶氮二异丁腈加入到反应釜中,升温至100 ℃,保温24 h,冷却至室温,滴至于10-160 mL冰乙醇中反复沉析3-5次,40 ℃真空干燥至恒重;
(2)称取0.1-2.5 g步骤(1)得到的固体加入至6-20 mL二甲基亚砜中,搅拌至其完全溶解后,加入3.4-32 mg EDC和1.0-9.5 mg NHS,室温下磁搅拌4 h,按照羧基和氨基摩尔比1:1加入支化聚乙烯亚胺或端氨基聚乙二醇,继续搅拌6 h;将所得混合液滴至于10-100 mL冰甲醇中反复沉析过夜,真空抽干,备用;
(3)称取40-800 mg步骤(2)得到的固体和0-10 mg 的紫杉醇加入至3-25 mL 二甲基亚砜中,超声1 min后,加入超声分散好的四氧化三铁纳米粒和0-10 mg的阿霉素溶液,继续超声2 min,将反应液逐滴加入至24-200 mL 2wt%或2.5wt%聚乙烯醇中超声自组装;
(4)将步骤(3)的产物通过磁分离,然后分别用蒸馏水、乙醇、蒸馏水清洗三次,最后在真空干燥箱内干燥4 h,得到磁靶向聚合类脂质体;
(5)将10-300 mg叶酸溶解于2-10 mL 二甲基亚砜,随后加入EDC和NHS,室温下磁搅拌4 h,所述叶酸、EDC和NHS的摩尔比为1:1:2;然后将所得混合溶液与步骤(4)所得磁靶向聚合类脂质体反应,机械搅拌2 h,通过磁分离,然后分别用蒸馏水、乙醇、蒸馏水清洗三次,最后在真空干燥箱内干燥4 h,即制备得到具有磁靶向和叶酸靶向的聚合类脂质体。
本发明还保护制得的靶向多功能聚合类脂质体的应用,所述的聚合类脂质体作为抗癌药物输送载体和基因治疗载体,同时装载亲水性药、疏水性药以及负载荧光染料。
本发明的显著优点:本发明反应过程简单,不用离心直接采用磁分离进行纯化即可,且制备得到的聚合类脂质体粒径可控、稳定、具有可控性和选择性药物释放的部位、速度、方式。此外,本发明的方法可以保护药物活性基团在体内环境不被降解,还可延长药物在血液中的循环时间,提高了药物在靶部位的浓度,降低全身毒副作用。此外,该聚合类脂质体相对于其他给药体系具有以下几个优点:可以同时装载亲、疏水药物促进药物的协同作用,提高肿瘤治疗效果;表面修饰上特异性配体,进一步提高药物或基因的靶向性,减少药物用量,降低毒副作用。该靶向多功能聚合类脂质体作为一种新型的抗癌药物载体材料,能够弥补脂质体在稳定性和控释性能上的不足,使其得到明显的改善,从而在临床能够实现非常可观的抗癌效果,具有诱人的应用前景。本发明对于补充当前比较单一的脂质体药物载体领域,提高脂质体的稳定性和靶向性也将具有非常重大的意义。
附图说明:
图1为实施例1反应条件制备的负载紫杉醇的靶向聚合类脂质体的扫描电镜图;
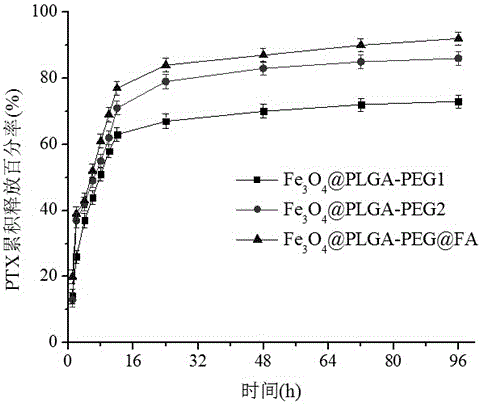
图2为紫杉醇从靶向聚合类脂质体中释放96 h之内的累积的紫杉醇药物释放曲线。
具体实施方式
本发明用以下实例来进一步说明本发明,但本发明的保护范围并不限于实施例。
实施例1
一种用于负载紫杉醇的磁靶向聚合类脂质体制备
(1)将1.0 g聚乙丙交酯、0.4 g马来酸酐和5 mg偶氮二异丁腈加入到反应釜中,升温至100 ℃,保温24 h,冷却至室温,滴至于10 mL冰乙醇中反复沉析3-5次,40 ℃真空干燥至恒重;
(2)称取0.1 g步骤(1)得到的固体加入至6 mL二甲基亚砜中,搅拌至其完全溶解后,加入3.4 mg EDC和1.0 mg NHS,室温下磁搅拌4 h,按照羧基和氨基摩尔比1:1加入支化聚乙烯亚胺,继续搅拌6 h;滴至于10 mL冰甲醇中反复沉析过夜,真空抽干,备用;
(3)称取40mg步骤(2)得到的固体和0.5 mg 的紫杉醇加入至3 mL 二甲基亚砜中,超声1 min后,加入超声分散好的四氧化三铁纳米粒,继续超声2 min,将反应液逐滴加入至24 mL 2wt%聚乙烯醇中超声自组装;
(4)将步骤(3)的产物通过磁分离,然后分别用蒸馏水、乙醇、蒸馏水清洗三次,最后在真空干燥箱内干燥4 h,即制备得到用于负载紫杉醇的磁靶向聚合类脂质体。
实施例2:一种用于负载阿霉素的磁靶向聚合类脂质体制备
(1)将20 g聚乙丙交酯、3.0 g马来酸酐和70 mg偶氮二异丁腈加入到反应釜中,升温至100 ℃,保温24 h,冷却至室温,滴至于160 mL冰乙醇中反复沉析3-5次,40 ℃真空干燥至恒重;
(2)称取2.5 g步骤(1)得到的固体加入至20 mL二甲基亚砜中,搅拌至其完全溶解后,加入32 mg EDC和9.5 mg NHS,室温下磁搅拌4 h,按照羧基和氨基摩尔比1:1加入端氨基聚乙二醇,继续搅拌6 h;滴至于100 mL冰甲醇中反复沉析过夜,真空抽干,备用。
(3)称取800 mg步骤(2)得到的固体加入至25 mL 二甲基亚砜中,超声1 min后,加入超声分散好的四氧化三铁纳米粒和10 mg的阿霉素溶液,继续超声2 min,将反应液逐滴加入至200 mL 2wt% 聚乙烯醇中超声自组装;
(4)将步骤(3)的产物通过磁分离,然后分别用蒸馏水、乙醇、蒸馏水清洗三次,最后在真空干燥箱内干燥4 h,即制备得到用于负载阿霉素的磁靶向聚合类脂质体。
实施例3:一种用于负载紫杉醇和阿霉素的磁靶向聚合类脂质体制备
(1)将3.0 g聚乙丙交酯、1.2 g马来酸酐和25 mg偶氮二异丁腈加入到反应釜中,升温至100 ℃,保温24 h,冷却至室温,滴至于50 mL冰乙醇中反复沉析3-5次,40 ℃真空干燥至恒重;
(2)称取0.5 g步骤(1)得到的固体加入至8 mL二甲基亚砜中,搅拌至其完全溶解后,加入3.9 mg EDC和1.5 mg NHS,室温下磁搅拌4 h,按照羧基和氨基摩尔比1:1加入支化聚乙烯亚胺,继续搅拌6 h;滴至于50 mL冰甲醇中反复沉析过夜,真空抽干,备用;
(3)称取80 mg步骤(2)得到的固体和1.5 mg 的紫杉醇加入至12 mL 二甲基亚砜中,超声1 min后,加入超声分散好的四氧化三铁纳米粒和0.5 mg的阿霉素溶液,继续超声2 min,将反应液逐滴加入至120 mL 2wt% 聚乙烯醇中超声自组装;
(4)将步骤(3)的产物通过磁分离,然后分别用蒸馏水、乙醇、蒸馏水清洗三次,最后在真空干燥箱内干燥4 h,即制备得到用于负载紫杉醇和阿霉素的药物载体。
实施例4: 一种用于负载紫杉醇的磁靶向和叶酸靶向的聚合类脂质体制备
(1)将3.0 g聚乙丙交酯、1.2 g马来酸酐和25 mg偶氮二异丁腈加入到反应釜中,升温至100 ℃,保温24 h,冷却至室温,滴至于50 mL冰乙醇中反复沉析3-5次,40 ℃真空干燥至恒重;
(2)称取0.5 g步骤(1)得到的固体加入至8 mL二甲基亚砜中,搅拌至其完全溶解后,加入3.9 mg EDC和1.5 mg NHS,室温下磁搅拌4 h,按照羧基和氨基摩尔比1:1加入支化聚乙烯亚胺,继续搅拌6 h;滴至于50 mL冰甲醇中反复沉析过夜,真空抽干,备用;
(3)称取80 mg步骤(2)得到的固体和1.5 mg 的紫杉醇加入至12 mL 二甲基亚砜中,超声1 min后,加入超声分散好的四氧化三铁纳米粒和0.5 mg的阿霉素溶液,继续超声2 min,将反应液逐滴加入至120 mL 2wt% 聚乙烯醇中超声自组装;
(4)将步骤(3)的产物通过磁分离,然后分别用蒸馏水、乙醇、蒸馏水清洗三次,最后在真空干燥箱内干燥4 h;
(5)将70 mg叶酸溶解于6 mL 二甲基亚砜,按摩尔比(1:1:2)加入EDC和NHS,室温下磁搅拌4 h;
(6)将步骤(4)得到的样品溶解后滴加至步骤(5)得到的反应液中机械搅拌2 h,通过磁分离,然后分别用蒸馏水、乙醇、蒸馏水清洗三次,最后在真空干燥箱内干燥4 h,即制备得到具有主动和被动靶向的药物载体。
载体的药物释放测试
将15 mg按实施例1、实施例3和实施例4所制备的载体负载上紫杉醇的药物,放入装有30 mL PBS溶液(pH=7.4)中,37℃恒温振荡箱,分别于1、2、4、6、8、12、24、48、和72 h取样,采用分光光度法测定紫杉醇的药物释放的量。按下列公式计算累积释放百分率(%),绘制释放曲线。累积释放百分率(%)=(Ci×V/紫杉醇总量)×100%,其中,Ci:表示各时间点释放介质中紫杉醇的浓度(μg/mL),V表示释放体系总体积(mL)。该药物载体对紫杉醇药物释放的曲线见附图2。
从图2中可看出,药物载体的释放呈二相性,均为先突释后缓释,Fe3O4@PLGA-PEG1、Fe3O4@PLGA-PEG2和Fe3O4@PLGA-PEG@FA药物载体的6h的累积释放百分率分别为44.3%、48.7%和51.9%;12 h的累积释放百分率分别为63.2%、70.8%和77.0%;72h时分别释放了71.9%、85.3%和90.2%,说明该聚合类脂质体作为一种新型的抗癌药物载体材料。(Fe3O4@PLGA-PEG1、Fe3O4@PLGA-PEG2和Fe3O4@PLGA-PEG@FA分别对应实施例1、实施例3和实施例4)
以上所述仅为本发明的较佳实施例,凡依本发明申请专利范围所做的均等变化与修饰,皆应属本发明的涵盖范围。
- 还没有人留言评论。精彩留言会获得点赞!