纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架及其制备方法和应用与流程
本发明涉及骨再生组织工程支架,特别是一种纤维蛋白凝胶/聚乳酸-羟基乙酸微球聚乳酸-羟基乙酸微球支架及其制备方法和应用。
背景技术:
骨是一种高度代谢的组织,需要丰富的血供。正常情况下,细胞的营养和氧气是由毛细血管扩散作用得到的,而扩散的最大距离为200μm,当一大块的组织工程骨植入体内后,组织工程骨中的细胞会面临缺乏营养和氧气的问题,从而导致移植失败。因此,骨移植物的血管化能力对骨修复起着至关重要的作用。
纤维蛋白凝胶有着良好的生物相容性,已经被广泛使用于止血、伤口封闭等的手术用途中。另外,纤维蛋白凝胶还有促进组织(如骨和神经)再生的性能,并且可以作为形成血管样结构的基质,从而实现支架的体外预血管化。然而,纤维蛋白凝胶的缺点是易于降解,强度差,不能用于体外长时间培养,故在实际应用中需要一种高强度、降解慢的支架来支撑纤维蛋白凝胶。聚乳酸-羟基乙酸共聚物(PLGA)是一种人工高分子材料,已经被FDA批准作为药用辅料,其作为一种硬基质有利于细胞的骨向分化。
技术实现要素:
本发明的目的是克服现有支架材料的不足,提供一种具有良好的微观形貌、可塑形性强、对间充质细胞的骨向分化有一定的优势的可预血管化的骨组织工程支架。
本发明另一目的是提供上述骨组织工程支架的制备方法和在骨再生方面的应用。
技术方案:本发明提供一种纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架(FP支架),该支架包括堆叠在一起的聚乳酸-羟基乙酸微球和填充在聚乳酸-羟基乙酸微球之间的纤维蛋白凝胶。
纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架是将纤维蛋白原溶液与聚乳酸-羟基乙酸微球混合均匀后,使纤维蛋白原溶液凝固得到的;纤维蛋白原溶液中纤维蛋白原的浓度为10mg/mL,纤维蛋白原溶液与聚乳酸-羟基乙酸微球的体积比为1∶2。为了便于细胞迁移,确保较好的骨组织修复效果,使纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架的孔隙直径为100~200μm;聚乳酸-羟基乙酸由摩尔比为50:50~90:10的乳酸和羟基乙酸共聚形成,聚乳酸-羟基乙酸微球直径为175~325μm。
纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架中,聚乳酸-羟基乙酸共聚物(PLGA)是已经被FDA批准的药用辅料,安全可靠。将PLGA制成微球状,并且微球是空心的,有用于载药的潜力。软基质纤维蛋白凝胶和硬基质PLGA有机地结合在一起,形成了一种软硬基质复合的组织工程支架。间充质干细胞可以在微球的表面分化,而血管样结构可以存在于微球之间的纤维蛋白凝胶当中。而这些血管样结构能够和体内的毛细血管吻合,从而为支架内的细胞提供营养和养分,从而更好的促进骨的修复。
本发明另一方面提供上述纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架的制备方法,该制备方法包括以下步骤:
1)通过复乳-溶剂挥发法制备聚乳酸-羟基乙酸微球;
2)将纤维蛋白原的磷酸盐缓冲溶液与步骤1)制得的聚乳酸-羟基乙酸微球混合均匀,所述纤维蛋白原溶液与所述聚乳酸-羟基乙酸微球的体积比为1∶2,加入凝血酶,加入凝血酶,使纤维蛋白原溶液形成凝胶,得到纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架。
步骤1)中,通过复乳-溶剂挥发法制备聚乳酸-羟基乙酸微球的方法具体包括:将聚乳酸-羟基乙酸溶于不溶于水的有机溶剂中,配制成油相,向油相中加入内水相,乳化形成初乳;向初乳中加入外水相,乳化形成复乳;将复乳加入到0.05-0.2wt%的聚乙烯醇溶液中(此溶液用于使形成的复乳稳定),以200-300转/分的转速搅拌12小时,过筛,冷冻干燥,制得聚乳酸-羟基乙酸微球。
步骤1)中,油相为聚乳酸-羟基乙酸的二氯甲烷溶液,油相中聚乳酸-羟基乙酸的浓度为0.05~0.2g/mL,内水相为0.9wt%的NaCl水溶液(即生理盐水),外水相为0.5~2wt%的聚乙烯醇水溶液;油相(0.05~0.2g/mL的聚乳酸-羟基乙酸的二氯甲烷溶液)、内水相(0.9wt%的NaCl水溶液)、外水相(0.5~2wt%的聚乙烯醇水溶液)和0.05-0.2wt%的聚乙烯醇溶液的体积比为5mL∶0.3mL∶10mL∶500mL。
步骤2)中,纤维蛋白原溶液中纤维蛋白原浓度为10mg/mL,凝血酶溶液为50单位/毫升。
本发明从优化骨替代材料的血管化能力出发,把PLGA做成微球,然后把纤维蛋白凝胶加入到微球堆叠成的支架中,从而得到FP支架。外周血中的间充质细胞可以在微球表面分化,而血管内皮祖细胞可以于微球之间的纤维蛋白基质中形成血管样结构,此支架将进一步服务于生物医学领域。
本发明另一方面提供上述纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架在骨再生领域中的应用。
有益效果:本发明制备的FP支架的两种原料(纤维蛋白以及PLGA)都是已经用于人体的材料,因此安全性好,而且制备过程操作简单,成本低;本发明所制备的FP支架的孔隙直径为100~200μm,此种孔径范围有利于细胞迁移,能确保较好的骨组织修复效果;本发明所制备的FP支架能够在体外将成骨分化与预血管化有效的结合在一起,从而能够应用于大块骨缺损问题的解决。
附图说明
图1是PLGA微球光镜照片(放大率100倍);
图2是FP支架光镜照片(放大率100倍);
图3是间充质细胞在不同的培养环境下成骨诱导一周后成骨相关基因的表达情况;
图4是预血管化后的FP支架复合物硬组织切片染色图片(放大率100倍)。
具体实施方式
实施例1
纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架(FP支架)的制备方法为:
(1)制备聚乳酸-羟基乙酸微球(PLGA微球)
将分子量为11万的PLGA溶于二氯甲烷中,配制成浓度为0.05g/mE的PLGA溶液5mL作为油相,再向该溶液中加入300μL的生理盐水(0.9wt%的NaCl水溶液)作为内水相,搅拌乳化,转速为1400转/分。加入质量分数为0.5wt%的PVA溶液10mL,搅拌乳化,转速为1400转/分。将得到的混合物倒入到质量分数为0.05wt%的PVA溶液500mL中,搅拌,转速为200转/分,搅拌12小时。用50目和100目的标准筛筛取,冷冻干燥得到PLGA微球。制得的微球粒径测得为188~323μm。
(2)将浓度为10mg/mL的纤维蛋白的前体(纤维蛋白原冻干粉,Sigma-Aldrich,50-70%protein,以磷酸盐缓冲溶液配制)溶液与步骤(1)制得的PLGA微球充分混合均匀,纤维蛋白原溶液和聚乳酸-羟基乙酸微球的体积比为1∶2,加入凝血酶溶液(凝血酶浓度为50IU/mL,纤维蛋白原溶液和凝血酶体积比为25∶2),使纤维蛋白溶液凝固,得到FP支架。得到纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架(FP支架),FP支架孔隙的直径测得为116~193μm。
实施例2、3、4、5、6、7、8与实施例1基本相同,不同之处在于制备聚乳酸-羟基乙酸微球步骤中使用的PLGA溶液浓度、搅拌的转速和PVA溶液浓度,以及制得的PLGA微球粒径及FP支架孔隙直径的不同,具体如下:
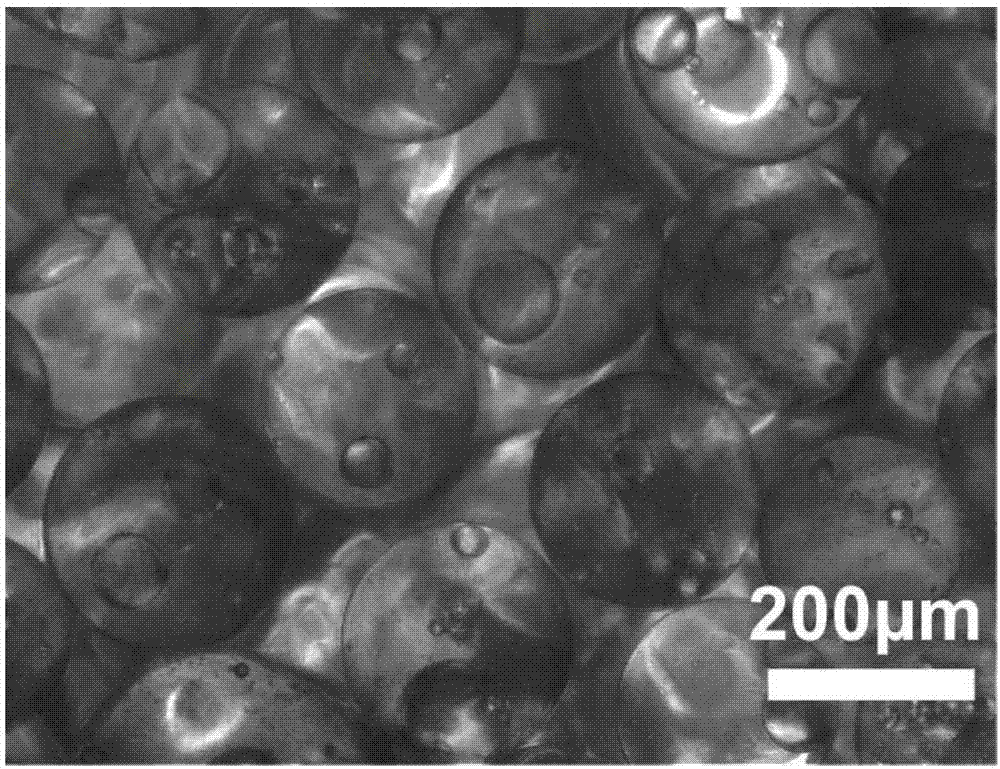
附图1是PLGA微球光镜照片(放大率100倍)。可以发现微球为空心的结构。
附图2是FP支架光镜照片(放大率100倍)。可以发现疏松堆积的微球间有大量的孔隙。
实施例9
纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架对成骨相关基因表达的影响:
实验组:将含有间充质细胞的纤维蛋白的前体(纤维蛋白原)溶液(纤维蛋白原浓度为10毫克/毫升)加入到实施例1~8步骤(1)制得的堆叠在一起的PLGA微球中,使含有间充质细胞的纤维蛋白的前体(纤维蛋白原)溶液与PLGA微球充分混合均匀,并加入凝血酶溶液(50单位/毫升),使含有间充质细胞的纤维蛋白的前体(纤维蛋白原)溶液凝固,得到细胞/FP支架的复合物。将细胞/FP支架的复合物在成骨诱导液中诱导分化。
对照组1:将间充质细胞接入到孔板中,待细胞贴壁后,以成骨诱导液诱导分化。对照组1中除将FP支架换成单纯的孔板培养外,培养条件与实验组相同。
对照组2:向含有间充质细胞的纤维蛋白的前体(纤维蛋白原)溶液(纤维蛋白原浓度为10毫克/毫升)中加入凝血酶溶液(50单位/毫升),使纤维蛋白原凝固,得到细胞/纤维蛋白凝胶复合物。将细胞/纤维蛋白凝胶复合物在成骨诱导液中诱导分化。对照组2中除将FP支架换成纤维蛋白凝胶,培养条件与实验组相同。
诱导一周后用实时定量PCR测实验组、对照组1和对照组2成骨相关基因(ALP,BMP-2,OSX,COL-1,OCN,RUNX-2)的表达。
附图3是间充质细胞在不同的培养环境下成骨诱导一周后成骨相关基因的表达。可以发现成骨相关基因(ALP,BMP-2,OSX,COL-1,OCN,RUNX-2)的表达在对照组2(孔板培养组)、对照组1(纤维蛋白凝胶组)以及实验组(FP支架组)是依次增高的。对照组1(纤维蛋白凝胶组)和实验组(FP支架组)成骨相关基因的表达高于孔板培养组,而实验组(FP支架组)成骨相关基因有着最高的表达(除了OCN这个指标在纤维蛋白凝胶组和FP支架组的比较中没有明显的的统计学差异,其它各个指标各个组之间比较皆有统计学差异)。说明FP支架在促进间充质细胞的分化的方面上有一定的优势。
实施例10
纤维蛋白凝胶/聚乳酸-羟基乙酸微球支架对血管样结构形成的影响:
实施例9实验组的细胞/FP支架的复合物培养3周后,纤维蛋白凝胶几乎全部降解,向其中加入含内皮细胞及间充质干细胞的纤维蛋白前体溶液(纤维蛋白前体溶液中纤维蛋白原浓度为10毫克/毫升),充分混合均匀,并以凝血酶溶液(凝血酶溶液浓度为50单位/毫升)凝固,得到新的细胞/FP支架的复合物,培养一周,用硬组织切片观察血管样结构的形成,如图4所示。图4是预血管化后的FP支架复合物硬组织切片染色图片(放大率100倍)。可以看到大量的管腔样结构存在于微球之间,说明FP支架可以运用于体外预血管化。
- 还没有人留言评论。精彩留言会获得点赞!