钙敏感受体调节剂在调控铬(VI)诱导的细胞焦亡中的应用的制作方法
本发明涉及医药用途领域,具体涉及钙敏感受体调节剂在调控铬(vi)诱导的细胞焦亡中的应用。
背景技术
细胞焦亡(pyroptosis)是近几年新发现的一种依赖于caspase-1或caspase-11活化的新型细胞死亡方式。细胞焦亡在形态学上同时具有部分坏死和凋亡的特征,但与细胞凋亡不同的是,细胞发生焦亡时细胞膜上形成众多1-2nm的孔隙,使细胞膜失去完整性,导致细胞膜失去调控物质进出的能力,最终导致细胞膜溶解,释放出细胞内容物,诱发炎症反应。
钙敏感受体(casr)是g蛋白偶联受体(gpcr)超家族的成员之一。casr是一种广泛表达的g蛋白偶联受体,主要负责检测细胞外ca2+水平的变化,从而调节甲状旁腺激素分泌和降钙素释放,还能够通过结合多种配体或与多种g蛋白相互作用使钙浓度正常化。此外,casr可以调控不同的下游信号通路来影响细胞命运。因此,casr对细胞激素分泌、凋亡及分化起至关重要的作用。同时,casr在消化、呼吸、心血管和肿瘤疾病中发挥作用。但钙敏感受体与细胞焦亡之间的关系,特别是钙敏感受体与铬(vi)诱导的细胞焦亡之间的关系至今未见报道。
技术实现要素:
针对上述现有技术,本发明的目的是提供钙敏感受体调节剂在调控铬(vi)诱导的细胞焦亡中的应用。
为实现上述目的,本发明采用如下技术方案:
本发明的第一方面,提供钙敏感受体调节剂在制备调控细胞焦亡的药物中的应用。
优选的,所述细胞焦亡是由铬(vi)诱导的。
优选的,所述钙敏感受体调节剂包括:钙敏感受体抑制剂、钙敏感受体拮抗剂和钙敏感受体激活剂。
优选的,所述调控细胞焦亡包括:抑制细胞焦亡和促进细胞焦亡。
进一步的,本发明提供钙敏感受体抑制剂在制备抑制由铬(vi)诱导的细胞焦亡的药物中的应用。
优选的,所述钙敏感受体抑制剂为nps2390。
优选的,所述细胞焦亡为df-1细胞的焦亡。
优选的,所述铬(vi)的浓度为20μmol/l。
本发明的第二方面,提供一种调控由铬(vi)诱导的细胞焦亡的药物,所述药物以有效量的钙敏感受体调节剂作为活性成分。
本发明的有益效果:
本发明首次研究发现,铬(vi)诱导的钙敏感受体(casr)激活对df-1细胞焦亡具有增强作用,而钙敏感受体抑制剂可以减轻铬(vi)触发的casr激活以及随后df-1细胞的焦亡。因此,本发明揭示了铬(vi)诱导细胞焦亡的一种新的机制,对于避免铬(vi)的毒性作用,以及细胞焦亡的深入研究具有重要的意义。
附图说明
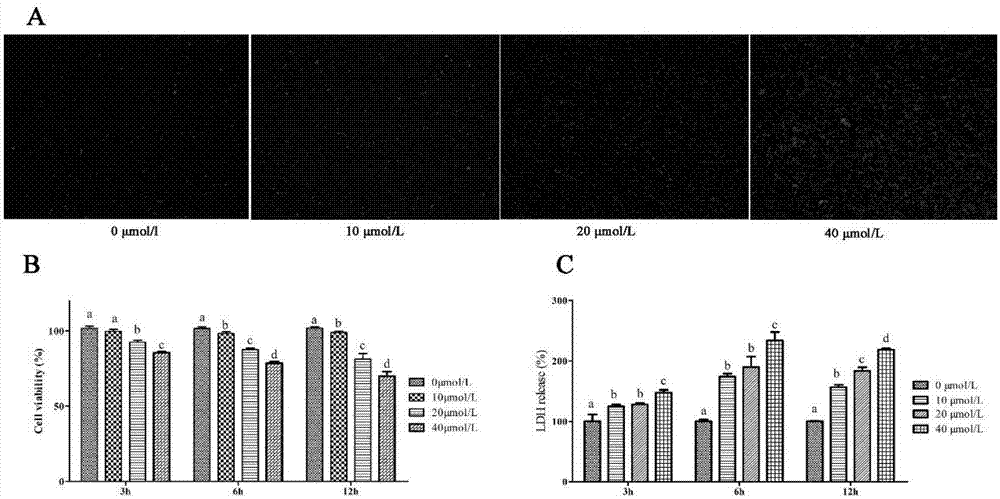
图1:不同剂量(0,10,20或40μmol/l)k2cr2o7诱导的细胞毒性;其中,a:pi染色后df-1细胞的荧光图像;b:df-1细胞中用cr6+处理后的细胞活力;c:cr6+对df-1细胞中ldh释放的影响;将各对照组设定为100%,其他组的变化以各自的对照组的相对百分比表示;具有不同上标(a,b,c,d)的同一列中的值显着不同;数据表示为平均值±sd;呈现差异(p<0.05)(n=3);所有的试验重复三次。
图2:k2cr2o7触发df-1细胞中的焦亡和casr激活;其中,a,b表示在cr6+暴露后通过fcm结果显示出膜孔的形成以及半胱天冬酶-1的活化(焦亡百分比,q2);c表示焦亡和坏死细胞之间的不同形态特征,图片从左到右分别为3h对照组,3h40μmol/lcr6+组,6h40μmol/lcr6+组和12h40μmol/lcr6+组,展示的是焦亡代表性的过程;d,e分别表示cr6+处理对il-1β和il-18水平的影响;f表示cr6+暴露对casrp1/p2蛋白水平的影响,比值为代表casr蛋白的活化程度;g表示cr6+处理对[ca2+]i水平的影响;h表示[ca2+]i作用于稳态调节器,时间对[ca2+]i的波动的影响;将各个对照组设置为1,其他处理组以各个处理组与对照组的比值表示;具有不同上标(a,b,c,d)的同一列中的值显着不同;数据表示为平均值±sd。呈现差异(p<0.05)(n=3);所有的试验重复三次。
图3:casr活化调节cr6+诱导的焦亡;其中,a,b分别表示cr6++nps2390对细胞sytoxblue和caspase-1双阳性的影响;c,d,e分别表示cr6++nps2390对ldh,il-1β和il-18水平的影响;f,g表示cr6++nps2390对casrp1/p2蛋白水平的影响;h表示cr6++nps2390处理对[ca2+]i的影响;具有不同上标(a,b,c,d)的同一列中的值显着不同;数据表示为平均值±sd;呈现差异(p<0.05)(n=3);所有的试验重复三次。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
正如背景技术部分所介绍的,细胞焦亡是一种新型的细胞死亡方式,细胞在受到不同的刺激时会通过不同的通路启动焦亡进程。目前,细胞焦亡主要存在于巨噬细胞和树突状细胞中,但关于铬(vi)诱导的df-1细胞焦亡及其作用机制至今未见报道。
本发明通过建立分别用cr6+(0,10,20或40μmol/l)和cr6+与nps2390(casr抑制剂,10μmol/l)共孵育处理df-1细胞。采用流式细胞术检测双阳性的焦亡细胞,通过扫描电镜观察焦亡细胞的形态,用elisa法检测il-1β及il-18的表达以及通过westernblot技术检测casr蛋白的表达并通过荧光酶标仪检测[ca2+]i的含量。结果发现,cr6+以时间/剂量依赖方式引起df-1细胞的细胞毒性。进一步的实验表明,cr6+能够增加[ca2+]i含量而nps2390可以减轻cr6+触发的casr激活以及随后在df-1细胞的焦亡。最终本发明发现cr6+激活casr会增强df-1细胞的焦亡。
为了使得本领域技术人员能够更加清楚地了解本申请的技术方案,以下将结合具体的实施例详细说明本申请的技术方案。
本发明实施例中所用的化学品都是最高等级的纯度,nps2390购自tocrisbioscience(uk)。n,n,n',n'-四(2-吡啶基甲基)乙二胺(tpen)购自sigma(p4413)。细胞计数试剂盒-8(cck-8),ldh细胞毒性检测试剂盒和fluo-3-乙酰氧基甲酯(fluo3-am)购自dojindolaboratories(japan)。fam-flicacaspase-1试剂盒从immunochemistrytechnologies(usa)获得。sytoxblue来自molecularprobes(usa)。从beyotime公司购买了细胞膜和细胞质蛋白提取试剂盒(p0033)。试验所用的两种一抗是钙敏感受体抗体(abcam,ab79829)和抗nadph抗体(solarbio,m1000110)。二抗是hrp缀合的山羊抗兔igg(cwb10,cw0103m)和过氧化物酶缀合的affinipure山羊抗小鼠igg(h+l)(zsgb-bio,zb-2305)。bicinchoninin酸(bca)蛋白质测定试剂盒购自cwbio(cw0014)。增强型化学发光(ecl)试剂盒购自clinxscienceinstrumentsco.ltd(jp001b250)。细胞培养基dmem来自gibco(c11995500bt)。d-hank盐平衡液(hbss)由solarbio(h1045)提供。此外,k2cr2o7、碘化丙锭(pi)等均来自科尚公司(中国泰安)。df-1由atcc(北京,中国)机构提供。
本发明实施例中所用的未进行具体说明试验材料均为本领域常规的试验材料,均可通过商业渠道购买得到。
实施例1:
1.试验方法:
1.1细胞培养及活力检测:
将df-1细胞在含有10%胎牛血清(fbs)的dmem中于37℃在5%co2湿润培养箱中进行培养。
使用cck-8检测细胞活力,具体的,将细胞接种在96孔板中约80%进行试验。将这些细胞用k2cr2o7(0,10,20或40μmol/l)分别处理3h,6h及12h,然后根据制造商的说明将cck-8工作溶液加入到每个孔中。在37℃温育2小时后,使用酶标仪(thermofishermultiskanfc)在450nm处读取吸光度。
此外,将细胞接种在6孔板中。用k2cr2o7(0,10,20或40μmol/l)处理12小时后,通过pi(2.5μg/ml)进行染色。随后,通过光学显微镜(上海teelen)观察染色细胞,随之用荧光显微镜(nikonte2000)拍摄荧光图像。
1.2细胞处理:
根据以上cck-8和pi染色的结果,本实验中应用10、20或40μmol/lk2cr2o7。因此,将df-1细胞随机分为以下三组:(1)对照组分别在37℃,dmem培养3h,6h或12h。(2)cr(vi)处理组:将df-1细胞与k2cr2o7(10、20或40μmol/l)在37℃温育3h,6h或12h以及(3)cr(vi)+nps2390(casr抑制剂,10μmol/l):将df-1细胞与nps2390和k2cr2o7(20μmol/l)共孵育3h,6h或12h。
1.3ldh细胞毒性检测:
收集k2cr2o7组以及k2cr2o7+nps2390组所有组细胞的上清液。根据制造商的说明,通过ldh细胞毒性检测试剂盒检测ldh水平。使用酶标仪(biotek,elx800)测定490nm处的吸光度。
1.4胞内钙含量检测:
细胞经过cr处理后,将96孔板细胞与0.5mmtpen一起孵育10分钟,然后在37℃在黑暗中加载4μm荧光染料fluo3-am(含有0.02%pluronicf-127)30分钟。此后,他们被hbss清洗。最后,通过荧光酶标仪(moleculardevices,spectramaxi3x)测量染色的细胞并通过荧光强度(激发波长485nm和发射波长525nm)分析[ca2+]i。其他组采用与上述相同的方法测定。
1.5流式细胞仪检测焦亡细胞:
使用fam-flica体外caspase-1检测试剂盒测量细胞的焦亡。将细胞接种在6孔板中并培养24小时。然后,细胞用cr6+或cr6++nps2390处理指定的时间。于指定的处理后,将收获的细胞与fam-yvad-fmk工作溶液在37℃培养箱中在黑暗中孵育1小时。用pbs洗涤三次后,使用1mmsytoxblue染色剂在室温下染色细胞10分钟。随后进行流式细胞术进行细胞焦亡的分析。在每次实验中,随机选择10000个细胞用于检测焦亡细胞,每组细胞检测三次。如上所述,fam-yvad-fmk和sytox蓝染色是双重阳性的细胞即为焦亡细胞。
1.6扫描电子显微镜观察:
2.5%戊二醛用于细胞过夜固定,之后用pbs冲洗三次。然后,通过梯度脱水法(30,50,70,95和100%乙醇)使样品脱水,并通过叔丁醇法干燥。干燥后,样品用金-钯溅射涂布。最后,使用3kv或5kv的操作场发射扫描电子显微镜(hitachilimited,su8020)对干燥的样品成像。
1.7测定il-1β和il-18:
根据鸡il-1β和il-18elisa试剂盒的说明,测定df-1细胞上清液中il-1β和il-18的分泌。
1.8casr蛋白的制备:
所有实验组细胞(每个样品中约5×108个细胞)通过pbs洗涤三次,然后遵循说明获得casr蛋白裂解物(p0033)。在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sds-page)之前,通过bca蛋白质测定试剂盒对这些样品进行定量。
1.9casr蛋白的western印迹分析:
通过western印迹收集定量的蛋白质样品用于检测casr蛋白质的水平[25]。具体来说,分离的样品使用10%丙烯酰胺分离凝胶进行sds-page并转移到聚偏二氟乙烯(pvdf)膜上。将膜用5%脱脂奶粉封闭1小时,并分别与4℃下的一抗:casr抗体(3:500)和gapdh(1:2500)过夜孵育。随后,膜在tbst中洗涤三次,每次持续10分钟,并与相应的二抗(casr-cw0103m1:2000gapdh-zb-23051:1000)温育1小时,并再次用tbst根据上述方法洗涤。最后,通过在fusionfxvilberlourmat上使用ecl试剂盒检测蛋白条带。gapdh用作内部参考来标准化每个蛋白带的密度。获得的数据表示为每种蛋白质和gapdh的光密度比。
1.10统计分析:
结果以平均值±标准偏差(sd)表示。0.05水平被认为是显著的(p<0.05)。单因素方差分析用于确定各组间差异的显著性。所有统计分析均使用统计程序版本19.0(spssinc.chicago,il,usa)进行。
2.试验结果:
2.1细胞活力的毒性试验结果:
为了检测cr6+的df-1细胞活力及毒性的作用,将细胞通过pi染色并且在cr6+处理12h后通过荧光显微镜观察。鉴于pi是可渗透的染料,因此通过pi摄取来监测细胞膜完整性。图1a表示在cr6+处理12小时后红色荧光增加,并且随剂量增加而增加。在该试验中,选择细胞活力和ldh释放从而直接评估cr6+的细胞毒性。如图1b和c所示,细胞活力随着处理浓度的增加而降低。与此同时,ldh释放随着处理浓度的增加而增加。这三个指标均存在剂量依赖性。细胞经过相应处理后,红色荧光和ldh释放的剂量依赖性增加确定了cr6+可最终导致细胞死亡。
2.2cr6+在df-1细胞中触发焦亡以及激活casr:
在实验中,首先确定cr6+是否诱导df-1细胞中的焦亡。在cr6+(0,10,20或40μmol/l)处理3,6,12小时后,收集细胞以通过流式细胞术检测df-1细胞中的半胱天冬酶-1活化和细胞膜完整性。fcm结果指出,用cr6+处理的df-1细胞在12小时显示出胱天蛋白酶-1和sytoxblue双阳性细胞的百分比的剂量依赖性升高,如图2b所示。然而,与相应对照组相比,3和6h的10μmol/lcr6+组没有显着差异。如图2c所示的电镜结果显示在细胞膜中存在多个泡状类似尺寸的突起。同时,它对于发育细胞有点肿胀,但存在质膜完整性。此外,图2c中有一些成员孔隙(3h40μmol/lcr6+组,箭头所示)。随着时间的推移,肿胀的细胞变得扁平并且看起来像煎蛋(图2c,12小时40μmol/lcr6+组)。此外,随着时间的增加,cr6+暴露后的il-1β/18水平升高,我们很容易在图2d,e中得到。在3小时,低剂量组(10μmol/lcr6+组)与对照组相比差异不显著。
由于坏死和焦亡具有共同的形态特征,因此仅通过观察死亡细胞的形态来区分是比较困难的。在本发明的研究中,通过电镜图来分别区分坏死和焦亡。不同的分辨率图片用于集中观察细胞的不同部分,如膜孔、细胞质和焦亡小体。如图2c所示,细胞经历细胞质扁平化过程并形成一些膜孔(3h40μmol/lcr6+组,箭头指示),这些与前面讨论的焦亡的特征类似。然而,坏死细胞死亡主要呈现出爆炸状。此外,焦亡过程中会出现焦亡小体(12h40μmol/lcr6+组,在图2c箭头指示)而在坏死细胞死亡过程中不会产生。sem结果是焦亡形态学的初步证明。
在图2f中显示了casr蛋白的表达。由于casr的一抗为多克隆抗体,在pvdf中显示出两条蛋白条带。蛋白质印迹分析通过大分子量蛋白质水平(p1)/小分子量(p2)表示,这个比例代表casr蛋白的活化程度。正如所料,随着时间的推移,p1/p2的比率增加。相反,在cr6+暴露后3小时没有显着影响。他们发现,在6小时和12小时处理中,p1/p2的最大比率为20μmol/lcr6+处理组。由于casr激活,[ca2+]i随着cr6+剂量依赖性方式增加。[ca2+]i作用于稳态调节器,时间对[ca2+]i的波动有显着影响,如图2h所示。
2.3casr激活介导cr6+诱导的焦亡:
为了证实通过casr激活促进了细胞焦亡,因此使用casr活化抑制剂nps2390。在cr6++nps2390处理后,通过半胱天冬酶-1活化,il-1β/18产生和ldh释放来检查细胞焦亡。
nps2390降低了cr6+处理后半胱天冬酶-1双阳性细胞的百分比(图3b)。此外,il-1β和18和ldh的释放在预期暴露于casr抑制剂治疗后也降低(图3c,d和e)。在3h时,抑制剂对il-1β和18抑制作用不显著。
同时,检测cr6++nps2390处理的细胞中casr活化水平(图3f,g)。图3g中的数据证实抑制剂nps2390显着地抑制了cr6+增加的p1/p2casr蛋白质水平。因此nps2390抑制cr6+触发的casr活化水平。cr6+处理导致[ca2+]i显着增加,而与cr6++nps2390共暴露显着抑制了cr6+诱导的[ca2+]i升高。因此,这些数据表明casr激活在df-1细胞焦亡中发挥作用。
综上,cr6+激活casr会增强df-1细胞的焦亡,本发明的研究对于避免铬(vi)的毒性作用,以及细胞焦亡的深入研究具有重要的意义。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- Virosaine A的四氢吡咯基和吗啉基衍生物的组合物在抗骨质疏松药物中的应用
- 鉴定嗅觉受体调节剂的方法
- 用于治疗局部晚期或转移性雌激素受体阳性乳腺癌的雌激素受体调节剂的制作方法
- 作为mglu5受体的负性别构调节剂的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法
- Virosaine A的哌嗪基和咪唑基衍生物的组合物在抗骨质疏松药物中的应用
- 受体调节剂的环烷基氧基吡啶化合物和杂环烷基氧基吡啶化合物的制作方法
- 作为甲酰肽受体调节剂的苯基氨基甲酸酯衍生物的制作方法
- 雄激素受体调节剂的晶形的制作方法
- 受体调节剂的环烷基氧基吡啶化合物和杂环烷基氧基吡啶化合物的制作方法
- 作为甲酰肽受体调节剂的苯基氨基甲酸酯衍生物的制作方法
- 使用单一溶剂进行克罗米芬合成的制作方法
- 性甾体前体单独或与选择性雌激素受体调节剂联合用于预防和治疗绝经后女性的性功能障碍的制作方法
- Schiglautone A衍生物的组合物用于制备抗骨质疏松药物的制作方法
- 用于治疗间皮瘤的雌激素受体β激动剂的制作方法
- 一种1-boc-3-羟甲基吡咯烷的制备方法
- Virosaine A的四氢吡咯基和吗啉基衍生物的组合物在抗骨质疏松药物中的应用
- 鉴定嗅觉受体调节剂的方法
- 用于治疗局部晚期或转移性雌激素受体阳性乳腺癌的雌激素受体调节剂的制作方法
- 作为mglu5受体的负性别构调节剂的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法
- 稳定的无定形的盐酸氯卡色林的制作方法