一种HA靶向的双金属氢氧化物-超小铁纳米材料及其制备和应用的制作方法
本发明属于纳米诊疗剂及其制备和应用领域,特别涉及一种ha靶向的双金属氢氧化物-超小铁纳米材料及其制备和应用。
背景技术:
近年来,随着纳米技术与分子影像学的发展,具有肿瘤诊断与治疗功能的纳米诊疗平台的构建为肿瘤的早期诊断与个体化治疗提供了可能。mr成像由于其灵敏度高、分辨率高、无创伤或辐射效应等优点,被看作是最有效的早期癌症临床诊断技术之一。与常用的含gd和mn的mr阳性造影剂相比,超小尺寸的四氧化三铁纳米颗粒(<5nm)的不仅具有良好的t1成像效果,还具备更好的生物相容性,是一种潜在的高效t1造影剂。但是,fe3o4纳米颗粒易聚集、无法特异性识别肿瘤细胞,因此如果选择合适的载体有望提供其胶体稳定性、赋予其肿瘤靶向功能,并且能够负载抗肿瘤药物,将有望构建具有肿瘤mr成像与靶向给药相结合的治疗一体化纳米平台。ldh可以在其晶体结构中掺杂有功能性离子,或者可以在表面上用官能团或np(例如:fe3o4,au和agnps)进行修饰。徐等人设计的ph超灵敏锰基层状双氢氧化物(mn-ldh)纳米粒子具有极好的纵向弛豫性,这可能源于mn-ldh中mn离子的独特微观结构。史等人已经开发出gd掺杂的层状双氢氧化物ldh/au纳米复合材料作为药物载体和诊断剂。在用肝素修饰mg-al-ldh-gd/au纳米材料后,观察到其在小鼠体内的mr成像效果明显增强,并且在尾静脉注射高剂量纳米复合材料后20天内对小鼠没有可检测的组织损伤。因此,这种新型的mn掺杂的ldh纳米材料与已经证明的用于药物和基因递送的能力一起是用于癌症诊断和治疗的非常有潜力的治疗剂。段等人在这项工作中,开发了一种“自下而上”的方法来制备稀土(gd3+和yb3+)共掺杂层状双氢氧化物(ldh)单层纳米片,具有精确控制的组成和均匀的形态。由于gd3+和yb3+成功引入ldh主体层,gd和yb-ldh单层纳米片表现出优异的磁共振(mr)/x射线计算机断层扫描(ct)双模成像功能。
ldh具有高度细胞相容性,载药量极高和ph可控释放等特性,这对于化学治疗等高毒性药物尤为重要。最近的一项研究:saifullah等人报道了使用ldh开发生物相容性纳米递送系统,结核病药物异烟肼与mg-al-ldh结合,并且在模拟缓冲溶液中测量其释放动力学。ldh表现出改善的细胞相容性,在使用正常人肺和小鼠成纤维细胞评价时,与游离异烟肼相比,载药复合物的药物递送效率更高。与此同时,已有研究证明ldh是通过网格蛋白介导的内吞作用将药物传送到细胞内,这就可以保证药物可以被ldh快速地带入细胞基质中,使得ldh可以直接作为药物递送载体而无需进行额外修饰。因此,ldh已经成为理想型抗癌药物的无机纳米载体候选物之一。
检索国内外文献尚没有发现关于层状双氢氧化物负载阿霉素和超小铁纳米颗粒的制备及其用于肿瘤mr成像/药物治疗的研究报道。
技术实现要素:
本发明所要解决的技术问题是提供一种ha靶向的双金属氢氧化物-超小铁纳米材料及其制备和应用。本发明通过共沉淀法合成ldh-fe3o4纳米复合材料,活化的透明质酸通过硅烷偶联剂aptes共价键和在ldh-fe3o4层板表面,最后进行抗癌药物dox的表面负载。
本发明的一种ha靶向的双金属氢氧化物-超小铁纳米材料,其特征在于,所述纳米材料为层状双金属氢氧化物-超小四氧化三铁复合纳米材料表面负载透明质酸;超小四氧化三铁的纳米粒径为2-5nm。
进一步的,所述超小四氧化三铁的纳米粒径为3.2nm。
本发明的一种ha靶向的双金属氢氧化物-超小铁纳米材料的制备方法,包括:
(1)将fe3o4纳米粒子分散在水溶液中并超声10-30min,与金属离子的水溶液混合,滴加碱并调节ph,得到橙色悬浮液,老化,离心收集,超纯水洗涤以完全除去未反应的离子,冷冻干燥,得到双金属氢氧化物-超小铁纳米材料ldh-fe3o4;为了防止样品中的碳酸盐污染,在整个合成过程中使用脱碳酸水,并且共沉淀反应在氮气下进行;
(2)将活化的透明质酸ha滴加在表面带有氨基的ldh-fe3o4-aptes纳米颗粒水溶液中,室温条件下,反应1-3天,得到表面具有透明质酸ha靶向双金属氢氧化物-超小铁纳米材料ldh-fe3o4-hanps。
上述制备方法的优选方式如下:
所述步骤(1)中fe3o4纳米粒子由下列方法制备:将三氯化铁溶解在二甘醇deg中,然后加入柠檬酸钠,反应1-2h,再加入无水乙酸钠混合至澄清透明,进行溶剂热反应,冷却,离心,洗涤,烘干;其中fecl3、柠檬酸钠和无水乙酸钠的质量比为0.64~0.7:0.47~0.50:1.31~1.33。
所述溶解为搅拌溶剂:60~80℃下搅拌1~2h;溶剂热反应为:反应温度为180~220℃,反应时间为3~4h。
所述离心具体为:8500~9000rpm,离心10~15min,弃上清液,用无水乙醇回溶,再8500~9000rpm离心10~15min,重复操作2~3次。
进一步优选,fe3o4纳米粒子由下列方法制备:在搅拌下将无水氯化铁(1081mg)溶解在40ml二甘醇中以形成均匀溶液,将柠檬酸钠(471mg)加入到上述溶液中,并将混合物在水浴中加热至80℃直至形成澄清溶液;随后,将乙酸钠(1312mg)加入到上述混合物溶液中并溶解,然后将混合物转移到体积为100ml的teflon衬里的不锈钢高压釜中并密封在空气中,将高压釜置于200℃的烘箱中4h,冷却至室温后,通过离心(10000rpm,5min)收集黑色溶液并用乙醇纯化3次以除去过量的反应物和副产物,将所得黑色产物再分散到水中并冻干以获得fe3o4nps。
所述步骤(1)中金属离子的水溶液为mg(no3)2·6h2o和al(no3)3·9h2o的混合水溶液;
mg(no3)2·6h2o和al(no3)3·9h2o的摩尔浓度比为0.09~0.095:0.032~0.036。
所述步骤(1)中滴加碱并调节ph具体为:采用碱为浓度为1.0~1.2m的naoh溶液,滴加速度0.4ml/min,调节ph到9.3~9.7。
所述步骤(1)中老化12-24h;冷冻干燥24-48h。
所述步骤(2)中活化的透明质酸ha为edc和nhs活化ha,其中ha与edc和nhs的物质量比为1:5:5。
所述步骤(2)中表面带有氨基的ldh-fe3o4-aptes纳米颗粒:将(3-氨基丙基)二甲基乙氧基硅烷aptes滴加到上述ldh-fe3o4的水溶液中,搅拌反应12-24h,得到了表面带有氨基的ldh-fe3o4-aptes纳米颗粒。
所述步骤(2)中ldh-fe3o4-aptes和活化后的ha的投料质量比为1:1。
所述步骤(2)中室温条件下,反应2天。
本发明的一种所述方法制备的ha靶向的双金属氢氧化物-超小铁纳米材料。
本发明提供一种ha靶向的载药双金属氢氧化物-超小铁纳米材料,所述ha靶向的双金属氢氧化物-超小铁纳米材料负载药物,其中负载方法为:按照ldh-fe3o4-hanps与抗癌药物的投料质量比为1:2;将药物水溶液滴加入所述ha靶向的双金属氢氧化物-超小铁纳米材料ldh-fe3o4-hanps的水溶液中,搅拌24-72h,得到ha靶向的载药双金属氢氧化物-超小铁纳米材料;所述通过离心除去上清液的方法分离得到载药体系。
所述药物为dox。
通过紫外-可见光谱表征方法计算ldh-fe3o4-ha/dox载药体系中药物的上载效率与上载率。
dox的上载效率和上载率通过如下所示的公式(a)和(b)计算得到,可以用来评价载体对dox的负载。
上载效率(%)=上载药物的质量/投入药物的质量*100%(a)
上载率(%)=上载药物的质量/(上载药物的质量+载体的质量)*100%(b)
本发明提供的一种所述的ha靶向的载药双金属氢氧化物-超小铁纳米材料在制备用于肿瘤的mr成像以及药物化疗药物中的应用。
本发明使用zeta电势及动态光散射分析(dls)、紫外可见吸收光谱(uv-vis)、场发射扫描电子显微镜(sem)、透射电子显微镜(tem)、傅里叶变换红外光谱(ftir)、电感耦合等离子体原子发射光谱法(icp-aes)、磁共振(mr)成像分析等手段表征制备的层状双氢氧化物负载阿霉素和超小铁纳米颗粒。然后利用cck-8法评价纳米颗粒的细胞毒性,最后进行黑鼠体内肿瘤模型的mr成像实验,以及药物抗肿瘤实验,借以考察ldh-fe3o4-ha/doxnps的成像和治疗效果。此外,通过组织分布实验研究ldh-fe3o4-ha/doxnps在动物体内的代谢情况。具体测试结果如下:
(1)tem测试结果
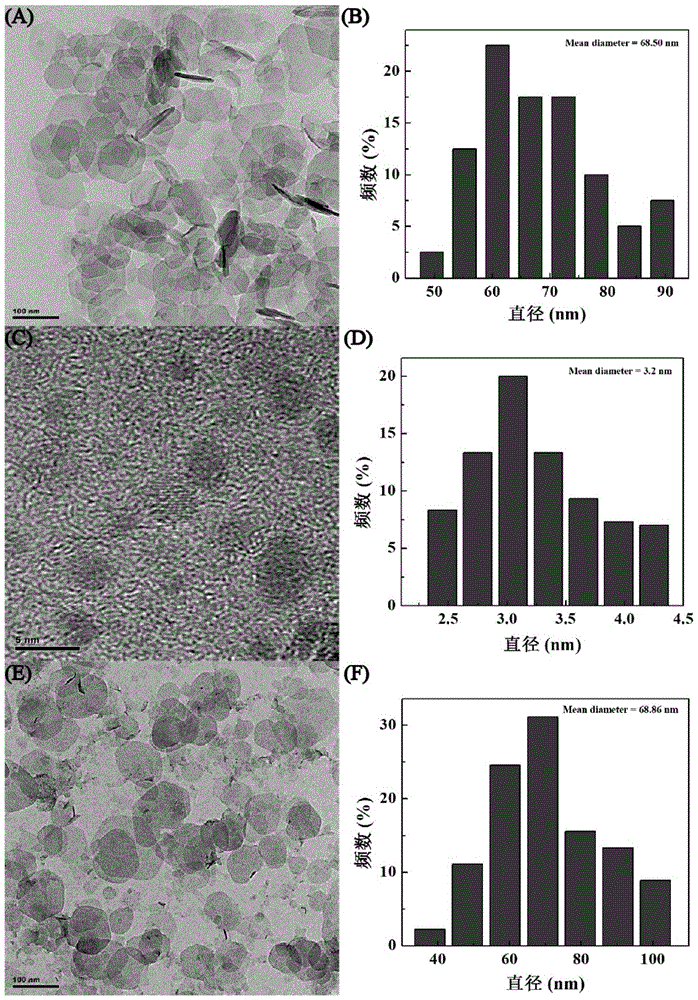
通过tem观察ldh的形态,如图1(a),结果表明ldh形态均匀,平均粒径约为68.50nm,tem结果见图1(c)显示,水热法合成fe3o4纳米颗粒以后,黑色的fe3o4的尺寸低至3.2nm,见图1(d)。另外,可观察到黑色的fe3o4纳米颗粒成功地负载在ldh的层板表面,见图1(e),这说明已经成功制备粒径分布均匀的ldh-fe3o4纳米复合物。
(2)粉末x射线衍射(xrd)测试结果
用粉末x射线衍射(xrd)分析合成的ldh纳米载体的结构。
mg2al(oh)6(no3)0.5-ldh纳米颗粒的典型xrd图谱,如图2所述,基底间距为
(3)ftir光谱测试结果
利用ftir光谱测试进一步研究材料的表面组成(见图3),(a)(c)(d)(e)四条光谱中均出现3443cm-1处的宽吸收峰,这是由金属氢氧化物层的o-h和夹层中的水分子伸缩振动产生,1386cm-1处的尖峰吸收来自于ldh层间阴离子no3-的伸缩振动。(b)光谱曲线中出现了典型的fe-o伸缩振动(v=516cm-1),峰值位于2924cm-1处和3436cm-1属于-ch2和-oh拉伸振动。此外,谱线(c)中也分别产生了硅烷偶联剂中的si-ch2和氨基-nh2的吸收峰(v=1200cm-1)和(v=1620cm-1)。最后在(d)光谱曲线中透明质酸的羧酸基团在1630cm-1处显示出强峰,在1405cm-1处显示宽峰,均来自于coo-基团的不对称和对称伸展振动。因此,通过红外谱图可以得出靶向配体ha已经共价键合在ldh-fe3o4纳米复合物表面。
(4)uv-vis光谱测试结果
通过测定ldh-fe3o4-ha/doxnps的uv-vis图谱(见图4),结果表明ldh-fe3o4-ha在480nm处无紫外吸收,然而在ldh-fe3o4-ha/dox中480nm处出现较强吸收,证明ldh-fe3o4-ha/dox的成功合成。
(5)zeta电势及水动力学直径测试结果
粒径和zeta电势测定结果(见图5和图6)表明ldh的表面电势为+36.6mv,水动力学直径为107.2nm。ldh-fe3o4的表面电势略微降低(+30.2mv),同时水动力直径也增加为124.2nm。证明了fe3o4的成功装载。ldh-fe3o4-ha的表面电势大幅降低为-16.1mv,粒径为325.1nm。由于dox带正电荷,ldh-fe3o4-ha/dox的表面电势也增大为-9.1mv,粒径则无明显差别,最后说明了dox在载体上的成功负载。
(6)药物累计释放统计结果
为了发挥dox的治疗效果,因此有必要研究dox从ldh-fe3o4-ha/doxnps中的释放动力学(见图7)。将1mg/ml的ldh-fe3o4-ha/doxnps溶解在pbs溶液中,装入透析袋中,分别置于9ml的pbs(ph=7.4)或醋酸缓冲液(ph=5.0)中,然后将其置于37℃恒温摇床中振荡。在每个时间点下将1ml的缓冲外液取出并用uv-vis测试。与此同时,将1ml对应ph值的新鲜缓冲液加入其中。在不同ph环境下,ldh-fe3o4-ha/doxnps中dox的缓释特点为初始快速缓释,随后缓慢释放的特点。在pbs(ph=7.4)溶液中,大约有5%的dox在1h之内从络合物中释放出来,在10h内有8%的dox释放出来。药物在醋酸缓冲液(ph=5.0)中的缓释速率略高于在pbs缓冲液(ph=7.4)中的缓释速率。在ph=5.0缓冲液中,大约有15%的dox在1h内缓释出来,大约有40%的药物在10h之内缓释出来。这可能是由于在酸性条件下,dox更易于质子化且更亲水,能够略微提升dox从疏水性的树状大分子内核中的释放速率。所以,可以总结得出ldh-fe3o4-ha/doxnps在肿瘤酸性条件下会比正常组织部位具有更高的dox释放速率。
(7)磁共振(mr)分析结果
通过icp-aes测试法测定实施例1制备的fe3o4,ldh-fe3o4和ldh-fe3o4-ha中fe元素的含量。分别配制fe浓度为0.1,0.2,0.4,0.8和1.6mm的ldh-fe3o4-ha的水溶液500μl,通过磁共振成像分析仪测定材料在不同fe浓度下的t1弛豫效应(如图8)。经过计算得出fe3o4,ldh-fe3o4和ldh-fe3o4-ha的r1值分别为0.42,5.53和4.38mm-1s-1。ldh-fe3o4-ha的r1高于fe3o4的r1值。说明实施例1制备的ldh-fe3o4-hanps可以作为mr分子影像诊断中的优良t1阳性造影剂。
(8)细胞活力评价
以b16细胞为模型,利用cck-8法检测ldh-fe3o4-hanps的细胞毒性与ldh-fe3o4-ha/doxnps的体外抗肿瘤效果。结果如图9所示:与pbs对照组相比,ldh-fe3o4-hanps在试验浓度范围内对黑色素瘤(b16)细胞没有明显细胞毒性,细胞存活率均在100%以上,说明ldh-fe3o4-hanps具有良好的细胞相容性。当dox的含量相同时,经单纯dox处理的b16细胞的存活率都低于ldh-fe3o4-ha/doxnps的存活率,说明同等浓度的dox水平,dox对细胞产生的毒性远远大于ldh-fe3o4-ha/doxnps。当ldh-fe3o4-ha/doxnps(dox的浓度为12.5μg/ml)孵育细胞48h后,细胞存活率均在50%以下,证明ldh-fe3o4-ha/doxnps在体外具有很好的抑制癌细胞增殖的效果。
(9)细胞吞噬实验
为了研究ldh-fe3o4-ha对b16细胞有特异性的靶向性,采用icp-aes检测b16-hhar细胞和b16-lhar细胞对ldh-fe3o4-ha的吞噬量(见图10),可以发现当材料中铁的浓度升高,b16细胞内部吞噬铁的含量也越高。当在培养基中提前加入2mm的ha溶液,孵育2h,将b16表面的cd44受体部分封闭后,细胞吞噬铁的含量明显降低。因此,可以证明ldh-fe3o4-ha对表面cd44受体高表达的b16细胞具有优异的靶向性。
(10)流式细胞仪检测
通过流式细胞仪检测定量地证明了ldh-fe3o4-ha/dox对b16细胞的体外靶向性(见图11)。因为在dox浓度保持一致时,实验组ldh-fe3o4-ha/dox与对照组ldh-fe3o4-ha/dox+free-ha对比,dox荧光峰值明显向右偏移。而且,随着dox的含量升高,进入细胞的dox的总量也呈现递增趋势。所以,该实验也可以证明ldh-fe3o4-ha/dox对表面cd44受体高表达的b16细胞具有优异的靶向性。
(11)激光共聚焦显微镜技术检测
为了定性研究ldh-fe3o4-ha/dox对b16细胞的体外靶向性,我进行了激光共聚焦显微镜技术检测实验。因此,使用激光共聚焦显微镜进行游离dox,对实验组ldh-fe3o4-ha/dox与对照组ldh-fe3o4-ha/dox+free-ha之间细胞内化情况进行比较。如图12所示,孵育4h,实验组ldh-fe3o4-ha/dox可进入b16细胞质与细胞核内部。相反,对于用游离dox孵育的细胞,当细胞在4h后孵育时在细胞核中观察到荧光。另一方面,对照组ldh-fe3o4-ha/dox+free-ha的clsm图像显示,没有在细胞核中看见dox的高荧光强度,表明b16细胞可以更有效地内化修饰靶向配体ha的ldh-fe3o4-ha/dox。
(12)小鼠肿瘤部位t1mr成像
为了检验ldh-fe3o4-hanps进行肿瘤区域mr成像的可能性,见图13(a)。在注射后的同一时间点,没有提前注射透明质酸配体的肿瘤部位会比提前注射注射透明质酸配体的明显更亮,这也可以通过s/n数据的定量分析进行验证见图13(b)。显然,两种不同的注射情况均可在注射后15min达到峰值肿瘤s/n值,然后由于nps通过代谢途径排泄,s/n值开始下降。这些结果证实,由于透明质酸靶向配体的特异性识别效应,ldh-fe3o4-hanps在体内具有更长的血液半衰期,可用于增强肿瘤mr成像。
有益效果
(1)本发明工艺十分简单,易于操作分离,同时原料来源广泛,具有良好的发展应用前景;
(2)本发明首次利用共沉淀的方法将超小铁负载到ldh表面,改善其胶体稳定性来提高超小铁的磁共振成像性能,以便赋予其生物成像的功能,通过静电吸引将大量抗癌药物dox成功引入复合物层间来提高对肿瘤治疗效果。在ldh-fe3o4复合材料的表面修饰透明质酸配体(ha)不仅可以增强肿瘤部位的核磁共振成像效果,也能获得治疗效率极高的诊疗一体化纳米平台;
(3)本发明方法制备得到的纳米材料具有良好的生物相容性和体内血液循环时间,对cd44受体高表达的肿瘤细胞具有靶向作用,如果能将此纳米材料应用到肿瘤的诊断和治疗中,此纳米材料必将大幅提高mr成像效果及药物化疗效果,为新型诊疗一体化纳米平台的开发提供了新方向,前景非常广阔;
(4)本发明的ldh-fe3o4-hanps作为抗癌药物阿霉素(dox)的载体,不仅具有敏感的ph响应释放特性,还可以对cd44受体表达的肿瘤细胞进行特异性识别,从而达到高效抑制肿瘤的理想化效果;
(5)与现有技术相比:cn106865622a公开了一种fe3o4@ldh复合纳米材料的合成方法。本专利与它的不同之处在于:第一、从合成材料和方法上比较,本申请利用无水氯化铁、柠檬酸钠和乙酸钠通过溶剂热法得到一种柠檬酸稳定的fe3o4纳米颗粒;而不是由氢氧化铁和氢氧化亚铁分解产生的氧化铁颗粒。第二、从尺寸方面进行比较,本申请合成的超小四氧化三铁粒径约为3.2nm,合成的ldh-fe3o4直径为68.8nm,远小于cn106865622a中fe3o4@ldh的直径(d=500nm)。本申请制备的纳米材料尺寸小于100nm,更易于被肿瘤细胞内吞,在生物医药领域具有更好的应用前景。第三,应用范围不同。本申请合成的ldh-fe3o4的弛豫率为5.53mm-1s-1,与超小铁相比弛豫率显著性提高了13倍,可以应用于mr成像造影剂。而cn106865622a中材料是用于磁靶向治疗。第四,靶向方式不同。本申请在ldh-fe3o4表面修饰透明质酸,赋予材料对cd44受体表达的肿瘤细胞的靶向性,并且经细胞和动物实验证明材料能够富集在肿瘤部位提高治疗效果和成像效果。最后,本申请构建的诊疗一体化纳米平台ldh-fe3o4-ha/dox能够实时、精确诊断病情并同步进行治疗,而且在治疗过程中能够监控疗效并随时调整给药方案,有利于达到最佳治疗效果,并减少毒副作用。本专利指出该领域未来可能的发展方向,有利于推动该领域的基础研究和应用。
附图说明
图1(a)为实施例1制备的ldh的tem图片;(b)实施例1制备的ldh的tem图片中粒径的统计分布情况;(c)实施例1制备的fe3o4的tem图片;(d)实施例1制备的fe3o4的tem图片中粒径的统计分布情况;(e)实施例1制备的ldh-fe3o4的tem图片;(f)实施例1制备的ldh-fe3o4的tem图片中粒径的统计分布情况;
图2为实施例1制备的ldh,fe3o4,ldh-fe3o4的粉末xrd图片;
图3为实施例1制备的ldh,fe3o4,ldh-fe3o4,ldh-fe3o4-aptes,ldh-fe3o4-ha的傅里叶红外转换光谱的对比;其中:(a)为ldh;(b)为fe3o4;(c)为ldh-fe3o4;(d)为ldh-fe3o4-aptes;(e)为ldh-fe3o4-ha;
图4为实施例1载药前后两种ldh-fe3o4-ha,ldh-fe3o4-ha/dox材料与单纯的dox的紫外吸收光谱的对比;
图5为实施例1制备的ldh,ldh-fe3o4,ldh-fe3o4-aptes,ldh-fe3o4-ha,ldh-fe3o4-ha/doxnps样品在水溶液(图片分别对应为1,2,3,4和5号溶液)中的水动力学直径变化图;
图6为实施例1制备的ldh,ldh-fe3o4,ldh-fe3o4-aptes,ldh-fe3o4-ha,ldh-fe3o4-ha/doxnps样品在水溶液中的水动力学直径变化图;
图7为实施例1制备的ldh-fe3o4-ha/dox在两种ph=5.0和7.4的释放环境中,ldh-fe3o4-ha/dox的药物累计释放曲线;
图8为实施例2配置不同浓度梯度的fe3o4,ldh-fe3o4和ldh-fe3o4-ha溶液的t1弛豫时间的倒数随fe浓度变化的线性关系图(a)和t1加权mr成像图片(b);
图9为实施例3中b16细胞经实施例1制备的ldh-fe3o4-ha(载体浓度为58.3μg/ml),ldh-fe3o4-ha/dox(dox浓度为:1.6、3.2、6.3、12.5和25μg/ml)和纯pbs处理24和48h后的cck-8细胞活力分析结果图;
图10为为实施例4中采用icp-aes检测透明质酸受体高表达的b16细胞和透明质酸受体低表达的b16细胞对ldh-fe3o4-ha的吞噬量比较;
图11为实施例5中采用流式分析仪定量分析透明质酸受体高表达的b16细胞和透明质酸受体低表达的b16细胞对ldh-fe3o4-ha/dox的吞噬结果;
图12为实施例6中采用共聚焦显微镜验证ldh-fe3o4-ha/dox分别在透明质酸受体高表达的b16细胞和透明质酸受体低表达的b16细胞中的分布情况;
图13(a)为向异种移植b16肿瘤的小鼠体内静脉注射ldh-fe3o4-ha之前和之后不同时间点t1加权mr图像;(b)为mr图像的信噪比(snr)分析结果;
图14为ldh-fe3o4-ha/dox的反应合成示意图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
材料的合成:
(1)在搅拌下将fecl3(1081mg,阿达玛斯试剂,500g,批次:p1276861)溶解在40ml二甘醇中以形成均匀溶液。将柠檬酸钠(471mg,国药集团,500g,批号:20140611)加入到上述溶液中,并将混合物在水浴中加热至80℃直至形成澄清溶液。随后,将乙酸钠(1312mg,上海凌峰化学试剂,500g,批号:20140124)加入到上述混合物溶液中并溶解,然后将混合物转移到体积为100ml的teflon衬里的不锈钢高压釜中并密封在空气中。将高压釜置于200℃的烘箱中4h。冷却至室温后,通过离心(10000rpm,5min)收集黑色溶液并用乙醇纯化3次以除去过量的反应物和副产物。将所得黑色产物再分散到水中并冻干以获得粒径大小为3.2nm的fe3o4nps粉用于进一步使用。
(2)将事先制备好的超小铁纳米颗粒充分分散在水溶液中并超声30min,然后与50ml的mg(no3)2·6h2o(0.09m,国药集团,500g,批号:20180118)和al(no3)3·9h2o(0.045m,国药集团,500g,批号:20180308)的水溶液混合,接着用naoh(1.0m)溶液缓慢滴定,滴至ph=9.5±0.2时,瓶内形成橙色悬浮液。将得到的橙色悬浮液进一步老化24h,离心收集,超纯水洗涤以完全除去未反应的离子,样品冷冻干燥48h。为了防止样品中的碳酸盐污染,在整个合成过程中使用脱碳酸水,并且共沉淀反应在氮气下进行。
(3)将(3-氨基丙基)二甲基乙氧基硅烷(aptes)滴加到ldh-fe3o4的水溶液中,剧烈搅拌反应24h,得到了表面带有氨基的ldh-fe3o4-aptes纳米颗粒。在此基础上,用edc和nhs活化透明质酸ha(分子量5830)溶液,最后将活化的ha滴加在ldh-fe3o4-aptes的水溶液中,反应48h后,得到表面具有透明质酸靶向的药物载体(ldh-fe3o4-ha)。
(4)选用材料与药物质量比为1:2的投料比,将dox(分子量579.8)的水溶液加入材料的水溶液中,共搅拌72h,制备ldh-fe3o4-ha/dox载药体系。通过离心除去上清液的方法可以分离得到载药体系。通过紫外-可见光谱表征ldh-fe3o4-ha/dox载药体系中上载药物的含量。
实施例2
为了评价ldh-fe3o4-ha作为mri造影剂的成像效果,将材料与单纯的fe3o4纳米颗粒的r1弛豫率进行比较,r1弛豫率为单位摩尔浓度铁的纵向弛豫时间,可通过不同浓度的t1弛豫时间的倒数拟合计算得到。通过icp-aes测试法测定实施例1制备的fe3o4,ldh-fe3o4和ldh-fe3o4-ha中fe元素的含量。分别配制fe浓度为0.1,0.2,0.4,0.8和1.6mm的ldh-fe3o4-ha的水溶液500μl,通过磁共振成像分析仪测定材料在不同fe浓度下的t1弛豫效应(如图8)。经过计算得出fe3o4,ldh-fe3o4和ldh-fe3o4-ha的r1值分别为0.42,5.53和4.38mm-1s-1。ldh-fe3o4-ha的r1高于fe3o4的r1值。说明实施例1制备的ldh-fe3o4-hanps可以作为mr分子影像诊断中的优良t1阳性造影剂。
实施例3
以b16细胞为模型,利用cck-8法检测ldh-fe3o4-hanps的细胞毒性与ldh-fe3o4-ha/doxnps的体外抗癌效果。配制铁的浓度为1000μg/mlldh-fe3o4-hanps的pbs母液,然后在超净工作台用无菌的pbs配制dox的浓度并添加10μl不同浓度的ldh-fe3o4-ha/dox的pbs溶液。使得最终dox浓度为1.6、3.2、6.3、12.5和25μg/ml,最高浓度对应的载体含量做一组。并用紫外照射过夜杀菌。将细胞培养板继续放置在5%co2,37℃继续孵育24h和48h。然后倒掉培养液,用pbs洗2遍,每孔再中加入100μl新的培养液(含10μlcck-8,90μl培养基),继续培养4h,用酶标仪测量在450nm处吸光值,并根据此值计算细胞的存活率。
实施例4
为了研究ldh-fe3o4-ha对b16细胞有特异性的靶向性,采用icp-aes检测b16-hhar细胞和b16-lhar细胞对ldh-fe3o4-ha的吞噬量。操作步骤如下:将b16细胞接种于24孔板中,每孔接细胞为2×105个,加入1ml培养基,并在37℃和5%co2下孵育。孵育过夜后,用含有pbs(对照)的1ml新鲜培养基和不同fe浓度的ldh-fe3o4-ha(分别为20,40,60,80和100μg/ml)替换培养基。在细胞悬浮液中计数细胞数后,将细胞再培养4h,将细胞离心,用王水溶液消化过夜,并稀释。进行icp-aes以测定细胞样品中的fe含量。
实施例5
将2×105个b16细胞种在12孔板上,培养过夜,然后倒掉原培养基,每孔加入900μl培养基和100μlldh-fe3o4-ha/dox的pbs溶液(dox最终浓度为:5μg/ml),培养3h。倒去培养基,pbs洗涤3次,此时b16细胞被消化、离心,收集,然后用流式细胞仪检测各组样品的荧光强度。
实施例6
将5×104个b16细胞种在12孔板上,培养过夜,然后倒掉原培养基,加入含dox浓度为5μg/ml的ldh-fe3o4-ha/dox纳米复合材料的培养基培养4h。此时b16细胞先用pbs溶液洗3次,然后用2.5%的戊二醛固定30min,再用pbs溶液洗3次,最后细胞核用dapi染色(5-7min)。然后用激光共聚焦显微镜观察细胞形貌。
实施例7
将ldh-fe3o4-hanps和ldh-fe3o4-hanps+free-ha([fe]=500μg/ml,in0.2ml生理盐水/每只老鼠)分别通过尾静脉注射接有肿瘤(b16)的c57bl/6小鼠体内(肿瘤体积大约为200-300mm3,),通过mr成像仪(somatomdefinitionflash,siemens,erlangen,germany)检测不同时间点的t1mr成像。扫描参数为tr:280ms,te:15ms,fov:80×100,matrix:318×314,thickness:0.7mm,gap:0.14nm,nex:10。
- 还没有人留言评论。精彩留言会获得点赞!
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺