一种含有磷酸根的棉花修饰材料及其制备方法和应用与流程
本发明属于分析化学领域,具体涉及一种含有磷酸根的棉花修饰材料以及该材料被固载上金属离子后作为固相萃取吸附剂的应用。
背景技术:
纤维素是由β-D-葡萄糖单元组成的线性聚合物,含有大量的羟基基团(每个葡萄糖单元含有三个羟基)。作为最丰富的天然聚合物材料,纤维素环境友好、廉价、生物相容性好而且孔隙度高。纤维素在很多领域都有广泛的应用,例如作为催化剂材料、过滤膜材料和吸附剂材料。作为一种纤维素材料,棉花拥有纤维素以上的优点,近年来得到极大的关注。
在我们之前的工作中,多种棉花相关的功能化材料被开发,并用于复杂生物样品中目标分析物的选择性富集,均表现出很好的效果。然而,之前的修饰方法普遍存在功能团的修饰量较低的问题,这对吸附剂的吸附容量会有一定的影响。
接枝共聚(Grafting copolymerization),是一种通用的赋予聚合物材料功能性的方法,同时也被广泛用于制备纤维素接枝共聚物。纤维素接枝共聚修饰主要基于三种方式:(a)嫁接支链(grafting onto);(b)长出支链(grafting from);(c)大单体共聚接枝(grafting through)。其中,“长出支链”是最普遍采用的方法,归功于它的高接枝密度和可控性。“长出支链”是指在纤维素骨架上长聚合物刷子,可以有很多方式,包括自由基聚合、开环聚合和可控/活性自由基聚合。
技术实现要素:
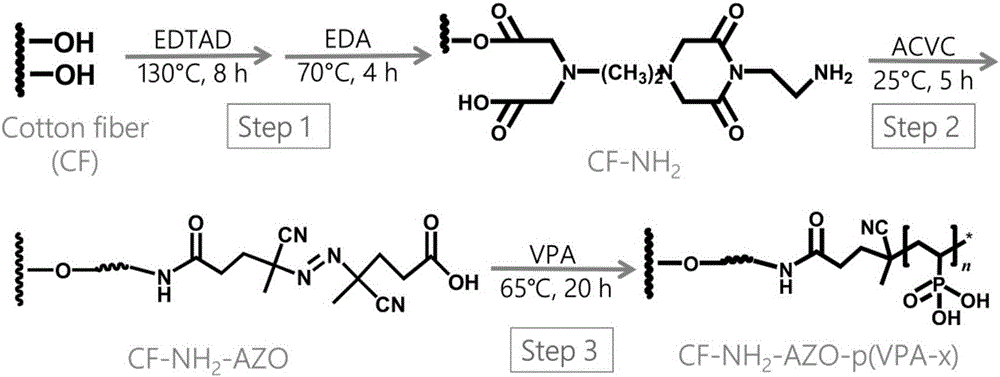
本发明的目的是克服现有制备技术的不足,利用纤维素接枝共聚修饰中“长出支链”方式的普遍实用性和高接枝密度,开发一种新型的含有磷酸根的棉花修饰材料,CF-NH2-AZO-p(VPA-x),随后,该材料被固载上金属离子,CF-NH2-AZO-p(VPA-x)-Mn+被作为固定金属亲和色谱的材料用于多种生物样品中磷酸化多肽的选择性富集。
本发明的目的通过以下技术方案实现:
一种含有磷酸根的棉花修饰材料,其结构特征如下式I,
CF-NH2-AZO-p(VPA-x)(I),式中CF为棉花纤维(Cotton fiber,CF),AZO为自由基引发剂,VPA为乙烯基膦酸,x=0,0.5,1,2,3,4。
优选的,式I中的x=2。
一种制备上述含有磷酸根的棉花修饰材料的方法,包括如下步骤:
(1)制备氨基修饰的棉花CF-NH2:称取0.5g乙二胺四乙酸二酐(EDTAD)于500mL圆底烧瓶中,加入300mL无水N’N-二甲基酰胺(DMF),再加入1.0g脱脂棉。充分混合之后,磁力搅拌条件下130℃反应6h。反应完成后,冷却一段时间,将反应液倒掉,重新加入300mL DMF,再加入0.5mL乙二胺,磁力搅拌条件下70℃反应4h。产物依次用二次水和丙酮清洗,60℃真空干燥4h。
(2)制备CF-NH2-AZO:称取0.4g CF-NH2于50mL离心管中,加入40mL无水二氯甲烷,再加入0.2g 4,4’-偶氮二(4-氰戊酰氯)(ACVC)和0.1mL三乙胺,25℃反应5h。产物依次用二氯甲烷、乙醇、二次水和丙酮清洗,室温干燥过夜。
(3)制备CF-NH2-AZO-p(VPA-x):称取0.25g CF-NH2-AZO于50mL反应釜中,加入25mL甲醇和0.5g乙烯基膦酸(VPA)。密封,65℃反应20h。产物依次用甲醇、水和丙酮清洗,60℃真空干燥,得到的产物作为CF-NH2-AZO-p(VPA-2)(x=2)。此外,其它五种CF-NH2-AZO-p(VPA-x)(x=0,0.5,1,3,4)的制备方法与CF-NH2-AZO-p(VPA-2)类似,只是改变乙烯基膦酸的投料量(x=0,VPA=0;x=0.5,VPA=0.125g;x=1,VPA=0.25g;x=3,VPA=0.75g;x=4,VPA=1g)。
优选的,上述制备方法的步骤(3)中,x=2。
一种以棉花纤维为基底的固相萃取吸附剂,其结构特征如下式II,
CF-NH2-AZO-p(VPA-x)-Mn+(II),式中CF为棉花纤维(Cotton fiber,CF),AZO为自由基引发剂,VPA为乙烯基膦酸,x=0,0.5,1,2,3,4,Mn+为金属离子。
优选的,式II中的x=2。
优选的,Mn+为Ti4+,Zr4+,Fe3+中的任意一种。
一种制备以棉花纤维为基底的固相萃取吸附剂的方法:
分别配制含有不同金属离子的水溶液(0.1M)各20mL,往这种溶液里加入0.2g CF-NH2-AZO-p(VPA-x),室温震荡5h。产物依次用乙醇、水和丙酮清洗,60℃真空干燥,得到CF-NH2-AZO-p(VPA-x)-Mn+。
优选的,上述制备方法的CF-NH2-AZO-p(VPA-x)中,x=2。
进一步地,上述制备方法中含金属离子的盐为硫酸钛、氧氯化锆、氯化铁中的任意一种。
本发明还公开了上述方法制备的以棉花纤维为基底的固相萃取吸附剂在选择性富集生物样品中磷酸化肽的用途。
本发明以天然的棉花纤维为基底,采用纤维素接枝共聚修饰中“长出支链”方式在氨基化棉花表面修饰磷酸根基团,继而在磷酸根基团上修饰金属离子,这一系列的修饰不会破坏棉花纤维的机械性能,仍保持棉花本身特有的渗透性和生物相容性,其表面的磷酸根修饰量较大,通过改变单体乙烯基膦酸的投料量,可以控制磷酸根的修饰量。因此,该修饰对棉花进行功能化,增加了棉花纤维的实用性。取3-5mg上述制备的纤维材料装入注射器针头上,再套上针管,即得到简易的注射器固相萃取装置。萃取过程中,采用手动推拉的方式进行反复萃取,由于纤维材料的渗透性极好,该萃取方式背压小、阻力小。该方法操作简单、溶剂消耗少、快速,完成一次萃取流程仅需3分钟。
附图说明
图1为CF-NH2-AZO-p(VPA-x)制备的流程图。
图2为β-酪蛋白酶解液的质谱图:
(a)直接分析;(b)经过CF-NH2-AZO-p(VPA-2)-Ti4+萃取后;(c)经过CF-NH2-AZO-p(VPA-2)-Zr4+萃取后;(d)经过CF-NH2-AZO-p(VPA-2)-Fe3+萃取后;磷酸化多肽被标记成‘αn’和‘βn’。
图3为β-酪蛋白和牛血清蛋白(BSA)酶解混合液(1:100)经过CF-NH2-AZO-p(VPA-x)-Ti4+处理之后的质谱图:
x表示VPA与CF-NH2-AZO的质量比:(a)0,(b)0.5,(c)1.0,(d)2.0,(e)3.0和(f)4.0;磷酸化多肽被标记成‘αn’和‘βn’。
图4为β-酪蛋白和BSA酶解混合液(1:1000)的质谱图:
(a)直接分析;(b)经过CF-NH2-AZO-p(VPA-2)-Ti4+萃取后;磷酸化多肽被标记成‘αn’和‘βn’。
图5脱脂牛奶酶解液的质谱图:
(a)直接分析;(b)经过CF-NH2-AZO-p(VPA-2)-Ti4+萃取后;血清的质谱图:(c)直接分析;(d)经过CF-NH2-AZO-p(VPA-2)-Ti4+萃取后。
图6鼠脑裂解液中磷酸化多肽的分析情况。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
【实施例1】CF-NH2-AZO-p(VPA-x)的制备
首先制备氨基修饰的棉花,得到CF-NH2;再将自由基引发剂接到CF-NH2上,得到CF-NH2-AZO;然后采用表面引发聚合法在CF-NH2-AZO表面修饰磷酸根,得到CF-NH2-AZO-p(VPA-x),如附图1所示。
其中CF-NH2的制备方法如下:称取0.5g乙二胺四乙酸二酐(EDTAD)于500mL圆底烧瓶中,加入300mL无水N’N-二甲基酰胺(DMF),再加入1.0g脱脂棉。充分混合之后,磁力搅拌条件下130℃反应6h。反应完成后,冷却一段时间,将反应液倒掉,重新加入300mL DMF,再加入0.5mL乙二胺,磁力搅拌条件下70℃反应4h。产物依次用二次水和丙酮清洗,60℃真空干燥4h。
CF-NH2-AZO的制备方法如下:称取0.4g CF-NH2于50mL离心管中,加入40mL无水二氯甲烷,再加入0.2g 4,4’-偶氮二(4-氰戊酰氯)(ACVC)和0.1mL三乙胺,25℃反应5h。产物依次用二氯甲烷、乙醇、二次水和丙酮清洗,室温干燥过夜。
CF-NH2-AZO-p(VPA-x)的制备方法如下:称取0.25g CF-NH2-AZO于50mL反应釜中,加入25mL甲醇和0.5g乙烯基膦酸(VPA)。密封,65℃反应20h。产物依次用甲醇、水和丙酮清洗,60℃真空干燥,得到的产物作为CF-NH2-AZO-p(VPA-2)(x=2)。此外,其它五种CF-NH2-AZO-p(VPA-x)(x=0,0.5,1,3,4)的制备方法与CF-NH2-AZO-p(VPA-2)类似,只是改变乙烯基膦酸的投料量(x=0,VPA=0;x=0.5,VPA=0.125g;x=1,VPA=0.25g;x=3,VPA=0.75g;x=4,VPA=1g)。
【实施例2】CF-NH2-AZO-p(VPA-x)-Mn+的制备
配制硫酸钛水溶液(0.1M),氧氯化锆水溶液(0.1M),氯化铁水溶液(0.1M)各20mL,分别往这三份溶液里加入0.2g CF-NH2-AZO-p(VPA-2),室温震荡5h。产物依次用乙醇、水和丙酮清洗,60℃真空干燥。
【实施例3】三种CF-NH2-AZO-p(VPA-2)-Mn+(Mn+=Ti4+,Zr4+,Fe3+)分别应用于β-酪蛋白酶解液中磷酸化多肽的选择性富集
将β-酪蛋白用100mM Tris-HCl(pH 8.5)配制成1mg/mL的溶液。在上述溶液中按照酶与底物比为1:50(w/w)的比例加入胰蛋白酶,并在37℃反应16h。酶解后的多肽产物经真空离心浓缩仪抽干后存放在-20℃的冰箱中备用。
准确称取5mg CF-NH2-AZO-p(VPA-2)-Mn+于1-mL一次性注射器针头中进行萃取。用已经平衡好的CF-NH2-AZO-p(VPA-2)-Mn+反复萃取100μL含有多肽的混合液(3%TFA-50%ACN(v/v))。经过上样液清洗两遍之后,材料上的分析物用100μL解吸液(2.5%NH3·H2O)解吸到离心管中。解吸液经真空离心浓缩仪抽干后,加入1.2μL基质溶液(20mg/mL 2,5-DHB于50%ACN,1%H3PO4的水溶液中)溶解多肽,全部样品点在MALDI靶上用于MALDI-TOF MS分析。所有的质谱分析都采用日本Shimadzu公司的AximaTOF2型基质辅助激光解吸电离-飞行时间质谱仪(MALDI-TOF MS)。MALDI MS分析时采用波长为337nm的氮气激光器,其脉冲宽度为3ns;采用20kV的加速电压,在正离子反射模式下进行检测。每张谱图是200次激光扫描的平均结果。
检测结果如附图2所示:当β-酪蛋白酶解物未经富集直接经MALDI MS分析时,虽然可以检测到3个磷酸化多肽的信号峰,但是谱图中存在大量非磷酸化多肽的峰,并且所能检测到的磷酸化多肽的峰很弱(图2a)。经过三种CF-NH2-AZO-p(VPA-2)-Mn+分别处理之后,解吸液中均可以检测到7个磷酸化多肽的信号峰(图2b,2c,2d),而绝大多数非磷酸化多肽的信号被有效地消除,表明这三种CF-NH2-AZO-p(VPA-2)-Mn+对磷酸化多肽都具有很好的萃取选择性。其中,所能检测到的磷酸化多肽的信息如附表1所示。
【实施例4】比较CF-NH2-AZO-p(VPA-x)-Ti4+在β-酪蛋白和BSA酶解混合液中对磷酸化多肽的萃取效果
为了比较6种不同磷含量的CF-NH2-AZO-p(VPA-x)-Ti4+(x=0,0.5,1,2,3,4)对磷酸化肽段的富集能力,将磷酸化蛋白(β-酪蛋白)与非磷酸蛋白(BSA)酶解产物的混合物作为分析物(β-酪蛋白:BSA=1:100)。
称取1mg BSA溶于100μL含8M尿素及100mM Tris-HCl的变性缓冲液(pH 8.5)中。在上述溶液中加入5μL 100mM三(2-甲酰乙基)膦盐酸盐(三羧甲基磷酸,TCEP),并在室温下反应20min以还原蛋白质中的二硫键。继续往上述溶液中加入5μL 100mM碘乙酰胺(IAA),并在避光条件下,室温下反应30min使被还原的巯基烷基化。经还原及烷基化的蛋白质用300μL 100mM Tris-HCl(pH 8.5)稀释后,按照酶与底物比为1:50(w/w)的比例加入胰蛋白酶,并在37℃反应16h。酶解后的多肽产物抽干后存放在-20℃的冰箱中备用。
准确称取5mg CF-NH2-AZO-p(VPA-x)-Ti4+于1-mL一次性注射器针头中进行萃取。用已经平衡好的CF-NH2-AZO-p(VPA-2)-Ti4+反复萃取100μL含有多肽的混合液(3%TFA-50%ACN(v/v))。经过上样液清洗两遍之后,材料上的分析物用100μL解吸液(2.5%NH3·H2O)解吸到离心管中。解吸液经真空离心浓缩仪旋干后,加入1.2μL基质溶液(20mg/mL 2,5-DHB于50%ACN,1%H3PO4的水溶液中)溶解多肽,全部样品点在MALDI靶上用于MALDI-TOF MS分析。检测结果如附图3所示:所有这六种材料对磷酸化多肽均表现出一定的选择性,从质谱图中磷酸化多肽个数和杂峰情况来看,CF-NH2-AZO-p(VPA-2)-Ti4+表现得最好(图3)。推测的原因是,当磷酸根配体含量太少时,材料固载金属离子的能力有限,从而限制其对磷酸化多肽的萃取能力;当磷酸根配体数量太多时,过多的磷酸根配体占据着金属离子的空轨道,从而削弱了金属离子对磷酸化多肽的萃取能力。
【实施例5】CF-NH2-AZO-p(VPA-2)-Ti4+应用于更复杂的β-酪蛋白和BSA酶解混合液中磷酸化多肽的萃取
为了进一步评价CF-NH2-AZO-p(VPA-2)-Ti4+对磷酸化多肽的萃取能力,我们继续提高磷酸化蛋白(β-酪蛋白)与非磷酸蛋白(BSA)酶解产物的混合物中BSA的比例。
准确称取5mg CF-NH2-AZO-p(VPA-x)-Ti4+于1-mL一次性注射器针头中进行萃取。用已经平衡好的CF-NH2-AZO-p(VPA-2)-Ti4+反复萃取100μL含有多肽的混合液(3%TFA-50%ACN(v/v))。经过上样液清洗两遍之后,材料上的分析物用100μL解吸液(2.5%NH3·H2O)解吸到离心管中。解吸液经真空离心浓缩仪旋干,加入1.2μL基质溶液(20mg/mL 2,5-DHB于50%ACN,1%H3PO4的水溶液中)溶解多肽,全部样品点在MALDI靶上用于MALDI-TOF MS分析。
检测结果如附图4所示:当β-酪蛋白酶解物和BSA酶解物的比例为1:1000时,在未经过前处理的谱图中只能看到大量的非磷酸化肽信号(图4a);经过CF-NH2-AZO-p(VPA-2)-Ti4+处理之后,谱图中可以看到6个磷酸化肽的峰,而且大量的非磷酸化肽信号被去除(图4b),说明CF-NH2-AZO-p(VPA-2)-Ti4+对磷酸化肽有极好的选择性。
【实施例6】CF-NH2-AZO-p(VPA-2)-Ti4+应用于脱脂牛奶酶解物中磷酸化多肽的选择性富集
脱脂牛奶购买自武汉大学某超市。牛奶的酶解过程如下:取100μL低脂牛奶经真空离心浓缩仪抽干后复溶于100μL含8M尿素及100mM Tirs-HCl的变性缓冲液(pH 8.5)中。上述溶液经10mM二硫苏糖醇(DTT)于37℃下反应30min以还原蛋白质中的二硫键,之后在20mM碘乙酰胺(IAA)中于避光条件下,室温下反应30min使被还原的巯基烷基化。经还原及烷基化的蛋白质用300μL 100mM Tris-HCl(pH 8.5)稀释后,按照酶与底物比为1:50(w/w)的比例加入胰蛋白酶,并在37℃反应16h。所有的酶解物保存在-20℃冰箱中备用。酶解后的多肽样品稀释500倍后用于材料的选择性评价。
称取5mg CF-NH2-AZO-p(VPA-x)-Ti4+于1-mL一次性注射器针头中进行萃取。萃取磷酸化多肽时,牛奶酶解物用上样液稀释500倍再进行萃取。上样液和解吸液分别为100μL 3%TFA-50%ACN(v/v)和2.5%氨水水溶液。萃取完成之后,解吸液进行冷冻旋干,1.2μL基质溶液(20mg/mL 2,5-DHB in 50%(v/v)ACN,1%(v/v)H3PO4)溶解多肽,全部样品点在MALDI靶上用于MALDI-TOF MS分析。
检测结果如附图5所示:牛奶酶解物未经过材料处理直接进样时,质谱图中只能看到6个磷酸化多肽以及大量的非磷酸化肽(图5a);经过材料处理之后,质谱图中清晰的呈现着25个磷酸化多肽(图5b,附表2),表明材料可用于实际样品分析。
【实施例7】CF-NH2-AZO-p(VPA-2)-Ti4+应用于血清中内源性磷酸化多肽的富集
正常人的血清样品通过标准的临床渠道从武汉大学校医院获得,采集到的血清保存在-20℃冰箱中。
准确称取5mg CF-NH2-AZO-p(VPA-x)-Ti4+于1-mL一次性注射器针头中进行萃取。萃取磷酸化多肽时,血清(2μL)需要用上样液稀释50倍再进行萃取。上样液和解吸液分别为100μL 3%TFA-50%ACN(v/v)和2.5%氨水水溶液。萃取完成之后,解吸液进行冷冻旋干,1.2μL基质溶液(20mg/mL 2,5-DHB in 50%(v/v)ACN,1%(v/v)H3PO4)溶解多肽,全部样品点在MALDI靶上用于MALDI-TOF MS分析。
检测结果如附图5所示:血清未经过材料处理直接进样时,质谱图中只能非磷酸多肽的信号(图5c);经过材料处理之后,质谱图中清晰的呈现着4个磷酸化多肽,而且几乎看不到非磷酸化肽的信号(图5d,附表3),表明材料适用于高蛋白生物样品的分析。
【实施例8】CF-NH2-AZO-p(VPA-2)-Ti4+应用于鼠脑裂解液中磷酸化多肽的富集
斯普拉格(SD)雌性大鼠由湖北省疾控中心提供,年龄3~4个月,体重250~300g。鼠脑被取下后,清洗干净,切碎。取0.5g鼠脑组织,用匀浆管研碎,加入1mL RIPA裂解液(含磷酸酶抑制剂和蛋白酶抑制剂)。在冰浴中裂解30分钟后,于4℃下12000rpm离心30min,收集上清液。利用BCA方法对上述上清液中的蛋白进行定量。往上述上清液中加入3体积的丙酮/乙醇/乙酸混合液(50/50/0.1,v/v/v)进行蛋白沉淀。之后4℃下4000rpm离心30min;去除上清液后,得到蛋白质,在空气中晾干。蛋白质用含8M尿素和0.2M Tris,4mM CaCl2的溶液复溶后同上述步骤进行酶解。酶解后的多肽产物经C18脱盐并抽干后存放在-20℃的冰箱中备用。
准确称取10mg CF-NH2-AZO-p(VPA-x)-Ti4+于1-mL一次性注射器针头中进行萃取。萃取鼠脑裂解液样品时,鼠脑蛋白的用量为0.5mg。上样液和解吸液分别为100μL 3%TFA-50%ACN(v/v)和2.5%氨水水溶液。解吸液经真空离心浓缩仪抽干后,用C18SPE脱盐,然后用反相液相色谱-电喷雾串联质谱(LC-ESI-MS/MS)分析。
经富集后的细胞裂解物酶解产物采用nanoRPLC-ESI-MS/MS(TripleTOF 5600+,ABSciex)进行质谱分析。多肽首先被结合到CapTrap柱(5μm,5×0.3mm,Agilent Technologies)上,然后被洗脱到反相C18分析柱(75μm×150mm,3μmparticle size,poresize,Eksigent)上。液相色谱的流动相分别为溶液A(3%DMSO,97%H2O,0.1%甲酸)和溶液B(3%DMSO,97%ACN,0.1%甲酸),其梯度设置如表3-1所示,流速为300nL/min。一级质谱扫描范围从400到1800amu,250ms累积时间。每个完整的一级质谱扫描包括40次二级质谱分析,扫描范围从350到1500amu,离子的带电量为+2到+5价。二级质谱分析阀值设为120,18秒内排除相同质荷比离子。
检测结果如图6所示:该方法在0.5mg鼠脑裂解液中共检测到3241个磷酸化多肽,其中单磷酸化多肽有2975个,多磷酸化多肽有266个,对磷酸化多肽的特异性为86.6%(图6)。此外,该方法共鉴定到3760个磷酸化位点。结果表明该材料在复杂生物样品的分析中表现良好,有望用于磷酸化蛋白组的全分析。
表1β-酪蛋白酶解液中鉴定到的磷酸化多肽的详情
“_”表示磷酸化位点
表2脱脂牛奶酶解液中鉴定到的磷酸化多肽的详情
“_”表示磷酸化位点;[Mo]表示蛋氨酸的氧化位点。
表3人类血清中鉴定到的磷酸化多肽的详情
“_”表示磷酸化位点。
- 还没有人留言评论。精彩留言会获得点赞!