单氟代环丙烷类化合物及其制备方法和应用与流程
本发明涉及环丙烷类化合物,特别涉及一种单氟代环丙烷类化合物及其制备方法和应用。
背景技术:
由于其特殊的成键,环丙烷结构是很多生物活性分子的重要结构单元。很多上市的药物分子具有环丙烷结构,例如Odanacatib(组织蛋白酶K抑制剂),Singulair(抗哮喘药物)和Ciprofloxacin(广谱抗生素)(H.W.Liu,C.T.Walsh,BiochemistryoftheCyclopropylGroup.InTheChemistryoftheCyclopropylGroup;Rappoport,Z.,Ed.;Wiley:NewYork,1987,p959;J.Salaün,Top.Curr.Chem.2000,207,1.等)。氟原子作为电负性最大的元素,具有较小的原子半径(接近氢原子的原子半径)。像药物分子中引入氟原子可以在最小的改变空间影响的条件下,提高其新陈代谢稳定性,膜渗透性(H.J.D.Banner,S.Bendels,M.Kansy,B.Kuhn,K.Müller,U.Obst-Sander,M.Stahl,ChemBioChem.2004,5,637;M.Sani,A.Volonterio,M.Zanda,ChemMedChem2007,2,1693;S.Purser,P.R.Moore,S.Swallow,V.Gouverneur,Chem.Soc.Rev.2008,37,320;C.,R.Mathys,L.A.Hardegger,S.Meyer,D.Bur,F.Diederich,Eur.J.Org.Chem.2010,24,4617.等)。目前合成单氟代环丙烷类化合物的方法主要有以下几种:(1)使用含氟重氮环丙烷类化合物与普通烯烃的反应(Dailey,W.P.TetrahedronLett.1987,25,580);(2)重氮羧酸酯与单氟烯烃的反应(Meyer,O.G.J.;Frohlich,R.;Haufe,G.Synthesis.2000,10,1497);(3)利用CHFI2与烯烃在Et2Zn(或者Cu/I2)作用下的反应(Tamura,O.;Hashimoto,M.;Kobayashi,Y.;Katoh,T.;Nakatani,K.;Kamada,M.;Hayakawa,I.;Akiba,T.;Terashima,S.TetrahedronLett.1992,33,3483;Kamada,M.;Hayakawa,I.;Akiba,T.;Tera-jima,A.;Tamura,O.;Kobayashi,J.;Hashimoto,M.;Katoh,T.;Nakatani,K.JapanesePatent04327568,1992);(4)含氟汞试剂与普通烯烃的反应(Seyferth,D.;Woodruff,R,A.J.Org.Chem.1973,38,4031);(5)其他含氟环丙烷化合物之间相互转换的反应(Johnson,W.M.P.;Holan,G.;Tarvis,K,EAust.J.Chem.1986,39,271)。上述合成单氟代环丙烷类化合物的方法适用范围较窄,且部分方法产率较低,使用的试剂毒性较大,不易工业化生产。目前,合成光学活性的单氟代环丙烷了化合物的方法有:(1)单氟类卡宾对含手性辅基的烯烃的环丙烷化(O.Tamura,M.Hashimoto,Y.Kobayashi,T.Katoh,K.Nakatani,M.Kamada,I.Hayakawa,T.Akiba,S.Terashima,TetrahedronLett.1992,33,3487);(2)对氟代环丙烷取代羧酸的酶拆分。其中,方法(1)的对映选择性和非对映选择性较差,方法(2)转化率低,底物普适性差。因此,本领域尚需提供一种新型的合成单氟代环丙烷类化合物的方法,原料毒性低,底物普适性好,且不仅能制备得到消旋化合物,且能得到非消旋的化合物。
技术实现要素:
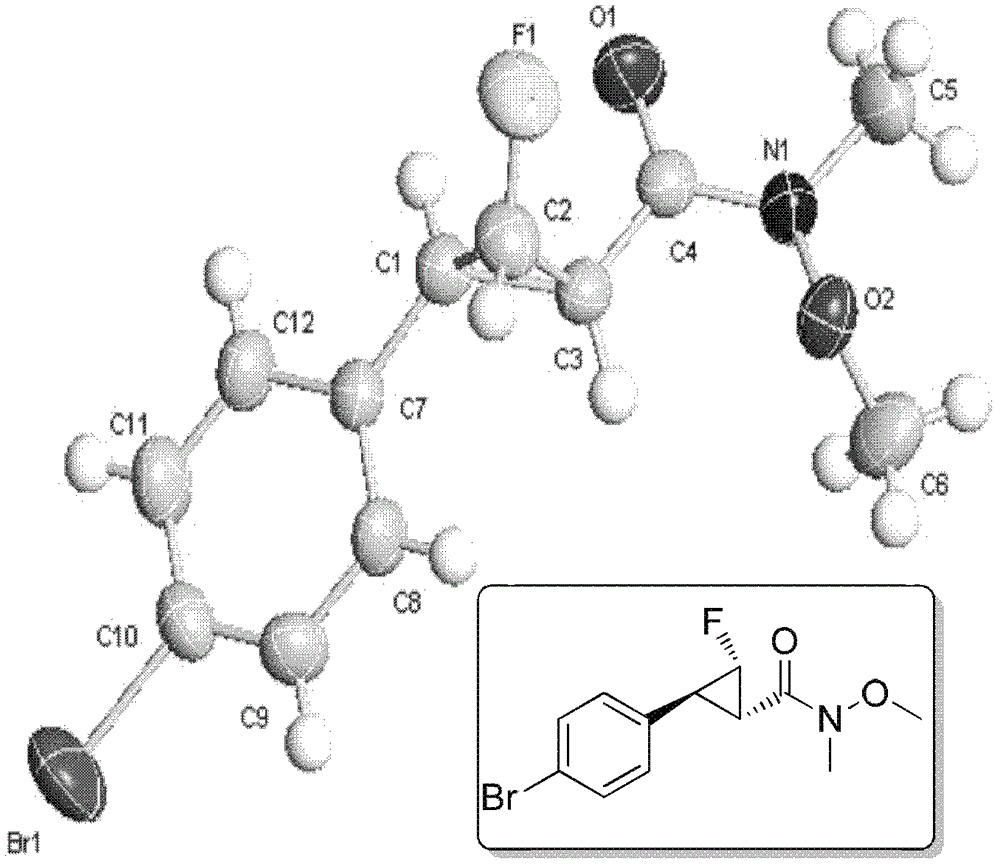
本发明的目的在于提供一种新型的单氟代环丙烷类化合物及其制备方法,原料毒性低,底物普适性好,且不仅能制备得到消旋化合物,且能得到非消旋的化合物。本发明的第一方面,提供一种式I化合物,式中,Ra为取代或未取代的C1-30烷基、取代或未取代的C1-30烷氧基、取代或未取代的C6-14芳基、取代或未取代的C4-14杂芳基、或胺基;所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:卤素、C1-10烷基、C1-10烷氧基、或胺基;R1和R2独立地选自:氢、C1-30烷基、C6-14芳基、C4-14杂芳基、C2-30烯基、C3-30炔基或卤素;表示R构型或者S构型。在另一优选例中,所述胺基为-NR10R11或-NR10OR11,式中,R10和R11独立地选自C1-6烷基或C1-6卤代烷基。在另一优选例中,Ra为取代或未取代的C1-10烷基、取代或未取代的C1-6烷氧基、取代或未取代的C6-14芳基、、取代或未取代的C4-14杂芳基或胺基;较佳地,Ra为取代或未取代的C1-6烷基、取代或未取代的C1-6烷氧基、取代或未取代的C6-14芳基、或胺基。在另一优选例中,所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:卤素、C1-6烷基、C1-6烷氧基、或胺基。在另一优选例中,Ra为取代或未取代的C1-6烷基、取代或未取代的C1-6烷氧基、取代或未取代的C6-14芳基、、取代或未取代的C4-14杂芳基或胺基;且所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:卤素、C1-4烷基、C1-4烷氧基、或胺基。在另一优选例中,R1和R2独立地选自:氢、C1-10烷基、C6-14芳基、C4-14杂芳基、C2-10烯基、C3-10炔基;较佳地,R1和R2独立地选自:氢、C1-6烷基、C6-14芳基、C4-14杂芳基、C2-10烯基、C3-10炔基。在另一优选例中,所述化合物为式Ia化合物、式Ib化合物、式Ic化合物、式Id化合物、式Ie化合物、式If化合物、式Ig化合物、或式Ih化合物,结构如下:各式中,Ra、R1和R2的定义如上所述。在另一优选例中,所述式I化合物为式I-1化合物:式中,R1、R2和的定义如上所述。在另一优选例中,所述化合物为式Ia-1化合物:式中,R1和R2的定义如上所述。本发明的第二方面,提供第一方面所述的式I化合物的制备方法,包括步骤:(a1)式IV化合物与氟化试剂反应,得到式II化合物;或(a2)式VI化合物与烷基化试剂反应,得到式II化合物;(b)在有机溶剂中以及碱存在下,式III化合物与式II化合物反应,形成所述式I化合物,各式中,R1、R2、Ra、的定义如第一方面所述;Rb选自取代或未取代的C1-30烷基、取代或未取代的C1-30烷氧基、取代或未取代的C3-10环烷基、取代或未取代的C6-14芳基、取代或未取代的C4-14杂芳基,其中所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:卤素、C1-4烷基、硝基、氰基;R4为硝基、氰基、脂基、取代或未取代的苯甲酰基、取代或未取代的C1-10的烷基磺酰基、取代或未取代的苯磺酰基,所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:C1-10烷基、卤素、C1-4烷氧基。在另一优选例中,所述Rb选自取代或未取代的C1-10烷基、取代或未取代的C1-10烷氧基、取代或未取代的C3-10环烷基、取代或未取代的C6-14芳基、取代或未取代的C4-14杂芳基。较佳地,所述Rb选自取代或未取代的C1-6烷基、取代或未取代的C1-4烷氧基、取代或未取代的C3-6环烷基、取代或未取代的C6-14芳基、取代或未取代的C4-14杂芳基。在另一优选例中,R4为硝基、氰基、脂基、取代或未取代的苯甲酰基、三氟甲磺基、苯磺酰基,取代的苯磺酰基,所述取代是指苯环上具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:C1-4烷基、卤素、C1-4烷氧基。在另一优选例中,所述氟化试剂包括但不限于:NFSI氟化剂、Selectfluor氟试剂、NFTh氟化剂、NFOBS氟化剂、氮-氟代吡啶盐类氟化剂、或F2。在另一优选例中,所述烷基化试剂为C1-30的卤代烷烃、C1-30的磺酸酯、C1-30的碳酸酯或C1-30的磷酸酯;较佳地,所述烷基化试剂为C1-10的卤代烷烃、C1-10的磺酸酯、C1-10的碳酸酯或C1-10的磷酸酯,更佳地,为C1-6的卤代烷烃、C1-6的磺酸酯、C1-6的碳酸酯或C1-6的磷酸酯。在另一优选例中,所述步骤(a1)中,式IV化合物与氟化试剂在有机溶剂中,在碱存在下,于-78℃~60℃(较佳地,-78℃~25℃)反应1-96小时(较佳地1-12小时),从而制得式II化合物。在另一优选例中,所述步骤(a2)中,式VI化合物与烷基化试剂在有机溶剂中,在碱存在下,于-78℃~60℃(较佳地,-78℃~25℃)反应1-96小时(较佳地1-12小时),从而制得式II化合物。在另一优选例中,所述步骤(a1)或所述步骤(a2)使用的碱为C1-C4的烷基锂、胺基锂、NaH、KH、或其组合。在另一优选例中,所述步骤(a1)或所述步骤(a2)使用的有机溶剂为四氢呋喃、二甲基甲酰胺、六甲基磷酰胺、乙二醇二甲醚、乙醚、或其混合物。在另一优选例中,所述式IV化合物为R构型(基于S原子)式IV化合物或S构型(基于S原子)式IV化合物。在另一优选例中,所述式VI化合物为R构型(基于S原子)式VI化合物或S构型(基于S原子)式VI化合物。在另一优选例中,所述式IV化合物、所述碱、所述氟化试剂的摩尔比为1∶0.1~5∶0.1~5,较佳地为1∶0.5~2.5∶0.5~2.5,更佳地为1∶1~1.2∶1~1.2。在另一优选例中,所述式VI化合物、所述碱、所述烷基化试剂的摩尔比为1∶0.1~5∶0.1~10,较佳地为1∶0.5~2.5∶0.5~5,更佳地为1∶1~1.2∶1~3。在另一优选例中,所述步骤(b)中,式III化合物与式II化合物于-78℃~60℃(较佳地,-78℃~25℃)反应0.5-72小时(较佳地0.5-5小时),得到所述式I化合物。在另一优选例中,所述步骤(b)中,所述有机溶剂选自:四氢呋喃THF、甲苯PhCH3、二氯甲烷CH2Cl2、六甲基磷酸三胺HMPA、乙二醇二甲醚DME、乙醚Et2O、二甲基甲酰胺DMF、二甲基亚砜DMSO、乙腈CH3CN或其混合物;和/或所述碱为C1-C4的烷基锂,胺基锂,胺基钠,胺基钾,C1-C4的醇钾,C1-C4的醇钠,C1-C4的醇锂,氢化钠或其组合。在另一优选例中,所述步骤(b)中,所述式II化合物、所述碱、所述式III化合物的摩尔比为1∶0.1~5∶0.1~5。在另一优选例中,所述式II化合物、所述碱、所述式III化合物的摩尔比为1∶0.5~3∶0.5~2.5,较佳地,所述式II化合物、所述碱、所述式III化合物的摩尔比为1∶1~1.8~1~1.5。本发明的第三方面,提供一种式II化合物,式中,R2选自:氢、C1-30烷基、C6-14芳基、C4-14杂芳基、C2-30烯基、C3-30炔基;Rb选自取代或未取代的C1-30烷基、取代或未取代的C1-30烷氧基、取代或未取代的C3-10环烷基、取代或未取代的C6-14芳基,其中所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:卤素、C1-4烷基、硝基、氰基;R4为硝基、氰基、脂基、取代或未取代的苯甲酰基、取代或未取代的C1-10的烷基磺酰基、取代或未取代的苯磺酰基,所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:C1-10烷基、卤素、C1-4烷氧基。在另一优选例中,所述式II化合物为R构型(基于S原子)式II化合物或S构型(基于S原子)式II化合物。在另一优选例中,R2选自:氢、C1-10烷基、C6-14芳基、C4-14杂芳基、C2-10烯基、C3-10炔基;较佳地,R2选自:氢、C1-6烷基、C6-14芳基、C4-14杂芳基、C2-10烯基、C3-10炔基。在另一优选例中,所述Rb选自取代或未取代的C1-10烷基、取代或未取代的C1-10烷氧基、取代或未取代的C3-10环烷基、取代或未取代的C6-14芳基;较佳地,所述Rb选自取代或未取代的C1-6烷基、取代或未取代的C1-4烷氧基、取代或未取代的C3-6环烷基、取代或未取代的C6-14芳基。在另一优选例中,R4为硝基、氰基、脂基、苯甲酰基、三氟甲磺基、苯磺酰基,取代的苯磺酰基,所述取代是指苯环上具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:C1-4烷基、卤素、C1-4烷氧基。本发明的第四方面,提供第三方面所述的式II化合物的制备方法,包括步骤:(a1)式IV化合物与氟化试剂反应,得到式II化合物;或(a2)式VI化合物与烷基化试剂反应,得到式II化合物;各式中,R2、R4、Rb的定义如上所述。在另一优选例中,所述氟化试剂选自下组:NFSI氟化剂、Selectfluor氟试剂、NFTh氟化剂、NFOBS氟化剂、氮-氟代吡啶盐类氟化剂、或F2;和/或所述烷基化试剂为C1-30的卤代烷烃、C1-30的磺酸酯、C1-30的碳酸酯或C1-30的磷酸酯。在另一优选例中,所述步骤(a1)中,式IV化合物与氟化试剂在有机溶剂中,在碱存在下,于-78℃~60℃(较佳地,-78℃~25℃)反应1-96小时(较佳地1-12小时),从而制得式II化合物。在另一优选例中,所述步骤(a2)中,式VI化合物与烷基化试剂在有机溶剂中,在碱存在下,于-78℃~60℃(较佳地,-78℃~25℃)反应1-96小时(较佳地1-12小时),从而制得式II化合物。在另一优选例中,所述步骤(a1)或所述步骤(a2)使用的碱为C1-C4的烷基锂,胺基锂,胺基钠,胺基钾,C1-C4的醇钾,C1-C4的醇钠,C1-C4的醇锂,氢化钠或其组合。在另一优选例中,所述步骤(a1)或所述步骤(a2)使用的有机溶剂为四氢呋喃THF、甲苯PhCH3、二氯甲烷CH2Cl2、六甲基磷酸三胺HMPA、乙二醇二甲醚DME、乙醚Et2O、二甲基甲酰胺DMF、二甲基亚砜DMSO、乙腈CH3CN或其混合物在另一优选例中,所述式IV化合物为R构型(基于S原子)式IV化合物或S构型(基于S原子)式IV化合物。在另一优选例中,所述式VI化合物为R构型(基于S原子)式VI化合物或S构型(基于S原子)式VI化合物。在另一优选例中,所述式IV化合物、所述碱、所述氟化试剂的摩尔比为1∶0.1~5∶0.1~5,较佳地为1∶0.5~2.5∶0.5~2.5,更佳地为1∶1~1.2∶1~1.2。在另一优选例中,所述式VI化合物、所述碱、所述烷基化试剂的摩尔比为1∶0.1~5∶0.1~10,较佳地为1∶0.5~2.5∶0.5~5,更佳地为1∶1~1.2∶1~3。本发明的第五方面,提供式I化合物的用途,用于制备式VIII单氟化环丙烷衍生物,所述单氟化环丙烷衍生物的结构为:式中,R1和R2独立地选自:氢、C1-30烷基、C6-14芳基、C4-14杂芳基、C2-30烯基、C3-30炔基;Rd为氢、取代或未取代的C1-30烷基、取代或未取代的C1-30烷氧基、取代或未取代的C6-14芳基、取代或未取代的C4-14杂芳基或胺基;所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:卤素、C1-10烷基、C1-10烷氧基、或胺基;为双键或单键,而Rc为H或无;表示R构型或者S构型;附加条件是Rd与Ra不同。在另一优选例中,R1和R2独立地选自:氢、C1-10烷基、C6-14芳基、C4-14杂芳基、C2-10烯基、C3-10炔基;较佳地,R1和R2独立地选自:氢、C1-6烷基、C6-14芳基、C4-14杂芳基、C2-10烯基、C3-10炔基。在另一优选例中,Rd为氢、取代或未取代的C1-10烷基、取代或未取代的C1-10烷氧基、取代或未取代的C6-14芳基、或胺基。在另一优选例中,所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:卤素、C1-6烷基、C1-6烷氧基、或胺基。在另一优选例中,Rd为取代或未取代的C1-6烷基、取代或未取代的C1-6烷氧基、取代或未取代的C6-14芳基、取代或未取代的C4-14杂芳基或胺基;且所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:卤素、C1-4烷基、C1-4烷氧基、或胺基。本发明的第六方面,提供一种单氟化环丙烷衍生物,所述单氟化环丙烷衍生物的结构为:式中,R1和R2独立地选自:氢、C1-30烷基、C6-14芳基、C4-14杂芳基、C2-30烯基、C3-30炔基;为双键或单键;Rc为H或无;Rd为H;表示R构型或者S构型。本发明的第七方面,提供一种单氟化环丙烷衍生物的制备方法,包括步骤:式中,R1、R2、Ra、的定义如上所述。在还原剂的作用下,在有机溶剂中,还原式I化合物(消旋化合物或非消旋(包括光学纯)化合物),从而得到式XI所示的单氟代环丙烷衍生物(消旋化合物或非消旋(包括光学纯)化合物)。在另一优选例中,反应条件是-78℃~60℃(较佳地,-78℃~25℃)的条件下,反应1-72小时(较佳地0.5~5小时)。所述的还原剂包含但不限于:氢化铝锂LiAlH4、二异丁基铝氢DIBAL-H、硼氢化钠、三乙氧基硼氢化钠或其混合物。所述的有机溶剂为四氢呋喃THF、甲苯PhCH3、二氯甲烷CH2Cl2、六甲基磷酸三胺HMPA、乙二醇二甲醚DME、乙醚Et2O、二甲基甲酰胺DMF、二甲基亚砜DMSO、乙腈CH3CN或其混合物。式I化合物与还原剂的摩尔比为1∶1~10,较佳地为1∶1.5~8,更佳地为1∶2~5。在另一优选例中,所述单氟化环丙烷衍生物的制备方法还包括步骤:式中,R1、R2、的定义如上所述。在还原剂的作用下,在有机溶剂中,还原式XI化合物(消旋化合物或非消旋(包括光学纯)化合物),形成式XII所示的单氟化环丙烷类化合物(消旋化合物或非消旋(包括光学纯)化合物)。在另一优选例中,反应条件是-78℃~60℃(较佳地,-78℃~25℃)的条件下,反应1-72小时(较佳地0.5~5小时)。所述的还原剂包含但不限于:氢化铝锂LiAlH4、二异丁基铝氢DIBAL-H、硼氢化钠、三乙氧基硼氢化钠或其混合物。所述的有机溶剂为四氢呋喃THF、甲苯PhCH3、二氯甲烷CH2Cl2、六甲基磷酸三胺HMPA、乙二醇二甲醚DME、乙醚Et2O、二甲基甲酰胺DMF、二甲基亚砜DMSO、乙腈CH3CN或其混合物。醛基取代的单氟代环丙烷衍生物(消旋化合物或非消旋(包括光学纯)化合物)与还原剂的摩尔比为1∶1~10,较佳地为1∶1.5~8,更佳地为1∶2~5。在另一优选例中,所述单氟化环丙烷衍生物的制备方法包括步骤:式中,R1、R2、Ra、Rd、Rc、的定义如上所述。在有机溶剂中,式I化合物产物(消旋化合物或非消旋(包括光学纯)化合物)与RdLi、RdMgBr,Rd2Mg,Rd2CuLi,或RdSiR11R12R13反应,从而得到酮羰基取代的单氟化环丙烷类化合物(消旋化合物或非消旋(包括光学纯)化合物);Rd为取代或未取代的C1-30烷基、取代或未取代的C6-14芳基、或胺基;所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:卤素、C1-10烷基、C1-10烷氧基、或胺基;附加条件是Rd与Ra不同。在另一优选例中,反应条件为-78℃~60℃(较佳地-78℃~25℃)的条件下,反应反应1-72小时(较佳地0.5~5小时)。在另一优选例中,R11、R12、R13独立地选自取代或未取代的C1-6烷基、取代或未取代的C6-14芳基、或胺基;所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:卤素、C1-4烷基、C1-6烷氧基、或胺基;所述的溶剂为四氢呋喃THF、甲苯PhCH3、二氯甲烷CH2Cl2、六甲基磷酸三胺HMPA、乙二醇二甲醚DME、乙醚Et2O、二甲基甲酰胺DMF,二甲基亚砜DMSO,乙腈CH3CN或其混合物。式I化合物与RdLi、RdMgBr,Rd2Mg,Rd2CuLi,或RdSiR11R12R13的摩尔比为1∶0.05~10,较佳地为1∶0.1~5,更佳地为1∶0.5~2。以上各方面中所述C6-14芳基优选为苯基、奈基、芘基、蒽基或菲基。所述C4-14杂芳基优选为呋喃基、亚呋喃基、芴基、吡咯基、噻吩基、噁唑基、咪唑基、噻唑基、吡啶基、嘧啶基、喹唑啉基、喹啉基、异喹啉基或吲哚基。本发明提供了一种新型结构的单氟代环丙烷类化合物及其制备方法。本发明的合成方法简单有效;原料毒性低,底物普适性好,易于合成制备;得到的目标化合物纯度高,适于工业化生产。且本发明不仅能制备消旋的产物,也可以制备非消旋(包括光学纯)的化合物。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1为化合物[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺((R)-N-Tosyl-S-monofluoromethyl-S-phenylsulfoximine)的X-ray单晶衍射结构。图2为化合物(1S,2S,3S)-2-(4-溴苯基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-(4-bromophenyl)-3-fluoro-N-methoxy-N-methylcyclopropanecarboxamide的X-ray单晶衍射结构。具体实施方式本申请的发明人经过广泛而深入地研究,发现采用非消旋(包括光学纯)的亚砜亚胺试剂可制备得到非消旋(包括光学纯)的单氟化亚砜亚胺试剂,且采用单氟化亚砜亚胺试剂可进一步合成单氟代环丙烷类化合物,且不仅能够得到非消旋(包括光学纯)的单氟代环丙烷类化合物,而且能够得到消旋的单氟代环丙烷类化合物,且操作简便,原料毒性低,易于合成制备,底物普适性好,得到的目标化合物纯度高。在此基础上,完成了本发明。术语氟化试剂(氟化剂)如本文所用,氟化试剂(氟化剂)与式IV化合物反应,生成相应的含氟的式II化合物。本发明中,氟化试剂(氟化剂)可以采用本领域惯常使用的氟化试剂(氟化剂),包括但不限于:NFSI氟化剂(N-氟代双苯磺酰亚胺)、Selectfluor氟试剂(1-氯甲基-4-氟-1,4-二氮双环[2.2.2.]辛烷双氟硼酸盐)、NFTh氟化剂(1-氟-4-羟基-1,4-重氮化二环2.2.2辛烷双(四氟硼酸盐))、NFOBS氟化剂(邻苯磺酰氟化胺)、氮-氟代吡啶盐类氟化剂(参见化学试剂,2004,26(4),211-213)、或氟气F2。式I化合物本发明的式I化合物,结构为:式中,Ra、R1和R2以及的定义如前所述。在另一优选例中,所述化合物为式Ia化合物、式Ib化合物、式Ic化合物、式Id化合物、式Ie化合物、式If化合物、式Ig化合物、或式Ih化合物,结构如下:各式中,Ra、R1和R2的定义如上所述。在另一优选例中,所述式I化合物为式I-1化合物:式中,R1和R2以及的定义如上所述。在另一优选例中,所述化合物为式Ia-1化合物:式中,R1和R2的定义如上所述。式I化合物的制备方法本发明提供的式I化合物的制备方法,包括步骤:(a1)式IV化合物与氟化试剂反应,得到式II化合物;或(a2)式VI化合物与烷基化试剂反应,得到式II化合物;(b)在有机溶剂中以及碱存在下,式III化合物与式II化合物反应,形成所述式I化合物,各式中,R1、R2、Ra、Rb、R4的定义如前所述;在另一优选例中,所述氟化试剂可以采用本领域惯常使用的氟化试剂,例如所述氟化试剂包括但不限于:NFSI氟化剂、Selectfluor氟试剂、NFTh氟化剂、NFOBS氟化剂、氮-氟代吡啶盐类氟化剂、或氟气(F2)。在另一优选例中,所述烷基化试剂为C1-30的卤代烷烃、C1-30的磺酸酯、C1-30的碳酸酯或C1-30的磷酸酯。式I化合物的用途本发明的式I化合物,可以作为原料,用于制备单氟化环丙烷衍生物(式VIII化合物),所述单氟化环丙烷衍生物的结构为:式中,R1和R2独立地选自:氢、C1-30烷基、C6-14芳基、C4-14杂芳基、C2-30烯基、C3-30炔基;Rd为氢、取代或未取代的C1-30烷基、取代或未取代的C1-30烷氧基、取代或未取代的C6-14芳基、或胺基;所述取代是指具有一个或多个(较佳地,1~6个;更佳地,1-3个)选自下组的取代基:卤素、C1-10烷基、C1-10烷氧基、或胺基;为双键或单键,而Rc为H或无;表示R构型或者S构型;附加条件是Rd与Ra不同。在另一优选例中,当为双键时;Rc为无;Rd为氢。在另一优选例中,当为单键时;Rc为氢;Rd为氢。式II化合物如本文所用,“式II化合物”“如式II所示的化合物”具有相同的含义,均是指具有如下式II所述结构的化合物:式中,R1、R4、Rb、的定义如上所述。式II化合物为S构型(基于S原子)化合物或R构型(基于S原子)化合物。式II化合物的制备方法本发明提供的式II化合物的制备方法,包括步骤:(a1)式IV化合物与氟化试剂反应,得到式II化合物;或(a2)式VI化合物与烷基化试剂反应,得到式II化合物;各式中,R2、R4、Rb的定义如上所述。所述氟化试剂选自下组:NFSI氟化剂、Selectfluor氟试剂、NFTh氟化剂、NFOBS氟化剂、氮-氟代吡啶盐类氟化剂、或F2。所述烷基化试剂为C1-30的卤代烷烃、C1-30的磺酸酯、C1-30的碳酸酯或C1-30的磷酸酯。在另一优选例中,所述步骤(a1)中,式IV化合物与氟化试剂在有机溶剂中,在碱存在下,于-78℃~60℃(较佳地,-78℃~25℃)反应1-96小时(较佳地1-12小时),从而制得式II化合物。在另一优选例中,所述步骤(a2)中,式VI化合物与烷基化试剂在有机溶剂中,在碱存在下,于-78℃~60℃(较佳地,-78℃~25℃)反应1-96小时(较佳地1-12小时),从而制得式II化合物。在另一优选例中,所述步骤(a1)或所述步骤(a2)使用的碱为C1-C4的烷基锂,胺基锂,胺基钠,胺基钾,C1-C4的醇钾,C1-C4的醇钠,C1-C4的醇锂,氢化钠或其组合。在另一优选例中,所述步骤(a1)或所述步骤(a2)使用的有机溶剂为四氢呋喃THF、甲苯PhCH3、二氯甲烷CH2Cl2、六甲基磷酸三胺HMPA、乙二醇二甲醚DME、乙醚Et2O、二甲基甲酰胺DMF、二甲基亚砜DMSO、乙腈CH3CN或其混合物在另一优选例中,所述式IV化合物为R构型(基于S原子)式IV化合物或S构型(基于S原子)式IV化合物。在另一优选例中,所述式VI化合物为R构型(基于S原子)式VI化合物或S构型(基于S原子)式VI化合物。在另一优选例中,所述式IV化合物、所述碱、所述氟化试剂的摩尔比为1∶0.1~5∶0.1~5,较佳地为1∶0.5~2.5∶0.5~2.5,更佳地为1∶1~1.2∶1~1.2。在另一优选例中,所述式VI化合物、所述碱、所述烷基化试剂的摩尔比为1∶0.1~5∶0.1~10,较佳地为1∶0.5~2.5∶0.5~5,更佳地为1∶1~1.2∶1~3。本发明的优点在于:1.本发明提供一种新型结构的单氟代环丙烷类化合物。2.本发明提供一种新型的单氟代环丙烷类化合物的制备方法。3.本发明的合成方法简单有效;原料毒性低,底物普适性好,易于合成制备;得到的目标化合物纯度高,适于工业化生产。4.本发明不仅能制备消旋的产物,也可以制备非消旋(包括光学纯)的化合物。本发明提到的上述特征,或实施例提到的特征可以任意组合。本案说明书所揭示的所有特征可与任何组合物形式并用,说明书中所揭示的各个特征,可以被任何提供相同、均等或相似目的的替代性特征取代。因此除有特别说明,所揭示的特征仅为均等或相似特征的一般性例子。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件或按照制造厂商所建议的条件。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明方法中。文中所述的较佳实施方法与材料仅作示范之用。实施例1[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺((R)-N-Tosyl-S-monofluoromethyl-S-phenylsulfoximine)的合成氮气保护下,250毫升三颈瓶中加入[(S)-N-对甲苯磺酰基]甲基苯基亚砜亚胺9.3克(30mmol)和150毫升干燥的THF,冷却至-78℃,然后滴加正丁基锂nBuLi(1.6M,33mmol,1.1当量equiv),保持-78℃反应半小时后,加入NFSI(12g,1.2equiv)。自然升温至25℃搅拌过夜,后加入H2O淬灭反应,乙醚萃取得到有机层。有机层用饱和食盐水洗涤,加入MgSO4干燥后蒸除溶剂,柱层析得到产物(6.4g,产率65%)。白色固体。熔点:89~91℃。旋光:[α]D24=+49.8°(c=1.00,CHCl3).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30(体积比),0.7mL/min,λ=214nm,tR(major)=46.33min,tR(minor)=50.60min。X-ray单晶衍射结构如图1所示。1H核磁表征(300MHz,CDCl3)δ8.03(d,J=7.8Hz,2H),7.90(d,J=8.3Hz,2H),7.77(t,J=7.4Hz,1H),7.64(t,J=7.7Hz,2H),7.29(d,J=8.0Hz,2H),5.74(dd,J=59.1,9.3Hz,1H),5.58(dd,J=59.6,9.3Hz,1H),2.41(s,3H)。19F核磁表征(282MHz,CDCl3)δ-205.84(t,J=46.7Hz)。13C核磁表征(101MHz,CDCl3)δ143.42(s),140.12(s),135.40(s),133.10(s),129.81(s),129.46(s),129.10(s),126.74(s),92.79(d,J=227.6Hz),21.54(s).红外表征(膜):3089,3027,2958,1915,1596,1451,1320,1252,1151,1062,947,814,760,655,543,447cm-1。质谱表征(ESI,m/z):345.0(M+NH4+).。元素分析表征:理论值C14H14FNO3S2:C,51.36;H,4.31;N,4.28;实验值:C,51.65;H,4.53;N,3.88。实施例2[(R)-N-对甲苯磺酰基]-1-氟乙基苯基亚砜亚胺((R)-N-Tosyl-S-1-fluoroethy-S-phenylsulfoximine)的合成氮气保护下,50毫升三颈瓶中加入[(R)-N-对甲苯磺酰基]氟甲基苯基亚砜亚胺1.96克(6mmol)和30毫升干燥的THF,冷却至-78℃,然后滴加nBuLi(1.6M,6.6mmol,1.1equiv),保持-78℃反应半小时后,加入MeI(2.13g,2.5equiv)。-78℃反应1小时后自然升温至25℃搅拌过夜,后加入H2O淬灭反应,乙醚萃取得到有机层。有机层用饱和食盐水洗涤,加入MgSO4干燥后蒸除溶剂,柱层析得到产物(1.54g,产率75%)。其中一个非对映异构体数据:白色固体。熔点:117-118℃.旋光:[α]D28=+141.7°(c=0.52,CHCl3)。1H核磁共振(300MHz,CDCl3)δ7.99(d,J=7.9Hz,2H),7.86(d,J=8.3Hz,2H),7.76(t,J=7.4Hz,1H),7.63(t,J=7.8Hz,2H),7.27(d,J=7.4Hz,2H),5.97(dq,J=46.7Hz,6.1Hz,1H),2.41(s,3H),1.64(dd,J=23.0,6.3Hz,3H)。19F核磁表征(282MHz,CDCl3)δ-170.22(dt,J=46.1,23.1Hz)。13C核磁表征(101MHz,CDCl3)δ143.14(s),140.48(s),135.21(s),131.57(s),129.90(s),129.61(s),129.37(s),126.64(s),100.83(d,J=224.2Hz),21.53(s),14.32(d,J=20.0Hz)。质谱表征(ESI,m/z):705.2(2M+Na+)。实施例3(1S,2S,3S)-2-苯基-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-phenyl-3-fluoro-N-methoxy-N-methyl-cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),氮-甲基-氮-甲氧基基肉桂酰胺(76mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(六甲基硅基胺基锂0.52mmol),搅拌20min后,撤去冷浴,自然升至室温25℃搅拌3h,加水2mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(80mg,产率90%)。无色液体。旋光:[α]D25=+134.3°(c=0.54,CH2Cl2).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=13.75min,tR(minor)=15.59min。1H核磁表征(300MHz,CDCl3)δ7.27(m,3H),7.13(d,J=7.8Hz,2H),4.91(ddd,J=64.3,7.0,3.2Hz,1H),3.79(s,3H),3.39(ddd,J=22.0,6.9,3.0Hz,1H),3.29(s,3H),(m,1H).19F核磁表征(282MHz,CDCl3)δ-213.2(ddd,J=64.2,21.7,4.7Hz)。13C核磁表征(101MHz,CDCl3)δ166.9(s),136.9(s),128.7(s),127.0(s),126.9(s),76.8(d,J=237.8Hz),61.7(s),32.7(s),27.9(d,J=10.9Hz),27.5(d,J=11.0Hz).红外表征(膜):3035,2971,2939,1663,1501,1433,1387,1193,1104,1011,978,749,699,588,473cm-1。质谱表征(EI,m/z):443.0(M+).高分辨质谱表征(EI,m/z):calcd.ForC12H14FNO2+(M+)223.1009,found223.1007。实施例4(1S,2S,3S)-2-(4-氟苯基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-(4-fluorophenyl)-3-fluoro-N-methoxy-N-methyl-cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(84mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至20℃搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(68mg,产率81%)。白色固体.熔点:75-76℃.[α]D29=+113.7°(c=1.0,CH2Cl2).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30(体积比),0.7mL/min,λ=214nm,tR(major)=10.88min,tR(minor)=13.93min。1H核磁表征(300MHz,CDCl3)δ7.15-7.06(m,2H),7.05-6.85(m,2H),4.87(ddd,J=10.8,7.0,3.4Hz,1H),3.79(s,3H),3.38(ddd,J=10.9,6.9,3.0Hz,1H),3.30(s,3H),2.79-2.59(m,1H)。19F核磁表征(282MHz,CDCl3)δ-115.71~-115.95(m,1F),-213.90(ddd,J=64.3,21.5,4.7Hz,1F).13C核磁表征(101MHz,CDCl3)δ166.64(s),161.86(d,J=245.6Hz),132.54(d,J=3.0Hz),128.49(d,J=8.0Hz),115.53(d,J=21.7Hz),76.65(d,J=237.8Hz),61.72(s),32.64(s),27.48(d,J=11.6Hz),27.18(d,J=11.1Hz).红外表征(膜):3503,3017,2942,1660,1518,1462,1423,1390,1225,1150,1009,980,823,786,607,533,433cm-1。质谱表征(EI,m/z):241(M+).高分辨质谱表征(EI,m/z):calcd.ForC12H13F2NO2+(M+)241.0914,found241.0916。实施例5(1S,2S,3S)-2-(4-氯苯基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-(4-chlorophenyl)-3-fluoro-N-methoxy-N-methyl-cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(90mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至25℃搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(93mg,产率90%)。白色固体.熔点:106-107℃.[α]D28=+122.3°(c=1.0,CH2Cl2).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=12.63min,tR(minor)=17.63min。1H核磁表征(300MHz,CDCl3)δ7.28(d,J=8.0Hz,2H),7.07(d,J=8.4Hz,2H),4.87(ddd,J=64.1,7.1,3.3Hz,1H),3.79(s,3H),3.36(ddd,J=19.9,7.0,3.2Hz,1H),3.29(s,3H),2.75-2.68(m,1H)。19F核磁表征(282MHz,CDCl3)δ-213.64(ddd,J=64.2,21.4,4.3Hz).13C核磁表征(101MHz,CDCl3)δ166.49(s),135.39(s),132.80(s),128.79(s),128.24(s),76.58(d,J=238.2Hz),61.75(s),32.68(s),27.61(d,J=10.7Hz),27.28(d,J=11.1Hz).红外表征(膜):3445,2986,2947,1661,1497,1445,1422,1386,1264,1173,1112,1073,1012,975,811,783,677,503,478,407cm-1。质谱表征(EI,m/z):257(M+).高分辨质谱表征(EI,m/z):calcd.ForC12H13ClFNO2+(M+)257.0619,found257.0617。实施例6(1S,2S,3S)-2-(3-氯苯基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-(3-chlorophenyl)-3-fluoro-N-methoxy-N-methyl-cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(90mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温25℃搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(91mg,产率88%)。白色固体.熔点.51-52℃.[α]D28=+110.0°(c=1.0,CH2Cl2).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=12.13min,tR(minor)=13.98min。1H核磁表征(300MHz,CDCl3)δ7.29-7.19(m,2H),7.08(s,1H),7.07-7.01(m,1H),4.88(ddd,J=64.0,7.1,3.3Hz,1H),3.79(s,3H),3.36(ddd,J=21.3,7.0,3.2Hz,1H),3.29(s,3H),(m,1H)。19F核磁表征(282MHz,CDCl3)δ-213.51(ddd,J=64.1,21.3,4.8Hz).红外表征(膜):2945,1661,1599,1472,1386,1290,1199,1100,1015,977,881,781,687,597,439cm-1。13C核磁表征(101MHz,CDCl3)δ166.36(s),138.95(s),134.58(s),129.92(s),127.21(s),126.85(s),125.33(s),76.46(d,J=238.8Hz),61.78(s),32.71(s),27.64(d,J=10.7Hz),27.43(d,J=11.4Hz)。质谱表征(EI,m/z):257(M+)。高分辨质谱表征(EI,m/z):calcd.ForC12H13ClFNO2+(M+)257.0619,found257.0618。实施例7(1S,2S,3S)-2-(4-溴苯基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-(4-bromophenyl)-3-fluoro-N-methoxy-N-methyl-cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(108mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(六甲基硅基胺基锂,0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(108mg,产率90%)。白色固体.熔点.124-125℃.[α]D28=+105.5°(c=1.0,CH2Cl2).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=16.78min,tR(minor)=20.53min。X-ray单晶衍射结构如图2所示。1H核磁表征(300MHz,CDCl3)δ7.43(d,J=8.2Hz,2H),7.01(d,J=8.2Hz,2H),4.87(ddd,J=64.1,7.1,3.2Hz,1H),3.79(s,3H),3.38(dd,J=6.7,3.1Hz,0.5H),3.27(m,3.5H),2.74-2.69(m,1H)。19F核磁表征(282MHz,CDCl3)δ-213.61(dd,J=64.1,21.2Hz)。13C核磁表征(101MHz,CDCl3)δ166.42(s),135.93(s),131.75(s),128.59(s),120.82(s),76.51(d,J=238.6Hz),61.76(s),32.70(s),27.59(d,J=11.1Hz),27.35(d,J=11.2Hz)。红外表征(膜):3445,2943,1660,1493,1442,1386,1264,1175,1073,1008,965,808,655,500,474,431cm-1。质谱表征(EI,m/z):301(M+)。高分辨质谱表征(EI,m/z):calcd.ForC12H13BrFNO2+(M+)301.0114,found301.0111。实施例8(1S,2S,3S)-2-(4-甲基苯基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-(4-methylphenyl)-3-fluoro-N-methoxy-N-methyl-cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(82mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(85mg,产率90%)。白色固体.熔点.105-106℃.[α]D29=+110.7°(c=1.0,CH2Cl2).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=12.83min,tR(minor)=15.83min。1H核磁表征(300MHz,CDCl3)δ7.12(d,J=7.9Hz,2H),7.02(d,J=7.8Hz,2H),4.88(ddd,J=64.4,7.1,3.2Hz,1H),3.78(s,3H),3.40(dd,J=6.6,3.1Hz,0.5H),3.34-3.28(m,3.5H),2.75-2.66(m,1H),2.33(s,3H)。19F核磁表征(282MHz,CDCl3)δ-214.07(ddd,J=64.3,21.7,4.3Hz)。13C核磁表征(101MHz,CDCl3)δ166.98(s),136.67(s),133.81(s),129.35(s),126.76(s),76.93(d,J=237.8Hz),61.72(s),32.68(s),27.69(d,J=10.9Hz),27.42(d,J=10.9Hz),21.01(s)。红外表征(膜):3445,2919,2850,1662,1522,1471,1418,1383,1174,1073,1015,968,805,782,613,501,469,420cm-1。质谱表征(EI,m/z):237(M+).高分辨质谱表征(EI,m/z):calcd.ForC12H13ClFNO2+(M+)237.1165,found237.1166。实施例9(1S,2S,3S)-2-(4-叔丁基苯基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-(4-tert-butylphenyl)-3-fluoro-N-methoxy-N-methyl-cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(99mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(78mg,产率70%)。白色固体.熔点:60-61℃.[α]D26=+118.5°(c=1.0,CH2Cl2).对映体过量通过chirapakAD-H(4.6mm×250mm)测定,方法为:正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=7.18min,tR(minor)=9.97minDionexUtimate3000.1H核磁表征(300MHz,CDCl3)δ7.33(d,J=8.3Hz,2H),7.08(d,J=8.1Hz,2H),4.91(ddd,J=64.4,7.1,3.2Hz,1H),3.78(s,3H),3.37(ddd,J=10.7,6.8,3.1Hz,1H),3.29(s,3H),2.83-2.64(m,1H),1.30(s,9H)。19F核磁表征(282MHz,CDCl3)δ-214.22(ddd,J=64.2,21.8,4.7Hz)。13C核磁表征(101MHz,CDCl3)δ167.02(s),150.04(s),133.86(s),126.59(s),125.59(s),76.93(d,J=238.0Hz),61.72(s),34.48(s),32.70(s),31.33(s),27.64(d,J=10.9Hz),27.45(d,J=11.4Hz)。红外表征(膜):3345,3054,2964,2867,1660,1524,1388,1322,1266,1185,1090,1011,984,819,565,440cm-1。质谱表征(EI,m/z):279(M+)。高分辨质谱表征(EI,m/z):calcd.ForC16H22FNO2+(M+)279.1635,found237.1636。实施例10(1S,2S,3S)-2-(4-甲氧基苯基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-(4-methoxylpenyl)-3-fluoro-N-methoxy-N-methyl-cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(88mg,0.4mmol)和4mL干燥的甲苯,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(74mg,产率73%)。黄色固体。熔点:52~53℃。[α]D26=+124.6°(c=11,CH2Cl2).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=18.58min,tR(minor)=23.53min。1H核磁表征(300MHz,CDCl3)δ7.07(d,J=8.6Hz,2H),6.84(d,J=8.6Hz,2H),4.87(ddd,J=64.4,7.1,3.3Hz,1H),3.79(s,3H),3.78(s,3H),3.39(dd,J=7.0,3.3Hz,0.5H),3.35-3.25(m,3.5H),2.72-2.62(m,1H)。19F核磁表征(282MHz,CDCl3)δ-214.27(ddd,J=64.5,21.8,4.5Hz).13C核磁表征(101MHz,CDCl3)δ167.02(s),158.71(s),128.76(s),128.01(s),114.13(s),76.89(d,J=237.7Hz),61.71(s),55.29(s),32.65(s),27.34(d,J=10.9Hz),27.31(d,J=10.8Hz)。红外表征(膜):3503,2936,2849,1662,1518,1464,1386,1249,1179,1034,979,822,771,563,479cm-1。质谱表征(EI,m/z):253(M+).高分辨质谱表征(EI,m/z):calcd.ForC13H16FNO3+(M+)253.1114,found253.1111。实施例11(1S,2S,3S)-2-(3-甲氧基苯基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-(3-methoxylpenyl)-3-fluoro-N-methoxy-N-methyl-cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(88mg,0.4mmol)和4mL干燥的甲苯,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(75mg,产率74%)。黄色液体.[α]D28=+122.6°(c=1.0,CH2Cl2).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=17.40min,tR(minor)=23.13min。1H核磁表征(300MHz,CDCl3)δ7.22(t,J=7.9Hz,1H),6.79(d,J=8.4Hz,1H),6.74-6.60(m,2H),4.90(ddd,J=64.3,7.1,3.3Hz,1H),3.80(s,3H),3.79(s,3H),3.37(ddd,J=21.9,6.9,3.3Hz,1H),3.29(s,3H),2.83-2.61(m,1H)。19F核磁表征(282MHz,CDCl3)δ-213.77(ddd,J=64.3,21.7,4.6Hz)。13C核磁表征(101MHz,CDCl3)δ166.92(s),159.86(s),138.49(s),129.70(s),118.97(s),112.92(s),112.32(s),76.78(d,J=238.1Hz),61.73(s),55.25(s),32.69(s),27.95(d,J=10.9Hz),27.58(d,J=10.8Hz).红外表征(膜):3500,2940,2837,1663,1604,1584,1495,1431,1386,1293,1158,1011,778,694,456cm-1。质谱表征(EI,m/z):253(M+).高分辨质谱表征(EI,m/z):calcd.ForC10H12FNO3+(M+)253.1114,found253.1112。实施例12(1S,2S,3S)-2-(2-甲氧基苯基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-(2-methoxylpenyl)-3-fluoro-N-methoxy-N-methyl-cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(88mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(77mg,产率75%)。无色液体.[α]D28=+94.7°(c=1.0,CHCl3).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=13.78min,tR(minor)=23.93min。1H核磁表征(300MHz,CDCl3)δ7.23(m,1H),7.01-6.81(m,3H),4.96(ddd,J=64.9,7.0,3.4Hz,1H),3.85(s,3H),3.78(s,3H),3.50(ddd,J=15.0,7.4,3.3Hz,1H),3.30(s,3H),2.86-2.59(m,1H)。19F核磁表征(282MHz,CDCl3)δ-214.64(ddd,J=65.1,22.7,4.6Hz).13C核磁表征(101MHz,CDCl3)δ167.53(s),158.27(s),128.13(s),127.40(s),124.99(s),120.41(s),110.61(s),76.85(d,J=236.9Hz),61.66(s),55.47(s),32.72(s),26.07(d,J=11.0Hz),24.18(d,J=11.5Hz)。红外表征(膜):3500,3003,2939,2838,1660,1602,1499,1437,1385,1248,1123,1012,980,755,597,462cm-1。质谱表征(EI,m/z):253(M+)。高分辨质谱表征(EI,m/z):calcd.ForC13H16FNO3+(M+)253.1114,found253.1115。实施例13(1S,2S,3S)-2-(2-噻吩基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2R,3R)-2-fluoro-N-methoxy-N-methyl-3-(thiophen-2-yl)cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(79mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(73mg,产率80%)。黄色液体.[α]D28=+124.3°(c=0.09,CH2Cl2).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=16.23min,tR(minor)=18.93min。1H核磁表征(300MHz,CDCl3)δ7.15(d,J=5.1Hz,1H),6.96-6.89(m,1H),6.84(d,J=3.1Hz,1H),4.90(ddd,J=63.8,7.1,3.1Hz,1H),3.79(s,3H),3.53(ddd,J=20.2,6.6,3.1Hz,1H),3.27(s,3H),2.85-2.62(m,1H)。19F核磁表征(282MHz,CDCl3)δ-213.17(ddd,J=64.1,20.2,4.7Hz)。13C核磁表征(101MHz,CDCl3)δ166.31(s),140.08(s),127.05(s),124.61(s),123.93(s),77.06(d,J=239.8Hz),61.76(s),32.70(s),28.88(d,J=11.3Hz),23.37(d,J=12.4Hz).红外表征(膜):3073,2968,2938,1663,1429,1387,1316,1177,1100,1010,968,851,703,599,473cm-1。质谱表征(EI,m/z):229(M+)。高分辨质谱表征(EI,m/z):calcd.ForC10H12FNO2S+(M+)229.0573,found229.0568。实施例14(1S,2S,3S)-2-(1-萘基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺(1S,2S,3S)-2-fluoro-N-methoxy-N-methyl-3-(naphthalen-2-yl)cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(96mg,0.4mmol)和4mL干燥的甲苯,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(82mg,产率75%)。无色液体.[α]D26=+34.2°(c=0.9,CH2Cl2).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=15.17min,tR(minor)=13.06min。1H核磁表征(300MHz,CDCl3)δ8.28(d,J=8.2Hz,1H),7.88(d,J=7.4Hz,1H),7.78(d,J=8.2Hz,1H),7.64-7.49(m,2H),7.38(t,J=7.5Hz,1H),7.30-7.23(m,1H),5.05(ddd,J=64.7,7.1,3.5Hz,1H),3.90(dd,J=7.2,3.4Hz,0.5H),3.86-3.77(m,3.5H),3.37(s,3H),2.86-2.58(m,1H)。19F核磁表征(282MHz,CDCl3)δ-215.44(ddd,J=64.7,21.5,4.8Hz).13C核磁表征(101MHz,CDCl3)δ167.07(s),133.74(s),132.72(s),132.38(s),128.59(s),128.00(s),126.64(s),126.19(s),125.19(s),124.19(s),76.34(d,J=235.1Hz),61.75(s),32.80(s),26.82(d,J=12.2Hz),26.09(d,J=11.2Hz)。红外表征(膜):3048,2936,1660,1597,1510,14177,1386,1195,1175,1108,1011,970,801,779,619,504,423cm-1。质谱表征(EI,m/z):237(M+).高分辨质谱表征(EI,m/z):calcd.ForC16H16FNO2+(M+)273.1165,found237.1167。实施例15(1S,2S,3S)-2-氟-N-甲氧基-N-甲基-3-丙基环丙基碳酰胺(1S,2S,3R)-2-fluoro-N-methoxy-N-methyl-3-propylcyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(63mg,0.4mmol)和4mL干燥的甲苯,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(45mg,产率60%)。无色液体.[α]D26=+85.4°(c=0.6,CHCl3).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=98/2,0.7mL/min,λ=214nm,tR(major)=27.38min,tR(minor)=29.08min。1H核磁表征(300MHz,CDCl3)δ4.64(ddd,J=65.1,6.9,3.3Hz,1H),3.76(s,3H),3.25(s,3H),2.29-2.06(m,2H),1.53-1.18(m,4H),0.94(t,J=7.3Hz,3H)。19F核磁表征(282MHz,CDCl3)δ-216.04(dd,J=65.4,21.0Hz)。13C核磁表征(126MHz,CDCl3)δ167.87(s),76.95(d,J=232.7Hz),61.42(s),32.46(s),31.18(s),24.52(d,J=11.8Hz),23.47(d,J=9.0Hz),21.24(s),13.49(s)。红外表征(膜):3500,2962,2934,2875,1663,1465,1416,1385,1318,1200,1110,971,878,723,616,434cm-1。质谱表征(EI,m/z):189(M+)。高分辨质谱表征(EI,m/z):calcd.ForC9H16FNO2+(M+)189.1165,found189.1169。实施例16(1S,2S,3S)-2-氟-N-甲氧基-N,2-二甲基-3-苯基环丙基碳酰胺(1S,2S,3S)-2-fluoro-N-methoxy-N,2-dimethyl-3-phenylcyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]-1-氟乙基苯基亚砜亚胺(205mg,0.6mmol),(76mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(66mg,产率70%)。白色固体.熔点:54-55℃.[α]D28=+42.1°(c=0.64,CHCl3).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=44.98min,tR(minor)=42.98min。1H核磁表征(300MHz,CDCl3)δ7.40-7.23(m,3H),7.20(d,J=7.7Hz,2H),3.81(s,3H),3.53(dd,J=22.1,7.7Hz,1H),3.31(s,3H),2.85-2.51(m,1H),1.48(d,J=19.6Hz,2H).19F核磁表征(282MHz,CDCl3)δ-164.57--181.84(m)。13C核磁表征(126MHz,CDCl3)δ167.48(s),135.07(s),128.42(s),128.18(s),126.89(s),81.80(d,J=229.3Hz),61.67(s),32.66(s),32.27(d,J=12.3Hz),29.54(d,J=11.1Hz),17.96(d,J=23.3Hz)。红外表征(膜):3479,2969,2936,1667,1500,1440,1379,1259,1174,1105,990,874,731,700,594,419cm-1。质谱表征(EI,m/z):237(M+)。高分辨质谱表征(EI,m/z):calcd.ForC13H16FNO2+(M+)237.1165,found237.1162。实施例17(1S,2S,3S)-2-氟-N-甲氧基-N,2-二甲基-3-苯基环丙基碳酰胺(1S,2S,3S)-3-(4-bromophenyl)-2-fluoro-N-methoxy-N,2-dimethylcyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[(R)-N-对甲苯磺酰基]-1-氟乙基苯基亚砜亚胺(205mg,0.6mmol),(108mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(91mg,产率72%)。白色固体。熔点:76-77℃.[α]D28=+36.3°(c=0.52,CHCl3).76%ee.对映体过量通过Lux5uCellulose-1(4.6mm×250mm)测定,方法是正己烷/异丙醇=70/30,0.7mL/min,λ=214nm,tR(major)=13.58min,tR(minor)=11.93min。1H核磁表征(300MHz,CDCl3)δ7.39(d,J=8.4Hz,2H),7.03(d,J=8.1Hz,2H),3.75(s,3H),3.41(dd,J=21.8,7.6Hz,1H),3.26(s,3H),2.61(b,1H),1.41(d,J=19.5Hz,3H)。19F核磁表征(282MHz,CDCl3)δ-17114--171.74(m)。13C核磁表征(101MHz,CDCl3)δ167.15(s),134.25(s),131.65(s),130.01(d,J=1.3Hz),120.91(s),81.53(d,J=230.1Hz),61.79(s),32.71(s),31.69(d,J=12.8Hz),29.77(d,J=11.4Hz),18.00(d,J=23.2Hz)。红外表征(膜):3286,3026,2990,2948,1651,1492,1385,1259,1175,1013,935,830,748,598,485,434cm-1。质谱表征(EI,m/z):315(M+)。高分辨质谱表征(EI,m/z):calcd.ForC13H15BrFNO2+(M+)315.0270,found315.0272。实施例18(1S,2S,3S)-2-氟-N-甲氧基-3-(4-甲氧基苯基)-环丙基甲醛(1S,2S,3S)-2-fluoro-3-(4-methoxyphenyl)cyclopropanecarbaldehyde的制备N2保护下,向25mLSchlenk反应管中加入(1S,2S,3S)-2-氟-N-甲氧基-3-(4-甲氧基苯基)-N-N-甲基环丙基碳酰胺(1S,2S,3S)-2-fluoro-N-methoxy-3-(4-methoxyphenyl)-N-methylcyclopropanecarboxamide(76mg,0.3mmol)和3mL干燥的THF,冷至0℃,缓慢加LiAlH4(34mg,0.9mmol)0℃反应1小时后依次加15μLH2O,15μL20%NaOH(aq),45μLH2O,室温搅拌2小时后,加5mL饱和氯化铵水溶液,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(10∶1)得到产物(46mg,产率80%)。黄色液体.[α]D27=+170.6°(c=1.0007,CHCl3).对映体过量通过手性柱Lux5uAmylose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=98/2,0.5mL/min,λ=214nm,tR(major)=11.52min,tR(minor)=11.89min。1H核磁表征(300MHz,CDCl3)δ9.34(d,J=5.7Hz,1H),7.01(d,J=8.7Hz,2H),6.84(d,J=8.7Hz,2H),5.03(ddd,J=62.2,6.4,3.3Hz,1H),3.77(s,3H),3.33(ddd,J=22.7,6.2,3.3Hz,1H),2.35-2.22(m,1H)。19F核磁表征(282MHz,CDCl3)δ-211011(ddd,J=62.2,22.7,4.3Hz)。13C核磁表征(101MHz,cdcl3)δ195.03(d,J=7.9Hz),159.01(s),127.88(s),126.63(s),114.22(s),77.85(d,J=235.5Hz),55.24(s),38.68(d,J=11.1Hz),30.17(d,J=11.3Hz)。红外表征(膜):3445,3027,2958,2838,1900,1698,1611,1460,1356,1272,1250,1212,1027,906,838,751,556,491cm-1。质谱表征(EI,m/z):194(M+)。高分辨质谱表征(EI,m/z):calcd.ForC11H11FO2+(M+)194.0743,found194.0742。实施例19(1S,2S,3S)-2-氟-N-甲氧基-3-(4-甲氧基苯基)-环丙基甲醇((1S,2S,3S)-2-fluoro-3-(4-methoxyphenyl)cyclopropyl)methanol的制备N2保护下,向25mLSchlenk反应管中加入(1S,2S,3S)-2-氟-N-甲氧基-3-(4-甲氧基苯基)-N-N-甲基环丙基碳酰胺(1S,2S,3S)-2-fluoro-N-methoxy-3-(4-methoxyphenyl)-N-methyl-cyclopropanecarboxamide(76mg,0.3mmol)和3mL干燥的THF,冷至0℃,缓慢加LiAlH4(34mg,0.9mmol),0℃反应1小时后依次加15μLH2O,15μL20%NaOH(aq),45μLH2O,室温搅拌2小时后,加5mL饱和氯化铵水溶液,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,粗产物溶入3mL干燥的THF,N2保护下,冷至0℃,缓慢加LiAlH4(34mg,0.9mmol),0℃反应1小时后依次加15μLH2O,15μL20%NaOH(aq),45μLH2O,室温搅拌2小时后,加5mL饱和氯化铵水溶液,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。快速柱层析(5∶1)得到产物(41mg,产率70%)。黄色液体.[α]D29=+58.6°(c=0.94,CHCl3).对映体过量通过手性柱Lux5uCellulose-2(4.6mm×250mm)测定,方法是正己烷/异丙醇=80/20,0.7mL/min,λ=214nm,tR(major)=10.13min,tR(minor)=10.83min。1H核磁表征(300MHz,CDCl3)δ6.97(d,J=8.6Hz,2H),6.82(d,J=8.7Hz,2H),4.74(ddd,J=64.0,6.2,2.2Hz,1H),4.06(dd,J=11.4,5.7Hz,1H),3.85-3.73(m,4H),2.36-2.16(m,1H),1.94(s,1H),1.72-1.52(m,1H)。19F核磁表征(282MHz,CDCl3)δ-218.80(ddd,J=64.1,21.9,5.1Hz)。13C核磁表征(101MHz,CDCl3)δ158.38(s),130.12(s),127.56(s),114.08(s),78.02(d,J=228.7Hz),60.45(d,J=9.7Hz),55.33(s),28.49(d,J=10.3Hz),26.59(d,J=10.8Hz)。红外表征(膜):3383,3006,2937,2837,1614,1518,1443,1290,1249,1179,1070,1038,967,818,756,566,528cm-1。质谱表征(EI,m/z):196(M+)。高分辨质谱表征(EI,m/z):calcd.ForC11H13FO2+(M+)196.0900,found:196.0903。实施例20(1S,2S,3S)-2-氟-N-甲氧基-3-(4-甲氧基苯基)-环丙基苯基酮((1S,2S,3S)-2-fluoro-3-(4-methoxyphenyl)cyclopropyl)(phenyl)methanone的制备N2保护下,向25mLSchlenk反应管中加入(1S,2S,3S)-2-氟-N-甲氧基-3-(4-甲氧基苯基)-N-N-甲基环丙基碳酰胺(1S,2S,3S)-2-fluoro-N-methoxy-3-(4-methoxyphenyl)-N-methylcyclopropanecarboxamide(76mg,0.3mmol)和3mL干燥的THF,冷至0℃,缓慢滴加PhMgBr(1MinTHF,0.45mL,0.45mmol),0℃反应1.5小时后加5mL饱和氯化铵水溶液,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(10∶1)得到产物(61mg,产率75%)。白色固体。Mp:108-109℃。[α]D29=+192.2°(c=1.0,CHCl3)。对映体过量通过Lux5uCellulose-2(4.6mm×250mm)测定,条件是正己烷/异丙醇=80/20,0.7mL/min,λ=214nm,tR(major)=12.78min,tR(minor)=10.78min。1H核磁表征(300MHz,CDCl3)δ8.07(d,J=7.2Hz,2H),7.60(t,J=7.3Hz,1H),7.51(t,J=7.4Hz,2H),7.11(d,J=8.7Hz,2H),6.86(d,J=8.7Hz,2H),5.05(ddd,J=64.3,7.0,3.5Hz,1H),3.80(s,3H),3.62(ddd,J=21.4,6.8,3.6Hz,1H),3.17-3.05(m,1H)。19F核磁表征(282MHz,CDCl3)213.11(ddd,J=64.4,21.3,4.8Hz)。13C核磁表征(101MHz,CDCl3)δ191.85(s),158.88(s),138.01(s),133.24(s),128.71(s),128.55(s),128.33(s),128.11(s),114.27(s),78.25(d,J=239.8Hz),55.35(s),33.83(d,J=11.8Hz),28.90(d,J=10.5Hz)。红外表征(膜):3052,2953,2835,1669,1613,1519,1449,1353,1246,1179,1073,969,874,722,694,646,536,456cm-1。质谱表征(EI,m/z):271(M+H+).高分辨质谱表征(ESI,m/z):calcd.ForC17H15FNaO2+(M+)293.0954,found293.0961。实施例212-氟-N-甲氧基-3-(4-甲氧基苯基)-环丙基苯基酮(2-fluoro-3-(4-methoxyphenyl)cyclopropyl)(phenyl)methanone的制备N2保护下,向25mLSchlenk反应管中加入[N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(E)-3-(4-甲氧基苯基)-1-苯基丙-2-烯-1-酮(E)-3-(4-methoxyphenyl)-1-phenylprop-2-en-1-one(95mg,0.4mmol)和4mL干燥的THF,冷至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水2mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(34mg,产率35%)。白色固体.Mp:108-109℃。1H核磁表征(300MHz,CDCl3)δ8.07(d,J=7.2Hz,2H),7.60(t,J=7.3Hz,1H),7.51(t,J=7.4Hz,2H),7.11(d,J=8.7Hz,2H),6.86(d,J=8.7Hz,2H),5.05(ddd,J=64.3,7.0,3.5Hz,1H),3.80(s,3H),3.62(ddd,J=21.4,6.8,3.6Hz,1H),3.17-3.05(m,1H)。19F核磁表征(282MHz,CDCl3)δ-213.11(ddd,J=64.4,21.3,4.8Hz)。13C核磁表征(101MHz,CDCl3)δ191.85(s),158.88(s),138.01(s),133.24(s),128.71(s),128.55(s),128.33(s),128.11(s),114.27(s),78.25(d,J=239.8Hz),55.35(s),33.83(d,J=11.8Hz),28.90(d,J=10.5Hz)。红外表征(膜):3052,2953,2835,1669,1613,1519,1449,1353,1246,1179,1073,969,874,722,694,646,536,456cm-1。质谱表征(EI,m/z):271(M+H+)。高分辨质谱表征(ESI,m/z):calcd.ForC17H15FNaO2+(M+)293.0954,found293.0961。实施例222-(2-甲氧基苯基)-3-氟-N-甲氧基-N-甲基-环丙基碳酰胺2-(2-methoxylpenyl)-3-fluoro-N-methoxy-N-methyl-cyclopropanecarboxamide的制备N2保护下,向25mLSchlenk反应管中加入[N-对甲苯磺酰基]单氟甲基苯基亚砜亚胺(196mg,0.6mmol),(88mg,0.4mmol)和4mL干燥的THF,冷却至-78℃,缓慢滴加LHMDS(0.52mmol),搅拌20min后,撤去冷浴,自然升至室温搅拌3h,加水5mL淬灭反应,无水乙醚萃取(15mL×3),合并有机相,饱和食盐水洗(5mL),无水硫酸镁干燥。减压旋蒸除去溶剂,快速柱层析(5∶1)得到产物(77mg,产率75%)。无色液体。1H核磁表征(300MHz,CDCl3)δ7.23(m,1H),7.01-6.81(m,3H),4.96(ddd,J=64.9,7.0,3.4Hz,1H),3.85(s,3H),3.78(s,3H),3.50(ddd,J=15.0,7.4,3.3Hz,1H),3.30(s,3H),2.86-2.59(m,1H)。19F核磁表征(282MHz,CDCl3)δ-214.64(ddd,J=65.1,22.7,4.6Hz).13C核磁表征(101MHz,CDCl3)δ167.53(s),158.27(s),128.13(s),127.40(s),124.99(s),120.41(s),110.61(s),76.85(d,J=236.9Hz),61.66(s),55.47(s),32.72(s),26.07(d,J=11.0Hz),24.18(d,J=11.5Hz)。红外表征(膜):3500,3003,2939,2838,1660,1602,1499,1437,1385,1248,1123,1012,980,755,597,462cm-1。质谱表征(EI,m/z):253(M+)。高分辨质谱表征(EI,m/z):calcd.ForC13H16FNO3+(M+)253.1114,found253.1115。应理解,本发明不限于所披露的实例化合物,本发明的保护范围以所附权利要求书限定为准。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1