抗ROBO4抗体的制作方法
[背景领域]
Roundabout同源物4(ROBO4),分子量为110kDa的蛋白质,具有单次跨膜结构(非专利文献1),并且已知通过结合已知的血管生成抑制剂剂Slit同源物2(Slit2)(专利文献1和非专利文献2)抑制血管生成。已报导Slit2抑制通过血管内皮生长因子(VEGF)促进的HUVEC的迁移,还已报导对于ROBO4基因转染的血管内皮细胞(在下文中,所述血管内皮细胞也称为"EC"),相较于空载体转染的EC,Slit2抑制VEGF或bFGF对细胞迁移的促进(专利文献1和非专利文献2-4)。
此外,已报导在从野生型小鼠衍生的EC或利用对照siRNA转染的EC中但不是在从ROBO4基因敲除小鼠衍生的EC或利用敲低ROBO4基因的siRNA转染的EC中,观察到Slit2针对VEGF对细胞迁移的促进、管腔形成的促进或通透性的增加的抑制作用(专利文献2和非专利文献4至6)。此外,已报导Slit2通过ROBO4在具有激光诱导的脉络膜新生血管化或氧诱导性视网膜病变的小鼠模型中抑制血管生成或血管通透性的增加,所述小鼠模型为具有渗出性年龄相关性黄斑变性或糖尿病视网膜病变的动物疾病模型(专利文献2和非专利文献4)。
尽管存在这些发现,但还有显示ROBO4不结合Slit2的报导(非专利文献9和专利文献5)。关于其功能还已报导ROBO4参与血管生成的促进而非血管生成的抑制,因为ROBO4基因敲除EC的迁移或管腔形成被抑制(非专利文献10和11)。
在临床实践中,已报导ROBO4在来自结肠癌、神经节神经胶质瘤、膀胱癌、乳腺癌、转移性黑素瘤、肾癌、肺癌、肝癌或结肠癌的肝转移中的瘤内血管中高度表达(专利文献3和非专利文献1、3和7)。此外,已报导ROBO4也在增生性糖尿病视网膜病变患者的纤维血管膜中的血管中表达(非专利文献8)。这样,ROBO4在血管内皮细胞,具体地,在病理状态中新近形成的血管的内皮细胞中表达。这可表明因ROBO4的高度表达而引起的病理性血管生成,但也可表明用于抑制病理性血管生成的ROBO4的补偿性表达。
如上所述,ROBO4参与抗血管生成作用。因此,假定抗ROBO4的抗体及其功能性片段在涉及血管生成的疾病的治疗中是有用的。然而,不能断定抗ROBO4的激动性或拮抗性(agonistic or antagonistic)抗体是抑制还是促进血管生成。
EP专利号1,565,491(专利文献4)和WO2008/100805(专利文献5)中描述的抗体称为抗ROBO4的抗体(在下文中,称为"抗ROBO4抗体")。但这些抗体在体内都不显示对血管生成的阻抑或抑制作用。
[引用列表]
[专利文献]
[专利文献1]WO2004/003163
[专利文献2]WO2008/073441
[专利文献3]WO2002/036771
[专利文献4]欧洲专利号1,565,491
[专利文献5]WO2008/100805
[非专利文献]
[非专利文献1]Genomics,2002,vol.79,p.547-552
[非专利文献2]Developmental Biology,2003,vol.261,p.251-267
[非专利文献3]Biochemical and Biophysical Research Communications,2005,vol.332,p.533-541
[非专利文献4]Nature Medicine,2008,No.14,p.448-453
[非专利文献5]Science Translational Medicine,2010,vol.2,p.23ral9
[非专利文献6]Proceedings of the National Academy of Sciences,2010,vol.107,p.10520-10525
[非专利文献7]Oncology Reports,2006,vol.15,p.1437-1443
[非专利文献8]Molecular Vision,2009,vol.15,p.1057-1069
[非专利文献9]The FASEB Journal,2005,vol.19,p.121-123
[非专利文献10]BMC Cell Biology,2008,vol.9,p.61-72
[非专利文献11]The FASEB Journal,2009,vol.23,p.513-522
[发明概述]
[本发明待解决的问题]
本发明的一个目的是提供抗ROBO4的抗体。
本发明的另一目的是提供包含具有抗血管生成作用等的抗ROBO4抗体的药物组合物。
本发明的又一目的是提供用于产生所述抗体的方法。
本发明的进一步目的是提供使用所述抗体等抑制血管生成的方法。
[解决问题的方法]
本发明人已进行勤奋的研究来实现这些目的,从而成功地构建了检测ROBO4的下游信号的激活的筛选系统。此外,本发明人已使用筛选系统来成功地获得新的抗ROBO4单克隆抗体,所述抗体激活ROBO4的下游信号,在表达ROBO4的EC中具有抑制由各种血管生成因子(例如VEGF、bFGF、HGF、PDGF-BB和SDF-1)诱导的细胞迁移的活性,并且甚至在体内模型中显示抗血管生成作用。这样,完成了本发明。
具体地,本发明涉及:
(1)具有下列(I)至(III)中描述的性质的抗体或其功能性片段:
(I)结合ROBO4蛋白,优选以1×10-8或更低,特别优选的5×10-9或更低的KD值结合;
(II)在体外不存在交联抗体(cross-linking antibody)的情况下阻抑或抑制血管内皮细胞迁移;和
(III)在体内阻抑或抑制血管生成;
(2)根据(1)的抗体或其功能性片段,其中ROBO4蛋白为人ROBO4蛋白;
(3)根据(1)的抗体或其功能性片段,其中ROBO4蛋白是由SEQ ID NO:2的氨基酸No.1至1007的氨基酸序列组成的蛋白质;
(4)根据(1)的抗体或其功能性片段,其中ROBO4蛋白是由SEQ ID NO:2的氨基酸No.46至1007的氨基酸序列组成的蛋白质;
(5)根据(3)或(4)的抗体或其功能性片段,其中所述抗体或其功能性片段结合由SEQ ID NO:2的氨基酸No.132至209的氨基酸序列组成的位点;
(6)根据(1)的抗体或其功能性片段,其中所述抗体或其功能性片段为单克隆抗体或其功能性片段;
(7)根据(1)至(6)中任一项的抗体或其功能性片段,其中所述抗体由重链和轻链组成,所述重链包含由SEQ ID NO:44(图25)所示的氨基酸序列组成的CDRH1,由SEQ ID NO:46(图26)所示的氨基酸序列或通过一个氨基酸的置换从SEQ ID NO:46的氨基酸序列衍生的氨基酸序列组成的CDRH2,和由SEQ ID NO:48(图27)所示的氨基酸序列组成的CDRH3,所述轻链包含由SEQ ID NO:50(图28)所示的氨基酸序列或通过1至3个氨基酸的置换从SEQ ID NO:50的氨基酸序列衍生的氨基酸序列组成的CDRL1,由SEQ ID NO:52(图29)所示的氨基酸序列组成的CDRL2,和由SEQ ID NO:54(图30)所示的氨基酸序列组成的CDRL3;
(8)根据(1)至(7)中任一项的抗体或其功能性片段,其中所述抗体由重链和轻链组成,所述重链包含由SEQ ID NO:44(图25)所示的氨基酸序列组成的CDRH1,由SEQ ID NO:46(图26)所示的氨基酸序列或由SEQ ID NO:68(图44)所示的氨基酸序列组成的CDRH2,和由SEQ ID NO:48(图27)所示的氨基酸序列组成的CDRH3,所述轻链包含由SEQ ID NO:50(图28)所示的氨基酸序列或由SEQ ID NO:70(图46)所示的氨基酸序列组成的CDRL1,由SEQ ID NO:52(图29)所示的氨基酸序列组成的CDRL2,和由SEQ ID NO:54(图30)所示的氨基酸序列组成的CDRL3;
(9)根据(1)至(7)中任一项的抗体或其功能性片段,其中所述抗体包含重链可变区和轻链可变区,所述重链可变区由SEQ ID NO:31(图16)所示的氨基酸序列组成,所述轻链可变区由SEQ ID NO:33(图18)所示的氨基酸序列组成;
(10)根据(1)至(8)中任一项的抗体或其功能性片段,其中所述抗体包含选自下列a)至d)的任意一个重链可变区和选自e)和f)的轻链可变区:
a)由SEQ ID NO:56(图32)的氨基酸No.20至137所示的氨基酸序列组成的重链(hMAb1-H1-型)可变区,
b)由SEQ ID NO:58(图34)的氨基酸No.20至137所示的氨基酸序列组成的重链(hMAb1-H2-型)可变区,
c)由SEQ ID NO:60(图36)的氨基酸No.20至137所示的氨基酸序列组成的重链(hMAb1-H3-型)可变区,和
d)由SEQ ID NO:62(图38)的氨基酸No.20至137所示的氨基酸序列组成的重链(hMAb1-H4-型)可变区;和
e)由SEQ ID NO:64(图40)的氨基酸No.21至134所示的氨基酸序列组成的轻链(hMAb1-L1-型)可变区,和
f)由SEQ ID NO:66(图42)的氨基酸No.21至134所示的氨基酸序列组成的轻链(hMAb1-L2-型)可变区;
(11)根据(1)至(8)中任一项的抗体或其功能性片段,其中所述抗体包含下列重链可变区与轻链可变区的组合1)至6)的任一组合:
1)由SEQ ID NO:58(图34)的氨基酸No.20至137所示的氨基酸序列组成的重链可变区和由SEQ ID NO:64(图40)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区,
2)由SEQ ID NO:58(图34)的氨基酸No.20至137所示的氨基酸序列组成的重链可变区和由SEQ ID NO:66(图42)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区,
3)由SEQ ID NO:62(图38)的氨基酸No.20至137所示的氨基酸序列组成的重链可变区和由SEQ ID NO:66(图42)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区;
4)由SEQ ID NO:62(图38)的氨基酸No.20至137所示的氨基酸序列组成的重链可变区和由SEQ ID NO:64(图40)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区;
5)由SEQ ID NO:56(图32)的氨基酸No.20至137所示的氨基酸序列组成的重链可变区和由SEQ ID NO:64(图40)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区;和
6)由SEQ ID NO:60(图36)的氨基酸No.20至137所示的氨基酸序列组成的重链可变区和由SEQ ID NO:64(图40)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区;
(12)根据(1)至(11)中任一项的抗体或其功能性片段,其中所述抗体或其功能性片段是嵌合抗体或其功能性片段;
(13)根据(1)至(11)中任一项的抗体或其功能性片段,其中所述抗体或其功能性片段为人源化抗体或其功能性片段;
(14)根据(1)至(13)中任一项的抗体或其功能性片段,其中所述抗体包含人IgG1或人IgG2重链恒定区;
(15)根据(1)至(6)中任一项的抗体或其功能性片段,其中所述抗体或其功能性片段结合被根据(7)至(14)的任一种抗体识别的抗原上的位点;
(16)根据(1)至(6)中任一项的抗体或其功能性片段,其中所述抗体或其功能性片段与根据(7)至(14)的任一种抗体竞争对ROBO4蛋白的结合;
(17)根据(1)至(8)的抗体,其中所述抗体包含下列重链与轻链的组合1)至6)中的任一个组合;
1)由SEQ ID NO:58(图34)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:64(图40)的氨基酸No.21至239所示的氨基酸序列组成的轻链(H-1140),
2)由SEQ ID NO:58(图34)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:66(图42)的氨基酸No.21至239所示的氨基酸序列组成的轻链(H-1143),
3)由SEQ ID NO:62(图38)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:66(图42)的氨基酸No.21至239所示的氨基酸序列组成的轻链(H-2143);
4)由SEQ ID NO:62(图38)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:64(图40)的氨基酸No.21至239所示的氨基酸序列组成的轻链(H-2140);
5)由SEQ ID NO:56(图32)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:64(图40)的氨基酸No.21至239所示的氨基酸序列组成的轻链(H-1040),和
6)由SEQ ID NO:60(图36)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:64(图40)的氨基酸No.21至239所示的氨基酸序列组成的轻链(H-2040),
(18)包含根据(17)的任一抗体的重链的修饰形式的抗体,其中所述修饰形式缺乏所述重链的1至数个羧基末端氨基酸,优选所述重链的1至8个羧基末端氨基酸,更优选所述重链的1至2个羧基末端氨基酸;
(19)根据(1)至(6)中任一项的抗体,其中所述抗体在氨基酸序列上与根据(17)的任一抗体具有95%或更高的同一性;对于人ROBO4具有1×10-8或更低的KD值;在体外不存在交联抗体的情况下阻抑或抑制血管内皮细胞迁移;和在体内阻抑或抑制血管生成;
(20)根据(15)的抗体或其功能性片段,其中所述抗体或其功能性片段为人抗体或其功能性片段;
(21)选自下列(I)至(III)的核苷酸序列:
(I)包含编码根据(1)至(20)中任一项的抗体的重链或轻链的部分或完整氨基酸序列的核苷酸序列的核苷酸序列;
(II)由包含编码根据(1)至(20)中任一项的抗体的重链或轻链的部分或完整氨基酸序列的核苷酸序列组成的核苷酸序列;和
(III)由编码根据(1)至(20)中任一项的抗体的重链或轻链的部分或完整氨基酸序列的核苷酸序列组成的核苷酸序列;
(22)包含根据(21)的核苷酸序列的插入物的重组载体;
(23)包含被引入其中的根据(21)的核苷酸或根据(22)的重组载体的重组细胞;
(24)产生根据(1)至(20)中任一项的抗体的细胞,其中所述细胞优选为哺乳动物细胞,更优选CHO细胞,乃至更优选CHOK1SV;
(25)用于产生根据(1)至(20)中任一项的抗体或其功能性片段的方法,包括下列步骤(I)和(II):
(I)培养根据(23)或(24)的细胞;和
(II)从获自步骤(I)的培养物收集根据(1)至(20)中任一项的抗体或其功能性片段;
(26)通过根据(25)的生产方法生产的抗体或其功能性片段;
(27)根据(1)至(20)和(26)中任一项的抗体或其功能性片段的修饰形式;
(28)包含根据(1)至(20)和(26)中任一项的抗体或其功能性片段或根据(27)的修饰形式作为活性成分的药物组合物;
(29)根据(28)的药物组合物,其中药物组合物为用于治疗或预防血管生成性疾病的药剂;
(30)根据(28)的药物组合物,其中血管生成性疾病为渗出性年龄相关性黄斑变性、糖尿病视网膜病变、黄斑水肿、良性或恶性肿瘤、动脉粥样硬化、晶体后纤维增生症、血管瘤、慢性炎症、眼部新生血管性疾病、增生性视网膜病变、新生血管性青光眼、角膜组织移植物或其它组织移植物的免疫排斥、类风湿关节炎、银屑病、急性炎症、脓毒症或肥胖症;
(31)根据(28)的药物组合物,其中血管生成性疾病为渗出性年龄相关性黄斑变性、糖尿病视网膜病变、黄斑水肿、晶体后纤维增生症、眼部新生血管性疾病、增生性视网膜病变、新生血管性青光眼或角膜组织移植物的免疫排斥;
(32)包含根据(1)至(20)和(26)中任一项的抗体或其功能性片段或根据(27)的修饰形式作为活性成分的血管生成抑制剂;
(33)用于治疗或预防血管生成性疾病的方法,包括给需要的受试者施用有效量的根据(1)至(20)和(26)中任一项的抗体或或其功能性片段或根据(27)的修饰形式,或根据(28)至(31)中任一项的组合物,优选其中血管生成性疾病为具有表达的ROBO4蛋白的个体中的血管生成性疾病;和
(34)权利要求28至31中任一项的药物组合物,其中将所述组合物与其它治疗性或预防性药剂组合使用,优选其中所述药剂为抗血管生成药物、抗炎药和/或抗癌药。
[本发明的有益效果]
根据本发明,可获得用于血管生成性疾病的治疗剂等,所述治疗剂包含结合ROBO4并具有抗血管生成作用的抗体。
[附图说明]
[图1]图1是显示在HEK293细胞中人ROBO4的瞬时表达中,作为应答元件的针对NF-κB、GAS、ISRE、IL-8启动子或TCF的报道分子活性的变化的存在或不存在的图示。图中的误差棒代表标准差(n=3)。
[图2]图2是显示在HEK293细胞中全长人ROBO4或人ROBO4的细胞内区域缺失变体的瞬时表达中,IL-8启动子活性的变化的存在或不存在的图示。图中的误差棒代表标准差(n=5或10)。
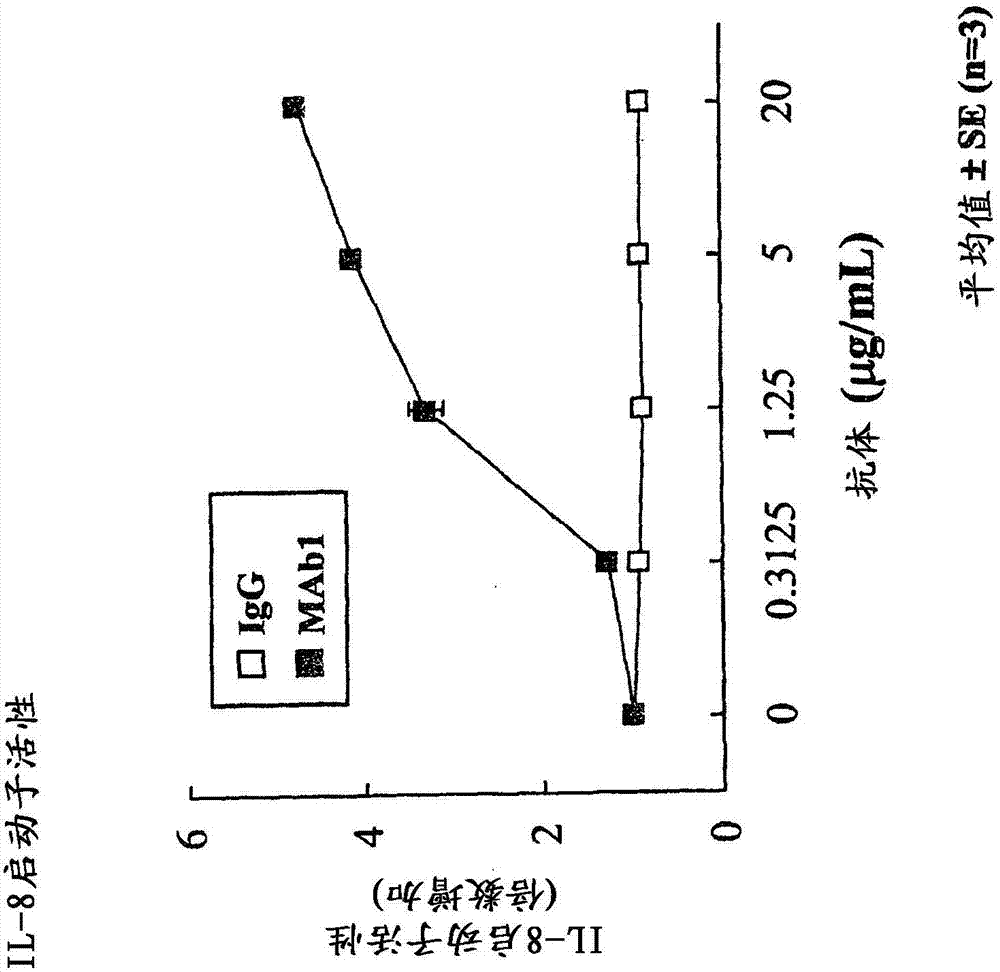
[图3]图3是显示由抗ROBO4抗体MAb1引起的转染人ROBO4的HEK293细胞中的IL-8启动子活性的变化的图示。图中的误差棒代表标准差(n=3)。
[图4]图4是显示由抗ROBO4抗体MAb2、MAb3或MAb4引起的转染人ROBO4的HEK293细胞中的IL-8启动子活性的变化的图示。图中的误差棒代表标准差(n=3)。
[图5]图5是显示由抗ROBO4抗体MAb1引起的在VEGF或bFGF存在的情况下HUVEC的迁移能力的变化的图示。图中的误差棒代表标准差(n=3或4)。
[图6]图6是显示由抗ROBO4抗体MAb2、MAb3或MAb4引起的在bFGF存在的情况下HUVEC的迁移能力的变化的图示。图中的误差棒代表标准差(n=4)。
[图7]图7是显示针对人ROBO4、小鼠ROBO4、大鼠ROBO4或食蟹猴ROBO4的抗ROBO4抗体MAb1的结合活性的存在或不存在的图示。
[图8]图8是显示针对人ROBO1、人ROBO2或人ROBO3的抗ROBO4抗体MAb1的结合活性的存在或不存在的图示。上方的框显示关于MAb1的结果,下方的框显示关于阳性对照抗体的结果,其确认细胞表面上的这些蛋白质的表达。
[图9]图9是显示针对人ROBO4的细胞外区域/结构域缺失变体的抗ROBO4抗体MAb1的结合活性的存在或不存在的图示。上方的框显示关于MAb1的结果,下方的框显示关于抗FLAG抗体的结果,其确认细胞表面上的这些蛋白质的表达。
[图10]图10是显示由抗ROBO4抗体MAb1引起的激光诱导的脉络膜新生血管化模型中血管生成的变化的图示。图中的误差棒代表标准差(n=4只眼),并且■或□显示每只眼的结果。
[图11]图11是显示由抗ROBO4嵌合抗体cMAb1-1或cMAb1-2引起的转染人ROBO4的HEK293细胞中的IL-8启动子活性的变化的图示。图中的误差棒代表标准差(n=3)。
[图12]图12是显示由抗ROBO4嵌合抗体cMAb 1-1或cMAb 1-2引起的在bFGF存在的情况下HUVEC的迁移能力的变化的图示。图中的误差棒代表标准差(n=4)。
[图13]图13显示编码全长人ROBO4的cDNA(SEQ ID NO:1)。
[图14]图14显示人ROBO4的全长氨基酸序列(SEQ ID NO:2)。
[图15]图15显示编码MAb1的重链可变区的cDNA的核苷酸序列(SEQ ID NO:30)。
[图16]图16显示MAb1重链可变区的氨基酸序列(SEQ ID NO:31)。
[图17]图17显示编码MAb1的轻链可变区的cDNA的核苷酸序列(SEQ ID NO:32)。
[图18]图18显示MAb1轻链可变区的氨基酸序列(SEQ ID NO:33)。
[图19]图19显示编码cMAb1的轻链的cDNA的核苷酸序列(SEQ ID NO:37)。
[图20]图20显示cMAb1轻链的氨基酸序列(SEQ ID NO:38)。
[图21]图21显示编码cMAb1-1的重链的cDNA的核苷酸序列(SEQ ID NO:39)。
[图22]图22显示cMAb1-1重链的氨基酸序列(SEQ ID NO:40)。
[图23]图23显示编码cMAb1-2的重链的cDNA的核苷酸序列(SEQ ID NO:41)。
[图24]图24显示cMAb1-2重链的氨基酸序列(SEQ ID NO:42)。
[图25]图25显示MAb1的重链CDRH1的氨基酸序列(SEQ ID NO:44)。
[图26]图26显示MAb1的重链CDRH2的氨基酸序列(SEQ ID NO:46)。
[图27]图27显示MAb1的重链CDRH3的氨基酸序列(SEQ ID NO:48)。
[图28]图28显示MAb1的轻链CDRL1的氨基酸序列(SEQ ID NO:50)。
[图29]图29显示MAb1的轻链CDRL2的氨基酸序列(SEQ ID NO:52)。
[图30]图30显示MAb1的轻链CDRL3的氨基酸序列(SEQ ID NO:54)。
[图31]图31显示编码hMAb1-H1-型重链的cDNA的核苷酸序列(SEQ ID NO:55)。
[图32]图32显示hMAb1-H1-型重链的氨基酸序列(SEQ ID NO:56)。
[图33]图33显示编码hMAb1-H2-型重链的cDNA的核苷酸序列(SEQ ID NO:57)。
[图34]图34显示hMAb1-H2-型重链的氨基酸序列(SEQ ID NO:58)。
[图35]图35显示编码hMAb1-H3-型重链的cDNA的核苷酸序列(SEQ ID NO:59)。
[图36]图36显示hMAb1-H3-型重链的氨基酸序列(SEQ ID NO:60)。
[图37]图37显示编码hMAb1-H4-型重链的cDNA的核苷酸序列(SEQ ID NO:61)。
[图38]图38显示hMAb1-H4-型重链的氨基酸序列(SEQ ID NO:62)。
[图39]图39显示编码hMAb1-L1-型轻链的cDNA的核苷酸序列(SEQ ID NO:63)。
[图40]图40显示hMAb1-L1-型轻链的氨基酸序列(SEQ ID NO:64)。
[图41]图41显示编码hMAb1-L2-型轻链的cDNA的核苷酸序列(SEQ ID NO:65)。
[图42]图42显示hMAb1-L2-型轻链的氨基酸序列(SEQ ID NO:66)。
[图43]图43显示hMAb1-H2-或hMAb1-H4-型重链的CDRH1的氨基酸序列(SEQ ID NO:67)。
[图44]图44显示hMAb1-H2-或hMAb1-H4-型重链的CDRH2的氨基酸序列(SEQ ID NO:68)。
[图45]图45显示hMAb1-H2-或hMAb1-H4-型重链的CDRH3的氨基酸序列(SEQ ID NO:69)。
[图46]图46显示hMAb1-L2-型轻链的CDRL1的氨基酸序列(SEQ ID NO:70)。
[图47]图47显示hMAb1-L2-型轻链的CDRL2的氨基酸序列(SEQ ID NO:71)。
[图48]图48显示hMAb1-L2-型轻链的CDRL3的氨基酸序列(SEQ ID NO:72)。
[图49]图49是显示由H-1040、H-1143、H-1140、H-2040、H-2143或H-2140引起的转染人ROBO4的HEK293细胞中IL-8启动子活性的变化的图示。
[图50]图50是显示在bFGF存在的情况下由H-1143、H-2140或H-2143引起的HUVEC的迁移能力的变化的图示。图示中的误差棒代表标准差(n=4)。
[图51]图51是显示H-1143的交叉物种反应性的图示。
[图52]图52是显示H-2140的交叉物种反应性的图示。
[图53]图53是显示H-2143的交叉物种反应性的图示。
[图54]图54是显示H-1143、H-2140或H-2143的结合特异性的图示。
[图55]图55是显示由H-2143引起的激光诱导的脉络膜新生血管化模型中血管生成的变化的图示。图示中的误差棒代表标准差(n=3-4只眼)。
[用于进行本发明的方式]
1.定义
在本发明中,"基因"意指包含编码蛋白质的氨基酸的核苷酸序列的核苷酸或核苷酸序列或其互补链。"基因"意欲包括例如多核苷酸、寡核苷酸、DNA、mRNA、cDNA和cRNA,如包含编码蛋白质的氨基酸的核苷酸序列或其互补链的核苷酸序列。这样的基因是单链、双链或三链或更多链的核苷酸序列,并且所述"基因"还意欲包括DNA与RNA链的缔合物、核糖核苷酸(RNAs)与脱氧核糖核苷酸(DNAs)在一条核苷酸链上的混合物,以及包含这样的核苷酸链的双链或三链或更多链的核苷酸序列。本发明的"ROBO4基因"的实例可包括编码ROBO4蛋白的氨基酸序列的核苷酸序列的DNA、mRNA、cDNA和cRNA。
在本发明中,术语"核苷酸"或"核苷酸序列"具有如在"核酸"中相同的含义,并且还意欲包括例如DNA、RNA、探针、寡核苷酸、多核苷酸和引物。这样的核苷酸序列是单链、双链或三链或更多链的核苷酸,所述"核苷酸"序列还意欲包括DNA与RNA链的缔合物、核糖核苷酸(RNAs)与脱氧核糖核苷酸(DNAs)在一条核苷酸链上的混合物,以及包含这样的核苷酸链的两条链或三条链或更多条链的缔合物。
在本发明中,术语"多肽"、"肽"和"蛋白"具有相同的含义。
在本发明中,"抗原"还以"免疫原"的含义使用。
在本发明中,"细胞"还包括来源于动物个体、传代培养的细胞、原代培养的细胞、细胞系、重组细胞等的各种细胞。
在本发明中,识别ROBO4蛋白的抗体也称为"抗ROBO4抗体"。所述"抗ROBO4抗体"包括抗ROBO4嵌合抗体、抗ROBO4人源化抗体、抗ROBO4人抗体等。
在本发明中,"抗体的功能性片段"意指发挥原始抗体的至少一种功能(例如结合亲和力(KD值))的抗体片段。"抗体的功能性片段"的实例可包括但不限于Fab、F(ab')2、scFv、Fab'、单链免疫球蛋白等。这样的抗体功能性片段可通过用酶(例如木瓜蛋白酶或胃蛋白酶)处理抗体蛋白的全长分子来获得,或可以是使用重组基因在适当的宿主细胞中产生的重组蛋白。优选"功能性片段"还具有原始抗体的至少一种生物活性。
此外,在本发明的上下文中,编码重链或轻链的"部分氨基酸序列"的核苷酸序列为编码上文中定义的"抗体的功能性片段"的核苷酸序列或包括所述核苷酸序列。
在本发明中,抗体结合的"位点",即被抗体识别的"位点",意指被所述抗体结合或识别的抗原上的部分肽或部分构象。在本发明中,这样的位点也称为表位或抗体结合位点。被本发明的抗ROBO4抗体结合或识别的ROBO4蛋白上的位点的实例可包括ROBO4蛋白上的部分肽或部分构象。
已知抗体分子的重链和轻链各自具有3个互补决定区(CDRs)。互补决定区也称为高变结构域(hypervariable domain)。它们位于抗体重链和轻链的可变区中。这些位点具有特别高度可变的一级结构并且通常被分隔在重链和轻链多肽链的相应一级结构上的三个位置上。在本发明中,抗体的互补决定区从重链氨基酸序列的氨基末端起称为CDRH1、CDRH2和CDRH3(对于重链的互补决定区而言),以及从轻链氨基酸序列的氨基末端起称为CDRL1、CDRL2和CDRL3(对于轻链的互补决定区而言)。这些位点在三维结构上彼此靠近并决定对于待结合的抗原的特异性。
在本发明中,"抗体突变体"意指这样的多肽,所述多肽具有通过氨基酸的置换、缺失、添加和/或插入(在下文中,统称为"突变")从原始抗体的氨基酸序列衍生的氨基酸序列,并且结合本发明的ROBO4蛋白。这样的抗体突变体中的突变氨基酸的数目为1至2、1至3、1至4、1至5、1至6、1至7、1至8、1至9、1至10、1至12、1至15、1至20、1至25、1至30、1至40或1至50个。这样的抗体突变体也包含在本发明的"抗体"中。
在本发明中,术语"1至数个"中的"数个"是指2至10个,优选2至8个,更优选2个。
由本发明的抗体产生的活性或性质的实例可包括生物活性或理化性质,并且可具体地包含各种生物活性、针对抗原或表位的结合活性、在生产或贮存过程中的稳定性以及热稳定性。
在本发明中,短语"在严格条件下杂交"意指在涉及如下条件下的杂交:在含有5×SSC的溶液中于65℃杂交,随后于含2×SSC-0.1%SDS的水溶液中于65℃洗涤20分钟,于含0.5×SSC-0.1%SDS的水溶液中于65℃洗涤20分钟,以及于含0.2×SSC-0.1%SDS的水溶液中于65℃洗涤20分钟,或在与此等同的条件下的杂交。SSC意指150mM NaCl-15mM柠檬酸钠的水溶液,n×SSC意指具有n倍浓度的SSC。
2.ROBO4蛋白
在本说明书中,术语"ROBO4"与"ROBO4蛋白"以相同的含义使用。
(2-1)性质
本发明的ROBO4蛋白具有下列性质:
(i)ROBO4具有约110kDa的分子量和单次跨膜结构,并且为参与血管生成的SLIT2蛋白的受体蛋白。本发明的任何ROBO4蛋白可以以从膜(例如细胞膜)释放的形式存在,并且可以以与膜(例如细胞膜)结合的形式存在。在该上下文中,分子量意指在SDS-PAGE的非还原条件下的表观分子量。ROBO4的N-末端细胞外区域包含两个免疫球蛋白样结构域(在下文中,称为"Ig-样结构域")和两个纤连蛋白III型结构域,而其C末端细胞内区域包含富含蛋白质的区域。在本说明书中,这两个免疫球蛋白样结构域从氨基末端起分别称为Ig样结构域1和Ig样结构域2。人ROBO4蛋白由SEQ ID NO:2的氨基酸No.28至1007的氨基酸序列组成。SEQ ID NO:2的氨基酸No.1至27代表分泌信号;其氨基酸No.28至467代表细胞外区域;其氨基酸No.46至131代表Ig样结构域1;其氨基酸No.137至224代表Ig样结构域2;其氨基酸No.252至340代表纤连蛋白III型结构域1;其氨基酸No.347至438代表纤连蛋白III型结构域2;其氨基酸No.468至490代表细胞膜中的区域;以及其氨基酸No.491至1007代表细胞内区域。
(ii)ROBO4具有抗血管生成作用。在本发明中,术语"抗血管生成"意指分子自身、与另一种因子合作地或作为与另一种因子的缔合物而直接或间接地阻抑和/或抑制血管生成。抗血管生成作用可以例如以对由VEGF导致的血管通透性的增加、促细胞迁移活性或管腔形成活性的抑制作用作为指标来进行评价。
(iii)ROBO4包含下列(a)至(e)中任一项中描述的氨基酸序列(在下文中,称为"ROBO4氨基酸序列"),由包含ROBO4氨基酸序列的氨基酸序列组成或由ROBO4氨基酸序列组成:
(a)由SEQ ID NO:2所示的氨基酸序列(图14);
(b)显示与SEQ ID NO:2(图14)所示的氨基酸序列具有80%或更高,82%或更高,84%或更高,86%或更高,88%或更高,90%或更高,92%或更高,94%或更高,96%或更高,98%或更高,或99%或更高的序列同一性并且显示抗血管生成作用的多肽的氨基酸序列;
(c)包含具有1至50、1至45、1至40、1至35、1至30、1至25、1至20、1至15、1至10、1至8、1至6、1至5、1至4、1至3、1或2或1个氨基酸的置换、缺失、添加或插入的SEQ ID NO:2(图14)所示的氨基酸序列并且抑制血管生成的多肽的氨基酸序列;
(d)包含具有氨基酸No.1至45或1至131缺失的SEQ ID NO:2氨基酸序列并且抑制血管生成的多肽的氨基酸序列;和
(e)多肽的氨基酸序列,其由与具有与编码由SEQ ID NO:2(图14)所示的氨基酸序列的核苷酸序列互补的核苷酸序列的核苷酸在严格条件下杂交的核苷酸的核苷酸序列编码,并且抑制血管生成。
ROBO4蛋白可作为由两个或更多个亚单位构成的均或杂寡聚缔合物的整个或其部分存在。
ROBO4蛋白的氨基酸序列和/或其它性质在个体、组织、体液、细胞、含ROBO4蛋白级分、纯化的或部分纯化的ROBO4蛋白制剂等中,或在多个个体、组织、细胞、含ROBO4蛋白级分或ROBO4蛋白制剂之间可能既不相同也不均质。一个个体、组织、体液、细胞、含ROBO4蛋白级分、纯化的或部分纯化的ROBO4蛋白制剂等可包含多种类型的在氨基酸序列和/或性质上不同的ROBO4蛋白。或者,多个个体、组织、细胞、含ROBO4蛋白级分或ROBO4蛋白制剂在ROBO4蛋白的氨基酸序列和/或其它性质方面可存在差异。甚至这样的在氨基酸序列和/或性质上彼此不同的蛋白质全都包括在本发明的"ROBO4蛋白"中,只要它们具有上文中(i)至(iii)中描述的性质即可。
(iv)本发明的ROBO4蛋白可获自脊椎动物、优选哺乳动物、更优选啮齿类动物(例如小鼠或大鼠)或人的组织,更优选人或小鼠的组织,来源于这样的组织的细胞,这样的细胞的培养物等。这样的组织和细胞不受特别限制,只要它们包含ROBO4蛋白。其实例可包括关节组织、血液、淋巴、胸腺、脾和来源于它们中的任一个的细胞。优选组织和细胞是来源于具有血管生成的动物或患者的组织和细胞。然而,本发明的ROBO4蛋白的来源不限于上文中描述的来源,本发明的ROBO4蛋白还意欲包括甚至来源于其它动物物种、其它组织、其它细胞等的ROBO4蛋白,只要它们具有上文中(i)至(iii)中描述的性质。
本发明的ROBO4蛋白可以是天然和重组蛋白的任一种。ROBO4蛋白还意欲包括与另一种肽或蛋白质例如载体或标签的融合产物。ROBO4蛋白还意欲包括提供以化学修饰(包括聚合物(例如PEG)的添加)和/或生物修饰(包括糖链修饰)的形式。此外,本发明的ROBO4蛋白意欲包括ROBO4蛋白片段。具有上文中(ii)中描述的性质的ROBO4蛋白片段称为ROBO4蛋白的功能性片段。
(2-2)ROBO4基因
本发明的ROBO4基因包含下列(a)至(c)中任一项中描述的核苷酸序列(在下文中,称为"ROBO4基因序列"),由包含ROBO4基因序列的核苷酸序列组成,或由ROBO4基因序列组成:
(a)由SEQ ID NO:1(图13)所示的核苷酸序列;
(b)与由与SEQ ID NO:1(图13)所示的核苷酸序列互补的核苷酸序列组成的核苷酸在严格条件下杂交、并且编码抑制血管生成的多肽的氨基酸序列的核苷酸序列;和
(c)包含具有1至150、1至140、1至130、1至120、1至110、1至100、1至90、1至80、1至70、1至60、1至50、1至45、1至40、1至30、1至25、1至20、1至15、1至10、1至8、1至6、1至5、1至4、1至3、1或2或1个碱基的置换、缺失、添加或插入的由SEQ ID NO:1(图13)所示的核苷酸序列、并且编码抑制血管生成的多肽的氨基酸序列的核苷酸序列。
ROBO4基因在具有伴随血管生成的疾病(例如增生性糖尿病视网膜病变)的患者的纤维血管膜中的血管或瘤内血管中过表达。此外,ROBO4基因似乎在来源于患有被认为涉及血管生成的疾病(例如渗出性年龄相关性黄斑变性、黄斑水肿、动脉粥样硬化、晶体后纤维增生症、血管瘤、慢性炎症、眼部新生血管性疾病、增生性视网膜病变、新生血管性青光眼、角膜组织移植物或其它组织移植物的免疫排斥、类风湿关节炎、银屑病、急性炎症、脓毒症或肥胖症)的患者或来自这些疾病的动物模型的组织或血液级分中过表达。
ROBO4基因的表达和表达水平可利用ROBO4基因转录产物和ROBO4蛋白的任一种作为指标来进行测定,以及可通过RT-PCR、Northern印迹杂交等(对于前一指标)和通过免疫测定(例如,酶联免疫吸附测定;在下文中,称为"ELISA")等(对于后一指标)来测定。
(2-3)蛋白质的制备
本发明的ROBO4蛋白可从动物组织(包括体液)、来源于所述组织的细胞或所述细胞的培养物纯化或分离,以及通过基因重组、体外翻译、化学合成等来制备。
(2-3-1)天然ROBO4的纯化或分离
天然ROBO4蛋白可以从例如来源于患有血管生成性疾病(例如渗出性年龄相关性黄斑变性、糖尿病视网膜病变、黄斑水肿、良性或恶性肿瘤、动脉粥样硬化、晶体后纤维增生症、血管瘤、慢性炎症、眼部新生血管性疾病、增生性视网膜病、新生血管性青光眼、角膜组织移植物或其它组织移植物的免疫排斥、类风湿关节炎、银屑病、急性炎症、脓毒症或肥胖症)的患者或非人动物的组织(包括体液、细胞等)、来源于所述组织的细胞或所述细胞的培养物纯化或分离。这样的非人动物还包括这些疾病的模型动物。用于模型制备的动物不受特别地限制,只要它们是脊椎动物。所述动物优选为哺乳动物,更优选啮齿类动物(例如小鼠或大鼠),更优选小鼠或大鼠。这样的患者或模型动物的组织和细胞不受特别限制,只要它们包含ROBO4蛋白。其实例可包括关节组织、血液、淋巴、胸腺、脾和来源于它们中任一个的细胞。优选组织和细胞是来源于具有血管生成或显示类似症状的患者或模型动物。然而,本发明的ROBO4蛋白的来源不限于上文中描述的来源,本发明的ROBO4蛋白可来源于其它其它动物物种、其它组织、其它细胞等。
从这样的组织、细胞、细胞培养物等的纯化或分离可通过本领域技术人员公知的方法的组合例如分级分离和层析来进行。这样的方法包括但不限于盐析、凝胶过滤、离子交换层析、亲和层析、疏水层析、正相或反相层析等。可制备与抗ROBO4单克隆抗体交联的亲和凝胶,将其加载至柱子,从而制备用于亲和层析的柱子。将含ROBO4蛋白的粗制或部分纯化的级分添加至这样的柱子。随后,利用无菌磷酸缓冲盐溶液(PBS)除去非特异性吸附的物质,随后可向其中加入用于洗脱的缓冲液从而选择性收集ROBO4蛋白。可将含ROBO4蛋白的溶液经历凝胶过滤或经历缓冲液置换和/或使用浓缩器(例如Centriprep)浓缩。
(2-3-2)重组ROBO4蛋白的制备
本发明的ROBO4蛋白还可以重组形式来进行制备。具体地,利用编码ROBO4蛋白或ROBO4蛋白片段的氨基酸序列的基因转染宿主细胞,并且从所述细胞的培养物收集ROBO4蛋白。例如,将ROBO4基因或其片段插入表达载体。随后,用所得的重组载体转染原核或真核宿主细胞,并将所获得的重组细胞温育从而表达ROBO4蛋白。可使用本领域已知的表达模式,例如分泌表达、可溶性形式的细胞内表达或包涵体法。同样地,不仅可将ROBO4蛋白作为具有与天然ROBO4蛋白相同的氨基末端(N-末端)和/或羧基末端(C-末端)的分子表达,而且还可将其作为与分泌信号、细胞内定位信号、用于亲和纯化的标签或伴侣肽的融合蛋白表达。可通过适当的操作组合(例如(2-3-1)天然ROBO4蛋白的纯化或分离中描述的分级分离和层析)来从这样的重组细胞培养物纯化或分离ROBO4蛋白。
ROBO4基因或其片段可通过本领域技术人员公知的方法来制备。
其实例可包括:利用ROBO4 cDNA表达文库作为模板,使用一组能够特异性扩增所述序列的引物进行的聚合酶链式反应(在下文中,称为"PCR";Saiki,R.K.等,Science(1988)239,p.487-489);利用用于ROBO4表达的mRNA级分作为模板,使用能够反转录所述序列的引物和一组能够特异性扩增该序列的引物进行的反转录PCR(在下文中,称为"RT-PCR");使用免疫测定进行的表达克隆;和使用纯化的ROBO4蛋白的部分氨基酸序列进行的cDNA克隆。
(2-3-3)体外翻译
本发明的ROBO4蛋白还可通过体外翻译来制备。这样的翻译法不受特别限制,只要其为使用无细胞翻译系统(包括转录和翻译所必需的酶、底物和能量物质)的方法即可。其实例可包括使用由Roche Diagnostics生产的快速翻译系统(Rapid Translation System,RTS)的方法。
(2-3-4)化学合成
本发明的ROBO4蛋白还可通过化学合成来制备。化学合成法的实例可包括固相肽合成法(例如Fmoc合成和Boc合成法)。
3.抗ROBO4抗体
(3-1)抗ROBO4抗体的类型
本发明的抗体可以是单克隆和多克隆抗体的任一种。本发明的单克隆抗体的实例可包括非人动物来源的抗体(非人动物抗体)、人来源的抗体(人抗体)、嵌合抗体以及人源化抗体,优选嵌合抗体、人源化抗体和人来源的抗体(人抗体),更优选人源化抗体和人来源的抗体(人抗体)。
非人动物抗体的实例可包括来源于脊椎动物(例如哺乳动物和鸟类)的抗体。哺乳动物来源的抗体的实例可包括啮齿类动物来源的抗体(例如小鼠抗体和大鼠抗体)。鸟类来源的抗体的实例可包括鸡抗体。
嵌合抗体的实例可包括但不限于包含与人抗体(人免疫球蛋白)恒定区结合的非人动物抗体来源的可变区的抗体。非人动物抗体来源的可变区的实例可包括来源于随后描述的MAb1的重链和轻链可变区。
人源化抗体的实例可包括但不限于移植有非人动物抗体的可变区中的CDR的人抗体(人免疫球蛋白可变区)、移植有所述CDR以及非人动物抗体的构架区的部分序列的人抗体,和已用人抗体氨基酸替代这些人源化抗体的任一种中的一个或两个或更多个非人动物抗体来源氨基酸的抗体。非人动物抗体的可变区中的CDR的实例可包括来源于随后描述的MAb1的重链可变区中的CDRH1至3和轻链可变区中的CDRL1至3。
人抗体不受特别限制,只要其为识别本发明的抗原的抗体。其实例可包括结合与被具有本发明的的抗体CDR的抗体结合的位点相同的位点的人抗体,和结合与被上述MAb1结合的位点相同的ROBO4上的位点的人抗体。
根据本发明的抗体可以是由来源于多个不同抗体的位点构成的抗体。其实例可包括包含在众多不同抗体中交换的重链和/或轻链的抗体、包含在其中交换的全长重链和/或轻链的抗体、包含在其中交换的可变区或恒定区的抗体以及包含在其中交换的全部或一些CDR的抗体。嵌合抗体的重链和轻链可变区可来源于本发明的不同抗体。人源化抗体的重链和轻链可变区中的CDRH1至3和CDRL1至3可来源于两个或更多个本发明的不同抗体。人抗体的重链和轻链可变区中的CDRH1至3和CDRL1至3可以是由本发明的两个或更多个不同抗体具有的CDR的组合。
本发明的单克隆抗体的同种型不受特别限制,其实例可包括IgG(例如IgG1、IgG2、IgG3和IgG4)、IgM、IgA(例如IgA1和IgA2)、IgD和IgE,并且可优选地包括IgG和IgM,更优选IgG2。单克隆抗体的同种型和亚类可通过例如奥克特洛尼测验(Ouchterlony test)、ELISA、放射免疫测定(在下文中,称为"RIA")来测定。可使用用于鉴定的市售试剂盒(由Bio-Rad Laboratories,Inc.生产的小鼠分型试剂盒(Mouse Typer Kit),由AbD Serotec生产的大鼠单克隆抗体分亚型试剂盒(RAT MONOCLONAL ANTIBODY ISOTYPING TEST KIT))。
(3-2)抗ROBO4抗体的结合特异性
本发明的抗体识别ROBO4蛋白。换句话说,本发明的抗体结合ROBO4蛋白。这样的抗体称为"抗ROBO4抗体"。此外,本发明的优选抗体特异性识别ROBO4蛋白。换句话说,本发明的优选抗体特异性结合ROBO4蛋白。此外,本发明的更优选抗体特异性结合由ROBO4蛋白具有的Ig样结构域。这样的Ig样结构域的实例可包括Ig样结构域1和Ig样结构域2。本发明的更优选抗体识别由SEQ ID NO:2的氨基酸No.132至209的氨基酸序列组成的区域。本发明的抗体结合人ROBO4蛋白、猴,优选食蟹猴ROBO4蛋白和兔ROBO4蛋白,但不结合小鼠和大鼠ROBO4蛋白(实施例4)-3和实施例11)-4中的物种交叉反应性)。
在本发明中,"特异性识别",即"特异性结合"意指不是非特异性吸附的结合。用于确定结合是特异性与否的标准的实例可包括解离常数(在下文中,称为"KD")。本发明的优选抗体具有1×10-5或更低,5×10-6或更低,2×10-6或更低,或1×10-6或更低,更优选5×10-7或更低,2×10-7或更低,或1×10-7或更低,乃至更优选5×10-8或更低,2×10-8或更低,或1×10-8或更低,更优选5×10-9或更低,2×10-9或更低,或1×10-9或更低,最优选5×10-10或更低,2×10-10或更低,或1×10-10或更低的对于ROBO4蛋白的KD值。更具体地,本发明的优选抗体具有2×10-8或更低,更优选1×10-8或更低,更优选5×10-9或更低的对于ROBO4蛋白的KD值。
在本发明中,抗体对抗原的结合可通过ELISA、RIA、表面等离子体共振(在下文中,称为"SPR")分析等来测定或确定。用于SPR分析的设备的实例可包括BIAcore(TM)(由GE Healthcare Bio-Sciences Crop.生产的)、ProteOn(TM)(由Bio-Rad Laboratories,Inc.生产的)、SPR-Navi(TM)(由BioNavis Oy Ltd.生产的)、Spreeta(TM)(由Texas Instruments Inc.生产的)、SPRi-PlexII(TM)(由Horiba,Ltd.生产的)和Autolab SPR(TM)(由Metrohm生产的)。抗体对细胞表面上表达的抗原的结合可通过流式细胞术等来测定。
(3-3)抗ROBO4抗体的体外抗血管生成活性
本发明的抗体在体外不存在交联抗体的情况下具有抗血管生成活性。已知某些抗体在体外不存在交联抗体的情况下不显示药理活性,但在体内不存在交联抗体的情况下显示药理活性(Cancer Cell(2011),19,p.101-113)。这可能是因为在体内发现白细胞表达具有与交联抗体的功能相同的功能的Fcγ受体(Nature(2008),8,p.34-47);因此,抗体通过在白细胞存在的情况下、甚至在交联抗体不存在时发生交联来显示药理活性。然而,在实际生物体中,病灶中白细胞的数目在个体间不同(Cancer Res(2011),71,5670-5677),据推测在个体间导致不同的抗体作用(显示依赖于由白细胞诱导的交联的药理活性)。本发明的抗体甚至在体外不存在交联抗体的情况下显示优良的抗血管生成活性。因此,本发明的抗体还可在体内具有不依赖于白细胞的数目的抗血管生成作用,从而在制药上是合适的。
抗血管生成活性意指抑制血管内皮细胞生长、迁移、管腔形成等的活性。体外抗血管生成活性可通过血管通透性、血管内皮细胞迁移或管腔形成测试来评价。
例如,用于这样的评价的血管通透性测试可包括将正常人脐静脉内皮细胞(HUVEC)接种至具有1μm孔径的Boyden小室的上层,以形成单层,随后测量透过所述细胞层的FITC-标记的葡聚糖等的量。透过细胞层的FITC-标记的葡聚糖的量可使用例如体外血管通透性测定(In Vitro Vascular Permeability Assay)(Cat.ECM640,由Millipore Corp.生产的)来测量。当以5μg/mL或更低的浓度添加的抗体显示抑制透过细胞层的FITC-标记的葡聚糖的量的效果时,该抗体可被评价为对血管通透性具有抑制作用和具有抗血管生成活性。本发明的抗体在上述测量条件下在优选5μg/mL或更低,更优选1μg/mL或更低,特别优选0.5μg/mL或更低的浓度上,显示抗血管通透性的抑制活性。
用于这样的评价的细胞迁移测试可包括将HUVEC接种于具有3至8μm的孔径的Boyden小室的上层,将含有内皮细胞迁移促进剂(例如VEGF)的培养基添加至下层,并测量迁移至下层的细胞的数目。当抗体显示减少迁移HUVEC细胞的数目的作用时,该抗体可被评价为具有对血管内皮细胞迁移的抑制作用,并且具有抗血管生成活性。迁移细胞的数目可使用例如血管内皮细胞迁移测定系统(Cat.354143,由BD Biosciences生产的)来测量。本发明的抗体在上述测量条件下在优选5μg/mL或更低,更优1μg/mL或更低,特别优选0.5μg/mL或更低的浓度上,显示抗细胞迁移的抑制活性。
用于这样的评价的管腔形成测试可包括将HUVEC接种于利用基质胶(Matrigel)涂覆的细胞培养容器,和测量通过HUVEC在基质胶上形成的管腔结构的分支点的数目、管长度等。当抗体显示减少管腔结构的分支点的数目或管的长度的作用时,该抗体可被评价为具有对管腔形成的抑制作用和具有抗血管生成活性。管腔结构的分支点的数目或管的长度可以使用例如血管内皮细胞管形成测定系统(Cat.354149,由BD Biosciences生产的)来测量。本发明的抗体在上述测量条件下在优选5μg/mL或更低,更优选1μg/mL或更低,特别优选0.5μg/mL或更低的浓度上,显示抗管腔形成的抑制活性。
然而,这样的测定系统不限于这些测试,只要其能够测定由ROBO4蛋白诱导的血管生成及其抑制作用。
交联抗体意指结合本发明的抗体的Fc区域并且用于交联本发明的两个或更多个抗体分子的抗体。例如,当本发明的抗体的Fc区来源于小鼠时,交联抗体是指这样的抗体,所述抗体结合小鼠Fc区域,并且通过本发明的这两个抗体分子分别在交联抗体的两个结合位点上的结合而缔合两个或更多个本发明的抗体分子。
短语"在交联抗体不存在的情况下具有抗血管生成活性"意指抗体在与血管生成抑制相关的评价系统(例如上述评价系统)中,甚至在不与交联抗体共存在的情况下显示抗血管生成作用。
短语"在交联抗体存在的情况下具有抗血管生成活性"意指抗体在与血管生成相关的评价系统(例如上述抗血管生成活性评价系统)中在交联抗体不存在的情况下不显示抗血管生成活性,但当与一种或多种交联抗体分子,优选两种或更多种交联抗体共存在的情况下,相对于一个本发明的抗体分子而言显示抗血管生成活性。
(3-4)抗ROBO4抗体的抗血管生成的体内阻抑或抑制活性
本发明的抗体在体内阻抑或抑制血管生成。抗血管生成的体内阻抑或抑制活性可按照标准方法利用动物疾病模型来评价。例如,在后面实施例4)-6中描述的激光诱导的脉络膜新生血管化模型被广泛地用作血管生成的疾病模型,并且可将新形成的血管的数目作为评分来用于评价。同样,例如,在患者的情况下,肿瘤样品还可在施用本发明的抗体之前和之后通过活组织检查从肿瘤患者收集,并且他们的瘤内血管的血管密度可通过免疫组化分析(immunohistochemical analysis,IHC)测量,以给新形成的血管的量评分。
(3-5)利用抗ROBO4抗体激活下游信号
可将本发明的抗ROBO4抗体用于评价系统,所述评价系统使用显示一些诱导的对ROBO4蛋白的反应的细胞系或原代培养细胞。这样的细胞系的实例可包括小鼠血管内皮细胞系(ATCC NO.CRL-2779)。这样的原代培养细胞的实例可包括小鼠血管内皮细胞和人血管内皮细胞。
本发明的抗体是抗ROBO4的激动性(agonistic)抗体。具体地,本发明的抗体结合ROBO4并且激活ROBO4的下游信号。因此,本发明的抗体的抗血管生成作用可利用ROBO4下游信号的激活作为指标来进行评价。ROBO4下游信号的实例可包括IL-8启动子活性。相较于不表达人ROBO4的细胞,在表达全长人ROBO4的细胞中IL-8启动子活性显著增强,而在表达缺失细胞内结构域的人ROBO4的细胞中几乎未被观察到。因此,IL-8启动子活性的增强表明检测到ROBO4信号的激活(实施例3)。IL-8启动子活性可以例如通过将抗ROBO4抗体添加至或将抗ROBO4抗体与交联抗体共添加至用具有IL-8启动子序列插入物的报告载体和人ROBO4表达质粒转染的细胞,随后测定报道分子活性来进行评价。
(3-6)抗ROBO4小鼠单克隆抗体和嵌合抗体
MAb1为通过实施例2中描述的方法获得的抗ROBO4小鼠单克隆抗体。
编码MAb1的重链可变区的cDNA的核苷酸序列示于SEQ ID NO:30(图15)中,其氨基酸序列示于SEQ ID NO:31(图16)中。CDRH1的氨基酸序列示于SEQ ID NO:44(图25)中;CDRH2的氨基酸序列示于SEQ ID NO:46(图26)中;并且CDRH3的氨基酸序列示于SEQ ID NO:48(图27)中。编码MAb1的轻链可变区的cDNA的核苷酸序列示于SEQ ID NO:32(图17)中,其氨基酸序列示于SEQ ID NO:33(图18)中。CDRL1的氨基酸序列示于SEQ ID NO:50(图28)中;CDRL2的氨基酸序列示于SEQ ID NO:52(图29)中;并且CDRL3的氨基酸序列示于SEQ ID NO:54(图30)中。
本发明的抗体优选显示减弱的对蛋白质降解或氧化的敏感性、增强的生物活性、增强的结合抗原的能力或赋予其的理化或功能性质等。这样的抗体突变体的实例可包括具有通过保守氨基酸置换从原始抗体的氨基酸序列衍生的氨基酸序列的抗体。保守氨基酸置换是在与氨基酸侧链相关的氨基酸组中发生的置换。
优选氨基酸组如下:酸性组,包括天冬氨酸和谷氨酸;碱性组,包括赖氨酸、精氨酸和组氨酸;非极性组,包括丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸和色氨酸;以及不带电荷的极性家族,包括甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸和酪氨酸。其它优选氨基酸组如下:脂肪族羟基组,包括丝氨酸和苏氨酸;含酰胺组,包括天冬酰胺和谷氨酰胺;脂肪族组,包括丙氨酸、缬氨酸、亮氨酸和异亮氨酸;和芳香族组,包括苯丙氨酸、色氨酸和酪氨酸。优选在不减弱原始抗体的抗原结合活性的情况下进行抗体突变体中的这样的氨基酸置换。
具有通过保守氨基酸置换从本发明的MAb1的氨基酸序列衍生的氨基酸序列的抗体突变体,以及包含通过保守氨基酸突变从MAb1-来源的CDRH1至3和CDRL1至3的任一个的氨基酸序列衍生的CDR氨基酸序列的小鼠抗体、大鼠抗体、嵌合抗体、人源化抗体、人抗体等也包括在本发明中。
本发明的抗体的恒定区不受特别限制。优选地,来源于人抗体的那些抗体用于本发明的抗体以治疗或预防人的疾病。人抗体的重链恒定区的实例可包括Cγ1、Cγ2、Cγ3、Cγ4、Cμ、Cδ、Cα1、Cα2和Cε。人抗体的轻链恒定区的实例可包括Cκ和Cλ。
编码以本发明的小鼠-人IgG1-型嵌合抗体为例的cMAb1-1的含分泌信号的轻链的核苷酸序列及其氨基酸序列以及编码其重链的核苷酸序列和其氨基酸序列分别示于SEQ ID NO:37、38、39和40(图19、20、21和22)中。同样地,编码以本发明的小鼠-人IgG2-型嵌合抗体为例的cMAb1-2的含分泌信号的轻链的核苷酸序列和其氨基酸序列以及编码其重链的核苷酸序列和其氨基酸序列分别示于SEQ ID NO:37、38、41和42(图19、20、23和24)中。
(3-7)抗ROBO4抗体的功能性片段
根据一个方面,本发明提供了本发明的抗ROBO4抗体的功能性片段。抗体的功能性片段意指维持抗体或于后面(3-10)中描述的其修饰形式的至少部分功能的片段。所述抗体的这样的功能的实例通常可包括抗原结合活性、抗原活性调节活性、抗体依赖性细胞毒活性和补体依赖性细胞毒活性。本发明的抗ROBO4抗体的功能的实例可包括ROBO4蛋白结合活性、抗血管生成活性和ROBO4下游信号激活作用。更具体地,具有本发明的抗ROBO4抗体显示的上述活性(3-3)至(3-5)的全部或一些的任何功能性片段包括在本发明的抗体的功能性片段中。
抗体的功能性片段不受特别限制,只要其为维持抗体或其修饰形式的至少部分活性的抗体片段。其实例可包括但不限于Fab、F(ab')2、Fv、包含通过适当接头连接的重链和轻链Fv的单链Fv(scFv)、双抗体(diabodies)、线性抗体、从抗体片段形成的多特异性抗体以及Fab'(其为通过在还原条件下处理F(ab')2获得的抗体可变区的单价片段)。包含除本发明的抗体的片段外的部分(moiety)的分子,如在具有接头部分的scFv中,也包括在本发明的抗体的功能性片段的含义中。
通过缺失其氨基末端和/或羧基末端上的1至数个或更多个氨基酸而从抗体衍生的并且维持抗体的至少部分功能的分子也包括在本发明的抗体的功能性片段的含义中。
本发明的抗体或其功能性片段可以是具有针对至少2个类型的不同抗原的特异性的多特异性抗体。多特异性抗体不限于双特异性抗体(所述双特异性抗体结合2种类型的不同抗原),并且具有针对3或更多个类型的不同抗原的特异性的抗体也包括在本发明的"多特异性抗体"的含义中。
本发明的多特异性抗体可以是全长抗体或其功能性片段(例如,双特异性F(ab')2抗体)。双特异性抗体还可通过结合2个类型的抗体的重链和轻链(HL对)来制备。双特异性抗体还可通过融合2或更多个类型的产生单克隆抗体的杂交瘤以制备产生双特异性抗体的融合细胞来获得(Millstein等,Nature(1983)305,p.537-539)。还可以以与上述方式相同的方式制备多特异性抗体。
根据一个方面,本发明的抗体是单链抗体(单链Fv;在下文中,称为"scFv")。scFv通过经由多肽接头连接抗体的重链与轻链可变区来获得(Pluckthun,The Pharmacology of Monoclonal Antibodies,113,ed Rosenburg and Moore,Springer Verlag,New York,p.269-315(1994),Nature Biotechnology(2005),23,p.1126-1136)。此外,包含通过多肽接头连接的2个scFv的双-scFv可用作双特异性抗体。此外,包含三个或更多个scFv的多-scFv还可用作多特异性抗体。
本发明包括包含通过适当的接头连接的抗体的全长重链与轻链序列的单链免疫球蛋白(Lee,H-S,等,Molecular Immunology(1999)36,p.61-71;Shirrmann,T.等,mAbs(2010),2,(1)p.1-4)。这样的单链免疫球蛋白可被二聚化,从而维持与原先为四聚体的抗体的结构和活性相似的结构和活性。同样地,本发明的抗体可以是具有单个重链可变区并且不具有轻链序列的抗体。这样的抗体称为单结构域抗体(sdAb)或纳米抗体(nanobody),并且已报导其维持结合抗原的能力(Muyldemans S.等,Protein Eng.(1994)7(9),1129-35,Hamers-Casterman C.等,Nature(1993)363(6428)446-8)。这些抗体也包括在根据本发明的抗体的功能性片段的含义中。
(3-8)抗人ROBO4人源化抗体(在下文中为"抗ROBO4人源化抗体")
根据一个方面,本发明提供了人源化抗体或其功能性片段。本发明的抗ROBO4人源化抗体或其功能性片段具有抗血管生成活性,并且优选地在体内具有抗血管生成活性。优选地,人源化抗体或其功能性片段特异性结合ROBO4蛋白。此外,人源化抗体或其功能性片段是抗ROBO4的激动性抗体,并且激活其下游信号。此外,人源化抗体或其功能性片段在体外不存在交联抗体的情况下阻抑或抑制血管内皮细胞迁移。
本发明的人源化抗体的实例可包括已用非人动物抗体的互补决定区(CDR)替代MAb的CDR的人来源的抗体(参见Nature(1986)321,p.522-525),和通过CDR移植法(国际公布号WO90/07861)移植了CDR序列和构架区的一些氨基酸残基的人抗体。此外,通过用其它氨基酸残基置换每一个CDR中的1至3个氨基酸残基从人源化抗体衍生的变体也包括在本发明的抗体中,只要变体具有活性(3-3)至(3-5)的全部或一些活性。
本发明的抗ROBO4人源化抗体或其功能性片段的优选实例可包括由重链和轻链组成并且识别本发明的ROBO4蛋白的抗体,和维持抗体的ROBO4蛋白结合活性的抗体的部分,所述重链具有包含由SEQ ID NO:44(图25)所示的氨基酸序列组成的CDRH1、由SEQ ID NO:46(图26)所示的氨基酸序列或通过1个氨基酸的置换从SEQ ID NO:46的氨基酸序列衍生的氨基酸序列组成的CDRH2,和由SEQ ID NO:48(图27)所示的氨基酸序列组成的CDRH3的可变区,所述轻链具有包含由SEQ ID NO:50(图28)所示的氨基酸序列或通过1至3个氨基酸的置换从SEQ ID NO:50的氨基酸序列衍生的氨基酸序列组成的CDRL1、由SEQ ID NO:52(图29)所示的氨基酸序列组成的CDRL2,和由SEQ ID NO:54(图30)所示的氨基酸序列组成的CDRL3的可变区。
CDRH2中的氨基酸置换的实例可包括CDRH2中由SEQ ID NO:46的氨基酸No.4所示的氨基酸的置换。具体地,可用谷氨酰胺替代SEQ ID NO:46的氨基酸No.4天冬酰胺。为此目的待置换的氨基酸不受限制,只要所得的抗体具有由本发明的抗ROBO4抗体显示的活性(3-3)至(3-5)的全部或一些活性。
CDRL1中的氨基酸置换的实例可包括CDRL1中由SEQ ID NO:50的氨基酸No.9、11和13所示的氨基酸的任意1至3个,优选3个的置换。具体地,SEQ ID NO:50的丝氨酸(氨基酸No.9)、甘氨酸(氨基酸No.11)和苏氨酸(氨基酸No.13)可被选自谷氨酸、赖氨酸和亮氨酸的氨基酸,优选分别被谷氨酸、赖氨酸和亮氨酸替代。为此目的待置换的氨基酸不受限制,只要所得的抗体具有本发明的抗ROBO4抗体显示的活性(3-3)至(3-5)的全部或一些活性。
已报导肽或蛋白质中的天冬酰胺残基在一些条件下容易进行脱酰胺作用(Gerger等:The Journal of Biological Chemistry第262卷No.2,785-794,1987),从而上述CDR中的氨基酸置换可提高本发明的人源化抗体的稳定性。
具有这些CDRH的更优选人源化抗体的重链可变区的实例可包括SEQ ID NO:56(图32)的氨基酸No.20至137所示的氨基酸序列(其中CDRH1、CDRH2和CDRH3分别由SEQ ID NO:56(图32)的氨基酸No.50至54、69至85和118至126表示)、SEQ ID NO:58(图34)的氨基酸No.20至137所示的氨基酸序列(其中CDRH1、CDRH2和CDRH3分别由SEQ ID NO:58(图34)的氨基酸No.50至54、69至85和118至126表示)、SEQ ID NO:60(图36)的氨基酸No.20至137所示的氨基酸序列(其中CDRH1、CDRH2和CDRH3分别由SEQ ID NO:60(图36)的氨基酸No.50至54、69至85和118至126表示)和SEQ ID NO:62(图38)的的氨基酸No.20至137所示的氨基酸序列(其中CDRH1、CDRH2和CDRH3分别由SEQ ID NO:60(图38)的氨基酸No.50至54、69至85和118至126表示)。具有这些CDL的更优选的人源化抗体的轻链可变区的实例可包括SEQ ID NO:64(图40)的氨基酸No.21至134所示的氨基酸序列(其中CDRL1、CDRL2和CDRL3分别由SEQ ID NO:64(图40)的氨基酸No.44至59、75至81和114至122表示)和SEQ ID NO:66(图42)的氨基酸No.21至134所示的氨基酸序列(其中CDRL1、CDRL2和CDRL3分别由SEQ ID NO:66(图42)的氨基酸No.44至59、75至81和114至122表示)。
更优选的人源化抗体的重链可变区和轻链可变区的更优选组合的实例可包括:包含由SEQ ID NO:58(图34)的氨基酸No.20至137所示的氨基酸序列组成的重链可变区和由SEQ ID NO:64(图40)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区的人源化抗体;包含由SEQ ID NO:58(图34)的氨基酸No.20至137所示的氨基酸序列组成的重链可变区和由SEQ ID NO:66(图42)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区的人源化抗体;包含由SEQ ID NO:62(图38)的氨基酸No.20至137所示的氨基酸序列线成的重链可变区和由SEQ ID NO:66(图42)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区的人源化抗体;包含由SEQ ID NO:62(图38)的氨基酸No.20至137所示的氨基酸序列组成的重链可变区和由SEQ ID NO:64(图40)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区的人源化抗体;包含由SEQ ID NO:56(图32)的氨基酸No.20至137所示的氨基酸序列组成的重链可变区和由SEQ ID NO:64(图40)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区的人源化抗体;以及包含由SEQ ID NO:60(图36)的氨基酸No.20至137所示的氨基酸序列组成的重链可变区和由SEQ ID NO:64(图40)的氨基酸No.21至134所示的氨基酸序列组成的轻链可变区的人源化抗体。
包含重链可变区与轻链可变区的更优选组合的全长人源化抗体的甚至更优选的实例可包括:包含由SEQ ID NO:58(图34)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:64(图40)的氨基酸No.21至239所示的氨基酸序列组成的轻链的人源化抗体(H-1140);包含由SEQ ID NO:58(图34)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:66(图42)的氨基酸No.21至239所示的氨基酸序列组成的轻链的人源化抗体(H-1143);包含由SEQ ID NO:62(图38)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:66(图42)的氨基酸No.21至239所示的氨基酸序列组成的轻链的人源化抗体(H-2143);包含由SEQ ID NO:62(图38)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:64(图40)的氨基酸No.21至239所示的氨基酸序列组成的轻链的人源化抗体(H-2140);包含由SEQ ID NO:56(图32)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:64(图40)的氨基酸No.21至239所示的氨基酸序列组成的轻链的人源化抗体(H-1040);和包含由SEQ ID NO:60(图36)的氨基酸No.20至463所示的氨基酸序列组成的重链和由SEQ ID NO:64(图40)的氨基酸No.21至239所示的氨基酸序列组成的轻链的人源化抗体(H-2040)。
本发明的最优选抗体为H-1140、H-1143、H-2140和H-2143。
H-1140具有如下性质:1)特异性结合人ROBO4但非ROBO1、ROBO2和ROBO3,2)具有3.9nM的针对人ROBO4的KD值,3)在40℃下维持针对人ROBO4的亲和力4周,4)抑制由选自VEGF、bFGF、HGF、PDGF-BB和SDF-1的一个或多个血管生成因子特别是VEGF或bFGF诱导的HUVEC迁移,5)在体内抑制血管生成,和6)在基于ISPRI Web的免疫原性筛选(EpiVax,Inc)中的低免疫原性。
H-1143具有如下性质:1)特异性结合人ROBO4但非ROBO1、ROBO2和ROBO3,2)具有3.5nM的针对人ROBO4的KD值,3)在40℃下维持针对人ROBO4的亲和力4周,4)抑制由选自VEGF、bFGF、HGF、PDGF-BB和SDF-1的一个或多个血管生成因子特别是VEGF或bFGF诱导的HUVEC迁移,5)在体内抑制血管生成,和6)在EpiScreenTM免疫原性测试(Antitope Ltd.)中的低免疫原性。
H-2140具有如下性质:1)特异性结合人ROBO4但非ROBO1、ROBO2和ROBO3,2)具有1.8nM的针对人ROBO4的KD值,3)在40℃下维持针对人ROBO4的亲和力4周,4)抑制由不同血管生成因子例如VEGF、bFGF、HGF、PDGF-BB和SDF-1特别是VEGF或bFGF诱导的HUVEC迁移,5)在体内抑制血管生成,和6)在EpiScreenTM免疫原性测试(Antitope Ltd.)中的低免疫原性。
H-2143具有如下性质:1)特异性结合人ROBO4但非ROBO1、ROBO2和ROBO3,2)具有1.7nM的针对人ROBO4的KD值,3)在40℃下维持针对人ROBO4的亲和力4周,4)抑制由不同血管生成因子例如VEGF、bFGF、HGF、PDGF-BB和SDF-1特别是VEGF或bFGF诱导的HUVEC迁移,5)在体内抑制血管生成,和6)在EpiScreenTM免疫原性测试(Antitope Ltd.)中的低免疫原性,和7)在对食蟹猴单次玻璃体内注射(2.75mg/眼)后,在临床体征、体重、摄食量、血液学、血液化学、病理学、视网膜电描记术上未显示重大变化。
包含与抗体例如H-1140、H-1143、H-2143、H-2140、H-1040和H-2040的氨基酸序列具有95%或更高,优选97%或更高,更优选99%或更高的同一性的氨基酸序列的抗体也包括在本发明的抗体中,只要抗体具有活性(3-3)至(3-5)的全部或一些活性。此外,具有在氨基酸序列上与包含重链可变区和轻链可变区的组合的抗体或包含重链和轻链的组合的抗体的CDR相同的CDR,并且具有除与其具有95%或更高,优选97%或更高,更优选99%或更高的同一性的CDR氨基酸序列外的氨基酸序列的抗体也包括在本发明的抗体中,只要抗体具有活性(3-3)至(3-5)的全部或一些活性。
(3-9)结合相同位点的抗体
与被本发明提供的抗体结合的位点"结合相同的位点的抗体"也包括在本发明的抗体中。与被某些抗体结合的位点"结合相同的位点的抗体"意指结合被抗体识别的抗原分子上的位点的另一种抗体。如果第二抗体结合被第一抗体结合的抗原分子上的部分肽或部分三维结构,则可确定第一和第二抗体结合相同位点。此外,通过确认第二抗体与第一抗体竞争对抗原的结合,即,第二抗体干扰第一抗体对抗原的结合(即使未确定特定结合位点的肽序列或三维结构),则可确定第一和第二抗体结合相同位点。此外,当第一和第二抗体结合相同位点并且第一抗体具有本发明的抗体的一个方面的作用特征,例如抗血管生成活性时,第二抗体也极其可能具有与其相同的活性。因此,如果第二抗ROBO4抗体结合被第一抗ROBO4抗体结合的位点,则可确定第一与第二抗体结合ROBO4蛋白上的相同位点。此外,通过确认第二抗ROBO4抗体与第一抗ROBO4抗体竞争对ROBO4蛋白的结合,第一和第二抗体可被确定为结合ROBO4蛋白上相同位点的抗体。
结合被本发明的MAb1识别的ROBO4蛋白上的位点的抗体也包括在本发明中。
抗体结合位点可通过本领域技术人员公知的方法例如免疫测定来测定。例如,一系列肽通过抗原的氨基酸序列的适当的C-末端或N-末端截断(truncation)来制备,并且研究抗体对其的反应性以大致确定识别位点。随后,合成更短的肽,可研究抗体对这些肽的反应性,从而确定结合位点。抗原片段肽可使用技术例如基因重组或肽合成来制备。
当抗体结合或识别抗原的部分构象时,可通过使用X射线结构分析鉴定抗原上靠近抗体的氨基酸残基来确定抗体的结合位点。
(3-10)抗ROBO4抗体或其功能性片段的修饰形式
本发明提供了抗体或其功能性片段的修饰形式。本发明的抗体或其功能性片段的修饰形式意指通过化学或生物学修饰提供的本发明的抗体或其功能性片段。化学修饰形式包括具有缀合有化学部分的氨基酸骨架的形式、具有化学修饰的N连接或O连接的碳水化合物链的形式等。所述化学部分或形式可以是有毒的或细胞毒性的。生物学修饰形式包括已经历翻译后修饰(例如,N-连接的或O-连接的糖基化、N-末端或C-末端加工、脱酰胺、天冬氨酸的异构化或甲硫氨酸的氧化)的形式、包含通过使用原核宿主细胞表达添加至N末端的甲硫氨酸残基的形式等。这样的修饰也意欲包括经标记允许检测或分离本发明的抗体或抗原的形式,例如酶标记形式、荧光标记形式或亲和标记形式。本发明的抗体或其功能性片段的这样的修饰形式有效用于改善本发明的原始抗体或其功能性片段的稳定性或血液潴留(blood retention)、减小抗原性、检测或分离抗体或抗原等。
化学修饰形式中包含的化学部分的实例可包括水溶性聚合物例如聚乙二醇、乙二醇/丙二醇共聚物、羧甲基纤维素、葡聚糖和聚乙烯醇。
生物修饰形式的实例可包括通过酶促处理、细胞处理等修饰的形式、与另一个肽(例如标签)融合(通过基因重组添加的)的形式和从表达内源或外源糖链修饰酶的宿主细胞制备的形式。
这样的修饰可在抗体或其功能性片段的任意位置或期望的位置上产生。或者,可在其中的一个或两个或更多个位置上产生相同的或两个或更多个不同的修饰。
在本发明中,"抗体片段的修饰形式"还意欲包括甚至"抗体的修饰形式的片段"。
例如,偶尔地,已知通过培养的哺乳动物细胞产生的抗体在其重链中缺乏羧基末端赖氨酸残基(Journal of Chromatography A,705:129-134(1995))。还已知偶尔地,重链的2个羧基末端氨基酸残基(即,甘氨酸和赖氨酸)丢失,并且新近位于羧基末端的脯氨酸残基被酰胺化(Analytical Biochemistry,360:75-83(2007))。然而,这些重链序列中的这样的缺乏或修饰既不影响抗体结合其抗原的能力也不影响抗体的效应子功能(补体激活、抗体依赖细胞毒性等)。因此,具有修饰的抗体和抗体的功能性片段也包括在本发明的抗体中。这样的抗体的实例可包括通过在重链的羧基末端删除或缺失1或2个氨基酸从本发明的抗体衍生的缺失突变体,和具有酰胺化残基(例如,重链的羧基末端位点上酰胺化的脯氨酸残基)的缺失突变体。然而,根据本发明的抗体的缺失突变体不限于上述类型,只要缺失突变体维持结合抗原的能力和活性(3-3)至(3-5)的全部或一些活性。构成根据本发明的抗体的两条重链可由选自全长重链和缺失突变体的重链的任一类型的重链组成,或可由选自其的任何两种类型的组合组成。缺失变体重链的定量比率易受例如产生根据本发明的抗体的培养的哺乳动物细胞的类型以及细胞的培养条件影响。这样的缺失变体重链如根据本发明的抗体的主要组分的实例可包括两条重链,所述两条重链都不存在一个羧基末端氨基酸残基。所有这些缺失变体都包括在根据本发明的抗体变体、抗体的功能性片段或其修饰形式中。
4.产生抗体的方法
(4-1)使用杂交瘤的方法
为制备本发明的抗ROBO4抗体,按照Kohler和Milstein的方法(Kohler和Milstein,Nature(1975)256,p.495-497,Kennet,R.ed.,Monoclonal Antibody,p.365-367,Prenum Press,N.Y.(1980)),利用ROBO4蛋白免疫的动物的脾分离产生抗ROBO4抗体的细胞。将所述细胞与骨髓瘤细胞融合,从而建立杂交瘤,可从这些杂交瘤的培养物获得单克隆抗体。
(4-1-1)抗原的制备
可以例如按照本说明书的其它段落中描述的天然或重组ROBO4蛋白制备法获得用于抗ROBO4抗体的制备的抗原。可这样制备的抗原的实例可包括ROBO4蛋白或包含具有其至少6个连续氨基酸的部分序列的ROBO4蛋白片段,以及还包含它们的添加至其的任意氨基酸序列或载体的衍生物(在下文中,统称为"ROBO4抗原")。
重组ROBO4抗原可通过用包含ROBO4抗原的氨基酸序列的核苷酸序列的基因转染宿主细胞,并从所述细胞的培养物收集抗原来制备。可以例如从具有血管生成的人或啮齿类动物组织、来源于所述组织的细胞或所述细胞的培养物纯化或分离天然ROBO4抗原。在无细胞体外翻译系统中从包含编码ROBO4抗原的氨基酸序列的核苷酸序列获得的ROBO4抗原也包括在本发明的"ROBO4抗原"中。
(4-1-2)抗ROBO4单克隆抗体的产生
通常通过下列步骤产生单克隆抗体:
(a)制备抗原,
(b)制备产生抗体的细胞,
(c)制备骨髓瘤细胞(myeloma cells)(在下文中,称为"骨髓瘤(myelomas)"),
(d)将产生抗体的细胞与骨髓瘤融合,
(e)筛选产生目标抗体的杂交瘤群体,和
(f)获得单个细胞克隆(克隆)。
该产生方法还包括:(g)培养杂交瘤的步骤,产生杂交瘤移植动物的步骤等,(h)必要时,测定或确定单克隆抗体的生物活性的步骤。
在下文中,将针对这些步骤详细地描述用于制备单克隆抗体的方法。然而,用于制备抗体的方法不限于它们,例如可使用除脾细胞和骨髓瘤外的产生抗体的细胞。
(a)制备抗原的步骤
可按照(2-3)中的上述ROBO4蛋白制备法制备抗原。
(b)制备产生抗体的细胞的步骤
将步骤(a)中获得的抗原与佐剂(例如弗氏完全或不完全佐剂或硫酸铝钾)混合,并用所得的抗原免疫实验室动物。可使用用于本领域中已知的杂交瘤制备法的任何实验室动物而无限制。具体地,例如,可使用小鼠、大鼠、山羊、绵羊、牛或马。从可容易获得的待与分离的产生抗体的细胞融合的骨髓瘤细胞的角度来看,待免疫的动物优选为小鼠或大鼠。
实际使用的小鼠和大鼠品系不受特别限制。例如,在小鼠的情况下,可使用A、AKR、BALB/c、BALB/cAnNCrj、BDP、BA、CE、C3H、57BL、C57BL、C57L、DBA、FL、HTH、HT1、LP、NZB、NZW、RF、R III、SJL、SWR、WB、129。例如,在大鼠的情况下,可使用Wistar、Low、Lewis、Sprague-Dawley、ACI、BN或Fischer。
这些小鼠和大鼠可获自实验动物培育者/配售者,例如CLEA Japan,Inc.或Charles River Laboratories Japan Inc.。
其中,鉴于与后面描述的骨髓瘤细胞的融合相容性,作为待免疫的动物,BALB/c小鼠品品系或Wistar和Low大鼠品系是特别优选的。
还鉴于人与小鼠抗原之间的同源性,还优选使用其除去自身抗体的生物学机制已被减弱的小鼠,即自身免疫疾病小鼠。
在该上下文中,这些小鼠或大鼠在免疫时优选为5于12周龄,更优选6至8周龄。
可使用例如Weir,D.M.,Handbook of Experimental Immunology第I、II、III卷,Blackwell Scientific Publications,Oxford(1987),Kabat,E.A.和Mayer,M.M.,Experimental Immunochemistry,Charles C Thomas Publisher Spigfield,Illinois(1964)的方法,利用ROBO4蛋白免疫动物。
抗体滴度确定法的实例可包括但不限于免疫测定(例如RIA和ELISA)。
来源于从被免疫的动物分离的脾细胞或淋巴细胞的产生抗体的细胞可按照本领域已知的方法,例如Kohler等人,Nature(1975)256,p.495,;Kohler等,Eur.J.Immnol.(1977)6,p.511,;Milstein等,Nature(1977),266,p.550,;Walsh,Nature,(1977)266,p.495,)的方法来制备。
在脾细胞的情况下,可采用一般方法,其包括切碎脾,将细胞通过不锈钢筛过滤,随后将所得的细胞漂浮在Eagle's最低必需培养其(MEM)等中,以分离产生抗体的细胞。
(c)制备骨髓瘤的步骤
用于细胞融合的骨髓瘤细胞不受特别限制,可从本领域已知的细胞系适当地选择来使用。考虑到从融合细胞选择杂交瘤的方便性,优选使用HGPRT(次黄嘌呤-鸟嘌呤,磷酸核糖基转移酶)缺陷型品系,即小鼠-来源的X63-Ag8(X63)、NS1-ANS/1(NS1)、P3X63-Ag8.U1(P3U1)、X63-Ag8.653(X63.653)、SP2/0-Ag14(SP2/0)、MPC11-45.6TG1.7(45.6TG)、FO、S149/5XXO、BU.l等、大鼠来源的210.RSY3.Ag.1.2.3(Y3)等或人来源的U266AR(SKO-007)、GM1500-GTG-A12(GM1500)、UC729-6、LICR-LOW-HMy2(HMy2)、8226AR/NIP4-1(NP41)等,所述品系的筛选方法已建立。这些HGPRT缺陷型品系可从例如美国典型培养物保藏中心(ATCC)获得。
将这些细胞在适当的培养基例如8-氮鸟嘌呤培养基[补充有谷氨酰胺、2-巯基乙醇、庆大霉素和胎牛血清(在下文中,称为"FCS")以及还补充有8-氮鸟嘌呤的RPMI-1640培养基]、Iscove's改良Dulbecco's培养基(在下文中,称为"IMDM")或Dulbecco's改良Eagle培养基(在下文中,称为"DMEM")中传代培养,并且在细胞融合之前于普通培养基[例如,含有10%FCS的ASF104培养基(由Ajinomoto Co.,Inc.生产的)]中传代培养3至4天以确保在细胞融合当天细胞的数目等于或大于2×107个细胞。
(d)产生抗体的细胞与骨髓瘤细胞融合的步骤
可按照本领域中已知的方法(Weir,D.M.,Handbook of Experimental Immunology第I、II、III卷,Blackwell Scientific Publications,Oxford(1987),Kabat,E.A.和Mayer,M.M.,Experimental Immunochemistry,Charles C Thomas Publisher Spigfield,Illinois(1964)等),在阻止细胞活力极度减弱的条件下将产生抗体的细胞与骨髓瘤细胞融合。例如,可使用化学方法(所述方法包括将产生抗体的细胞在高浓度聚合物(例如聚乙二醇)溶液中与骨髓瘤细胞融合)或使用电刺激的物理方法。
(e)筛选产生目标抗体的杂交瘤群体的步骤
用于通过细胞融合获得的杂交瘤的选择方法不受特别限制,通常使用HAT(次黄嘌呤-氨基蝶呤-胸苷)选择法(Kohler等,Nature(1975)256,p.495;Milstein等,Nature(1977)266,p.550)。该方法对于使用HGPRT-缺陷型骨髓瘤细胞系获得杂交瘤是有效的,所述细胞系在氨基蝶呤存在的情况下不能存活。具体地,可在HAT培养基中培养未融合的细胞和杂交瘤,从而使得仅抗氨基蝶呤的杂交瘤能够被选择保留和生长。
(f)获得单个细胞克隆的步骤(克隆)
可使用本领域已知的方法例如甲基纤维素、软琼脂糖或有限稀释法(参见例如,Barbara,B.M.和Stanley,M.S.:Selected Methods in Cellular Immunology,W.H.Freeman and Company,San Francisco(1980))克隆杂交瘤。有限稀释法是优选的。
(g)培养杂交瘤的步骤和产生杂交瘤移植动物的步骤
可培养选择的杂交瘤,从而产生单克隆抗体。优选地,克隆期望的杂交瘤,随后将其经历抗体产生。
可从杂交瘤的培养物收集由该杂交瘤产生的单克隆抗体。此外,还可从用单克隆抗体基因转染的细胞的培养物收集重组抗体。此外,可将杂交瘤腹膜内注射至相同品系的小鼠(例如,上述BALB/cAnNCrj)或Nu/Nu小鼠,并让其生长。随后,还可从它们的腹水收集单克隆抗体。
(h)测定或确定单克隆抗体的生物活性的步骤
可根据目的选择和使用各种生物学测试。
(4-2)细胞免疫法
可将表达天然ROBO4蛋白的细胞、表达重组ROBO4蛋白或其片段的细胞等用作免疫原,从而通过上述杂交瘤法来制备抗ROBO4抗体。
表达天然ROBO4蛋白的细胞的实例可包括来源于患有血管生成性疾病(例如增生性糖尿病视网膜病变或肿瘤)的患者的细胞,和来源于这些患者的组织的细胞。这样的细胞优选为血管内皮细胞,但不限于它们。在一次免疫中以1×105至1×109个细胞,优选1×106至1×l08个细胞,更优选0.5至2×107个细胞,更优选1×107个细胞的量使用这些表达ROBO4蛋白的细胞。可根据ROBO4蛋白的表达水平改变用于免疫的细胞的数目。通常可通过腹膜内途径和通过皮内注射途径等施用免疫原。(4-1-2)中描述的方法可用于杂交瘤制备法。
(4-3)基因重组和宿主细胞
为了制备本发明的抗体,用包含编码其重链的氨基酸序列的核苷酸序列的核苷酸(重链核苷酸)和包含编码其轻链的氨基酸序列的核苷酸序列的核苷酸(轻链核苷酸),或用包含重链核苷酸的插入物的载体和包含轻链核苷酸的插入物的载体转染宿主细胞,随后培养所述细胞,可从培养物收集抗体。可将重链和轻链核苷酸插入一个载体中。
原核或真核细胞可用作宿主细胞。当真核细胞用作宿主时,可使用动物细胞、植物细胞或真核微生物。
动物细胞的实例可包括哺乳动物来源的细胞,即,猴来源的COS细胞(Gluzman,Y.Cell(1981)23,p.175-182,ATCC CRL-1650)、小鼠成纤维细胞NIH3T3(ATCC No.CRL-1658)、小鼠NSO细胞系(ECACC)、中国仓鼠卵巢细胞(CHO细胞,ATCC CCL-61)、其二氢叶酸还原酶缺陷型品系(CHOdhfr-:Urlaub,G.和Chasin,L.A.Proc.Natl.Acad.Sci.U.S.A.(1980)77,p.4126-4220)、由Lonza Biologies开发的CHOKI SV、来源于禽类例如鸡的细胞和来源于昆虫的细胞。
同样地,本发明的宿主细胞包括可产生抗体蛋白的细胞,其中连接于抗体蛋白的糖链的结构被修饰,其中具有修饰的抗体的生物活性优选相较于无修饰的抗体得到增强。本发明的这样的宿主细胞的实例包括CHO细胞,所述CHO细胞可产生具有结合于抗体的Fc区域的复杂N-糖苷-连接的糖链的抗体蛋白,其中在结合于抗体的Fc区域的总的复杂N-糖苷-连接的糖链中,其中岩藻糖不结合于糖链的还原端中的N-乙酰葡糖胺的糖链的比率为20%或更多(WO2000/61739,WO2002/31140)。
真核微生物的实例可包括酵母。原核细胞的实例可包括大肠杆菌(E.coli)和枯草芽孢杆菌(Bacillus subtilis)。
优选使用哺乳动物来源的细胞,更优选使用CHO细胞,乃至更优选将CHOK1SV用作产生本发明的抗ROBO4抗体的宿主细胞。
用于分泌本发明的抗体(来源于不同动物物种的单克隆抗体,大鼠抗体、小鼠抗体、嵌合抗体、人源化抗体、人抗体等)的信号肽不限于与抗体相同的物种、相同的类型和相同的亚型(subtype)的抗体的分泌信号或抗体自身的分泌信号。可选择和使用与其不同类型或亚型的抗体的任何分泌信号或来源于与其不同真核生物物种或原核生物物种的蛋白质的任何分泌信号。
(4-4)设计和制备人源化抗体的方法
人源化抗体的实例可包括但不限于CDR已被非人动物抗体的CDR替代的人来源的抗体(参见Nature(1986)321,p.522-525)、通过CDR移植法(参见WO90/07861和US6972323)移植有CDR序列和构架区的一些氨基酸残基的人抗体,和已用人抗体氨基酸替代这些人源化抗体的任何抗体中的一个或两个或更多个非人动物抗体来源的氨基酸的抗体。
(4-5)制备人抗体的方法
本发明的抗体的其它实例可包括人抗体。抗ROBO4人抗体意指由人来源的抗体的氨基酸序列组成的抗ROBO4抗体。抗ROBO4人抗体可通过使用具有包含人抗体重链-和轻链-编码基因的人基因组DNA片段的产生人抗体的小鼠的方法来获得(参见Tomizuka,K.等,Nature Genetics(1997)16,p.133-143,;Kuroiwa,Y.等,Nuc.Acids Res.(1998)26,p.3447-3448;Yoshida,H.等,Animal Cell Technology:Basic and Applied Aspects第10卷,p.69-73(Kitagawa,Y.,Matuda,T.和Iijima,S.eds.),Kluwer Academic Publishers,1999.;Tomizuka,K.等,Proc.Natl.Acad.Sci.USA(2000)97,p.722-727等)。
具体地,这样的产生人抗体的动物可通过破坏非人哺乳动物的内源性免疫球蛋白重链和轻链基因座,并且替代地通过酵母人工染色体(YAC)载体等向其引入人免疫球蛋白重链和轻链基因座来制备。或者,通过基因重组技术,利用这样的人抗体的重链-和轻链-编码cDNA,优选利用包含每一个cDNA的载体转化真核细胞,随后培养产生重组人单克隆抗体的转化细胞。可从培养上清液获得该抗体。
在该上下文中,例如,真核细胞,优选哺乳动物细胞例如CHO细胞、淋巴细胞或骨髓瘤细胞可用作宿主。
同样地,用于获得选自人抗体文库(参见Wormstone,I.M.等,Investigative Ophthalmology&Visual Science.(2002)43(7),p.2301-2308;Carmen,S.et.al,Briefings in Functional Genomics and Proteomics(2002),1(2),p.189-203;Siriwardena,D.等,Opthalmology(2002)109(3),p.427-431等)的噬菌体展示来源的人抗体的方法是已知的。
例如,可使用噬菌体展示法(Nature Biotechnology(2005),23,(9),p.1105-111),所述方法包括允许人抗体的可变体在噬菌体表面上表达为单链抗体(scFv),和选择结合抗原的噬菌体。
可将基于其对抗原的结合选择的噬菌体经历基因分析,从而确定编码结合抗原的人抗体的可变区的DNA序列。
如果结合抗原的scFv的DNA序列被测定,则制备具有该序列的表达载体,可用表达载体转染适当的宿主,让其表达人抗体(WO92/01047,WO92/20791,WO93/06213,WO93/11236,WO93/19172,WO95/01438,WO95/15388,Annu.Rev.Immunol(1994)12,p.433-455,NatureBiotechnology(2005)23(9),p.1105-1116)。
(4-6)用于制备抗体的功能性片段的方法
用于制备单链抗体的方法在本领域是公知的(参见例如,美国专利号4,946,778、5,260,203、5,091,513和5,455,030)。在该scFv中,重链可变区与轻链可变区通过阻止它们形成缀合物的接头,优选多肽接头连接(Huston,J.S.等,Proc.Natl.Acad.Sci.U.S.A.(1988),85,p.5879-5883)。scFv中的重链可变区和轻链可变区可来源于相同抗体或可来源于不同抗体。
例如,由12至19个残基组成的任意单链肽用作连接这些可变区的多肽接头。
为了获得scFv编码DNA,在编码抗体的重链或重链可变区的DNA和编码其轻链或轻链可变区的DNA的序列当中,将编码完整或期望的氨基酸序列的每一个DNA部分用作模板,并使用侧翼连接模板的两个末端的引物对通过PCR扩增所述DNA部分。随后,与侧翼连接其两个末端的引物对组合进一步扩增编码多肽接头部分的DNA,以将它们分别连接于重链和轻链。
可按照常规方法,将scFv-编码DNA用于制备包含DNA的表达载体,用表达载体转化宿主细胞。此外,培养所述宿主细胞,可按照常规方法从培养物收集scFv。
同样地,为了获得抗体的其它功能性片段,按照上述方法获得编码每一个功能性片段的基因,用所述基因转染细胞。可从所述细胞的培养物收集目标功能性片段。
可将本发明的抗体多聚化,从而增强其对于抗原的亲和力。待多聚化的抗体可以是一个类型的抗体或可以是分别识别众多表位或相同抗原的众多抗体。抗体多聚化法的实例可包括两条scFv对IgG CH3结构域的结合、其对链霉抗生物素蛋白的结合和螺旋-转角-螺旋基序的引入。
本发明的抗体可以是多个类型的氨基酸序列不同的抗ROBO4抗体的混合物,即多克隆抗体。多克隆抗体的实例可包括多个类型的CDR组的部分或全部CDR上不同的抗体的混合物。这样的多克隆抗体可从混合培养的不同产生抗体的细胞的培养物收集而来(WO2004/061104)。此外,可将分开制备的抗体混合。此外,作为多克隆抗体的一个方面的抗血清可通过用期望的抗原免疫动物并随后按照标准方法从动物收集血清来制备。
缀合有不同分子(例如聚乙二醇(PEG))的抗体还可用作抗体的修饰形式。
本发明的抗体还可以是利用这些抗体与其它药物形成的缀合物的任何缀合物(免疫缀合物)。这样的抗体的实例可包括缀合有放射性物质或具有药理作用的化合物的抗体(Nature Biotechnology(2005)23,p.1137-1146)。
(4-7)抗体的纯化
可将获得的抗体纯化成均质水平(homogeneous level)。常用蛋白质分离和纯化法可用于抗体的分离和纯化。
可通过适当地选择或组合的方法来分离和纯化抗体,所述方法是例如层析柱、过滤器、超滤、盐析、透析、制备型聚丙烯酰胺凝胶电泳和/或等电聚焦(Strategies for Protein Purification and Charcterization:A Laboratoy Course Manual,Daniel R.Marshak等人eds.,Cold Spring Harbor Laboratory Press(1996);Antibodies:A Laboratory Manual.Ed Harlow和David Lane,Cold Spring Harbor Laboratory(1988)),但不限于它们。
层析的实例包括亲和层析、离子交换层析、疏水层析、凝胶过滤、反相层析和吸附层析。
这些层析法可使用液相层析例如HPLC或FPLC来进行。
用于亲和层析的柱子的实例可包括蛋白A、蛋白G和抗原柱子。
蛋白A柱子的实例包括Hyper D(由Pall Corp.生产的)、POROS(由Applied Biosystems,Inc.生产的)和Sepharose F.F.(由GE Healthcare Bio-Sciences Crop.生产的)。
同样地,还可基于其对抗原的结合活性,使用固定有抗原的载体纯化抗体。
本发明甚至提供了编码本发明的抗体或其功能性片段或修饰形式的基因、包含基因的插入物的重组载体、利用所述基因或载体转染的细胞和产生本发明的抗体的细胞。
通过方法(4-1)至(4-6)的任何方法产生的抗体或其功能性片段可包括在本发明中。
5.药物组合物
本发明提供了包含抗ROBO4抗体或其功能性片段或其修饰形式的药物组合物。
本发明的药物组合物在疾病的治疗或预防中是有用的,所述疾病显示作为发作、进展和/或恶化过程中的病理检查所见之一的血管生成,并且可通过抑制该血管生成或血管通透性来改善(在下文中,为方便起见将该疾病称为"血管生成性疾病")。血管生成性疾病的实例可包括渗出性年龄相关性黄斑变性、糖尿病视网膜病变、黄斑水肿、良性或恶性肿瘤、动脉粥样硬化、晶体后纤维增生症、血管瘤、慢性炎症、眼部新生血管性疾病、增生性视网膜病变、新生血管性青光眼、角膜组织移植物或其它组织移植物的免疫排斥、类风湿关节炎、银屑病、急性炎症、脓毒症和肥胖症。本发明的药物组合物在血管生成性疾病的治疗或预防中有效用作药剂,优选用于治疗或预防渗出性年龄相关性黄斑变性、糖尿病视网膜病变、黄斑水肿、良性或恶性肿瘤、晶体后纤维增生症、眼部新生血管性疾病、增生性视网膜病变、新生血管性青光眼和角膜组织移植物的免疫排斥,更优选用于治疗或预防渗出性年龄相关性黄斑变性、糖尿病视网膜病变、黄斑水肿、良性或恶性肿瘤、晶体后纤维增生症、眼部新生血管性疾病、增生性视网膜病变和新生血管性青光眼。
在本发明中,疾病的治疗和/或预防包括但不限于疾病,优选具有表达的ROBO4蛋白的个体的疾病发作的预防、其恶化或进展的阻抑或抑制、由患有所述疾病的个体显示的一个或两个或更多个症状的减轻、其恶化或进展的阻抑或好转、继发病的治疗或预防等。
本发明的药物组合物可包含治疗或预防有效量的抗ROBO4抗体或抗体的功能性片段和药学上可接受的稀释剂、载体、增溶剂、乳化剂、防腐剂和/或添加剂。
"治疗或预防有效量"意指通过特定剂型和施用途径对特定疾病产生治疗或预防作用的量。
本发明的药物组合物可包含用于改变、维持或保持组合物或其中包含的抗体(在下文中,称为"药用材料")的pH、渗透压、粘性、透明度、颜色、张力、无菌性或稳定性、溶解度、持续释放、吸收性、通透性、剂型、强度、性质、形状等。药用材料不受特别限制,只要它们是药学上可接受的材料。例如,无毒性或低毒性是优选由这些药用材料具有的性质。
药用材料的的实例可包括但不限于下列物质:氨基酸例如甘氨酸,丙氨酸,谷氨酰胺,天冬酰胺,组氨酸,精氨酸和赖氨酸;抗微生物剂;抗氧化剂例如抗坏血酸、硫酸钠和亚硫酸氢钠;缓冲剂例如磷酸盐、柠檬酸盐或硼酸盐缓冲剂、碳酸氢钠和Tris-HCl溶液;填充剂例如甘露醇和甘氨酸;螯合剂例如乙二胺四乙酸(EDTA);络合剂例如咖啡因、聚乙烯吡咯烷、β-环糊精和羟丙基-β-环糊精;膨胀剂例如葡萄糖、甘露糖和糊精;其它碳氢化合物例如单糖、二糖、葡萄糖、甘露糖和糊精;着色剂;矫正剂;稀释剂;乳化剂;亲水聚合物例如聚乙烯吡咯烷;低分子量多肽;形成盐的抗衡离子;抗菌药例如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟苯甲酸丙酯、氯己定、山梨酸和过氧化氢;溶剂例如甘油、丙二醇和聚乙二醇;糖醇例如甘露醇和山梨醇;悬浮剂;表面活性剂例如PEG、山梨坦酯、聚山梨醇酯类例如聚山梨醇酯20和聚山梨醇酯80、曲拉通、氨基丁三醇、卵磷脂和胆固醇;稳定性增强剂例如蔗糖和山梨醇;弹性增强剂例如氯化钠、氯化钾、甘露醇和山梨醇;运载物质;稀释剂;赋形剂;和/或药物添加剂。
添加的这些药物原料的量为抗ROBO4抗体或其功能性片段或其修饰形式的重量的0.001至1000倍,优选0.01至100倍,更优选0.1至10倍。
包含免疫脂质体(含有封装在脂质体中的抗ROBO4抗体或其功能性片段或其修饰形式)或修饰抗体形式(含有缀合有脂质体的抗体)的药物组合物(美国专利号6214388等)也包括在本发明的药物组合物中。
赋形剂或载体不受特别限制,只要它们为通常用于可注射水、盐水、人工脑脊髓液和用于口服或胃肠外施用的其它制剂的液体或固体材料。盐水的实例可包括中性盐水和含血清白蛋白盐水。
缓冲液的实例可包括经调整使药物组合物的终pH达到7.0至8.5的Tris缓冲液、经调整使其终pH达到4.0至5.5的醋酸盐缓冲液、经调整使其终pH达到5.0至8.0的柠檬酸盐缓冲液和经调整使其终pH值达到5.0至8.0的组氨酸缓冲液。
本发明的药物组合物为固体、液体、悬浮液等。本发明的药物组合物的另一个实例可包括冻干制剂。冻干制剂可使用赋形剂(例如蔗糖)来形成。
本发明的药物组合物的施用途径可以是肠内施用、局部施用和胃肠外施用的任一种,并且优选地根据靶向疾病来选择。其具体实例可包括静脉内施用、动脉内施用、肌内施用、真皮内施用、皮下施用、腹膜内施用、经皮肤施用、骨内施用和关节内施用。同样地,眼内施用可优选地用于眼血管生成性疾病例如渗出性年龄相关性黄斑变性、糖尿病视网膜病变、黄斑水肿、晶体后纤维增生症、眼部新生血管性疾病、增生性视网膜病变、新生血管性青光眼,或角膜组织移植物的免疫排斥。
可根据施用方法、抗体对ROBO4蛋白的结合亲和力等来确定药物组合物的配方。具有更高的对ROBO4蛋白的亲和力(更低的KD值)的本发明的抗ROBO4抗体或其功能性片段或其修饰形式可在更低的剂量上发挥其药效。
本发明的抗ROBO4抗体的剂量可适当地根据个体的物种、疾病的类型、症状、性别、年龄、预先存在的病况、抗体对ROBO4蛋白的结合亲和力或其生物活性以及其它因素来确定。可每天1次至每180天1次或每天2次或3次或更多次施用通常0.01至1000mg/kg,优选0.1至100mg/kg的剂量。
药物组合物的形式的实例可包括注射(包括冻干制剂和滴剂)、栓剂、经鼻吸收制剂、经皮肤吸收制剂、舌下制剂、胶囊、片剂、软膏、粒剂、气雾剂、丸剂、粉剂、悬浮液、乳剂、滴眼剂和生物植入制剂。
可将包含本发明的抗ROBO4抗体或其功能性片段或其修饰形式作为活性成分的药物组合物与其它治疗性或预防性试剂组合使用。所述试剂的实例包括抗血管生成药、抗炎药和/或抗癌药。例如,给受试者施用抗血管生成药、抗炎药和/或抗癌药,随后,给其施用包含抗ROBO4抗体或抗体的功能性片段作为活性成分的药物组合物。或者,给受试者施用药物组合物,随后给其施用抗血管生成药、抗炎药和/或抗癌药。或者,将药物组合物与抗血管生成药、抗炎药和/或抗癌药同时给受试者施用。抗血管生成药的实例可包括雷珠单抗(ranibizumab)。
本发明甚至提供了用于治疗或预防血管生成性疾病(例如渗出性年龄相关性黄斑变性、糖尿病视网膜病变、黄斑水肿、良性或恶性肿瘤、动脉粥样硬化、晶体后纤维增生症、血管瘤、慢性炎症、眼部新生血管性疾病、增生性视网膜病变、新生血管性青光眼、角膜组织移植物或其它组织移植物的免疫排斥、类风湿关节炎、银屑病、急性炎症、脓毒症,或肥胖症)的方法、本发明的抗体用于制备用于治疗或预防血管生成性疾病的药物组合物的用途以及本发明的抗体用于治疗或预防血管生成性疾病的用途。包含本发明的抗体的用于治疗或预防的试剂盒也可包括在本发明中。
6.诊断组合物
本发明提供了包含本发明的抗ROBO4抗体或其功能性片段或其修饰形式的用于检查或诊断的组合物(在下文中,统称为"诊断组合物")。
本发明的诊断组合物有效用于血管生成性疾病(例如渗出性年龄相关性黄斑变性、糖尿病视网膜病变、黄斑水肿、良性或恶性肿瘤、动脉粥样硬化、晶体后纤维增生症、血管瘤、慢性炎症、眼部新生血管性疾病、增生性视网膜病变、新生血管性青光眼、角膜组织移植物或其它组织移植物的免疫排斥、类风湿关节炎、银屑病、急性炎症、脓毒症或肥胖症)的检查或诊断。本发明的诊断组合物还有效用于不满足常规诊断标准的早期血管生成或前血管生成症状、演化成血管生成的尚未诊断的症状等的检查或诊断。在本发明中,检查或诊断包括例如确定或测试获得疾病的风险、确定疾病的存在或不存在、测试进展或恶化的程度、测试或确定使用包含抗ROBO4抗体等的药物组合物的药物疗法的作用、测试或确定除药物疗法外的疗法的作用、测试复发的风险以及确定复发的存在或不存在。然而,根据本发明的检查或诊断不限于这些,只要其为常用检查或诊断。
当在来源于受试者的样品中以相较于来源于健康个体的样品2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20倍或更多的量,优选10倍或更多的量检测到ROBO4蛋白时,受试者可被诊断为具有血管生成性疾病或处于获得该病的高风险中。此外,当ROBO4蛋白的血清浓度超过特定参考值时,受试者被诊断为具有血管生成性疾病或可被诊断为处于获得该病的高风险中。所述参考值通常为0.01至10ng/ml,优选0.1至1ng/ml,更优选0.1至0.3ng/ml。
这样的诊断组合物可包含pH缓冲剂、渗透压调节剂、盐、稳定剂、杀菌剂、显色剂、增敏剂、聚集抑制剂等。
本发明甚至提供了用于检查或诊断血管生成性疾病(例如渗出性年龄相关性黄斑变性、糖尿病视网膜病变、黄斑水肿、良性或恶性肿瘤、动脉粥样硬化、晶体后纤维增生症、血管瘤、慢性炎症、眼部新生血管性疾病、增生性视网膜病变、新生血管性青光眼、角膜组织移植物或其它组织移植物的免疫排斥、类风湿关节炎、银屑病、急性炎症、脓毒症或肥胖症)的方法、本发明的抗体用于制备用于诊断血管生成性疾病的组合物的用途以及本发明的抗体用于检查或诊断血管生成性疾病的用途。包含本发明的抗体的用于检查或诊断的试剂盒也可包括在本发明中。
包括本发明的抗体的检查或诊断法优选为夹心ELISA。可使用采用抗体的常用检测法例如ELISA、RIA、ELISPOT(酶联免疫斑点(enzyme-linked immunospot))测定、斑点印迹、奥克特洛尼测验或CIE(对流免疫电泳)。用于夹心ELISA测定系统的抗体可以是两个识别ROBO4但彼此不竞争的抗体的任意组合。除了生物素以外,可在生物化学分析中进行的标记法例如HRP、碱性磷酸酶或FITC可用作用于抗体的标记法。生色底物例如TMB(3,3',5,5'-四甲基联苯胺),BCIP(5-溴-4-氯-3-吲哚基磷酸酯)、对-NPP(对-硝基苯基磷酸酯)、OPD(邻-苯二胺)、ABTS(3-乙基苯丙噻唑啉-6-磺酸)、SuperSignal ELISA Pico化学发光底物(Thermo Fisher Scientific Inc.)、荧光底物例如QuantaBlu(TM)Fluorogenic过氧化物酶底物(Thermo Fisher Scientific Inc.)和化学发光底物可用于使用酶促标记的检测。可将来源于人或非人动物的样品以及人工处理的样品(例如重组蛋白)经历该测定。来源于生物体个体的测试样品的实例可包括但不限于血液、滑液、腹水、淋巴液、脑脊髓液和组织匀浆上清液。
包含本发明的抗体的用于检查或诊断的夹心ELISA试剂盒可包含ROBO4蛋白标准的溶液、着色剂、用于稀释的缓冲液、用于固相的抗体、用于检测的抗体和洗涤溶液等。结合于抗原的抗体的量可优选使用例如吸光度、荧光法、发光法或RI(放射性同位素)法的方法来测量。吸光度板读数器、荧光板读数器、RI液体闪烁计数器等优选用于测量。
[实施例]
在下文中,将参考实施例更详细地描述本发明。然而,本发明无意限定于这些。
在下文中的实施例中,除非另外指出,否则按照"Molecular Cloning"(Sambrook,J.,Fritsch,E.F.和Maniatis,T.,Cold Spring Harbor Laboratory Press,1989)中描述的方法或由本领域技术人员使用的其它实验手册中描述的方法,或按照使用的市售的试剂或试剂盒的说明书进行基因工程的每一项操作。
(实施例1)表达载体的制备
1)-1人ROBO4表达载体的制备
1)-1-1全长人ROBO4表达载体的制备
利用EcoRV和NotI从包含人ROBO4 cDNA(登录号BC039602)的质粒(由Open Biosystems生产的)切出人ROBO4 cDNA,将其整合在pCI载体(由Promega Corp.生产的)的EcoRV与NotI之间,以制备全长人ROBO4表达载体(在下文中,称为"pCI-hROBO4")。该载体中克隆的人ROBO4基因的序列示于SEQ ID NO:1中。同样地,人ROBO4的氨基酸序列示于SEQ ID NO:2中。
1)-l-2人ROBO4细胞外区域表达载体的制备
使用下列引物组通过PCR反应扩增编码人ROBO4细胞外区域多肽(由SEQ ID NO:2的氨基酸No.1至461所示的氨基酸序列组成;在下文中,缩写为"人ROBO4-ECD")的cDNA:
引物1F:5'-aaaggtaccaccatgggctctggaggagacagcctcctg-3'和
引物1R:5'-aaagatatcctgctccagggtccagggaccatgctcact-3'
将获得的PCR产物克隆入pEF6/V5-His-TOPO载体(由Life Technologies Corp.生产的)(在下文中,将所得的载体缩写为"pEF6-ROBO4-ECD";在下文中,由"pEF6-ROBO4-ECD"表达的重组蛋白称为"rROBO4-ECD")。
1)-l-3N-末端FLAG-标记全长人ROBO4和人ROBO4细胞外区域/结构域缺失变体的表达载体的制备
为了构建用于表达如下蛋白质的载体:所述蛋白质包含人ROBO4的由SEQ ID NO:2的氨基酸No.28至1007所示的氨基酸序列组成的区域(在图中,该区域称为"hROBO4-28")、由其中氨基酸No.46至1007所示的氨基酸序列组成的区域(在图中,该区域称为"hROBO4-46")、由其中氨基酸No.132至1007所示的氨基酸序列组成的区域(在图中,该区域称为"hROBO4-132")、由其中氨基酸No.210至1007所示的氨基酸序列组成的区域(在图中,该区域称为"hROBO4-210")、由其中氨基酸No.225至1007所示的氨基酸序列组成的区域(在图中,该区域称为"hROBO4-225")或由其中氨基酸No.341至1007所示的氨基酸序列组成的区域(在图中,该区域称为"hROBO4-341"),其中N末端用FLAG标记,以pCI-hROBO4作为模板,使用每一个引物组进行PCR反应:
用于hROBO4-28扩增的引物组:
引物2F:5'-ggtaccgccatgggctctggaggagacagcctcctcggcggcagaggttccctgcctctgctgctcctgctcatcatgggaggcatggctgattacaaggatgacgacgataagcaggactccccgccccagatcctagtccac-3'和
引物2R:5'-gctagcggagtaatctacaggagaagcaccagccttg-3',
用于hROBO4-46扩增的引物组:
引物3F:5'-ggtaccgccatgggctctggaggagacagcctcctcggcggcagaggttccctgcctctgctgctcctgctcatcatgggaggcatggctgattacaaggatgacgacgataagcctggccctgccaggatgagctgccaag-3',和引物2R,
用于hROBO4-132扩增的引物组:
引物4F:5'-ggtaccgccatgggctctggaggagacagcctcctcggcggcagaggttccctgcctctgctgctcctgctcatcatgggaggcatggctgattacaaggatgacgacgataaggtggctgtcctccgggaggatttccagatc-3'和引物2R,
用于hROBO4-210扩增的引物组:
引物5F:5'-ggtaccgccatgggctctggaggagacagcctcctcggcggcagaggttccctgcctctgctgctcctgctcatcatgggaggcatggctgattacaaggatgacgacgataagaccaacagcgcaggacatagggagagcc-3'和引物2R,
用于hROBO4-225扩增的引物组:
引物6F:5'-ggtaccgccatgggctctggaggagacagcctcctcggcggcagaggttccctgcctctgctgctcctgctcatcatgggaggcatggctgattacaaggatgacgacgataagatccaggagccccaggactacacggagcc-3'和引物2R,
用于hROBO4-341扩增的引物组:
引物7F:5'-ggtaccgccatgggctctggaggagacagcctcctcggcggcagaggttccctgcctctgctgctcctgctcatcatgggaggcatggctgattacaaggatgacgacgataagaggctgccggaaaaagtgcccagtgcccca-3'和引物2R。将获得的PCR产物整合入pCR4Blunt-TOPO载体(由Life Technologies Corp.生产的)以制备克隆载体。利用KpnI和NheI从每一个克隆载体切出对应的cDNA,将其整合在pCI载体的KpnI与NheI之间以制备N末端FLAG-标记全长人ROBO4表达载体和4个人ROBO4细胞外区域/结构域缺失突变体表达载体。N末端FLAG-标记全长人ROBO4载体由来自N末端的编码ROBO4的信号序列(SEQ ID NO:2的氨基酸No.1至27的氨基酸)+FLAG序列(DYKDDDDK)+ROBO4(SEQ ID NO:2的氨基酸No.28至1007的氨基酸)的核苷酸组成。在下文中,用于表达N末端FLAG-标记全长人ROBO4的载体称为"pCI-FLAG-hROBO4-28"。在人ROBO4细胞外区域/结构域缺失变体表达载体中,例如,用于表达由SEQ ID NO:2的氨基酸No.46至1007组成的ROBO4的载体由编码ROBO4的信号序列(SEQ ID NO:2的氨基酸No.1至27的氨基酸)+FLAG序列(DYKDDDDK)+细胞外区域-缺失的ROBO4(SEQ ID NO:2的氨基酸No.46至1007的氨基酸)的核苷酸组成。该载体称为"pCI-hROBO4-46"。同样地,编码在ROBO4的细胞外区域中具有部分缺失的ROBO4的载体分别称为"pCI-hROBO4-132"、"pCI-hROBO4-210"、"pCI-hROBO4-225"和"pCI-hROBO4-341"。
克隆在载体中的编码FLAG-标记全长人ROBO4或人ROBO4的每一个细胞外区域/结构域缺失变体的氨基酸序列的核苷酸序列示于SEQ ID NO:3、5、7、9、11或13中。同样地,人ROBO4的对应FLAG-标记全长人ROBO4或细胞外区域/结构域缺失变体的氨基酸序列示于SEQ ID NO:4、6、8、10、12或14中。
1)-l-4人ROBO4细胞内区域缺失变体表达载体的制备
为了构建用于表达包含人ROBO4的由SEQ ID NO:2的氨基酸No.1至511所示的氨基酸序列组成的区域(在下文中,该区域称为"hROBO4-ΔC")的蛋白质的载体,将终止密码子正好插入在编码人ROBO4的第511个氨基酸的密码子之后,其中以pCI-hROBO4作为模板,使用用于hROBO4-ΔC的引物组:
引物8F:5'-cagatataccagtgaggatgcctgaatcctaaaacacaggatggatc-3',和
引物8R:5'-gatccatcctgtgttttaggattcaggcatcctcactggtatatctg-3',
和QuikChange XL Site-Directed Mutagenesis试剂盒(由Agilent Technologies,Inc.生产的)来制备hROBO4-ΔC表达载体(在下文中,称为"pCI-hROBO4-ΔC")。
1)-2小鼠ROBO4表达载体的制备
利用小鼠心脏QUICK-克隆cDNA(由Takara Bio Inc.生产的)作为模板,使用如下引物组来进行PCR反应:
引物9F:5'-ggtaccgccatgggacaaggagaggagccgagagcagccatg-3'和
引物9R:5'-gcggccgcggaggaatcaccagccttgggcacagcaccag-3'
将获得的PCR产物整合入pCR-Blunt II-TOPO载体(由Life Technologies Corp.生产的)以制备包含小鼠ROBO4 cDNA的克隆载体,利用KpnI和NotI从克隆载体切出小鼠ROBO4 cDNA,将其整合在pCI载体的KpnI与NotI之间以制备小鼠ROBO4表达载体(在下文中,称为"pCI-mROBO4")。克隆在该载体中的小鼠ROBO4基因中的ORF位点的序列示于SEQ ID NO:15的核苷酸No.7至3051中。同样地,小鼠ROBO4的氨基酸序列示于SEQ ID NO:16中。
1)-3大鼠ROBO4表达载体的制备
以大鼠脾QUICK-克隆cDNA(由Takara Bio Inc.生产的)为模板,使用如下引物组进行PCR反应:
引物10F:5'-ggtaccgccatgggacaaggagaggagctgagagcagcc-3'和
引物10R:5'-gcggccgcggaggaatcaccagccttgggcacaacacc-3'
将获得的PCR产物整合入pCR4Blunt-TOPO载体以制备包含大鼠ROBO4cDNA的克隆载体。利用KpnI和NotI从克隆载体切出大鼠ROBO4 cDNA,将其整合在pCI载体的KpnI与NotI之间以制备大鼠ROBO4表达载体(在下文中,称为"pCI-raROBO4")。大鼠ROBO4 cDNA的核苷酸序列示于SEQ ID NO:17中。由该核苷酸序列编码的氨基酸序列示于SEQ ID NO:18中。
1)-4N末端FLAG-标记食蟹猴ROBO4表达载体的制备
以从食蟹猴的肾总RNA合成的cDNA为模板,使用如下引物组进行PCR反应:
引物11F:5'-ggtaccgccatgggctctggaggagaaagcctccggg-3'和
引物11R:5'-ggagtaatctacaggagaagcaccagccttg-3'
将获得的PCR产物整合入pCR4Blunt-TOPO载体以制备两种类型的克隆载体,所述载体各自包含食蟹猴ROBO4 cDNA(在下文中,称为cynoROBO4-l或cynoROBO4-2)(在下文中,这些载体分别称为pCR-cynoROBO4-l和pCR-cynoROBO4-2)。
随后,利用pCR-cynoROBO4-l或pCR-cynoROBO4-2作为模板,使用如下引物组进行PCR反应:
引物12F:5'-ggatccgccatgggctctggaggagaaagcctccg-3'和
引物12R:5'-gcggccgctcaggagtaatctacaggagaagcaccagccttg-3'
将获得的PCR产物整合入pCR4Blunt-TOPO载体以制备各自包含食蟹猴ROBO4 cDNA的克隆载体。利用BamHI和NotI从克隆载体切出对应的食蟹猴ROBO4 cDNA,将其整合在pCI载体的BamHI与NotI之间以制备两种类型的食蟹猴ROBO4表达载体(在下文中,分别称为pCI-cynoROBO4-1和pCI-cynoROBO4-2)。
随后,以pCI-cynoROBO4-1或pCI-cynoROBO4-2为模板,使用如下引物组进行PCR反应:
引物13F:5'-ggtaccgccatgggctctggaggagaaagcctccgaggctcccgggcttcccggcctctgctgctcctgctcatcatgggaggcatggctgattacaaggatgacgacgataagcaggactccccgccccagatcctagtccac-3'和引物12R。
将获得的PCR产物整合入pCR-TOPO载体(由Life Technologies Corp.生产的)以制备每一个包含N-末端FLAG-标记食蟹猴ROBO4 cDNA的克隆载体。利用KpnI和NotI从克隆载体切出对应的食蟹猴ROBO4 cDNA,将其整合在pCI载体的KpnI与NotI之间以制备N末端FLAG-标记食蟹猴ROBO4表达载体(在下文中,分别称为"pCI-FLAG-cynoROBO4-1"和"pCI-FLAG-cynoROBO4-2")。克隆在pCI-FLAG-cynoROBO4-1和pCI-FLAG-cynoROBO4-2的每一个中的食蟹猴ROBO4 cDNA的核苷酸序列分别示于SEQ ID NO:19和21中。由每一个核苷酸序列编码的氨基酸序列分别示于SEQ ID NO:20和22中。
1)-5N末端FLAG-标记人ROBO1表达载体的制备
以人心脏QUICK-Clone cDNA(由Takara Bio Inc.生产的)为模板,使用如下引物组进行PCR反应:
引物13F:
5'-ggggacaagtttgtacaaaaaagcaggcttcaccatgattgcggagcccgctcacttttacctg-3',和
引物13R:
5'-ggggaccactttgtacaagaaagctgggtcgctttcagtttcctctaattcttc-3'
将获得的PCR产物和pDONR221载体(由Life Technologies Corp.生产的)经历BP反应以制备包含人ROBO1cDNA的供体载体。
随后,以供体载体为模板,使用如下引物组进行PCR反应:
引物14F:5'-gcggccgcatgattgcggagcccgctcacttttacctgtttggattaatatgtctctgttcaggctcccgtcttgattacaaggatgacgacgataagcgtcaggaagattttccacctcgcattgttg-3'和
引物14R:5'-gctagctcagctttcagtttcctctaattcttc-3',
将获得的PCR产物整合入pCR4Blunt-TOPO载体以制备包含N-末端FLAG-标记人ROBO1 cDNA的克隆载体。利用Nhel和NotI从克隆载体切出N末端FLAG标记人ROBO1 cDNA,将其整合在pCI载体的Nhel与NotI之间以制备表达载体(在下文中,称为"pCI-FLAG-hROBO1")。N末端FLAG-标记人ROBO1 cDNA的核苷酸序列示于SEQ ID NO:23中。由该核苷酸序列编码的氨基酸序列示于SEQ ID NO:24中。
1)-6人ROBO2表达载体的制备
以人肺QUICK-克隆cDNA(由Takara Bio Inc.生产的)为模板,使用如下引物组进行PCR反应:
引物15F:5'-gcggccgcatgagtctgctgatgtttacacaactactg-3'和
引物15R:5'-gctagcctataattcacctgtaaactgtccttgactgttg-3'
将获得的PCR产物整合入pCR4Blunt-TOPO载体以制备包含人ROBO2 cDNA的克隆载体。利用Nhel和NotI从克隆载体切出人ROBO2 cDNA,将其整合在pCI载体的Nhel与NotI之间以制备表达载体(在下文中,称为"pCI-hROBO2")。人ROBO2 cDNA的核苷酸序列示于SEQ ID NO:25中。由该核苷酸序列编码的氨基酸序列示于SEQ ID NO:26中。
1)-7人ROBO3表达载体的制备
以人ROBO3/pENTR223.1(由Open Biosystems生产的)为模板,使用如下引物组进行PCR反应:
引物16F:5'-gcggccgcatgctgcgctacctgctgaaaacgctgctg-3'和
引物16R:5'-gctagctcatcttggttcctctcggcgrttctgtcc-3'
将获得的PCR产物整合入pCR4Blunt-TOPO载体以制备包含人ROBO3 cDNA的克隆载体。利用NotI和Nhel从克隆载体切出人ROBO3 cDNA,将其整合在pCI载体的NotI与Nhel之间以制备表达载体(在下文中,称为"pCI-hROBO3")。克隆在该载体中的人ROBO3基因中的ORF位点的序列示于SEQ ID NO:27的核苷酸No.35至4192中。同样地,人ROBO3的氨基酸序列示于SEQ ID NO:28中。
(实施例2)单克隆抗体的制备
2)-1抗原性蛋白的制备
为了表达rROBO4-ECD,使用293fectin(由Life Technologies Corp.生产的),利用pEF6-ROBO4-ECD转染FreeStyle 293-F细胞(由Life Technologies Corp.生产的),在8%CO2条件下于37℃培养6天。在培养完成后,通过离心收集培养液,将其用作rROBC4-ECD纯化原液。使用具有15000的分子量截留值(cutoff)的透析管将获得的培养物上清针对20mM Tris-HCl,pH 7.5进行透析,通过滤器(0.45μm)过滤,随后添加至使用20mM Tris-HCl,pH 7.5平衡的HiTrap 16/10 Q XL(由GE Healthcare Bio-Sciences Crop.生产的)。利用NaCl梯度(20mM Tris-HCl,pH 7.5/0.2M NaCl,20mM Tris-HCl,pH 7.5/1M NaCl)进行洗脱。通过SDS-聚丙烯酰胺凝胶电泳(在下文中,缩写为"SDS-PAGE")分离一部分洗脱级分。随后,将凝胶经历考马斯亮蓝染色(在下文中,缩写为"CBB染色")和通过Western印迹进行的检测,以确认级分包含rROBO4-ECD。随后,收集包含rROBO4-ECD的级分,将其添加至利用PBS平衡的HiLoad 16/60Superdex 75pg(由GE Healthcare Bio-Sciences Crop.生产的)。在用PBS洗脱后,通过SDS-PAGE分离一部分洗脱级分。随后,将凝胶经历CBB染色,通过Western印迹检测以确认级分包含rROBO4-ECD。收集包含rROBO4-ECD的级分,将其用作用于免疫的抗原和用作用于结合亲和力测定的抗原。使用BCA蛋白质测定试剂(由Pierce Biotechnology,Inc.生产的)测量蛋白质浓度。
2)-2免疫
使用六周龄雌性BALB/c小鼠。在第0天,给每一只小鼠皮下或皮内施用50μg的rROBO4-ECD与弗氏完全佐剂的混合物。在第7、14和21天,给小鼠皮下或皮内施用50μg的rROBO4-ECD与弗氏不完全佐剂的混合物。在第38天,给小鼠皮下或皮内施用50μg的rROBO4-ECD。在第42天,收集小鼠淋巴结或脾,将其用于杂交瘤制备。
2)-3杂交瘤制备
使用Hybrimune杂交瘤产生系统(由Cyto Pulse Sciences,Inc.生产的)对淋巴结细胞或脾细胞和小鼠骨髓瘤SP2/0-agl4细胞进行电融合,利用ClonaCell-HY选择培养基D(由StemCell Technologies Inc.生产的)稀释并进行培养。收集出现的杂交瘤集落以制备单克隆杂交瘤。培养收集的每一个杂交瘤集落,并筛选获得的杂交瘤培养上清液以产生抗ROBO4抗体的杂交瘤。
2)-4抗体筛选
2)-4-l用于细胞-ELISA的表达抗原基因的细胞的制备
将HEK293细胞在含10%FBS的DMEM培养基中调整至7.5×105个细胞/mL。使用Lipofectamine 2000(由Life Technologies Corp.生产的),利用pCI-hROBO4或阴性对照pCI-模拟物转染细胞,将其以50μL/孔的浓度分配至96孔半区板(由Corning Inc.生产的),在含10%FBS的DMEM培养基中于37℃和5%CO2的条件下过夜培养。将获得的彼此附着的转染的细胞用于细胞-ELISA。
2)-4-2用于流式细胞术分析的抗原基因表达细胞的制备
将HEK293T细胞以1.125×107个细胞/瓶的浓度接种于225-cm2培养瓶(由Sumitomo Bakelite Co.,Ltd.生产的),在含10%FBS的DMEM培养基中于37℃和5%CO2的条件下过夜培养。第二天,使用Lipofectamine 2000,用pCI-ROBO4或阴性对照pCI-模拟物转染HEK293T细胞,在37℃于5%CO2的条件下进一步过夜培养。第二天,用TrypLE Express(由Life Technologies Corp.生产的)处理表达载体转染的HEK293T细胞,用含10%FBS的DMEM洗涤,并随后悬浮于含5%FBS的PBS中。将获得的细胞悬浮液用于流式细胞术分析。
2)-5细胞-ELISA
在从2)-4-1中制备的表达载体-转染的HEK293细胞除去上清液后,将杂交瘤培养上清液添加至pCI-hROBO4-和pCI-模拟物-转染的HEK293细胞的每一个,并让细胞在4℃静置1小时。用含5%FBS的PBS洗涤每一个孔中的细胞一次。随后,向其中添加用含5%FBS的PBS稀释500倍的在山羊中产生的抗小鼠IgG-过氧化物酶抗体(由Sigma-AldrichCorp.生产的),并让细胞在4℃静置1小时。用含5%FBS的PBS洗涤每一个孔中的细胞5次。随后,将分别以0.4mg/mL和0.6%(v/v)的浓度溶解于OPD溶解溶液(0.05M柠檬酸三钠,0.1M十二水合磷酸氢二钠,pH 4.5))中的OPD着色液(邻-苯二胺盐酸盐(由Wako Pure Chemical Industries,Ltd.生产的)和H2O2以25μL/孔的浓度添加至其中。在间歇性搅拌的条件下进行颜色反应,并通过以25μL/孔的浓度添加1MHCl来终止反应。随后,使用板读数器(ENVISION;由Perkin Elmer,Inc.生产的)测量490nm处的吸光度。为了选择产生特异性结合在细胞膜表面上表达的ROBO4的抗体的杂交瘤,将相较于阴性对照pCI-模拟物-转染的HEK293细胞,在pCI-hROBO4-转染的HEK293细胞中显示更高吸光度的培养上清液中的杂交瘤选择为抗ROBO4抗体产生阳性的杂交瘤。
2)-6流式细胞术分析
由在2)-5细胞-ELISA中确定为阳性的每一个杂交瘤产生的抗体经流式细胞术进一步确认结合ROBO4。将2)-4-2中制备的HEK293T细胞悬浮液离心。在除去上清后,将杂交瘤培养上清添加至pCI-hROBO4-转染的细胞和pCI-模拟物-转染的细胞的每一种细胞,并将所得的悬浮液在4℃静置1小时。用含5%FBS的PBS洗涤细胞两次。随后,向其中添加用含5%FBS的PBS稀释100倍的抗小鼠IgG FITC缀合物(由Sigma-Aldrich Corp.生产的)或用含5%FBS的PBS稀释320倍的抗大鼠IgG FITC缀合物(由Sigma-Aldrich Corp.生产的),并让所得的悬浮液于4℃静置1小时。用含5%FBS的PBS洗涤细胞三次,随后重悬浮于含5%FBS和2μg/mL 7-氨基放线菌素D(由Molecular Probes生产的)的PBS中,并将其经历使用流式细胞仪(FC500;由Beckman Coulter,Inc.生产的)的检测。使用Flowjo(由TreeStar Inc.生产的)分析数据。通过门控排除7-氨基放线菌素D-阳性死亡细胞,并随后制备活细胞的FITC荧光强度的直方图。产生其中pCI-ROBO4-转染的HEK293T细胞的直方图相较于阴性对照pCI-模拟物-转染的293T细胞的直方图偏移至更强的荧光强度区域的样品的杂交瘤被获得作为抗ROBO4抗体-产生性杂交瘤。由获得的杂交瘤产生的抗ROBO4抗体被分别命名为MAb1、MAb2、MAb3和MAb4。
2)-7单克隆抗体的同种型确定
使用小鼠单克隆分型试剂盒或大鼠单克隆分型试剂盒(由AbD Serotec生产的)确定每一种单克隆抗体的同种型。结果为IgG1(MAb1和MAb2)和IgG2b(MAb3和MAb4)。
2)-8单克隆抗体的制备
从杂交瘤培养上清(在下文中,称为"抗体纯化原液")纯化每一种单克隆抗体。
如下制备抗体纯化原液:将8至9×107个杂交瘤接种于1272-cm2培养瓶(由Corning Inc.生产的),并在含20%Ultra-LoW IgG胎牛血清的杂交瘤SFM培养基(由Life Technologies Corp.生产的)中于37℃、5%CO2的条件下培养4天,并随后收集上清。
使用Hitrap Protein G HP或Hitrap MabSelect SuRe(由GE Healthcare Bio-Sciences Crop.生产的)纯化抗体。对Hitrap Protein G HP,将抗体纯化原液添加至柱子,用结合缓冲液(0.02M磷酸钠,pH 7.0)洗涤,随后用0.1M甘氨酸,pH 2.7洗脱。相反地,对于Hitrap MabSelect SuRe,将抗体纯化原液添加至柱子,用PBS洗涤,随后用2M精氨酸-HCl,pH 4.0洗脱。中和洗脱的抗体溶液,随后用PBS替换缓冲液。使用BCA蛋白测定试剂测量利用Hitrap Protein G HP纯化的抗体的浓度。将小鼠IgG2a(由R&D systems,Inc.生产的)用作校准曲线的标准。或者,通过测量结合于POROS G 20μm柱子PEEK,4.6mmx50mm,0.83mL(由Applied Biosystems,Inc.生产的)的抗体的洗脱液的吸光度(O.D.280nm)来测定利用Hitrap MabSelect SuRe纯化的抗体的浓度。具体地,将利用PBS稀释的抗体样品添加至利用平衡缓冲液(30.6mM十二水磷酸二氢钠,19.5mM磷酸二氢钾(monopotassium phosphate),0.15M NaCl,pH 7.0)平衡的POROS G 20μm。用平衡缓冲液洗涤柱子,随后用洗脱剂(0.1%(v/v)HCl,0.15M NaCl)洗脱结合至柱子的抗体。测量洗脱液中吸光度(O.D.280nm)的峰面积,并按照下列公式计算浓度:抗体样品浓度(mg/mL)=(抗体样品的峰面积)/(标准的峰面积(人IgG1))×标准的浓度(mg/mL)×样品的稀释比率。
(实施例3)ROBO4下游信号的激活的检测
3)-l包含白细胞介素-8(IL-8)启动子区作为应答元件的报告载体的制备
以IL-8启动子区DNA为模板,使用如下引物组进行PCR反应:
引物17F:5'-ggtaccgataaggaacaaataggaag-3'和
引物17R:5'-gagctcagcttgtgtgctctgctgtc-3'
将获得的PCR产物整合入pCR4Blunt-TOPO载体以制备包含IL-8启动子区(-253至-59)DNA的克隆用载体。利用KpnI和SacI从克隆用载体切出IL-8启动子区(-253至-59)DNA,将其整合在pGL4.15载体(由Promega Corp.生产的)的KpnI与SacI之间,以制备包含IL-8启动子区作为应答元件的报告载体。IL-8启动子区(-253至-59)DNA的核苷酸序列示于SEQ ID NO:29中。
3)-2包含核因子-κβ(NF-κβ)、干扰素γ激活序列(GAS)、干扰素刺激应答元件(ISRE)、转染级T细胞因子(TCF)作为应答元件的报告载体
将pGL4.32[luc2P/NF-κB-RE/Hygro]载体(由Promega Corp.生产的)、pGAS-TA-Luc载体(由制Takara Bio Inc.造的)、pISRE-TA-Luc载体(由Takara Bio Inc.生产的)和TOPflash(由Millipore Corp.生产的)分别用作包含NF-κβ、GAS、ISRE或TCF作为应答元件的报告载体。或者,将不含应答序列的pTA-Luc载体(由Takara Bio Inc.生产的)用作阴性对照。将pRL-TK载体(由Takara Bio Inc.生产的)用作内部对照。
3)-3瞬时表达人ROBO4的细胞中信号变化的分析
将HEK293细胞以2×104个细胞/孔的浓度接种于96孔板(涂覆有胶原I;由Asahi Glass Co.,Ltd.生产的),在含有10%FBS的DMEM培养基中于37℃、5%CO2的条件下过夜培养。第二天,使用FuGene6转染剂,利用pCI-ROBO4、pCI-ROBO4-ΔC或阴性对照pCI-模拟物和3)-1和3)-2中显示的每一个报告载体转染HEK293细胞,随后在37℃于5%CO2的条件下过夜培养。第二天,在板读数器(Mithras;由Berthold Technologies GmbH&Co,KG生产的)中,使用Dual-Glo萤光素酶测定系统(由Promega Corp.生产的)将每一个孔的萤火虫萤光素酶和海肾萤光素酶活性确定为发光强度,按照下列公式计算每一个孔的报道分子活性:报道分子活性=萤火虫萤光素酶活性产生的发光强度/海肾萤光素酶活性产生的发光强度。作为结果,相较于阴性对照pCI-模拟物-转染的细胞,在pCI-hROBO4-转染的细胞中仅IL-8启动子活性得到增强(图1)。此外,在pCI-hROBO4-转染的细胞中检测到的该IL-8启动子活性的增强在用pCI-hROBO4-ΔC(hROBO4的细胞内区域缺失突变体)转染的细胞中被显著减弱,表明在pCI-hROBO4-转染的细胞中检测的IL-8启动子活性的增强需要ROBO4的细胞内区域(图2)。因此,pCI-hROBO4-转染的细胞中IL-8启动子活性的增强表明检测到ROBO4下游信号的激活。
(实施例4)MAb1的性质
4)-1MAb1对ROBO4下游信号的激活
将3)-3中制备的pCI-hROBO4-转染的细胞或pCI-模拟物-转染的细胞过夜培养。第二天,以0、0.3125、1.25、5和20μg/mL或0、0.25、1、4和16μg/mL的浓度将每一种抗ROBO4抗体(MAb1、MAb2、MAb3或MAb4)或阴性对照小鼠IgG1(由R&D systems,Inc.生产的)添加至其中,并将细胞在37℃于5%CO2的条件下培养5小时。随后,在板读数器(Mithras)中,使用Dual-Glo萤光素酶测定系统(由Promega Corp.生产的)将每一个孔的萤火虫萤光素酶和海肾萤光素酶活性确定为发光强度,按照下列公式计算每一个孔的报道分子活性:报道分子活性=萤火虫萤光素酶活性产生的发光强度/海肾萤光素酶活性产生的发光强度。作为结果,阴性对照小鼠IgG不影响瞬时表达人ROBO4的细胞中的IL-8启动子活性,然而MAb1增强IL-8启动子活性(图3)。如同MAb1一样,MAb2也增强IL-8启动子活性,然而MAb3或MAb4不增强IL-8启动子活性(图4)。在pCI-模拟物细胞中,MAb1或MAb2不增强IL-8启动子活性。这些结果表明MAb1激活ROBO4的下游信号,但并非所有抗ROBO4抗体激活ROBO4的下游信号。
在交联抗体(AffiPure山羊抗小鼠IgG Fc片段特异性的,Cat NO.115-005-071,Jackson humunoResearch)(两个针对MAb3或MAb4的一个分子的交联抗体)存在的情况下的启动子活性评价经确认不增强ROBO4下游信号的活性的MAb3和MAb4。作为结果,对于两种抗体都观察到启动子活性的增强。
4)-2HUVEC迁移测试
将HUVEC(由KURABO INDUSTRIES LTD.生产的)在含有0.1%BSA的HuMedia-EB2(由KURABO INDUSTRIES LTD.生产的)于37℃、5%CO2的条件下过夜培养,随后利用含有0.1%BSA的HuMedia-EB2调整至4×105个细胞/mL。将0.25mL的具有4×105个细胞/mL的浓度的细胞悬浮液添加至具有明胶涂覆的膜的BD Falcon FluoroBlok 24多孔插入系统(孔径:8μm)中的小室的上层。随后,将含有0.1%BSA和10ng/mL人VEGF165(由PeproTech Inc.生产的)或人bFGF(BD Biosciences)和2g/mL小鼠IgG2a或每一种抗ROBO4抗体(MAb1、MAb2、MAb3或MAb4)的HuMedia-EB2添加至小室的下层。在37℃于5%CO2的条件下温育2至3小时后,用含有4μg/mL钙黄绿素-AM(由Life Technologies Corp.生产的)的HuMedia-EB2对迁移至下层的HUVEC染色15分钟。随后,使用板读数器(FlexStation;Molecular Devices,LLC)测量每一个孔的荧光强度(激发波长/荧光波长:485nm/538nm),按照下列公式计算每一个孔中迁移细胞的量:迁移细胞的量=添加HUVEC的孔的荧光强度-未添加HUVEC的孔的荧光强度。作为结果,MAb1抑制由VEGF或bFGF诱导的HUVEC的迁移(图5)。如同MAb1一样,MAb2也抑制由bFGF诱导的HUVEC的迁移,然而MAb3或MAb4不抑制细胞迁移(图6)。这些结果表明抗ROBO4抗体对IL-8启动子活性的增强与抗HUVEC迁移的抑制活性相关。
4)-3物种交叉反应性
4)-3-1表达抗原基因的细胞的制备
将HEK293细胞以1.5×106个细胞/皿的浓度接种于60-mm培养皿(由Corning Inc.生产的)中,并在含10%FBS的DMEM培养基于37℃、5%CO2的条件下过夜培养。第二天,使用FuGENE6转染剂,利用pCI-hROBO4、pCI-mROBO4、pCI-raROBO4、pCI-FLAG-cynoROBO4-1、pCI-FLAG-cynoROBO4-2、pCI-hROBO1、pCI-hROBO2或pCI-hROBO3转染HEK293细胞,在37℃、5%CO2的条件下进一步过夜培养。第二天,用TrypLE Express(由Life Technologies Corp.生产的)处理表达载体-转染的细胞,用含5%FBS的PBS洗涤,随后悬浮于含5%FBS的PBS中。将获得的细胞悬浮液用于流式细胞术分析。
4)-3-2流式细胞术分析
将4)-3-1中制备的每一个细胞悬浮液离心,并除去上清。随后,将MAb1或阴性对照小鼠IgG2a以10μg/mL的浓度添加至2×105个表达载体-转染的细胞,让所得的悬浮液在4℃静置1小时。用含5%FBS的PBS洗涤细胞1次。随后,将用含5%FBS的PBS稀释100倍的抗小鼠IgG FITC缀合物添加至其中,并让所得的悬浮物在4℃静置1小时。用含5%FBS的PBS洗涤细胞三次,随后重悬浮于含5%FBS的PBS中,并将其经历使用流式细胞仪(BD FACSCalibur)的检测。使用Flowjo分析数据。制备FITC荧光强度的直方图。确定抗体以跨物种的方式结合,此时MAb1的直方图相较于阴性对照小鼠IgG2a的直方图偏移至更强的荧光强度区域。物种交叉反应性研究的结果表明MAb1不结合小鼠ROBO4或大鼠ROBO4,但结合人ROBO4和食蟹猴ROBO4(图7)。
4)-4结合特异性
4)-4-l表达抗原基因的细胞的制备
将HEK293细胞以1.2×106个细胞/皿或1.5×106个细胞/皿的浓度接种于60-mm培养皿(由Corning Inc.生产的)中,并在含10%FBS的DMEM培养基于37℃、5%CO2的条件下过夜培养。第二天,使用FuGENE6转染剂,利用pCI-hROBO4、pCI-FLAG-hROBO1、pCI-hROBO2或pCI-hROBO3转染HEK293细胞,在37℃、5%CO2的条件下进一步过夜培养。第二天,用TrypLE Express(由Life Technologies Corp.生产的)处理表达载体-转染的细胞,用含5%FBS的PBS洗涤,随后悬浮于含5%FBS的PBS中。将获得的细胞悬浮液用于流式细胞术分析。
4)-4-2流式细胞术分析
将4)-4-1中制备的每一个细胞悬浮液离心,并除去上清。随后,将MAb1或阳性对照人ROBO4抗体(由R&D systems,Inc.生产的)、小鼠中产生的单克隆抗FLAG M2抗体(由Sigma-Aldrich Corp.生产的)、人ROBO2抗体(由R&D systems,Inc.生产的)或单克隆抗人ROBO3抗体(由R&D systems,Inc.生产的)或阴性对照小鼠IgG1或小鼠IgG2a以10μg/mL的浓度添加至2×105个表达载体-转染的细胞,让所得的悬浮液在4℃静置1小时。用含5%FBS的PBS洗涤细胞1次。随后,将用含5%FBS的PBS稀释1000倍的抗小鼠IgG FITC缀合物添加至其中,并让所得的悬浮物在4℃静置1小时。用含5%FBS的PBS洗涤细胞三次,随后重悬浮于含5%FBS的PBS中,并将其经历使用流式细胞仪(BD FACSCalibur)的检测。使用Flowjo分析数据。制备FITC荧光强度的直方图。确定抗体以特异性的方式结合,此时MAb1的直方图相较于阴性对照小鼠IgG1或小鼠IgG2a的直方图偏移至更强的荧光强度区域。结果表明MAb1不结合hROBO1、hROBO2或hROBO3,但特异性结合hROBO4(图8)。在该上下文中,通过使用阳性对照抗体,hROBO4、hROBO1、hROBO2和hR0B03各自被确认在细胞膜上表达(图8)。
4)-5表位确定
4)-5-1表达抗原基因的细胞的制备
将HEK293细胞以1.5×106个细胞/皿的浓度接种于60-mm培养皿(由Corning Inc.生产的)中,并在含10%FBS的DMEM培养基于37℃、5%CO2的条件下过夜培养。第二天,使用FuGENE6转染剂,利用pCI-FLAG-hROBO4-28、pCI-FLAG-hROBO4-46、pCI-FLAG-hROBO4-132、pCI-FLAG-hROBO4-210、pCI-FLAG-hROBO4-225、pCI-FLAG-hROBO4-341转染HEK293细胞,在37℃、5%CO2的条件下进一步过夜培养。第二天,用TrypLE Express(由Life Technologies Corp.生产的)处理表达载体-转染的细胞,用含5%FBS的PBS洗涤,随后悬浮于含5%FBS的PBS中。将获得的细胞悬浮液用于流式细胞术分析。
4)-5-2流式细胞术分析
将4)-5-1中制备的每一种细胞悬浮液离心,并除去上清。随后,将MAb1、小鼠中产生的阳性对照单克隆抗FLAG M2抗体或阴性对照小鼠IgG2a以10μg/mL的浓度添加至2×105个表达载体-转染的细胞,让所得的悬浮液在4℃静置1小时。用含5%FBS的PBS洗涤细胞1次。随后,将用含5%FBS的PBS稀释1000倍的抗小鼠IgG FITC缀合物添加至其中,让所得的悬浮物在4℃静置1小时。用含5%FBS的PBS洗涤细胞3次,随后重悬浮于含5%FBS的PBS中,将其经历使用流式细胞仪(BD FACSCalibur)的检测。使用Flowjo分析数据。制备FITC荧光强度的直方图。当MAb1的直方图相较于阴性对照小鼠IgG2a的直方图偏移至更强的荧光强度区域时,则抗体测定为结合细胞。结果表明,MAb1结合pCI-FLAG-hROBO4-28-、pCI-FLAG-hROBO4-46-或pCI-FLAG-hROBO4-132-转染的细胞,但不结合pCI-FLAG-hROBO4-210-、pCI-FLAG-hROBO4-225-或pCI-FLAG-hROBO4-341-转染的细胞。因此,MAb1经显示可识别SEQ ID NO:2中显示的人ROBO4的No.132至209的氨基酸序列(图9)。在本说明书中,通过使用阳性对照抗FLAG抗体,确认了每一个细胞内区域/结构域缺失变体在细胞膜上表达(图9)。
4)-6在具有激光诱导的脉络膜新生血管化的猴模型中进行的药效评价
4)-6-l麻醉
以0.04mg/kg的剂量给每一只食蟹猴肌内注射美托咪定盐酸盐(由Nippon Zenyaku Kogyo Co.,Ltd.生产的)。15分钟后,以15mg/kg的剂量给其肌内注射盐酸氯胺酮(由Daiichi Sankyo Co.,Ltd.生产的)。
4)-6-2模型制备
将4)-6-l中麻醉的每一只食蟹猴保持在猴椅上。将4%的利多卡因滴眼剂(由AstraZeneca pic生产的)施用于两只眼以进行眼表面的麻醉/止痛处理。将5mg/mL托吡卡胺-5mg/mL盐酸去氧肾上腺素混合物滴眼剂(由Santen Pharmaceutical Co.,Ltd.生产的)施用于眼以进行瞳孔开大。使用绿色激光视网膜凝固器OcuLight GLx(由Iridex Corp.生产的),通过激光辐射(辐射的热量:350-500mW,照射时间:0.1秒,斑点尺寸:50μm,斑点数目:6或9个斑点)来热损伤视网膜的黄斑区。
4)-6-3测试物质的施用
在模型制备后第7天,将33G Nanopass针从结膜插入玻璃体,使用100-μL汉密尔顿氏注射器通过PE20聚乙烯管将50μL媒介物或13.2mg/mL MAb1在2分钟内注射至其中。对每一个组(包括4只眼)进行测试。在施用完成后,将0.5%左氧氟沙星水合物滴眼剂(由Santen Pharmaceutical Co.,Ltd.生产的)施用至眼。
4)-6-4药效评价
在模型制备后第7、14和21天,在麻醉下使用混合型眼底照相机CX-1(由Canon Inc.制造)通过常规方法对眼底进行照像。随后,将10%的荧光素以0.1mL/Kg的剂量对其静脉内注射。在完成荧光素的静脉内注射后,每1分钟至6分钟后进行荧光血管造影术。存储图像资料,使用图像分析仪(WinRoof,manufactured by Mitani Corp.)计算荧光素在其上积累的部位的面积。按照下列公式计算新形成的血管的量:新形成的血管的量=模型制备后第21天荧光素在其上积累的部位的面积-模型制备后第7天荧光素在其上积累的部位的面积。作为在施用媒介物的组与施用MAb1的组之间比较新形成的血管的量的结果,施用MAb1的组中4只眼中有3只经确认减少了新形成的血管的量,尽管已确认剩余的1只眼与媒介物组之间新形成的血管的量无差异。这意味着MAb1的施用抑制激光诱导的脉络膜新生血管化(图10)。
(实施例5)MAb1cDNA的克隆和测序
5)-1MAb1重链和轻链的N末端氨基酸序列的测定
为了测定MAb1的重链和轻链的N末端氨基酸序列,通过SDS-PAGE分离实施例2)-8中纯化的MAb1。将在凝胶中所分离的蛋白质从凝胶转移至Sequi-Blot PVDF膜(Bio-Rad Laboratories,Inc.),然后用洗涤缓冲液(25mM NaCl,10mM硼酸盐缓冲剂,pH 8.0)洗涤所述膜,随后通过将其浸入染色液(50%甲醇,20%醋酸,0.05%考马斯亮蓝)5分钟来进行染色,随后用90%甲醇脱色。切取在PVDF膜上显现的对应于重链(具有更小的迁移率的条带)和轻链(具有更大的迁移率的条带)的条带部分。按照自动化Edman法(参见Edman等人,(1967)Eur.J.Biochem.1,80),使用Procise cLC protein sequencer Model 492cLC(Applied Biosystems,Inc.)鉴定它们各自的N末端氨基酸序列。作为结果,对应于MAb1的重链的条带的N末端氨基酸序列为EVQLVESGGGLVKPGGSLKL,对应于轻链的条带的N末端氨基酸序列为DAVMTQTPLSLPVSL。
5)-2从生产MAb1的杂交瘤制备mRNA
为了克隆MAb1的重链-和轻链-编码cDNA,使用mRNA分离试剂盒(Roche Applied Science)从生产MAb1的杂交瘤制备mRNA。
5)-3MAb1cDNA的克隆和测序
参考基于MAb1重链和轻链的γ1和κ同种型确定的重链和轻链的N末端氨基酸序列(分别地(实施例2)-7)和5-1))和由Kabat等人制备的抗体氨基酸序列数据库(参见Strausberg,R.L.,等人(2002)Proc.Natl.Acad.Sci.U.S.A.99.16899-16903,和Kabat,E.A.,等人(1991)in Sequences of Proteins of Immunological Interest第I和II卷,U.S.Department of Health and Human Services),合成分别与抗体基因的编码区的5'末端序列和其含终止密码子的3'末端序列杂交的若干寡核苷酸引物。使用5)-2中制备的mRNA和TaKaRa One Step RNA PCR试剂盒(AMV)(Takara Bio Inc.)扩增重链-和轻链-编码cDNA。作为结果,使用下列引物组成功地扩增了抗体的重链-和轻链-编码cDNA:
用于重链的引物组:
LYHF6:5'-cctcaccatgaactttgg-3',
G1EVR1:5'-aagatatcttatttaccaggagagtgggagag-3';
用于轻链的引物组:
M19EIF1:5'-aagaattcatgaagttgcctgttagg-3',
KEVR1:5'-aagatatcttaacactcattcctgttgaagct-3'。
使用pEF6/V 5-His TOPO TA Expression试剂盒(Invitrogen Corp.)分别克隆通过PCR扩增的重链和轻链cDNA。使用基因测序仪("AB1 PRISM3700DNA分析仪;Applied Biosystems"或"Applied Biosystems 3730x1分析仪;Applied Biosystems")测定编码重链和轻链的各自可变区的克隆cDNA的核苷酸序列。使用GeneAmp 9700(Applied Biosystems,Inc.)进行测序反应。
测定的编码MAb1重链可变区的cDNA的核苷酸序列示于SEQ ID NO:30中,其氨基酸序列示于SEQ ID NO:31中。编码小鼠抗体MAb1的轻链可变区的cDNA的核苷酸序列示于SEQ ID NO:32中,其氨基酸序列示于SEQ ID NO:33中。
(实施例6)嵌合MAb1(cMAb1)的制备
6)-1表达载体pCMA-LK、pCMA-Gl和pCMA-G2的制备
6)-1-1嵌合和人源化轻链表达载体pCMA-LK的构建
用限制性内切酶XbaI和PmeI消化质粒pcDNA3.3-TOPO/LacZ(Invitrogen Corp.),使用In-Fusion Advantage PCR克隆试剂盒(Clontech Laboratories,Inc.)将获得的约5.4kb的片段连接于包含编码人κ链分泌信号和人κ链恒定区的DNA序列(SEQ ID NO:34)的DNA片段,以制备pcDNA3.3/LK。
以pcDNA3.3/LK为模板,使用下文中显示的引物组进行PCR。将获得的约3.8kb的片段磷酸化,随后自身连接以从pcDNA3.3/LK构建在CMV启动子的下游具有信号序列编码序列、克隆位点和人κ链恒定区-编码序列的嵌合和人源化轻链表达载体pCMA-LK。
引物组
3.3-F1:5'-tataccgtcgacctctagctagagcttggc-3',
3.3-R1:5'-gctatggcagggcctgccgccccgacgttg-3'。
6)-1-2嵌合和人源化IgG1-型重链表达载体pCMA-G1的构建
用XbaI和PmeI消化pCMA-LK以除去编码κ链分泌信号和人κ链恒定区的序列。使用In-Fusion Advantage PCR克隆试剂盒(Clontech Laboratories,Inc.)将所得的DNA片段连接于包含编码人重链信号序列和人IgG1恒定区的氨基酸的DNA序列(SEQ ID NO:35)的DNA片段,以构建在CMV启动子的下游具有信号序列-编码序列、克隆位点和人IgG1重链恒定区-编码序列的嵌合和人源化IgG1-型重链表达载体pCMA-G1。
6)-1-3嵌合和人源化IgG2-型重链表达载体pCMA-G2的构建
用XbaI和PmeI消化pCMA-LK以除去编码κ链分泌信号和人κ链恒定区的序列。使用In-Fusion Advantage PCR克隆试剂盒(Clontech Laboratories,Inc.)将所得的DNA片段连接于包含编码人重链信号序列和人IgG2恒定区的氨基酸的DNA序列(SEQ ID NO:36)的DNA片段,以构建在CMV启动子的下游具有信号序列-编码序列、克隆位点和人IgG2重链恒定区-编码序列的嵌合和人源化IgG2-型重链表达载体pCMA-G2。
6)-2嵌合MAb1轻链表达载体的构建
以编码MAb1的轻链可变区的cDNA作为模板,使用KOD-Plus-(TOYOBO CO.,LTD.)和下文中显示的引物组扩增包含编码轻链可变区的cDNA的位点,使用In-Fusion Advantage PCR克隆试剂盒(Clontech Laboratories,Inc.)将其插入用于嵌合和人源化抗体轻链表达的一般目的载体pCMA-LK的限制性内切酶BsiWI-切割位点,以构建嵌合MAb1轻链表达载体。获得的表达载体被命名为"pCMA-LK/MAb1L"。编码嵌合MAb1轻链的核苷酸序列示于SEQ ID NO:37中,其氨基酸序列示于SEQ ID NO:38中。SEQ ID NO:37的核苷酸No.1至60代表编码信号序列的核苷酸序列。其核苷酸No.61至402代表编码可变区的核苷酸序列。其核苷酸No.403至717代表编码恒定区的核苷酸序列。SEQ ID NO:38的氨基酸No.1至20代表信号序列的氨基酸。其氨基酸No.21至134代表可变区的氨基酸。氨基酸No.135至239代表恒定区的氨基酸。
用于轻链的引物组:
MAb1 LF:
5'-tctccggcgcgtacggcgatgctgtgatgacccaaactccactctcc-3',
MAb1 LR:
5'-ggagggggcggccacagcccgtttgatttccagcttggtgcctcc-3'。
6)-3嵌合MAb1 IgG1-型重链表达载体的构建
以编码MAb1的重链可变区的cDNA为模板,使用KOD-Plus-(TOYOBO CO.,LTD.)和下文中显示的引物组扩增包含编码重链可变区的cDNA的位点,使用In-Fusion Advantage PCR克隆试剂盒(Clontech Laboratories,Inc.)将其插入嵌合和人源化IgG1-型重链表达载体pCMA-G1的限制性内切酶BsiWI-切割的位点,以构建嵌合MAb1 IgG1-型重链表达载体。将获得的表达载体命名为"pCMA-G1/MAb1H"。编码嵌合MAb1 IgG1-型重链示的核苷酸序列示于SEQ ID NO:39中,其氨基酸序列示于SEQ ID NO:40中。SEQ ID NO:39的核苷酸No.1至57代表编码信号序列的核苷酸序列。其核苷酸No.58至411代表编码可变区的核苷酸序列。其核苷酸No.412至1401代表编码恒定区的核苷酸序列。SEQ ID NO:40的氨基酸No.1至19代表信号序列的氨基酸序列。其氨基酸No.20至137代表可变区的氨基酸序列。氨基酸No.138至467代表恒定区的氨基酸序列。
用于IgG1-型重链的引物组:
MAb1 HF:
5'-cagatgggtgctgagcgaagtgcagctggtggagtctgggggag-3',
MAb1 H1R:
5'-ttggtggaggctgagctgactgtgagagtggtgccgtggccccag-3'。
6)-4嵌合MAb1IgG2-型重链表达载体的构建
以编码MAb1的重链可变区的cDNA为模板,使用KOD-Plus-(TOYOBO CO.,LTD.)和下文中显示的引物组扩增包含编码重链可变区的cDNA的位点,使用In-Fusion Advantage PCR克隆试剂盒(Clontech Laboratories,Inc.)将其插入嵌合和人源化IgG2-型重链表达载体pCMA-G2的限制性内切酶BsiWI-切割的位点,以构建嵌合MAb1 IgG2-型重链表达载体。将获得的表达载体命名为"pCMA-G2/MAb1"。编码嵌合MAb1 IgG2-型重链示的核苷酸序列于SEQ ID NO:41中,其氨基酸序列示于SEQ ID NO:42中。
用于IgG2-型重链的引物组:
MAb1 HF:
5'-cagatgggtgctgagcgaagtgcagctggtggagtctgggggag-3';
MAb1 2R:
5'-ttggtgctggctgagctgactgtgagagtggtgccgtggccccag-3'
(实施例7)IgG1-型嵌合MAb1抗体和IgG2-型嵌合MAb1抗体的制备
7)-1 IgG1-型嵌合MAb1抗体和IgG2-型嵌合MAb1抗体的产生
按照手册传代培养和培养FreeStyle 293-F细胞(Invitrogen Corp.)。将在对数生长期的1.2x109个FreeStyle 293-F细胞(Invitrogen Corp.)接种于3L Fernbach Erlenmeyer培养瓶(Corning Inc.),利用FreeStyle 293表达培养基(Invitrogen Corp.)将其稀释成1.0x106个细胞/mL,随后以90rpm在37℃于8%CO2培养箱中摇动培养1小时。将3.6mg聚乙烯亚胺(Polysciences,Inc.,#24765)溶解于20mL的Opti-Pro SFM培养基(Invitrogen Corp.)中。随后,将使用PureLink HiPure Plasmid试剂盒(Invitrogen Corp.)制备的H链表达载体(0.4mg)和L链表达载体(0.8mg)悬浮于20mL的Opti-Pro SFM培养基(Invitrogen Corp.)中。将20mL的表达载体/Opti-Pro SFM混合溶液添加至20mL的聚乙烯亚胺/Opti-Pro SFM混合溶液,逐渐搅拌混合物,再放置5分钟,随后添加至FreeStyle 293-F细胞。将细胞以90rpm在37℃于8%CO2培养箱中摇动培养7天,将获得的培养上清液通过一次性胶囊过滤器(Advantec,#CCS-045-ElH)过滤。
通过pCMA-Gl/MAb1 H与pCMA-LK/MAb1 L之间和pCMA-G2/MAb1 H与pCMA-LK/MAb 1 L之间的组合获得的IgG1-型和IgG2-型嵌合MAb1抗体分别被缩写成"cMAb1-l"和"cMAb1-2"。术语"cMAb1"意指IgG1-型和IgG2-型嵌合MAb1抗体。
7)-2cMAb1-1和cMAb1-2的纯化
通过rProtein A亲和层析(在4-6℃)纯化上文中7-1)中获得的培养上清液。在室温进行rProtein A亲和层析纯化后的缓冲液置换步骤。首先,将1100至1200ml的培养上清液施加至用PBS平衡的MabSelect SuRe(由GE Healthcare Bio-Sciences Crop.制造的,HiTrap柱子;容积1mLx2连接的)。将整个培养液置于柱子中,随后用PBS洗涤柱子。然后,用2M精氨酸盐酸盐溶液(pH 4.0)进行洗脱以收集含抗体级分。使用脱盐柱(由GE Healthcare Bio-Sciences Corp.制造的,HiTrap脱盐柱;容积5mLx2连接的),利用PBS置换该级分中的缓冲液。最后,用离心UF过滤装置VIVASPIN20(分子量截留值:30K,Sartorius,于4℃)将级分浓缩成至20.0mg/mL或更高的IgG浓度,将其用作纯化样品。
7)-3cMAb1-1和cMAb1-2的性质
7)-3-1ROBO4下游信号的激活
除将人IgG(由Sigma-Aldrich Corp.生产的)用作阴性对照;和将人IgG、cMAb1-1或cMAb1-2以0.313μg/mL的终浓度添加至培养基外,按照4)-1的方法进行该测试。作为结果,阴性对照人IgG不影响瞬时表达人ROBO4的细胞中的IL-8启动子活性,而cMAb1-1和cMAb1-2增强IL-8启动子活性(图11)。这些结果表明cMAb1-1或cMAb1-2激活ROBO4的下游信号,如同MAb1一样。
7)-3-2HUVEC迁移测试
除将人IgG用作阴性对照,和将人IgG、cMAb1-1或cMAb1-2以0.5μg/mL的终浓度添加至培养基外,按照4)-2的方法进行该测试。作为结果,cMAb1-1或cMAb1-2抑制bFGF诱导的HUVEC的迁移(图12)。这些结果表明cMAb1-1或cMAb1-2抑制HUVEC的迁移,如同MAb1一样。
(实施例8)小鼠抗人ROBO4单克隆抗体MAb1的人源化抗体的设计
8)-1MAb1的人源化形式的设计
8)-1-1MAb1可变区的分子建模
通过公知的同源性建模法(Methods in Enzymology,203,121-153,(1991))进行MAb1可变区的分子建模。将在蛋白质数据库(Nuc.Acid Res.35,D301-D303(2007))中注册的人免疫球蛋白可变区的一级序列(可作为从x射线晶体结构推导的三维结构获得)与所测定的MAb1可变区的一级序列相比较。作为结果,3FFD因其在缺乏构架区的抗体中与MAb1重链可变区的最高序列同一性而被选择。同样地,1T66因其对MAb1轻链可变区的最高序列同源性而被选择。通过从对应于MAb1重链和轻链的3FFD和1T66的配位对组合获得“构架模型”来制备构架区的三维结构。关于MAb1的CDR,按照Thornton等人的分类(J.Mol.Biol.,263,800-815,(1996)),CDRL1、CDRL2、CDRL3、CDRH1和CDRH2被分别分配至簇16A、7A、9A、10A和10B。使用H3法则(FEBS letter 399,1-8(1996))将CDRH3分类至k(7)B。随后,将每一个CDR的典型构象整合入构架核苷酸。
最后,进行能量计算(以排除不利的原子间接触)以根据能量获得可能为MAb1可变区的分子模型。使用商购可得的蛋白质三维结构预测程序Prime和配位搜索程序MacroModel(Schrodinger,LLC)进行这些操作。
8)-1-2人源化MAb1氨基酸序列的设计
通过公知的CDR移植法(Proc.Natl.Acad.Sci.USA 86,10029-10033(1989))构建每一个人源化MAb1抗体(hMAb1)。基于构架区中的氨基酸的同源性选择2个不同的受体抗体。将MAb1构架区的序列与Kabat抗体氨基酸序列数据库(Nuc.Acid Res.29,205-206(2001))中的所有人构架相比较。作为结果,B3抗体因其对构架区有83%的序列同源性而被选择作为受体。将B3构架区的氨基酸残基与MAb1的氨基酸残基比对以鉴定使用的不同氨基酸的位置。使用上文中构建的MAb1的三维模型分析这些残基的位置。随后,根据由Queen等人提供的标准(Proc.Natl.Acad.Sci.USA 86,10029-10033(1989))选择待移植至受体上的供体残基。将一些选择的供体残基整合入受体抗体以构建人源化MAb1的序列,如下面实施例中描述的。同样地,通过用其它氨基酸残基置换hMAb1的每一个CDR中的1至3个氨基酸残基来构建hMAb1变体,如下面实施例中描述的。
8)-2cMAb1重链的人源化
8)-2-1hMAb1-H1-型重链:
通过在由SEQ ID NO:42所示的cMAb1-2重链中用谷氨酰胺替代氨基酸No.32(赖氨酸)、用精氨酸替代氨基酸No.38(赖氨酸)、用丙氨酸替代氨基酸No.59(苏氨酸)、用甘氨酸替代氨基酸No.61(谷氨酸)、用甘氨酸替代氨基酸No.63(精氨酸)、用赖氨酸替代氨基酸No.95(谷氨酸)、用天冬酰胺替代氨基酸No.103(丝氨酸)、用丙氨酸替代氨基酸No.107(丝氨酸)、用缬氨酸替代氨基酸No.112(甲硫氨酸)、用酪氨酸替代氨基酸No.114(苯丙氨酸)、用谷氨酰胺替代氨基酸No.129(组氨酸)、用亮氨酸替代氨基酸No.132(苏氨酸)和用缬氨酸替代氨基酸No.133(亮氨酸)设计的人源化MAb1重链,被命名为"hMAb1-H1-型重链"。
hMAb1-H1-型重链的氨基酸序列示于SEQ ID NO:56中。SEQ ID NO:56的氨基酸序列中由氨基酸残基1至19组成的序列、由氨基酸残基20至137组成的序列和由氨基酸残基138至463组成的序列分别对应于信号序列、重链可变区和重链恒定区。SEQ ID NO:56的氨基酸序列中由氨基酸残基50至54组成的序列、由氨基酸残基69至85组成的序列和由氨基酸残基118至126组成的序列分别对应于CDRH1序列、CDRH2序列和CDRH3序列。编码SEQ ID NO:56的氨基酸序列的核苷酸序列示于SEQ ID NO:55中。SEQ ID NO:55的核苷酸序列中由核苷酸1至57组成的序列、由核苷酸58-411组成的序列和由核苷酸412-1389组成的序列分别编码信号序列、重链可变区序列和重链恒定区序列。SEQ ID NO:55的核苷酸序列和SEQ ID NO:56的氨基酸序列也分别示于图31和32中。
8)-2-2hMAb1-H2-型重链:
通过在由SEQ ID NO:42所示的cMAb1-2重链中用谷氨酰胺替代氨基酸No.32(赖氨酸)、用精氨酸替代氨基酸No.38(赖氨酸)、用丙氨酸替代氨基酸No.59(苏氨酸)、用甘氨酸替代氨基酸No.61(谷氨酸)、用甘氨酸替代氨基酸No.63(精氨酸)、用谷氨酰胺替代氨基酸No.72(天冬酰胺)、用赖氨酸替代氨基酸No.95(谷氨酸)、用天冬酰胺替代氨基酸No.103(丝氨酸)、用丙氨酸替代氨基酸No.107(丝氨酸)、用缬氨酸替代氨基酸No.112(甲硫氨酸)、用酪氨酸替代氨基酸No.114(苯丙氨酸)、用谷氨酰胺替代氨基酸No.129(组氨酸)、用亮氨酸替代氨基酸No.132(苏氨酸)和用缬氨酸替代氨基酸No.133(亮氨酸)设计的人源化MAb1重链,被命名为"hMAb1-H2-型重链"。
hMAb1-H2-型重链的氨基酸序列示于SEQ ID NO:58中。SEQ ID NO:58的氨基酸序列中由氨基酸残基1至19组成的序列、由氨基酸残基20至137组成的序列和由氨基酸残基138至463组成的序列分别对应于信号序列、重链可变区和重链恒定区。SEQ ID NO:58的氨基酸序列中由氨基酸残基50至54组成的序列、由氨基酸残基69至85组成的序列和由氨基酸残基118至126组成的序列分别对应于CDRH1序列、CDRH2序列和CDRH3序列。编码SEQ ID NO:58的氨基酸序列的核苷酸序列示于SEQ ID NO:57中。SEQ ID NO:57的核苷酸序列中由核苷酸1至57组成的序列、由核苷酸58-411组成的序列和由核苷酸412-1389组成的序列分别编码信号序列、重链可变区序列和重链恒定区序列。SEQ ID NO:57的核苷酸序列和SEQ ID NO:58的氨基酸序列也分别示于图33和34中。
8)-2-3hMAb1-H3-型重链:
通过在由SEQ ID NO:42所示的cMAb1-2重链中用谷氨酰胺替代氨基酸No.32(赖氨酸)、用精氨酸替代氨基酸No.38(赖氨酸)、用丙氨酸替代氨基酸No.59(苏氨酸)、用甘氨酸替代氨基酸No.61(谷氨酸)、用赖氨酸替代氨基酸No.95(谷氨酸)、用天冬酰胺替代氨基酸No.103(丝氨酸)、用丙氨酸替代氨基酸No.107(丝氨酸)、用缬氨酸替代氨基酸No.112(甲硫氨酸)、用酪氨酸替代氨基酸No.114(苯丙氨酸)、用谷氨酰胺替代氨基酸No.129(组氨酸)、用亮氨酸替代氨基酸No.132(苏氨酸)和用缬氨酸替代氨基酸No.133(亮氨酸)设计的人源化MAb1重链,被命名为"hMAb1-H3-型重链"。
hMAb1-H3-型重链的氨基酸序列示于SEQ ID NO:60中。SEQ ID NO:60的氨基酸序列中由氨基酸残基1至19组成的序列、由氨基酸残基20至137组成的序列和由氨基酸残基138至463组成的序列分别对应于信号序列、重链可变区和重链恒定区。SEQ ID NO:60的氨基酸序列中由氨基酸残基50至54组成的序列、由氨基酸残基69至85组成的序列和由氨基酸残基118至126组成的序列分别对应于CDRH1序列、CDRH2序列和CDRH3序列。编码SEQ ID NO:60的氨基酸序列的核苷酸序列示于SEQ ID NO:59中。SEQ ID NO:59的核苷酸序列中由核苷酸1至57组成的序列、由核苷酸58-411组成的序列和由核苷酸412-1389组成的序列分别编码信号序列、重链可变区序列和重链恒定区序列。SEQ ID NO:59的核苷酸序列和SEQ ID NO:60的氨基酸序列也分别示于图35和36中。
8)-2-4hMAb1-H4-型重链:
通过在由SEQ ID NO:42所示的cMAb1-2重链中用谷氨酰胺替代氨基酸No.32(赖氨酸)、用精氨酸替代氨基酸No.38(赖氨酸)、用丙氨酸替代氨基酸No.59(苏氨酸)、用甘氨酸替代氨基酸No.61(谷氨酸)、用谷氨酰胺替代氨基酸No.72(天冬酰胺)、用赖氨酸替代氨基酸No.95(谷氨酸)、用天冬酰胺替代氨基酸No.103(丝氨酸)、用丙氨酸替代氨基酸No.107(丝氨酸)、用缬氨酸替代氨基酸No.112(甲硫氨酸)、用酪氨酸替代氨基酸No.114(苯丙氨酸)、用谷氨酰胺替代氨基酸No.129(组氨酸)、用亮氨酸替代氨基酸No.132(苏氨酸)和用缬氨酸替代氨基酸No.133(亮氨酸)设计的人源化MAb1重链,被命名为"hMAb1-H4-型重链"。
hMAb1-H4-型重链的氨基酸序列示于SEQ ID NO:62中。SEQ ID NO:62的氨基酸序列中由氨基酸残基1至19组成的序列、由氨基酸残基20至137组成的序列和由氨基酸残基138至463组成的序列分别对应于信号序列、重链可变区和重链恒定区。SEQ ID NO:62的氨基酸序列中由氨基酸残基50至54组成的序列、由氨基酸残基69至85组成的序列和由氨基酸残基118至126组成的序列分别对应于CDRH1序列、CDRH2序列和CDRH3序列。编码SEQ ID NO:62的氨基酸序列的核苷酸序列示于SEQ ID NO:61中。SEQ ID NO:61的核苷酸序列中由核苷酸1至57组成的序列、由核苷酸58-411组成的序列和由核苷酸412-1389组成的序列分别编码信号序列、重链可变区序列和重链恒定区序列。SEQ ID NO:61的核苷酸序列和SEQ ID NO:62的氨基酸序列也分别示于图37和38中。
8)-3MAb1轻链的人源化
8)-3-1hMAb1-L1-型轻链:
通过在由SEQ ID NO:38所示的cMAb1轻链中用异亮氨酸替代氨基酸No.22(丙氨酸)、用丝氨酸替代氨基酸No.27(苏氨酸)、用苏氨酸替代氨基酸No.34(丝氨酸)、用谷氨酸替代氨基酸No.37(天冬氨酸)、用脯氨酸替代氨基酸No.38(谷氨酰胺)、用亮氨酸替代氨基酸No.62(苯丙氨酸)、用脯氨酸替代氨基酸No.84(亮氨酸)、用缬氨酸替代氨基酸No.108(苯丙氨酸)、用酪氨酸替代氨基酸No.112(苯丙氨酸)、用脯氨酸替代氨基酸No.125(甘氨酸)、用缬氨酸替代氨基酸No.129(亮氨酸)、用天冬氨酸替代氨基酸No.130(谷氨酸)和用苏氨酸替代氨基酸No.134(丙氨酸)设计的人源化MAb1轻链被命名为"hMAb1-L1-型轻链"。
hMAb1-L1-型轻链的氨基酸序列示于SEQ ID NO:64中。SEQ ID NO:64的氨基酸序列中由氨基酸残基1至20组成的序列、由氨基酸残基21至134组成的序列和由氨基酸残基135至239组成的序列分别对应于信号序列、轻链可变区和轻链恒定区。SEQ ID NO:64的氨基酸序列中由氨基酸残基44至59组成的序列、由氨基酸残基75至81组成的序列和由氨基酸残基114至122组成的序列分别对应于CDRL1序列、CDRL2序列和CDRL3序列。编码SEQ ID NO:64的氨基酸序列的核苷酸序列示于SEQ ID NO:63中。SEQ ID NO:63的核苷酸序列中由核苷酸1至60组成的序列、由核苷酸61至402组成的序列和由核苷酸403-717组成的序列分别编码信号序列、轻链可变区序列和轻链恒定区序列。SEQ ID NO:63的核苷酸序列和SEQ ID NO:64的氨基酸序列也分别示于图39和40中。
8)-3-2hMAb1-L2-型轻链:
通过在由SEQ ID NO:38所示的cMAb1轻链中用异亮氨酸替代氨基酸No.22(丙氨酸)、用丝氨酸替代氨基酸No.27(苏氨酸)、用苏氨酸替代氨基酸No.34(丝氨酸)、用谷氨酸替代氨基酸No.37(天冬氨酸)、用脯氨酸替代氨基酸No.38(谷氨酰胺)、用谷氨酸替代氨基酸No.52(丝氨酸)、用赖氨酸替代氨基酸No.54(甘氨酸)、用亮氨酸替代氨基酸No.56(苏氨酸)、用亮氨酸替代氨基酸No.62(苯丙氨酸)、用脯氨酸替代氨基酸No.84(亮氨酸)、用缬氨酸替代氨基酸No.108(苯丙氨酸)、用酪氨酸替代氨基酸No.112(苯丙氨酸)、用脯氨酸替代氨基酸No.125(甘氨酸)、用缬氨酸替代氨基酸No.129(亮氨酸)、用天冬氨酸替代氨基酸No.130(谷氨酸)和用苏氨酸替代氨基酸No.134(丙氨酸)设计的人源化MAb1轻链被命名为"hMAb1-L2-型轻链"。
hMAb1-L2-型轻链的氨基酸序列示于SEQ ID NO:66中。SEQ ID NO:66的氨基酸序列中由氨基酸残基1至20组成的序列、由其氨基酸残基21至134组成的序列以及由其氨基酸残基135至239组成的序列分别对应于信号序列、轻链可变区和轻链恒定区。SEQ ID NO:66的氨基酸序列中由氨基酸残基44至59组成的序列、由氨基酸残基75至81组成的序列和由氨基酸残基114至122组成的序列分别对应于CDRL1序列、CDRL2序列和CDRL3序列。编码SEQ ID NO:66的氨基酸序列的核苷酸序列示于SEQ ID NO:65中。SEQ ID NO:65的核苷酸序列中由核苷酸1至60组成的序列、由核苷酸61至402组成的序列和由核苷酸403-717组成的序列分别编码信号序列、轻链可变区序列和轻链恒定区序列。SEQ ID NO:65的核苷酸序列和SEQ ID NO:66的氨基酸序列也分别示于图41和42中。
(实施例9)人源化MAb1的制备
9)-1人源化MAb1重链表达载体的构建
9)-1-1hMAb1-H1-型重链表达载体的构建
合成(GeneArt人工基因合成服务)包含编码由SEQ ID NO:56的氨基酸No.20至137所示的hMAb1-H1-型重链可变区的基因的DNA,利用限制性内切酶BlpI切割。将获得的DNA片段插入嵌合和人源化IgG2-型重链表达载体(pCMA-G2)的经限制性内切酶BlpI切割的位点,以构建hMAb1-H1-型重链表达载体。获得的表达载体被命名为"pCMA-G2/hMAb1-H1"。hMAb1-H1-型重链的核苷酸序列示于SEQ ID NO:55中。
9)-1-2hMAb1-H2-型重链表达载体的构建
使用下文中显示的引物组和QuikChange XL Site-Directed Mutagenesis试剂盒(Agilent Technologies,Inc.),利用9)-1-1中构建的pCMA-G2/hMAb1-H1作为模板作为模板构建hMAb1-H2-型重链表达载体。获得的表达载体被命名为"pCMA-G1/hMAb1-H2"。hMAb1-H2-型重链的核苷酸序列示于SEQ ID NO:57中,其氨基酸序列示于SEQ ID NO:58中。
引物组:
H-N53Q-F:5'-gggtggcaaccatcagccaaggcggcacctacacctac-3'
H-N53Q-R:5'-gtaggtgtaggtgccgccttggctgatggttgccaccc-3'
9)-1-3 hMAb1-H3-型重链表达载体的构建
合成(GeneArt人工基因合成服务)包含编码SEQ ID NO:60的氨基酸No.20至137所示的hMAb1-H3-型重链可变区的基因的DNA,用限制性内切酶BlpI进行切割。将所获得的DNA片段插入嵌合和人源化IgG2-型重链表达载体(pCMA-G2)的经限制性内切酶BlpI切割的位点以构建hMAb1-H3-型重链表达载体。获得的表达载体被命名为"pCMA-G2/hMAb1-H3"。hMAb 1-H3-型重链的核苷酸序列示于SEQ ID NO:59中。
9)-1-4hMAb1-H4-型重链表达载体的构建
以9)-1-3中构建的pCMA-G2/hMAb1-H3为模板,使用下文中显示的引物组和QuikChange XL Site-Directed Mutagenesis试剂盒(Agilent Technologies,Inc.)构建hMAb1-H4-型重链表达载体。获得的表达载体被命名为"pCMA-Gl/hMAb1-H4"。hMAb1-H4-型重链的核苷酸序列示于SEQ ID NO:61中,其氨基酸序列示于SEQ ID NO:62中。
引物组:
H-N53Q-F:5'-gggtggcaaccatcagccaaggcggcacctacacctac-3'
H-N53Q-R:5'-gtaggtgtaggtgccgccttggctgatggttgccaccc-3'
9)-2人源化MAb1轻链表达载体的构建
9)-2-1hMAb1-L1-型轻链表达载体的构建
合成(GeneArt人工基因合成服务)包含编码SEQ ID NO:64的氨基酸No.21至134所示的hMAb1-L1-型轻链可变区的基因的DNA,用限制性内切酶BsiWI进行切割。将所获得的DNA片段插入用于嵌合和人源化抗体轻链表达的一般目的载体pCMA-LK的经限制性内切酶BsiWI切割的位点,以构建hMAb1-L1-型轻链表达载体。获得的表达载体被命名为"pCMA-LK/hMAb1-L1"。hMAb1-L1-型轻链的核苷酸序列示于SEQ ID NO:63中。
9)-2-2hMAb1-L2-型轻链表达载体的构建
以9)-2-1中构建的pCMA-LK/hMAb1-L1为模板,使用KOD-Plus-(TOYOBO CO.,LTD.)和引物组A和B的每一个通过PCR获得DNA片段,使用引物组C通过重叠延伸PCR将其连接以制备包含编码hMAb1-L2-型轻链的基因的DNA。用限制性内切酶XbaI和PmeI切割该DNA以获得DNA片段,随后将所述DNA片段插入用于嵌合和人源化抗体轻链表达的一般目的载体(pCMA-LK)的经限制性内切酶XbaI/PmeI切割的位点,以构建hMAb1-L2-型轻链表达载体。获得的表达载体被命名为"pCMA-LK/hMAb1-L2"。hMAb1-L2-型轻链的核苷酸序列示于SEQ ID NO:65中,其氨基酸序列示于SEQ ID NO:66中。
引物组A:
L inf-F:
5'-gcctccggactctagagccaccatggtgctgcagacccaggtgttc-3'
L-EKL-:
5'-caggtacaggttcttgttctcgttttccaggctctggctgcttctgcagc-3'
引物组B:
L-EKL-F:
5'-gaaaacgagaacaagaacctgtacctgaactggtatctgcagaagcccg-3'
L inf-R:5'-tagcctcccccgtttaaacgggcccctaacactcccccctg-3'
引物组C:
L inf-F:
5'-gcctccggactctagagccaccatggtgctgcagacccaggtgttc-3'
L inf-R:5'-tagcctcccccgtttaaacgggcccctaacactcccccctg-3'。
(实施例10)人源化MAb1的制备
10-7-1)人源化MAb1的纯化
按照手册传代培养和培养FreeStyle 293-F细胞(Invitrogen Corp.)。
将对数生长期的1.2x109个细胞的FreeStyle 293-F细胞(Invitrogen Corp.)接种于3L Fernbach Erlenmeyer培养瓶(Corning Inc.),利用FreeStyle 293表达培养基(Invitrogen Corp.)将其稀释成1.0x106个细胞/mL,随后以90rpm在37℃于8%CO2培养箱中摇动培养1小时。将3.6mg聚乙烯亚胺(Polysciences,Inc.,#24765)溶解于20mL的Opti-Pro SFM培养基(Invitrogen Corp.)中。随后,将使用PureLink HiPure Plasmid试剂盒(Invitrogen Corp.)制备的H链表达载体(0.4mg)和L链表达载体(0.8mg)悬浮于20mL的Opti-Pro SFM培养基(Invitrogen Corp.)中。将20mL的表达载体/Opti-Pro SFM混合溶液添加至20mL的聚乙烯亚胺/Opti-Pro SFM混合溶液,逐渐搅拌混合物,再放置5分钟,随后添加至FreeStyle 293-F细胞。将细胞以90rpm在37℃于8%CO2培养箱中摇动培养7天,将获得的培养上清液通过一次性胶囊过滤器(Advantec,#CCS-045-ElH)过滤,以与7)-2中相同的方式进行纯化。
通过pCMA-G2/hMAb1-H1与pCMA-LK/hMAb1-L1之间的组合获得的人源化MAb1抗体命名为"H-1040"。通过pCMA-G2/hMAb1-H2与pCMA-LK/hMAb1-L1之间的组合获得的人源化MAb1抗体被命名为"H-1140"。通过pCMA-G2/hMAb1-H2与pCMA-LK/hMAb1-L2之间的组合获得的人源化MAb1抗体被命名为"H-1143"。通过pCMA-G2/hMAb1-H3与pCMA-LK/hMAb1-L1之间的组合获得的人源化MAb1抗体被命名为"H-2040"。通过pCMA-G2/hMAb1-H4与pCMA-LK/hMAb1-L1之间的组合获得的人源化MAb1抗体被命名为"H-2140"。通过pCMA-G2/hMAb1-H4与pCMA-LK/hMAb1-L2之间的组合获得的人源化MAb1抗体被命名为"H-2143"。
(实施例11)抗ROBO4人源化抗体的性质
11)-1结合亲和力
使用Biacore 3000(由GE Healthcare Bio-Sciences Corp.制造),以固定的抗体作为配体和以抗原为分析物来测定每一个抗体与rROBO4-ECD之间的解离常数。
通过固定(利用胺偶联法)在传感器芯片CM5(由GE Healthcare Bio-Sciences Corp.生产)上的抗人IgG抗体(由GE Healthcare Bio-Sciences Corp.生产)结合约80RU的抗体。使用的运行缓冲液为包含0.05%表面活性剂P20的PBS。以30μL/min的流速将抗原的系列稀释溶液(0.1-200nM)添加至抗体结合的芯片上,进行300秒。随后,监控解离相,进行300秒。以10μL/min的流速将3M MgCl2添加至其中作为再生溶液,进行30秒。使用分析软件(BIAevaluation Software,4.1版)的1:1结合模型分析数据,以计算缔合速率常数kon、解离速率常数koff和解离常数(KD;KD=koff/kon)。作为结果,KD值为0.41nM(对于H-1040)、3.5nM(对于H-1143)、3.9nM(对于H-1140)、0.40nM(对于H-2040)、1.7nM(对于H-2143)和1.8nM(对于H-2140)。
11)-2ROBO4下游信号的激活
除将人IgG用作阴性对照,和将人IgG、H-1040、H-1140、H-1143、H-2040、H-2140、H-2143或cMAb1-2以0.63μg/mL的终浓度添加至培养基外,按照4)-1的方法进行该测试。作为结果,阴性对照人IgG不影响瞬时表达人ROBO4的细胞中的IL-8启动子活性,而所有抗ROBO4人源化抗体都以等同于cMAb1-2的水平增强IL-8启动子活性(图49)。这些结果表明所有抗ROBO4人源化抗体激活ROBO4的下游信号,如同MAb1一样。
11)-3HUVEC迁移测试
除将人IgG用作阴性对照,将人IgG、H-1143、H-2140或H-2143以0.5μg/mL的终浓度添加至培养基,和使用平板读数器(EnVision:Perkin Elmer,Inc.)测量每一个孔的荧光强度(激发波长/荧光波长:485nm/538nm)外,按照4)-2的方法进行该测试。作为结果,H-1143、H-2140或H-2143抑制由bFGF诱导的HUVEC的迁移(图50)。此外,H-1140显示抗HUVEC迁移的抑制活性。这些结果表明H-1140、H-1143、H-2140或H-2143抑制HUVEC的迁移。
11)-4物种交叉反应性
11)-4-l制备表达抗原基因的细胞
按照4)-3-l的方法制备细胞。
11)-4-2流式细胞术分析
除将人IgG用作阴性对照;将FITC-AffiniPure山羊抗人IgG(Fcγ片段特异性的)(由Jackson ImmunoResearch Laboratories,Inc.生产的)用作二抗;和将流式细胞仪(FC500;由Beckman Coulter,Inc.生产的)用作检测器外,按照4)-3-2的方法进行该测试。作为结果,H-1143、H-2140或H-2143不结合小鼠ROBO4或大鼠ROBO4,但显示结合人ROBO4和食蟹猴ROBO4,如同亲代抗体MAb1一样(图51、52和53)。此外,H-1140显示与H-1143、H-2140和H-2143相同的结果。
11)-5H-1140、H-1143、H-2140或H-2143的结合特异性
11)-5-1制备表达抗原基因的细胞
除将pCI-FLAG-hROBO4-28用作人ROBO4表达载体外,按照4)-4-1的方法制备细胞。
11)-5-2流式细胞术分析
除将人IgG或小鼠IgG2A用作阴性对照;将针对小鼠IgG的缀合有荧光素的山羊IgG级分(由Cappel Laboratories,Inc.生产的)或FITC-AffiniPure山羊抗人IgG(Fcγ片段特异性的)用作二抗;和将流式细胞仪(FC500)用作检测器外,按照4)-4-2的方法进行该测试。作为结果,H-1143、H-2140或H-2143不结合hROBO1、hROBO2或hROBO3,但显示特异性结合人hROBO4,如同亲代抗体MAb1一样(图54)。此外,H-1140显示与H-1143、H-2140和H-2143相同的结果。在本说明书中,通过使用阳性对照抗体,确认hROBO4、hROBO1、hROBO2和hROBO3各自在细胞膜上表达(图54)。
11)-6在具有激光诱导的脉络膜新生血管化的猴模型中进行的药效评价
11)-6-1麻醉
以0.08mg/kg的剂量给每一只食蟹猴肌内注射美托咪定盐酸盐。15分钟后,以15mg/kg的剂量给其肌内注射盐酸氯胺酮。
11)-6-2模型制备
将11)-6-l中麻醉的每一只食蟹猴以仰卧位保持在不锈钢操作台上。将5mg/mL托吡卡胺-5mg/mL盐酸去氧肾上腺素混合滴眼剂施用于眼以进行瞳孔开大。使用绿色激光视网膜凝固器OcuLight GLx,通过激光照射(辐射的热量:500mW,照射时间:0.1秒,斑点尺寸:50μm,斑点数目:9个斑点)来热损伤视网膜的黄斑区。手术后,向经过操作处理的眼内滴加左旋氧氟沙星滴眼剂。
11)-6-3测试物质的施用
在模型制备后第7天,麻醉每一只食蟹猴,随后将其以仰卧位保持在不锈钢操作台上。随后将用无菌纯水稀释4倍的PA IODO洗眼液(Nitten Pharmaceutical Co.,Ltd.)施用于眼以对外眼部消毒。将33G针从结膜插入玻璃体,使用1-mL注射器将盐水或0.05mL调整至1.1mg/0.05mL的H-2143注射至其中。在施用完成后,使用拭子将眼耳用倍他米松-A软膏施用至结膜,通过眼的睁闭将其扩散至整个眼的表面。
11)-6-4药效评价
在模型制备后第7、14和21天,在麻醉下使用混合型眼底照相机CX-1通过常规方法对眼底进行照像。随后,将荧光素以0.05mL/Kg的剂量静脉内注射至其中。在完成荧光素的静脉内注射后,每1分钟至10分钟后进行荧光血管造影术,存储图像资料。根据图像资料,按照ZahnG等人的方法(Zahn G等人,Arch.Ophthalmol.2009127:1329-1335),基于每一个荧光素在其上积累的激光辐射部位的荧光强度,将严重度按1至5级的等级进行分类。
随后,基于百分比计算所有激光辐射部位中对应于严重度分类为4级和5级的部位的比率,以评价脉络膜新生血管化。作为施用盐水的组与施用H-2143的组之间脉络膜新生血管化比较的结果,随着离模型制备的时间的流逝,4和5级的比率在施用盐水的组中增加,而在施用H-2143的组中未观察到这样的增加。这意味着H-2143的施用抑制了激光诱导的脉络膜新生血管化(图55)。
[工业适用性]
本发明提供的抗体的使用使得能够治疗或预防血管生成疾病例如渗出性年龄相关性黄斑变性、糖尿病视网膜病变、黄斑水肿、良性或恶性肿瘤、动脉粥样硬化、晶体后纤维增生症、血管瘤、慢性炎症、眼部新生血管性疾病、增生性视网膜病、新生血管性青光眼、角膜组织移植物或其它组织移植物的免疫排斥、类风湿关节炎、银屑病、急性炎症、脓毒症或肥胖症,以及检查或诊断血管生成性疾病。
[序列表文本]
SEQ ID NO:1:全长人ROBO4 cDNA的核苷酸序列(图13)
SEQ ID NO:2:人ROBO4的氨基酸序列(图14)
SEQ ID NO:3:编码N末端FLAG-标记的全长人ROBO4的氨基酸序列的核苷酸序列
SEQ ID NO:4:N末端FLAG标记的全长人ROBO4的氨基酸序列
SEQ ID NO:5:编码由SEQ ID NO:2的氨基酸No.46至1007的氨基酸序列组成的人ROBO4的N末端FLAG标记的细胞外区域/结构域缺失变体的氨基酸序列的核苷酸序列
SEQ ID NO:6:由SEQ ID NO:2的氨基酸No.46至1007的氨基酸序列组成的人ROBO4的N末端FLAG标记的细胞外区域/结构域缺失变体的氨基酸序列
SEQ ID NO:7:编码由SEQ ID NO:2的氨基酸No.132至1007的氨基酸序列组成的人ROBO4的N末端FLAG标记的细胞外区域/结构域缺失变体的氨基酸序列的核苷酸序列
SEQ ID NO:8:由SEQ ID NO:2的氨基酸No.132至1007的氨基酸序列组成的人ROBO4的N末端FLAG标记的细胞外区域/结构域缺失变体的氨基酸序列
SEQ ID NO:9:编码由SEQ ID NO:2的氨基酸No.210至1007的氨基酸序列组成的人ROBO4的N末端FLAG标记的细胞外区域/结构域缺失变体的氨基酸序列的核苷酸序列
SEQ ID NO:10:由SEQ ID NO:2的氨基酸No.210至1007的氨基酸序列组成的人ROBO4的N末端FLAG标记的细胞外区域/结构域缺失变体的氨基酸序列
SEQ ID NO:11:编码由SEQ ID NO:2的氨基酸No.225至1007的氨基酸序列组成的人ROBO4的N末端FLAG-标记的细胞外区域/结构域缺失变体的氨基酸序列的核苷酸序列
SEQ ID NO:12:由SEQ ID NO:2的氨基酸No.225至1007的氨基酸序列组成的人ROBO4的N末端FLAG-标记细胞外区域/结构域缺失变体的氨基酸序列
SEQ ID NO:13:编码由SEQ ID NO:2的氨基酸No.341至1007的氨基酸序列组成的人ROBO4的N末端FLAG-标记细胞外区域/结构域缺失变体的氨基酸序列的核苷酸序列
SEQ ID NO:14:由SEQ ID NO:2的氨基酸No.341至1007的氨基酸序列组成的人ROBO4的N末端FLAG-标记细胞外区域/结构域缺失变体的氨基酸序列
SEQ ID NO:15:小鼠ROBO4 cDNA的核苷酸序列
SEQ ID NO:16:小鼠ROBO4的氨基酸序列
SEQ ID NO:17:大鼠ROBO4 cDNA的核苷酸序列
SEQ ID NO:18:大鼠ROBO4的氨基酸序列
SEQ ID NO:19:猴ROBO4 cDNA1的核苷酸序列
SEQ ID NO:20:猴ROBO4的氨基酸序列1
SEQ ID NO:21:猴ROBO4 cDNA2的核苷酸序列
SEQ ID NO:22:猴ROBO4氨基酸序列2
SEQ ID NO:23:人ROBO1 cDNA的核苷酸序列
SEQ ID NO:24:人ROBO1的氨基酸序列
SEQ ID NO:25:人ROBO2 cDNA的核苷酸序列
SEQ ID NO:26:人ROBO2的氨基酸序列
SEQ ID NO:27:人ROBO3 cDNA的核苷酸序列
SEQ ID NO:28:人ROBO4的氨基酸序列
SEQ ID NO:29:IL-8启动子区域的核苷酸序列
SEQ ID NO:30:编码MAb1重链可变区的cDNA的核苷酸序列(图15)
SEQ ID NO:31:MAb1重链可变区的氨基酸序列(图16)
SEQ ID NO:32:编码MAb1轻链可变区的cDNA的核苷酸序列(图17)
SEQ ID NO:33:MAb1轻链可变区的氨基酸序列(图18)
SEQ ID NO:34:包含编码人κ链分泌信号和人κ链恒定区的氨基酸的cDNA的核苷酸序列
SEQ ID NO:35:包含编码人重链信号序列和人IgG1恒定区的氨基酸的cDNA的核苷酸序列
SEQ ID NO:36:包含编码人重链信号序列和人IgG2恒定区的氨基酸的cDNA的核苷酸序列
SEQ ID NO:37:编码cMAb1轻链的cDNA的核苷酸序列(图19)
SEQ ID NO:38:cMAb1轻链的氨基酸序列(图20)
SEQ ID NO:39:编码cMAb1-1重链的cDNA的核苷酸序列(图21)
SEQ ID NO:40:cMAb1-1重链的氨基酸序列(图22)
SEQ ID NO:41:编码cMAb1-2重链的cDNA的核苷酸序列(图23)
SEQ ID NO:42:cMAb1-2重链的氨基酸序列(图24)
SEQ ID NO:43:编码MAb1重链CDRH1的氨基酸序列的核苷酸序列
SEQ ID NO:44:MAb1重链CDRH1的氨基酸序列(图25)
SEQ ID NO:45:编码MAb1重链CDRH2的氨基酸序列的核苷酸序列
SEQ ID NO:46:MAb1重链CDRH2的氨基酸序列(图26)
SEQ ID NO:47:编码MAb1重链CDRH3的氨基酸序列的核苷酸序列
SEQ ID NO:48:MAb1重链CDRH3的氨基酸序列(图27)
SEQ ID NO:49:编码MAb1轻链CDRL1的氨基酸序列的核苷酸序列
SEQ ID NO:50:MAb1轻链CDRL1的氨基酸序列(图28)
SEQ ID NO:51:编码MAb1轻链CDRL2的氨基酸序列的核苷酸序列
SEQ ID NO:52:MAb1轻链CDRL2的氨基酸序列(图29)
SEQ ID NO:53:编码MAb1轻链CDRL3的氨基酸序列的核苷酸序列
SEQ ID NO:54:MAb1轻链CDRL3的氨基酸序列(图30)
SEQ ID NO:55:编码hMAb1-H1-型重链的cDNA的核苷酸序列(图31)
SEQ ID NO:56:hMAb1-H1-型重链的氨基酸序列(图32)
SEQ ID NO:57:编码hMAb1-H2-型重链的cDNA的核苷酸序列(图33)
SEQ ID NO:58:hMAb1-H2-型重链的氨基酸序列(图34)
SEQ ID NO:59:编码hMAb1-H3-型重链的cDNA的核苷酸序列(图35)
SEQ ID NO:60:hMAb1-H3-型重链的氨基酸序列(图36)
SEQ ID NO:61:编码hMAb1-H4-型重链的cDNA的核苷酸序列(图37)
SEQ ID NO:62:hMAb1-H4-型重链的氨基酸序列(图38)
SEQ ID NO:63:编码hMAb1-L1-型轻链的cDNA的核苷酸序列(图39)
SEQ ID NO:64:hMAb1-L1-型重链的氨基酸序列(图40)
SEQ ID NO:65:编码hMAb1-L2-型重链的cDNA的核苷酸序列(图41)
SEQ ID NO:66:hMAb1-L2-型重链的氨基酸序列(图42)
SEQ ID NO:67:hMAb1-H2或hMAb1-H4-型重链的CDRH1(图43)
SEQ ID NO:68:hMAb1-H2或hMAb1-H4-型重链的CDRH2(图44)
SEQ ID NO:69:hMAb1-H2或hMAb1-H4-型重链的CDRH3(图45)
SEQ ID NO:70:hMAb1-L2-型轻链的CDRL1(图46)
SEQ ID NO:71:hMAb1-L2-型轻链的CDRL2(图47)
SEQ ID NO:72:hMAb1-L2-型轻链的CDRL3(图48)
- 还没有人留言评论。精彩留言会获得点赞!