选择性取代的喹啉化合物的制作方法
本申请要求2013年10月14日提交的美国临时专利申请第61/890,718号的优先权。该申请通过引用并入本文。
发明背景
技术领域
本公开内容的实施方案涉及选择性取代的喹啉化合物和包含一种或多种所述化合物作为活性成分的药物试剂。更具体地,本公开内容的实施方案涉及用作针对Toll样受体(TLR)7和Toll样受体8的拮抗剂或抑制剂的化合物,以及所述化合物在有效治疗系统性红斑狼疮(SLE)和狼疮肾炎的药物组合物中的用途。
相关技术描述
系统性红斑狼疮(SLE)和狼疮肾炎是以炎症和组织损伤为特征的自身免疫性疾病。例如,SLE可以对皮肤、肝脏、肾脏、关节、肺和中枢神经系统造成损伤。SLE患者可经历全身症状,例如极度疲劳、关节疼痛和肿胀、不明原因发热、皮疹、肾功能障碍。因为在患者中涉及的器官不同,因此症状可多样化。SLE是主要发于年轻女性的疾病,发作高峰为15-40岁,并且在女性中的患病率比男性高约10倍。
目前对SLE的治疗通常涉及免疫调节药物,例如贝利单抗(belimumab)、羟氯喹、强的松(prednisone)和环磷酰胺。所有这些药物可具有剂量限制性副作用,并且许多患者仍然患有难以控制的疾病。
发明概述
本公开内容的实施方案提供用于预防或治疗患者中以Toll样受体7活化或Toll样受体8活化为特征的疾病或病况的化合物及方法。一个实施方案以式(I)的化合物为特征:
其中R1和R2中的至少一个为-H、甲基或乙基,而另一个为
-H;或另一个为
被以下任选取代的C1-C6烃基:
-OH、甲氧基、乙氧基、-OCH(CH3)2、-O(CH2)2CH3、苯基、呋喃基、-O(CH2)2OH、苯氧基、甲硫基、-F、-N(CH3)2、氰基、吡啶基氧基、氟苯氧基、异色满基、苯酚、苄基氨基、-NHCH3、氧代-、氨基、羧基、7元螺氨基、饱和或不饱和的且任选地包括选自O和N的一个或多个杂原子以及在一个或多个C或N原子上由甲基、氰基、氟、甲基氨基或三氟甲基任选取代的三元至六元环烃基;或者另一个为
饱和或不饱和的、任选桥接的、任选包括选自O、S和N的一个或多个杂原子以及在一个或多个C或N原子上由甲基、乙基、吡啶基、氮杂环丁基、乙酰氨基、甲酰氨基、氰基、氟、甲基氨基或三氟甲基任选取代的C3-C7环烃;或者
R1和R2连同它们所连接的氮原子一起形成8元至11元螺环二胺、8元二环二胺、7元螺噁茂胺、被乙基任选取代的哌啶基或被甲酰氨基、氨基甲基、甲基、(乙基氨基)甲基、(二甲基氨基)甲基、二甲基氨基、(甲基氨基)甲基和氨基中的至少一个任选取代的四元至六元环烃基;并且其中R3为-H或甲基。
在另一实施方案中,化合物为式(I)的化合物,其具有在式(Ia)、式(Ib)、式(Ic)或(Id)之一中所阐述的立体化学,其具有与以上式(Ia)所阐述的相同的取代基选择:
另一实施方案提供了式(Ie)(相对立体化学显示如下)的化合物:
在另一实施方案中,化合物为式(II)的化合物:
其中
R4为-H或甲基;
R5为饱和的、部分饱和的或不饱和的C1-C5烃基以及被以下任选取代的C1-C5烃基:
-H、-Cl、-F、-OH、-NH2、氧代-、-N(CH2CH3)2、苯基、环己基、苯基三唑基、环己基三唑基、吡啶基、吡咯烷基,
被甲基或羟甲基任选取代的吗啉基,
被以下取代的-O-:
C1-C6烃基、甲基苯基、甲基环己基、吡啶基、二嗪基或者被-F或甲基任选取代的苯基,
被以下取代的-NH-:
直链的、支链的或环状的、饱和的或不饱和的以及被氧代-、苯基、甲基、或-OH任选取代的C2-C7烃基,
被甲基、甲氧基、苯基或氨基任选取代的吡啶基,
被乙基任选取代的二嗪基,
苯并咪唑基、甲基苯基、苯基吡唑基、萘啶基,
被-F、甲基、乙基或乙氧基任选取代的苯基,
被甲基任选取代的咪唑烷基
或者R5为其中n为1-3,并且其中所述环状胺被以下任选取代
被以下任选取代的C1-C3烃基:
-OH、-F、苯基、-NH2、环己基、-N(CH3)2、-C(O)NH2、甲基磺酰氨基、苯磺酰氨基、甲基苯磺酰氨基,或者
被甲基或羟基任选取代的吡咯烷基,或者
-NHC(O)R6,其中R6为
C1-C5烃基、苯基、吡啶基、氟苯基、甲基磺酰基、氟苯磺酰基、二甲基吡唑磺酰基,或者
被甲基任选取代的吡唑基;
被-C(O)CH3、-C(O)CH2CH3、甲基、氧代-、C(O)Ph、-NH2、-NH-C(O)CH3或者任选取代的哌啶基,
被-C(O)OC(CH3)3、甲基、-C(O)CH3、-C(O)Ph、C(O)CH(CH3)2、-C(O)CH3或者甲基磺酰基任选取代的哌嗪基;或者
R5为其中n为1或2,并且其中所述环状二胺在至少一个碳原子上被以下任选取代
甲基、氧代-、-N(CH3)2、氨基、-CH2CH3,或者
被甲基、-C(O)CH3、-C(O)CH(CH3)2、-C(O)Ph或–C(O)OC(CH3)3任选取代的哌啶基,并且
其中R7为–H、苯基、-C(O)CH3、C1-C3烃基、-C(O)NH2或–C(O)Ph;并且R8为甲氧基或氰基。
另一实施方案提供式(III)的化合物:
其中
R11为H或甲基;
R10为H,或者当R14和R9都是H时,R10为甲基-1,4’-联哌啶基;
R9为-H或为被1,4’-联哌啶基、氧代-、羟基、甲基吡啶基或由羟基、-N(CH3)2或哌啶基任选取代的哌啶基取代的-CH2-;
在另一实施方案中,化合物选自rel-(2R,6R)-4-(8-氰基喹啉-5-基)-N-((3R,4S)-4-氟吡咯烷-3-基)-6-甲基吗啉-2-甲酰胺盐酸盐、(2R,6R)-4-(8-氰基喹啉-5-基)-6-甲基-N-(1-甲基哌啶-4-基)吗啉-2-甲酰胺、5-((2S,6R)-2-([1,4’-联哌啶]-1’-基甲基)-6-甲基吗啉代)喹啉-8-甲腈以及5-((2R,7R)-2-(羟甲基)-7-甲基-1,4-氧杂氮杂环庚烷-4-基)喹啉-8-甲腈。
在另一实施方案中,前述段落的化合物或其药物有效的盐对在HEK-293细胞系中表达的人TLR7受体的IC50小于或等于20nM。在另一实施方案中,本公开内容的前述段落的化合物或其药物有效的盐对在HEK-293细胞系中表达的人TLR7受体的IC50小于或等于100nM。在另一实施方案中,对在HEK-293细胞系中表达的人TLR7受体的IC50通过以下测量:(1)将在包含10%胎牛血清的达尔伯克改良伊格尔培养基中密度为2.22×105个细胞/ml的稳定表达TLR7的HEK-293细胞系的细胞接种至384孔板内,并且在37℃、5%CO2下孵育2天;(2)添加所述化合物或其药物可接受的盐,并且将所述细胞孵育30分钟;(3)添加3μg/ml的CL097(InvivoGen)并且将所述细胞孵育约20小时;以及(4)通过测量发光对NF-κB依赖性报告物活化进行定量。
在本公开内容的其它实施方案中,化合物对在HEK-293细胞系中表达的人TLR7受体的IC50小于或等于200nM、小于或等于180nM、小于或等于160nM、小于或等于140nM、小于或等于120nM、小于或等于100nM、小于或等于80nM、小于或等于60nM、小于或等于40nM、小于或等于20nM。在本公开内容的其它实施方案中,化合物对在HEK-293细胞系中表达的人TLR7受体的IC50为10nM至30nM、10nM至50nM、10nM至100nM、30nM至50nM、30nM至100nM或50nM至100nM。在其它实施方案中,对在HEK-293细胞系中表达的人TLR7受体的IC50通过以下测量:(1)将在包含10%胎牛血清的达尔伯克改良伊格尔培养基中密度为2.22×105个细胞/ml的稳定表达TLR7的HEK-293细胞系的细胞接种至384孔板内,并且在37℃、5%CO2下孵育2天;(2)添加所述化合物或其药物可接受的盐,并且将所述细胞孵育30分钟;(3)添加3μg/ml的CL097(InvivoGen)并且将所述细胞孵育约20小时;以及(4)通过测量发光对NF-κB依赖性报告物活化进行定量。
其它实施方案提供了治疗狼疮的方法,包括但不限于治疗系统性红斑狼疮、皮肤型狼疮、神经精神性狼疮、胎儿心脏传导阻滞和抗磷脂综合征,所述方法包括施用药物有效量的本公开内容的化合物或药物可接受的盐。
其它实施方案提供了拮抗TLR7的方法,包括施用药物有效量的本公开内容的化合物或药物可接受的盐。
其它实施方案提供了拮抗TLR8的方法,包括施用药物有效量的本公开内容的化合物或药物可接受的盐。
其它实施方案提供了包含至少一种本公开内容的化合物或药物可接受的盐和至少一种药物可接受的载体的药物组合物。
其它实施方案提供了治疗系统性红斑狼疮或狼疮的方法,包括施用药物有效量的本公开内容的化合物或药物可接受的盐。
其它实施方案提供了拮抗TLR7的方法,包括施用药物有效量的本公开内容的化合物或药物可接受的盐。
其它实施方案提供了拮抗TLR8的方法,包括施用药物有效量的本公开内容的化合物或药物可接受的盐。
其它实施方案提供了包含本公开内容的至少一种化合物或药物可接受的盐和至少一种药物可接受的载体的药物组合物。
本文所使用的术语“任选取代的”意为主体结构可以包括但不必须包括独立地选自低级烷基、甲氧基-、-OH、-NH2、-CH2-NH-CH2、-OCH2CH2CH3或-OCH(CH3)2中的一个或多个取代基。如果任选取代的部分是环状的,那么任选取代可以是环中两个原子之间的甲基桥。
本文所使用的符号“C(O)”指的是具有式C=O的羰基。
除非另有说明,否则在本公开内容(包括权利要求)中所使用的“一个(种)(a)”和“一个(种)(an)”意为“一个(种)或多个(种)”。
如本文所使用,“低级烷基”指的是具有一个至四个碳原子的直链的饱和烃,或在三个碳基团和四个碳基团的情况下为直链、支链或环状的饱和烃。
如本文所使用,当涉及包含氮的杂环部分时,术语“通过氮连接”意为所述部分与另一结构连接的点是通过作为杂环的一部分的氮。
如本文所使用,术语“TLR7/8”意为“TLR7和TLR8”或者“TLR7或TLR8”或者“TLR7和/或TLR8”。基于出现“TLR7/8”的上下文,本领域的技术人员能够理解具体的含义。
本文所述的杂环部分包括氮杂环丁基、吡咯烷基、哌啶基、甲基氮杂环丁基、吡唑基、哌嗪基、吗啉基、噻唑基、吡咯并吡咯基、咪唑烷基和异噻唑基。在提及杂环基团的情况下,除非另外说明,否则应当理解的是,在基团中的杂环原子可以处于基团中的任何位置。还应当理解的是,咪唑基、吡唑基、噻唑基和吡咯基可以是不饱和的或部分不饱和的。本公开内容的实施方案可以包括药物组合物,所述药物组合物包含一种或多种本公开内容的化合物与药物可接受的赋形剂。这些药物组合物可以用于治疗或预防患者(通常是人类患者)中以TLR7/8活化为特征的疾病或病况,所述患者患有或易患此类病况或疾病。以TLR7/8活化为特征的疾病或病况的实例包括系统性红斑狼疮(SLE)和狼疮肾炎。
如本文所使用,本公开内容的实施方案的化合物的“有效量”为以足以治疗或预防SLE和狼疮肾炎的量的上述化合物的有效量。
本文所提供的实施方案可以包括不对称中心或手性中心。实施方案包括各种立体异构体及其混合物。本公开内容的实施方案的化合物的各个立体异构体可以由包含不对称中心或手性中心的商购原料来合成制备,或通过制备对映体化合物的混合物然后拆分那些化合物来制备。适当的拆分方法包括:将指定(+/-)的对映体的外消旋混合物附着于手性助剂,通过色谱法或重结晶分离所产生的非对映体,并且从所述助剂中分离光学纯产物;或在手性色谱柱上直接分离光学对映体的混合物。
本公开内容的实施方案还包括包含本公开内容的任何化合物以及药物可接受的赋形剂的药物组合物。药物组合物可以用于治疗或预防SLE和狼疮肾炎。因此,本公开内容的实施方案还可以以用于治疗或预防患有或易患狼疮肾炎或SLE的人类患者中的SLE或狼疮肾炎的方法为特征。
本公开内容的实施方案包括本文所提供的化合物的药物可接受的盐。术语“药物可接受的盐”指的是在合理的医学判断范围内适用于与人类和动物的组织接触而没有异常毒性、刺激性或过敏反应的那些盐。药物可接受的盐是本领域众所周知的。例如,S.M.Berge等人在J.Pharmaceutical Sciences 66:1-19,1977中详细描述了药物可接受的盐。可以在化合物的最终分离和纯化过程中原位制备盐或单独通过游离的碱性基团与适当的有机酸的反应原位制备盐。代表性的酸加成盐包括乙酸盐、己二酸盐、藻酸盐、抗坏血酸盐、天冬氨酸盐、苯磺酸盐、苯甲酸盐、硫酸氢盐、硼酸盐、丁酸盐、樟脑酸盐、樟脑磺酸盐(camphersulfonate)、柠檬酸盐、环戊烷丙酸盐、二葡糖酸盐、十二烷基硫酸盐、乙磺酸盐、富马酸盐、葡庚糖酸盐、甘油磷酸盐、半硫酸盐、庚糖酸盐(heptonate)、己酸盐、氢溴酸盐、盐酸盐、氢碘酸盐、2-羟基-乙磺酸盐、乳糖酸盐、乳酸盐、月桂酸盐、月桂基硫酸盐、苹果酸盐、马来酸盐、单马来酸盐、丙二酸盐、甲磺酸盐、2-萘磺酸盐、烟酸盐、硝酸盐、油酸盐、草酸盐、棕榈酸盐、双羟萘酸盐、果胶酸盐、过硫酸盐、3-苯基丙酸盐、磷酸盐、苦味酸盐、新戊酸盐、丙酸盐、硬脂酸盐、琥珀酸盐、硫酸盐、酒石酸盐、硫氰酸盐、甲苯磺酸盐、三氟乙酸盐、十一烷酸盐、戊酸盐等。代表性的碱金属盐或碱土金属盐包括钠盐、锂盐、钾盐、钙盐、镁盐等,以及无毒性铵盐、季铵盐和胺阳离子盐,包括但不限于铵、四甲基铵、四乙基铵、甲胺、二甲胺、三甲胺、三乙胺、乙胺等。
本文所用的术语“药物可接受的酯”表示在体内水解并且包括在人体内容易分解以留下母体化合物或其盐的那些酯。适当的酯基团包括,例如衍生自药物可接受的脂肪族羧酸,特别是链烷酸、链烯酸、环烷酸和链烷双酸,其中各个烷基或烯基基团通常具有不超过6个碳原子的那些酯基团。具体的酯的实例包括甲酸酯、乙酸酯、丙酸酯、丁酸酯、丙烯酸酯和乙基琥珀酸酯。
在本申请中,对映体通过符号“R”或“S”指定,或通过常规方法用定义在三维空间中位于页面平面上方的取代基的加粗线以及定义在三维空间中位于打印页面平面下方的取代基的点划线或虚线来绘制。如果没有进行立体化学指定,那么结构定义包括两种立体化学选择。如果结构或化学名称包括“REL”或“rel”,那么将该结构理解为显示相对立体化学。
附图简述
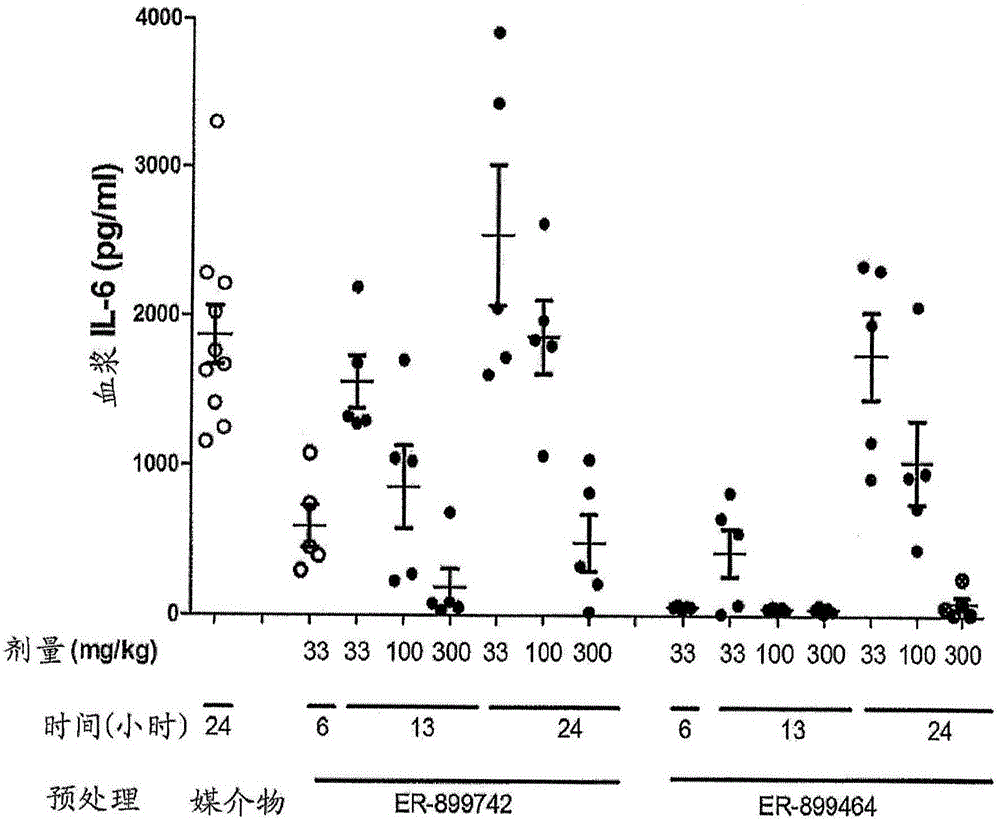
图1A和图1B示出了通过化合物ER-899742和ER-899464对小鼠中的TLR7途径的短期体内抑制。图例:将雌性BALB/c小鼠通过灌胃口服单独的媒介物(0.5%甲基纤维素水溶液)或者以33mg/kg、100mg/kg或300mg/kg在媒介物中配制的化合物给药。在口服给药6小时、13小时或24小时后,对小鼠皮下注射15μg R848以刺激TLR7。通过心脏穿刺收集血浆,然后通过标准ELISA程序评估在TLR7刺激之后1.5小时的IL-6的水平。在单个实验中并排测试了ER-899742和ER-899464(图1A)。用ER-899742进行了重复实验,其在三个时间点检验了所有三种剂量(图1B)。
图2A至图2C示出了在NZBxNZW品系(下文中缩写为NZBWF1/J或NZB/W)狼疮疾病模型中测试ER-899742的结果。图例:接收5周龄的雌性NZBWF1/J小鼠,进行基线取血,并且通过以下抗-dsDNA滴度监控小鼠的疾病进展。在27周龄后,将小鼠随机分成具有相等中值的抗-dsDNA滴度的小组,并且在29周龄时用单独的媒介物(Veh;0.5%甲基纤维素)或者以33mg/kg、100mg/kg或300mg/kg每天一次口服(QD PO)治疗。在治疗17周后,在46周龄时,对小鼠取血并且测试抗-dsDNA滴度。在50周龄(21周的化合物治疗)处死所有小鼠。在50周龄结束之前(21周的治疗后),从各个小鼠收集尿液,并且测定各只动物的尿白蛋白/肌酸酐比(UACR,蛋白尿)作为肾功能的间接量度(图2A)。在本研究中观察了最高剂量组和最低剂量组的死亡率的时间进程(图2B)。并未见到用化合物治疗的死亡率。此外,在中剂量组未观察到死亡率(未示出)。显示了在给药17周后,在46周龄时,治疗对抗-dsDNA滴度的影响(图2C)。未观察到统计上的显著效果。
图3A至图3E示出了在姥鲛烷:DBA/1品系狼疮疾病模型中测试化合物ER-899742的结果。图例:向9周龄的雌性DBA/1小鼠给予腹膜内注射0.5ml姥鲛烷或PBS。在注射姥鲛烷后的9周,将动物进行取血用于自身抗体滴度。在注射姥鲛烷之后10周,开始用媒介物(Veh;0.5%甲基纤维素)或33mg/kg ER-899742、100mg/kg ER-899742或300mg/kg的ER-899742进行一天一次的口服给药,并且持续治疗13周。在化合物治疗13周后,使小鼠安乐死,并且通过ELISA在血浆样品中测量抗-dsDNA(图3A)滴度、抗-Sm/nRNP(图3B)滴度、抗-组蛋白(图3C)滴度和抗-RiboP(图3D)滴度(通过ANOVA用Dunnett后检验测定治疗相对于媒介物的统计显著性)。在用300mg/kg的ER-899742治疗13周之后,通过qPCR板测量全血中IFN调节基因的表达,并且计算IFN基因标签评分(关于IFN评分计算的细节,参见“药理学材料和方法”部分)(图3E)。表格示出了相对于PBS对照,通过姥鲛烷治疗而显著上调的基因的完整列表。当计算干扰素评分时,在治疗的动物与媒介物治疗的动物之间未见显著差异。然而,相对于媒介物治疗,化合物治疗使六个基因出现显著减低(学生t检验),并且将该六个基因在表格中进行了标记。
图4A至图4C示出了在与图2A相同的实验中,在NZB/W疾病模型中测试ER-899464的结果。图例:在50周龄结束之前(21周的治疗后),从各个小鼠收集尿液,并且测定各只动物的尿白蛋白/肌酸酐比(UACR,蛋白尿)作为肾功能的间接量度(图4A)。在本研究中观察了最高剂量组和最低剂量组的死亡率的概括(图4B)。在中剂量组未见死亡率(未示出)。显示了在给药17周后,在46周龄时,治疗对抗-dsDNA滴度的影响(图5C)。未观察到统计上的显著效果。
图5A至图5D示出了在与图3A至图3E中所示的实验相同的实验中,在姥鲛烷疾病模型中测试ER-899464的结果。图例:在化合物治疗13周后,使小鼠安乐死,并且通过ELISA在血浆样品中测量抗-dsDNA(图5A)滴度、抗-Sm/nRNP(图5B)滴度、抗-组蛋白(图5C)滴度和抗-RiboP(图5D)滴度(通过ANOVA用Dunnett后检验测定治疗相对于媒介物的统计显著性)。正如针对ER-899742所进行的,测试了干扰素驱动的基因表达,但是图3B中所示的疾病上调基因未受到用ER-899464治疗的影响。
图6示出了根据本文所示的各种实施方案的结构和相应的化学名称。“ER-编号”是对各个化合物所指定的参考编号。在可获得的情况下,还包括对稳定表达人TLR7的HEK细胞系的活性、对稳定表达人TLR9的HEK细胞系的活性、1H NMR数据和质谱分析数据。
图7A至图7G示出了在DBA/1J小鼠中的姥鲛烷诱导的疾病中用ER-899742给药的作用。图例:向9周龄的雌性DBA/1小鼠给予腹膜内注射0.5ml姥鲛烷或PBS。在注射姥鲛烷后的10周,将动物进行取血用于自身抗体滴度。在注射姥鲛烷之后11周,开始用媒介物(Veh;0.5%甲基纤维素)或33mg/kg ER-899742或300mg/kg ER-899742进行一天一次的口服给药,并且持续治疗14周。在化合物治疗14周后,使小鼠安乐死,并且通过ELISA在血浆样品中测量抗-dsDNA(图7A)滴度、抗-RiboP(图7B)滴度、抗-Sm/nRNP(图7C)滴度和抗-组蛋白(图7D)滴度(通过ANOVA用Dunnett后检验测定治疗相对于媒介物的统计显著性)。在给药结束时,将相同的血浆用于通过ELISA测量总的IgG滴度(图7E)。在总体IgG水平存在最小变化的情况下,可见自身抗体对dsDNA和RiboP的控制。在本实验中的姥鲛烷治疗的小鼠患有关节炎,其中发生了在后爪的关节具有肿胀关节的关节炎。根据严重程度指定关节炎评分,基于肿胀和炎症的指征,将各只爪在0-4级进行评分。概括了在各只动物上进行评估的两只后爪的评分,并且如以上ELISA滴度,将所述评分用统计评估描绘于图7F中。观察到了剂量依赖性的统计学上的显著抑制。当计算干扰素评分时,在治疗的动物与媒介物治疗的动物之间未见显著差异。然而,图7G显示在用ER-899742治疗时,28个疾病相关的干扰素调节基因中有五个发生下调。
在产生高水平的自身抗体之后,图8包含对具有晚期疾病的DBA/1J小鼠中的姥鲛烷诱导的疾病用ER-899742治疗一个月的结果。图例:向10周龄的DBA/1J小鼠i.p.注射姥鲛烷。三个月后,获得抗-RiboP滴度和抗-dsDNA滴度,并且将动物随机分成具有一致平均滴度的组。在口服给药ER-899742一周、两周或四周后处死各组,并且在血清中测量RiboP滴度。图8显示在给药28天后,无统计学上显著反转的抗-RiboP滴度或抗-DNA滴度,尽管给药与滴度缺乏增长有关。
图9为作为HCl盐的ER-899742的晶体结构的ORTEP图。
发明详述
I.TLR和狼疮
哺乳动物Toll样受体(TLR)除了起到能够检测外源性(“非自身”)病原体相关分子模式(PAMP-即通过TLR4检测细菌LPS)的先天免疫受体的作用以外,它们还能够识别宿主组织损伤或应激反应后释放的内源性刺激物(DAMP)。Kono,H.和K.L.Rock,How dying cells alert the immune system to danger.Nat Rev Immunol,2008.8(4):p.279-89。在最近的十年中,已经出现了对内源性(“自身”)危险相关分子模式(DAMP)的TLR活化与自身免疫紊乱的病因学之间的关联的理解。具体地,TLR7可以通过来源于哺乳动物源和病毒源的单链RNA(ssRNA)来活化,而TLR9可以通过来源于哺乳动物源、病毒源和细菌源的DNA来活化。
狼疮的特征在于针对双链DNA(dsDNA)本身和相关的蛋白质(组蛋白)的自身抗体反应性,以及针对诸如Ro、La、Smith(Sm)和U1snRNP的大量RNA相关蛋白质的自身抗体反应性。Kirou,K.A.等人,Activation of the interferon-alpha pathway identifies a subgroup of systemic lupus erythematosus patients with distinct serologic features and active disease.Arthritis Rheum,2005.52(5):p.1491-503。显示与疾病严重程度直接相关的狼疮的第二种常见标志为:在狼疮患者的PBMC(所谓的1型IFN基因标签)中1型干扰素(IFN)(特别是IFNα)的异常表达以及多组IFNα调节基因的相应提高。Kirou,K.A.等人,同上。血液中的IFN主要来源于称作浆细胞样树突状细胞(pDC)的特化的免疫细胞,其组成型表达TLR7和TLR9。
当许多研究小组共同证明了从狼疮患者中而不是从健康供体中分离的抗体复合物能够以TLR7/9依赖性方式和RNA/DNA依赖性方式驱动pDC产生IFN时,推测了这两种疾病特性、自身抗体以及IFN水平之间的因果关系。Means,T.K.等人,Human lupus autoantibody-DNA complexes activate DCs throμgh cooperation of CD32and TLR9.J Clin Invest,2005.115(2):407-17页;Vollmer,J.等人,Immune stimulation mediated by autoantigen binding sites within small nuclear RNAs involves Toll-like receptors 7and 8.J Exp Med,2005.202(11):1575-85页;Savarese,E.等人,U1small nuclear ribonucleoprotein immune complexes induce type I interferon in plasmacytoid dendritic cells throμgh TLR7.Blood,2006.107(8):3229-34页。此外,IFN刺激TLR7/9在B细胞上的表达增加,由此增强自身反应性B细胞分化成产生抗体的浆细胞的TLR/BCR(B细胞受体)活化。Banchereau,J.和V.Pascual,Type I interferon in systemic lupus erythematosus and other autoimmune diseases.Immunity,2006.25(3):383-92页。以这种方式,包含核酸TLR7/9配体的自身抗体复合物的水平驱动促炎性循环和狼疮疾病发展。我们认为有可能TLR7/8的药理学拮抗将通过破坏这种促炎性循环、降低IFN水平以及抑制由pDC和B细胞介导的自身免疫疾病过程来为狼疮患者提供治疗益处。
几种其它证据表明TLR7在人狼疮病因学中的作用,并且支持了TLR受体是疾病干预的有效靶标的观点。已经鉴定了TLR7的3’UTR中的特异性多态性,并且显示出与TLR7表达提高和IFN基因标签增强两者相关。Shen,N.等人,Sex-specific association of X-linked Toll-like receptor 7(TLR7)with male systemic lupus erythematosus.Proc Natl Acad Sci U S A,2010.107(36):15838-43页。Deng,Y.等人,MicroRNA-3148modulates allelic expression of toll-like receptor 7variant associated with systemic lupus erythematosus.PLOS Genetics,2013.e1003336。此外,狼疮护理标准(SOC)抗疟药物(例如氯喹)破坏内体TLR7/9信号传导并抑制由ssRNA-核糖核蛋白复合物或狼疮患者血清诱导的PBMC和/或pDC IFNα的产生。此外,骨髓DC和单核细胞在自身RNA/TLR8信号传导后产生IL-12p40、TNFα和IL-6,表明除了TLR7驱动pDC产生IFN的作用以外,TLR8依赖性促炎症细胞因子对人狼疮病因学存在额外的贡献。Vollmer,同上;Gorden,K.B.等人,Synthetic TLR agonists reveal functional differences between human TLR7and TLR8.J Immunol,2005.174(3):1259-68页。
小鼠模型证明在狼疮中也存在TLR的作用。公开的研究已经共同证明,单TLR7基因缺失或双TLR7/9基因缺失或双TLR7/9药理学抑制在四种不同的狼疮模型中降低了疾病的严重程度。Nickerson,K.M.等人,TLR9regulates TLR7-and MyD88-dependent autoantibody production and disease in a murine model of lupus.J Immunol,2010.184(4):1840-8页;Fairhurst,A.M.等人,Yaa autoimmune phenotypes are conferred by overexpression of TLR7.Eur J Immunol,2008.38(7):1971-8页;Deane,J.A.等人,Control of toll-like receptor 7expression is essential to restrict autoimmunity and dendritic cell proliferation.Immunity,2007.27(5):801-10页;Savarese,E.等人,Requirement of Toll-like receptor 7for pristane-induced production of autoantibodies and development of murine lupus nephritis.Arthritis Rheum,2008.58(4):1107-15页。单独的TLR7的转基因过表达在正常的抗疾病C57BL/6品系中导致自发性抗-RNA自身反应性和肾炎,这突出了TLR7作为自身免疫的关键性决定因素的作用。Deane,同上。
从安全性角度来看,并没有报道TLR7、TLR8或TLR9单基因缺陷型小鼠或者TLR7/8和TLR7/9双基因缺陷型小鼠免疫受损至观测到机会致病菌感染的程度。同样地,认为SOC抗疟药物以预测至少部分抑制TLR7/9信号传导的剂量长期用于人类中,以控制狼疮疾病发作是非常安全和有效的。Lafyatis,R.,M.York和A.Marshak-Rothstein,Antimalarial agents:closing the gate on Toll-like receptors?Arthritis Rheum,2006.54(10):3068-70页;Costedoat-Chalumeau,N.等人,Low blood concentration of hydroxychloroquine is a marker for and predictor of disease exacerbations in patients with systemic lupus erythematosus.Arthritis Rheum,2006.54(10):3284-90页。事实上,除了儿童期及较小范围的成人期对革兰氏阳性细菌感染的敏感性增加外,然而具有高度受损的TLR和IL-1R信号传导途径(MyD88缺陷或IRAK-4缺陷)的人类仍然是健康的并且维持了足够的宿主防御机制。Casanova,J.L.,L.Abel和L.Quintana-Murci,Human TLRs and IL-1Rs in Host Defense:Natural Insights from Evolutionary,Epidemiological,and Clinical Genetics.Annu Rev Immunol,2010。
基于此信息和其它信息,我们认为,在小鼠临床前SLE模型的情况中尤其充分证实TLR7是靶标。基因性人体研究和功能性人体研究两者支持以下假设:TLR7和/或TLR8途径的拮抗为对狼疮患者提供治疗益处。此外,小鼠TLR基因缺失研究和人类中抗疟药物的长期使用表明可以在未显著损害宿主防御的情况下进行药理学的TLR7、TLR8和/或TLR9抑制。
因此可以期望,抑制TLR7、TLR8或者TLR7和TLR8两者的化合物用作对SLE或狼疮肾炎的治疗剂或预防剂。
本发明人已经发现抑制TLR 7和/或TLR 8的化合物,并且因此期望对SLE或狼疮肾炎具有预防或治疗性效果。本文描述了本公开内容的化合物和方法。
II.治疗用途
可以改变在本公开内容的药物组合物中的活性成分的剂量水平,以获得实现所期望的对特定患者的治疗反应、组成和施用模式的活性化合物的量。所选择的剂量水平取决于特定化合物的活性、施用途径、所治疗的病况的严重程度以及所治疗的患者的病况和既往病史。根据患者特有的因素,包括年龄、体重、总的健康状态以及其它可以影响本公开内容的化合物的功效的因素,使用标准方法测定各个特定情况的剂量。通常,在口服施用的情况下,本公开内容的化合物或其药物可接受的盐以每个成人每天约30μg至100μg的剂量、30μg至500μg的剂量、30μg至10g的剂量、100μg至5g的剂量或100μg至1g的剂量施用。在经由注射施用的情况下,其以每个成人每天约30μg至1g的剂量、100μg至500mg的剂量或100μg至300mg的剂量施用。在两种情况下,剂量以一次施用或分几次施用。可以例如使用程序模拟剂量。
但是并不意味着向哺乳动物(包括人类)施用本公开内容的化合物要限于特定的施用模式、剂量或给药频率。本公开内容涵盖所有的施用模式,包括口服施用、腹膜内施用、肌内施用、静脉内施用、关节内施用、病灶内施用、皮下施用或任何其它足以提供适于预防或治疗SLE或狼疮肾炎的剂量的途径。可以将本公开内容的一种或多种化合物以单剂量或多剂量施用于哺乳动物。当以多剂量施用时,所述剂量可以彼此间隔例如几个小时、一天、一周、一个月或一年。应当理解,对于任何特定的对象,应当根据个体需要以及实施或指导施用包含本公开内容的化合物的药物组合物的人员的专业判断,随时间调整特定的剂量方案。
对于临床应用,本公开内容的化合物通常可以静脉内、皮下、肌内、经结肠、经鼻、腹膜内、经直肠、经颊或口服施用。包含至少一种本公开内容的化合物(适用于人用药物或兽用药物)的组合物可以以允许通过适当的途径施用的形式提供。可以使用一种或多种药物可接受的佐剂或赋形剂,根据常规方法来制备这些组合物。所述佐剂尤其包括稀释剂、无菌水介质和各种无毒的有机溶剂。用于治疗用途的可接受的载体或稀释剂在制药领域是众所周知的,并且例如描述于Remington:The Science and Practice of Pharmacy(第20版),A.R.Gennaro编辑,Lippincott Williams和Wilkins,2000,Philadelphia,以及Encyclopedia of Pharmaceutical Technology,J.Swarbrick和J.C.Boylan编辑,1988,1999,Marcel Dekker,New York。所述组合物可以以片剂、丸剂、颗粒剂、粉剂、水溶液或混悬剂、可注射溶液、酏剂或糖浆的形式提供,并且所述组合物可以任选地包含选自甜味剂、调味剂、着色剂和稳定剂中的一种或多种试剂以获得药物可接受的制剂。
媒介物的选择以及媒介物中活性物质的含量通常根据产品的溶解性和化学性质、特定的施用模式和在药学实践中需遵守的规定来确定。例如,诸如乳糖、柠檬酸钠、碳酸钙和磷酸二钙的赋形剂以及诸如淀粉、海藻酸和与润滑剂(例如,硬脂酸镁、十二烷基硫酸钠和滑石)组合的某些复合硅酸盐的崩解剂,可以用于制备片剂。为了制备胶囊,使用乳糖和高分子量聚乙二醇是有利的。当使用水性悬浮液时,可以包含促进悬浮的乳化剂。还可以使用稀释剂,例如蔗糖、乙醇、聚乙二醇、丙二醇、甘油、氯仿或它们的混合物。
对于肠胃外施用,使用本公开内容的组合物在植物油(例如,芝麻油、花生油或橄榄油)中的乳液、悬液或溶液,药物可接受的盐的水性有机溶液(例如,水和丙二醇)、可注射的有机酯(例如,油酸乙酯)或无菌水溶液。本公开内容的组合物的盐的溶液尤其可用于通过肌内注射或皮下注射而施用。可以将包括盐在纯蒸馏水中的溶液的水溶液用于静脉内施用,条件是:(i)适当地调节它们的pH,(ii)用足量的葡萄糖或氯化钠适当地缓冲并且使其等渗,以及(iii)通过加热、辐照或微滤对它们进行杀菌。包含本公开内容的化合物的适当组合物可以溶于或悬浮于适当的载体中用于喷雾器或者悬浮液气雾剂或溶液气雾剂,或可以被吸收到或吸附于适当的固体载体上以用于干粉吸入器中。用于直肠施用的固体组合物包括根据已知方法配制的并且包含至少一种本公开内容的化合物的栓剂。
待用于治疗性施用的本公开内容的化合物的剂量制剂应当是无菌的。通过经无菌膜(例如,0.2微米膜)过滤或通过其它常规方法从而易于实现无菌化。制剂通常以冻干形式或作为水溶液储存。在一些实施方案中,本公开内容的组合物的pH例如可以为包括端值在内的3至11,可以为包括端值在内的5至9,或可以为包括端值在内的7至8。
虽然一种施用途径为通过口服剂量施用,但可以使用其它施用方法。例如,组合物可以以各种剂型通过皮下、静脉内、肌内、经结肠、经直肠、经鼻或腹膜内施用,所述剂型例如栓剂、植入的丸剂或小圆柱剂、气雾剂、口服剂量制剂以及诸如软膏剂、滴剂和皮肤贴剂的外用制剂。本公开内容的实施方案的化合物可以掺入诸如植入物的成型制品中,包括但不限于瓣膜、支架、管和假体,其可以使用惰性材料,例如合成聚合物或硅酮(例如,组合物、硅酮橡胶或其它可商购的聚合物)。此类聚合物可以包括聚乙烯吡咯烷酮、吡喃共聚物、聚羟基-丙基-甲基丙烯酰胺-苯酚、聚羟乙基-天冬酰胺-苯酚或被棕榈酰残基取代的聚环氧乙烷-聚赖氨酸。此外,本公开内容的化合物可以与一类用于实现药物控释的生物可降解的聚合物结合,所述聚合物例如聚乳酸、聚乙醇酸、聚乳酸与聚乙醇酸的共聚物、聚ε己内酯、聚羟基丁酸、聚原酸酯、聚缩醛、聚二氢吡喃、聚氰基丙烯酸酯以及水凝胶的交联共聚物或两亲性嵌段共聚物。
本公开内容的化合物还可以以脂质体递送系统的形式,例如小的单层囊泡、大的单层囊泡和多层囊泡,来进行施用。脂质体可以由各种脂质,例如胆固醇、硬脂胺或磷脂酰胆碱形成。还可以使用与化合物分子偶联的抗体、抗体片段、生长因子、激素或其它靶标部分(例如,参见Remington:The Science and Practice of Pharmacy,见上文)来递送本公开内容的化合物,包括与本公开内容的实施方案的化合物的血液组分体内结合。
III.合成
提供了用于制备本公开内容的实施方案的一般合成路线和特定合成路线。本领域技术人员可以认识到对这些程序进行某些改变或修饰也可以致使合成本公开内容的化合物。在一些情况下,短语“例如/诸如”用于列举更多的一般性化合物或结构的各种可选方案。应当理解,“例如/诸如”不应理解为是限制性的,而且其含义与“包括,例如,但不限于”一致。
以下所提供的具体实例的某些条件是共有的。使用Emrys Liberator或Initiator微波反应器进行微波加热。使用SP4快速色谱系统进行柱色谱法。使用Büchii旋转蒸发器或离心蒸发器进行溶剂去除。使用氘代溶剂在Varian光谱仪上在400MHz处记录NMR光谱。将相对于残余质子化溶剂的化学位移进行报告。
使用各种比例的一种或多种以下溶剂在预涂有0.25mm硅胶层的玻璃板上进行薄层色谱:EtOAc、庚烷、二氯甲烷或MeOH。
使用XBridgeTM C18 1.7μm 2.1×50mm柱在Waters AcquityTM系统上对许多实例进行分析性LC/MS。溶剂A和溶剂B分别为水w/0.1%甲酸和乙腈w/0.1%甲酸。5分钟总的方法时间,5%B至99%B经4分钟,流速为0.3ml/min。以电喷雾正离子模式在Waters SQD上从100-2000amu获得质谱数据。
可选地,使用XBridgeTM C8 3.5μm 4.6×50mm柱在Waters自动纯化系统上进行纯度和质量确认。溶剂A和溶剂B分别为水w/0.1%甲酸和乙腈w/0.1%甲酸。6分钟总的方法时间,10%B至95%B经5分钟,流速为2.5ml/min。以电喷雾正离子模式在Micromass ZQTM上从130-1000amu获得质谱数据。
使用XBridgeTMC8 5μm,19×100mm柱在Waters自动纯化系统上对许多实例进行制备型反相LC/MS。溶剂A和溶剂B分别为水w/0.1%甲酸和乙腈w/0.1%甲酸。12分钟总的方法时间,30%B至95%B经10分钟,流速为20ml/min。以电喷雾正离子模式在Micromass ZQTM上从130-1000amu获得质谱数据。
使用以下手性柱中的一个:IA(5cm×50cm或2cm×25cm)、AD(2cm×25cm)或OD(2cm×25cm),对许多实例进行外消旋化合物的制备型HPLC拆分。在由相同的固定相构成的0.45cm×25cm柱(IA、AD或OD)上通过HPLC分析来测定经纯化的化合物的对映体比例。
以下阐明了用于制备本公开内容的化合物的一般方法和实验。在某些情况下,通过实施例描述具体的化合物。然而,应当理解,在各个情况中,根据以下所描述的方案和实验来制备一系列本公开内容的化合物。对于可获得NMR和/或质谱数据的那些化合物,该数据示于图6中。
以下缩写用于本文中:
定义:以下缩写具有所指出的含义:
AcOH:乙酸
anhyd:无水的
aq.:水性的
Bn:苄基
Boc:叔丁氧基羰基
CSA:樟脑磺酸
d:天
DAMP:危险相关分子模式
DBU:1,8-重氮双环[5.4.0]十一碳-7-烯
DCE:1,2-二氯乙烷
DCM:二氯甲烷
DIPEA:N,N-二异丙基乙胺
DMA:N,N-二甲基乙酰胺
DMAP:4-二甲基氨基吡啶
DMF:N,N-二甲基甲酰胺
DMSO:二甲基亚枫
dsDNA:双链DNA
EDC:1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐
ee:对映体过量
EtOAc:乙酸乙酯
EtOH:乙醇
h:小时
HATU:N,N,N’,N’-四甲基-O-(7-氮杂苯并三唑-1-基)脲六氟磷酸盐
HCl:盐酸
HCQ:羟氯喹
hep:正庚烷
HEPES:4-(2-羟乙基)-1-哌嗪乙烷磺酸
HPLC:高效液相色谱
IFN:干扰素
IPA:异丙基醇或异丙醇
K2CO3:碳酸钾
MeOH:甲醇
MgSO4:硫酸镁(无水的)
min:分钟
MTBE:甲基叔丁基醚
Na2CO3:碳酸钠
Na2SO4:硫酸钠(无水的)
NaBH4:硼氢化钠
NaCl:氯化钠
NaH:分散在油中的60%氢化钠
NaHCO3:碳酸氢钠
NaOH:氢氧化钠
NBS:N-溴丁二酰亚胺
NH4Cl:氯化铵
NH4Cl:氯化铵
NH4OH:氢氧化铵
NMP:N-甲基吡咯烷酮
Ns:对硝基苯磺酰基或邻硝基苯磺酰基
℃:摄氏度
PAMP:病原体相关分子模式
PBMC:外周血单核细胞
PBS:磷酸盐缓冲盐水
pDC:浆细胞样树突状细胞
PhNTf2:N-苯基三氟甲烷磺酰亚胺
qPCR:定量聚合酶链反应
R848:瑞喹莫德(resiquimod)
rt:室温
sat:饱和的
SNAP:牌快速色谱柱
SOC:护理标准
ssRNA:单链RNA
T3P:丙基磷酸酐
tBuOK:叔丁醇钾
TEA:三乙胺
TEMPO:2,2,6,6-四甲基哌啶-1-氧化物
Tf:三氟甲磺酸酯
TFA:三氟乙酸
THF:四氢呋喃
TLDA:低密度阵列
TLR:Toll样受体
TSA:对甲苯磺酸
一般合成方法
根据方案1-31中所示的一般合成方法制备化合物:
方案1
利用关键中间体3来制备若干实例,所述中间体3可以根据方案1中所描述的路线来制备。用盐酸羟胺处理可商购的5-溴喹啉-8-甲醛1(Frédérieric de Montigny,Gilles Argouarch,Claude Lapinte,“New Route to Unsymmetrical 9,10-Disubstituted Ethynylanthracene Derivatives,”Synthesis,2006,293-298.)以得到肟2。随后在催化量的乙酸铜存在下将2转化为相应的腈3以得到本文所报告的关键中间体之一。使用以下详述的适当条件,通过用适当的芳香族化合物、杂芳香族化合物和饱和的杂环化合物例如哌啶、哌嗪和吗啉,来取代5-溴喹啉-8-甲醛的5-位,使中间体3用于产生本文所报告的化合物。
在方案2中示出了产生关键中间体3的可选方法,其中用乙酸钠代替合成中第一步的三乙胺。
方案2
通过如方案3中所描述的一般缩合方法产生若干实例,其中溴喹啉3与适当的亲核试剂4缩合以形成可以是以下更详细描述的关键中间体或最终化合物的5。
方案3
通过如方案4中所示的一般方法中所描述的高级中间体14制备由化合物15表示的许多实例。适当保护的手性环氧化物6与烯丙胺缩合以提供手性氨基醇7。在用nesylate保护仲胺后,将所得的中间体8进行分子间环化以形成不饱和的吡喃9。烯胺双键的还原以形成10之后是对nesyl基团进行去保护以提供9。在使用或未使用钯催化剂的情况下,将11与溴化物3(方案1或2)进行缩合以得到12,在对13进行去保护后,然后活化所得醇以得到关键中间体14。活化的14可以通过使用适当取代的胺和缩合试剂易于转变为以下提供的许多实例,以得到一般结构15的化合物。
方案4
在方案5中描述了制备一般结构10的可选方法。通过用N-溴代丁二酰亚胺处理可以获得经保护的醇8的自由基环化以得到16。使用碱消除溴基团得到烯醇17,然后用硅烷还原所述烯醇17以得到中间体10。
方案5
在方案6中描述了制备一般结构11的可选方法。用手性环氧树脂原料6起始,在用Boc保护基团对仲胺进行保护后,形成醇18。使用水溶性DCC的内脂化(lactonation)提供19,所述19然后可以使用烷基锂例如甲基锂进行烷基化,以形成缩酮20和21的混合物。然后将缩酮混合物进行还原以形成吗啉化合物22(为所需的非对映体异构体)和23的非对映体混合物,所述非对映混合物可以易于通过硅胶柱色谱法进行分离。发现甲基吗啉混合物的比率为有利于结构22的4:1至9:1。随后获得高级化合物的X射线晶体结构以确认化合物22的绝对立体化学。通过酸例如TFA进行去保护然后用碱中和,化合物22易于转化为11。
方案6
在方案7中示出了制备关键中间体11的第三种方法。可商购的经保护的环氧化物6与氨水缩合以得到氨基醇23,所述氨基醇23继而与手性氯丙酸甲酯24缩合以形成光学纯酰胺25。使用强碱例如氢化钠形成醚得到内酰胺26,所述内酰胺26可以通过将酰胺还原为环胺而被转化为中间体11。
方案7
方案8中示例了产生涵盖方案3中的一般结构5和方案4中的化合物12的实例的可选方法。由可商购来源(27和29)制备的原料28和30可以易于在无机碱存在下缩合以形成31。经由还原性水解去除酚保护基团以形成32,用酸水解缩醛保护基团以形成醛33,并且然后在催化酸性缩合条件下形成二环杂环34。然后将34上的酚羟基团活化以形成35,所述35随后可以与11缩合以形成如方案4中所示的12。化合物11可以由如以下实例中所示的其它亲核试剂取代。
方案8
制备具有一般结构15的化合物的两种可选方法使用方案9和方案10中描述的方法。将中间体13通过形成三氟甲磺酸酯36来活化,然后在诸如碳酸钾的碱存在下用适当的胺取代,以形成如方案9中所描述的所需目标化合物15。
方案9
用来自方案6的Boc保护的手性吗啉22起始,本领域的技术人员能够通过将保护的醇转化为如方案10中所示的叠氮化物中间体37来产生具有一般结构15的化合物的其它实例。在还原叠氮化物、Boc基团去保护以及与3缩合后,37易于转化为伯胺ER-884884。通过烷基化或酰化过程,ER-884884同样可以转化为由一般结构15描述的其它类似物。
方案10
可选的一组化合物实例的制备为通过关键中间体13的氧化以形成38,然后经由酰胺偶联条件形成实例,以形成如方案11中所示的39。使用这种一般方法制备一些实例将需要一个或两个额外的步骤,以得到一般结构40的所需目标化合物。同样地,通过本领域的技术人员使用各种方法可以易于由38产生一般结构41所描述的各种酯。
方案11
同样地,通过以下两种可行方法制备醚实例:(1)用碱和来自方案4的化合物11取代烷基、烯基或芳基官能团上的活化基团;或者在适当的碱存在下,使用具有酚或烷基醇的活化的醇14或36。在方案12中示出了提供具有一般化学结构42的实例的两种方法。
方案12
还可以将关键中间体13进行氧化以形成醛43,然后与各种烷基和芳基偶联试剂缩合以得到如方案13中所描述的实例44或46。然后可以将所得的产物转化为其它实例:通过44的氧化以得到一般结构45的化合物或46的还原以得到n=2的一般结构47的化合物。同样地,本领域的技术人员可以通过活化羟基由中间体44产生其它实例,例如形成三氟甲磺酸酯,然后使用几种可行的还原剂进行还原以得到包含减少一个亚甲基的实例或n=1的47。
方案13
通过使用方案14制备最后一组实例。使用相同的合成方法以制备方案4中的化合物13,本领域的技术人员可以用1-氨基-3-丁烯62取代烯丙胺来制备所需的七元杂环68。然后可以活化68,并且然后以上述的几个方案中所示的类似方式与各种取代的胺缩合以产生其它类似物。
方案14
实例的制备
化合物3-方案1
向5-溴喹啉-8-甲醛1(1.00g,4.24mmol)和盐酸羟胺(1.177g,16.94mmol)在乙腈(110mL)中的悬浮液添加TEA(2.362mL,16.94mmol),然后加热至回流3h以提供黄色悬浮液。在完成的反应完全冷却至室温,过滤沉淀物,用乙腈(50mL)冲洗滤饼。将粗制固体经过用EtOAc(300mL)洗脱的短的硅胶垫(10g)纯化,以得到黄色固体状的醛肟2。
将无水乙腈(180mL)中的醛肟2(1.001g,4.0mmol)和一水合乙酸铜(II)(84.6mg,0.424mmol)搅拌回流12h。将完成的反应冷却至室温,过滤并且用H2O洗涤滤垫以提供褐色固体。将粗制固体经过用DCM(100mL)洗脱的短的硅胶垫(约10g)纯化,以在真空中浓缩和干燥洗脱产物后提供米白色固体状的5-溴喹啉-8-甲腈3(0.783g,3.4mmol,收率为79.3%,经过两步)。参见:Frédérieric de Montigny,Gilles Argouarch,Claude Lapinte,Synthesis,2006,293。
化合物3-方案2
在15℃下向三水合乙酸钠(31.6g,0.232mol)在EtOH(0.498L)中的经搅拌的溶液添加5-溴喹啉-8-甲醛(49.84g,0.211mol),然后添加盐酸羟胺(15.55g,0.223mol)。将所得的混合物加热至70℃持续3h,此后将反应冷却至35℃,然后用水(250mL)稀释。将混合物部分浓缩至约250mL,此后添加水(250mL)、2-甲氧基-2-甲基丙烷(120mL)和庚烷(120mL),然后将混合物再浓缩至约250mL。用水(250mL)稀释所获得的浆料并且冷却至0℃,此后添加1M NaOH水溶液(211mL),并且将最终的混合物剧烈搅拌10min。过滤悬浮液,用水(498mL)冲洗,并且将滤饼在30℃下干燥18h以得到呈棕褐色粉末的醛肟2(49.75g,0.198mol,93.9%收率)。
在15℃下向2(48.21g,0.192mol)在乙腈(386mL)中的经搅拌的悬浮液添加乙酸铜(II)(0.523g,2.9mmol),然后添加乙酸(13.1mL,0.229mol)。将所得的混合物加热至回流21h,此后将完成的反应冷却至50℃。添加水(0.39L),并且将混合物部分浓缩,然后用水(290mL)稀释并冷却至5℃。添加1M NaOH水溶液(230mL),并且持续剧烈搅拌10min。过滤悬浮液,用水(500mL)冲洗滤饼并且干燥以得到呈灰黑色粉末状的化合物3(42.80g,0.183mol,95.6%收率)。
ER-878952的合成-方案3和方案15(方法1)
方案15
将NMP(1mL)中的3(200.2mg,0.86mmol)和可商购的顺式-2,6二甲基吗啉69(133.4mg,1.16mmol-作为方案3中的化合物4的代表)在150℃下微波处理1h。将完成的反应物进行过滤并且分成几个小瓶,用NMP稀释并且通过HPLC(C18柱,具有0.1%TFA的乙腈/水的10/90-95/5梯度,运行15min,t=8.5-9min)纯化,以在真空中浓缩和干燥所需合并的部分后获得ER-878952(180mg.0.68mmol,79.1%收率)。
以与ER-878952相似的方式使用3(15mg,0.064mmol)和2-乙基吗啉(22.2mg,0.191mmol)产生ER-880369(8.2mg,0.031mmol,48.4%收率)。未进行对映体的分离。
以与ER-878952相似的方式使用3(400mg,1.716mmol)和来自方案4的11(398.1mg,1.799mmol)产生ER-885618(385.2mg,1.032mmol,60.7%收率)。
化合物ER-878952的合成(方法2,方案3和方案15)
向化合物3(12.00g,0.0515mol)在NMP(30.0mL)中的经搅拌的悬浮液添加69(14.8g,0.129mol),然后在120℃下加热4h。将完成的反应物冷却至50℃,用IPA(30mL)、庚烷(60mL)稀释,然后进一步冷却至0℃。在30min后,通过过滤收集沉淀,用预先冷却(在0℃)的IPA(18.0mL)/庚烷(36mL)混合物冲洗,并且在N2/真空下干燥2h以得到呈黄色粉末状的ER-878952(11.00g)。将滤液进行浓缩,在EtOAc(120mL)和饱和NaHCO3水溶液(60mL)之间分配。分离有机层,用水(60mL)洗涤并且经过预处理(庚烷-EtOAc 1:1)的硅胶,用EtOAc(120mL)洗脱,然后浓缩。因此将获得的褐色固体悬浮于EtOAc(10mL)庚烷(10mL)中并且加热至70℃,然后使其冷却至20℃。通过过滤收集沉淀,用EtOAc(5.0mL)和庚烷(5.0mL)的混合物冲洗,然后在N2/真空下干燥1h,以提供呈黄色粉末状的额外的ER-878952(0.649g)。总的过程提供ER-878952(11.64g,43.6mmol,89.6%收率)。
ER-879484(方法3,方案3和方案16)
方案16
向3(15mg,64.4mmol)和4-苄基-2-(氯甲基)吗啉70(43.6mg(0.193mmol)在DMF(0.5mL)中的经搅拌的溶液添加TEA(0.27μL,0.194mmol)。将反应混合物在160℃下微波处理1h,此后将完成的反应物经C-18反相制备型HPLC柱(Water's X-Bridge C18 19x 100mm柱;用具有0.05%TFA的0%–40%梯度的乙腈水溶液洗脱)直接纯化。将包含所需产物的部分合并,在真空中浓缩并且干燥以得到ER-879484(4.2mg,0.015mmol,22.7%收率)。使用手性HPLC柱分离ER-879484(3.0mg,0.010mmol)的对映体,以在真空中浓缩所需部分并且干燥后得到ER-879569(1.0mg,0.004mmol)和ER-879570(1.0mg,0.004mmol)。虽然绝对立体化学式是未知的,但可任意指定。
以与ER-879484相似的方式产生ER-879739(12mg,0.047mmol,73.6%收率),其中使用3(15mg,0.064mmol)和2-甲基吗啉(19.5mg,0.195mmol)起始。未进行对映体的分离。
以与ER-879484相似的方式产生ER-880191(9.5mg,0.036mmol,23.7%收率),其中使用3(35mg,0.150mmol)和(2S,6S)-2,6-二甲基吗啉(741mg,6.434mmol)起始。还分离顺式异构体ER-878952(15.2mg,0.057mmol,37.9%收率)。在这个制备过程中未使用TEA。
衍生自ER-878952的其它实例:
ER-885160:将ER-878952(85.6mg,0.320mmol)溶于1,2-乙二醇(1mL),然后添加氢氧化钾(60mg,1.069mmol)。将反应混合物在120℃下微波处理10h,此后将其过滤,然后直接注入C-18反相制备型HPLC进行纯化(Water's X-Bridge C18 19x 100mm柱;用具有0.05%TFA的10%–100%乙腈水溶液洗脱)。将所需的部分浓缩至干燥,溶于MeOH(3mL)并且经碳酸盐浸渍的硅胶柱(Biotage Isolute SPE,Si-CO3,1g)洗脱,用MeOH(3mL)洗涤,在真空中浓缩并且干燥以得到ER-885160(56.2mg,0.197mmol,61.6%收率)。
作为方案4中的化合物15的实例的化合物ER-890963的制备
化合物7:在内部温度为18-19℃下,将22L的反应器装载(2R)-苄基2-环氧丙基醚(0.7692kg,4.684mol)。在18-19℃下添加烯丙胺(3800mL,51mol),并且将所得的混合物加热至50℃。在20h后,将混合物进行浓缩,与MTBE(4L x 3)共沸以产生呈无色油状的(R)-1-(烯丙基氨基)-3-(苄氧基)丙-2-醇7(约1037g,4.684mol,假设100%收率)。
化合物8:在10-11℃下向碳酸氢钠(1180g,14.0mol)在水(7.2L)中的经搅拌的悬浮液添加邻硝基苯磺酰氯(1038g,4.684mol)在DCM(3100mL)中的溶液,然后将所得的两相混合物升温至20℃。在3h内添加7(约1037g,假设4.684mol)在DCM(4100mL)中的溶液,同时将内部温度维持在20-23℃并且持续剧烈搅拌过夜。将混合物在搅拌下用水(4100mL)稀释,然后分离各层。用MTBE(4100ml)萃取水层。用正庚烷(4100mL)稀释合并的有机层,依次用1.0M HCl(4700mL)、饱和NaHCO3(2.0kg)、水(4100mL)洗涤,浓缩并且与MTBE(5200mLx 3)共沸至干燥,以在真空中干燥3天后得到呈褐绿色油状的(R)-N-烯丙基-N-(3-(苄氧基)-2-羟丙基)-2-硝基苯磺酰胺8(1.855kg,4.56mol,97%收率)。
化合物9:将8(1.80kg,4.429mol)在DMA(5.40L)中的经搅拌的悬浮液加热至40℃以实现完全溶解,然后冷却至25℃,此后将混合物添加至包含乙酸铜(II)(0.145kg,0.797mol)的分离反应器,然后用DMA(5.40L)冲洗原始容器。添加氯化钯(II)(0.063kg,0.354mol),然后用氧气(1bar)取代内部气氛并且升温至28-32℃持续3天。将完成的反应混合物分成相等的2部分以促进处理。将各个部分分别倾入0.1M HCl(23L)和MTBE(9.0L)的混合物中,同时控制T-内部<25℃。分离各层并且用MTBE(9.0L和5.4L)萃取水层。合并所有有机层,依次用0.1M HCl(5.5L)、8%NaHCO3(5.9kg)、29%NaCl(6.3kg)洗涤。将硅藻土545(270g)添加至有机层,搅拌30min,过滤并且用MTBE(2.7L)冲洗滤饼。合并所有滤液并且浓缩。将微红色油状物再溶于DCM(3.6L)中,并且用1,3,5-三嗪烷(triazinane)-2,4,6-三硫酮(79gkg,0.44mol)在25℃下处理1h。将混合物用MTBE(18L)稀释并且经过硅藻土545(270g)过滤。用MTBE(3.6L)冲洗反应器和滤饼,并且将合并的滤液进行浓缩以产生呈黄色油状的(R)-2-((苄氧基)甲基)-6-甲基-4-((2-硝基苯基)磺酰基)-3,4-二氢-2H-1,4-噁嗪9(1748g,4.322mol,97.6%收率)。
化合物10:将9(1748g,4.322mol)在DCM(3.5L)中的经搅拌的悬浮液加热至33-35℃,直到获得自由流动的悬浮液,此后将混合物冷却至18-20℃。在搅拌下将分离反应器中的DCM(2.62L)中的TFA(1.67L,21.6mol)冷却至5℃,此后在将温度维持在5-6℃下添加三乙基硅烷(1.04L,6.48mol),然后冷却至-5℃。将9在DCM中的悬浮液在1.5h内缓慢添加至主反应器中,同时将温度维持在-5℃至-3℃,然后在-5℃至-3℃持续搅拌4h。用预先冷却的正庚烷(8.74L,在-10℃下)稀释完成的反应物,然后倾入预先冷却的NaOH溶液(NaOH:890g,在水中为22.3mol:8.7L,在5℃下),同时控制T-内部<15℃(在1h内),然后用MTBE(3.5L)冲洗反应器。用MTBE(5.2L)稀释混合物并且分离各层。将有机层依次用水(8.7L)、30wt%NaCl(3.5kg)水溶液、水(5.2L)洗涤,用硅藻土545(175g)处理并且过滤。用MTBE(1.75L)冲洗处理的容器和滤饼,并且将合并的滤液在真空下浓缩至约3.5L,与正庚烷(8.7L)共沸并且浓缩至约5L。通过过滤收集黄褐色沉淀,用正庚烷(3.5L)冲洗并且在N2/真空下干燥1h。将1.65kg所得的固体与从单独批次获得的353g固体合并,并且悬浮于1:1的正庚烷/EtOAc(8.0L)中。将混合物加热至61-63℃以实现完全溶解,在1h内冷却至23-25℃,用庚烷(4L)稀释并且在30min内进一步冷却至10-12℃。在此温度下持续搅拌30min。通过过滤收集淡黄褐色沉淀,用正庚烷/EtOAc 6:1(2L)冲洗,然后用正庚烷(4L)冲洗,然后在N2/真空下干燥过夜,然后在35℃下在真空烘箱中干燥2d,以产生呈黄褐色固体状的(2R,6R)-2-((苄氧基)甲基)-6-甲基-4-((2-硝基苯基)磺酰基)吗啉10(1616g,3.98mol,74%收率,从8经2个步骤)。
次要产物:通过母液10的纯化分离(2R,6S)-2-((苄氧基)甲基)-6-甲基-4-((2-硝基苯基)-磺酰基)吗啉71(非对映异构体)。
化合物11:向1.0M t-BuOK(0.650L,0.650mol)在冷却至5℃的THF(0.310L)中的经搅拌的溶液添加苯硫醇(63.66mL,0.620mol),同时维持在<10℃。将混合物在10℃下搅拌30min,然后升温至15℃持续1h,此后添加10(240.00g,590.5mmol)在THF(0.60L)中的溶液,同时将温度维持在15-20℃,然后搅拌2h。用1.0M HCl(1.30L)在正庚烷(3.60L,预先冷却至10℃)中的混合物缓慢淬灭完成的反应,同时将反应混合物维持<15℃。将所得的混合物剧烈搅拌10min,然后分离各层。用水(0.24L)萃取有机层,用正庚烷(0.24L)冲洗。合并所有的水层,并且用正庚烷(3.60L)洗涤,然后在搅拌下添加NaCl(240g)。用5.0M NaOH(165mL)使水性混合物碱化,然后用DCM(每次3.60L和2.40L)萃取两次。用20wt%NaCl水溶液(1400g)洗涤合并的有机层,浓缩,与MTBE(1400mL)共沸,用MTBE(960mL)再稀释并且经玻璃过滤器过滤。将滤液进行浓缩以产生呈褐色透明油状的(2R,6R)-2-((苄氧基)甲基)-6-甲基吗啉11,其未经进一步纯化用于后续反应。
化合物12:向3(137.6g,0.591mol)在DMA(260mL)中的经搅拌的溶液添加DIPEA(308mL,1.77mol),然后添加经DMA(130mL)冲洗的11(130.67g,0.5905mol)在DMA(260ml)中的溶液。将反应混合物在125-130℃加热2h。将完成的反应混合物冷却至30℃,并且用EtOAc(1.96L)和水(0.65L)稀释,此后在剧烈搅拌下将其倾入水(2.61L)中。将所得的混合物经过硅藻土545垫(260g)过滤并且分离各层。用EtOAc(1.31L)萃取水层,然后合并有机层,用5%NaCl(每次1.0kg)洗涤两次并且进行浓缩以产生黑色固体。将所述固体溶于DCM(1L),用正庚烷(520mL)稀释,然后添加硅胶(196g)和MgSO4(130g)。将所得的浆料在20℃下搅拌30min,过滤并且用乙酸异丙酯(2.09L)洗脱。浓缩合并的滤液并且将所得的褐色固体悬浮于EtOAc(196mL)和正庚烷(523mL)的混合物中。将混合物加热至70℃,然后冷却至室温并且搅拌过夜。通过过滤收集沉淀,用EtOAc/正庚烷3:8(220mL)的混合物洗涤,并且在真空下干燥以得到呈黄褐色粉末状的5-((2R,6R)-2-((苄氧基)甲基)-6-甲基吗啉代)喹啉-8-甲腈12(178.44g,0.478mol,80%收率)。
化合物13:在室温下,向12(167.3g,0.45mol)在乙腈(500mL)中的经搅拌的悬浮液添加三甲基碘硅烷(82.9mL,0.582mol)。将所得的混合物在70℃下加热2h,此后将其冷却至室温,用水(167g)缓慢淬灭并且在25-30℃下搅拌1h。将反应混合物冷却至15℃,然后添加28%氢氧化铵水溶液(500g),此后将反应在室温下搅拌过夜。将混合物进行部分浓缩,然后用水(0.5L)、MTBE(0.04L)和正庚烷(0.3L)稀释,然后冷却至0-5℃。通过过滤收集沉淀并且用预先冷却的水(500ml)冲洗,然后用正庚烷/MTBE 7:1(400ml)冲洗,然后在真空下(40℃)干燥过夜以得到呈黄褐色粉末状的5-((2R,6R)-2-(羟甲基)-6-甲基吗啉代)喹啉-8-甲腈13或ER-885493(127.2g,0.45mol,100%收率)。
化合物14:在室温下向13(24.8g,0.0875mol)在DCM(200mL)中的经搅拌的溶液分批添加对甲苯磺酰氯(17.95g,94.17mmol),然后添加TEA(24.60mL,0.1765mol)。将反应搅拌3h,此后用水(200mL)淬灭完成的反应。用盐水(50mL)洗涤分离的有机层,经Na2SO4干燥,过滤并且浓缩为褐色焦油。将粗产物经硅胶(SNAP 340x 2g,用庚烷/EtOAc=5/1至3/1洗脱、TLC庚烷/EtOAc=3/1,rf=0.6)纯化,以在真空中浓缩所需部分并且干燥后得到呈黄色粉末状的((2R,6R)-4-(8-氰基喹啉-5-基)-6-甲基吗啉-2-基)甲基4-甲基苯磺酸酯14(34.98g.79.95mmol,84.9%收率)。
作为Boc保护的ER-890963的化合物15:在室温下向14(13.9g,31.77mmol)和TEA(8.86mL,63.541mmol)在DMA(89mL)中的溶液在5min内逐滴添加可商购的(S)-叔丁基2-乙基哌嗪-1-甲酸酯(7.49g,34.95mmol)。将反应混合物在110℃下搅拌12h以完成反应,此后将反应冷却至室温。将反应物进行浓缩以去除DMA,然后用DCM(30mL)稀释。将所得的有机溶液用水(每次30mL)、盐水(30mL)洗涤两次,并且经MgSO4干燥。将粗产物进行过滤,在真空中浓缩,并且经硅胶(SNAP 340g,用庚烷中的10%至30%EtOAc洗脱,TLC庚烷/EtOAc=3/1,rt=0.6)纯化,以在真空中浓缩合并的所需部分并且干燥后产生呈黄色粉末状的5-((2S,6R)-2-(((S)-4-(3,3-二甲基丁酰基)-3-乙基哌嗪-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈或Boc保护的ER-890963(12.27g,24.15mmol,76%收率)。
ER-890963或化合物15:
在室温下将Boc保护的ER-890963(23.55g,49.10mmol)在搅拌下溶于DCM(50mL),然后将TFA(50mL)溶于其中。将反应在室温下搅拌4h,此后将完成的反应物在真空中进行浓缩。将粗制深橙色材料在搅拌下溶于DCM(50mL)中,并且在20℃下添加饱和NaHCO3水溶液进行中和,直到溶液的pH变为pH 5-6。将分离的水层用DCM(每次50mL)萃取两次,此后用盐水(20mL)洗涤合并的有机层,经Na2SO4干燥,过滤并且浓缩至干燥。将粗制残余物从DCM/iPrOH/庚烷/Et2O=1/1/1/1中结晶以得到呈黄色粉末状的ER-890963(17.89g,47.14mmol,96%收率)。
通过ER-886604所述的相似方法制备ER-886604(7.8mg,0.021mmol,73%收率),其中以14(12.5mg,0.029mmol)和1-氨基-4-甲基苯(0.030mL,0.290mmol)起始,在180℃下使用微波处理15min。将ER-886604通过反相HPLC(Water's X-Bridge C18 19x 100mm柱,用包含0.05%TFA的10%乙腈水溶液进行洗脱)纯化。将产物部分进行合并以及浓缩至干燥,然后在MeOH(1mL)中稀释,经过碱性硅胶塞(Biotage SiCO3,1g,用MeOH(1mL)洗脱),在真空中浓缩并且干燥。不需要进行Boc去保护。
通过ER-886604所述的相似方法制备ER-886608(8.2mg,0.019mmol,67%收率),其中以14(12.5mg,0.029mmol)和5-氨基-1,2-二甲基苯并咪唑二盐酸盐(30mg,0.128mmol)连同TEA(0.040mL,0.290mmol)起始。
通过ER-886604所述的相似方法制备ER-886609(7.4mg,0.017mmol,59%收率),其中以14(12.5mg,0.029mmol)和5-氨基-1-乙基-2-甲基苯并咪唑(30mg,0.171mmol)起始。
通过ER-886604所述的相似方法制备ER-886611(9.2mg,0.027mmol,88%收率),其中以14(12.5mg,0.029mmol)和1-氨基环己烷(30mg,0.171mmol)起始。
通过ER-886604所述的相似方法制备ER-886787(4.5mg,0.012mmol,43.9%收率),其中以14(12.5mg,0.029mmol)和2-氨基嘧啶(24.7mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886788(5.2mg,0.014mmol,51%收率),其中以14(12.5mg,0.029mmol)和2-氨基吡啶(24.4mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886789(4.5mg,0.012mmol,42%收率),其中以14(12.5mg,0.029mmol)和2-氨基-6-甲基吡啶(28.1mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886790(4.6mg,0.012mmol,43%收率),其中以14(12.5mg,0.029mmol)和2-氨基-5-甲基吡啶(28.1mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886814(4.2mg,0.012mmol,40.4%收率),其中以14(12.5mg,0.029mmol)和D-脯氨醇(26.2mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886815(4.0mg,0.011mmol,38.2%收率),其中以14(12.5mg,0.029mmol)和2,2-二甲基吡咯烷(14.2mg,0.145mmol)起始。
通过ER-886604所述的相似方法制备ER-886816(6.0mg,0.016mmol,60%收率),其中以14(12.5mg,0.029mmol)和2-异丙基吡咯烷(29.4mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886817(4.2mg,0.012mmol,62%收率),其中以14(12.5mg,0.029mmol)和(R)-2-甲基吡咯烷(22.1mg,0.263mmol)起始。
通过ER-890604所述的相似方法制备ER-886818(4.2mg,0.010mmol,35.2%收率),其中以14(12.5mg,0.029mmol)和(S)3-苯基吡咯烷(38.2mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886819(5.2mg,0.015mmol,52%收率),其中以14(12.5mg,0.029mmol)和(R)-3-甲基吡咯烷(22.1mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886820(6.2mg,0.018mmol,62%收率),其中以14(12.5mg,0.029mmol)和(S)-3-羟基吡咯烷(22.6mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886853(6.2mg,0.017mmol,58%收率),其中以14(12.5mg,0.029mmol)和2-氨基-4-甲基吡啶(28.1mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886854(2.9mg,0.007mmol,25%收率),其中以14(12.5mg,0.029mmol)和3-苯基吡咯烷盐酸盐(47.7mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886855(4.9mg,0.013mmol,44%收率),其中以14(12.5mg,0.029mmol)和2-氨基-5-甲氧基吡啶(32.2mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886856(7.8mg,0.022mmol,78%收率),其中以14(12.5mg,0.029mmol)和(S)-2-甲基吡咯烷(22.1mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886857(5.6mg,0.015mmol,54%收率),其中以14(12.5mg,0.029mmol)和2,5-二甲基吡咯烷(25.7mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886858(3.6mg,0.009mmol,32%收率),其中以14(12.5mg,0.029mmol)和2-氨基-4-甲氧基吡啶(32.2mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886859(2mg,0.005mmol,20%收率),其中以14(12.5mg,0.029mmol)和2-氨基-6-甲氧基吡啶(32.2mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886860(2.5mg,0.006mmol,21%收率),其中以14(12.5mg,0.029mmol)和5-氨基-1-苯基吡唑(41.3mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886866(8.2mg,0.022mmol,78%收率),其中以14(12.5mg,0.029mmol)和L-脯氨醇(22.1mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886867(4.5mg,0.013mmol,45%收率),其中以14(12.5mg,0.029mmol)和(R)-3-羟基吡咯烷(22.6mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886868(6.5mg,0.019mmol,65%收率),其中以14(12.5mg,0.029mmol)和(S)-3-甲基吡咯烷(22.1mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886869(5.3mg,0.015mmol,51%收率),其中以14(12.5mg,0.029mmol)和3,3-二甲基吡咯烷(25.7mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886948(6.2mg,0.016mmol,56%收率),其中以14(12.5mg,0.029mmol)和2-氨基-3-甲氧基吡啶(32.2mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886949(4.8mg,0.013mmol,46%收率),其中以14(12.5mg,0.029mmol)和(R)-3羟基哌啶(26.2mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886950(5.0mg,0.013mmol,46%收率),其中以14(12.5mg,0.029mmol)和(R,S)-2,6-二甲基哌啶(29.4mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886951(3.2mg,0.009mmol,31%收率),其中以14(12.5mg,0.029mmol)和(S)-3-羟基哌啶(26.2mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886953(5.8mg,0.016mmol,55%收率),其中以14(12.5mg,0.029mmol)和4-羟基哌啶(26.2mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-886955(7.5mg,0.020mmol,69%收率),其中以14(12.5mg,0.029mmol)和2-羟甲基哌啶(29.9mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-887137(4.5mg,0.012mmol,42%收率),其中以14(12.5mg,0.029mmol)和2,3-二甲基哌嗪(29.6mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-887138(5.9mg,0.016mmol,57%收率),其中以14(12.5mg,0.029mmol)和2-氨基吡啶(24.4mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-887139(6.5mg,0.018mmol,63%收率),其中以14(12.5mg,0.029mmol)和3-氨基吡啶(24.4mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-887141(5.2mg,0.014mmol,50%收率),其中以14(12.5mg,0.029mmol)和4-甲基哌啶(25.7mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-887142(4.5mg,0.012mmol,41%收率),其中以14(12.5mg,0.029mmol)和4,4-二氟哌啶(31.4mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-887143(4.7mg,0.011mmol,38%收率),其中以14(12.5mg,0.029mmol)和4-苯基哌啶(41.8mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-887144(6.2mg,0.017mmol,59%收率),其中以14(12.5mg,0.029mmol)和4-氟哌啶(26.8mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-887145(6.5mg,0.019mmol,65%收率),其中以14(12.5mg,0.029mmol)和1-氨基环戊烷(22.1mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-887146(7mg,0.018mmol,60%收率),其中以14(12.5mg,0.029mmol)和1-氨基-3-甲基环己烷(29.4mg,0.263mmol)起始。
通过ER-886604所述的相似方法制备ER-887177(5.3mg,0.014mmol,49%收率),其中以14(12.5mg,0.029mmol)和2-氨基-3-甲基吡啶(20mg,0.145mmol)起始。
通过ER-886604所述的相似方法制备ER-887253(10.2mg,0.029mmol,60%收率),其中以14(20mg,0.046mmol)和哌嗪(40mg,0.460mmol)起始。
通过ER-886604所述的相似方法制备ER-887442(6.2mg,0.016mmol,59%收率),其中以14(12.2mg,0.028mmol)和1-氨基-4-甲基环己烷(30mg,0.265mmol)起始。
通过ER-886604所述的相似方法制备ER-887443(4.5mg,0.013mmol,47%收率),其中以14(12.5mg,0.029mmol)和1-氨基-环丁烷(10mg,0.141mmol)起始。
通过ER-886604所述的相似方法制备ER-887444(7.7mg,0.020mmol,70.7%收率),其中以14(12.5mg,0.029mmol)和1-氨基-环庚烷(20mg,0.177mmol)起始。
通过ER-886604所述的相似方法制备ER-887526(6.2mg,0.016mmol,57%收率),其中以14(12.5mg,0.029mmol)和1-氨基-4-羟基环己烷(30mg,0.260mmol)起始。
通过ER-886604所述的相似方法制备ER-887528(5.4mg,0.015mmol,51.2%收率),其中以14(12.5mg,0.029mmol)和1-氨基-2-羟基环戊烷(30mg,0.297mmol)起始。
通过ER-886604所述的相似方法制备ER-887539(5.3mg,0.014mmol,49%收率),其中以14(12.5mg,0.029mmol)和1-氨基-2-甲基环己烷(30mg,0.265mmol)起始。
通过ER-886604所述的相似方法制备ER-887538(6.5mg,0.014mmol,51.8%收率),其中以14(12.5mg,0.029mmol)和2-氨基-5-苯基吡啶(50mg,0.294mmol)起始。
通过ER-886604所述的相似方法制备ER-887540(6.1mg,0.014mmol,49%收率),其中以14(12.5mg,0.029mmol)和2-氨基-3-苯基吡啶(50mg,0.294mmol)起始。
通过ER-886604所述的相似方法制备ER-887586(6.2mg,0.017mmol,59%收率),其中以14(12.5mg,0.029mmol)和(S,R)-1-氨基-2-羟基吡咯烷(10mg,0.099mmol)起始。
通过ER-886604所述的相似方法制备ER-887587(7.5mg,0.019mmol,65%收率),其中以14(12.5mg,0.029mmol)和2-氨基-3-乙氧基吡啶(40mg,0.290mmol)起始。
通过ER-886604所述的相似方法制备ER-887588(5.6mg,0.013mmol,45%收率),其中以14(12.5mg,0.029mmol)和4-氨基-2-苯基吡啶(20mg,0.118mmol)起始。
通过ER-886604所述的相似方法制备ER-887589(2.4mg,0.006mmol,19%收率),其中以14(12.5mg,0.029mmol)和2-氨基-6-苯基吡啶(20mg,0.118mmol)起始。
通过ER-886604所述的相似方法制备ER-887722(3.5mg,0.009mmol,32%收率),其中以14(12.5mg,0.029mmol)和5-甲基哌嗪-2-酮(20mg,0.175mmol)起始。
通过ER-886604所述的相似方法制备ER-887723(6.2mg,0.017mmol,59%收率),其中以14(12.5mg,0.029mmol)和1-N-甲基哌嗪(10mg,0.100mmol)起始。
通过ER-886604所述的相似方法制备ER-887724(6.2mg,0.016mmol,55%收率),其中以14(12.5mg,0.029mmol)和1-N-丙基哌嗪(40mg,0.138mmol)起始。
通过ER-886604所述的相似方法制备ER-887725(7.2mg,0.018mmol,64%收率),其中以14(12.5mg,0.029mmol)和4-(二甲基氨基)-哌啶(20mg,0.156mmol)起始。
通过ER-886604所述的相似方法制备ER-887927(10.2mg,0.024mmol,82.3%收率),其中以14(12.5mg,0.029mmol)和1,4’-联哌啶(20mg,0.119mmol)起始。
通过ER-886604所述的相似方法制备ER-887928(3.2mg,0.009mmol,31%收率),其中以14(12.5mg,0.029mmol)和(R)-叔丁基哌啶-3-基氨基甲酸酯(30mg,0.150mmol)起始。
通过ER-886604所述的相似方法制备ER-888070(4.5mg,0.012mmol,43%收率),其中以14(12.5mg,0.029mmol)和哌啶-4-基氨基甲酸叔丁酯(30mg,0.150mmol)起始。
通过ER-886604所述的相似方法制备ER-888202(6.2mg,0.018mmol,62%收率),其中以14(12.5mg,0.029mmol)和哌啶(0.034mL,0.348mmol)起始。
通过ER-886604所述的相似方法制备ER-888203(7.2mg,0.020mmol,58%收率),其中以14(15.5mg,0.035mmol)和吗啉(0.030mL,0.350mmol)起始。
通过ER-886604所述的相似方法制备ER-888204(6.2mg,0.016mmol,57%收率),其中以14(12.5mg,0.029mmol)和(2S,6R)-2,6-二甲基吗啉(0.070mL,0.580mmol)起始。
通过ER-886604所述的相似方法制备ER-888205(4.6mg,0.012mmol,41%收率),其中以14(12.5mg,0.029mmol)和((2R,6R)-6-甲基吗啉-2-基)甲醇或ER-885491(40mg,0.305mmol)起始。
ER-885491:向11(890.2mg,4.023mmol)在MeOH(8mL)中的经搅拌的悬浮液添加5%钯碳(270mg),此后将混合物用H2气体吹扫三次,同时在充气间隔抽真空。将反应在H2atm、40℃下搅拌8h。将未完成的反应在用N2气体吹扫下于真空中脱气,然后添加5%钯碳(100mg)和2滴浓HCl,此后在40℃下将反应如上所述在H2atm下放置4h。用N2气体吹扫完成的反应,然后经硅藻土545过滤,用MeOH(5mL)洗脱,在真空中浓缩并且干燥。将粗产物ER-885491(378.2mg,2.883mmol,71.7%收率)未经进一步纯化用于先前步骤中。
通过ER-886604所述的相似方法制备ER-888285(8.6mg,0.020mmol,59%收率),其中以14(15mg,0.034mmol)和N-(2-吡啶基)哌嗪(30mg,0.184mmol)起始。
通过ER-886604所述的相似方法制备ER-888286(10.2mg,0.020mmol,71.3%收率),其中以14(14.6mg,0.033mmol)和N-(4-吡啶基)哌嗪(30mg,0.184mmol)起始。
通过ER-886604所述的相似方法制备ER-888288(7.2mg,0.016mmol,52%收率),其中以14(15mg,0.034mmol)和N-(哌啶-4-基)乙酰胺(20mg,0.141mmol)起始。通过先前所述的程序形成HCl盐。
通过ER-886604所述的相似方法制备ER-888289(16.2mg,0.039mmol,21.6%收率),其中以14(80mg,0.183mmol)和1,8-萘啶-2-胺(100mg,0.689mmol)起始。
通过ER-886604所述的相似方法制备ER-888320(5.8mg,0.015mmol,42%收率),其中以14(15.5mg,0.035mmol)和哌啶-4-甲酰胺(20mg,0.156mmol)起始。
通过ER-886604所述的相似方法制备ER-888321(6.2mg,0.013mmol,37%收率),其中以14(15.5mg,0.035mmol)和N-(哌啶-4-基)苯甲酰胺(40mg,0.196mmol)起始。
通过ER-886604所述的相似方法制备ER-888322(10.5mg,0.027mmol,75.3%收率),其中以14(15.5mg,0.035mmol)和1-异丙基哌嗪(20mg,0.156mmol)起始。
通过ER-886604所述的相似方法制备ER-888330(4.2mg,0.011mmol,30%收率),其中以14(15.5mg,0.035mmol)和哌嗪-1-甲酰胺(20mg,0.155mmol)起始。
通过ER-886604所述的相似方法制备ER-888479(7.6mg,0.018mmol,51%收率),其中以14(15mg,0.034mmol)和4-环己基哌啶(30mg,0.179mmol)起始。
通过ER-886604所述的相似方法制备ER-888480(8.3mg,0.020mmol,58%收率),其中以14(15mg,0.034mmol)和4-(吡咯烷-1-基哌啶(30mg,0.194mmol)起始。
通过ER-886604所述的相似方法制备ER-888838(6.2mg,0.015mmol,45%收率),其中以14(15mg,0.034mmol)和3,5-二甲基吡啶-2,6-二胺(20mg,0.146mmol)起始。
通过ER-886604所述的相似方法制备ER-888977(1.2mg,0.003mmol,11%收率),其中以14(12.5mg,0.029mmol)和1,3-二甲基-1H-吡唑-5-胺(28.8mg,0.259mmol)起始。
通过ER-886604所述的相似方法制备ER-889448(8.2mg,0.022mmol,63%收率),其中以14(15mg,0.034mmol)和1-乙基哌嗪(0.020mL,0.136mmol)起始。
通过ER-886604所述的相似方法制备ER-889469(6.5mg,0.018mmol,52%收率),其中以14(15mg,0.034mmol)和1-(氮杂环丁烷-3-基)吡咯烷(20mg,0.158mmol)起始。
通过ER-886604所述的相似方法制备ER-889470(7.2mg,0.017mmol,48%收率),其中以14(15mg,0.034mmol)和1-(氮杂环丁烷-3-基)哌啶(20mg,0.158mmol)起始。
通过ER-886604所述的相似方法制备ER-889557(7.7mg,0.020mmol,58.6%收率),其中以14(15mg,0.034mmol)和哌啶-4-基甲醇(20mg,0.174mmol)起始。
通过ER-886604所述的相似方法制备ER-889571(3.2mg,0.008mmol,23%收率),其中以14(15mg,0.034mmol)和(R)-1,3’-二吡咯烷(20mg,0.143mmol)起始。
通过ER-886604所述的相似方法制备ER-889572(1.1mg,0.003mmol,7.7%收率),其中以14(15mg,0.034mmol)和(R)-1-(吡咯烷-3-基)哌啶(20mg,0.130mmol)起始。
通过ER-886604所述的相似方法制备ER-889601(6.7mg,0.018mmol,51%收率),其中以14(15mg,0.034mmol)和1-甲基-1,4-二氮杂环庚烷(20mg,0.175mmol)起始。
通过ER-886604所述的相似方法制备ER-889602(10.2mg,0.022mmol,65.3%收率),其中以14(15mg,0.034mmol)和苯基(哌嗪-1-基)甲酮(30mg,0.158mmol)起始。
通过ER-886608所述的相似方法制备ER-891084(7.2mg,0.016mmol,47%收率),其中以14(15mg,0.034mmol)和1-(哌啶-4-基)氮杂环庚烷(30mg,0.165mmol)起始。
通过ER-886604所述的相似方法制备ER-890108(15.2mg,0.036mmol,58.6%收率),其中以14(27mg,0.062mmol)和1-(氮杂环丁烷-3-基)-4-甲基哌嗪(90.2mg,0.581mmol)起始。还将三乙胺(0.008mL,0.062mmol)添加至反应。
通过ER-886604所述的相似方法制备ER-890112(296.5mg,0.683mmol,74.7%收率),其中以14(400.6mg,0.916mmol)和4,4’-联哌啶(290mg,1.723mmol)起始。
通过ER-886604所述的相似方法制备ER-894472(53.9mg,0.143mmol,25%收率)和ER-894473(51.2mg,0.135mmol,23.6%收率),其中以14(250mg,0.571mmol)和5-甲基哌嗪-2-酮(78.3mg,0.686mmol)起始。任意指定各个非对映甲基的立体化学。
通过ER-886604所述的相似方法制备ER-886507(4.2mg,0.013mmol,51.9%收率),其中以14(10.6mg,0.024mmol)和吡咯烷(0.022mL,0.257mmol)起始,使用甲苯(1mL)代替DMA作为溶剂。不需要进行Boc去保护。
通过ER-890507所述的相似方法制备ER-886508(3.3mg,0.010mmol,38.9%收率),其中以14(10.8mg,0.025mmol)和N,N-二乙胺(0.027mL,0.262mmol)起始。
通过ER-890507所述的相似方法制备ER-886509(4.8mg,0.013mmol,44.9%收率),其中以14(12.5mg,0.029mmol)和苄胺(0.028mL,0.263mmol)起始。
通过ER-890507所述的相似方法制备ER-886601(6.6mg,0.018mmol,64.2%收率),其中以14(12.5mg,0.029mmol)和苯胺(0.008mL,0.087mmol)起始。
通过ER-890507所述的相似方法制备ER-886602(6.4mg,0.017mmol,60.1%收率),其中以14(12.5mg,0.029mmol)和1-氨基-3-甲苯(0.028mL,0.263mmol)起始。
通过ER-890507所述的相似方法制备ER-887104(2.1mg,0.005mmol,17.9%收率),其中以14(12.5mg,0.029mmol)和(S)-2-(三氟甲基)吡咯烷(36.1mg,0.260mmol)起始。
通过ER-890507所述的相似方法制备ER-886603(7.6mg,0.020mmol,71%收率),其中以14(12.5mg,0.029mmol)和1-氨基-2-甲苯(0.030mL,0.290mmol)起始,使用NMP(1mL)代替甲苯作为溶剂。
通过ER-886507所述的相似方法制备ER-886957(4.7mg,0.013mmol,45%收率),其中以14(12.5mg,0.029mmol)和2-甲基哌啶(25.7mg,0.263mmol)起始。
通过ER-886507所述的相似方法制备ER-886958(6.2mg,0.016mmol,57%收率),其中以14(12.5mg,0.029mmol)和2-乙基哌啶(29.3mg,0.263mmol)起始。
通过ER-886507所述的相似方法制备ER-887139(2.1mg,0.005mmol,18%收率),其中以14(12.5mg,0.029mmol)和(S)-2-三氟甲基吡咯烷(36.1mg,0.263mmol)起始。
通过ER-886507所述的相似方法制备ER-887252(2.6mg,0.006mmol,21%收率),其中以14(12.5mg,0.029mmol)和2-氨基-4-苯基吡啶(20mg,0.145mmol)起始。
通过ER-886507所述的相似方法制备ER-887258(4.2mg,0.010mmol,34%收率),其中以14(12.5mg,0.029mmol)和甲苯(0.5mL)中的N-苯基哌嗪(0.040mL,0.290mmol)起始。
通过ER-886507所述的相似方法制备ER-887259(3.2mg,0.009mmol,30%收率),其中以14(12.5mg,0.029mmol)和2,6-二甲基吡啶(30mg,0.290mmol)起始。
通过ER-886507所述的相似方法制备ER-887260(3.3mg,0.009mmol,30.1%收率),其中以14(12.5mg,0.029mmol)和(S,S)-2,5-二甲基哌嗪(29.6mg,0.263mmol)起始。
通过ER-886507所述的相似方法制备ER-887261(4.2mg,0.011mmol,39%收率),其中以14(12mg,0.027mmol)和N-乙酰基哌嗪(40mg,0.274mmol)起始。
通过ER-886507所述的相似方法制备ER-887262(2.4mg,0.006mmol,22%收率),其中以14(12.5mg,0.029mmol)和4-(R)-羟基-2-(S)-羟甲基吡咯烷(30.4mg,0.263mmol)起始。
通过ER-886608所述的相似方法制备ER-887268(9.3mg,0.017mmol,10%收率),其中使用甲苯(100mL)以14(50mg,0.114mmol)和(R)-叔丁基3-甲基哌嗪-1-甲酸酯(100mg,0.570mmol)起始。如以上Boc保护的ER-890963所述,需要Boc去保护。通过反相HPLC(Water's X-Bridge C18 19x 100mm柱,用具有0.05%TFA的10%–40%乙腈水溶液进行洗脱)纯化ER-887268,然后如ER-886608所述进行中和。
通过ER-887268所述的相似方法制备ER-887269(6.2mg,0.025mmol,21.4%收率),其中以14(51.8mg,0.118mmol)和(R)-叔丁基2-甲基哌嗪-1-甲酸酯(100mg,0.570mmol)起始。
通过ER-887268所述的相似方法制备ER-887270(12.2mg,0.033mmol,30%收率),其中以14(50mg,0.114mmol)和(S)-叔丁基2-甲基哌嗪-1-甲酸酯(200mg,1.14mmol)起始。
通过ER-887268所述的相似方法制备ER-887271(2.3mg,0.006mmol,5.5%收率),其中以14(48.2mg,0.110mmol)和(R,R)-叔丁基2,5-二甲基哌嗪-1-甲酸酯盐酸盐(100mg,0.399mmol)以及DIPEA(0.10mL,0.55mmol)起始。
通过ER-887268所述的相似方法制备ER-887272(3.2mg,0.008mmol,7.1%收率),其中以14(52.7mg,0.120mmol)和(S,R)-叔丁基2,5-二甲基哌嗪-1-甲酸酯(100mg,0.467mmol)起始。
通过ER-890963所述的相似方法制备ER-890119(256.2mg,0.630mmol,58.6%收率),其中以14(450mg,1.029mmol)和4-(氮杂环丁烷-3-基)哌嗪-1-甲酸叔丁酯(314.2mg,1.302mmol)起始。还将三乙胺(0.172mL,1.23mmol)添加至反应。使用二噁烷(2mL)代替DMA。需要用TFA对Boc基团进行去保护,然后如先前所述进行最终产物的中和。
通过ER-890119所述的相似方法制备ER-892253(152.3mg,0.362mmol,4.0%总收率),其中以14(4.0mg,9.1mmol)和(1-(氮杂环丁烷-3-基)哌啶-4-基)氨基甲酸叔丁酯(2.52g,9.9mmol)起始。
通过ER-890119所述的相似方法制备ER-888605(7.6mg,0.017mmol,5.0%收率),其中以14(150mg,0.343mmol)和[1,4’-联哌啶]-2-酮盐酸盐(82.5mg,0.377mmol)起始。不需要进行Boc基团去保护。
通过ER-890119所述的相似方法制备ER-888605(7.6mg,0.017mmol,5.0%收率),其中以14(150mg,0.343mmol)和[1,4’-联哌啶]-2-酮盐酸盐(82.5mg,0.377mmol)起始。不需要进行Boc基团去保护。
通过ER-890119所述的相似方法制备ER-890093(15.2mg,0.035mmol,45.4%收率),其中以14(33.6mg,0.077mmol)和4-(哌啶-4-基)吗啉(52mg,0.305mmol)起始。不需要进行Boc基团去保护。
通过ER-890119所述的相似方法制备ER-890104(569mg,1.06mmol,42.6%收率),其中以14(1.08g,2.5mmol)和4-(哌啶-4-基)哌嗪-1-甲酸叔丁酯(1.00g,3.7mmol)起始。如上所述进行ER-890104(21mg,0.039mmol)的Boc基团去保护,以得到ER-890106(12.4mg,0.029mmol,73.2%收率)。
通过ER-890119所述的相似方法制备ER-890105(65mg,0.122mmol,11.3%收率),其中以14(1.08g,2.5mmol)和4-(哌啶-4-基)哌嗪-1-甲酸叔丁酯(1.00g,3.7mmol)起始。还将DIPEA(0.65mL,3.7mmol)添加至反应混合物。如上所述进行ER-890105(60mg,0.112mmol)的Boc基团去保护,以得到ER-890107(11.3mg,0.026mmol,23.2%收率)。
通过ER-886608所述的相似方法制备ER-890311(4.5mg,0.011mmol,31%收率),其中以14(15mg,0.034mmol)和(S)-1-(吡咯烷-3-基)哌啶二盐酸盐(30mg,0.108mmol)起始,用乙腈(1mL)代替DMA。还将三乙胺(0.014mL,0.102mmol)添加至反应。根据先前所述的方法产生产物的二盐酸盐。
通过ER-890311所述的相似方法制备ER-890342(41.3mg,0.101mmol,11%收率),其中以14(150.2mg,0.916mmol)和4-(氮杂环丁烷-3-基)吗啉(221.6mg,1.030mmol)起始。
通过ER-890311所述的相似方法制备ER-890343(25.2mg,0.062mmol,77.2%收率),其中以14(35.2mg,0.080mmol)和1-(氮杂环丁烷-3-基)-4-甲基哌嗪(40.3mg,0.0201mmol)起始。
通过ER-890311所述的相似方法制备ER-890344(21.4mg,0.059mmol,73.8%收率),其中以14(35.2mg,0.080mmol)和(S)-叔丁基3-甲基哌嗪-1-甲酸酯(28.2mg,0.201mmol)起始。在用TFA进行Boc基团的去保护之后进行中和。
通过ER-890344所述的相似方法制备ER-890963(685.2mg,1.806mmol,86%),其中以14(919mg,2.101mmol)和(S)-叔丁基2-乙基哌嗪-1-甲酸酯(500mg,2.333mmol)起始。根据先前所述的方法产生产物的二盐酸盐。
通过ER-890311所述的相似方法制备ER-891090(54.2mg,0.133mmol,46.8%收率),其中以14(137.5mg,0.314mmol)和(S)-1,3’-二吡咯烷二盐酸盐(30mg,0.165mmol)起始。不需要进行Boc基团去保护。
通过ER-890311所述的相似方法制备ER-895204(35.2mg,0.084mmol,73.1%收率),其中以14(50mg,0.114mmol)和N-乙基哌啶-4-甲酰胺(21.4mg,0.137mmol)起始。根据先前所述的方法产生产物的盐酸盐。
作为来自方案4的化合物15的修改实例的ER-887612的制备:
将化合物3(201mg,0.862mmol)和(R)-2-羟甲基吗啉盐酸盐(132,0.856mmol)在NMP(3mL)中的混合物加热至170℃持续16h。将完成的反应物进行冷却,过滤,用MeOH(2mL)洗脱,然后通过HPLC使用C-18柱直接纯化,其中用包含0.1%TFA的10%–100%乙腈水溶液洗脱。收集所需产物并且浓缩至干燥。将所得产物溶于MeOH(2mL)中,并且经过碱性二氧化硅塞(Biotage,1g,SiCO3),用MeOH(5mL)洗脱,以得到(R)-5-(2-(羟甲基)吗啉代)喹啉-8-甲腈或ER-886849(108mg,0.401mmol,46.9%收率)。
向ER-886849(101mg,0.375mmol)在DCM(2mL)中的经搅拌的溶液添加对甲苯磺酰氯(78.5mg,0.412mmol),然后添加DIPEA(0.13mL,0.746mmol)和DMAP(2.3mg,0.019mmol)。将反应混合物在室温下搅拌2h,此后添加额外的对甲苯磺酰氯(78.7mg,0.413mmol),然后在室温下搅拌4h。在搅拌下将水(1.2mL)和DCM(5.9mL)添加至完成的反应,然后分离各层。用盐水(1.2mL)洗涤有机层,经MgSO4干燥,过滤并浓缩至干燥。将粗产物经硅胶(Biotage SP4,Interchim 25g,用庚烷中的20%-100%EtOAc梯度洗脱)纯化,将所需部分进行收集,在真空中浓缩并且干燥,以得到(R)-(4-(8-氰基喹啉-5-基)吗啉-2-基)甲基4-甲基苯磺酸酯(85mg,0.201mmol,53.6%收率)。
将(R)-(4-(8-氰基喹啉-5-基)吗啉-2-基)甲基4-甲苯-磺酸酯(27mg,0.064mmol)和2-氨基吡啶(90mg,0.956mmol)在NMP(1mL)中的溶液在150℃下微波处理15min。将冷却的反应物用NMP(3mL)进行稀释并且通过HPLC使用C-18直接纯化,其中用包含0.1%TFA的10%–100%乙腈水溶液洗脱。收集所需产物并且浓缩至干燥。将所得产物溶于MeOH(2mL),并且经过碱性二氧化硅塞(Biotage,1g,SiCO3),用MeOH(5mL)洗脱,以得到ER-887612(16mg,0.046mmol,71.9%收率)。
以与ER-886849相似的方式制备ER-885211(4mg,0.016mmol,24.7%收率),其中以化合物3(15mg,0.064mmol)和(R)-2-甲基吗啉(22mg,0.160mmol)开始。将TEA(0.05mL,0.359mmol)添加至反应。
化合物10的可选合成-方案5
化合物16:向化合物8(2.869g,7.06mmol)在冷却至5-6℃的乙腈(14.4ml)中的经搅拌的溶液添加TFA(0.163ml,2.12mmol),然后添加NBS(1.385g,7.78mmol)。将反应混合物搅拌1h,此后添加9%NaHCO3(6.6g,7.1mmol),然后添加亚硫酸钠(Na2SO3;0.27g,2.1mmol),并且然后搅拌5min。将混合物用水(5.7ml)和甲苯(29ml)稀释,再搅拌5min,然后分离各层。用甲苯(14.4ml)萃取水层,此后用20%NaCl(7.20ml)洗涤合并的有机层,浓缩至约5ml,然后用MTBE(29ml)稀释。添加2M NaOH(7.1ml)并且将所得的两相混合物剧烈搅拌10min。分离有机层并且依次用20%NaCl(每次14ml)、水(5.7ml)洗涤两次,浓缩至约5ml并且用甲苯(14.4ml)稀释。将包含(2R)-2-((苄氧基)甲基)-6-(溴甲基)-4-((2-硝基苯基)-磺酰基)吗啉16的所得溶液直接用于下一反应。
化合物17:向16(约3.43g,7.06mmol,来自以上)在甲苯中的经搅拌的溶液添加DBU(2.66ml,17.648mmol),然后在100℃下加热4h。将完成的反应物冷却至15℃,然后在搅拌下添加MTBE(60ml)和1M HCl(21.2ml)。分离各层,此后用MTBE(20ml)萃取水层。用水(10ml)、9wt%NaHCO3水溶液(10g,10.713mmol)、20wt%NaCl(10ml)洗涤合并的有机层,然后浓缩至干燥。将所产生的带有盐的粗制黄色油状物用DCM(10ml)稀释,过滤并且浓缩以产生呈橙色油状的粗制(R)-2-((苄氧基)甲基)-6-亚甲基-4-((2-硝基苯基)磺酰基)吗啉17(3.2g)。
化合物10:在0℃下向三乙基硅烷(1.69ml,10.6mmol)在DCM(4ml)中的经搅拌的溶液添加TFA(2.72ml,35.3mmol),然后冷却至-15℃。添加DCM(4ml)中的粗制17(约2.86g,7.06mmol),同时将温度维持在-5℃,然后添加经DCM(4ml)冲洗的残余物。将所得的混合物在-10℃至-5℃搅拌1h,然后升温至2℃-3℃再持续1h。将完成的反应物冷却至-10℃,倾入预先冷却(2℃)的2M NaOH(21.2ml,42.4mmol),用DCM(2ml)冲洗反应器。用MTBE(50ml)萃取最终混合物以及用水(10ml)、20wt%NaCl(10ml)洗涤有机层,并且进行浓缩以产生橙色的油状物。将粗产物经硅胶(正庚烷/MTBE 1:2)纯化,以在合并以及在真空中浓缩所需部分然后干燥之后,得到呈淡黄色固体状的(2R,6R)-2-((苄氧基)甲基)-6-甲基-4-((2-硝基苯基)磺酰基)吗啉10(1.437g,3.54mmol,50%收率,由8经3个步骤)。
化合物11的可选合成-方案6
化合物18和化合物19:向甘氨酸(85.86g,1.144mol)在1,4-二噁烷(660mL)中的经搅拌的悬浮液添加1.0M NaOH水溶液(1144mL,1.114mol),然后加热至80℃,此后缓慢添加(2R)-苄基2-环氧丙基醚6(93.90g,0.5718mol)在1,4-二噁烷(94mL)中的溶液,同时将内部温度在2h内维持在77-82℃。将完成的反应混合物冷却至18℃,然后添加二碳酸二叔丁酯(262.1g,1.201mol),将温度维持在18℃至21℃。将混合物在室温下搅拌过夜,此后将完成的混合物用庚烷(2000mL)洗涤两次。将水层用20wt%柠檬酸(270g)进行酸化并且用EtOAc(2000mL和2x 1000mL)萃取三次。将合并的有机层用20wt%NaCl(每次460g)洗涤两次,浓缩,溶于EtOAc(560mL),过滤,浓缩并且用DCM(280mL)稀释,以在溶液中产生(R)-2-((3-(苄氧基)-2-羟丙基)(叔丁氧基羰基)氨基)乙酸18。
在15℃下,向EDC(120.6g,0.6290mol)和DMAP(2.10g,0.0172mol)悬浮于DCM(380mL)中的经搅拌的溶液在30min内添加上述18的溶液,同时将温度维持低于20℃。将反应混合物在18-20℃搅拌3h,此后将其冷却至10℃,然后在搅拌下用20wt%柠檬酸(820g)淬灭。分离各层并且用MTBE(1.4L)萃取水层。用饱和NaHCO3(480g)水溶液、30%NaCl(470g)洗涤合并的有机层,并且进行浓缩。因此将获得的粗产物经硅胶(用4:1至3:1的正庚烷/EtOAc洗脱)纯化,以在合并所需部分、在真空中浓缩和干燥后得到呈透明黄色油状的(R)-叔丁基2-((苄氧基)甲基)-6-氧代吗啉-4-甲酸酯19(96g,0.298mol,26.1%收率,在两个步骤中)。
化合物22和化合物23:向19(134.29g,0.418mol)在冷却至-75℃的THF(1100mL)中的经搅拌的溶液在1h内逐滴添加乙醚(334mL,0.501mol)中的1.5M MeLi-LiBr复合物,同时将温度维持在<-65℃。将混合物冷却至-75℃并且搅拌1.5h,此后将反应用20wt%NH4Cl(270g)水溶液在10min内缓慢淬灭,同时将温度维持在<-55℃。将混合物在1h内升温至0℃,分配于水(270g)与MTBE(1340mL)之间。用MTBE(1100mL)萃取水层,然后合并有机层并且用20wt%NaCl(270g)洗涤,以及浓缩至干燥。将残余物溶于甲苯(1100mL),过滤,浓缩,与甲苯(1100mL)共沸至干燥,并且然后溶于DCM(1200ml)。将混合物冷却至-72℃并且添加三乙基硅烷(0.200L,1.25mol),然后在45min内添加三氟甲磺酸三甲基甲硅烷基酯(151mL,0.836mol),同时将温度维持在<-68℃。将DCM(336mL,5.24mol)中的TFA(129mL,1.67mol)在20min内添加至完成的反应,同时将温度维持在<-65℃。将混合物升温至-10℃,然后在搅拌下添加饱和NaHCO3(0.70kg)水溶液。分离各层并且将水层用DCM(每次940mL)萃取两次。将合并的有机层用饱和NaHCO3(0.70kg)水溶液洗涤,浓缩,溶于乙腈(400mL),用二碳酸二叔丁酯(91.2g,0.418mol)在20-25℃进行处理,并且搅拌1h。将完成的反应物与甲苯(800ml)共沸至干燥,并且经硅胶(用9:1至4:1的正庚烷/EtOAc洗脱)纯化,以在合并所需部分、在真空中浓缩和干燥后得到呈白色固体状的(2R,6R)-叔丁基2-((苄氧基)甲基)-6-甲基吗啉-4-甲酸酯22(61.90g,0.193mol,46%收率,来自19)。通过硅胶柱色谱法可分离次要的立体异构体(2R,6S)-叔丁基2-((苄氧基)甲基)-6-甲基吗啉-4-甲酸酯23。
化合物11:在室温下,向22(27mg,0.084mol)在DCM(0.60mL)中的经搅拌的溶液添加TFA(0.30mL,0.0039mol),然后搅拌30min。将完成的反应物进行浓缩,与甲苯(1.8mL x 2)共沸至干燥两次,然后溶于DCM(3.0mL)。将有机溶液用饱和NaHCO3(0.50g)水溶液洗涤,在真空中浓缩并且干燥以得到呈无色膜状的(2R,6R)-2-((苄氧基)甲基)-6-甲基吗啉11(19mg,100%收率)。
化合物11的第二可选合成-方案7
化合物23:将(2R)-苄基2-环氧丙基醚6(21.0g,0.128mol)在EtOH(100mL)中的溶液在室温下缓慢添加至7.0M氨水在MeOH(100mL)和28%氢氧化铵水溶液(210mL)中的溶液。将反应容器紧密封盖并且在室温下搅拌23h。将完成的反应物在真空中浓缩,并且将粗产物与甲苯(100mL)共沸至干燥两次,以得到包含约15%二聚物的呈蜡状固体的(R)-1-氨基-3-(苄氧基)丙-2-醇23(23g)。粗产物未经进一步纯化用于下一反应。
化合物25:向23(12.0g,49.7mmol)在EtOH(15mL)中的溶液添加可商购的(S)-(-)-2-氯丙酸甲酯24(6.69g,54.6mol)。将混合物加热至70℃并且搅拌14h,此后将完成的反应物在真空中进行浓缩。将粗产物用EtOAc(50mL)稀释,用1N HCl(20mL)、盐水(20mL)洗涤,然后将有机相经无水Na2SO4干燥,过滤并且浓缩至干燥。经硅胶(SNAP10g,庚烷/EtOAc=5/1至1/5,然后仅EtOAc,TLC hep/EtOAc=1/3,rf=0.45)纯化,在将所需的经收集的部分在真空中浓缩并且干燥后得到无色的浆状物(S)-N-((R)-3-(苄氧基)-2-羟丙基)-2-氯丙酰胺25(9.86g,36.2mmol,73%收率)。
化合物26:向60%氢化钠(5.82g,0.0728mol)在冷却至0℃的THF(440mL)中的经搅拌的悬浮液在15min内逐滴添加THF(100mL)中的25(9.89g,36.4mmol)。将反应混合物在0℃下再搅拌30min,此后使其升温至室温持续1h。将完成的反应物完全冷却至0℃,此时缓慢添加异丙醇(100mL)。将粗制溶液用Dowex H+中和,然后过滤掉树脂,用异丙醇洗涤两次(每次20mL)并且将滤液浓缩至干燥。将粗产物经硅胶(SNAP 100g,hep/EtOAc=1/1至仅EtOAc,TLC hep/EtOAc=1/3,rf=0.4)纯化,以在将所需的收集的部分进行收集、在真空中浓缩和干燥后得到(2R,6R)-6-((苄氧基)甲基)-2-甲基吗啉-3-酮26(6.42g,27.3mmol,75%收率)。
化合物11:
向26(6.67g,28.3mmol)在THF(20mL)溶液中的经搅拌的溶液在室温下逐滴添加THF(40.0mL)中的1M氢化铝锂。将反应在室温下搅拌2.5h,此后将完成的反应冷却至0℃,然后缓慢地逐滴添加水(13mL),然后添加1M NaOH水溶液(0.8mL)。将淬灭的反应在室温下搅拌,直到形成自由流动的白色沉淀。将沉淀经硅藻土545垫过滤并且用EtOAc、DCM和Et2O(各自为10mL)洗涤。将滤液进行浓缩并且经硅胶(SNAP 100g,仅有DCM至DCM/MeOH=97/3,TLCCHCl3/MeOH=9/1,rf反式=0.5,rf顺式=0.4)纯化。获得所得的11的顺式/反式非对映体混合物(4.42g,20.0mmol,70.6%收率)中的纯11(0.93g,4.2mmol,15%收率)。
化合物12的可选制备-方案8
化合物28:向碳酸钠(31g,0.37mol)在水(50ml)中的悬浮液添加1-氨基-3,3-二乙氧基丙烷(10.00mL,61.81mmol)在DCM(50mL)中的溶液,然后冷却至0℃。在0℃下,在剧烈搅拌中添加苯磺酰氯(7.65mL,60.0mmol),然后升温至20℃并且持续搅拌2h,此后添加MTBE(150mL)。分离有机层,用1.0M HCl(50mL)、饱和NaHCO3(50g)、水(50g)洗涤,浓缩并且与MTBE(150mL x 2)共沸至干燥两次,以得到呈淡黄色透明油状的N-(3,3-二乙氧基丙基)苯磺酰胺28(17.34g,60.34mmol,97%收率)。
化合物30:向2-氟-4-羟基苯甲腈29(15.00g,0.1094mol)在冷却至0℃的DMF(45.0mL)中的经搅拌的溶液添加碳酸钾(37.8g,0.274mol),然后在0-5℃搅拌30min。在<5℃下,将苄基溴(13.7mL,0.115mol)添加至反应混合物,在5℃下搅拌1h,然后升温至20℃并且再搅拌2.5h。将完成的反应物分配于水(180ml)与MTBE(220mL)之间,分离各层并且将有机层用水(90mL)洗涤,浓缩并且与EtOAc(每次150mL)共沸至干燥两次,以得到呈白色固体状的4-(苄氧基)-2-氟苯甲腈30(24.64g,0.1084mol,99%收率)。
化合物32:在室温下向28(13.28g,46.21mmol)在NMP(30.0mL)中的经搅拌的溶液添加30(10.00g,44.01mmol),然后添加Cs2CO3(21.5g,66.0mmol)。将所得的混合物在110℃下加热16h,然后冷却至室温。将混合物分配于水(120g)与MTBE(120mL)之间,并且用MTBE(120mL)萃取水层。将合并的有机层用水(60g)洗涤,浓缩并且与EtOAc(每次100mL)共沸至干燥两次,以产生呈褐色油状的N-(5-(苄氧基)-2-氰基苯基)-N-(3,3-二乙氧基丙基)苯磺酰胺31。将粗产物在氢气气氛(气球压力)下用EtOAc(100mL)中的10wt%Pd-C(1.40g)进行氢解3h,此后将经吹扫的反应混合物经过硅藻土垫过滤,用EtOAc(100mL)冲洗并且浓缩。因此将获得的粗产物经硅胶(用2:3的正庚烷/MTBE洗脱)纯化,以得到呈黄色粘性油状的N-(2-氰基-5-羟基苯基)-N-(3,3-二乙氧基丙基)苯-磺酰胺32(16.38g,40.50mmol,92%收率)。
化合物33:向32(5.45g,13.5mmol)在冷却至0℃的THF(40mL)中的经搅拌的溶液添加水(5.4mL),然后添加TFA(11mL,0.14mol)。使所得的混合物升温至20℃并且搅拌过夜。将完成的反应物与甲苯(每次54mL)共沸至干燥两次,以得到呈粘性油状的N-(2-氰基-5-羟基苯基)-N-(3-氧代丙基)苯磺酰胺33(4.55g,13.8mmol,100%收率)。
化合物34:向33(1.64g,4.96mmol)在70℃下加热的甲苯(29.5mL)和NMP(1.2mL)的混合物中的经搅拌的悬浮液添加D-(+)-10-樟脑磺酸(1.15g,4.96mmol),然后在100℃下加热14h。将完成的反应物冷却至室温,用EtOAc(60mL)稀释,用水(6.3mL)洗涤,并且进行浓缩以产生深褐色油状物。将粗产物经硅胶(用1:1的正庚烷/EtOAc洗脱)纯化,以得到呈黄色固体状的5-羟基-1-(苯基磺酰基)-1,2-二氢喹啉-8-甲腈34(685mg,2.19mmol,44%收率)。
化合物35和化合物12:向34(0.393g,1.26mmol)在DCM(3.0ml)中的经搅拌的悬浮液添加2,6-二甲基吡啶(0.437ml,3.78mmol),然后冷却至1-2℃。添加三氟甲烷磺酸酐(0.275ml,1.64mmol)在DCM(1.0ml)中的溶液,同时将温度维持在低于4℃。将反应混合物在2-3℃搅拌1h,倾入预先冷却(5℃)的MTBE(20ml)和1M HCl(6.3ml)的混合物中。将所得的、分离的有机层用9wt%NaHCO3(3g)、20wt%NaCl(5g)洗涤,经Na2SO4(2g)干燥1h,过滤并且进行浓缩以产生呈黄色油状的粗制8-氰基-1-(苯基磺酰基)-1,2-二氢喹啉-5-基三氟甲烷-磺酸酯35。将35溶于NMP(2.5ml)和DIPEA(1.75ml,10.1mmol),然后将11(0.446g,2.02mmol)溶于其中,并且将所得的混合物在125℃下加热过夜。将完成的反应物冷却至室温并且分配于EtOAc(30ml)与水(10ml)之间。将有机层用水(10ml)洗涤,浓缩并且经硅胶塞柱(用1:1的正庚烷/EtOAc洗脱)纯化,以得到呈褐色固体状的5-((2R,6R)-2-((苄氧基)甲基)-6-甲基吗啉代)-喹啉-8-甲腈12(80.2mg,0.215mmol,17%收率)。
化合物36的合成-方案9:向13(10.97g,38.72mmol)在DCM(44ml)中的经搅拌的悬浮液添加2,6-二甲基吡啶(5.38ml,46.5mmol),然后冷却至0℃。添加三氟甲烷磺酸酐(Tf2O;6.84mL,40.7mmol)在DCM(22ml)中的溶液,同时将温度维持在<5℃并且搅拌1h。将完成的反应用饱和碳酸氢钠(65g)淬灭,并且将混合物升温至15℃。分离各层并且用DCM(55L)萃取水层。将合并的有机层用20wt%NaCl(33g)洗涤并且经硅酸镁载体(Florisil)(11g)搅拌1.5h,此后将混合物进行过滤,用MTBE(55mL)洗脱并且浓缩。将黄褐色固体悬浮于DCM(11ml)中,用正庚烷(110ml)稀释,过滤,用10:1的正庚烷/DCM(121ml)冲洗,并且在真空下干燥以得到呈淡黄褐色固体状的((2R,6R)-4-(8-氰基喹啉-5-基)-6-甲基吗啉-2-基)甲基三氟甲烷磺酸酯36(15.20g,36.6mmol,94%收率)。
使用方案9和方案17合成ER-887927:
方案17
向36(1.002g,2.412mmol)在乙腈(6.0mL)中的经搅拌的悬浮液添加碳酸钾(1.33g,9.65mmol),然后添加可商购的1,4’-联哌啶72(609mg,3.62mmol)。将反应混合物在回流下加热5h,此后将完成的反应物冷却至室温,用水(12mL)稀释并且进行部分浓缩。添加正庚烷(10mL)和MTBE(10mL),并且将混合物进行部分浓缩,此时通过过滤收集由此形成的褐色固体,用以下冲洗:(1)水(15mL)和(2)正庚烷(15mL),并且在真空下干燥过夜。将干燥的固体溶于正庚烷(10mL,0.2mol),用乙腈(5.0mL,0.096mol)稀释,然后用硅酸镁载体(0.50g)在室温下处理10min。将混合物进行过滤,用乙腈(10mL)洗脱并且浓缩以产生黄褐色固体,所述固体用1:2的MTBE/正庚烷(15ml)磨碎,过滤,用1:3的MTBE/正庚烷(10ml)冲洗,并且在N2/真空下干燥以产生呈淡黄褐色粉末状的ER-887927(1.001g,2.31mmol,95%收率)。
通过ER-887927所述的相似方法制备ER-893881(15.2mg,0.037mmol,51.6%收率),其中以36(30mg,0.072mmol)和(S)-1,3’-二吡咯烷二盐酸盐(20.5mg,0.144mmol)起始,使用TEA(0.020mL,0.141mmol)代替K2CO3。
通过ER-893881所述的相似方法制备ER-894483(30mg,0.079mmol,32.8%收率),其中以36(100mg,0.241mmol)和(R)-3-甲基哌嗪-2-酮(54.9mg,0.481mmol)起始。
通过ER-893881所述的相似方法制备ER-894484(30mg,0.079mmol,32.8%收率),其中以36(100mg,0.241mmol)和(S)-3-甲基哌嗪-2-酮(54.9mg,0.481mmol)起始。
通过ER-893881所述的相似方法制备ER-894504(30mg,0.076mmol,31.5%收率),其中以36(100mg,0.241mmol)和(2S,5R)-2,5-二甲基哌嗪(54.9mg,0.481mmol)起始。
通过ER-893881所述的相似方法制备ER-894505(30mg,0.076mmol,31.5%收率),其中以36(100mg,0.241mmol)和2,3-二甲基哌嗪(54.9mg,0.481mmol)起始。
通过ER-893881所述的相似方法制备ER-894655(140mg,0.309mmol,64.2%收率),其中以36(200mg,0.482mmol)和2,2-二甲基哌嗪-1-甲酸叔丁酯(206mg,0.961mmol)起始。使用4N HCl二噁烷水解Boc保护的基团,然后通过与甲苯共沸至干燥并且在真空下干燥分离所需产物。
通过ER-893881所述的相似方法制备ER-894151(1.066mg,3.16mmol,65.4%收率),其中以36(2.0g,4.81mmol)和氮杂环丁烷-3-基氨基甲酸叔丁酯(0.995g,5.78mmol)起始。使用DCM(3mL)中的TFA(3mL)对Boc保护的中间体进行去保护。使反应搅拌30分钟,此后将反应物与甲苯(每次5mL)共沸三次浓缩至干燥。将残余物用DCM(10mL)稀释,用饱和NaHCO3(5mL)、水(5mL)、盐水(5mL)洗涤两次,经MgSO4干燥,过滤,在真空中浓缩并且干燥以得到所需产物。
ER-890250:在-78℃下,向ER-887927(50mg,0.115mmol)在THF(1mL)中的冷却的经搅拌的溶液添加乙醚(0.15mL,0.24mmol)中的1.6M甲基锂-溴化锂复合物,由此使得淡黄色溶液变成亮红色/橙色。将反应混合物在-78℃下搅拌1.5h,此后用氢氧化铵水溶液(2mL)将其淬灭,然后缓慢升温至室温。将反应物用DCM(5mL)萃取三次并且干燥合并的有机层,过滤并且浓缩至干燥。
将粗制中间体溶于丙酮(1mL),然后将硝酸铈铵(300mg,0.547mmol)水溶液(1.5mL)溶于其中。将反应混合物搅拌30min,此后将反应混合物浓缩成粗制固体。将固体悬浮于5mL丙酮中,搅拌5min,过滤并且将固体滤垫用丙酮(每次5mL)洗脱三次。将合并的滤液进行浓缩,然后通过反相HPLC(X-Bridge C18 19x 100mm柱,使用包含0.1%甲酸的乙腈/水梯度)纯化,将所需的部分进行合并,浓缩,溶于MeOH(2mL),经过SiCO3柱,用MeOH洗脱两次,在真空中浓缩并且干燥以得到ER-890250(4.4mg,0.010mmol,8.5%收率)。
来自方案10的ER-884884的合成:
化合物37:向来自方案6的22(1.003g,3.121mmol)在EtOH(5mL)中的经搅拌的溶液添加5%钯碳(100mg),然后用氢气对烧瓶进行几次充气。在维持氢气气氛(气球压力)下将反应加热至40℃并且搅拌过夜,此后将反应物用氮气吹扫几次,同时在吹扫间隔用真空清扫(housevacuum)抽空系统。将完成的反应物经硅藻土545过滤,将滤垫用EtOH(每次5mL)洗涤两次,然后在真空中浓缩并且干燥合并滤液的浓缩物。将粗产物(3R,5S)-叔丁基3-(羟甲基)-5-甲基哌啶-1-甲酸酯(0.720g,3.114mmol,99.8%收率)未经进一步纯化用于下一步。
在室温下向(3R,5S)-叔丁基3-(羟甲基)-5-甲基哌啶-1-甲酸酯(0.783g,3.385mmol)在DCM(5mL)中的经搅拌的溶液添加对甲苯磺酰氯(0.968g,5.078mmol),然后添加DMAP(40mg,0.33mmol)和DIPEA(1.18mL,6.77mmol)。将反应混合物在室温下搅拌3h,此后添加水(5mL),然后再搅拌15min。将所得的有机层用0.1N HCl(5mL)、盐水(3mL)洗涤,经MgSO4干燥,过滤并浓缩至干燥。将粗产物经硅胶(Biotage,用3:1庚烷:EtOAc洗脱)纯化,以得到(3S,5R)-叔丁基3-甲基-5-((甲苯磺酰氧基)甲基)哌啶-1-甲酸酯(0.8602g,2.232mmol,65.9%收率)。
在室温下向(3S,5R)-叔丁基3-甲基-5-((甲苯磺酰氧基)甲基)哌啶-1-甲酸酯(0.860g,2.232mmol)在DMF(7mL)中的经搅拌的溶液添加叠氮化钠(0.218g,3.347mmol),此后将反应升温至80℃并且再搅拌3h。将完成的反应冷却至室温,用EtOAc(25mL)稀释并且用水(每次5mL)洗涤三次。将所得的有机层经无水Na2SO4干燥,过滤,浓缩,此后将粗产物经硅胶(Biotage,用庚烷中的0%至15%EtOAc梯度洗脱)纯化,以在真空中浓缩所需合并的部分和干燥后,得到呈无色结晶固体的(2R,6R)-叔丁基2-(叠氮基甲基)-6-甲基吗啉-4-甲酸酯37(0.545g,2.126mmol,95.3%收率)。
ER-884884:向37(0.545g,2.126mmol)在MeOH(5mL)中的经搅拌的溶液添加5%钯活性碳(250mg),然后用氢气对烧瓶进行几次充气。在氢气气氛(气球压力)下将反应维持在室温并且搅拌12h,此后将反应物用氮气吹扫几次,同时在吹扫间隔用真空清扫抽空系统。将完成的反应物经硅藻土545过滤,将滤垫用EtOH(每次2mL)洗涤两次,然后在真空中浓缩并且干燥合并滤液的浓缩物。将粗产物(2S,6R)-叔丁基2-(氨基甲基)-6-甲基吗啉-4-甲酸酯(0.489g,2.10mmol,99.9%收率)未经进一步纯化用于下一步。
在室温下向(2S,6R)-叔丁基2-(氨基甲基)-6-甲基吗啉-4-甲酸酯(50.2mg,0.218mmol)在DCM(0.5mL)中的经搅拌的溶液添加TFA(0.25mL,3.4mmol)。将反应混合物搅拌1h,此后将其进行浓缩,与甲苯(每次2mL)共沸至干燥两次,并在真空中干燥。将粗制去保护的吗啉在搅拌下溶于DMA(1mL),然后将TEA(2mL)和化合物3(50mg,0.214mmol)溶于其中。将反应混合物升温至140℃并且搅拌1h,此后将完成的反应物冷却至室温并且直接注入制备型反相HPLC柱(在过滤后),以在真空下浓缩所需合并的部分并且干燥后得到ER-884884(12.1mg,0.043mmol,19.7%收率)。
方案10中的经取代的化合物15或ER-879713:向ER-884884(30.2mg,0.107mmol)在DCM(0.5mL)中的经搅拌的溶液添加TEA(30μL,0.20mmol),然后添加2,2-二甲基丙酰氯(20μL,0.162mmol)。将反应混合物在室温下搅拌3h,此后将完成的反应物进行浓缩,过滤并且经由制备型反相HPLC(Water’s X-Bridge C18 19x 100mm柱;用包含0.05%TFA的乙腈水溶液的梯度洗脱)直接纯化,以在真空下浓缩所需合并的部分并且干燥之后得到ER-879713(20.5mg,0.056mmol,52.3%收率)。
使用与ER-879713相似的方法获得ER-886432(10.2mg,0.023mmol,52.7%收率),其中以ER-884884(50mg,0.177mmol)和1-苯基环丁烷碳酰氯(8.5mg,0.044mmol)起始。
使用与ER-879713相似的方法获得ER-886563(3.6mg,0.023mmol,20.3%收率),其中以ER-884884(12.4mg,0.044mmol)和苯乙酰氯(0.007mL,0.053mmol)起始。
ER-888137:向ER-884884(30.2mg,0.107mmol)在NMP(0.5mL)中的经搅拌的溶液添加2-氯-5-氟嘧啶(140mg,1.056mmol)。将反应混合物在150℃下微波处理5min,此后将冷却的反应物经C-18反相HPLC制备型柱纯化,其中用10%-40%的乙腈水溶液梯度洗脱。将所需部分在真空下浓缩并且干燥以得到ER-888137(6.5mg,0.017mmol,9.7%收率)。
以与ER-888137相似的方式制备ER-888701(12.2mg,0.031mmol,17.7%收率),其中以ER-884884(50mg,0.177mmol)和2-氯-5-乙基嘧啶(150mg,1.052mmol)起始。
以与ER-888137相似的方式制备ER-888896(3.0mg,0.008mmol,23.1%收率),其中以ER-884884(10.1mg,0.036mmol)和2-氯吡嗪(30mg,0.261mmol)起始。
方案18:取代的化合物15的可选路线:
使用方案18的ER-879713或化合物76:
化合物73:向37(0.545g,2.126mmol)在MeOH(5mL)中的经搅拌的溶液添加5%钯活性碳(250mg),然后用氢气对烧瓶进行几次充气。在氢气气氛(气球压力)下将反应维持在室温并且搅拌12h,此后将反应物用氮气吹扫几次,同时在吹扫间隔用真空清扫抽空系统。将完成的反应物经硅藻土545过滤,将滤垫用EtOH(每次2mL)洗涤两次,然后在真空中浓缩并且干燥合并滤液的浓缩物。将粗产物(2S,6R)-叔丁基2-(氨基甲基)-6-甲基吗啉-4-甲酸酯73(0.489g,2.10mmol,99.9%收率)未经进一步纯化用于下一步。
化合物74:向73(50.2mg,0.218mmol)在DCM(0.5mL)中的经搅拌的溶液添加TEA(36.5uL,0.268mmol),然后添加2,2-二甲基丙酰氯(29.5uL,0.235mmol)。将反应混合物在室温下搅拌1h,此后将完成的反应物倾入水,用DCM(每次3mL)萃取三次并且将合并的有机层经MgSO4干燥,过滤,浓缩并且在真空下干燥以得到粗制的(2R,6S)-叔丁基2-甲基-6-(新戊酰氨基甲基)吗啉-4-甲酸酯74(R=tBu)。
ER-879713:向粗制的74在DCM(5mL)中的经搅拌的溶液添加TFA(0.25mL,3.4mmol),然后在室温下搅拌1h。将完成的反应物进行浓缩并且与甲苯共沸两次,然后在真空中干燥30min,此后将粗制的高级中间体75溶于DMA(1mL),然后将TEA和化合物3(50mg,0.214mmol)溶于其中。将反应混合物升温至140℃并且搅拌1h,此后将完成的反应物冷却至室温并且直接注入制备型反相HPLC柱(在过滤后),以在真空下浓缩所需合并的部分并且干燥后得到76的实例或ER-879713(9.3mg,0.025mmol,11.6%收率,R=tBu)。
使用与ER-879713相似的方法获得ER-879689(4.3mg,0.013mmol,6.0%收率,R=Me),其中以73(50.2mg,0.218mmol,R=Me)和3(50mg,0.215mmol)起始。
使用与ER-879713相似的方法获得ER-886360(14.3mg,0.035mmol,15.8%%收率,R=CH(Me)Ph),其中以73(50.2mg,0.218mmol,R=CH(Me)Ph)和3(50mg,0.215mmol)起始。
取代的化合物15的其它实例:
ER-888603:向37(58.1mg,0.227mmol)和环己基乙炔(0.026mL,0.200mmol)在叔丁醇(0.08mL)和水(0.07mL)中的经搅拌的溶液添加碳酸氢钠(2.5mg,0.030mmol),然后添加硫酸铜(II)五水合物(2.5mg,0.010mmol)和抗坏血酸钠(7.8mg,0.039mmol)。将反应混合物在室温下搅拌14h,此后添加DCM(5mL)以及饱和碳酸氢钠(5mL),并且再搅拌10min。分离各层并且将水层用DCM(每次3mL)萃取两次。将合并的有机层经无水MgSO4干燥,过滤并且浓缩至干燥。将粗制的Boc保护的中间体在搅拌下溶于DCM(3mL),然后将TFA(0.8mL)溶于其中。将反应在室温下搅拌1h,此后将完成的反应物进行浓缩并且使用甲苯(2次,每次5mL)共沸至干燥。将粗产物经由HPLC(Water’s X-Bridge C18 19x 100mm柱;用包含0.05%TFA的乙腈水溶液的梯度洗脱)纯化,以得到(2R,6R)-2-((4-环己基-1H-1,2,3-三唑-1-基)甲基)-6-甲基吗啉(8.9mg,0.034mmol,16.8%收率)。
向(2R,6R)-2-((4-环己基-1H-1,2,3-三唑-1-基)甲基)-6-甲基吗啉(8.9mg,0.034mmol)在DMA(0.3mL)和TEA(0.005mL,0.036mmol)中的经搅拌的溶液添加3(7.85mg,0.034mmol)。将混合物在150℃下微波处理30min,此后将冷却的反应物直接注入制备型C-18反相HPLC柱(Water's X-Bridge C18 19x 100mm柱;用包含0.05%TFA的10%-40%乙腈水溶液的梯度洗脱)。将所需收集的部分在真空中浓缩并且干燥,以得到ER-888603(3.3mg,0.008mmol,23.3%收率或3.9%总收率)。
以与ER-888603相似的方式制备ER-888604(5.2mg,0.013mmol,6.5%总收率),其中以37(58.1mg,0.227mmol)、苯乙炔(0.022mL,0.200mmol)和3(7.85mg,0.034mmol)起始。
ER-889556:向ER-887268(140.3mg,0.384mmol)在水(1.5mL)中的经搅拌的悬浮液添加甲醛(1mL)和甲酸(0.55mL),此后将反应混合物在110℃下微波处理1.5h。将完成的反应物进行冷却并且直接注入制备型C-18反相HPLC柱,其中用包含0.1%TFA的10%-40%乙腈水溶液的梯度洗脱。将所需收集的部分进行浓缩,溶于MeOH(5ml),经过SiCO3塞,用MeOH(10mL)洗脱,在真空中浓缩并且干燥以得到ER-889556(75mg,0.197mmol,51.5%收率)。
以与ER-889556相似的方式制备ER-890114(75.9mg,0.170mmol,40.5%收率),其中以ER-890112(182mg,0.420mmol)起始。
以与ER-889556相似的方式制备ER-890108(72.1mg,0.171mmol,40.7%收率),其中以ER-890119(170.6mg,0.420mmol)起始。
以与ER-889556相似的方式制备ER-890345(43.5mg,0.115mmol,38%收率),其中以ER-890344(110.2mg,0.302mmol)起始。
以与ER-889556相似的方式制备ER-890346(52.6mg,0.139mmol,73.3%收率),其中以ER-887269(69mg,0.189mmol)起始。
以与ER-889556相似的方式制备ER-890831(85.2mg,0.225mmol,74.5%收率),其中以ER-887270(110.2mg,0.302mmol)起始。
以与ER-889556相似的方式制备ER-890964(506.2mg,1.286mmol,71.2%收率),其中以ER-890963(685.2mg,1.806mmol)起始。
以与ER-889556相似的方式制备ER-890186(10.2mg,0.023mmol,20.7%收率),其中以ER-890107(48mg,0.111mmol)起始。
以与ER-889556相似的方式制备ER-890223(35mg,0.078mmol,42.9%收率),其中以作为TFA盐的ER-890106(100mg,0.182mmol)起始。
以与ER-889556相似的方式制备ER-894656(31.7mg,0.068mmol,61.5%收率),其中以作为二盐酸盐的ER-894655(50mg,0.111mmol)起始。
ER-889728:向ER-888070(12.5mg,0.034mmol)在DCM(0.5mL)中的经搅拌的溶液添加TEA(0.01mL,0.072mmol),然后添加烟酰氯(10mg,0.071mmol)。将反应混合物在室温下搅拌1h,此后用DCM(5mL)稀释反应物,用水(2mL)、盐水(2mL)洗涤,经MgSO4干燥,过滤并且浓缩至干燥。将粗产物经制备型C-18反相HPLC柱纯化,其中用包含0.1%TFA的10%-25%乙腈水溶液的梯度洗脱。将所需收集的部分进行浓缩,溶于MeOH(5ml),经过SiCO3塞,用MeOH(10mL)洗脱,在真空中浓缩并且干燥以得到ER-889728(7.2mg,0.015mmol,45%收率)。
以与ER-889728相似的方式制备ER-889729(8.2mg,0.017mmol,51.3%收率),其中以ER-888070(12.5mg,0.034mmol)和异烟酰氯(10mg,0.071mmol)起始。
以与ER-889728相似的方式制备ER-889734(8.6mg,0.018mmol,52.9%收率),其中以ER-888070(12.5mg,0.034mmol)和皮考啉酰氯(10mg,0.071mmol)起始。
以与ER-889728相似的方式制备ER-889744(12mg,0.028mmol,80.8%收率),其中以ER-888070(12.5mg,0.034mmol)和己酰氯(9mg,0.067mmol)起始。
以与ER-889728相似的方式制备ER-889745(8mg,0.018mmol,54%收率),其中以ER-888070(12.5mg,0.034mmol)和异丁酰氯(7mg,0.066mmol)起始。
以与ER-889728相似的方式制备ER-889746(7.6mg,0.017mmol,50%收率),其中以ER-888070(12.5mg,0.034mmol)和2,2-二甲基丙酰氯(8mg,0.066mmol)起始。
以与ER-889728相似的方式制备ER-890113(25.6mg,0.054mmol,66.7%收率),其中以ER-890112(35.2mg,0.081mmol)和乙酸酐(0.093mL,0.984mmol)起始。
以与ER-889728相似的方式制备ER-890120(20.3mg,0.045mmol,54.2%收率),其中以ER-890119(33.7mg,0.083mmol)和乙酸酐(0.012mL,0.127mmol)起始。
以与ER-889728相似的方式制备ER-890122(35.2mg,0.069mmol,43.1%收率),其中以ER-890119(65.2mg,0.160mmol)和苯甲酰氯(0.037mL,0.318mmol)起始。
以与ER-889728相似的方式制备ER-890142(45.2mg,0.084mmol,53.1%收率),其中以ER-890112(68.5mg,0.158mmol)和苯甲酰氯(0.037mL,0.318mmol)起始。
以与ER-889728相似的方式制备ER-890187(9.4mg,0.020mmol,18.0%收率),其中以ER-890107(48mg,0.111mmol)和乙酸酐(0.125mL,1.3mmol)起始。
以与ER-889728相似的方式制备ER-890188(8.9mg,0.018mmol,16.0%收率),其中以ER-890107(48mg,0.111mmol)和异丁酰氯(0.051mg,0.487mmol)起始。
以与ER-889728相似的方式制备ER-890189(10mg,0.019mmol,16.7%收率),其中以ER-890107(48mg,0.111mmol)和苯甲酰氯(0.056mg,0.482mmol)起始。
以与ER-889728相似的方式制备ER-890190(6.5mg,0.014mmol,36.8%收率),其中以ER-890119(15.6mg,0.038mmol)和异丁酰氯(0.006mL,0.058mmol)起始。
以与ER-889728相似的方式制备ER-890219(32.0mg,0.067mmol,91.8%收率),其中以作为TFA盐的ER-890106(40.2mg,0.073mmol)、TEA(0.20mL,1.43mmol)和乙酸酐(0.10mL,1.06mmol)起始。
以与ER-890219相似的方式制备ER-890221(28.2mg,0.056mmol,76.7%收率),其中以作为TFA盐的ER-890106(40.2mg,0.073mmol)和异丁酰氯(0.080mL,0.764mmol)起始。
以与ER-890219相似的方式制备ER-890222(30.1mg,0.056mmol,76.7%收率),其中以作为TFA盐的ER-890106(40.5mg,0.074mmol)和苯甲酰氯(0.20mL,1.723mmol)起始。
以与ER-889728相似的方式制备ER-892254(24.2mg,0.0.52mmol,67.5%收率),其中以ER-892253(32.2mg,0.077mmol)和乙酸酐(0.015mL,0.151mmol)起始。将乙腈(0.5mL)添加至反应混合物。
以与ER-889728相似的方式制备ER-892256(25.2mg,0.052mmol,41.9%收率),其中以ER-890119(50.2mg,0.124mmol)和甲烷磺酰氯(0.011mL,0.142mmol)起始。
以与ER-889728相似的方式制备ER-893926(124.2mg,0.255mmol,51.7%收率),其中以ER-888070(180.2mg,0.493mmol)和1,3-二甲基-1H-吡唑-4-碳酰氯(93.8mg,0.592mmol)起始。
以与ER-889728相似的方式制备ER-893927(45.2mg,0.0.83mmol,57.8%收率),其中以ER-892253(60.5mg,0.144mmol)和1,3-二甲基-1H-吡唑-4-碳酰氯(27.4mg,0.173mmol)起始。
以与ER-889728相似的方式制备ER-893948(65.3mg,0.147mmol,29.9%收率),其中以ER-888070(180.2mg,0.493mmol)和甲烷磺酰氯(68mL,0.593mmol)起始。
以与ER-889728相似的方式制备ER-894149(67.2mg,0.133mmol,80.6%收率),其中以ER-888070(60.2mg,0.165mmol)和苯磺酰氯(0.023mL,0.180mmol)起始。
以与ER-889728相似的方式制备ER-894150(58.2mg,0.111mmol,69.9%收率),其中以ER-888070(58.2mg,0.159mmol)和4-氟苯磺酰氯(0.025mL,0.188mmol)起始。
以与ER-889728相似的方式制备ER-894152(36.2mg,0.095mmol,63.6%收率),其中以ER-894151(50.6mg,0.150mmol)和乙酸酐(0.014mL,0.135mmol)起始。
以与ER-889728相似的方式制备ER-894153(5.4mg,0.012mmol,7.4%收率),其中以ER-894151(52.2mg,0.155mmol)和4-氟苯甲酰氯(25mg,0.158mmol)起始。
以与ER-889728相似的方式制备ER-894154(38.5mg,0.093mmol,62.4%收率),其中以ER-894151(50.4mg,0.149mmol)和甲烷磺酰氯(0.012mL,0.146mmol)起始。
以与ER-889728相似的方式制备ER-894155(42.1mg,0.085mmol,57.1%收率),其中以ER-894151(50.3mg,0.149mmol)和4-氟苯磺酰氯(29mg,0.149mmol)起始。
以与ER-889728相似的方式制备ER-894159(20.4mg,0.041mmol,27.4%收率),其中以ER-894151(50.5mg,0.150mmol)和1,3-二甲基-1H-吡唑-4-磺酰氯(29mg,0.149mmol)起始。
以与ER-889728相似的方式制备ER-894160(47.2mg,0.0.90mmol,65.8%收率),其中以ER-888070(50.1mg,0.137mmol)和1,3-二甲基-1H-吡唑-4-磺酰氯(27mg,0.139mmol)起始。
以与ER-889728相似的方式制备ER-894206(11.3mg,0.029mmol,19%收率),其中以ER-894151(50.6mg,0.150mmol)和异丁酰氯(16mg,0.150mmol)起始。
以与ER-889728相似的方式制备ER-894594(215mg,0.487mmol,46.4%收率),其中以ER-894151(354mg,1.049mmol)和苯甲酸酐(407mL,1.81mmol)起始。使用乙腈(2mL)代替DCM。
ER-890252的制备:向来自方案9的36(2.0g,4.8mmol)在乙腈(15mL)中的经搅拌的溶液添加(R)-叔丁基吡咯烷-2-氨基甲酸酯(1.10g,5.9mmol),然后添加TEA(1.6mL,11.5mmol)。将反应在70℃下搅拌3h,此后将完成的反应物浓缩成粗制浆状物,用DCM(20mL)稀释,用水(5mL)洗涤,干燥,过滤并且浓缩至干燥。将粗产物经硅胶(BiotageSP4,40+M,以在1:1的EtOAc:DCM中5%MeOH至1:1的EtOAc:DCM中10%MeOH的梯度经过10个柱体积循环洗脱)纯化。将包含产物的部分进行合并,浓缩并且在真空下干燥以得到((R)-1-(((2S,6R)-4-(8-氰基喹啉-5-基)-6-甲基吗啉-2-基)甲基)吡咯烷-3-基)氨基甲酸叔丁酯(1.35g,3.0mmol,62%收率)。
向((R)-1-(((2S,6R)-4-(8-氰基喹啉-5-基)-6-甲基吗啉-2-基)甲基)吡咯烷-3-基)氨基甲酸叔丁酯(1.35g,3.0mmol)在DCM(10mL)中的经搅拌的溶液添加TFA(8.1mL)。将反应物在室温下搅拌,此后将其进行浓缩并且与甲苯(每次10mL)共沸三次至干燥,然后在真空下干燥以得到作为TFA盐的粗制5-((2S,6R)-2-(((R)-3-氨基吡咯烷-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈(1.39g,3.0mmol,100%收率)。
以与ER-890222相似的方式制备ER-890252(120.3mg,0.306mmol,71.2%收率),其中以作为TFA盐的5-((2S,6R)-2-(((R)-3-氨基吡咯烷-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈(200mg,0.430mmol)和乙酸酐(0.80mL,8.46mmol)起始。
以与ER-890122相似的方式制备ER-890253(146.5mg,0.348mmol,80.8%收率),其中以作为TFA盐的5-((2S,6R)-2-(((R)-3-氨基吡咯烷-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈(200mg,0.430mmol)和异丁酰氯(0.50mL,4.77mmol)起始。
以与ER-890122相似的方式制备ER-894544(103.6mg,0.227mmol,52.9%收率),其中以作为TFA盐的5-((2S,6R)-2-(((R)-3-氨基吡咯烷-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈(200mg,0.430mmol)和苯甲酰氯(0.50mL,4.31mmol)起始。
以与ER-890222相似的方式制备ER-894546(96.7mg,0.214mmol,49.8%收率),其中以作为TFA盐的5-((2S,6R)-2-(((R)-3-氨基吡咯烷-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈(200mg,0.430mmol)和乙酸酐(0.80mL,8.46mmol)起始。以与5-((2S,6R)-2-(((R)-3-氨基吡咯烷-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈相似的方式制备5-((2S,6R)-2-(((S)-3-氨基吡咯烷-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈,其中在制备ER-890252的以上所述第一步中使用(S)-叔丁基吡咯烷-2-基氨基甲酸酯作为原料。
以与ER-894546相似的方式制备ER-894547(120.8mg,0.287mmol,66.7%收率),其中以作为TFA盐的5-((2S,6R)-2-(((S)-3-氨基吡咯烷-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈(200mg,0.430mmol)和异丁酸酐(0.70mL,4.22mmol)起始。
以与ER-894546相似的方式制备ER-894548(110.4mg,0.242mmol,56.4%收率),其中以作为TFA盐的5-((2S,6R)-2-(((S)-3-氨基吡咯烷-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈(200mg,0.430mmol)和苯甲酸酐(0.50g,2.21mmol)起始。
以与ER-889556相似的方式制备ER-894545(32mg,0.084mmol,19.6%收率),其中以作为TFA盐的5-((2S,6R)-2-(((R)-3-氨基吡咯烷-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈(200mg,0.430mmol)起始。
以与ER-889556相似的方式制备ER-894549(103.8mg,0.274mmol,63.6%收率),其中以作为TFA盐的5-((2S,6R)-2-(((S)-3-氨基吡咯烷-1-基)甲基)-6-甲基吗啉代)喹啉-8-甲腈(200mg,0.430mmol)起始。
使用修改的方案7和方案4制备886355:向方案7中的(R)-1-氨基-3-(苄氧基)丙-2-醇、化合物22(8.0g,44.1mmol)在DMF(60mL)中的经搅拌的溶液添加(S)-2-氯丁酸(5.0g,40.8mmol),然后添加TEA(10.5g.103.8mmol)、DMAP(0.4g,3.3mmol)并且最后添加EDC(9.52g,49.7mmol)。将反应混合物在室温下搅拌5d,此后将完成的反应物浓缩成粗制浆状物。经硅胶(Biotage,用庚烷中的20%-100%EtOA的梯度洗脱)纯化,然后收集所需部分,在真空中浓缩并且干燥,以得到(S)-N-((R)-3-(苄氧基)-2-羟丙基)-2-氯丁酰胺(683.5mg,2.392mmol,5.9%收率)。
向氢化钠(203.1mg,5.1mmol,作为60%油状分散体)在冷却至0℃的THF(18mL)中的经搅拌的悬浮液在5min内逐滴添加THF(3.8mL)中的(S)-N-((R)-3-(苄氧基)-2-羟丙基)-2-氯丁酰胺(362.8mg,1.270mmol),此后将反应在0℃下搅拌30min,然后在室温下搅拌5h。将完成的反应通过缓慢添加IPA(1mL)来淬灭,然后添加H+形式的Dowex 50,直到观察到中性pH成为酸性pH。将最终的悬浮液进行过滤并且将固体用EtOAc冲洗两次。将合并的滤液进行浓缩并且将所得的粗产物经硅胶(Biotage,用1:1的EtOAc:庚烷洗脱)纯化。将所需部分合并,在真空中浓缩并干燥以得到(2R,6R)-6-((苄氧基)甲基)-2-乙基吗啉-3-酮(314mg,1.260mmol,99.2%收率)。
在室温下,向(2R,6R)-6-((苄氧基)甲基)-2-乙基吗啉-3-酮(362.2mg,1.453mmol)在THF(2mL)中的经搅拌的溶液在2min内逐滴添加THF中的1M氢化铝锂(2mL,2mmol)。将反应在室温下搅拌2.5h,此后将其冷却至0℃,然后逐滴添加水(0.6mL),然后添加1M氢氧化钠水溶液(0.04mL)。将淬灭的反应升温至室温,搅拌直到形成颗粒状固体并且经硅藻土545垫过滤,用EtOAc(5mL)、DCM(5mL)和乙醚(5mL)冲洗。将滤液进行浓缩并且将所得的粗产物经硅胶(Biotage,用DCM中的5%–10%MeOH的梯度洗脱)纯化,然后合并所需部分,在真空中浓缩并且干燥以得到(2R,6R)-2-((苄氧基)甲基)-6-乙基吗啉(50.2mg,0.213mmol,14.6%收率)。
向(2R,6R)-2-((苄氧基)甲基)-6-乙基吗啉(12.4mg,0.053mmol)和化合物3(10.2mg,0.044mmol)在DMA(2mL)中的经搅拌的溶液添加DIPEA(0.015mL,0.086mmol),然后在150℃下微波处理7h。将冷却的完成的反应直接注入C-18反相HPLC(Water’s X-Bridge C18,19x100mm柱,用具有0.1%甲酸的10%–90%乙腈水溶液的线性梯度洗脱),并且浓缩所需的峰,然后在高真空下干燥以得到ER-886355(6.2mg 0.016mmol,36.4%收率)。
ER-887199的制备:将(2R,6R)-2-((苄氧基)甲基)-6-乙基吗啉(552.2mg,2.347mmol)在MeOH(10mL)中的经搅拌的溶液使用H-Qube氢化仪器用H2气体在1个大气压下经10%Pd(OH)2柱循环16h。将完成的反应溶液进行浓缩并且在真空中干燥以得到粗产物((2R,6R)-6-乙基吗啉-2-基)甲醇(320mg,2.204mmol,93.9%收率),其未经进一步纯化用于下一步。
将1-甲基吡咯烷-2-酮(2ml)中的((2R,6R)-6-乙基吗啉-2-基)甲醇(145.2mg,1.00mmol)和化合物3(266.4mg,1.143mmol)在180℃下微波处理15分钟,此后将其冷却至室温并且直接注入C-18反相HPLC(Water’s X-Bridge C18,19x 100mm柱,用具有0.1%甲酸的10%–90%乙腈水溶液的线性梯度洗脱),并且浓缩所需的峰,然后在高真空下干燥以得到ER-887199(92.3mg 0.313mmol,31.3%收率)。
使用方案11和方案19制备实例ER-899742
方案19
ER-895194或38:在0-5℃下向13(231.0g,815.3mmol)在DCM(3.93L)中的经搅拌的溶液添加二乙酸碘苯(525g,1630.6mmol),同时将温度维持在<5℃。添加TEMPO(25.4g,162.8mmol),然后添加水(151mL),此后将所得的反应混合物升温至10℃,搅拌30分钟,然后使其升温至室温并且搅拌15h。将完成的反应物冷却至<15℃,并且通过缓慢添加1.34L 10%(w/v)硫代硫酸钠水溶液来淬灭,同时将反应温度维持≤15℃,然后在室温下再搅拌45min。通过缓慢添加1M氢氧化钠水溶液将淬灭的反应的pH调节至pH 9,同时将温度维持在≤25℃。分离搅拌的各层并且用水(560mL)洗涤有机层。将1-丁醇(2.31L)添加至合并的水层,此后将混合物冷却至10-15℃,然后缓慢添加5M硫酸(231mL),将温度维持在≤25℃以获得约pH 5。将所得的层进行分离并且将水层用1-丁醇(2.31L)萃取3次,同时将水层的pH在萃取之间维持为约pH 5。将合并的水层进行浓缩,同时升温至50-55℃,此后将所得的黄色固体浆料经过与正庚烷(每次693mL)共沸三次浓缩至1.5L的体积,然后添加DCM(2.31L)。将黄色固体悬浮液在室温下搅拌1h,然后过滤,将滤垫用DCM(462mL)洗涤两次。将收集的黄色滤饼在40℃下于真空中干燥过夜,然后悬浮于甲苯(1.16L)中,并且在45℃下于真空中浓缩至完全干燥以得到呈黄色固体状的38或ER-895194(187g,629mmol,77%收率)。
向38(300mg,1.01mmol)在DCM(2mL)中的经搅拌的溶液添加(3S,4R)-叔丁基3-氨基-4-氟吡咯烷-1-甲酸酯和(3R,4S)-叔丁基3-氨基-4-氟吡咯烷-1-甲酸酯77(205.3mg,1.005mmol)、HBTU(247mg,1.211mmol)和DIEA(0.70mL,4.04mmol),然后在室温下搅拌16h。发现其已完成并且浓缩至干燥,然后溶于EtOAc(20mL),用水(10mL)、2N柠檬酸水溶液(10mL)、饱和NaHCO3(10mL)和盐水(10mL)洗涤1次。将合并的水层用EtOAc(每次10mL)萃取3次,此后经MgSO4干燥合并的有机部分,过滤并且浓缩至干燥。将粗产物经25g Biotage硅胶柱纯化,其用DCM(总200mL)中的0%-10%MeOH洗脱,以得到78和79的非对映体混合物。
使用适当大小的手性技术的5μM Chiralpak IA柱分离78和79,其中用庚烷:EtOH:MeOH:DEA(70:15:15:0.1)溶剂系统进行洗脱。在浓缩以及经真空清扫产生干燥固体后获得:作为第一洗脱部分的72(95mg,0.196mmol,19.5%收率);以及作为第二洗脱部分的73(75mg,0.155mmol,15.4%收率)。
将78(95mg,0.196mmol)在搅拌下溶于二噁烷(17μL),然后在室温下,在3分钟内逐滴添加二噁烷中的4N HCl(0.49mL 1.97mmol,10当量)。将反应再搅拌4h,此后将完成的反应物进行浓缩并且使用甲苯(每次10mL)共沸3次至干燥,然后进行高真空干燥以获得作为HCl盐的ER-899742-HCl(69mg,0.164mmol,84%收率),其不需要进一步纯化。
ER-899742的绝对立体化学的间接测定
方案20
使用间接方法测定ER-899742的绝对立体化学,其中使用Tsuzuki等人在Tetrahedron Asymmetry 2001,12,2989l中所述的经确认的手性原料,以得到方案20中的手性化合物81。
向(3S,4S)-叔丁基3-(苄基氨基)-4-羟基吡咯烷-1-甲酸酯80(3.091g,10.57mmol)和咪唑(3.60g,52.9mmol)在DCM(185ml)中的经搅拌的溶液添加三乙胺(4.42ml,31.7mmol)。将所得的混合物冷却至1-2℃,然后在30min内逐滴添加亚硫酰氯(1.16ml,15.9mmol)在DCM(46ml)中的溶液。将混合物在1-2℃下搅拌6h,升温至室温并且搅拌过夜,此后用水(46mL)淬灭反应。将有机层进行分离、浓缩以产生呈白色固体/泡沫状的粗产物,将所述粗产物进行硅胶柱色谱法(正庚烷/EtOAc2:1)以产生呈白色固体状的(3S,6S)-叔丁基3-苄基四氢吡咯并[3,4-d][1,2,3]氧杂噻唑-5(3H)-甲酸酯2-氧化物(2.10g,6.21mmol,58.7%收率)。
向(3S,6S)-叔丁基3-苄基四氢吡咯并[3,4-d][1,2,3]氧杂噻唑-5(3H)-甲酸酯2-氧化物(2.10g,6.21mmol)在用冷却至2-3℃的乙腈(10ml)和水(10ml)稀释的1,2-二氯乙烷(10ml)中的经搅拌的溶液添加氯化钌(III)水合物(14mg),然后添加高碘酸钠(1.39g,6.50mmol)。将所得的混合物在2-3℃下搅拌1h,在1h内升温至17-18℃,并且在该温度下搅拌16h。添加20wt%Na2SO4(5g),然后添加EtOAc(30ml),此后将所得的混合物剧烈搅拌10min并且通过硅藻土垫(2g)过滤。分离有机层,用20wt%亚硫酸钠(5g)、20wt%NaCl(5g)洗涤,并且进行浓缩以产生浅紫色/灰色油状物。将粗制油状物经过硅胶塞(10g),用EtOAc(120ml)洗脱,并且浓缩至干燥以得到呈白色固体状的(3S,6S)-叔丁基3-苄基四氢吡咯并[3,4-d][1,2,3]氧杂噻唑-5(3H)-甲酸酯2,2-二氧化物(1.54g,4.35mmol,70.0%收率)。
将(3S,6S)-叔丁基3-苄基四氢吡咯并[3,4-d][1,2,3]氧杂噻唑-5(3H)-甲酸酯2,2-二氧化物(20mg,0.056mmol)溶于TBAF(在THF中的1M溶液,1.0ml)并且在回流下加热过夜,此后将反应冷却至室温并且用HCl(1M溶液,2ml)酸化。在2h后,将混合物用NaHCO3(9%水溶液,2.5g)中和并且用EtOAc(10ml)萃取。分离有机层,浓缩并且与额外的两批进行合并,其中每批使用100mg(每次0.282mmol)起始氧杂噻唑。将合并的粗产物经硅胶柱色谱法(正庚烷/EtOAc 1:1)纯化,以经由TLC(硅胶)得到呈浅棕色油状以及极性较小的(3S,4S)-叔丁基3-(苄基氨基)-4-氟吡咯烷-1-甲酸酯82(29mg,0.099mmol,15.9%收率)以及经由TLC(硅胶)得到呈浅棕色油状以及极性较大的(3S,4R)-叔丁基3-(苄基氨基)-4-氟吡咯烷-1-甲酸酯81(20mg,0.068mmol,11.0%收率)。
将(3S,4R)-叔丁基3-(苄基氨基)-4-氟吡咯烷-1-甲酸酯81(16mg,0.054mmol)用乙醇(3ml)中的10wt%Pd-C(10mg)进行氢解。将完成的反应混合物进行过滤,浓缩并且与CDCl3共沸以得到(3S,4R)-叔丁基3-氨基-4-氟吡咯烷-1-甲酸酯83(8.3mg,0.041mmol,75.9%收率)。
在40℃下,向(3S,4R)-叔丁基3-氨基-4-氟吡咯烷-1-甲酸酯和38或ER-895194(15mg,0.050mmol)在DMF(0.2ml)中的经搅拌的溶液添加丙基磷酸酐(0.2g,50%溶液于EtOAc中)持续2h。将反应混合物经过硅胶塞(3g,用1:3的庚烷-EtOAc洗脱),然后通过制备型TLC(正庚烷/EtOAc 1:4)进一步纯化,以产生呈黄色/绿色油状的相应的酰胺78(11.2mg,0.023mmol,56%收率,在两个步骤中)。1H-NMR和HPLC与如之前所述的化合物78相匹配,由此间接确认了ER-899742的绝对立体化学。
还通过X射线衍射确认了ER-899742的绝对立体化学。结晶过程:将5.3mg ER-899742-01(批号为MC2-1130-120-1)溶于0.5mL IPA和0.3mL H2O中。将包含溶液的小瓶封盖并且在室温下储存一天。第二天,打开盖子,并且在室温下缓慢蒸发IPA持续一天。第三天,盖上盖子并且将小瓶在室温下储存2周,此后出现ER-899742-01的无色针状晶体,从中选择单晶用于X射线分析。X射线衍射分析:设备:R-AXIS RAPID II(RIGAKU);X射线源:CuKa(l=1.54187A);温度:297K;测量:沿着ω轴的振动方法;晶体大小:0.1x 0.1x 0.4mm。用最终的R因子0.0606和Flack参数-0.01处理晶体结构。ER-899742-01的结构被确定为(2R,6R)-4-(8-氰基喹啉-5-基)-N-[(3S,4R)-4-氟吡咯烷-3-基]-6-甲基吗啉-2-甲酰胺盐酸盐。参见图8的ORTEP图。
将(3S,4S)-叔丁基3-(苄基氨基)-4-氟吡咯烷-1-甲酸酯82(24mg,0.082mmol)用乙醇(3ml)中的10wt%Pd-C(10mg)进行氢解。将反应混合物进行过滤,浓缩并且与CHCl3共沸至干燥以得到(3S,4S)-叔丁基3-氨基-4-氟吡咯烷-1-甲酸酯(16.6mg,0.081mmol,99.2%收率),其未经纯化用于下一步。
将(3S,4S)-叔丁基3-氨基-4-氟吡咯烷-1-甲酸酯(12.5mg,0.061mmol)和38或ER-895194(18mg,0.061mmol)在DMF(0.2ml)中的经搅拌的溶液用丙基磷酸酐(50%溶液于EtOAc中,0.2g)在40℃下处理2h。将反应混合物经过硅胶塞(3g,用1:3的庚烷-EtOAc洗脱),然后通过制备型TLC(正庚烷/EtOAc 1:4)进一步纯化,以得到呈黄色/绿色油状的(3S,4S)-叔丁基3-((2R,6R)-4-(8-氰基喹啉-5-基)-6-甲基吗啉-2-甲酰氨基)-4-氟吡咯烷-1-甲酸酯85(14.2mg,0.029mmol,47%收率,在2个步骤中)。
使用与ER-899742-HCl相同当量的试剂获得ER-899745-HCL(62.3mg,0.148mmol,96%收率),以化合物79(75mg,0.155mmol)起始。
以与ER-899742相似的方式制备ER-894550(5.3mg,0.016mmol,18.4%收率),其中以38(25.9mg,0.087mmol)和乙胺盐酸盐(206mg,.962mmol)起始。使用DMF(0.5mL)代替DCM。将ER-894550通过反相HPLC(X-Bridge C18 19x 100mm柱;用包含0.1%甲酸的渐增乙腈水溶液的梯度洗脱)纯化,然后合并所需部分,在真空中浓缩并且干燥。将产物部分进行合并以及浓缩至干燥,然后在MeOH(1mL)中稀释,经过碱性硅胶塞(Biotage SiCO3,1g,用MeOH(1mL)洗脱),在真空中浓缩并且干燥。
以与ER-899742相似的方式制备ER-895473(103mg,0.261mmol,27.1%收率),其中以38(286mg,0.962mmol)和(S)-叔丁基2-乙基哌嗪-1-甲酸酯(206mg,.962mmol)起始。使用DMF(3mL)替代DCM用于酰胺的形成反应,并且将乙醚中的2.0M HCl(1.3mL,2.6mmol)用于Boc去保护过程,使用乙腈(1mL)作为溶剂。将ER-895473通过反相HPLC(X-Bridge C18 19x 100mm柱;用包含0.1%甲酸的渐增乙腈水溶液的梯度洗脱)纯化。将产物部分进行合并以及浓缩至干燥,然后在MeOH(1mL)中稀释,经过碱性硅胶塞(Biotage SiCO3,1g,用MeOH(1mL)洗脱),在真空中浓缩并且干燥。
以与ER-899742相似的方式制备ER-895474(6.3mg,0.015mmol,19.6%收率),其中以38(22.5mg,0.076mmol)和(3,4-二氟苯基)甲胺(10.83mg,.076mmol)起始。不需要进行Boc去保护。
以与ER-895473相似的方式制备ER-895475(16.2mg,0.044mmol,71.5%收率),其中以38(18.3mg,0.062mmol)和(R)-叔丁基吡咯烷-3-基氨基甲酸酯(11.46mg,.062mmol)起始。
以与ER-895474相似的方式制备ER-895476(14.0mg,0.042mmol,28.8%收率),其中以38(43.0mg,0.145mmol)和氮杂环丁烷盐酸盐(13.53mg,.145mmol)起始。
以与ER-895474相似的方式制备ER-895477(26.1mg,0.058mmol,32.1%收率),其中以38(54.0mg,0.182mmol)和1,4’-联哌啶(30.6mg,.182mmol)起始。
以与ER-895474相似的方式制备ER-895478(15.9mg,0.047mmol,29.0%收率),其中以38(48.4mg,0.163mmol)和环丙胺(11.42μl,.163mmol)起始。
以与ER-895473相似的方式制备ER-895479(14.9mg,0.042mmol,23.7%收率),其中以38(53.2mg,0.179mmol)和氮杂环丁烷-3-基氨基甲酸叔丁酯(30.8mg,.179mmol)起始。
以与ER-895474相似的方式制备ER-897922(15.1mg,0.041mmol,48.7%收率),其中以38(25mg,0.084mmol)和1-氨基丁-2-醇(13.0mg,0.146mmol)起始。
以与ER-895474相似的方式制备ER-897923(13.9mg,0.038mmol,44.9%收率),其中以38(25mg,0.084mmol)和2-乙氧基乙胺(13.0mg,0.146mmol)起始。
以与ER-895474相似的方式制备ER-897924(17.0mg,0.046mmol,54.9%收率),其中以38(25mg,0.084mmol)和(R)-2-氨基丁-1-醇(14.0mg,0.157mmol)起始。
以与ER-895474相似的方式制备ER-897925(4.5mg,0.012mmol,14.5%收率),其中以38(25mg,0.084mmol)和2-氨基丙烷-1,3-二醇(14.0mg,0.154mmol)起始。
以与ER-895474相似的方式制备ER-897926(7.6mg,0.021mmol,24.4%收率),其中以38(25mg,0.084mmol)和3-氨基丙烷-1,2-二醇(15.0mg,0.165mmol)起始。
以与ER-895474相似的方式制备ER-897927(15.0mg,0.039mmol,46.9%收率),其中以38(25mg,0.084mmol)和(R)-(四氢呋喃-2-基)甲胺(15.0mg,0.148mmol)起始。
以与ER-895474相似的方式制备ER-897928(14.9mg,0.039mmol,46.6%收率),其中以38(25mg,0.084mmol)和(四氢呋喃-2-基)甲胺(16.0mg,0.158mmol)起始。
以与ER-895474相似的方式制备ER-897929(10.3mg,0.027mmol,32.0%收率),其中以38(25mg,0.084mmol)和2-丙氧基乙胺(16.0mg,0.155mmol)起始。
以与ER-895474相似的方式制备ER-897930(12.8mg,0.033mmol,39.8%收率),其中以38(25mg,0.084mmol)和(R)-2-氨基戊-1-醇(16.0mg,0.155mmol)起始。
以与ER-895474相似的方式制备ER-897931(11.1mg,0.029mmol,34.5%收率),其中以38(25mg,0.084mmol)和2-异丙氧基乙胺(15.0mg,0.145mmol)起始。
以与ER-895474相似的方式制备ER-897932(10.0mg,0.026mmol,31.1%收率),其中以38(25mg,0.084mmol)和1-甲氧基丁-2-胺(0.0160g,0.155mmol)起始。
以与ER-895474相似的方式制备ER-897933(9.0mg,0.021mmol,24.6%收率),其中以38(25mg,0.084mmol)和2-氨基-1-(2-氟苯基)乙醇(23.0mg,0.148mmol)起始。
以与ER-895474相似的方式制备ER-897934(13.3mg,0.035mmol,41.1%收率),其中以38(25mg,0.084mmol)和(S)-2-氨基-3-甲基丁-1-醇(15.0mg,0.145mmol)起始。
以与ER-895474相似的方式制备ER-897935(15.7mg,0.041mmol,48.6%收率),其中以38(25mg,0.084mmol)和2,2-二甲氧基乙胺(15.0mg,0.143mmol)起始。
以与ER-895474相似的方式制备ER-897936(10.4mg,0.027mmol,32.2%收率),其中以38(25mg,0.084mmol)和2-(2-氨基乙氧基)乙醇(16.0mg,0.152mmol)起始。
以与ER-895474相似的方式制备ER-897937(12.1mg,0.031mmol,36.5%收率),其中以38(25mg,0.084mmol)和(1S,2S)-2-氨基环己醇(23.0mg,0.200mmol)起始。
以与ER-895474相似的方式制备ER-897938(8.5mg,0.022mmol,25.6%收率),其中以38(25mg,0.084mmol)和2-氨基环己醇(17.0mg,0.148mmol)起始。
以与ER-895474相似的方式制备ER-897939(10.1mg,0.025mmol,30.3%收率),其中以38(25mg,0.084mmol)和2-氨基己-1-醇(18.3mg,0.156mmol)起始。
以与ER-895474相似的方式制备ER-897940(10.3mg,0.026mmol,30.9%收率),其中以38(25mg,0.084mmol)和(S)-2-氨基-3,3-二甲基丁-1-醇(19.0mg,0.162mmol)起始。
以与ER-895474相似的方式制备ER-897941(14.0mg,0.035mmol,42.0%收率),其中以38(25mg,0.084mmol)和(S)-2-氨基己-1-醇(19.0mg,0.162mmol)起始。
以与ER-895474相似的方式制备ER-897942(9.9mg,0.025mmol,29.7%收率),其中以38(25mg,0.084mmol)和(2S,3S)-2-氨基-3-甲基戊-1-醇(18.0mg,0.154mmol)起始。
以与ER-895474相似的方式制备ER-897943(11.1mg,0.028mmol,33.3%收率),其中以38(25mg,0.084mmol)和(S)-2-氨基-4-甲基戊-1-醇(18.0mg,0.154mmol)起始。
以与ER-895474相似的方式制备ER-897944(10.9mg,0.027mmol,32.7%收率),其中以38(25mg,0.084mmol)和(R)-2-氨基-4-甲基戊-1-醇(18.0mg,0.154mmol)起始。
以与ER-895474相似的方式制备ER-897945(13.2mg,0.032mmol,38.3%收率),其中以38(25mg,0.084mmol)和(4-甲基吗啉-2-基)甲胺(20.0mg,0.154mmol)起始。
以与ER-895474相似的方式制备ER-897946(16.1mg,0.035mmol,42.0%收率),其中以38(25mg,0.084mmol)和(S)-2-氨基-4-(甲硫基)丁-1-醇(20.0mg,0.148mmol)起始。
以与ER-895474相似的方式制备ER-897947(12.0mg,0.029mmol,34.3%收率),其中以38(25mg,0.084mmol)和2-苯氧基乙胺(21.0mg,0.153mmol)起始。
以与ER-895474相似的方式制备ER-897948(12.0mg,0.028mmol,33.1%收率),其中以38(25mg,0.084mmol)和(S)-2-氨基-3-苯基丙-1-醇(24.0mg,0.159mmol)起始。
以与ER-895474相似的方式制备ER-897949(11.7mg,0.027mmol,32.3%收率),其中以38(25mg,0.084mmol)和2-苯氧基丙-1-胺(29.0mg,0.192mmol)起始。
以与ER-895474相似的方式制备ER-897950(11.7mg,0.027mmol,32.3%收率),其中以38(25mg,0.084mmol)和1-氨基-3-苯基丙-2-醇(23.0mg,0.152mmol)起始。
以与ER-895474相似的方式制备ER-897952(14.0mg,0.032mmol,38.6%收率),其中以38(25mg,0.084mmol)和2-(吡啶-3-基氧基)丙-1-胺(24.0mg,0.158mmol)起始。
以与ER-895474相似的方式制备ER-897955(8.2mg,0.019mmol,22.5%收率),其中以38(25mg,0.084mmol)和2-(4-氟苯氧基)乙胺(23.0mg,0.148mmol)起始。
以与ER-895474相似的方式制备ER-897956(11.2mg,0.026mmol,26%收率),其中以38(25mg,0.084mmol)和2-氨基-1-(3-氟苯基)乙醇(24.0mg,0.155mmol)起始。
以与ER-895474相似的方式制备ER-897957(9.8mg,0.022mmol,26.7%收率),其中以38(25mg,0.084mmol)和(S)-2-氨基-3-环己基丙-1-醇(30.0mg,0.191mmol)起始。
以与ER-895474相似的方式制备ER-897958(13.6mg,0.031mmol,36.5%收率),其中以38(25mg,0.084mmol)和异色满-1-基甲胺(24.0mg,0.147mmol)起始。
以与ER-895474相似的方式制备ER-897960(13.0mg,0.029mmol,34.6%收率),其中以38(25mg,0.084mmol)和1-氨基-3-苯氧基丙-2-醇(25.0mg,0.150mmol)起始。
以与ER-895474相似的方式制备ER-897961(9.7mg,0.022mmol,25.8%收率),其中以38(25mg,0.084mmol)和4-((1S,2R)-2-氨基-1-羟丙基)苯酚(32.0mg,0.191mmol)起始。
以与ER-895474相似的方式制备ER-897962(17.8mg,0.040mmol,47.4%收率),其中以38(25mg,0.084mmol)和(1S,2S)-2-氨基-1-苯基丙烷-1,3-二醇(26.0mg,0.155mmol)起始。
以与ER-895473相似的方式制备ER-897963(3.1mg,0.007mmol,8.4%收率),其中以38(25mg,0.084mmol)和4-(3-氨基-2-羟丙基)哌嗪-1-甲酸叔丁酯(40.0mg,0.154mmol)起始。
以与ER-895473相似的方式制备ER-897964(12.7mg,0.036mmol,21.5%收率),其中以38(25mg,0.084mmol)和3-氨基氮杂环丁烷-1-甲酸叔丁酯(27.0mg,0.157mmol)起始。
以与ER-895473相似的方式制备ER-897965(0.4mg,0.001mmol,1.3%收率),其中以38(25mg,0.084mmol)和(S)-叔丁基3-氨基吡咯烷-1-甲酸酯(29.0mg,0.156mmol)起始。
以与ER-895473相似的方式制备ER-897966(0.4mg,0.001mmol,1.3%收率),其中以38(25mg,0.084mmol)和(R)-叔丁基3-氨基吡咯烷-1-甲酸酯(29.0mg,0.156mmol)起始。
以与ER-895473相似的方式制备ER-897967(0.3mg,0.001mmol,0.9%收率),其中以38(25mg,0.084mmol)和(S)-叔丁基3-氨基哌啶-1-甲酸酯(30.0mg,0.150mmol)起始。
以与ER-895473相似的方式制备ER-897968(0.4mg,0.001mmol,1.3%收率),其中以38(25mg,0.084mmol)和(R)-叔丁基3-氨基哌啶-1-甲酸酯(30.0mg,0.150mmol)起始。
以与ER-895473相似的方式制备ER-897969(0.2mg,0.001mmol,0.6%收率),其中以38(25mg,0.084mmol)和(S)-叔丁基2-(氨基甲基)吡咯烷-1-甲酸酯(30.0mg,0.150mmol)起始。
以与ER-895473相似的方式制备ER-897970(3.4mg,0.008mmol,9.4%收率),其中以38(25mg,0.084mmol)和(2-氨基乙基)(苄基)氨基甲酸叔丁酯(38.0mg,0.152mmol)起始。
以与ER-895473相似的方式制备ER-898560(11.2mg,0.030mmol,30.9%收率),其中以38(28.8mg,0.097mmol)和吡啶-2-胺(9.12mg,.097mmol)起始。
以与ER-895474相似的方式制备ER-898561(12.8mg,0.033mmol,44.6%收率),其中以38(22.1mg,0.074mmol)和6-甲基吡啶-2-胺(8.04mg,.074mmol)起始。
以与ER-895474相似的方式制备ER-898562(7.4mg,0.020mmol,18.7%收率),其中以38(31.2mg,0.105mmol)和5-甲基异噁唑-3-胺(10.30mg,.105mmol)起始。
以与ER-895474相似的方式制备ER-898563(6.5mg,0.017mmol,16.7%收率),其中以38(30.7mg,0.103mmol)和2,2,2-三氟乙胺盐酸盐(13.99mg,.103mmol)起始。
以与ER-895474相似的方式制备ER-898564(1.4mg,0.004mmol,3.8%收率),其中以38(30mg,0.101mmol)和2,2-二氟乙胺(8.18mg,.101mmol)起始。
以与ER-895474相似的方式制备ER-898565(3.0mg,0.008mmol,7.5%收率),其中以38(30.2mg,0.102mmol)和3,3,3-二氟丙-1-胺(11.49mg,.102mmol)起始。
以与ER-895474相似的方式制备ER-898566(14.6mg,0.037mmol,20.4%收率),其中以38(53.7mg,0.181mmol)和N2,N2,2-三甲基丙烷-1,2-二胺(20.99mg,.181mmol)起始。
以与ER-895474相似的方式制备ER-898914(31.6mg,0.092mmol,28.8%收率),其中以38(95.2mg,0.320mmol)和2-氟乙胺盐酸盐(31.9mg,.32mmol)起始。
以与ER-895474相似的方式制备ER-898915(19.1mg,0.054mmol,19.3%收率),其中以38(82.3mg,0.277mmol)和3-氟丙-1-胺盐酸盐(31.4mg,.277mmol)起始。
以与ER-895474相似的方式制备ER-898916(14.6mg,0.037mmol,21.5%收率),其中以38(51.4mg,0.173mmol)和(R)-1,1,1-三氟丙-2-胺(20mg,.177mmol)起始。
以与ER-895474相似的方式制备ER-898917(27.6mg,0.066mmol,20.4%收率),其中以38(95.7mg,0.322mmol)和(R)-1,1,1-三氟-3-甲基丁-2-胺(45.4mg,.322mmol)起始。
以与ER-895474相似的方式制备ER-898918(15.0mg,0.038mmol,19.3%收率),其中以38(59.2mg,0.199mmol)和1,3-二甲基-1H-吡唑-5-胺(22.13mg,.199mmol)起始。
以与ER-895474相似的方式制备ER-898919(13.1mg,0.035mmol,10.5%收率),其中以38(98.1mg,0.33mmol)和1-甲基-1H-吡唑-5-胺(32.0mg,.33mmol)起始。
以与ER-895474相似的方式制备ER-898920(20.1mg,0.060mmol,21.4%收率),其中以38(83.3mg,0.280mmol)和2-氨基乙腈盐酸盐(25.9mg,.28mmol)起始。
以与ER-895474相似的方式制备ER-898921(11.4mg,0.032mmol,12.8%收率),其中以38(73.1mg,0.246mmol)和环丙烷甲腈盐酸盐(25.5mg,.246mmol)起始。
以与ER-895474相似的方式制备ER-898922(25.4mg,0.067mmol,33.7%收率),其中以38(59.0mg,0.198mmol)和1,2,4-噻二唑-5-胺(20.07mg,.198mmol)起始。
以与ER-895474相似的方式制备ER-898923(12.6mg,0.032mmol,16.5%收率),其中以38(57.6mg,0.194mmol)和3-甲基-1,2,4-噻二唑-5-胺(22.31mg,.194mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899017-HCl(328mg,0.769mmol,65.3%收率),其中以38(350mg,1.177mmol)和2,6-二氮杂螺[3.4]辛烷-6-甲酸叔丁酯(250mg,1.177mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899019-HCl(26mg,0.059mmol,58.2%收率),其中以38(30mg,0.101mmol)和4-(氨基甲基)-4-氟哌啶-1-甲酸叔丁酯(23.4mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899020-HCl(25mg,0.062mmol,61.4%收率),其中以38(30mg,0.101mmol)、3-(氨基甲基)氮杂环丁烷-1-甲酸叔丁酯(18.8mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899023-HCl(25.5mg,0.060mmol,59.4%收率),其中以38(30mg,0.101mmol)和1,6-二氮杂螺[3.4]辛烷-6-甲酸叔丁酯(21.4mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899024-HCl(30.1mg,0.068mmol,67.5%收率),其中以38(30mg,0.101mmol)和1,7-二氮杂螺[4.4]壬烷-1-甲酸叔丁酯(22.8mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899025-HCl(32.1mg,0.077mmol,76%收率),其中以38(30mg,0.101mmol)和4-氨基-1-甲基-1H-吡唑-3-甲酰胺(14.1mg,.101mmol)起始。不需要进行Boc去保护。
以与ER-899742-HCl相似的方式制备ER-899031-HCl(30.1mg,0.079mmol,78%收率),其中以38(30mg,0.101mmol)和(3-甲基氧杂环丁烷-3-基)甲胺(10.2mg,.101mmol)起始。不需要进行Boc去保护。
以与ER-899742-HCl相似的方式制备ER-899032-HCl(28.7mg,0.079mmol,78%收率),其中以38(30mg,0.101mmol)和2-氧代-6-氮杂螺[3.3]庚烷(10.0mg,.101mmol)起始。不需要进行Boc去保护。
以与ER-899742-HCl相似的方式制备ER-899033-HCl(32.8mg,0.093mmol,92%收率),其中以38(30mg,0.101mmol)和氧杂环丁烷-3-胺(7.4mg,.101mmol)起始。不需要进行Boc去保护。
以与ER-899742-HCl相似的方式制备ER-899034-HCl(26.4mg,0.067mmol,66.2%收率),其中以38(30mg,0.101mmol)和氧杂环丁烷-3,3-二基二甲胺二盐酸盐(19.1mg,.101mmol)起始。不需要进行Boc去保护。
以与ER-899742-HCl相似的方式制备ER-899035-HCl(25.9mg,0.071mmol,70.1%收率),其中以38(30mg,0.101mmol)和氧杂环丁烷-2-基甲胺(8.8mg,.101mmol)起始。不需要进行Boc去保护。
以与ER-899742-HCl相似的方式制备ER-899036-HCl(33.1mg,0.082mmol,82%收率),其中以38(30mg,0.101mmol)和哌嗪-1-甲酸叔丁酯(18.8mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899191-HCl(30.7mg,0.081mmol,80%收率),其中以38(30mg,0.101mmol)和氮杂环丁烷-3-甲酰胺(10.1mg,.101mmol)起始。不需要进行Boc去保护。
以与ER-899742-HCl相似的方式制备ER-899192-HCl(34.4mg,0.078mmol,77%收率),其中以38(30mg,0.101mmol)和2,7-二氮杂螺[4.4]壬烷-2-甲酸叔丁酯(22.8mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899193-HCl(38.1mg,0.081mmol,80%收率),其中以38(30mg,0.101mmol)和3,9-二氮杂螺[5.5]十一烷-3-甲酸叔丁酯(25.7mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899196-HCl(23.7mg,0.057mmol,56.4%收率),其中以38(30mg,0.101mmol)和4-氨基烟酰胺(13.84mg,.101mmol)起始。不需要进行Boc去保护。
以与ER-899742-HCl相似的方式制备ER-899282-HCl(29.6mg,0.079mmol,79%收率),其中以38(30mg,0.101mmol)和吡啶-4-胺(9.5mg,.101mmol)起始。不需要进行Boc去保护。
以与ER-899742-HCl相似的方式制备ER-899283-HCl(31.1mg,0.083mmol,83%收率),其中以38(30mg,0.101mmol)和吡啶-3-胺(9.5mg,.101mmol)起始。不需要进行Boc去保护。
以与ER-899742-HCl相似的方式制备ER-899285-HCl(28.5mg,0.059mmol,58.6%收率),其中以38(30mg,0.101mmol)和4-(4-氨基-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯(26.9mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899286-HCl(31.7mg,0.070mmol,69.2%收率),其中以38(30mg,0.101mmol)和3-(4-氨基-1H-吡唑-1-基)氮杂环丁烷-1-甲酸叔丁酯(24.0mg,.101mmol)起始。
以与ER-895474相似的方式制备ER-899287(29.7mg,0.079mmol,78%收率),其中以38(30mg,0.101mmol)和(1H-吡唑-5-基)甲胺(9.80mg,.101mmol)起始。
以与ER-895474相似的方式制备ER-899288(20.7mg,0.057mmol,56.6%收率),其中以38(30mg,0.101mmol)和1H-吡唑-4-胺(8.38mg,.101mmol)起始。
以与ER-895474相似的方式制备ER-899289(35.5mg,0.078mmol,77%收率),其中以38(30mg,0.101mmol)和(3-(三氟甲基)吡啶-2-基)甲胺(17.77mg,.101mmol)起始。
以与ER-895474相似的方式制备ER-899290(15.0mg,0.034mmol,33.9%收率),其中以38(30mg,0.101mmol)和1-(吡啶-2-基)乙胺(12.33mg,.101mmol)起始。
以与ER-895474相似的方式制备ER-899291(26.1mg,0.067mmol,66.7%收率),其中以38(30mg,0.101mmol)和吡啶-2-基甲胺(10.91mg,.101mmol)起始。
以与ER-895474相似的方式制备ER-899292(31.0mg,0.077.2mmol,76.4%收率),其中以38(30mg,0.101mmol)和(6-甲基吡啶-2-基)甲胺(12.3mg,.101mmol)起始。
以与ER-895474相似的方式制备ER-899293(32.0mg,0.079mmol,77.7%收率),其中以38(30mg,0.101mmol)和(1-甲基哌啶-2-基)甲胺(12.9mg,.101mmol)起始。
以与ER-895474相似的方式制备ER-899294(32.2mg,0.080mmol,79%收率),其中以38(30mg,0.101mmol)和(3-甲基吡啶-2-基)甲胺(12.3mg,.101mmol)起始。
以与ER-895473相似的方式制备ER-899334(51.3mg,0.140mmol,11.7%收率),其中以38(357.2mg,1.201mmol)和(R)-叔丁基2-(氨基甲基)吡咯烷-1-甲酸酯(224mg,1.201mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899414-HCl(31.1mg,0.075mmol,74.1%收率),其中以38(30mg,0.101mmol)和(R)-叔丁基2-(氨基甲基)吡咯烷-1-甲酸酯(20.2mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899415-HCl(30.5mg,0.071mmol,70.3%收率),其中以38(30mg,0.101mmol)和(S)-叔丁基2-(氨基甲基)哌啶-1-甲酸酯(21.6mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899416-HCl(24.2mg,0.055mmol,54.3%收率),其中以38(30mg,0.101mmol)和3-氨基-8-氮杂双环[3.2.1]辛烷-8-甲酸叔丁酯(22.84mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899417-HCl(32.8mg,0.076mmol,76%收率),其中以38(30mg,0.101mmol)和4-氨基氮杂环庚烷-1-甲酸叔丁酯(21.62mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899418-HCl(29.6mg,0.072mmol,70.9%收率),其中以38(30mg,0.101mmol)和(1R,5S,6S)-叔丁基6-氨基-3-氮杂双环[3.1.0]己烷-3-甲酸酯(20.0mg,.101mmol)起始。
以与ER-899742-HCl相似的方式制备ER-899476-HCl(31.0mg,0.068mmol,67.4%收率)或ER-899742和ER-899745的非对映体混合物,其中以38(30mg,0.101mmol)以及(3R,4S)-叔丁基3-氨基-4-氟吡咯烷-1-甲酸酯和(3S,4R)-叔丁基3-氨基-4-氟吡咯烷-1-甲酸酯(20.6mg,.101mmol)的1:1混合物起始。
以与ER-899742-HCl相似的方式制备作为非对映体混合物的ER-899477-HCl(25.5mg,0.059mmol,58.2%收率),其中以38(30mg,0.101mmol)以及(3R,4S)-叔丁基3-氨基-4-氟哌啶-1-甲酸酯和(3S,4R)-叔丁基3-氨基-4-氟哌啶-1-甲酸酯(22.02mg,.101mmol)的1:1混合物起始。
以与ER-899742-HCl相似的方式制备ER-899479-HCl(30.5mg,0.071mmol,70.6%收率),其中以38(30mg,0.101mmol)和6-氨基-2-氮杂螺[3.3]庚烷-2-甲酸叔丁酯(21.42mg,.101mmol)起始。
以与ER-895474相似的方式制备ER-897383(14.2mg,0.017mmol,14.1%收率),其中以38(35.2mg,0.118mmol)和2-氨基乙醇(10.9mg,0.178mmol)起始。使用DMF(1mL)代替DMAC。
以与ER-897383相似的方式制备ER-897385(14.2mg,0.017mmol,14.1%收率),其中以38(35mg,0.118mmol)和2-甲氧基乙胺(13.7mg,0.178mmol)起始。
以与ER-897383相似的方式制备ER-897445(87mg,0.245mmol,72.9%总收率),其中以38(100mg,0.336mmol)和(R)-2-((叔丁基二苯基甲硅烷基)氧基)丙-1-胺(158mg,0.505mmol)起始,然后使用DCM(1.1mL)中的含1M TBAF的THF(0.43mL,0.43mmol),在室温下搅拌1h去除叔丁基二苯基甲硅烷基保护的基团。将所需的产物经硅胶(用庚烷中的80%–100%EtOAc洗脱)纯化。
以与ER-897445相似的方式制备ER-897446(67mg,0.189mmol,75%总收率),其中以38(75mg,0.252mmol)和(S)-1-((叔丁基二苯基甲硅烷基)氧基)丙-2-胺(103mg,0.329mmol)起始。
以与ER-897445相似的方式制备ER-897447(78mg,0.220mmol,65.5%总收率),其中以38(100mg,0.336mmol)和(R)-1-((叔丁基二苯基甲硅烷基)氧基)丙-2-胺(158mg,0.505mmol)起始。
以与ER-897445相似的方式制备ER-897827(48.2mg,0.131mmol,64.9%总收率),其中以38(60mg,0.202mmol)和(S)-1-((叔丁基二苯基甲硅烷基)氧基)丁-2-胺(90mg,0.303mmol)起始。
以与ER-897445相似的方式制备ER-897828(49.4mg,0.129mmol,64%总收率),其中以38(60mg,0.202mmol)和(S)-1-((叔丁基二苯基甲硅烷基)氧基)-3-甲基丁-2-胺(103mg,0.303mmol)起始。
以与ER-897445相似的方式制备ER-897829(65.2mg,0.157mmol,77.7%总收率),其中以38(60mg,0.202mmol)和(S)-2-((叔丁基二苯基甲硅烷基)氧基)-1-苯基乙胺(114mg,0.303mmol)起始。
以与ER-897445相似的方式制备ER-897830(60.2mg,0.145mmol,71.8%总收率),其中以38(60mg,0.202mmol)和(R)-2-((叔丁基二苯基甲硅烷基)氧基)-1-苯基乙胺(114mg,0.303mmol)起始。
以与ER-895474相似的方式制备ER-899722(79mg,0.215mmol,25.6%收率),其中以38(250mg,0.841mmol)和2-甲基丙烷-1,2-二胺(0.09mL,0.841mmol)起始。使用DCM(2mL)代替DMAC。
以与ER-899722相似的方式制备ER-899295(27.5mg,0.0.71mmol,70.4%收率),其中以38(30mg,0.101mmol)和3-氨基-1H-吡唑-4-甲腈(10.9mg,0.101mmol)起始。
ER-898946:将38(50mg,0.168mmol)、HATU(128mg,0.336mmol)和DIEA(0.176ml,1.009mmol)溶于DCM:DMF(5mL:2mL),然后将4-氨基哌啶-1-甲酸叔丁酯(67.4mg,0.336mmol)溶于其中。将所得的反应混合物在室温下搅拌16h,此后添加额外的HATU(128mg,0.336mmol)和4-氨基哌啶-1-甲酸叔丁酯(67.4mg,0.336mmol),然后再搅拌3h。将完成的反应浓缩至干燥并且将粗产物通过色谱法(25g硅胶)纯化,用DCM中的10%乙腈洗脱,以产生纯的Boc保护的产物。将Boc保护的产物溶于DCM(4ml)/TFA(0.5ml)并且在室温下搅拌3h,此后在减压下去除溶剂,将残余物溶于MeOH(10mL)并且添加0.3g MP-碳酸盐(pH>7)。将所得的悬浮液在室温下搅拌30min,此后过滤聚合物微球,用MeOH(10mL)洗涤并且浓缩溶剂,以及在高真空下干燥以产生ER-898946(12mg,0.027mmol,16.0%收率)。
以与ER-898946相似的方式制备ER-898694-2HCl(67mg,0.155mmol,46.1%收率),其中以38(100mg,0.336mmol)和(S)-叔丁基2-(氨基甲基)吗啉-4-甲酸酯(95mg,.437mmol)起始,然后添加二噁烷(31μL)中的3N HCl以在浓缩以及在高真空下干燥后得到二盐酸盐。
制备ER-899742和ER-899745的可选方法:向38(2.91g,9.79mmol和TEA(1.706ml,12.24mmol)在DCM(50.0ml)中的经搅拌的溶液添加77(2.000g,9.792mmol)和HOBT(2.65g,19.59mmol)。将反应混合物冷却至0℃,然后分批添加EDC(3.75g,19.59mmol),此后将混合物升温至40℃并且搅拌3h。添加DCM(50mL),分离各层,此后用饱和氯化铵(20mL)、饱和NaHCO3(20mL)、盐水(20mL)洗涤有机层,经Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(BiotageSP4,用10%MeOH:DCM洗脱)纯化。如以上所述分离非对映体以获得78(1.65g,3.41mmol,34.8%收率)和79(1.49g,3.08mmol,31.5%收率)。
将78(470mg,0.97mmol)溶于DCM(5.0mL)的搅拌溶液中,然后添加TFA(2.5mL,32.45mmol),此后将反应升温至49℃并且搅拌2h。将完成的反应与甲苯(每次2mL)共沸三次至干燥,然后在真空中干燥以得到呈橙色固体状的ER-899742-TFA(543mg,0.97mmol,100%收率-所述产物包含1.5摩尔TFA:1摩尔ER-899742(通过质谱))。
通过将TFA盐溶于MeOH并且添加Amberlite IRA 400氢氧化物形式以及搅拌10min或一旦获得中性pH,就可以获得ER-899742游离碱。将所得的悬浮液进行过滤,用等体积的MeOH洗涤两次,并将合并的滤液浓缩成膏状物。将膏状物与甲苯共沸两次以得到游离碱形式的ER-899742(定量收率)。然后可以如上所述产生HCl盐形式。
可以通过用异丙醇中的5.5N HCL处理,以在室温下搅拌2h,然后与甲苯共沸3次至干燥以及在高真空下干燥后,由78直接获得ER-899742-HCl盐,得到通过质谱分析证明的1.5摩尔HCl:1摩尔ER-899742的所需产物(定量收率)。
ER-899464-HCl:向38(50g,168.2mmol)在DMF(250mL)中的经搅拌的溶液添加TEA(29.3mL,210.2mmol),然后添加4-氨基-1-甲基哌啶(28.8g,252.3mmol)和HOBT(45.4g,336.4mmol)。将反应混合物冷却至0℃,然后分批添加EDC(64.5g,336.4mmol)。将反应混合物升温至40℃并且再搅拌6h。将完成的反应物在搅拌下缓慢倾入包含水(1.5L)的烧瓶,此后添加DCM(1.5L),再搅拌10min。将两层进行分离并且将水层用DCM(每次600mL)萃取三次。将合并的有机层浓缩成DMF溶液,然后在真空中于50℃下进行浓缩。将所得的黄色浆料用乙醚(1L)稀释并且搅拌15min,此后通过过滤收集固体,然后用乙醚(0.5L)冲洗滤垫并且在真空中干燥以得到ER-899464(44.9g,114mmol,67.9%收率)。通过将ER-899464(22.8g,57.9mmol)溶于10体积异丙醇和1体积水,然后添加异丙醇中的1当量5.5N HCl以得到白色沉淀来获得HCl盐。将固体进行过滤并且用异丙醇(2体积)洗涤,然后在真空中干燥以得到ER-899464.HCl(20.3g,47.2mmol,81.5%)。
以与ER-899464相似的方式制备ER-899477(78mg,0.196mmol,58.3%收率),其中以38(100mg,0.336mmol)和(3S,4R)-叔丁基3-氨基-4-氟哌啶-1-甲酸酯(220mg,1.009mmol)起始。
以与ER-899464相似的方式制备ER-897968(475mg,1.252mmol,37.2%收率),其中以38(1.00g,3.364mmol)和(R)-叔丁基3-氨基哌啶-1-甲酸酯(2.021g,10.091mmol)起始。
以与ER-899464相似的方式制备ER-899018(370mg,0.975mmol,58.0%收率),其中以38(500mg,1.682mmol)和(氮杂环丁烷-3-基甲基)(甲基)氨基甲酸叔丁酯(500mg,2.497mmol)起始。
以与ER-899464相似的方式制备ER-899819(62mg,0.158mmol,31.3%收率),其中以38(150mg,0.505mmol)和3-氨基氮杂环庚烷-1-甲酸叔丁酯(324mg,1.514mmol)起始。
以与ER-899464-HCl相似的方式制备ER-899416-HCl(53mg,0.120mmol,35.7%收率),其中以38(100mg,0.336mmol)和(1R,3S,5S)-叔丁基3-氨基-8-氮杂双环[3.2.1]辛烷-8-甲酸酯(76mg,.336mmol)起始。
以与ER-899464-HCl相似的方式制备ER-899417-HCl(56mg,0.130mmol,38.7%收率),其中以38(100mg,0.336mmol)和4-氨基氮杂环庚烷-1-甲酸叔丁酯(144mg,.673mmol)起始。
以与ER-899464-HCl相似的方式制备ER-899285-HCl(52mg,0.108mmol,32.1%收率),其中以38(100mg,0.336mmol)和4-(4-氨基-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯(179mg,.673mmol)起始。
以与ER-899464-HCl相似的方式制备ER-899021-HCl(62mg,0.140mmol,41.7%收率),其中以38(100mg,0.336mmol)和2,6-二氮杂螺[3.5]壬烷-6-甲酸叔丁酯(152mg,.673mmol)起始。
以与ER-899464-HCl相似的方式制备ER-899619-HCl(36mg,0.084mmol,%收率),其中以38(100mg,0.336mmol)和(S)-叔丁基3-(甲基氨基)哌啶-1-甲酸酯(216mg,1.009mmol)起始。
以与ER-899464-HCl相似的方式制备ER-899616-HCl(21mg,0.049mmol,%收率),其中以38(100mg,0.336mmol)和(R)-叔丁基3-(甲基氨基)哌啶-1-甲酸酯(216mg,1.009mmol)起始。
以与ER-899464-HCl相似的方式制备ER-898566-HCl(272mg,0.630mmol,37.5%收率),其中以38(500mg,1.682mmol)和N2,N2,2-三甲基丙烷-1,2-二胺(586mg,5.045mmol)起始。
以与ER-899464-HCl相似的方式制备ER-899618-HCl(4.8mg,0.011mmol,3.2%收率),其中以38(500mg,1.682mmol)和4-氨基吡啶酰胺(138mg,1.009mmol)起始。
以与ER-899464相似的方式制备ER-899477(78mg,0.196mmol,58.3%收率,作为非对映体混合物),其中以38(100mg,0.336mmol)以及(3S,4R)-叔丁基3-氨基-4-氟哌啶-1-甲酸酯和(3R,4S)-叔丁基3-氨基-4-氟哌啶-1-甲酸酯(220mg,1.009mmol)的外消旋混合物起始。
ER-895415作为方案11中化合物41的实例:在0℃下,向38(1.10g,3.70mmol)在DCM(5mL)中的经搅拌的溶液在2min内逐滴添加乙二酰氯(1.0mL,11.42mmol)。使得反应混合物升温至室温并且搅拌1h,此后将反应物在真空中浓缩并且干燥。将干燥的浆状物冷却至0℃,然后在搅拌下缓慢添加MeOH(5mL)。将完成的反应物浓缩至干燥,用DCM(10mL)稀释,用饱和亚硫酸钠(3mL)、盐水(3mL)洗涤,然后经Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经过硅胶(用庚烷中的0%至50%EtOAc梯度洗脱)纯化,以在合并所需部分、在真空中浓缩和干燥之后得到ER-895415(894mg,2.81mmol,76%收率)。
根据方案21制备实例ER-899332:
方案21
将ER-899472-HCl(49.8mg,.119mmol)和多聚甲醛(8.90mg,.297mmol)在DCM(0.5mL)中的溶液在室温下搅拌1h。添加三乙酰氧基硼氢化钠(62.8mg,.297mmol)并且将所得的溶液在室温下搅拌2天。在去除溶剂之后,将粗产物在二氧化硅(在DCM中的15%MeOH)上进行层析以产生ER-899332(8.16mg,0.021mmol,18.3%收率)。
以与ER-899332相似的方式制备ER-899457(50mg,0.117mmol,97%收率),其中以ER-899336(50mg,0.122mmol)起始。
ER-899836:将ER-899477(76mg,.191mmol)在37%甲醛水溶液(0.5g,16.652mmol)和甲酸(0.5ml,13.036mmol)中的经搅拌的溶液升温至80℃持续3h,此后将完成的反应冷却至室温。将混合物与甲苯(每次2mL)共沸四次至干燥,并且将所得的残余物溶于MeOH(5mL),然后添加Amberlite IRA400氢氧化物形式(2g)并且搅拌10min。在搅拌下添加额外的Amberlite IRA400直到获得中性pH,此后将悬浮液进行过滤,浓缩以及与甲苯(每次2mL)共沸两次。然后,将粗制材料经过硅胶(Biotage SNAP Ultra,25g,用DCM中的1%-40%MeOH洗脱)纯化,以在合并所需部分、在真空中浓缩以及干燥后得到ER-899836(55mg,0.134mmol,69.9%收率)。
将ER-899836(50mg,0.124mmol)溶于乙腈(1mL),然后添加乙醚中的2M HCl(0.062ml,0.124mmol)并且在室温下搅拌30min。将所得的橙色溶液浓缩至干燥并且置于高真空下过夜,以得到定量收率的ER-899836-HCl。
以与ER-899836-HCl相似的方式制备ER-899688-HCl(381mg,0.886mmol,88.4%收率),其中以ER-897968(600mg,1.58mmol)起始。
以与ER-899836-HCl相似的方式制备ER-899820-HCl(45mg,0.110mmol,69.9%收率),其中以ER-899819(62mg,0.158mmol)起始。
以与ER-899836相似的方式相似地制备ER-899337(35.6mg,0.087mmol,24%收率),其中以作为游离碱的ER-897968(142mg,0.361mmol)起始。
以与ER-899836相似的方式相似地制备ER-899835(29mg,0.071mmol,81%收率),其中以作为游离碱的ER-899718(34mg,0.086mmol)起始。
以与ER-899836相似的方式相似地制备ER-899837(35.6mg,0.087mmol,24.2%收率),其中以作为游离碱的ER-899417(142mg,0.361mmol)起始。
以与ER-899836相似的方式制备ER-898707甲酸盐(17mg,0.0.36mmol,78%收率),其中以维持作为甲酸盐代替转化为如上HCl盐的ER-898694(20mg,0.046mmol)起始。
通过方案11中的一般结构39或41描述的其它实例
ER-895472:在-15℃下向38(22.7mg,.076mmol)和TEA(12.8μl,.092mmol)在THF中的冷却溶液添加氯甲酸乙酯(8.1μl,.084mmol)。在搅拌1.5h后,添加氢氧化铵(6.0μl,.153mmol),此后在-10℃下再持续搅拌2h。使反应升温至室温并且再搅拌2h。通过添加饱和NaHCO3(5mL)淬灭完成的反应,然后将水相用EtOAc(每次5mL)萃取3次。将合并的有机层经无水Na2SO4干燥,过滤并且浓缩以产生淡黄色油状物。将粗产物使用反相HPLC C-18(Water’s X-Bridge C1819x 100mm柱;使用包含0.1%甲酸的乙腈/水的梯度)纯化,以得到ER-895472(6.2mg,0.021mmol,27.5%收率)。
ER-899122:在0℃下,向38(80mg,.24mmol)和4-甲基吗啉(32μl,.288mmol)在THF(4mL)中的冷却溶液添加氯甲酸异丙酯(38μl,.084mmol)。在搅拌30min后,添加四氢-吡喃-4-基胺(29.1mg,.288mmol),此后在-10℃下再持续搅拌2h。使反应升温至室温并且再搅拌16h。通过添加饱和NaHCO3(5mL)淬灭完成的反应,然后将水相用EtOAc(每次5mL)萃取3次。将合并的有机层经无水Na2SO4干燥,过滤并且浓缩以产生淡黄色油状物。将粗产物经硅胶(25g)纯化,用庚烷中的80%–100%EtOAc的线性梯度洗脱,以在浓缩所需部分至干燥并且将产物置于高真空下后得到ER-899122(40mg,0.100mmol,41.7%收率)。
以与ER-899122相似的方式制备ER-899121(40mg,0.104mmol,43.3%收率),其中以38(80mg,0.24mmol)和3-氨基甲基-氧杂环丁烷(25.06mg,.288mmol)起始。
以与ER-899122相似的方式制备ER-899123(40mg,0.109mmol,45.5%收率),其中以38(80mg,0.24mmol)和3-氨基四氢呋喃(25.06mg,.288mmol)起始。
以与ER-899122相似的方式制备ER-899140(20mg,0.051mmol,21.3%收率),其中以38(80mg,0.24mmol)和(2-氨基乙基)(甲基)氨基甲酸叔丁酯(50.1mg,.288mmol)起始,之后使用TFA去除Boc基团,用如所述的MP碳酸盐中和。
以与ER-899122相似的方式制备ER-899151(15mg,0.035mmol,14.6%收率)和ER-899152(15mg,0.035mmol,14.6%收率),其中以38(80mg,0.24mmol)和作为立体异构体的混合物的3-氨基-1,1,1-三氟-2-丙醇(37.1mg,.288mmol)起始。使用ER-899122所述的色谱法分离两种产物。将立体中心任意地指定并且尚未明确确定。
以与ER-899122相似的方式制备ER-899153(32mg,0.083mmol,34.4%收率),其中以38(80mg,0.24mmol)和甘氨酸甲酯盐酸盐(36.1mg,.288mmol)起始。
以与ER-899122相似的方式制备ER-899154(16mg,0.041mmol,17.3%收率),其中以38(80mg,0.24mmol)和二甲基乙二胺(31.6μl,.288mmol)起始。
以与ER-899122相似的方式制备ER-899159(14mg,0.033mmol,13.8%收率)和ER-899160(13mg,0.031mmol,12.8%收率),其中以38(80mg,0.24mmol)和作为立体异构体的混合物的4-氨基-1,1,1-三氟丁-2-醇盐酸盐(51.6mg,.288mmol)起始。使用ER-899122所述的色谱法分离两种产物。将立体中心任意地指定并且尚未明确确定。
以与ER-899122相似的方式制备ER-899161(13mg,0.031mmol,12.9%收率),其中以38(80mg,0.24mmol)和作为非对映体混合物的4,4,4-三氟丁烷-1,3-二胺二盐酸盐(61.9mg,.288mmol)起始。
通过将ER-899153(24mg,0.65mmol)溶于MeOH(2mL)和水(0.5mL),然后添加氢氧化锂(3.12mg,13.0mmol)来制备ER-899152(9mg,0.024mmol,37.0%收率)。将反应在室温下搅拌16h,此后将完成的反应用3N HCl酸化至pH 3,然后用EtOAc(每次10mL)萃取3次,合并有机层,经无水Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经C-18反相HPLC柱纯化,其中用具有0.1%甲酸的10%–90%乙腈水溶液的线性梯度洗脱并且浓缩所需峰,然后在高真空下干燥。
以与ER-899140相似的方式制备ER-899278(20mg,0.051mmol,33.8%收率),其中以38(50mg,0.15mmol)和(R)-叔丁基2-(氨基甲基)吗啉-4-甲酸酯(48.6mg,.225mmol)起始。
以与ER-899140相似的方式制备ER-899366(70mg,0.171mmol,42.4%收率),其中以38(120mg,0.404mmol)和(2S,6R)-叔丁基2-(氨基甲基)-6-甲基吗啉-4-甲酸酯(112mg,.484mmol)起始。
以与ER-899140相似的方式制备ER-899367(40mg,0.102mmol,38%收率),其中以38(80mg,0.269mmol)和六氢吡咯并[3,4-c]吡咯-2(1H)-甲酸叔丁酯(68.5mg,.373mmol)起始。
以与ER-899122相似的方式制备ER-899459(30mg,0.074mmol,31.3%收率),其中以38(70mg,0.235mmol)和N,N-二甲基哌啶-4-胺(36.2mg,.283mmol)起始。
以与ER-899122相似的方式制备ER-899464(20mg,0.051mmol,18.9%收率),其中以38(80mg,0.269mmol)和1-甲基哌啶-4-胺(36.9mg,.323mmol)起始。
以与ER-899140相似的方式制备ER-899588(40mg,0.105mmol,44.8%收率),其中以38(70mg,0.235mmol)和哌啶-4-基氨基甲酸叔丁酯(56.6mg,.283mmol)起始。
以与ER-899140相似的方式制备ER-899608(40mg,0.102mmol,37.8%收率),其中以38(70mg,0.235mmol)和(4-甲基哌啶-4-基)氨基甲酸叔丁酯(63.4mg,.296mmol)起始。
以与ER-899122相似的方式制备ER-899680(40mg,0.098mmol,19.2%收率),其中以38(100mg,0.336mmol)和1-乙基哌啶-3-胺(43.1mg,.336mmol)起始。
以与ER-899122相似的方式制备ER-899431(53mg,0.103mmol,51.3%收率),其中以38(99mg,0.333mmol)和甲胺(在THF中为2M)(1.50mL,3.00mmol)起始。
以与ER-899122相似的方式制备ER-899626(29mg,0.071mmol,35.3%收率),其中以38(60mg,0.202mmol)和4-氨基-1-乙基哌啶(25.9mg,.202mmol)起始。
以与ER-899140相似的方式制备ER-899718(32mg,0.081mmol,40.1%收率),其中以38(60mg,0.202mmol)和4-氨基-4-甲基哌啶-1-甲酸叔丁酯(47.6mg,.222mmol)起始。
其它实例:方案11中的一般结构39的调整:
方案22
ER-899333-HCl:向38(58.2mg,.196mmol)和HBTU(89mg,.235mmol)在DCM(1.94mL)中的经搅拌的溶液添加DIEA(137μl,.783mmol),然后添加(3R,4S)-叔丁基3-氨基-4-氟哌啶-1-甲酸酯(42.7mg,.196mmol)。将反应搅拌过夜,此后将完成的反应物进行浓缩并且用EtOAc(10mL)稀释。将有机溶液用2N柠檬酸水溶液、饱和NaHCO3洗涤,经无水Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(50g,用庚烷中的40%-100%EtOAc洗脱,20个柱体积)纯化,以得到呈浅黄色固体状的86(58.5mg,0.118mmol,56.2%收率)。
向86(58.8mg,.118mmol)和碘甲烷(7.39μL,.118mmol)在冷却至0℃的DMF(1mL)中的经搅拌的溶液添加NaH(5.20mg,.13mmol,油状分散体)。将反应升温至室温并且搅拌3.5h。将完成的反应用冰/水浴冷却,并且通过缓慢添加饱和氯化铵(5mL)进行淬灭,随后添加水(5mL),以及用EtOAc(每次10mL)萃取两次。将合并的有机相经无水Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(25g,用庚烷中的EtOAc的40%-100%梯度洗脱,20个柱体积)纯化,以得到呈浅黄色固体状的87(42.9mg,0.084mmol,71.0%)。
向87(42.9mg,.084mmol)在EtOAc(1mL)中的经搅拌的溶液添加1,4-二噁烷中的4.0N HCl(0.419mL,1.677mmol),然后在室温下搅拌1h,此后将完成的反应物在真空中浓缩和干燥以得到ER-89933-HCL(23.4mg,0.054mmol,62.3%)。
方案23
ER-8999335:向38(357.2mg,1.201mmol)和HBTU(547mg,1.442mmol)在DCM(10mL)中的经搅拌的溶液添加DIEA(0.84mL,4.806mmol)和(氮杂环丁烷-3-基甲基)氨基甲酸叔丁酯(224mg,1.201mmol)。将反应混合物搅拌3h,此后将完成的反应物进行浓缩,溶于EtOAc(25mL)并且用2N柠檬酸水溶液(20mL)、饱和NaHCO3(20mL)洗涤,并且经无水Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(40g,用50%-100%EtOAc/庚烷洗脱,20个柱体积)纯化,以得到呈浅黄色固体状的88(181.6mg,0.390mmol,32.5%收率)。
在0℃下,向88(52.6mg,.113mmol)和碘乙烷(10.50μL,.13mmol)在DMF(1.0mL,12.915mmol)中的经搅拌的溶液添加60%氢化钠(5.87mg,.147mmol),此后使得反应升温至室温并且搅拌6h。将完成的反应冷却至0℃,并且通过缓慢添加饱和NH4Cl(5mL)进行淬灭,然后用水(5mL)稀释并且用EtOAc(每次10mL)萃取两次。将合并的有机相经无水Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(25g,用庚烷中的70-100%EtOAc洗脱,20个柱体积)纯化,以得到用于下一步的Boc保护的中间体。通过将中间体溶于EtOAc(1mL)以及添加TFA(0.5mL),然后搅拌1h而去除Boc。将完成的反应物浓缩至干燥,溶于DCM(10mL)。用饱和NaHCO3洗涤2次,经无水Na2SO4干燥,过滤,浓缩并且在高真空下干燥,以得到呈淡黄色固体状的ER-899335(4.1mg,0.010mmol,9.3%)。
方案24
ER-899336:在0℃下,向ER-899334(35.4mg,.097mmol)和碘甲烷(0.013mL,.213mmol)在DMF(1mL)中的经搅拌的溶液添加60%氢化钠(9.69mg,.242mmol),此后将反应物升温至室温并且搅拌过夜。将完成的反应冷却至0℃,并且通过缓慢添加饱和NH4Cl(5mL)进行淬灭,然后用水(5mL)稀释并且用EtOAc(每次10mL)萃取两次。将合并的有机相经无水Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(25g,用庚烷中的70%–100%EtOAc洗脱,20个柱体积)纯化,以在收集所需材料、浓缩以及置于高真空下后得到ER-899336(5.2mg,0.013mmol,13.6%收率)。
方案25
ER-899481:向ER-898946(60mg,.158mmol)在乙腈(10mL)中的经搅拌的溶液添加K2CO3(87mg,.632mmol)和2-溴乙酰胺(43.6mg,.316mmol)。将反应混合物升温至60℃并且搅拌16h,此后将完成的反应物进行过滤。将所得的溶液进行浓缩,并且将粗产物经C-18HPLC柱(用具有0.1%甲酸的10%–50%乙腈水溶液洗脱)纯化,以在收集所需材料、浓缩以及置于高真空后得到ER-899481(43mg,0.099mmol,62.3%收率)。
作为方案12中化合物42的实例的ER-885612:在0℃下,向13(25mg,0.088mmol)在DMF(0.5mL)中的冷却的、经搅拌的溶液添加NaH(3.5mg,0.088mmol,60%油状分散体),然后添加碘甲烷(16.5μL,0.265mmol)。将反应再搅拌20min,此后缓慢添加水(1mL)。将淬灭的反应用DCM(每次2mL)萃取两次,经MgSO4干燥,过滤并且浓缩至干燥。经反相制备型HPLC柱(X-Bridge C18 19x 100mm柱;用包含0.05%TFA的0%-50%乙腈水溶液洗脱)纯化,以在合并所需收集的部分、在真空中浓缩以及干燥后得到ER-885612(16.9mg,0.057mmol,64.6%收率)。
以与ER-885612相似的方式制备ER-885807(15.2mg,0.049mmol,55.7%收率),其中以13(25mg,0.088mmol)和碘乙烷(20.6mg,.132mmol)起始。
以与ER-885612相似的方式制备ER-885808(8.2mg,0.025mmol,28.6%收率),其中以13(25mg,0.088mmol)和异丙基碘(22.5mg,.132mmol)起始。
以与ER-885612相似的方式制备ER-885892(3.1mg,0.009mmol,10.4%收率),其中以13(25mg,0.088mmol)和1-碘-2-甲基丙烷(15.2uL,.132mmol)起始。
以与ER-885612相似的方式制备ER-885929(17.5mg,0.048mmol,54.6%收率),其中以13(25mg,0.088mmol)和1-碘己烷(37.4mg,.176mmol)起始。
以与ER-885612相似的方式制备ER-885930(7.9mg,0.021mmol,23.7%收率),其中以13(25mg,0.088mmol)和环己基甲基溴(31.3mg,.177mmol)起始。
以与ER-885612相似的方式制备ER-895324(35.2mg,0.098mmol,54.7%收率),其中以13(50.6mg,0.179mmol)和2-溴吡啶(20.4μL,.214mmol)起始。使用THF(1mL)代替DMF。
以与ER-893324相似的方式制备ER-895325(54.2mg,0.150mmol,83.8%收率),其中以13(50.6mg,0.179mmol)和2-溴嘧啶(57mg,.359mmol)起始。
以与ER-893324相似的方式制备ER-894552(5mg,0.014mmol,19.2收率),其中以13(20.4mg,0.072mmol)和2-氯吡嗪(8.3mg,.0.072mmol)起始。
ER-886137:在干燥的微波反应容器中添加DMSO(0.3mL)中的碳酸铯(172.5mg,0.529mmol)、碘化亚铜(I)(33.6mg,0.176mmol)、1,1’-联萘-2,2’-二胺(50.2mg,0.177mmol)、2-碘-1,3-二甲基苯(123mg,0.53mmol),然后添加13(50mg,0.177mmol)。将反应混合物在110℃下微波处理12h,此后将混合物直接注入反相制备型HPLC柱(Water’sX-Bridge C18 19x 100mm柱;使用包含0.05%TFA的0%-50%乙腈水溶液的梯度)用于洗脱纯化,以得到粗产物。将粗产物经过硅胶(Biotage,用庚烷中的25%EtOAc至100%EtOAc的梯度洗脱)纯化,以在合并所需收集的部分、在真空中浓缩和干燥之后得到ER-886137(12.1mg,0.031mmol,17.6%收率)。
ER-886514:向14(10.5mg,0.024mmol)和碳酸钾(30mg,0.217mmol)在甲苯(1mL)中的经搅拌的悬浮液添加苯酚(24.4mg,0.259mmol)。将反应混合物在150℃下微波处理5h,此后将粗制混合物过滤并且直接注入反相制备型HPLC柱(Water’s X-Bridge C18 19x 100mm柱;使用包含0.05%TFA的0%-50%乙腈水溶液的梯度),以在合并所需收集的部分、在真空中浓缩和干燥之后得到ER-886514(4.5mg,0.013mmol,54.1%收率)。
以与ER-886514相似的方式制备ER-886515(3.2mg,0.009mmol,37.6%收率),其中以14(10.6mg,0.024mmol)和3-甲基苯酚(28.1mg,0.260mmol)起始。
以与ER-886514相似的方式制备ER-886516(4.7mg,0.013mmol,52.4%收率),其中以14(10.6mg,0.024mmol)和4-甲基苯酚(28.1mg,0.260mmol)起始。
以与ER-886514相似的方式制备ER-886605(7.9mg,0.020mmol,85.1%收率),其中以14(10.3mg,0.024mmol)和3,4-二氟苯酚(20mg,0.154mmol)起始。在此制备中,使用1-甲基吡咯烷酮(1mL)代替甲苯。
以与ER-886605相似的方式制备ER-886606(7.2mg,0.019mmol,81.2%收率),其中以14(10.3mg,0.024mmol)和3-氟苯酚(13.2mg,0.118mmol)起始。
以与ER-886605相似的方式制备ER-886624(5.1mg,0.014mmol,59%收率),其中以14(10mg,0.023mmol)和2-氟苯酚(10mg,0.089mmol)起始。
以与ER-886605相似的方式制备ER-886786(8.2mg,0.022mmol,76.9%收率),其中以14(12.5mg,0.029mmol)和2-甲基苯酚(28.1mg,0.260mmol)起始。
使用化合物13或ER-885493作为原料的其它实例:
ER-885621:在N2气氛下,向双(2-甲氧基乙基)氨基三氟化硫(24.4μL,0.132mmol)在冷却至-78℃的DCM(0.1mL)中的经搅拌的溶液添加DCM(0.1mL)中的13(25mg,0.088mmol)。使得反应混合物升温至-50℃并且搅拌0.5h,升温至0℃并且搅拌1.5h。将反应混合物升温至5℃并且搅拌2h,此后逐滴添加饱和NaHCO3水溶液,直到达到pH 10。分离各层并且将有机层用水(1mL)洗涤两次,经MgSO4干燥,过滤并浓缩至干燥。经反相制备型HPLC柱纯化,其中用0%-50%乙腈水溶液洗脱,以在合并所需收集的部分、在真空中浓缩并且干燥后得到ER-885621(12.5mg,0.044mmol,49.8%收率)。
ER-885906:将13(85.5mg,0.302mmol)在亚硫酰氯(2mL)中的经搅拌的溶液升温至85℃持续24h,此后去除过量的亚硫酰氯并且将粗产物经反相制备型HPLC纯化,其中用0%-50%乙腈水溶液洗脱,在合并所需收集的部分、在真空中浓缩并且干燥后得到ER-885906(4.3mg,0.014mmol,4.7%收率)。
作为方案13中的化合物44的实例的ER-886431和ER-886480的制备
化合物43或ER-886250:在0℃下于氮气气氛中,向13(200mg,0.706mmol)在DCM(5mL)和吡啶(0.114mL,1.4mmol)中的经搅拌的溶液添加戴斯马丁氧化剂(Dess-Martin periodinane)(359mg,0.846mmol),此后将反应物升温至室温并且搅拌1h。发现反应进行的不完全,因此添加额外的戴斯马丁氧化剂(359mg,0.846mmol)和吡啶(0.114mL,1.4mmol),然后再搅拌30min。将完成的反应物倾入具有10%硫代硫酸钠水溶液(2mL)的饱和NaHCO3水溶液(4mL)中。将混合物搅拌30min,此后将混合物用DCM(每次4mL)萃取三次。用盐水(4mL)洗涤合并的有机层,经Na2SO4干燥,过滤并且浓缩。将粗产物经硅胶(Biotage SP4,25g,用庚烷中的10%至100%EtOAc洗脱)纯化,以在合并所需部分、在真空中浓缩和干燥之后,得到呈黄色浆状物的5-((2R,6R)-2-甲酰基-6-甲基吗啉代)喹啉-8-甲腈43或ER-886250(110mg,0.391mmol,55.4%收率)。
在0℃下,在氮气气氛中向43(25mg,0.089mmol)在THF(0.5mL)中的经搅拌的溶液在2min内逐滴添加THF中的1M乙烯基溴化镁(0.098mL,0.098mmol)。将反应在0℃下搅拌2h,此后缓慢添加饱和氯化铵(0.5mL),然后添加水(0.25mL)。将淬灭的反应升温至室温,再搅拌10min,并且用EtOAc(每次2mL)萃取两次。用盐水(1mL)洗涤合并的有机层,经Na2SO4干燥,过滤并且浓缩。将粗产物在制备型TLC板(Merck Silica Gel 60F254,2 20x 20cm板,用EtOAc洗脱)上纯化,以在所需部分与硅胶分离洗脱、在真空中浓缩以及干燥后,得到呈黄色浆状物的ER-886431(3mg,0.010mmol,11.2%收率,Rf=0.75,EtOAc)和ER-886480(3mg,0.0.10mmol,11.2%收率,Rf=0.80.EtOAc)。任意指定两种实例的游离的醇官能团的立体化学。
以与ER-886431和ER-886480相似的方式制备ER-886530(11mg,0.032mmol,36.4%收率,Rf=0.80,EtOAc)和ER-886531(3mg,0.0.10mmol,11.2%收率,Rf=0.75,EtOAc),其中以43(25mg,0.089mmol)和THF中的2M丁基氯化镁(0.131mL,0.262mmol)起始。将粗产物经硅胶(Biotage SP4,25g,用庚烷中的20%–100%EtOAc洗脱)纯化。任意指定两种实例的游离的醇官能团的立体化学。
以与ER-886530和ER-886531相似的方式制备ER-886532(4mg,0.011mmol,6.3%收率,Rf=0.80,EtOAc)和ER-886533(4mg,0.011mmol,6.3%收率,Rf=0.75,EtOAc),其中以43(49mg,0.174mmol)和THF中的1.3M环己基氯化镁(0.20mL,0.260mmol)起始。任意指定两种实例的游离的醇官能团的立体化学。
以与ER-886530和ER-886531相似的方式制备ER-886567(3.6mg,0.009mmol,5.3%收率,Rf=0.80,EtOAc)和ER-886568(8.6mg,0.022mmol,12.8%收率,Rf=0.75,EtOAc),其中以43(49mg,0.174mmol)和THF中的1M苯乙基氯化镁(0.26mL,0.260mmol)起始。任意指定两种实例的游离的醇官能团的立体化学。
以与ER-886530和ER-886531相似的方式制备ER-886520(26mg,0.084mmol,49.1%收率,Rf=0.80,EtOAc),其中以43(48mg,0.171mmol)和THF中的2M乙基氯化镁(0.128mL,0.256mmol)起始。将非对映体混合物用于额外的研究。
经由方案26的ER-886564和ER-886565
方案26
向22(2.51g,7.8mmol)在EtOH(40mL)中的经搅拌的溶液添加50%水中的10%钯活性碳(1.66g),然后用氢气对烧瓶进行几次充气。在氢气气氛(气球压力)下将反应维持在40℃并且搅拌16h,此后将反应物用氮气吹扫几次,同时在吹扫间隔用真空清扫抽空系统。将完成的反应物经硅藻土545过滤,将滤垫用EtOH(每次85mL)洗涤两次,然后在真空中浓缩并且干燥合并滤液的浓缩物。将粗产物(2R,6R)-叔丁基2-(羟甲基)-6-甲基吗啉-4-甲酸酯89(1.56g,6.7mmol,86.5%收率)未经进一步纯化用于下一步。
在0℃下,在氮气气氛中向89(1.501g,6.5mmol)在DCM(30mL)和吡啶(1.05mL,13.0mmol)中的经搅拌的溶液添加戴斯马丁氧化剂(3.3g,7.8mmol),此后将反应物升温至室温并且搅拌1h。发现反应进行的不完全,因此添加额外的戴斯马丁氧化剂(1.4g,3.3mmol)和吡啶(0.52mL,6.4mmol),然后再搅拌2h。将完成的反应物倾入具有10%硫代硫酸钠水溶液(18mL)的饱和NaHCO3水溶液(37mL)中。将混合物搅拌30min,此后将混合物用DCM(每次40mL)萃取三次。用盐水(37mL)洗涤合并的有机层,经Na2SO4干燥,过滤并且浓缩。将粗产物经硅胶(Biotage 40+S,40g,用庚烷中的10%-100%EtOAc洗脱)纯化,以在合并所需部分、在真空中浓缩和干燥之后,得到呈无色浆状物的(2R,6R)-叔丁基2-甲酰基-6-甲基吗啉-4-甲酸酯90(1.285g,5.6mmol,86.2%收率)。
在0℃下,在氮气气氛中向90(208mg,0.907mmol)在THF(5mL)中的经搅拌的溶液在2min内逐滴添加THF中的1M苄基溴化镁(2.3mL,2.3mmol)。将反应在0℃下搅拌2.5h,此后缓慢添加饱和氯化铵(4.8mL),然后添加水(2.5mL)。将淬灭的反应升温至室温,再搅拌10min,并且用EtOAc(每次20mL)萃取两次。用盐水(9.5mL)洗涤合并的有机层,经Na2SO4干燥,过滤并浓缩。将粗产物经硅胶(BiotageSP4,25g,用庚烷中的25%–100%EtOAc洗脱)纯化,以在合并所需部分、在真空中浓缩并且干燥后得到呈无色油状的(2R,6R)-叔丁基2-((R,S)-1-羟基-2-苯基乙基)-6-甲基吗啉-4-甲酸酯91(172mg,0.539mmol,59.4%收率,R=-CH2C6H5)。
向91(172mg,0.539mmol)在DCM(1.2mL)中的经搅拌的溶液添加TFA(1.2mL)。将反应物在室温下搅拌30min,此后将完成的反应物用甲苯(4.6mL)稀释,浓缩并且与甲苯(每次4.6mL)共沸两次至干燥以进行干燥,以得到未经进一步纯化作为TFA盐的1-((2R,6R)-6-甲基吗啉-2-基)-2-苯基乙醇92(179mg,0.534mmol,99.0%收率,R=-CH2C6H5)。
将粗制的92(179mg,0.534mmol)溶于N-甲基吡咯烷酮(3mL),然后将3(187mg,0.802mmol)和DIPEA(0.2mL,1.1mmol)溶于其中。将混合物在170℃下微波处理5h,此后将冷却的混合物直接注入C-18反相制备型HPLC柱,其中用具有0.1%TFA的10%-60%乙腈水溶液洗脱。将两种洗脱的部分分别浓缩至干燥,与MeOH(每次5mL)共沸两次。将各个异构体溶于MeOH(2mL)并且经过硅胶(硅胶-CO2)的碱性塞,其中用MeOH(每次2mL)洗脱两次,然后在真空中浓缩和干燥以分别得到93或ER-886564(19mg,0.051mmol,9.5%收率,第一部分,R=-CH2C6H5)以及94或ER-886565(23mg,0.062mmol,11.5%收率,第二部分,R=-CH2C6H5)。任意指定醇位置的立体化学。
以与ER-886564和ER-886564相似的方式制备ER-895200(22.2mg,0.075mmol,32.1%收率,第一部分)和ER-895310(15.2mg,0.051mmol,21.8%收率,第二部分),其中以3(54.6mg,0.234mmol)和1-((2R,6R)-6-甲基吗啉-2-基)乙醇(68.2mg,0.470mmol)起始。任意指定醇位置的立体化学。
ER-895326:向ER-895200(17.9mg,0.060mmol)在THF(0.3mL)中的经搅拌的溶液添加氢化钠(4.8mg,0.120mmol,60%油状分散体),然后添加2-溴嘧啶(19mg,0.120mmol)。将反应升温至60℃并且搅拌30min,此后将其冷却至室温并且通过逐滴添加水(0.5mL)来缓慢淬灭。将混合物用DCM(每次3mL)萃取三次,并且用盐水(3mL)洗涤合并的有机层,经Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(Biotage,用庚烷中的0%–10%EtOAc的梯度洗脱)纯化,以在收集所需的部分、在真空中浓缩和干燥之后得到ER-895326(20.3mg,0.054mmol,90.1%收率)。
以与ER-895326相似的方式制备ER-895327(6.4mg,0.017mmol,63%收率),其中以ER-895310(7.9mg,0.027mmol)和2-溴嘧啶(8mg,0.0.50mmol)起始。
ER-895412:在-40℃下,向1.6M正丁基锂在THF中的经搅拌的溶液(1.36mL,2.18mmol)逐滴添加乙醚(2mL)中的2-溴吡啶(0.21mL,2.20mmol),然后在-40℃下搅拌30min。在3min内逐滴添加THF(2mL)中的90(500mg,2.18mmol),此后将反应混合物在-40℃下搅拌2h,并且然后在0℃下搅拌1h。将完成的反应物用饱和氯化铵水溶液(2mL)缓慢淬灭,然后升温至室温,分离各层并且将水层用EtOAc(每次2mL)萃取两次。用盐水(2mL)洗涤合并的有机层,经Na2SO4干燥,过滤并且浓缩至干燥。将粗产物首先经过硅胶(Biotage,用庚烷中的30%EtOAc洗脱)纯化,然后从3:1的DCM:MeOH中结晶以在过滤以及在真空中干燥后得到(2R,6R)-叔丁基2-((S)-羟基(吡啶-2-基)甲基)-6-甲基吗啉-4-甲酸酯(150mg,0.486mmol,22.3%收率)。
向(2R,6R)-叔丁基2-((S)-羟基(吡啶-2-基)甲基)-6-甲基吗啉-4-甲酸酯(150mg,0.486mmol)在DCM(5mL)中的经搅拌的溶液添加TFA(1mL),然后在室温下搅拌1h。将完成的反应物进行浓缩并且与甲苯(每次5mL)共沸三次至干燥,然后用DCM(10ml)稀释,用饱和NaHCO3水溶液(2mL)、盐水(2mL)洗涤两次,经MgSO4干燥,过滤并且在真空中浓缩以及干燥,以得到粗制的(S)-((2R,6R)-6-甲基吗啉-2-基)(吡啶-2-基)甲醇(97.8mg,0.469,96.4%收率)。
向(S)-((2R,6R)-6-甲基吗啉-2-基)(吡啶-2-基)甲醇(97.8mg,0.469mmol)和化合物3(54.6mg,0.234mmol)在DMAC(1mL)中的经搅拌的溶液添加TEA(0.132mL,0.947mmol)。将反应在105℃下微波处理3h,此后将冷却的反应物经反相制备型HPLC柱(Water’s X-Bridge C1819x 100mm柱;使用包含0.1%甲酸的0%-50%乙腈水溶液的梯度)直接纯化,以在合并所需收集的部分、在真空中浓缩和干燥后得到ER-895296(15.2mg,0.042mmol,18.0%收率,R=2-吡啶基)。
作为方案13中的化合物45的实例的ER-886625的制备
在0℃下,在氮气气氛中向ER-886520(19mg,0.061mmol)在DCM(0.5mL)和吡啶(0.010mL,0124mmol)中的经搅拌的溶液添加戴斯马丁氧化剂(31.1mg,0.073mmol),此后将反应升温至室温并且搅拌1h。发现反应进行的不完全,因此添加额外的戴斯马丁氧化剂(31.1mg,0.073mmol)和吡啶(0.010mL,0124mmol),然后再搅拌30min。将完成的反应物倾入具有10%硫代硫酸钠水溶液(0.2mL)的饱和NaHCO3水溶液(0.4mL)中。将混合物搅拌30min,此后将混合物用DCM(每次0.3mL)萃取三次。用盐水(0.35mL)洗涤合并的有机层,经Na2SO4干燥,过滤并且浓缩。将粗产物经硅胶(Biotage SP4,25g,用庚烷中的10%-80%EtOAc洗脱)纯化,以在合并所需部分、在真空中浓缩和干燥之后,得到呈黄色固体状的45或ER-886625(7mg,0.023mmol,37.1%收率)。
以与ER-886625相似的方式制备ER-886626(10.8mg,0.030mmol,90.9%收率),其中以ER-886532和ER-886533(12mg,0.033mmol)的混合物起始。
以与ER-886625相似的方式制备ER-886629(6.6mg,0.017mmol,81%收率),其中以ER-886567和ER-886568(8mg,0.021mmol)的混合物起始。
ER-886912和ER-886913的制备:
在室温下向ER-886568(124mg,0.32mmol)在DCM(1.3mL)中的经搅拌的溶液添加甲磺酰氯(37μL,0.478mmol),然后添加DMAP(7.8mg,0.064mmol)和DIPEA(0.17mL,0.959mmol)。将反应在室温下搅拌2h,此后添加水(1mL)和DCM(5mL),然后再搅拌5min并且分离各层。用盐水(1mL)洗涤有机层,经Na2SO4干燥,过滤并且浓缩。将粗产物经硅胶(Biotage SP4,25g,用庚烷中的20%-100%EtOAc洗脱)纯化,以在合并所需部分、在真空中浓缩和干燥之后,得到呈黄色固体状的(R)-1-((2R,6R)-4-(8-氰基喹啉-5-基)-6-甲基吗啉-2-基)-3-苯基丙基甲烷-磺酸酯(136mg,0.292mmol,93.5%收率)。
将(R)-1-((2R,6R)-4-(8-氰基喹啉-5-基)-6-甲基吗啉-2-基)-3-苯基丙基甲磺酸盐(38mg,0.082mmol)在NMP(2mL)和吡咯烷(0.10mL,1.21mmol)中的溶液在150℃下微波处理15min,然后冷却,过滤并且直接注入C-18HPLC(Water’s X-Bridge C18 19x 100mm柱;使用包含0.05%TFA的0%-50%乙腈水溶液的梯度)。将ER-886912和ER-886913分别浓缩至干燥,溶于MeOH(3mL)并且经碳酸盐浸渍的硅胶柱(Biotage Isolute SPE,Si-CO3,1g)洗脱,用MeOH(3mL)洗涤,在真空中浓缩以及干燥以得到作为第一洗脱峰的ER-886912(1.4mg,0.003mmol,3.9%收率)和作为第二洗脱的ER-886913(0.6mg,0.001mmol,1.5%收率)。任意指定两种实例的胺的官能团的立体化学。
ER-886131的制备:经由方案27的方案7的修改:
方案27
将可商购的(S)-2-丙基环氧乙烷95(3.0g,34.8mmol,R=乙基)在氢氧化铵(100mL)中的经搅拌的溶液进行密封并且搅拌24h,然后与甲苯(每次100mL)共沸三次至干燥。将粗制的无色产物(S)-1-氨基戊-2-醇96(R=乙基)未经纯化用于下一反应。
向粗制的96(0.987mg,9.57mmol)在EtOH(20mL)中的经搅拌的溶液添加(S)-甲基2-氯丙酸酯97(1.568g,11.5mmol,R’=甲基),然后升温至70℃并且搅拌24h。将完成的反应物冷却至室温,浓缩至干燥并且将残余物溶于EtOAc(20mL)。将有机溶液用1N HCl水溶液(每次5mL)、盐水(5mL)洗涤三次,经MgSO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(Biotage,用庚烷中的20%–100%EtOAc的梯度洗脱)纯化,以得到(S)-2-氯-N-((S)-2-羟基戊基)丙酰胺98(0.356g,1.839mmol,19.2%收率,R=乙基;R’=甲基)。
在0℃下向98(0.356g,1.839mmol)在THF(22mL)中的经搅拌的溶液添加氢化钠(294.2mg,7.277mmol,60%油状分散体)。将反应在0℃下搅拌30min,然后升温至室温并且再搅拌5h。将完成的反应用IPA(1mL)缓慢淬灭,然后添加H+形式的Dowex 50,直到所示为中性pH。将悬浮液进行过滤并且用IPA(每次5mL)洗涤两次。将滤液进行浓缩,然后经硅胶(Biotage 25g,用EtOAc洗脱)纯化。在收集所需部分、在真空中浓缩和干燥后,获得顺式与反式之比为2:1的(2S,6S)-2-甲基-6-丙基吗啉-3-酮和(2R,6S)-2-甲基-6-丙基吗啉-3-酮99(168.2mg,1.07mmol,58.2%收率,R=乙基;R’=甲基)的混合物。
在室温下向99(168.2mg,1.07mmol)在THF(0.8mL)中的经搅拌的溶液在2min内逐滴添加1M四氢铝酸锂(1mL,1mmol)。将反应再搅拌2.5h,此后将完成的反应冷却至0℃,然后添加水(0.43mL)和1M氢氧化钠水溶液(0.03mL),然后搅拌30min。将所得的沉淀经硅藻土454过滤并且用EtOAc(2mL)、DCM(2mL)和乙醚(2mL)洗脱。将合并的滤液在真空中浓缩并且干燥,以得到粗制的(2R,S;6S)-2-甲基-6-丙基吗啉100(R=乙基;R’=甲基),其将直接用于下一反应。
将粗制的100溶于NMP(150mL),然后将3(150mg,0.636mmol)和DIPEA(0.2mL,1.1mmol)溶于其中。将混合物在145℃下微波处理7h,此后将冷却的混合物直接注入C-18反相制备型HPLC柱,其中用具有0.1%TFA的10%-60%乙腈水溶液洗脱。将两种洗脱的部分分别浓缩至干燥,与MeOH(每次5mL)共沸两次。将各个异构体溶于MeOH(2mL)并且经过硅胶(硅胶-CO2)的碱性塞,其中用MeOH(每次2mL)洗脱两次,然后在真空中浓缩和干燥以分别得到ER-886131(101)(64.2mg,0.217mmol,34.2%收率,顺式异构体,R=乙基,R’=甲基)和ER-886132(102)(25.2mg,0.85mmol,13.4%收率,反式异构体,R=乙基;R’=甲基)。
以与ER-886131相似的方式制备ER-886212(315.2mg,0.975mmol,8.5%总收率),其中以可商购的(S)-1-氨基庚-2-醇90(3.08g,23.5mmol,R=正丁基)和(S)-甲基2-氯丙酸酯97(1.568g,11.5mmol,R’=甲基)起始。
使用方案28的101的可选实例:
方案28
ER-886211的制备:
在氮气气氛下,向2-乙基环氧乙烷103(621mg,8.61mmol,R=乙基)在DCM(60mL)中的经搅拌的溶液添加苄胺(996mg,9.30mmol),然后添加三氟甲磺酸钪(341mg,0.693mmol)。将反应混合物在室温下搅拌20h,此后将完成的反应用饱和NaHCO3(20mL)淬灭,用DCM(每次10mL)萃取三次,并且将合并的有机层经MgSO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(Biotage 25g,用比率为10:10:0.1的庚烷:EtOAc:TEA洗脱)纯化,以在真空中浓缩合并的所需部分并且干燥后得到1,1’-(苄基脲二基)双(丁-2-醇)104(658mg,2.628mmol,30.4%收率,R=乙基)。
向104(584mg,2.323mmol)在水(0.3mL)中的经搅拌的溶液在5min内缓慢添加浓硫酸(2mL),此后将反应在150℃下加热2h。将完成的反应冷却至室温并且在搅拌下缓慢倾入饱和NaHCO3(20mL)。将混合物用DCM(每次10mL)萃取两次,并且用水(5mL)、盐水(5mL)洗涤合并的有机层,经MgSO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(Biotage 25g,以比率为2:1的庚烷:EtOAc洗脱)纯化,以在真空中分别浓缩合并的所需部分并且干燥后,得到(3S,5R)-1-苄基-3,5-二乙基哌啶105(234.2mg,1.003mmol,43.2%收率,R=乙基)和(3R,5R)-1-苄基-3,5-二乙基哌啶106(190.2mg,0.815mmol,35.1%收率,R=乙基)。
向105(107.1mg,0.462mmol)在MeOH(5mL)中的经搅拌的溶液添加5%钯活性碳(250mg),然后用氢气对烧瓶进行几次充气。在氢气气氛(气球压力)下将反应维持在室温并且搅拌12h,此后将反应物用氮气吹扫几次,同时在吹扫间隔用真空清扫抽空系统。将完成的反应物经硅藻土545过滤,将滤垫用MeOH(每次2mL)洗涤两次,然后在真空中浓缩并且干燥合并滤液的浓缩物。将粗产物(3S,5R)-3,5-二乙基哌啶107(0.066g,0.462mmol,99.9%收率,R=乙基)未经纯化用于下一步。
向107(0.066g,0.462mmol,R=乙基)在NMP(2mL)中的经搅拌的溶液添加DIPEA(0.13mL,0.728mmol)和3(86.3mg,0.370mmol)。将反应混合物在150℃下微波处理1h,此后将其经反相制备型HPLC柱(Water’s X-Bridge C18 19x 100mm柱;使用包含0.05%TFA的0%-50%乙腈水溶液的梯度)直接纯化,以在合并所需收集的部分、在真空中浓缩和干燥后得到101或ER-886211(45.2mg,0.153mmol,41.4%收率,R=乙基)的类似物。
其它实例:
ER-885113:在室温下,在氮气气氛中,向2-(二叔丁基膦基)联苯基(20mg,0.067mmol)和三(二亚苄基丙酮)二钯(0)(20mg,0.022mmol)在甲苯(0.8mL)中的经搅拌的溶液添加可商购的5-溴-8-甲氧基喹啉(201mg,0.844mmol)、叔丁醇钠(122mg,1.27mmol)和顺式-2,6-二甲基吗啉(125mg,1.085mmol),然后添加甲苯(0.8mL)。将反应混合物升温至回流并且搅拌3h,此后将完成的反应冷却至室温,然后添加水(5mL)。将所得的混合物用EtOAc(每次5mL)萃取两次,并且用盐水(2mL)洗涤合并的有机层,经Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(Biotage SP4,25+S,用庚烷中的12%–100%EtOAc洗脱)纯化两次,以在收集所需的部分、在真空中浓缩和干燥之后得到ER-885113(49mg,0.180mmol,21.3%收率)。
以与ER-885113相似的方式制备ER-887960(13.7mg,0.049mmol,23.5%收率),其中以5-溴-8-氯-1,7-萘啶(51mg,0.210mmol)和顺式-2,6-二甲基吗啉(31.4mg,0.273mmol)起始。
ER-886133和ER-886134:将(S)-2-((苄氧基)甲基)环氧乙烷(65g,0.396mol)和28%NH4OH在水中的溶液在室温下搅拌14h,此后将完成的反应进行浓缩并且与甲苯(每次150mL)共沸两次,以获得呈粗制白色固体状的(S)-1-氨基-3-(苄氧基)丙-2-醇(70.6g,0.390mol,98%收率)。
向粗制的(S)-1-氨基-3-(苄氧基)丙-2-醇(54.4g,0.300mol)在乙醇(400mL)中的经搅拌的溶液在30min内逐滴添加(R)-(+)-2-氯丙酸甲酯(40.44g,0.330mol)。将反应加热至75℃并且搅拌16h,此后将完成的反应物浓缩至干燥。将粗制混合物用EtOAc(200mL)稀释,用1NHCl水溶液(100mL)、盐水(100mL)洗涤,经Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(Biotage,用庚烷中的30%–80%EtOAc的线性梯度洗脱)纯化,以在合并所需部分、在真空中浓缩和干燥之后得到(R)-N-((R)-1-(苄氧基)丙-2-基)-2-氯丙酰胺(65.7g,0.239mol,79.7%收率)。
在0℃下向(R)-N-((R)-1-(苄氧基)丙-2-基)-2-氯丙酰胺(8.8g,0.032mol)在THF(440mL)中的冷却的经搅拌的溶液在10min内分批添加NaH(5.181g,0.130mol,作为60%油状分散体)。将反应混合物在0℃下搅拌,然后使其缓慢升温至室温并且再搅拌6h。将完成的反应用IPA(20mL)缓慢淬灭,然后添加Dowex 50(H+树脂)(30g),然后搅拌直到取得酸性pH。将淬灭的悬浮液进行过滤,用EtOAc(50mL)洗涤并且浓缩至干燥。将粗产物经硅胶(200g,用庚烷中的30%-50%梯度的EtOAc洗脱)纯化,以在合并所需部分、在真空中浓缩和干燥之后,得到(2S,6S)-6-((苄氧基)甲基)-2-甲基吗啉-3-酮(6.12g,0.026mol,81.3%收率)。
在室温下,在氮气气氛中向(2S,6S)-6-((苄氧基)甲基)-2-甲基吗啉-3-酮(6.12g,0.026mol)在THF(20mL)中的经搅拌的溶液在15min内逐滴添加THF(30mL,0.030mol)中的1M四氢铝酸盐。将反应混合物搅拌2.5h,此后将其冷却至0℃,然后缓慢添加水(13mL),并且然后添加1N NaOH水溶液(0.9mL)。将淬灭的反应进行搅拌,直到沉淀变成颗粒状,此后添加硅藻土545(10g),然后经硅藻土垫过滤并且用DCM(30mL)和乙醚(30mL)冲洗三次。将合并的滤液进行浓缩并且经硅胶(Biotage,用DCM中的0%–5%MeOH的梯度洗脱)纯化,以在合并所需部分、在真空中浓缩和干燥之后得到(2S,6S)-2-((苄氧基)甲基)-6-甲基吗啉(2.7g,0.012mol,46.2%收率)。
向(2S,6S)-2-((苄氧基)甲基)-6-甲基吗啉(2.7g,0.012mol)在DCM(50mL)中的经搅拌的溶液添加二碳酸二叔丁酯(6.807g,0.031mol),然后添加TEA(4.35mL,0.031mol)和DMAP(100mg,0.82mmol)。将反应在室温下搅拌3h,此后用0.1N HCl(50mL)和盐水(50mL)洗涤完成的反应物。将有机相进行浓缩,然后经硅胶(Biotage,用庚烷中的10%–20梯度的EtOAc洗脱)纯化,以在合并所需部分、在真空中浓缩和干燥之后获得(2S,6S)-叔丁基2-((苄氧基)甲基)-6-甲基吗啉-4-甲酸酯(3.68g,11.4mmol,95.4%收率)。
向(2S,6S)-叔丁基2-((苄氧基)甲基)-6-甲基吗啉-4-甲酸酯(3.102g,9.7mmol)在乙醇(15mL)中的经搅拌的溶液添加5%钯碳(300mg),然后抽真空并且用氢气对反应容器进行三次充气。在维持氢气气氛(气球压力)下将反应加热至40℃并且搅拌过夜,此后将反应物用氮气吹扫几次,同时在吹扫间隔用真空清扫抽空系统。将完成的反应物经硅藻土545过滤,将滤垫用乙醇(每次10mL)洗涤两次,然后在真空中浓缩并且干燥合并滤液的浓缩物。将粗产物(2S,6S)-叔丁基2-(羟甲基)-6-甲基吗啉-4-甲酸酯(2.15g,9.3mmol,95.8%收率)未经进一步纯化用于下一步。
在室温下向(2S,6S)-叔丁基2-(羟甲基)-6-甲基吗啉-4-甲酸酯(200mg,0.865mmol)在DCM(5mL)中的经搅拌的溶液添加TFA(0.5mL,6.7mmol)。将反应混合物搅拌1h,此后将其进行浓缩并且与甲苯(每次5mL)共沸两次至干燥并且在真空中干燥。将粗制去保护的吗啉在搅拌下溶于DMAC(1mL),然后将DIPEA(0.23mL,1.3mmol)和化合物3(152.4mg,0.654mmol)溶于其中。将反应混合物在140℃下微波处理并且搅拌3h,此后将完成的反应冷却至室温,浓缩并且经硅胶(Biotage,用庚烷中的30%–80%EtOAc洗脱)纯化,以在真空中浓缩所需合并的部分以及干燥之后得到5-((2S,6S)-2-(羟甲基)-6-甲基吗啉代)喹啉-8-甲腈或ER-885477(165.2mg,0.583mmol,89.2%收率)。
在-78℃下,在氮气气氛中,向双(2-甲氧基乙基)氨基三氟化硫(0.044mL,0.239mmol)在DCM(2mL)中的冷却的经搅拌的溶液在3min内逐滴添加DCM(2mL)中的ER-885477(50.4mg,0.178mmol)。将反应混合物升温至-50℃并且搅拌30min,此后将其升温至0℃并且搅拌1.5h。用逐滴添加饱和NaHCO3直到观察到碱性pH(~5mL)来缓慢淬灭完成的反应。将混合物用DCM(10mL)稀释,分离各层,此后将有机层用水(每次5mL)洗涤两次,经MgSO4干燥,过滤并且浓缩。将粗产物经反相HPLC柱(X-Bridge C18 19x 100mm柱;用具有0.1%甲酸的10%–90%乙腈水溶液的线性梯度洗脱)纯化,并且浓缩所需峰,然后在高真空下干燥以得到ER-886133(35.2mg0.123mmol,69.3%收率)。
向ER-885477(25.2mg,0.089mmol)添加亚硫酰氯(2mL),然后升温至85℃并且搅拌24h。将完成的反应与甲苯(每次5mL)共沸两次而浓缩至干燥。将粗产物经反相HPLC柱(X-Bridge C18 19x 100mm柱;用具有0.1%甲酸的10%–90%乙腈水溶液的线性梯度洗脱)纯化,并且浓缩所需峰,然后在高真空下干燥以得到ER-886134(2.1mg0.007mmol,7.8%收率)。
使用方案14制备ER-889363:向3-丁烯胺盐酸盐62(5.45g,50.6mmol)在DCM(33mL)中的经搅拌的悬浮液添加NaHCO3(110g),然后添加邻硝基苯磺酰氯(13.5g,60.8mmol)。将所得的混合物在室温下剧烈搅拌2h,此后添加苯肼盐酸盐(2.9g,20mmol)并且再持续搅拌1h。将完成的反应混合物用MTBE(70mL)萃取,然后依次用20%柠檬酸水溶液(35mL)、水(35mL)洗涤并且浓缩。将所得的紫色固体(13.32g)溶于NMP(70mL)并且添加碳酸钾(21g,0.15mol),然后添加(R)-缩水甘油苄醚6(9.98g,60.8mmol)。将混合物加热至50℃并且搅拌22h,此后将其用水(300mL)稀释并且用MTBE(每次200mL)萃取两次。将所有有机层进行合并以及浓缩,以产生橙色油状物,将其进行硅胶柱色谱法(正庚烷/MTBE 1:1)以产生呈橙色油状的64(7.90g,18.8mmol,37%收率,在2个步骤中)。
在室温下向64(7.90g,18.8mmol)在DMAC(94.8mL)中的经搅拌的溶液添加乙酸铜(II)(0.853g,4.70mmol),然后添加PdCl2(0.416g,2.35mmol)。在室温下将所得的混合物在O2(气球)下搅拌16h,此后添加额外的PdCl2(0.200g,1.13mmol),以及将混合物加热至40℃并且搅拌6h。将完成的反应用吡啶(4.5mL,56mmol)淬灭,搅拌5min然后用MTBE(400mL)稀释。用水(250mL)洗涤混合物,并且分离有机层,浓缩。将粗制黄色油状物通过硅胶柱色谱法(正庚烷/MTBE 1:1)纯化,以产生65(0.740g,1.77mmol,9.4%收率,31%收率(基于回收的物质))。
在0℃下向65(1.480g,3.54mmol)在DCM(14.8mL)中的冷却的经搅拌的溶液添加三乙基硅烷(2.96mL,18.6mmol),然后添加TFA(4.44mL,57.6mmol)。将反应混合物在0℃搅拌1h,此后将混合物升温至室温并且再搅拌1h。将完成的反应混合物与甲苯(每次60mL)共沸两次,然后通过硅胶柱色谱法(正庚烷/MTBE 1:1)纯化以产生呈黄色油状的66(1.382g,3.29mmol,92%收率)。
向66(1.382g,3.29mmol)在DMF(8.3mL,0.11mol)中的经搅拌的溶液添加碳酸钾(1.45g,10.5mmol),然后添加苯硫醇(0.360mL,3.50mmol)。将所得的混合物在40℃加热持续2h,此后将完成的反应用水(12mL)稀释。添加二碳酸二叔丁酯(0.897g,4.11mmol),然后在室温下搅拌1h。将完成的反应用水(29mL)稀释并且用MTBE(每次40mL)萃取两次,以及将合并的有机层进行浓缩以产生黄色油状物。将粗产物通过硅胶柱色谱法(正庚烷/MTBE 4:1)纯化,以得到呈无色油状的67(847mg,2.52mmol,77%收率)及其呈无色油状的67的立体异构体(8.3mg,0.25mmol,7.5%收率)。
在室温下向67(0.847g,2.52mmol)在DCM(4.2mL)中的经搅拌的溶液添加TFA(4.2mL,0.055mol)并且搅拌30min。将完成的反应混合物进行浓缩,与甲苯(20mL)共沸并且分配于饱和NaHCO3(8.5mL)与DCM(20mL)之间。分离有机层,经MgSO4(2.0g)干燥,过滤并且浓缩至干燥。将粗制中间体溶于NMP(2.12mL)中,随后将DIPEA(0.66mL,3.8mmol)溶于其中,然后将3(0.706g,3.03mmol)溶于其中。将所得的混合物加热至140℃并且搅拌2h,此后将完成的反应冷却至室温并且分配于EtOAc(40mL)与水(20mL)之间。将水层用EtOAc(20mL)萃取以及将合并的有机层用水(10ml)洗涤,并且进行浓缩以产生呈褐色固体/油状的粗产物。将粗产物经硅胶(用1:1的正庚烷/EtOAc洗脱)纯化以产生所需中间体:3的4:1混合物(0.684mg)。
将粗制中间体混合物(0.684mg)悬浮于乙腈(6.0ml),然后将三甲基碘硅烷(0.377mL,2.65mmol)悬浮于其中,然后加热至60℃并且搅拌2h。将完成的反应冷却至40℃,然后添加水(3.0ml),以及将反应冷却至室温并且再搅拌1h。添加28%的氢氧化铵水溶液(1.0mL)并且将所得的混合物用EtOAc(每次20mL)萃取两次,此后将合并的有机层进行浓缩,然后经硅胶(用100%EtOAc洗脱)纯化以产生呈黄色固体状的68或ER-889363(404mg,1.36mmol,53%收率)。
向ER-889363(355mg,1.194mmol)在DCM(4mL)中的经搅拌的溶液添加对甲苯磺酰氯(350mg,1.836mmol),然后添加DIPEA(0.32mL,1.837mmol)和DMAP(10mg,0.082mmol)。将反应混合物在室温下搅拌16h,此后用水(2mL)和盐水(2mL)洗涤完成的反应物,然后经Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(Biotage,SP4,25+M,用庚烷中的10%–60%EtOAc洗脱,经20个柱体积)纯化。将所需的部分进行合并,在真空中浓缩并且干燥以得到((2R,7R)-4-(8-氰基喹啉-5-基)-7-甲基-1,4-氧杂氮杂环庚烷-2-基)甲基4-甲基苯磺酸酯(476.6mg,1.056mmol,88.4%收率)。
将((2R,7R)-4-(8-氰基喹啉-5-基)-7-甲基-1,4-氧杂氮杂环庚烷-2-基)甲基-4-甲基-苯磺酸酯(19.4mg,0.043mmol)和1,4’-联哌啶(30mg,0.178mmol)溶于DMAC(0.5mL),然后在150℃下微波处理10min。将冷却的反应物用乙腈(0.5mL)稀释,过滤并且经反相HPLC(XbridgeC18柱,用包含0.1%甲酸的10%–40%乙腈水溶液的梯度洗脱)纯化。浓缩合并的所需部分,用MeOH(1ml)稀释并且经过碱性SiCO3柱,用MeOH(2mL)洗脱,然后在真空中浓缩并且干燥以得到ER-889822(11mg,0.025mmol,57.2%收率)。
其它实例:
ER-890094:将(3-(溴甲基)苯基)硼酸(129.5mg,0.603mmol)和1,4’-联哌啶(190mg,1.129mmol)在DMAC(1mL)中的溶液在150℃下微波处理10min,此后将反应物进行冷却并且浓缩至干燥,以作为粗制的(3-([1,4’-联哌啶]-1’-基甲基)苯基)硼酸用于下一步。
将包含3(44.5mg,0.191mmol)、粗制的(3-([1,4’-联哌啶]-1’-基甲基)苯基)硼酸(86.5mg,0.286mmol)、乙酸钯(II)(6mg,0.027mmol)、2-二环己基膦基-2’,6’-二甲氧基联苯基(12mg,0.029mmol)以及1M碳酸钠水溶液(0.029ml,0.029mmol)在EtOH(0.6mL)和甲苯(0.6mL)中的经搅拌的溶液加热至70℃持续16h。将完成的反应物进行冷却,用DCM(10mL)稀释,用水(3mL)洗涤,经Na2SO4干燥,过滤并且浓缩至干燥。将粗产物用1:1的DMSO:乙腈(2mL)稀释,并且通过HPLC(Xbridge C18,用包含0.1%甲酸的10%–40%乙腈水溶液洗脱)直接纯化。收集所需产物并且浓缩至干燥。将所得产物溶于MeOH(2mL),并且经过碱性二氧化硅塞(Biotage,1g,SiCO3),用MeOH(5mL)洗脱,以在真空中浓缩和干燥后得到ER-890094(5mg,0.012mmol,6.3%收率)。
以与ER-890094相似的方式制备ER-890244(63.2mg,0.153mmol,27.3%总收率),其中以(4-(溴甲基)苯基)硼酸(134.2mg,0.625mmol)和1,4’-联哌啶(125mg,0.564mmol)起始。
ER-888200:将包含3(251mg,1.077mmol)、(3-甲酰基-5-甲基苯基)硼酸(350mg,2.135mmol)、双(三苯基膦)氯化钯(II)(150mg,0.214mmol)、氯化锂(91mg,2.147mmol)、碳酸钠(230mg,2.17mmol)和10%碳酸钠水溶液(2.3ml)在DMF(11mL)中的经搅拌的溶液加热至90℃,持续3h。将冷却的反应物在搅拌下用EtOAc(48mL)和水(12mL)稀释,然后通过硅藻土545(1.2g)过滤,用EtOAc(10ml)洗脱。将分离的水层用EtOAc(每次12mL)萃取两次,并且用水(24mL)和盐水(24mL)洗涤合并的有机层,然后经Na2SO4干燥,过滤并且浓缩至干燥。将粗产物经硅胶(Biotage SP4,Interchim 25g,用庚烷中的20%–100%EtOAc洗脱)纯化,此后将所需产物部分进行合并,在真空中浓缩以及干燥以得到ER-888200(163mg,0.599mmol,55.6%收率)。
ER-888201:向ER-888200(21mg,0.077mmol)在冷却至0℃的MeOH(2.1mL)中的经搅拌的溶液添加四氢硼酸钠(3.2mg,0.085mmol)。将反应混合物搅拌1h,此后添加水(2.1mL),将混合物浓缩至一半体积,然后用EtOAc(19mL)萃取。用盐水(3.9mL)洗涤有机层,经Na2SO4干燥,过滤并浓缩至干燥以得到ER-888201(17.4mg,0.63mmol,82.4%收率)。
ER-888644:向ER-888201(91mg,0.332mmol)在DCM(1.8mL)中的经搅拌的溶液添加对甲苯磺酰氯(101mg,0.530mmol),然后添加DMAP(2mg,0.016mmol)和DIPEA(1.8mL,1.03mmol)。将反应混合物在室温下搅拌3h,此后添加额外的对甲苯磺酰氯(101mg,0.530mmol),然后搅拌2h。将完成的反应物在搅拌下用水(1mL)和DCM(5.2mL)稀释。分离各层并且将有机层用盐水(1mL)洗涤,经Na2SO4干燥,过滤并浓缩至干燥。将粗产物经硅胶(Biotage SP4,Interchim 25g,用庚烷中的20%–100%EtOAc洗脱),此后将所需产物部分进行合并,在真空中浓缩以及干燥以得到ER-888644(63mg,0.212mmol,65%收率)。
ER-888645:将ER-888644(20mg,0.068mmol)和4-羟基哌啶(70mg,0.692mmol)在N-甲基吡咯烷酮(2mL)中的溶液在150℃下微波处理15min。将冷却的反应物用NMP(4mL)进行稀释并且通过HPLC使用C-18柱(Xbridge C18,用包含0.1%TFA的10%–40%乙腈水溶液洗脱)直接纯化。收集所需产物并且浓缩至干燥。将所得的产物溶于MeOH(2mL),并且经过碱性二氧化硅塞(Biotage,1g,SiCO3),用MeOH(5mL)洗脱,以在真空中浓缩和干燥后得到ER-888645(19.9mg,0.056mmol,81.5%收率)。
以与ER-888645相似的方式制备ER-888646(17.9mg,0.047mmol,68.1%收率),其中以ER-888644(20mg,0.068mmol)和4-二甲基氨基哌啶(87.6mg,0.683mmol)起始。
以与ER-888645相似的方式制备ER-888647(15.3mg,0.043mmol,62.8%收率),其中以ER-888644(20mg,0.068mmol)和1-甲基哌嗪(68.4mg,0.683mmol)起始。
以与ER-888645相似的方式制备ER-889504(46mg,0.108mmol,62%收率),其中以ER-888644(51mg,0.174mmol)和1,4’-联哌啶(102mg,0.606mmol)起始。
一般筛选测定和药理学策略
为了鉴定有效的和选择性的TLR7/8化合物,故对全部人TLR4、TLR7和TLR9报告物系的基于细胞的组初步筛选类似物(更多细节参见“药理学材料与方法”)。在原代人PBMC测定中,还测试了对TLR7有效的和选择性的化合物子集对TLR8的活性(见以下表3)和对TLR7/8的效能(更多细节参见“药理学材料与方法”)。将某些化合物推进入短期体内(STIV)测定,以测定对小鼠TLR7的剂量依赖性活性和作用持续时间(更多细节参见“药理学材料与方法”)。然后评估所选择的化合物对以下小鼠狼疮疾病模型BXSB-Yaa、NZBxNZW和姥鲛烷DBA/1中的一种或多种的影响。
当在细胞系或原代细胞上表达的这些受体受到合成的小分子(CL097,R848)或核酸(RNA)配体刺激时,本文中的实施方案报道的许多化合物显示了对人TLR7和小鼠TLR7及人TLR8的纳摩尔效能。相反地,本文的实施方案中所报道的大多数化合物对TLR9途径是无活性的。
现有狼疮SOC药物包括诸如氯喹和羟氯喹(HCQ)的抗疟药物,其已经显示可在体外抑制TLR7/9活化。这可以至少部分地解释这些药物在控制狼疮突发中的有效性。然而,本公开内容的实施方案已经显示出提供更显著有效的抑制。例如,发现化合物ER-899742(以上所示和讨论的)对RNA-Ig TLR7/8刺激物的效能比HCQ对RNA-Ig TLR7/8刺激物的效能高约1000倍(IC50=0.0009μM,HCQ IC50~1.5μM)。这表明ER-899742将提供比现有狼疮治疗更有效的TLR7/8途径抑制。这通过以下表1中显示的结果得以证实。
表1.化合物ER-899742相对于羟氯喹(Plaquenil)的效能和选择性。
在体外药理学中,如以下所述在HEK 293细胞系中使用克隆的TLR7和TLR8进一步研究了ER-899742相对于羟氯喹的比较效能。还比较了对小鼠TLR7的效果。在读取发光强度之前,将细胞用TLR7/8激动剂CL097以预设的ED70-80刺激过夜:对于HEK-hTLR7为3μg/ml,对于HEK-mTLR7为1.5μg/ml和对于HEK-hTLR8为12μg/ml。进行三个测试并且使用Graphpad Prism 6非线性回归曲线拟合测定IC50值。在表2中示出了单个测试结果及其平均值。数据表明在这个测定中,ER-899742在HEK/TLR7细胞系中具有0.024μM的平均IC50,在HEK/TLR8细胞系中具有0.0024μM的平均IC50。
表2.ER-899742相对于羟氯喹对TLR7和TLR8响应的作用。
1mTLR7、小鼠TLR7;hTLR7、人TLR7;hTLR8、人TLR8
表3.在HEK-293测定形式中所选化合物对人TLR8的效能(更多细节参见“材料与方法”)。
短期体内(STIV)测定:为了体内评估化合物对于小鼠TLR7的效能,利用了短期体内(STIV)测定。简而言之,将化合物口服给药于小鼠,然后在各个时间点对小鼠皮下注射激动剂R848以刺激TLR7。然后在R848刺激之后,通过ELISA测量血浆IL-6水平以评估化合物效能和作用持续时间。重要的是,利用TLR7缺陷小鼠,在用R848进行体外或体内刺激之后,细胞因子的产生显示出完全为TLR7依赖性的。因此,在STIV测定中,化合物的活性可以确信地归因于对TLR7途径的调节。ER-899742在300mg/kg的单一口服剂量完全抑制体内R848/TLR7/IL-6途径至少24小时(参见图1A和图1B)。在以下表4中示出了一组化合物的STIV测定效能的汇总。
表4.所选化合物的短期体内(STIV)测定数据的汇总。
X=小鼠无法耐受此剂量
*在12只小鼠中发现4只小鼠与化合物不相容
X=小鼠无法耐受此剂量
小鼠狼疮疾病模型。选择两种不同的狼疮疾病模型(NZB/W和姥鲛烷)用于化合物POC评估,因为(1)NZB/W品系患有具有多基因病因学的自发性疾病,显示出人狼疮的许多标志,例如DNA相关的自身反应性、蛋白尿和免疫复合物介导的肾炎,以及(2)已经报道了对于两种疾病模型的阳性TLR7和/或TLR9靶标验证结果。
在SLE疾病模型中对于ER-899742的关键发现如下(参见图2A-图2C、图3A-图3E和图7A-图7G以及表7):
1)以33mg/kg至300mg/kg的几种剂量的ER-899742在NZB/W模型中提供了显著的存活益处,这与肾小球肾炎的显著降低的蛋白尿和组织学病症相一致。
2)ER-899742在姥鲛烷模型中抑制多种自身抗体特异性,尤其强烈影响了RAN相关的反应性例如抗-RiboP滴度。在这个模型中,全血中一些IFN调节基因的表达降低由ER-899742的治疗造成。还在这个模型中观察到ER-899742对关节炎的控制。
在SLE疾病模型中对于ER-899464的关键发现如下(参见图4-图5):
1)以33mg/kg至300mg/kg的几种剂量的ER-899464在NZB/W模型中提供了显著的存活益处,连同显著降低的蛋白尿。
2)ER-899464在姥鲛烷模型中抑制多种自身抗体特异性,尤其强烈影响了RAN相关的反应性例如抗-RiboP滴度。
药理学材料与方法:
体外药理学:
将HEK-293细胞(ATCC)设计成稳定表达NF-κB转录因子可诱导的E-选择素(ELAM-1)荧光素酶报告物,所述荧光素酶报告物来源于包含来自人E-选择素基因(登记号NM_000450)的启动子的碱基对-2241bp至-254bp的质粒pGL3(Promega)。随后将这些细胞设计成稳定地并分别地表达人TLR4、TLR7或TLR9全长ORF cDNA。将人TLR4cDNA(登记号NM_138554)克隆至pcDNA 3.0表达载体(Invitrogen)中。还将TLR4转染的细胞设计成表达人MD-2共受体[将MD-2cDNA(登记号NM_015364)克隆至pEF-BOS载体],并且在培养基中补充10nM可溶的CD14(R&D Systems)以使LPS响应性最优化。将人TLR9cDNA(登记号NM_017442)克隆至pBluescript II KS载体(Agilent)中。从OriGene获得人TLR7cDNA(登记号NM_016562)。稳定表达人TLR8(登记号NM_138636)或小鼠TLR7(登记号NM_133211)的HEK-293细胞购自于InvivoGen,并且然后用pNiFty2(NF-κB)-荧光素酶报告物质粒(InvivoGen)稳定转染。将在包含10%胎牛血清(FBS)的达尔伯克改良伊格尔培养基(DMEM)中密度为2.22×105个细胞/ml的各个细胞类型接种至384孔板中,并且在37℃、5%CO2下孵育2天。然后添加不同浓度的拮抗剂化合物。然后将细胞再孵育30分钟,之后添加以下适当的TLR激动剂(显示为最终浓度):10ng/ml的脂多糖(LPS;Sigma)用于TLR4、3μg/ml的CL097(InvivoGen)用于人TLR7和人TLR8以及小鼠TLR7、以及0.6μM的CpG-2006-2A[序列:TCGTCGTTAAGTCGTTAAGTCGTT(SEQ ID NO:1),具有硫代磷酸酯骨架,由Sigma-Aldrich合成]用于TLR9。然后将细胞孵育过夜,并且按照制造商建议的方案通过用(Promega)或SteadyliteTM(Perkin Elmer)试剂测量发光对NF-κB依赖性荧光素酶报告物活化进行定量。
基于人PBMC细胞的测定。从新鲜抽取的肝素化(10USP单位/ml,Hospira,Lakeforest,IL)的健康供体的全血中通过密度梯度离心(1077,Sigma,Inc.,St.Louis,MO)分离人外周血单核细胞(PBMC)。简而言之,将25ml血液在50ml圆锥管中用15ml PBS(不含Ca2+、Mg2+)稀释,并且使用脊椎穿刺针将12ml Histopaque置于下面。将管以1200rpm(350xg)离心45分钟,并且从血沉棕黄层收集PBMC。然后将细胞在PBS中洗涤两次,并且使红细胞在室温下通过在5ml氯化铵溶液(1X红细胞裂解缓冲液,eBioscience)中悬浮5分钟而裂解。在PBS中最终洗涤之后,将PBMC以2×106个/ml的最终浓度重悬浮于具有L-谷氨酰胺(Invitrogen)并且补充25mM HEPES(Mediatech,Inc,Manassas VA)、10%胎牛血清(HyClone,Logan,UT)和青霉素-链霉素-谷氨酰胺(Mediatech)的RPMI-1640培养基中,并且以100μl/孔(2×105个细胞/孔)接种于组织培养物处理过的96孔板(Falcon)中。
将溶解和连续稀释于100%DMSO中的拮抗剂化合物以一式三份添加至细胞以获得0.1%DMSO(v/v)的最终浓度。将溶解和连续稀释于PBS中的羟氯喹(Acros Organics)以一式三份添加至细胞。将PBMC与拮抗剂化合物或HCQ在37℃、5%CO2下孵育30分钟,之后以每孔100μl完全培养基添加以下各种TLR激动剂试剂(显示为最终浓度):1μM R848(瑞喹莫德;GLSynthesis,Worcester,MA)用于TLR7和TLR8,10ng/ml LPS(Sigma)用于TLR4,以及5μg/ml CpG-2216(InvivoGen)用于TLR9。为了制备模拟狼疮患者中包含RNA的自身抗体免疫复合物的TLR7/8激动剂,合成具有来自人U1snRNA茎环IV[(序列:GGGGGACUGCGU-UCGCGCUUUCCC(SEQ ID NO:2),具有硫代磷酸酯骨架]的序列的26-mer RNA(Dharmacon,Inc.,Lafayette,CO),其在之前已显示为有效的TLR7和TLR8激动剂。将这种RNA分子在无血清的RPMI中稀释至2.5μM,并且以1:25的稀释度或1μg/ml添加小鼠抗人单链DNA单克隆抗体(MAB3034,Millipore,Inc.,Billerica,MA),其还与RNA交叉反应。在添加至细胞之前,将产生的“RNA-Ig”刺激物在室温下孵育15-30分钟。将PBMC与各种TLR激动剂在37℃、5%CO2下孵育20小时。收集细胞培养上清液,并且根据制造商(BD Biosciences,Inc.,San Diego,CA)建议的方案通过标准ELISA程序如所示来评估各种人细胞因子的水平。在表5中显示了结果。在随后的测定(表6)中,检查了ER-899742阻断各种TLR7/8配体刺激正常PBMC,而不阻断TLR9的DNA介导的活化的能力。在该测定中,将细胞以1x 105个细胞/孔以100μl接种于96孔板。
表5--所选化合物的PBMC测定数据的汇总
表6.ER-899742相对于羟氯喹在跨越多个配体的人PBMC中的IL-6和IFN-α的阻断
1NA,未显示数据,因为值低于检测限,或者重复显示高的变化性
基于小鼠脾细胞的测定。从通过CO2安乐死的雌性BALB/c小鼠(Jackson Labs,Bar Harbor,ME)收获脾脏。通过将脾脏经过40μm尼龙细胞过滤器而获得单细胞悬浮液。用50ml PBS(Mediatech,Inc.,Manassas,VA)对细胞洗涤两次,并且将红细胞在室温下于5ml RBC裂解缓冲液(eBioscience,Inc.,San Diego,CA)中保持5分钟进行裂解。将细胞在PBS中再洗涤两次,并且最终以2.5×106个细胞/ml重悬浮于补充的RPMI-1640中。将细胞以100μl/孔(2.5×105个细胞/孔)接种于组织培养物处理过的96孔板中(Falcon)。将溶于100%DMSO中的连续稀释的化合物以一式三份添加至细胞,以获得0.1%DMSO的最终浓度。将细胞与化合物在37℃、5%CO2下孵育30分钟,然后添加100μl/孔的在完全培养基中的740nM R848(瑞喹莫德;GLSynthesis,Worcester,MA)至最终浓度为370nM R848。使细胞在37℃、5%CO2下孵育20小时。收集培养上清液,并且根据制造商(BD Biosciences,Inc.,San Diego,CA)建议的方案通过标准ELISA方法评估IL-6的水平。数据示于以下表7中。
表7-小鼠脾细胞结果
体内药理学:
短期体内(STIV)测定。通过灌胃口服200ul体积的在0.5%甲基纤维素水溶液(Sigma,St.Louis,MO)中配制的拮抗剂化合物对六周龄至八周龄的雌性BALB/c小鼠(Jackson Labs,Bar Harbor,ME)给药。在之后的各时间点,向小鼠皮下(s.c.)注射100μl体积的15μg R848(瑞喹莫德;GLSynthesis,Worcester,MA)以刺激TLR7。通过心脏穿刺收集血浆,然后根据制造商(R&D Systems)建议的方案通过标准ELISA方法评估在TLR7刺激之后1.5小时的IL-6的水平。
小鼠狼疮疾病模型品系。从Jackson Labs(Bar Harbor,ME)购买雌性NZBWF1/J小鼠,其显示具有自发性狼疮疾病。从Harlan Laboratories(Indianapolis,IN)购买雌性DBA/1小鼠,并且在指定鼠龄给予腹膜内注射0.5ml姥鲛烷(2,6,10,14-四甲基十五烷;Sigma,St.Louis,MO)以化学诱导狼疮疾病,或腹膜内注射0.5ml PBS以产生鼠龄一致的未患病的对照小鼠。
在图2A至图2C示出了实施方案的进一步测试,其显示了在NZBxNZW品系(在下文中缩写为NZBWF1/J或NZB/W)狼疮疾病模型中对ER-899742的测试。接收5周龄的雌性NZBWF1/J小鼠,进行基线取血,并且通过以下抗-dsDNA滴度监控小鼠的疾病进展。在27周龄时,将小鼠随机分成具有相等中值的抗-dsDNA滴度的小组,并且在29周龄用单独的媒介物(Veh;0.5%甲基纤维素)或者以33mg/kg、100mg/kg或300mg/kg每天一次口服(QD PO)治疗。在治疗17周后,在46周龄时,对小鼠取血并且测试抗-dsDNA滴度。在50周龄处死所有小鼠(21周的化合物治疗)。图2(A)显示在50周龄结束之前(21周的治疗后),从各个小鼠收集尿液,并且测定各只动物的尿白蛋白/肌酸酐比(UACR,蛋白尿)作为肾功能的间接量度。图2(B)显示了在本研究中对最高剂量组和最低剂量组所观察到的死亡率的时间进程。并未见到用化合物处理的死亡率。此外,在中剂量组中未观察到死亡率(未示出)。图2(C)显示在给药17周后,在46周龄时,治疗对抗-dsDNA滴度的影响。未观察到统计上的显著效果。
在实验结束时,以盲法从图2A至图2C中测试的动物收集肾脏,在10%福尔马林中固定24小时,包埋在石蜡中,并且产生H&E染色切片用于组织病理学评估(0/1+级:WNL至最低;2级:中等;3级:中等至明显;4级:严重)。结果示于表8中。
表8
通过ELISA评估自身抗体滴度。通过标准ELISA方法评价抗-dsDNA滴度、抗-Sm/nRNP滴度、抗-RiboP滴度和抗组蛋白滴度。简而言之,用100μl如下的含稀释抗原的PBS(显示最终浓度)对96孔EIA/RIA ELISA板(Corning)进行涂覆,在室温下保持90分钟:10U/mlSm/nRNP复合物(Immunovision)、10μg/ml小牛胸腺dsDNA(Sigma)、5U/ml RiboP(Immunovision)和5μg/ml组蛋白(Immunovision)。将板用PBS/0.05%Tween20(洗涤缓冲液)进行洗涤,并且用PBS/1%BSA(封闭缓冲液)在4℃封闭过夜。对板进行洗涤,将在封闭缓冲液中稀释的小鼠血浆样品(根据模型和抗原,以1:25-1:10,000进行稀释)以每孔100μl体积添加至孔,并且将板在室温下孵育90分钟。然后对板进行洗涤,将100μl以1:50,000稀释于PBS/1%BSA/0.05%Tween中的抗小鼠-IgG-HRPO(Southern Biotech)添加至各个孔,并且将板在室温下孵育90分钟。对板进行洗涤,并且将100μl来自OptEIA TMB底物试剂盒(BD Biosciences)的底物组分的1:1混合物添加至孔。在室温下孵育板,并且在充分显色后,通过添加100μl 0.18M硫酸溶液使反应停止。通过分光光度法在450nm对板进行读数。
蛋白尿的评估。从各只小鼠手动收集尿,或通过每个代谢笼饲养1-2只小鼠18小时来收集尿,并且对各个动物测定尿白蛋白/肌酸酐比(UACR)作为肾脏功能的间接量度(将UACR计算为每dL尿的白蛋白(mg)/肌酸酐(g)的比率)。使用抗小鼠白蛋白抗体组(Bethyl Labs)通过定制夹心ELISA方案测定尿样中的白蛋白水平,其中该抗体组包括包被抗体和用于检测的标记有HRP缀合物的二级抗体。使用商购的肌酸酐测试盒(Cayman)测定肌酸酐水平。
肾炎的组织学评估。以盲法从各只小鼠收集肾脏,将肾脏固定在10%福尔马林中24小时,包埋在石蜡中,并且产生H&E染色切片用于组织病理学评估。以下为肾炎疾病评分的特征:0级-正常限度;1级-带状毛细血管壁增厚;2级-细胞过多、细胞分裂、新月体形成;3级-参见2级,肾小球病变的严重程度和范围增加(受累肾小球%);4级-硬化;严重的肾小球疾病(非功能器官)。
评估全血中的干扰素基因表达。通过qPCR测量全血中IFN调节基因的表达。简而言之,使小鼠安乐死,经由腔静脉收集血液,并且将100μl保藏在包含RNAlater(Ambion,Austin TX)的管中。使用Mouse RiboPure血液RNA分离试剂盒(Ambion)分离总的RNA。使用NanoDrop ND-1000分光光度计(Thermo Scientific,Waltham MA)测定RNA浓度。使用VILOTM Master Mix(Life Technologies,Grand Island,NY)由100ng总RNA合成第一链cDNA。在逆转录之后,将cDNA用无核酸酶的水稀释并且与Fast Advanced Master Mix(Applied Biosystems)混合。然后将混合物应用于由Applied Biosystems制造的定制Low Density Array(TLDA),并且在ABI 7900HT快速实时PCR系统(Applied Biosystems)上进行qPCR。使用RQ Manager 1.2.1(Applied Biosystems)收集原始数据并且使用GeneData Analyst 2.2软件(GeneData)分析。
TLDA组包含多至45个选自以下表9的靶基因,和3个用于归一化的管家基因。基于变异系数,选择管家基因Hprt1用于进行归一化。对靶基因测定相对量,并且将该相对量用于计算各只患病小鼠相对于仅接受腹膜内注射PBS的未患病对照组的倍数变化。进行标准学生t检验以测定在未患病组(PBS治疗)与媒介物治疗的患病组(姥鲛烷治疗)之间何种靶基因显著增加,由此表示出疾病调节的基因组。对于图7G,使用在具有缺省选项的包装“碱基”中的p调节指令进行错误发现率(FDR)的修正。Holm,S.A simple sequentially rejective multiple test procedure.Scandinavian Journal of Statistics,1979.6(2):p.65–70。随后以t检验中所鉴定的所有疾病调节基因的中值倍数变化计算各只小鼠的“IFN评分”。
表9
- 还没有人留言评论。精彩留言会获得点赞!