一种来自灰黄链霉菌的L-谷氨酸氧化酶基因及其制备方法和应用与流程
本发明属于微生物基因工程领域,具体涉及一种来自灰黄链霉菌(Streptomyces griseoflavus)的L-谷氨酸氧化酶基因及其制备方法和应用。
背景技术:
L-谷氨酸的测定在味精生产、食品工业及临床检测中都十分重要。谷氨酸检测常用色谱法和酶法。色谱法由于受设备和前处理繁琐的限制,推广较难,酶法则常用谷氨酸脱氢酶和谷氨酸脱羧酶检测,但是它们底物专一性不强,且需要昂贵的辅酶才能反应。L-谷氨酸氧化酶(LGOX)是一种以黄素腺嘌呤二核苷酸(FAD)为辅基的黄素蛋白酶类,能专一地催化谷氨酸氧化成α-酮戊二酸、氨和过氧化氢,通过过氧化氢含量的变化可以方便地测定谷氨酸的含量,利用L-谷氨酸氧化酶研制出谷氨酸检测试剂盒和生物传感器,具有测量时间短、专一性好、操作方便等优点,可以评价食品的质量、实现味精发酵过程中在线检测与控制,因此受到了极大的重视。另一方面,在临床生化检验上,L-谷氨酸氧化酶可以用于测定肝脏中丙氨酸氨基转移酶、天冬氨酸氨基转移酶和r-谷氨酰基转移酶等的活性以及肌酐等的浓度,由L-谷氨酸氧化酶制成的微型传感器芯片还广泛用于大脑中纹状体、丘脑和皮层等不同部位神经通路的研究。
1983年,Kusakabe等从一株链霉菌X-119-6(Streptomyces sp.X-119-6)菌株中分离出底物特异性的L-谷氨酸氧化酶,以L-谷氨酸为底物的Km值仅为0.2mM,该酶耐热性较强,除催化L-谷氨酸氧化外,仅对L-天冬氨酸有微弱的催化作用。2006年日本Yamasa公司构建了链霉菌X-119-6基因组文库,通过探针筛选获得了LGOX基因,该基因长2103bp,编码701个氨基酸,含有14个信号肽序列,成熟的蛋白也是由α、β、γ三个亚基组成,一般组成二聚体形式,分子量大约为140KDa。他们构建大肠杆菌强启动子调控LGOX基因表达的载体,转化到大肠杆菌中,实现了LGOX前体蛋白在大肠杆菌的高效表达,表达的前体蛋白经过内切蛋白酶处理后具有更高的活性(US patent 7109008)。目前该产品转由Kikkoman公司生产并垄断了市场。
至今发现的LGOX全部来源于链霉菌,然而,不同分离菌株中LGOX的分子大小、比活性、对谷氨酸的专一性、最适pH值等均存在很大的差异,由于目前克隆获得的LGOX基因有限,造成这些差异的机制很不清楚。另外,由于LGOX生产相对滞后,至今所筛选到的 L-谷氨酸氧化酶产生菌的产酶能力大多很低,即使经过诱变,产酶能力也不高,因此获得新型LGOX基因并实现基因工程化生产成为解决该酶来源的根本途径。
技术实现要素:
本发明的目的在于提供一种来自灰黄链霉菌(Streptomyces griseoflavus)的L-谷氨酸氧化酶基因及其制备方法和应用,利用基因合成法制备L-谷氨酸氧化酶基因,并对该基因进行表达、纯化及酶的催化活性和底物谱分析,证明该基因对L-谷氨酸的专一催化活性较高,可作为L-谷氨酸含量检测用酶。
本发明从土壤中筛选获得一株产L-谷氨酸氧化酶的灰黄链霉菌,培养、提取总DNA,以L-谷氨酸氧化酶基因的保守序列设计引物进行PCR扩增,获得L-谷氨酸氧化酶基因的保守区域,利用染色体步移技术(Genome Walking)获得该基因的全长序列,得到了核苷酸序列如SEQ ID No.1所示的L-谷氨酸氧化酶基因。再利用基因合成方法合成出核苷酸序列如SEQ ID No.1所示的L-谷氨酸氧化酶基因,通过基因工程手段构建该基因表达载体并在大肠杆菌中表达,大大降低该L-谷氨酸氧化酶从野生菌中提取的成本,提高该L-谷氨酸氧化酶的催化活性。同时所述L-谷氨酸氧化酶底物专一性很强,能特异性地催化L-谷氨酸,可应用于L-谷氨酸含量检测。
为了达到上述目的,本发明的技术方案如下:
一种来自灰黄链霉菌的L-谷氨酸氧化酶基因,其核苷酸序列如SEQ ID No.1所示,其编码蛋白质的氨基酸序列如SEQ ID No.2所示。
一种来自灰黄链霉菌的L-谷氨酸氧化酶基因的制备方法,其是通过基因合成方法合成所述L-谷氨酸氧化酶基因,其中,所用的引物如下:
SgGOX1:ATGACTGAAGATCACGCGGTGGTGTGTTCTGAAAATGGTTTCTCCCGACGGGAGTTCGCG
SgGOX2:CGGCCAGGGCCGTCGCCACCGTGGCCGTGCCGGCCACCGCCGCGAACTCCCGTCGGGAGA
SgGOX3:GGTGGCGACGGCCCTGGCCGGCGGTACCGCCACGGCCCTGCCCGCGCCGGCCGCGCCGCT
SgGOX4:GGAGTCGGCGCCGCGACCGCCGCCGGGAAGGGCCGGGGCGAGCGGCGCGGCCGGCGCGGG
SgGOX5:GCGGTCGCGGCGCCGACTCCGACAGATGCCTCGCCGTCGCCCGTGCCCTGCTCGTCCTGG
SgGOX6:ACGCGCACGTAGCGCGGAACGAGGGGGCGGTCGTCGGAGTCCAGGACGAGCAGGGCACGG
SgGOX7:GTTCCGCGCTACGTGCGCGTCCTGAAAGACGGACTGCCGGCGCGACGGACCCGCCCCAAG
SgGOX8:TCACCAGCCCGGACGGGCCGGCGCCGATGACGAGGACGTCCTTGGGGCGGGTCCGTCGCG
SgGOX9:CGGCCCGTCCGGGCTGGTGACCGCCTGGCTGCTGAAGGAGGCGGGACACCGGGTGACGGT
SgGOX10:CTTGATGCGGCCGCCCGCCCGGTTGCCGTTGGCCTCCAGGACCGTCACCCGGTGTCCCGC
SgGOX11:GGGCGGGCGGCCGCATCAAGACCTTCCGAAAGGGCGGCCACGAAGGTGCCGGGCAGCCCT
SgGOX12:CGCATCGCGCCCGCCTCGGCGTACTGGCCGGGATCCGCGAAGGGCTGCCCGGCACCTTCG
SgGOX13:GCCGAGGCGGGCGCGATGCGTATCCCCGGCAGCCATCCGCTGGTGATGGAACTCATCGAC
SgGOX14:CGTCGACGTAGTGGAAGCGCCGCTTCTTCAGATCGAACCGGTCGATGAGTTCCATCACCA
SgGOX15:GCGCTTCCACTACGTCGACGTCGACGAGGAGGGACGTCCCGCCGCGCGCACCTGGATCCA
SgGOX16:GCGGGCGTAGTCGGCGCGCCGTACGCGGATGCCGTTGACGTGGATCCAGGTGCGCGCGGC
SgGOX17:GGCGCGCCGACTACGCCCGCTCGCCCCGGCGCGTGAACCGGTCCTTCGGTGTCCCGAAGG
SgGOX18:GCGGCACGCAGGATCGCTGCGGCGGGGGTGTCCCAGTGGGCCTTCGGGACACCGAAGGAC
SgGOX19:GCAGCGATCCTGCGTGCCGCGCTGGACCCCGTGCGCGACGAGTTCAGTCATGTCGGTCGG
SgGOX20:GCAGCCGCTCCGGCAGCGGTTTGTCGACCCGCTTGCCGTCCCGACCGACATGACTGAACT
SgGOX21:ACCGCTGCCGGAGCGGCTGCGGGGCTGGGGGCGGGTGGTGAAGCGGTTCGGCGACTGGTC
SgGOX22:GCTCGTCGAGCCCCGCGTGCTCGTGAGGAAACGGAACATCGACCAGTCGCCGAACCGCTT
SgGOX23:GCACGCGGGGCTCGACGAGCGGACCGTCGACCTCATCGGCGCCCTGGAGAACCTCACCTC
SgGOX24:AGGAGCCGATGAAGCTGTGGATGAAGGCCAGCGGGAGACGTAGGTGAGGTTCTCCAGGGC
SgGOX25:CCACAGCTTCATCGGCTCCTCCCTCATCAGCCCCGACACGCCCTTCTACGAGGACCGAGC
SgGOX26:ATTGGGCGCTCTTCCGCTTCCTCGCTCACTGACTCGCTGCGCTCGGTCCTCGTAGAAGGG
SgGOX27:GAAGCGGAAGAGCGCCCAATACGCAAACCGCCTCTCCCCGCGCGTTGGCCGATTCATTAT
SgGOX28:TGCCCGCTTTCCAGTCGGGAAACCTGTCGTGCCAGCTGCAATAATGAATCGGCCAACGCG
SgGOX29:TCCCGACTGGAAAGCGGGCAGTGAGCGCAACGCAATTAATGTGAGTTCGCTCACTCATCA
SgGOX30:CATACGAGCCGGAAGCATAAAGTGTAAAGCCTGGGGTGCCTGATGAGTGAGCGAACTCAC
SgGOX31:TTATGCTTCCGGCTCGTATGTTGTGTGGAATTGTGAGCGGAGAACAATTTCACACAGGAA
SgGOX32:CGGGTACCGAGCTCGAATTCGTAATCATGGTCATAGCTGTTTCCTGTGTGAAATTGTTCT
SgGOX33:GAATTCGAGCTCGGTACCCGGGGATCCTCTAGAGATTACTACGACAAGGCGACCAAGGTG
SgGOX34:CCTCGGTGAACTCCCACCAGCGGCGGCTGAACTCCAGCAGCACCTTGGTCGCCTTGTCGT
SgGOX35:CTGGTGGGAGTTCACCGAGGCGGACTGGAAACGGGAACTCGACGCCGTACGGCCGGGGCT
SgGOX36:CCCGTCGGCCGGCGCCCGGCCCGACCGGTAGTCCTCGTACAGCCCCGGCCGTACGGCGTC
SgGOX37:GCCGGGCGCCGGCCGACGGGAGCCTGCTCGGCGGGCATCCGTCCGTGCCGCCGGGGCACA
SgGOX38:CACCGGTTGGCGGCGTAGTGCACCCGCTGTCCCGCCGTGATGTGCCCCGGCGGCACGGAC
SgGOX39:CACTACGCCGCCAACCGGTGGGCCGGCCGCGACCAGCCCGAGGCGGCGCACATCGTCGGC
SgGOX40:TGATCATGAACCGGTTGGGGTTGTCGGAGACCGAGCCGCCGCCGACGATGTGCGCCGCCT
SgGOX41:CCCCAACCGGTTCATGATCAACCCGTCGCACCCGGTCGGCGGCAGCGCGGGCGGGGTCGT
SgGOX42:CCAGCGGGAGGCGTCGTCGGCCCAGCTGTACGAGGCGAGGACGACCCCGCCCGCGCTGCC
SgGOX43:CCGACGACGCCTCCCGCTGGGACTCCCTGGACGACGAGGCGCGCTACCCGCACGCCCTGC
SgGOX44:AAGACCTCGACGCGCCGGCCGTAGACCTGCTGGAGCCCGCGCAGGGCGTGCGGGTAGCGC
SgGOX45:GGCCGGCGCGTCGAGGTCTTCTACACGGGCGCGGGCCGCACCCAGAGCTGGCTGCGGGAT
SgGOX46:GACCGGGGAGCAGGACGGACGCCTCCCCGTACGCGTACGGATCCCGCAGCCAGCTCTGGG
SgGOX47:GTCCGTCCTGCTCCCCGGTCAGCACACGGAGCTGCTGAGCGCCATCCGCTCCGCCGAGGG
SgGOX48:CGGCTTGACCGAGGTGTGGTCGCCCGCGAAGAGCAGCGGGCCCTCGGCGGAGCGGATGGC
SgGOX49:ACCACACCTCGGTCAAGCCGTCGTGGATCGAGGGAGCCGTGGAGTCCGCCGTGCGTGCCG
SgGOX50:TCACGCTGTGTGGATCTCCAAGGCGGCACGCACGGCGGACTCC
本发明所述来自灰黄链霉菌的L-谷氨酸氧化酶基因在L-谷氨酸含量检测中的应用。
本发明所述来自灰黄链霉菌的L-谷氨酸氧化酶基因的获取方法如下:从江苏省南京市土壤微生物中筛选产L-谷氨酸氧化酶的菌株,将筛选得到的菌落提取总DNA,根据L-谷氨酸氧化酶保守盒子序列设计引物Primer A:5’-CACCTGGATCCACGTCAACG-3’和Primer B: 5’-GTGTAGAAGACCTCGACGCG-3’,以引物Primer A、Primer B为扩增引物,以总DNA为模板,进行PCR扩增,获得一段1179bp的PCR片段。以此序列为基础,采用Genome Walking Kit试剂盒(大连宝生物公司)获取其两侧的未知序列,查找完整的开放阅读框,从而获得该L-谷氨酸氧化酶基因的全序列即为本发明的L-谷氨酸氧化酶基因,其核苷酸序列如SEQ ID No.1所示,其编码的蛋白质序列如SEQ ID No.2所示。
本发明所述的核苷酸序列如SEQ ID No.1所示、编码的蛋白质序列如SEQ ID No.2所示的L-谷氨酸氧化酶基因可通过基因合成方法得到,即采用大量重叠的引物通过两步PCR进行全基因的合成(PTDS)。本发明在PTDS合成过程中设计长度大概为60bp左右的覆盖整个L-谷氨酸氧化酶基因的寡核苷酸的序列50个(引物SgGOX1-SgGOX50),其中每相邻的两个寡核苷酸序列有20个碱基的重复。
经检测,本发明制备得到的L-谷氨酸氧化酶的反应活力为36.7U/mg,所述L-谷氨酸氧化酶蛋白以L-谷氨酸为底物的最适反应温度为40℃,最适反应pH值为7.5,该L-谷氨酸氧化酶蛋白能特异地催化L-谷氨酸。
本发明的有益效果:
1.本发明从土壤中筛选出产L-谷氨酸氧化酶的灰黄链霉菌,并从中得到核苷酸序列如SEQ ID No.1所示,其编码的蛋白质序列如SEQ ID No.2所示的L-谷氨酸氧化酶基因。再通过基因合成方法合成出所述L-谷氨酸氧化酶基因,大大降低了该L-谷氨酸氧化酶的提取成本,提高了L-谷氨酸氧化酶的催化活性。
2.本发明得到的L-谷氨酸氧化酶底物专一性很强,能特异性地催化L-谷氨酸,可应用于L-谷氨酸含量检测。
附图说明
图1为本发明实施例5的L-谷氨酸氧化酶的SDS-PAGE电泳图,其中M为蛋白分子量MARKER,1代表用HisTrap HP试剂盒纯化的在大肠杆菌BL21(DE3)过量表达的L-谷氨酸氧化酶蛋白。
图2为本发明实施例7的酶活力测定结果。
图3为本发明实施例8的酶活力测定结果。
具体实施方式
以下结合具体实施方式详细描述本发明的技术方案。实施例仅用以说明本发明的技术方 案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围中。
本发明所用的试剂若未经说明,均购自西格玛-奥德里奇(Sigma-Aldrich)公司。本发明涉及分子生物学实验,如没有特别注明,均参考自《分子克隆》一书[J.萨姆布鲁克、E.F.弗里奇、T.曼尼阿蒂斯著,1994,科学出版社]。
实施例1 菌种分离
称取土壤样品1g,加入0.85%(w/v)氯化钠溶液1ml,5000转/分震荡混匀,3000转/分轻离心,倒掉上清,再加入0.85%(w/v)氯化钠溶液1ml,5000转/分震荡混匀,冰上10min静置,吸取100μL溶液涂布于含有50ppm重铬酸钾的高氏一号培养基(高氏一号培养基:可溶性淀粉20g/L,KNO31g/L,K2HPO40.5g/L,MgSO4·7H2O 0.5g/L,NaCl 0.5g/L,FeSO4·7H2O0.01g/L,琼脂20g/L,pH=7.4)中,30℃下培养4天。根据菌落形态和大小挑取菌落分别对应地接入对照与显色两种平皿中(平皿中均为高氏一号培养基),显色平皿中显色液为0.1M磷酸盐缓冲液(pH6.5),0.07%的4-氨基安替吡啉,0.8%的L-谷氨酸,0.1%的苯酚,2000U/L的辣根过氧化物酶。30℃下培养3天,取显色平皿,将显色液浸过的滤纸置于其菌落上,标记显色快、红色深的菌落在对照平皿上对应菌落,挑取该菌落在高氏一号培养基上划线分离,30℃下培养3天,挑取单菌落保藏备用。
实施例2 总DNA提取及菌种鉴定
将分离获得的菌株接种于10mL液体培养基(酵母粉3g/L,蛋白胨20g/L,葡萄糖10g/L,可溶性淀粉5g/L,大豆蛋白胨5g/L,MgSO4·7H2O 0.2g/L,pH=7.0)中,30℃下培养3天,培养液以7000r/min速度离心6分钟,得到菌体沉淀。
取0.15g新鲜菌体于研钵(-20℃预冷)中,反复液氮研磨至细粉状,迅速装入1.5mL离心管中,加入TE缓冲液550μL,65℃预热的20%(w/v)SDS溶液30μL,斡旋震荡5分钟,接着加入浓度为20mg/mL的蛋白酶K 20μL,混匀,37℃水浴1小时,加等体积的苯酚:氯仿:异戊醇(25:24:1,v/v)抽提,轻轻颠倒混匀,10000r/min速度离心10分钟;吸取上清至新离心管中,加等体积的氯仿:异戊醇(24:1,v/v)抽提,10000r/min速度离心5分钟,吸取上清与等体积异丙醇(4℃预冷)混匀,10000r/min速度离心5分钟,弃上清。沉淀用70%(v/v)酒精冲洗,干燥,加40μL TE缓冲液溶解,所得总DNA于-20℃保存。
以抽提的总DNA为模板,利用细菌的16s rRNA特异性引物进行扩增。扩增的引物为P16SF:5’-GGTTACCTTGTTACGACTT-3’和P16SR:5’-AGAGTTGATCCTGGCTCAG-3’。以KODPlus(Toyobo日本)为Taq DNA聚合酶,扩增条件依次为:94℃ 30s,55℃ 30s,72℃ 120s,扩增30个循环。PCR结束后,1%(w/v)琼脂糖凝胶回收,取10μL直接与T/A载体相连(宝生物工程(大连)有限公司),4℃连接过夜。将连接产物转化入大肠杆菌在DH5α感受态细胞中,获得阳性克隆,测序。测得的序列通过Blast程序与GenBank中核酸数据进行对比分析,得到菌株与灰黄链霉菌中的16s rRNA有100%的同源性,该菌株为灰黄链霉菌。
实施例3 灰黄链霉菌的L-谷氨酸氧化酶基因的获取
根据L-谷氨酸氧化酶保守盒子序列设计引物:Primer A:5’-CACCTGGATCCACGTCAACG-3’和Primer B:5’-GTGTAGAAGACCTCGACGCG-3’为扩增引物,以总DNA为模板,获得一段1179bp的PCR片段。PCR反应条件为:94℃ 30s,55℃ 30s,72℃ 90s,扩增30个循环。用1%琼脂糖胶回收片段,取10μl直接与T/A克隆载体相连(大连宝生物公司)。4℃连接过夜,在DH5α感受态中高效转化,获得阳性克隆,测序。
以获得的1179bp的PCR片段为基础,采用Genome Walking Kit试剂盒(大连宝生物公司)获取其两侧的未知序列,查找完整的开放阅读框,从而获得该L-谷氨酸氧化酶基因的全序列,具体过程如下:
为扩增5’端未知序列,设计引物:SP1:5’-ACATGACTGAACTCGTCGCGCAC-3’,SP2:5’-TCGGGACACCGAAGGACCGGTTC-3’和SP3:5’-TACGCGGATGCCGTTGACGTGG-3’。以总DNA为模板,SP1和试剂盒中的AP2Primer为引物,进行第一轮PCR反应。反应条件为:94℃ 1min,98℃ 1min;[94℃ 30s,68℃ 1min,72℃ 2min(5个循环)];94℃ 30s,25℃ 3min,72℃ 2min;[94℃ 30s,68℃ 1min,72℃ 2min,94℃ 30s,68℃ 1min,72℃ 2min,94℃ 30s,44℃ 1min,72℃ 2min(15个循环)];72℃ 10min。
取第一轮PCR反应产物1μL作为模板,以SP2和试剂盒中的AP2Primer为引物,进行第二轮PCR反应。反应条件为:[94℃ 30s,68℃ 1min,72℃ 2min,94℃ 30s,68℃ 1min,72℃ 2min,94℃ 30s,44℃ 1min,72℃ 2min(15个循环)];72℃ 10min。
取第二轮PCR反应产物1μL作为模板,以SP3和试剂盒中的AP2Primer为引物,进行第三轮PCR反应。反应条件为:[94℃ 30s,68℃ 1min,72℃ 2min,94℃ 30s,68℃ 1min,72℃ 2min,94℃ 30s,44℃ 1min,72℃ 2min(15个循环)];72℃ 10min。将第三轮PCR反应的产物用1%琼脂糖胶回收,测序,获得5’端未知序列929bp。
用同样的方法扩增3’端未知序列,设计引物:
SP4:5’-GTTCATGATCAACCCGTCGCAC-3’,SP5:
5’-ACTCCCTGGACGACGAGGCGCG-3’和SP6:5’-GCGCGTCGAGGTCTTCTACAC-3’。对第三轮PCR反应的片段进行测序,获得3’端未知序列762bp。
对上述三段序列(1179bp的PCR片段、5’端未知序列929bp片段、3’端未知序列762bp片段)进行拼接和分析,寻找阅读编码框,其中包含了一个2004bp的阅读框,即为本发明的L-谷氨酸氧化酶基因,其核苷酸序列如SEQ ID No.1所示,其编码的氨基酸序列如SEQ ID No.2所示。
实施例4 基因合成法合成来源于灰黄链霉菌的L-谷氨酸氧化酶基因
通过基因合成方法(Nucleic Acids Research,2004,32,e98)合成本发明的来源于灰黄链霉菌的L-谷氨酸氧化酶基因,所用的引物如下:
SgGOX1:ATGACTGAAGATCACGCGGTGGTGTGTTCTGAAAATGGTTTCTCCCGACGGGAGTTCGCG
SgGOX2:CGGCCAGGGCCGTCGCCACCGTGGCCGTGCCGGCCACCGCCGCGAACTCCCGTCGGGAGA
SgGOX3:GGTGGCGACGGCCCTGGCCGGCGGTACCGCCACGGCCCTGCCCGCGCCGGCCGCGCCGCT
SgGOX4:GGAGTCGGCGCCGCGACCGCCGCCGGGAAGGGCCGGGGCGAGCGGCGCGGCCGGCGCGGG
SgGOX5:GCGGTCGCGGCGCCGACTCCGACAGATGCCTCGCCGTCGCCCGTGCCCTGCTCGTCCTGG
SgGOX6:ACGCGCACGTAGCGCGGAACGAGGGGGCGGTCGTCGGAGTCCAGGACGAGCAGGGCACGG
SgGOX7:GTTCCGCGCTACGTGCGCGTCCTGAAAGACGGACTGCCGGCGCGACGGACCCGCCCCAAG
SgGOX8:TCACCAGCCCGGACGGGCCGGCGCCGATGACGAGGACGTCCTTGGGGCGGGTCCGTCGCG
SgGOX9:CGGCCCGTCCGGGCTGGTGACCGCCTGGCTGCTGAAGGAGGCGGGACACCGGGTGACGGT
SgGOX10:CTTGATGCGGCCGCCCGCCCGGTTGCCGTTGGCCTCCAGGACCGTCACCCGGTGTCCCGC
SgGOX11:GGGCGGGCGGCCGCATCAAGACCTTCCGAAAGGGCGGCCACGAAGGTGCCGGGCAGCCCT
SgGOX12:CGCATCGCGCCCGCCTCGGCGTACTGGCCGGGATCCGCGAAGGGCTGCCCGGCACCTTCG
SgGOX13:GCCGAGGCGGGCGCGATGCGTATCCCCGGCAGCCATCCGCTGGTGATGGAACTCATCGAC
SgGOX14:CGTCGACGTAGTGGAAGCGCCGCTTCTTCAGATCGAACCGGTCGATGAGTTCCATCACCA
SgGOX15:GCGCTTCCACTACGTCGACGTCGACGAGGAGGGACGTCCCGCCGCGCGCACCTGGATCCA
SgGOX16:GCGGGCGTAGTCGGCGCGCCGTACGCGGATGCCGTTGACGTGGATCCAGGTGCGCGCGGC
SgGOX17:GGCGCGCCGACTACGCCCGCTCGCCCCGGCGCGTGAACCGGTCCTTCGGTGTCCCGAAGG
SgGOX18:GCGGCACGCAGGATCGCTGCGGCGGGGGTGTCCCAGTGGGCCTTCGGGACACCGAAGGAC
SgGOX19:GCAGCGATCCTGCGTGCCGCGCTGGACCCCGTGCGCGACGAGTTCAGTCATGTCGGTCGG
SgGOX20:GCAGCCGCTCCGGCAGCGGTTTGTCGACCCGCTTGCCGTCCCGACCGACATGACTGAACT
SgGOX21:ACCGCTGCCGGAGCGGCTGCGGGGCTGGGGGCGGGTGGTGAAGCGGTTCGGCGACTGGTC
SgGOX22:GCTCGTCGAGCCCCGCGTGCTCGTGAGGAAACGGAACATCGACCAGTCGCCGAACCGCTT
SgGOX23:GCACGCGGGGCTCGACGAGCGGACCGTCGACCTCATCGGCGCCCTGGAGAACCTCACCTC
SgGOX24:AGGAGCCGATGAAGCTGTGGATGAAGGCCAGCGGGAGACGTAGGTGAGGTTCTCCAGGGC
SgGOX25:CCACAGCTTCATCGGCTCCTCCCTCATCAGCCCCGACACGCCCTTCTACGAGGACCGAGC
SgGOX26:ATTGGGCGCTCTTCCGCTTCCTCGCTCACTGACTCGCTGCGCTCGGTCCTCGTAGAAGGG
SgGOX27:GAAGCGGAAGAGCGCCCAATACGCAAACCGCCTCTCCCCGCGCGTTGGCCGATTCATTAT
SgGOX28:TGCCCGCTTTCCAGTCGGGAAACCTGTCGTGCCAGCTGCAATAATGAATCGGCCAACGCG
SgGOX29:TCCCGACTGGAAAGCGGGCAGTGAGCGCAACGCAATTAATGTGAGTTCGCTCACTCATCA
SgGOX30:CATACGAGCCGGAAGCATAAAGTGTAAAGCCTGGGGTGCCTGATGAGTGAGCGAACTCAC
SgGOX31:TTATGCTTCCGGCTCGTATGTTGTGTGGAATTGTGAGCGGAGAACAATTTCACACAGGAA
SgGOX32:CGGGTACCGAGCTCGAATTCGTAATCATGGTCATAGCTGTTTCCTGTGTGAAATTGTTCT
SgGOX33:GAATTCGAGCTCGGTACCCGGGGATCCTCTAGAGATTACTACGACAAGGCGACCAAGGTG
SgGOX34:CCTCGGTGAACTCCCACCAGCGGCGGCTGAACTCCAGCAGCACCTTGGTCGCCTTGTCGT
SgGOX35:CTGGTGGGAGTTCACCGAGGCGGACTGGAAACGGGAACTCGACGCCGTACGGCCGGGGCT
SgGOX36:CCCGTCGGCCGGCGCCCGGCCCGACCGGTAGTCCTCGTACAGCCCCGGCCGTACGGCGTC
SgGOX37:GCCGGGCGCCGGCCGACGGGAGCCTGCTCGGCGGGCATCCGTCCGTGCCGCCGGGGCACA
SgGOX38:CACCGGTTGGCGGCGTAGTGCACCCGCTGTCCCGCCGTGATGTGCCCCGGCGGCACGGAC
SgGOX39:CACTACGCCGCCAACCGGTGGGCCGGCCGCGACCAGCCCGAGGCGGCGCACATCGTCGGC
SgGOX40:TGATCATGAACCGGTTGGGGTTGTCGGAGACCGAGCCGCCGCCGACGATGTGCGCCGCCT
SgGOX41:CCCCAACCGGTTCATGATCAACCCGTCGCACCCGGTCGGCGGCAGCGCGGGCGGGGTCGT
SgGOX42:CCAGCGGGAGGCGTCGTCGGCCCAGCTGTACGAGGCGAGGACGACCCCGCCCGCGCTGCC
SgGOX43:CCGACGACGCCTCCCGCTGGGACTCCCTGGACGACGAGGCGCGCTACCCGCACGCCCTGC
SgGOX44:AAGACCTCGACGCGCCGGCCGTAGACCTGCTGGAGCCCGCGCAGGGCGTGCGGGTAGCGC
SgGOX45:GGCCGGCGCGTCGAGGTCTTCTACACGGGCGCGGGCCGCACCCAGAGCTGGCTGCGGGAT
SgGOX46:GACCGGGGAGCAGGACGGACGCCTCCCCGTACGCGTACGGATCCCGCAGCCAGCTCTGGG
SgGOX47:GTCCGTCCTGCTCCCCGGTCAGCACACGGAGCTGCTGAGCGCCATCCGCTCCGCCGAGGG
SgGOX48:CGGCTTGACCGAGGTGTGGTCGCCCGCGAAGAGCAGCGGGCCCTCGGCGGAGCGGATGGC
SgGOX49:ACCACACCTCGGTCAAGCCGTCGTGGATCGAGGGAGCCGTGGAGTCCGCCGTGCGTGCCG
SgGOX50:TCACGCTGTGTGGATCTCCAAGGCGGCACGCACGGCGGACTCC
以SgGOX1-SgGOX12;SgGOX13-SgGOX24;SgGOX25-SgGOX36;SgGOX37-SgGOX50为引物,利用PCR进行扩增SgGOX1、SgGOX2、SgGOX3、SgGOX4片段,在50μl反应体系中,其中内侧引物SgGOX2-SgGOX11、SgGOX14-SgGOX23、SgGOX26-SgGOX35、SgGOX38-SgGOX49引物的添加量为2ng,外侧引物SgGOX1、SgGOX12、SgGOX13、SgGOX24、SgGOX25、SgGOX36、SgGOX37、SgGOX50引物添加量为30ng,扩增条件为:94℃预热1min;94℃,30s;50℃,30s;72℃,1min。共25个循环。扩增片断通过琼脂糖凝胶回收,然后作为模版进行拼接,扩增小片段SGGOX1、SLG2、SgGOX3、SgGOX4各1μg,以SgGOX1和SgGOX50为引物进行PCR扩增,扩增条件为:94℃预热1min;94℃,30s;50℃,30s;72℃,3min。共25个循环。
转化:PCR结束后,用1%琼脂糖胶回收片段,取10μl直接与T/A克隆载体相连(大连宝生物公司)。4℃连接过夜,在DH5α感受态中高效转化,获得长度为2004bp的如SEQ ID No.1所示序列的阳性克隆,即为本发明的L-谷氨酸氧化酶基因,经序列测定,其核苷酸序列如SEQ ID No.1所示,其编码的蛋白质序列如SEQ ID No.2。
实施例5 L-谷氨酸氧化酶基因的大肠杆菌表达
将实施例4合成的L-谷氨酸氧化酶基因用BamH I和Sac I酶切后,通过T4 DNA连接酶将该基因与载体pET-28a(NEB公司)22℃连接2小时,得到一种表达载体pET-SgGOX,并将其转化大肠杆菌BL21(DE3)(Novagen公司),将转化子涂布于LB固体培养基中37℃培养16h。挑取单菌落接种于50mL含氨苄(终浓度100mg/L)的LB液体培养基中,37℃振荡培养5h,OD600约为0.6时,加入终浓度为0.4mM的IPTG,25℃诱导12h。将所得发酵培养液8000rpm离心去上清,收集湿细胞。取湿细胞用生理盐水洗涤两次,再悬浮于pH6.5、100mM的磷酸-磷酸钠缓冲液中(1g湿细胞/10ml缓冲液)得悬浮液,用超声波处理悬浮液(功率为400W,超声4s,间歇6s,重复99轮),8000rpm离心取上清,即得粗酶液。用凝胶-蛋白纯化试剂盒HisTrap HP(Amersham Biosciences公司)对其进行蛋白表达纯化,获得L-谷氨酸氧化酶蛋白。
经SDS-PAGE电泳检测,该L-谷氨酸氧化酶蛋白大小约73kDa,与预测值相符,具体电泳检测结果参见图1。
实施例6 L-谷氨酸氧化酶基因的酶活测定
L-谷氨酸氧化酶活力测定:反应体系为1ml,包含pH 6.5、100mM磷酸钠缓冲液,1mM的4-氨基安替安替吡啉,10mM的L-谷氨酸,10mM的苯酚,2000U/L的辣根过氧化物酶。在30℃下反应,使用分光光度计测定505nm处吸光值。酶活定义为,每分钟反应生成1μmol过氧化氢所需的酶量为一个酶活单位U。蛋白含量采用Brandford法测定。
采用上述方法测定实施例5所得L-谷氨酸氧化酶活力,结果为:L-谷氨酸氧化酶的反应活力为36.7U/mg。
实施例7 L-谷氨酸氧化酶基因的最适反应温度
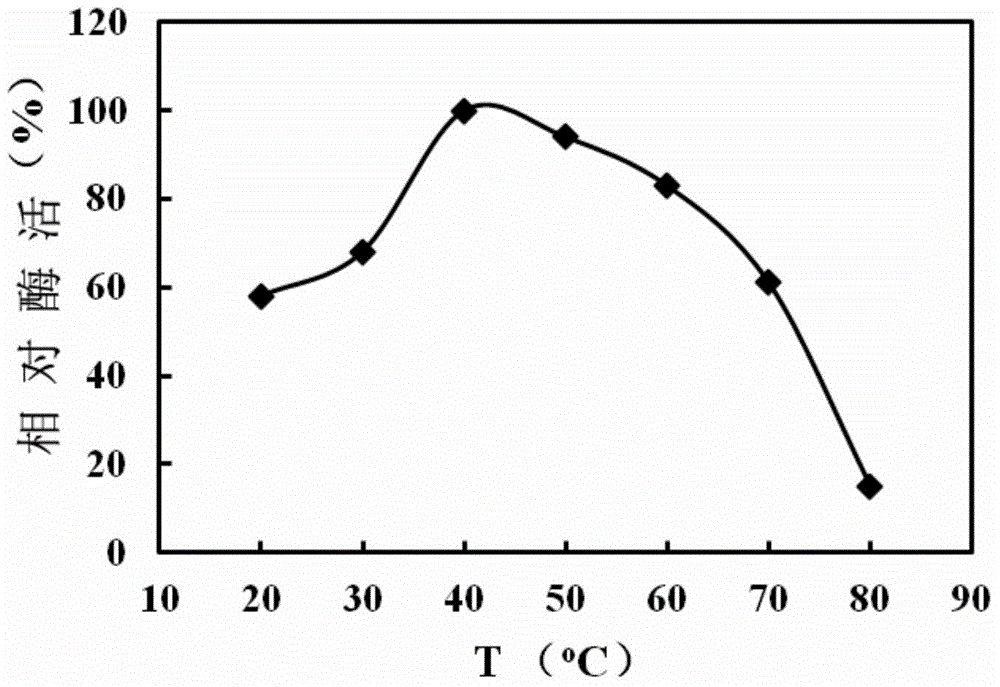
采用实施例6所述L-谷氨酸氧化酶活力测定体系,设定反应温度分别为20-80℃。经检测发现,该L-谷氨酸氧化酶蛋白以L-谷氨酸为底物的最适反应温度为40℃,具体测定结果参见图2。
实施例8 L-谷氨酸氧化酶基因的最适pH值
采用实施例6所述L-谷氨酸氧化酶活力测定体系,利用醋酸钠缓冲液、磷酸缓冲液以及甘氨酸-氢氧化钠缓冲液分别配制pH3-6、pH6-8.5、pH8.5-10.5反应液,检测酶的相对活性。检测结果表明:该L-谷氨酸氧化酶的最适反应pH值为7.5,具体测定结果参见 图3。
实施例9 L-谷氨酸氧化酶的底物谱
反应体系为1ml:取实施例5制得的L-谷氨酸氧化酶10μL,加入包含pH 6.5、100mM磷酸钠缓冲液,1mM的4-氨基安替安替吡啉,10mM的苯酚,2000U/L的辣根过氧化物酶的反应液中,分别加入各种底物(10mM),30℃下反应2min,使用分光光度计测定505nm处吸光值。
所述各种底物为L-谷氨酸(L-Glu),D-谷氨酸(D-Glu),L-谷氨酰胺(L-Gln),L-天冬氨酸(L-Asp),L-天冬酰胺(L-Asn),L-甘氨酸(L-Gly),L-精氨酸(L-Arg),L-脯氨酸(L-Pro),L-组氨酸(L-His),L-酪氨酸(L-Tyr),L-半胱氨酸(L-Cys),结果如表1所示。
表1
由表1可知:本发明的L-谷氨酸氧化酶能特异性地催化L-谷氨酸,对D-谷氨酸和L-谷氨酰胺具有极低的催化活性,对其他被测氨基酸不具有催化活性。本发明的L-谷氨酸氧化酶底物专一性很强,可适用于L-谷氨酸含量检测。
- 还没有人留言评论。精彩留言会获得点赞!