PAQR3多肽片段、其药物组合物及用途的制作方法
本发明涉及PAQR3多肽片段、其药物组合物及其用途。
背景技术:
中国是癌症的高发区,发病率及死亡率均高于世界平均水平[Ferlay J,Shin HR,Bray F,Forman D,Mathers C和Parkin DM,(2010)Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008,Int J Cancer 127(12):2893-917]。癌症是一种复杂的、多步骤、病因不明的疾病。在癌症的分子生物学方面的研究证明PI3K/Akt、MAPK/Erk信号通路的激活有利于癌细胞的生长增殖及转移[An S,Yang Y,Ward R,Liu Y,Guo XX和Xu TR,(2015)Raf-interactome in tuning the complexity and diversity of Raf function.FEBS J 282(1):32-53;Pal I,(2012)Mandal M.PI3K and Akt as molecular targets for cancer therapy:current clinical outcomes,Acta Pharmacol Sin 33(12):1441-58]。
申请人前期的结果证明,PAQR(Progestin and AdipoQ Receptor,孕酮及脂联素受体)家族中的蛋白PAQR3能够结合PI3K的催化亚基p110及Raf激酶,从而抑制PI3K/Akt和MAPK/Erk信号通路[Feng,L.,Xie,X.,Ding,Q.,Luo,X.,He,J.,Fan,F.,Liu,W.,Wang,Z.和Chen,Y.,(2007)Spatial regulation of Raf kinase signaling by RKTG,Proceedings of the National Academy of Sciences of the United States of America 104,14348-53;Wang,X.,Wang,L.,Zhu,L.,Pan,Y.,Xiao,F.,Liu,W.,Wang,Z.,Guo,F.,Liu,Y.,Thomas,W.G.和Chen,Y,(2013)PAQR3 modulates insulin signaling by shunting phosphoinositide 3-kinase p110a to the Golgi apparatus,Diabetes 62(2):444-56]。
我们近期的研究发现PAQR3发挥其阻断p110α与p85结合、Raf与MEK结合的重要功能区域在PAQR3蛋白的N端。根据PAQR3与p110及Raf的结合位点,我们设计并合成含有PAQR3蛋白的N端片段,研究证明该片段能够 有效地阻断p110α与p85,Raf-1与MEK的结合作用,从而抑制这两条信号通路的下游蛋白Akt及Erk的磷酸化水平,以此抑制胃癌细胞中这两条通路的活化,显著抑制肿瘤细胞的生长及转移。
技术实现要素:
本发明提供一种分离的氨基酸序列,该分离的氨基酸序列含有SEQ ID NO:1的片段,其中,该片段位于SEQ ID NO:1第1位到第70位之间,长至少40个氨基酸残基。
在一个具体实施例中,该片段长至少45个氨基酸残基,优选至少50个氨基酸残基。
在一个具体实施例中,该片段含有SEQ ID NO:1第6位到第55位氨基酸残基。
在一个具体实施例中,该片段位于SEQ ID NO:1第3位到第65位氨基酸残基之间。
在一个具体实施例中,该片段位于SEQ ID NO:1第5位到第60位氨基酸残基之间。
在一个具体实施例中,该分离的氨基酸序列由SEQ ID NO:1的所述片段组成。
在一个具体实施例中,该分离的氨基酸序列还含有促进穿膜的肽。
在一个具体实施例中,所述促进穿膜的肽选自:RQIKIWFQNRRMKWKK(SEQ ID NO:10)、YGRKKRRQRRR(SEQ ID NO:11)、KQAIPVAK-酰胺(SEQ ID NO:12)、RRRRNRTRRNRRRVR-酰胺(SEQ ID NO:13)、寡精氨酸(R9-R12)、KLTRAQRRAAARKNKRNTRGC(SEQ ID NO:14)、ALWKTLLKKVLKAPKKKRKVC(SEQ ID NO:15)、RKKRRQRRR(SEQ ID NO:16)、DAATATRGRSAASRPTERPRAPARSASRPRRPVE(SEQ ID NO:17)、GWTLNSAGYLLGKINLKALAALAKKIL-酰胺(SEQ ID NO:18)、AGYLLGKINLKALAALAKKIL-酰胺(SEQ ID NO:19)、YTAIAWVKAFIRKLRK-酰胺(SEQ ID NO:20)等。
在一个具体实施例中,所述分离的氨基酸序列由促进穿膜的肽与SEQ ID NO:1的所述片段组成。
在一个具体实施例中,所述分离的氨基酸序列如SEQ ID NO:3所示。
本发明还提供编码所述分离的氨基酸序列的核苷酸序列。
本发明还提供核酸构建物,该核酸构建物含有本发明编码所述分离的氨基酸序列的核苷酸序列,用于表达所述分离的氨基酸序列。
本发明还提供一种药物组合物,所述药物组合物含有本发明所述分离的氨基酸序列和药学上可接受的载体。
本发明还提供所述分离的氨基酸序列在制备用于治疗或预防PI3K/Akt和/或MAPK/Erk信号通路介导的疾病的药物中的用途。
在一个具体实施例中,所述用途为制备用于治疗或预防PI3K/Akt和/或MAPK/Erk信号通路介导的癌症或癌症转移的药物中的用途。
在一个具体实施例中,所述癌症包括胃癌、乳腺癌、结肠癌、皮肤癌和肾癌。
在一个具体实施例中,所述癌症是黑色素瘤。
附图说明
图1显示PAQR3的多肽能够抑制PI3K/Akt及MAPK/ErK信号通路。
图2显示PAQR3的片段能够抑制AGS细胞的迁移能力。
图3显示MTT及克隆形成实验证明,PAQR3的片段能够抑制胃癌细胞的生长。图中,day0、day1、day2、day3、day4分别指第0、1、2、3和4天。
图4显示PAQR3的片段能够抑制AGS细胞的皮下瘤生长。图中,day1、day3、day4、day7、day9、day11分别指第1、3、5、7、9和11天。
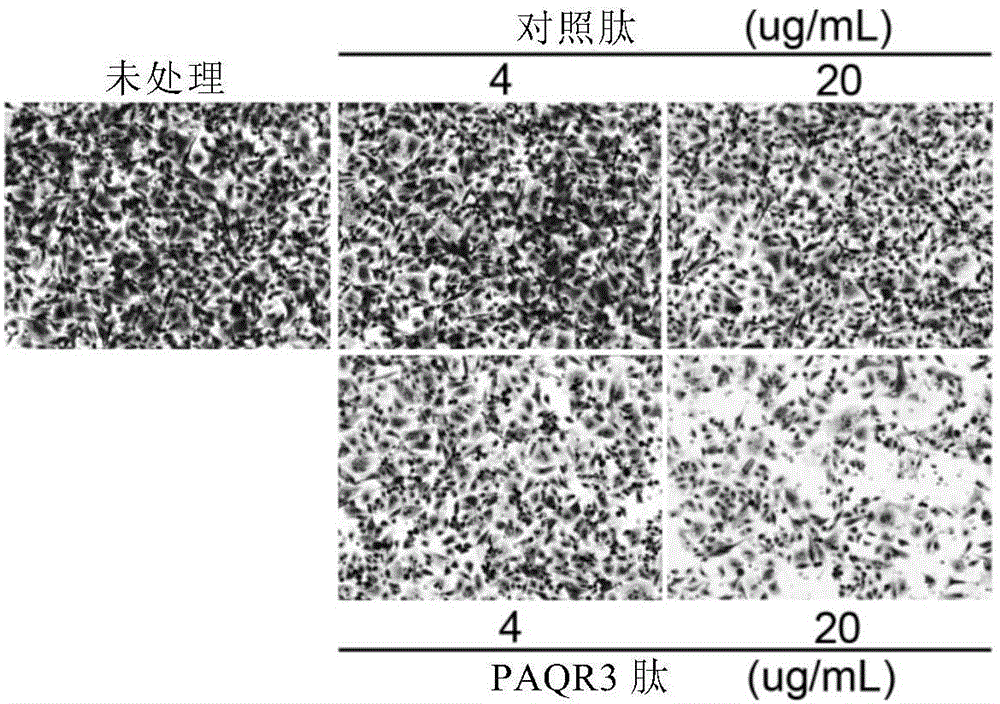
图5显示PAQR3的片段能够抑制黑色素瘤细胞A375的生长(A、B和C)、迁移(D和E)以及A375细胞中Akt及Erk的磷酸化水平(F)。图中,day0、day1、day2、day3、day4分别指第0、1、2、3和4天;“对照肽-1”、“对照肽-4”、“对照肽-20”以及“PAQR3肽-1”、“PAQR3肽-4”和“PAQR3肽-20”分别至浓度为1、4和20μg/ml的对照肽和PAQR3肽。
具体实施方式
本发明涉及分离的氨基酸序列,该序列为SEQ ID NO:1的片段,该片段位于SEQ ID NO:1第1位到第70位之间,且长至少40个氨基酸残基。
如本文所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多核苷酸和多肽是没有分离纯化的,但同样的多核苷酸或多肽如从天然状态中同存在的其他物质中分开,则为分离纯化的。“分离的氨基酸序列”是指该氨基酸序列基本上不含天然与其相关的其它蛋白、脂类、糖类或其它物质。
术语“片段”指仅由完整的全长多肽序列和结构的一部分组成的多肽。本发明涉及PAQR3的片段。PAQR3的氨基酸序列如SEQ ID NO:1所示。尤其是,本发明涉及PAQR3的N端片段,具体是位于SEQ ID NO:1第1位氨基酸残基到第70位氨基酸之间的片段,优选长至少40个氨基酸残基,例如至少45个氨基酸残基、至少48个氨基酸残基、至少50个氨基酸残基、至少53个氨基酸残基等。
优选的,所述片段至少含SEQ ID NO:1第6位到第55位氨基酸残基。因此,所述片段可以起始于SEQ ID NO:1的第1、2、3、4或5位氨基酸残基,并终止于SEQ ID NO:1第55、56、57、58、59、60、61、62、63、64、65、66、67、68、69或70位氨基酸残基,即第1-55、1-56、2-55、2-56,诸如此类。优选的,所述片段由SEQ ID NO:1第6-55位氨基酸残基组成。
应理解,在基因克隆操作中,常常需要设计合适的酶切位点,这势必在所表达的氨基酸序列末端引入了一个或多个不相干的残基,而这并不影响目的序列的活性。又如为了构建融合蛋白、促进重组蛋白的表达、获得自动分泌到宿主细胞外的重组蛋白、或利于重组蛋白的纯化,常常需要将一些氨基酸添加至重组蛋白的N-末端、C-末端或该蛋白内的其它合适区域内,例如,包括但不限于,适合的接头肽、信号肽、前导肽、末端延伸等。本发明氨基酸序列的氨基端或羧基端还可含有一个或多个多肽片段,作为蛋白标签。任何合适的标签都可以用于本发明。例如,所述的标签可以是FLAG,HA,HA1,c-Myc,Poly-His,Poly-Arg,Strep-TagII,AU1,EE,T7,4A6,ε,B,gE以及Ty1。这些标签可用于对蛋白进行纯化。下表列出了其中的一些标签及其序列。
本发明的氨基酸序列还可在所述片段的N端含有促进穿膜的肽段。本领域周知这类肽段,例如,可参见Siegmund Reissmann,Cell penetration:scope and limitations by the application of cell-penetrating peptides,J.Pept.Sci.2014;20:760–784。本文将其全部内容以引用的方式纳入本文。尤其是,适用于本发明的促进穿膜的肽段包括上述文献表1所列的编号为第1-92的序列。本文在此不一一列举。还可用于本发明的促进穿膜的肽段包括RKKRRQRRR。
因此,本发明的分离的氨基酸序列可由SEQ ID NO:1的所述片段组成,或者可由SEQ ID NO:1所述的片段以及合适的蛋白标签组成,或者可由SEQ ID NO:1的所述片段与促进穿膜的序列组成,或者可由SEQ ID NO:1的所述片段、蛋白标签以及促进穿膜的序列组成。
本发明的氨基酸序列可以是化学合成的产物,或是使用重组技术从原核或真核宿主(例如,细菌、酵母、丝状真菌、高等植物、昆虫和哺乳动物细胞)中产生的重组多肽。根据重组生产方案所用的宿主,本发明的多肽可以是糖基化的,或可以是非糖基化的。
本发明的多核苷酸可以是DNA形式或RNA形式。DNA形式包括cDNA、基因组DNA或人工合成的DNA。DNA可以是单链的或是双链的。DNA可以是编码链或非编码链。编码成熟多肽的编码区序列可以与SEQ ID NO:2所示的cDNA序列相同或者是简并的变异体。如本文所用,“简并的变异体”在本发明中是指编码本发明的氨基酸序列,但与如SEQ ID NO:2所示的序列有差别的核酸序列。
术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。
本发明中的多肽和多核苷酸优选以分离的形式提供,更佳地被纯化至均质。
本发明的核苷酸序列通常可以用PCR扩增法、重组法或人工合成的方法获得。对于PCR扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,并用市售的cDNA库或按本领域技术人员已知的常规方法所制备的cDNA库作为模板,扩增而得有关序列。当序列较长时,常常需要进行两次或多次PCR扩增,然后再将各次扩增出的片段按正确次序拼接在一起。
一旦获得了有关的序列,就可以用重组法来大批量地获得有关序列。这通常是将其克隆入载体,再转入细胞,然后通过常规方法从增殖后的宿主细胞中分离得到有关序列。
此外,还可用人工合成的方法来合成有关序列,尤其是片段长度较短时。通常,通过先合成多个小片段,然后再进行连接可获得序列很长的片段。
目前,已经可以完全通过化学合成来得到编码本发明氨基酸序列的DNA序列。然后可将该DNA序列引入本领域中已知的各种现有的DNA分子(或如载体)和细胞中。
本发明也涉及包含本发明的多核苷酸的载体,以及用本发明的载体经基因工程产生的宿主细胞,以及经重组技术产生本发明所述多肽的方法。优选的,本发明的载体是表达载体。
通过常规的重组DNA技术,可利用本发明的多核苷酸序列可用来表达或生产本发明的氨基酸序列。一般来说有以下步骤:
(1)用本发明的多核苷酸或其简并的变异体,或用含有该多核苷酸的重组表达载体转化或转导合适的宿主细胞;
(2)在合适的培养基中培养的宿主细胞;
(3)从培养基或细胞中分离、纯化蛋白质。
可将本发明的多核苷酸序列插入到重组表达载体中。术语“重组表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动物细胞病毒如腺病毒、逆转录病毒或其它载体。只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、 标记基因和翻译控制元件。表达载体还包括翻译起始用的核糖体结合位点和转录终止子。
本领域的技术人员熟知的方法能用于构建含本发明核酸序列和合适的转录/翻译控制信号的表达载体。这些方法包括体外重组DNA技术、DNA合成技术、体内重组技术等。所述的核酸序列可有效连接到表达载体中的适当启动子上,以指导mRNA合成。这些启动子的代表性例子有:大肠杆菌的lac或trp启动子;λ噬菌体PL启动子;真核启动子包括CMV立即早期启动子、HSV胸苷激酶启动子、早期和晚期SV40启动子、反转录病毒的LTRs和其它一些已知的可控制基因在原核或真核细胞或其病毒中表达的启动子。
此外,表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如真核细胞培养用的二氢叶酸还原酶、新霉素抗性以及绿色荧光蛋白(GFP),或用于大肠杆菌的四环素或氨苄青霉素抗性。
包含上述的适当DNA序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。
宿主细胞可以是原核细胞,如细菌细胞;或是低等真核细胞,如酵母细胞;丝状真菌细胞、或是高等真核细胞,如哺乳动物细胞。代表性例子有:大肠杆菌,链霉菌属;鼠伤寒沙门氏菌的细菌细胞;真菌细胞如酵母、丝状真菌、植物细胞;果蝇S2或Sf9的昆虫细胞;CHO、COS、293细胞、或Bowes黑素瘤细胞的动物细胞等。
本发明的多核苷酸在高等真核细胞中表达时,如果在载体中插入增强子序列时将会使转录得到增强。增强子是DNA的顺式作用因子,通常大约有10到300个碱基对,作用于启动子以增强基因的转录。
本领域一般技术人员都清楚如何选择适当的载体、启动子、增强子和宿主细胞。
用重组DNA转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主为原核生物如大肠杆菌时,能吸收DNA的感受态细胞可在指数生长期后收获,用CaCl2法处理,所用的步骤在本领域众所周知。另一种方法是使用MgCl2。如果需要,转化也可用电穿孔的方法进行。当宿主是真核生物,可选用如下的DNA转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿 孔、脂质体包装等。
获得的转化子可以用常规方法培养,表达本发明的基因所编码的多肽。根据所用的宿主细胞,培养中所用的培养基可选自各种常规培养基。在适于宿主细胞生长的条件下进行培养。当宿主细胞生长到适当的细胞密度后,用合适的方法(如温度转换或化学诱导)诱导选择的启动子,将细胞再培养一段时间。
在上面的方法中的重组多肽可在细胞内、或在细胞膜上表达、或分泌到细胞外。如果需要,可利用其物理的、化学的和其它特性通过各种分离方法分离和纯化重组的蛋白。这些方法是本领域技术人员所熟知的。这些方法的例子包括但并不限于:常规的复性处理、用蛋白沉淀剂处理(盐析方法)、离心、渗透破菌、超处理、超离心、分子筛层析(凝胶过滤)、吸附层析、离子交换层析、高效液相层析(HPLC)和其它各种液相层析技术及这些方法的结合。
如前所述,前期的研究证明,PAQR3能够结合PI3K的催化亚基p110及Raf激酶,从而抑制PI3K/Akt和MAPK/Erk信号通路。而本发明发现,PAQR3发挥其阻断p110α与p85结合、Raf与MEK结合的重要功能区域在PAQR3蛋白的N端,即本发明所述的SEQ ID NO:1的片段。
因此,本发明的氨基酸序列可用于治疗或预防已知PAQR3能治疗或预防的各种疾病,尤其是PI3K/Akt和/或MAPK/Erk信号通路介导的各种疾病。更具体而言,本发明的氨基酸序列可用于治疗或预防PI3K的催化亚基p110α与p85的结合和/或Raf(尤其是Raf-1)与MEK的结合所介导的各种疾病。
如前所述,已知PI3K/Akt信号通路是细胞增殖和生存的重要调节因子。已报道在许多人癌症中存在引起PIK3激酶活性增强的PIK3CA基因中的突变,这些癌症包括结肠、乳腺、脑、肝、胃和肺部的癌症〔Pal I,(2012)Mandal M.PI3K and Akt as molecular targets for cancer therapy:current clinical outcomes,Acta Pharmacol Sin 33(12):1441-58〕。细胞外信号调节激酶(Erk)/丝裂原活化蛋白激酶(MAPK)信号通路是经典的信号转导途径,具有调节细胞增殖、分化、凋亡等多重功能,与肿瘤的发生、发展、转移、预后等密切相关,在临床诊治中具有重要意义,尤其与消化系肿瘤发病、演进密切相关〔沈雁等,ERL/MAPK信号转导通路与消化系肿瘤,《胃肠病学》,2011年,第16卷,第2期〕。
因此,本发明的氨基酸序列尤其适合用于治疗和/或预防结肠、乳腺、脑、肝、皮肤、胃和肺部的癌症,以及这些部位发生的癌症向人体其它组织的转移。更具体而言,适用于本发明氨基酸序列治疗的疾病包括但不限于胃癌、乳腺癌、结肠癌、皮肤癌和肾癌。在一个具体实施例中,所述癌症是胃癌和黑色素瘤。
本发明因此包括本发明氨基酸序列在制备用于治疗或预防PI3K/Akt和/或MAPK/Erk信号通路介导的疾病的药物中的用途。更进一步地,本发明包括所述氨基酸序列在制备用于治疗或预防PI3K的催化亚基p110α与p85的结合和/或Raf(尤其是Raf-1)与MEK的结合所介导的疾病的药物中的用途。
更具体而言,本发明包括所述氨基酸序列在制备用于治疗或预防PI3K/Akt和/或MAPK/Erk信号通路介导的癌症及癌症转移的药物中的用途。
本发明还提供一种药物组合物,该药物组合物含有本发明的氨基酸序列和药学上可接受的载体。
药物组合物中可含有治疗或预防有效量的本发明氨基酸序列。“有效量”指某成分的用量足以产生所期望的反应。具体的有效量取决于多种因素,诸如欲治疗的特定病症、患者的身体条件(如患者体重、年龄或性别)、治疗持续时间、共同施与的疗法(如果有的话)以及所用的具体配方。“有效量”也指在该用量下,本发明氨基酸序列的毒性或负面效果不及于其所带来的正面疗效。
药学上可接受的载体通常是安全、无毒的,且广义上可包括制药产业中用于制备药物组合物的任何已知物质,如填充剂、稀释剂、凝结剂、黏合剂、润滑剂、助流剂、稳定剂、着色剂、润湿剂、崩解剂等。在选择适用于投递合成肽的赋形剂时,主要需考虑此药物组合物的给药方式,本领域技术人员熟知此项技术。
本发明药物组合物中所述氨基酸序列的含量为约1–1000μM;较佳为约10–500μM;更优秀为约25-250μM。举例来说,合成肽的浓度可为约1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45、50、55、60、65、70、75、80、85、90、95、100、150、200、250、300、350、400、450、500、550、600、650、700、750、800、850、900、950或1,000μM。
可根据已知的药学程序来制备上述药物组合物,譬如《雷明顿制药科学》 (Remington’s Pharmaceutical Sciences)(第17版,Alfonoso R.Gennaro编,麦克出版公司(Mack Publishing Company),伊斯顿,宾夕法尼亚(1985))一书中有详细的记载。
本发明的药物组合物可以是各种合适的剂型,包括但不限于药片、胶囊、注射剂等。
本发明还提供一种疾病治疗或预防方法,包括将本发明的氨基酸序列或含有该氨基酸序列的药物组合物给予需要该治疗或该预防的个体。所述疾病为PI3K/Akt和/或MAPK/Erk信号通路介导的疾病;更进一步地,所述疾病为PI3K的催化亚基p110α与p85的结合和/或Raf(尤其是Raf-1)与MEK的结合所介导的疾病。所述个体通常为哺乳动物,更具体而言,为人类。给药方式可以是本领域已知的各种给药方式,包括但不限于口服、注射等。
下文将以具体实施例的方式描述本发明。本发明的实施除非另外说明,将使用本领域技术人员已知的化学、生物化学、重组DNA技术和免疫学的常规方法。这些技术在文献中有完整的解释。参见,如Sambrook等,《分子克隆:实验室手册》(Molecular Cloning:a Laboratory Manual),第二版,1989等。
材料与方法:
1.1材料:
AGS胃癌细胞、MKN45胃癌细胞、PLD1胃癌细胞由本实验室保存;F12K、DMEM培养基,胎牛血清购自invitrogen生物公司,MTT购自Sigma公司,Transwell小室购自Corning生物技术公司,免疫缺陷的裸鼠购自斯莱克实验动物有限公司;本实验所用抗体:p-Akt(S473)、p-Erk、Akt、Erk购自Cell Signaling Technology生物公司,ki67购自BD生物公司,β-actin购自Santa Cruz生物公司。
1.2方法
1.2.1多肽序列设计:根据我们之前对PAQR3与P110及Raf-1结合作用的研究,设计PAQR3的多肽,对照多肽及PAQR3蛋白的多肽序列如下:
对照肽:RKKRRQRRR(SEQ ID NO:4);
实验肽:
RKKRRQRRRLKSAHYIELGSYQYWPVLVPRGIRLYTYEQIPGSLKDNPYITDGYRAYLP(又名PAQR3肽,SEQ ID NO:3)。
上述序列委托商业公司合成。
1.2.2免疫印迹实验:提取相应的细胞的蛋白,进行进行SDS-PAGE,转至PVDF膜后5%的奶粉封闭2h,加入稀释后的Erk1/2,p-Erk1/2,p-Akt,Akt抗体(以1∶1000稀释),4℃过夜,TBST洗膜后加入二抗HRP标记的羊抗鼠IgG(以1∶5000稀释),室温孵育1h,TBST洗膜后显影,以β-actin作为内参。
1.2.3 MTT法检测细胞的活力:将上述几株胃癌细胞取2000-3000个/孔,接种于96孔板中,分别加入对照多肽及PAQR3肽浓度为:4μg/mL,20μg/mL,每天换含多肽的新鲜培养基。于0、1、2、3、4天加入MTT检测细胞的活力。
1.2.4克隆形成实验:取AGS细胞、MKN45细胞、PLD1细胞各400个,接种于6孔板中,分别加入含对照多肽及PAQR3肽的培养基,每天换液一次。10天后弃掉孔板中的培养基,4%的多聚甲醛固定10分钟,后置结晶紫染液中染色,拍照并统计克隆数。
1.2.5迁移实验:将40000个AGS细胞用无血清的培养基洗三遍后,接种于Transwell小室中,下室加入含10%血清的培养基,并在上下室内加入相应浓度的对照多肽及PAQR3肽,24小时后取出小室,用4%的多聚甲醛固定10分钟,后置结晶紫染液中染色,并用棉棒轻轻擦拭上室细胞,置显微镜观察并拍照细胞,计数细胞的迁移情况。
1.2.6裸鼠皮下瘤及免疫组化实验:将5×106个细胞种入裸鼠皮下,待皮下瘤长至100mm3后,每天瘤内注射对照多肽及PAQR3肽,每只每天100μg,共 注射12天后取皮下瘤,石蜡包埋并切片,进行免疫组化检测,利用Ki67标记相应的增殖细胞,并拍照分析。
结果:
1.PAQR3肽能够抑制PI3K/Akt及MAPK/Raf信号通路
首先为了验证PAQR3的多肽能够替代PAQR3的蛋白,抑制PI3K/Akt及MAPK/Raf信号通路的作用,我们用对照多肽及PAQR3肽作用AGS细胞12小时后,提取各组细胞的蛋白,进行Western Blot检测。结果显示,PAQR3肽能够有效地抑制三株细胞中p-Akt(S473)及p-Erk的水平,间接证明了PAQR3肽可以替代PAQR3蛋白起到抑制胃癌细胞中PI3K/Akt及MAPK/Raf信号通路(图1)。
2.PAQR3肽能够抑制胃癌细胞的生长
为了验证PAQR3的多肽是否能够替代PAQR3的作用,抑制细胞的生长,我们通过MTT及克隆形成实验进行验证。结果显示,与对照多肽的作用相比,PAQR3肽能够有效抑制AGS、MKN45及PLD1细胞的生长(图3)。图3A-3C显示了克隆形成实验的结果;图3D-3F显示了MTT实验结果。
3.PAQR3肽抑制AGS细胞的迁移
胃癌的患者通常会有转移,严重加重病情。我们为了验证PAQR3肽是否能够抑制胃癌细胞的迁移,我们通过Transwell实验进行证实,结果显示PAQR3的多肽能够有效抑制AGS细胞的迁移率(图2)。
4.PAQR3能够抑制裸鼠皮下瘤的生长
为了进一步证实PAQR3能够抑制胃癌细胞的生长,我们首先建立AGS细胞的裸鼠皮下瘤模型,待瘤体长至100mm3后,分为两组,于瘤内每天注射相应的对照多肽及PAQR3肽100μg,隔天测量裸鼠皮下瘤的体积。12天后取下瘤体测量并拍照(图4A)。石蜡包埋各组瘤体,切片进行免疫组化检测,标记细胞生长指标的Ki67蛋白。结果显示PAQR3肽处理后裸鼠皮下瘤生长受到了 有效的抑制(图4B-4D)。
另外,申请人的实验还发现,所述PAQR3肽能够通过抑制PI3K/Akt及MAPK/Erk信号通路,从而有效抑制人恶性黑色素瘤细胞A375细胞的生长及转移。具体而言,分别采用MTT法(对照肽和PAQR3肽的浓度分别为1μg/mL、4μg/mL、20μg/mL)及克隆形成法(对照肽和PAQR3肽的浓度4μg/mL和20μg/mL)测试所述PAQR3肽能否抑制A375细胞的生长,并采用划痕实验及transwell小室法(对照肽和PAQR3肽的浓度4μg/mL的20μg/mL)测试所述PAQR3肽能否抑制A375细胞的迁移能力。还采用Western blot检测在对照肽及PAQR3肽(对照肽4μg/mL;PAQR3肽:20μg/mL)处理条件下A375细胞内p-Akt及p-Erk的水平。
结果显示在图5A-5F中。其中,图5A-5C证明,所述PAQR3肽能够抑制A375细胞的生长。图5D和5E证明,所述PAQR3肽对A375细胞的迁移能力有着抑制作用。图5F证明,所述PAQR3能够抑制A375细胞中Akt及Erk的磷酸化水平。
- 还没有人留言评论。精彩留言会获得点赞!