来源于透明质酸丰富的节点和导管系统的干细胞、其分离方法及用途与流程
本发明涉及来源于透明质酸丰富的节点和导管系统(Hyaluronic a cid-rich node and duct system,HAR-NDS)的干细胞、其分离方法及用途,更详细地,涉及具有分化为来源于透明质酸丰富的节点和导管系统的神经细胞的能力的作为成体干细胞的节点和导管干细胞(Node and ductal stem cells,NDSCs)及具有分化为造血细胞的能力的造血干细胞。
背景技术:
在经络及经穴之后,透明质酸丰富的节点和导管系统为在1960年代作为第三循环系统发现的结构体,其具有凤汉管(Bonghan)或普里莫血管系统(Primo Vascular System)的别称。透明质酸丰富的节点和导管系统由结(node)和导管(duct)形成,在整个身体中,以网状结构沿着脏器表面(Organ surface)、血管内(inside blood vessel)、淋巴管内(inside lymphatics)、皮肤及神经系统(nervous system)形成网络(Kim BH[非专利文献1];Soh KS[非专利文献2];Lee et al[专利文献1])。并且,在透明质酸丰富的节点和导管系统的结填充有先天性免疫细胞,尤其,存有丰富的肥大细胞、嗜酸粒细胞、嗜碱性粒细胞、嗜中性粒细胞及巨噬细胞(histiocytes)(Kwon BS et al[非专利文献3])。
干细胞(stem cell)是指具有自体再生和增殖能力及可分化为多种组织细胞的能力的细胞,可分为全能性干细胞(totipotent stem cell)、多潜能干细胞(Pluripotent stem cell)及多能干细胞(multipotent ste m cell)。
为了培养最优化的干细胞,生长因子和细胞因子(cytokine)的适当的组合是必不可少的。代表性地,在干细胞的生存、增殖及成熟(分化)过程中所需的干细胞因子(stem cell factor,SCF)(Broudy et al[非专利文献4])、FL(flt3/flt2 ligand)、白介素(interleukin,IL),白血病抑制因子(Leukemia inhibitory factor,LIF)、促血小板生成素(t hrombopoietin,TPO),碱性成纤维细胞生长因子(basic fibroblast gr owth factor,Basic FGF)等的生长因子和细胞因子起到这些功能。例如,若通过造血干细胞和造血支持细胞的共同培养对生长因子或细胞因子进行刺激,则可确认形成卵石区形成细胞(Cobblestone-area form ing cells,CAFCs)的造血前体细胞(hemopoietic precursor cells)。通过上述方法可确认造血干细胞的存在与否和增殖及分化(Nakahata et al[非专利文献5],Eaves et al[非专利文献6])。
存在于骨髓的成体非造血干细胞(non-hematopoietic stem cell)包括极小胚胎样干细胞(very small embryonic-like stem cell,VSELs)、多能成体干细胞(multipotent adult stem cell)、多能成体祖细胞(mul tipotent adult progenitor cell)、来源于骨髓的成体多系诱导性细胞(m arrow-isolated adult multilineage inducible cell)、间质干细胞(mesen chymal stem cell)及内皮祖细胞(endothelial progenitor cell)(Zuba-Surma EK et al[非专利文献7];Beltrami AP et al[非专利文献8];Ji ang Y et al[非专利文献9],Pittenger SC et al[非专利文献10])。
尤其,VSELs作为很少存在于啮齿类和人类的骨髓的小型胚胎样干细胞,针对谱系(lineage)及CD45为阴性,并表达干细胞标记,在体外(in vitro)可分化为外胚层、中胚层、内胚层等3种胚层(Kuci a M et al[非专利文献11])。
来源于造血干细胞和骨髓的VSELs记载于与神经干细胞相关的先行研究,并且,VSELs与造血干细胞的相关性也记载于先行研究(Sch effler B et al[非专利文献12];AV,T et al[非专利文献13])。尤其,人们已知道与神经细胞的发育相关的基因(Notch、Delta、neurogenin、OCT、Presenilin等)和生长因子(epidermal growth factor,NGF,br ain-derived neurotrophic factor),若投入如上所述的生长因子,则可观察使具有分化能力的成体非造血干细胞分化为神经元(neuron)、星形细胞(astrocyte)及少突细胞(oligodendrocyte)的现象,看通过神经细胞标记(GFAP、NeuN、βIII-tubulin、neurofilament、Brn3a、Thy-1、GFAP、vimentin、nestin、glutaminesynthetase)确认是否神经分化。将上述一系列过程成为神经细胞生成(neuropoiesis)或成体神经发生(neurognesis)。
最有名的神经细胞的分化(neuropoiesis)场所为被称为存在于脑中的室下区(subventricular zone,SVZ)的位于侧脑室表面的基底的薄细胞层和海马的齿状回(dentate gyrus,DG)及作为海马角(Cornu Ammonis,CA)部分的颗粒下层(subgranular zone,SGZ)。在SVZ使typeB1cells与神经干细胞发生反应,并形成神经前体细胞(type C cells)或神经母细胞(type A neuroblasts),在经过嘴侧迁移流(rostr al migratory stream,RMS)后,向嗅球(olfactory bulb)移动,并成熟为中间神经元(interneuron)。SGZ的DG使Radial type 1cells和type 2 cells分化为type 3 neuroblasts,在经过未成熟神经元(immature neurons)后,向颗粒细胞层(granule cell layer)移动,并成熟为颗粒神经元(granule neurons)。并且,在CA区域使锥体细胞(Pyramid al neuron)成熟(Goldman et al[非专利文献14];Scheffler,B et al[非专利文献15])。若利用具有如上所述的成体神经细胞的分化能力或再生(增殖)能力的成体干细胞移植,则有利于治疗神经变性疾病(neu rodegenerative diseases)、周围神经病变、帕金森病等。
如上所述,虽然已确定了来源于骨髓的成体干细胞或造血干细胞,并且发现了它们的体外制备及分化方法,但仍然在成体干细胞及造血干细胞的根本上的供应方面存在局限。
为此,本发明者为了开发成体干细胞及造血干细胞的新来源(sou rce)而努力的结果,可从透明质酸丰富的节点和导管系统分离成体干细胞及造血干细胞,所分离的细胞可在体外进行增殖。并且,在成体干细胞的情况下,分化为神经细胞的能力优秀,造血干细胞具有优秀的分化为造血细胞的能力,由此完成了本发明。
现有技术文献
专利文献
(专利文献1)1.KR 10-0950246,2010年03月23日非专利文献
(非专利文献1)1.Kim BH,The KyungrakSystem.J Jo Sun Med.,108:1-38,1965
(非专利文献2)2.Soh KS,Bonghan circulatory system as an ex tension of acupuncture meridians.J Acupunt Meridian Stud.,2:93-106,2009
(非专利文献3)3.Kwon BS et al.,Microscopic nodes and du cts inside lymphatics and on the surface of internal organs are rich in granulocytes and secretory granules.Cytokine.,60:587-592,2012
(非专利文献4)4.Broudy et.al.,Stem cell factor and hemato poiesis.Blood,90(4):1345-64,1997
(非专利文献5)5.Nakahata et al.,Hemopoietic colony-forming cells in umbilical cord blood with extensive capability to generate mono-and multipotential hemopoietic progenitors.J.Clin.Invest.,70:1324-1328,1982
(非专利文献6)6.Eaves et al.,Methology of long-term cultur e of human hematopoiesis,J.Tissue Cult.Methods.,13:55-62,1991
(非专利文献7)7.Zuba-Surma EK et al.,"Small stem cells"in adult tissues:very small embryonic-like stem cells stand up!.Cyto metry A.,75:4-13,2009
(非专利文献8)8.Beltrami AP et al.,Multipotent cells can be generated in vitro from several adult human organs(heart,liver,and bone marrow).Blood,110:3438-3446,2007
(非专利文献9)9.Jiang Y et al.,Pluripotency of mesenchymal stem cells derived from adult marrow.Nature,418:41-49,2002
(非专利文献10)10.Pittenger SC et al.,Multilineage potential of adult human mesenchymal stem cells.Science,284:143-147,1999
(非专利文献11)11.Kucia M et al.,A population of very small embryonic-like(VSEL)CXCR4(+)SSEA-1(+)Oct-4+ stem cells identified in adult bone marrow.Leukemia.20:857-869,2006
(非专利文献12)12.Scheffler B et al.,Marrow-mindedness:aperspective on neuropoiesis.Trends in Neurosciences,22(8):348-357,1999)
(非专利文献13)13.AV,T et al.,"From hematopoiesis to neu ropoiesis:evidence of overlapping genetic programs".Journal of Neu rochemistry,81:81-81,2002
(非专利文献14)14.Goldman et al.,"Adult neurogenesis:From canaries to the clinic".Journal of Neurobiology,36(2):267-286,1999
(非专利文献15)15.Scheffler,B et al.,"Phenotypic and funct ional characterization of adult brain neuropoiesis".PNAS,102(26):9353-9358,2005
(非专利文献16)16.Baum et al.,Isolation of a candidate human hematopoietic stem-cell population.PNAS,89(7):2804-2808,1992
(非专利文献17)17.Kirino T et al.,Selective vulnerability in the gerbil hippocampus following transient ischemia.Acta Neuropath ologica,62(3):201-208,1984
技术实现要素:
技术问题
本发明的目的在于,提供来源于透明质酸丰富的节点和导管系统的具有分化为神经细胞的能力的成体干细胞及其分离方法。
本发明的再一目的在于,提供通过对上述来源于透明质酸丰富的节点和导管系统的成体干细胞进行分化来制备神经细胞的方法。
本发明的还有一目的在于,提供一种如下的治疗剂,即,作为包含上述来源于透明质酸丰富的节点和导管系统的成体干细胞的细胞治疗剂治疗,治疗与神经疾病、癌、自体免疫性疾病、慢性感染疾病、难治性特应性疾病及组织损伤相关的需要脏器再生的疾病。
本发明的另一目的在于,提供作为来源于透明质酸丰富的节点和导管系统的细胞而具有分化为造血细胞的能力的造血干细胞的培养基其分离方法。
本发明的又一目的在于,提供以对上述来源于透明质酸丰富的节点和导管系统的造血干细胞进行分化的方式制备成熟的造血细胞的方法。
本发明的又一目的在于,提供如下的治疗剂,即,包含上述来源于透明质酸丰富的节点和导管系统的造血干细胞作为有效成分,用于治疗需要代替来源于骨髓及脾脏的造血功能的疾病或由肥大细胞(mast cell)及嗜酸粒细胞(eosinophil)介导的疾病或因骨髓引起的免疫功能的低下及亢进而产生的疾病。
解决问题的方案
为了达成上述目的,本发明提供具有分化为神经细胞的能力的来源于透明质酸丰富的节点和导管系统的成体干细胞。
并且,本发明提供来源于透明质酸丰富的节点和导管系统的成体干细胞的分离方法,包括:步骤(a),利用透明质酸丰富的节点和导管系统用染色试样对透明质酸丰富的节点和导管系统进行染色,来获取透明质酸丰富的节点和导管系统样品;以及步骤(b),从在上述步骤(a)中所获取的透明质酸丰富的节点和导管系统样品分离由Sca-1+、Lin-及CD45-组成的来源于透明质酸丰富的节点和导管系统的成体干细胞。
并且,本发明提供来源于透明质酸丰富的节点和导管系统的成体干细胞的分化方法,包括:步骤(a),通过在神经细胞分化培养基将来源于透明质酸丰富的节点和导管系统的成体干细胞与支持细胞共同培养来形成球体(sphere);以及步骤(b),利用单细胞(single cells)对所形成的上述球体进行游离后,对分化为神经细胞的生长因子进行处理,从而分化为神经细胞。
并且,本发明提供如下的治疗剂,即,作为包含来源于透明质酸丰富的节点和导管系统的成体干细胞作为有效成分的细胞治疗剂,用于治疗神经疾病及病症。
并且,本发明提供如下的治疗剂,即,包含来源于透明质酸丰富的节点和导管系统的成体干细胞作为有效成分,用于治疗与组织损伤相关的需要脏器再生的疾病。
并且,本发明提供如下的治疗剂,即,包含来源于透明质酸丰富的节点和导管系统的成体干细胞作为有效成分,用于治疗癌、自体免疫性疾病、慢性感染疾病以及难治性特应性疾病。
而且,本发明提供来源于透明质酸丰富的节点和导管系统的造血干细胞。
并且,本发明提供来源于透明质酸丰富的节点和导管系统的造血干细胞的分离方法,包括:步骤(a),利用透明质酸丰富的节点和导管系统用染色试样对透明质酸丰富的节点和导管系统进行染色,并进行提取来分离上述来源于透明质酸丰富的节点和导管系统的造血干细胞;以及步骤(b),通过在含有血清及细胞因子的集落形成细胞(col ony forming cells,CFCs)用甲基纤维素培养基培养在上述步骤(a)中所分离的透明质酸丰富的节点和导管系统的组织细胞来形成集落形成细胞。
并且,本发明提供来源于透明质酸丰富的节点和导管系统的造血干细胞的分化方法,步骤(a),通过在含有血清及细胞因子的培养基源于透明质酸丰富的节点和导管系统的造血干细胞中的起源于成血管细胞(hemangioblast)的细胞与造血支持细胞共同培养,来形成卵石区形成细胞;以及步骤(b),通过在集落形成细胞用甲基纤维素培养基传代培养在上述步骤(a)中所形成的卵石区形成细胞来形成成熟的造血细胞(hematopoietic cell)。
并且,本发明提供治疗剂,包含来源于透明质酸丰富的节点和导管系统的造血干细胞作为有效成分,用于治疗需要替换来源于骨髓或脾脏的造血功能的疾病。
并且,本发明提供治疗剂,包含来源于透明质酸丰富的节点和导管系统的造血干细胞作为有效成分,用于治疗由肥大细胞及嗜酸粒细胞介导的疾病。
并且,本发明提供治疗剂,包含来源于透明质酸丰富的节点和导管系统的造血干细胞作为有效成分,用于治疗因骨髓引起的免疫功能的低下或亢进而产生的疾病。
发明的效果
本发明可将很难从骨髓、外周血及脐带血(脐血)获取的作为成体干细胞的来源于透明质酸丰富的节点和导管系统的成体干细胞及造血干细胞作为替代来源从透明质酸丰富的节点和导管系统分离,从而可有效地适用于脑部疾病、神经疾病、慢性感染疾病、癌、自体免疫性疾病、脏器再生及各种难治性疾病的治疗。
附图说明
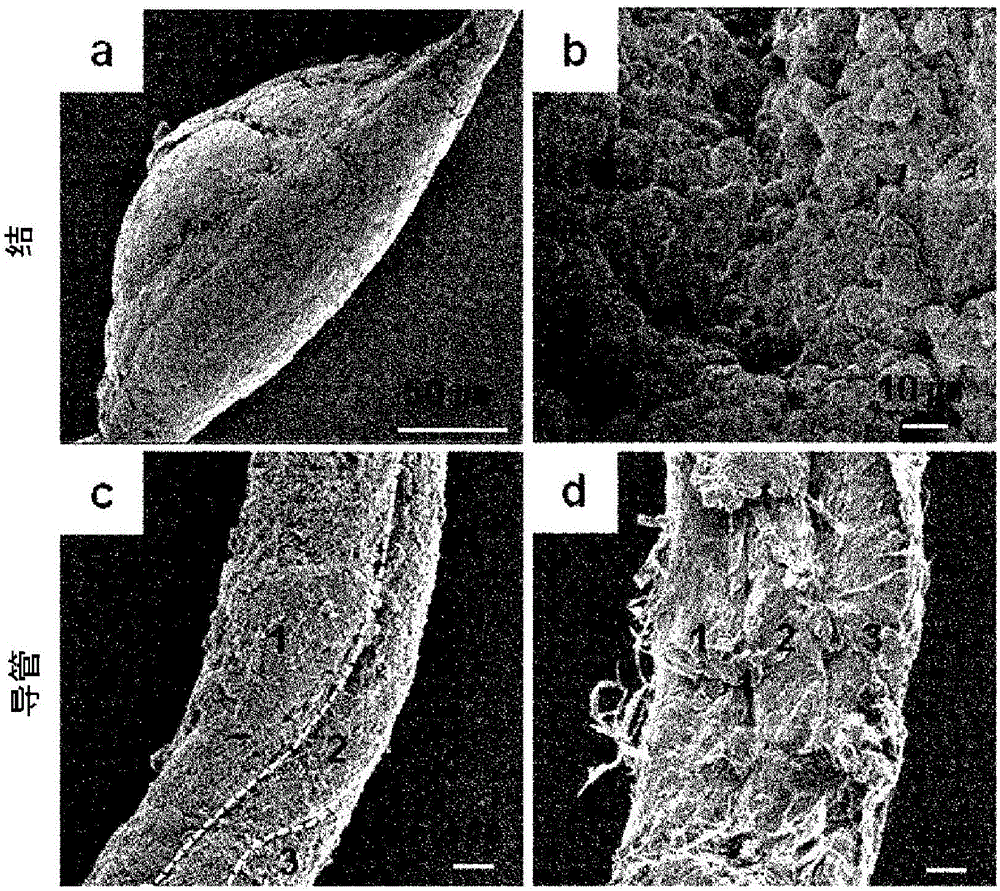
图1a、图1b、图1c、图1d为示出存在于小鼠肠道的表面、静脉和淋巴管(lymphatics)内部的透明质酸丰富的节点和导管系统的图,图1a为在对C57BL/6小鼠(5~6周龄)进行麻醉后通过1%的阿尔新蓝对存在于静脉和淋巴管内部的透明质酸丰富的节点和导管系统进行染色的结果的图,图1b为示出通过扫描电子显微镜(scanning electron microscope,SEM)观察透明质酸丰富的节点和导管系统的照片,图1c为示出通过透射电子显微镜(transmission electron microscope,TEM)观察HAR-node的照片,图1d为比较透明质酸丰富的节点和导管系统、血清、小便、腹膜液(PF)及淋巴管(LV)的玻尿酸(HA)的浓度的图。
图2为在对小鼠尾部的肌肉通过肌内注射注入作为HAR-NDS的染色法中的一个的1%的阿尔新蓝后示出淋巴管中央的透明质酸丰富的节点和导管系统(染色线)的图(可知,所分离的透明质酸丰富的节点和导管系统通常存在卷起的现象)。并且,通过静脉注射注入1%的阿尔新蓝后,若抽出静脉管的血液,则可确认以染色线显示的透明质酸丰富的节点和导管系统。
图3a、图3b、图3c、图3d、图3e为示出分离来源于骨髓的VSE Ls或来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞的方法的图。图3a为示出以进行VSELs或来源于透明质酸丰富的节点和导管系统的成体干细胞的流式细胞分析的方式分离Sca-1+Lin-CD45-细胞的通过流式细胞分选机(FACS sort er)的方法的图。图3b为通过流式细胞分析按百分比示出存在于骨髓或透明质酸丰富的节点和导管系统的Sca-1+Lin-CD45-细胞的存在量的图。图3c为示出利用流式细胞分选机从骨髓或透明质酸丰富的节点和导管系统分离的细胞的数量的图。图3d为在所分离的细胞中通过以7-AAD和Annexin V的免疫学染色示出细胞凋亡(apoptosis)的图。
图4为示出来源于透明质酸丰富的节点和导管系统的成体干细胞的SEM及TEM的照片。图4的A部分为通过流式细胞分选机分离的来源于透明质酸丰富的节点和导管系统的成体干细胞的细胞外观和细胞直径的SEM照片,图4的B部分为示出通过流式细胞分选机分离的来源于透明质酸丰富的节点和导管系统的成体干细胞的细胞内的小器官的TEM照片。
图5为示出由来源于骨髓的VSELs或来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞形成的球体形成(sphere formation)的图。图5的A部分为示出以将所分离的VSELs或来源于透明质酸丰富的节点和导管系统的成体干细胞与C2C12支持细胞(feeder)共同培养的方式实现球体形成的图。图5的B部分为示出来源于所分离的VSELs-或来源于透明质酸丰富的节点和导管系统的成体干细胞-的球体对碱性磷酸酶(alkaline phosphatase,AP)的发色结果的图,图5的C部分为示出球体形成的效率的,图5的D部分为示出具有VSELs或来源于透明质酸丰富的节点和导管系统的成体干细胞的分化能力的细胞的增殖的图。
图6为在来源于透明质酸丰富的节点和导管系统的成体干细胞球体(sphere)示出全能干细胞标记的表达的图。图6的A部分为利用来源于VSELs-及来源于透明质酸丰富的节点和导管系统的成体干细胞-的球体的cDNA和细胞溶解物对作为全能干细胞标记的Oct-4、Sox-2及Nanog的表达形态以逆转录聚合酶链反应(RT-PCR)(a)及蛋白质印迹(b)进行分析的图,而且将胚胎干细胞(ES)的脱氧核糖核酸(cDNA)和细胞溶解物作为阳性对照组使用,C2C12支持细胞的cDNA和细胞溶解物作为阴性对照组使用。图6的B部分为示出使来源于来源于透明质酸丰富的节点和导管系统的成体干细胞-及VSELs-的球体对全能干细胞标记的表达进行免疫染色的结果的图(比例尺:100x)。
图7为示出活体外的VSELs及来源于透明质酸丰富的节点和导管系统的成体干细胞的分化为神经细胞的图。图7的A部分为示出如下的结果,即,在使来源于VSELs-(图7的A部分的a)及来源于透明质酸丰富的节点和导管系统的成体干细胞-的(图7的A部分的b)球体机械游离为单细胞后,示出在对神经细胞分化诱导剂进行处理的神经细胞分化用培养基培养25日的结果,并且示出对所分化的细胞通过作为神经细胞标记的NeuN和MAP-2进行免疫染色的结果(神经细胞的细胞质表达NeuN阳性,神经细胞表达MAP-2阳性(比率:×100))。图7的B部分为示出通过RT-PCR及蛋白质印迹对未分化的单细胞的V SELs及来源于透明质酸丰富的节点和导管系统的成体干细胞的神经标记的表达形态进行分析的图,图7的C部分为示出通过RT-PCR及蛋白质印迹对诱导分化的VSELs及来源于透明质酸丰富的节点和导管系统的成体干细胞的神经细胞标记的表达形态进行分析的图(将胚胎干细胞(ES)的cDNA和细胞溶解物作为阴性对照组使用,将小鼠脑的cDNA和细胞溶解物作为阳性对照组使用)。
图8a、图8b、图8c、图8d为在缺氧缺血性脑损伤模型移植来源于透明质酸丰富的节点和导管系统的成体干细胞后示出在活体内神经细胞的分化的图。图8a为如下的图,即,在小鼠诱导缺氧缺血性脑损伤,在移植CM-Dil-labeled来源于透明质酸丰富的节点和导管系统的成体干细胞后,对脑进行分离,通过TTC染色法在所分离的脑确认脑的受损的部位(图8a的a部分),并且示出对脑损伤部位的比率进行检测的结果(图8a的b部分)。图8b为在海马的DG部位确认所移植的CM-Dil-labeled来源于透明质酸丰富的节点和导管系统的成体干细胞的神经细胞分化的图。并且,图8c为在海马的CA1和CA3部位确认所移植的CM-Dil-labeled来源于透明质酸丰富的节点和导管系统的成体干细胞的神经细胞分化的照片(作为神经细胞分化标记使用NeuN免疫染色法)。
图9为示出在透明质酸丰富的节点和导管系统发现的造血祖细胞的图。图9的A部分为示出造血祖细胞菌落的图,图9的B部分为示出通过Wright-Giemsa进行染色的来源于各菌落的细胞的照片。并且,图9的c部分为示出存在于BM及透明质酸丰富的节点和导管系统的肥大细胞祖细胞(mast cell progenitors,MCPs)的总计的曲线图,图9的d部分为示出对存在于MCPs菌落的细胞的表现型进行流式细胞分析的图。
图10为示出在透明质酸丰富的节点和导管系统发现的造血干细胞的图。图10的a部分为在体外(invitro)培养的卵石区形成细胞的照片(左面:倍率,×50;右面:单一菌落的放大,x100),图10的b部分为示出对在透明质酸丰富的节点和导管系统/OP9共同培养下的成血管细胞的存在与否进行流式细胞分析的曲线图,图10的c部分为示出在透明质酸丰富的节点和导管系统/OP9共同培养下已确认存在与否的造血干细胞(Hematopoietic stem cell,HSC)的图。并且,图10的d部分为示出针对Lin-卵石区形成细胞及各标记的Lin-CD45+卵石区形成细胞的相对百分比的图,图10的e部分为示出在透明质酸丰富的节点和导管系统/OP9共同培养下的卵石区形成细胞分化为骨髓(myeloi d)、B-细胞系及T-细胞系的图。
图11a、图11b为示出以诱导造血干细胞的方式形成的菌落的特征的图,图11的a部分为示出通过透明质酸丰富的节点和导管系统/OP9共同培养形成的卵石区形成细胞图,图11的b部分为示出对集落形成细胞的表现型进行流式细胞分析的曲线图。并且,图11的c部分为示出集落形成细胞的增殖能力的曲线图,图11的d部分为示出通过Wright-Giemsa或甲苯胺蓝进行染色的集落形成细胞的照片(比例尺:10μm;比率:×400)。
图12a、图12b、图12c为示出参与来源于骨髓、脾脏及透明质酸丰富的节点和导管系统的MCPs的出现的IFN-γ的重组形态的图,图12a为示出在正常小鼠及各种基因缺乏小鼠的透明质酸丰富的节点和导管系统下的MCPs菌落的出现频率的图,图12b部分为对比正常小鼠与IFN-γ-KO小鼠的从脾脏形成的造血祖细胞的数量的图。并且,图12c为示出存在于c-kitW-sh/W-sh及c-kitW-sh/+的透明质酸丰富的节点和导管系统的MCPs菌落的出现频率的图。
图13a、图13b、图13c为示出使骨髓细胞向透明质酸丰富的节点和导管系统移动的形态的图。
具体实施方式
本发明涉及来源于透明质酸丰富的节点和导管系统的干细胞,优选地,涉及来源于透明质酸丰富的节点和导管系统的具有分化为神经细胞的能力的成体干细胞及来源于透明质酸丰富的节点和导管系统的造血干细胞。
首先,对来源于透明质酸丰富的节点和导管系统的具有分化为神经细胞的能力的成体干细胞进行说明。
可从由存在于脏器表面、血管内、淋巴管内及皮肤的节点和导管形成的网状结构提取来源于透明质酸丰富的节点和导管系统的成体干细胞,尤其,在人类的情况下,可从胎盘(placenta)提取。上述提取方法为理论上可接收的方法,并且还可成为对研究者或患者不起到生物医药负担的迅速且有效的成体干细胞的提取方法。
为了从体内分离出透明的透明质酸丰富的节点和导管系统,优选地,可使用作为对透明质酸丰富的节点和导管系统进行选择性的染色的试样的亚甲蓝(Methylene blue)、杰纳斯绿B(Janus green B,JGB)及阿尔新蓝(Alcian blue)等,向体内以适当的浓度注入上述染色试剂,来使透明质酸丰富的节点和导管系统的获取实现顺畅地可视化。
在本发明中,用于确定来源于透明质酸丰富的节点和导管系统的成体干细胞的4种方法包括:1)将细胞特异性表现型标记(Marker)作为对象来识别细胞的类型的流式细胞分析;2)以平板效率(plating efficiency)及细胞集落的形态检测复制能力(增殖能力)的方法;3)作为全能干细胞的特异性表现型标记而利用免疫染色法的方法;以及4)在活体外利用与分化诱导剂及支持细胞的共同培养的分化能力检测方法和在活体内移植细胞来进行分化能力检测的方法。可通过记载于本说明书或公知的内容实现上述方法。
为了分离出来源于透明质酸丰富的节点和导管系统的成体干细胞,可使用流式细胞分析(Flow cytometry)和流式细胞分选机方法。即,可通过流式细胞术(Fluorescence-activated cell sorting,FACS)以单独或组合的方式对特异性识别在细胞的表面表达的标记(抗原)的抗体进行标记,通过附着在抗体的荧光物质对抗原的存在与否进行分析,并利用FACS sorter来获取所需的细胞。其中,可使用的荧光物质为异硫氰酸荧光素(Fluorescein isothiocyanate,FITC)、藻红蛋白(Phycoerythrin,PE)、别藻蓝蛋白(allo-phycocyanin,APC)、德克萨斯红(Texas Red,TR)、Cy3、Cy5、CyChrome、Red613、Red670、Tri-Color、QuantumRed、Alexa Fluor647等。
单独区分未分化的成体干细胞的普通免疫学表现型标记,并且在分化的步骤中也单独区分。例如,在造血干细胞的情况下,长期造血干细胞(long-term HSC,LT-HSC)具有c-kithigh、Sca-1high、Thy1.1low、IL-17R-、CD150+、Flt3-、Enderlin+、Rhodaminelow,CD34-,短期造血干细胞(Short-term HSC,ST-HSC)具有c-kit+、Sca-1+、Lin-、IL-17R-、Flt3+、Thy1.1low、CD11blow、CD34+。并且,在分化为造血干细胞的多能前体细胞(multipotent progenitor cell)的情况下,具有c-kit+、Sca-1+、Lin-、IL-17R-、Flt3+、Thy1.1-、CD11blow、CD34+。在人类的造血干细胞的情况下,具有CD34+、CD59+、Thy1+、CD38low/-、C-kit-/low或Lin-(Baumetal[非专利文献16])。
根据分化的程度,干细胞的表现型标记具有不同的表达形态。表现为干细胞及经细胞的表现型的免疫学标记包括:1)具有全分化能力的胚胎干细胞的Oct4、Sox2、Nanog、SSEA-1、SSEA-4、TRA-1-60、TRA1-81;2)根据大脑海马区域的神经细胞分化程度,免疫学标记包括Type 1(GFAP+、Nestin+、BLBP+、Sox2+)、Type 2a(GFAP+/-、Nestin+、BLBP+、Sox2+)、Type 2b(DCX+、NeuroD+、Prox1+、Nest in+、Ki67/PCNA+)、Type 3(DCX+、NeuroD+、Prox1+、PSA-NCAM+、GAD65+、βIII-tubulin+、MAP2ab+、Ki67/PCNA+)及Mature neur on(Calretinin+、NeuN+、NeuroD+、Prox1+、Calbindin+、βIII-tubulin+、MAP2ab+)等。
在本发明中,在干细胞的增殖过程中使用的培养基作为基础培养基(basal medium),包括杜尔伯科极限必需培养基(Dulbecco's Mod ified Eagle Medium,DMEM),DMEM-F12、NeuroCult Basal medium等,除此之外,只要是在本发明所属技术领域利用的培养基,即可使用。
在本发明中,能够以使移植的成体干细胞处于生存及分化的状态进行染色的亲脂性(lipophilic)荧光标记作为通常利用的标记,包括CM-DiI[Ex553/Em570]、SP-DiOC18(3)[Ex497/Em513]、FM-Dil[Ex553/570]、DiIC18(3)-DS[Ex555/Em570]、SPDiIC18(3)[Ex556/Em573]及DiIC18(5)-DS[Ex650/Em670]等,但不限定于此(略语:Ex为活化(Excitation)活化;Em为散发(Emission))。
在本发明中,缺血性疾病是指因向组织供给的血液的减少或中断而产生的功能异常、组织变性或坏死,具体地,包括心肌梗死及心绞痛等的缺血性心脏疾病以及伴随着肢体缺血、血流不足的损伤及截断等的创伤及骨折等。即,在本发明中,缺血性疾病不仅包括缺血性病症,还包括因损伤及伤害而产生的缺血状态。
在本发明中,神经疾病是指从神经细胞的细胞体(cell body)突出(projection)的神经突(neurite)存在异常的情况,除了阿耳茨海默氏病和帕金森病以外,代表性的疾病可包括忧郁症(depression)、癫痫(epilepsy)、多发性硬化症(multiple sclerosis)、燥症(mania)等。
在本发明中,脑部疾病大致表示成2种形态。第一种形态作为血管系统脑部疾病,包括因脑缺血、再灌注脑损伤、脑梗死、脑卒中、创伤性脑损伤(trauma)、缺氧性脑损伤(hypoxic brain damage)而产生的疾病。上述缺血性脑部疾病包括中风、脑卒中、脑溢血、脑梗死、头部损伤、阿耳茨海默氏病、血管性痴呆、克罗伊茨费尔特-雅各布病、昏睡及休克脑损伤等,但并不限定于此。在大脑产生短暂性脑缺血时,由于终止氧和葡萄糖的供给,因此在神经细胞产生ATP减少、水肿(edema),结果导致脑的大面积损伤。在发生脑缺血后的一段相当长的时间后,会产生神经细胞的凋亡,将其称为迟发性神经元损伤(delayed neuronal death)(Kirino T et al[非专利文献16])。
第二种形态作为退行性脑部疾病,伴随着在中枢神经系统的神经细胞发生退行性变化而产生。退行性脑部疾病包括阿耳茨海默氏病、轻度认知障碍、中风、血管性痴呆、额颞痴呆、路易体痴呆、克罗伊茨费尔特-雅各布病、创伤性头部损伤、梅毒、后天性免疫缺乏综合征、其它病毒感染、脑脓肿、脑瘤、多发性硬化症、因代谢性疾病而产生的痴呆、低氧血症、帕金森病、肌肉萎缩症、亨丁顿舞蹈症、皮克病、肌萎缩性侧束硬化症、癫痫、缺血、中风、注意力缺陷-多动障碍、精神分裂症、忧郁症、躁郁症、创伤后应激障碍,脊髓损伤及脊髓炎等,但并不限定于此。
除非另有说明,术语“治疗”是指逆转或缓解适用于上述内容的疾病及病症或上述疾病及病症的一种以上的症状或者抑制或预防上述疾病及病症的进展。如本发明所使用地,在“用于治疗”被定义为如上所述的情况下,术语“治疗”是指进行治疗的行为。因此,在哺乳动物疾病的“治疗”或“治疗法”包括:(1)抑制相应疾病的成长;(2)预防疾病的扩散;(3)减轻疾病;(4)预防疾病的复发;以及(5)缓解(palliating)疾病的症状。
为了治疗缺血性疾病,以药理学有效剂量投入本发明的组合物。“药理学有效剂量(therapeutically effective amount)”是指使所投入的化合物的量一定程度上降低治疗中的障碍的一种或一种以上的症状。因此,药理学有效剂量具为如下的使用量,即,上述使用量包括:(1)逆转疾病的进展速度的效果;(2)一定程度禁止疾病的进一步进展的效果;以及(3)一定程度减轻(优选地,去除)与疾病相关的一种或一种以上的症状的效果。
本发明的细胞治疗剂可以为包含药学上可接受的载体(转运体)及/或者添加物等的组合物。例如,可包括无菌水、生理盐水、惯用的缓冲剂(磷酸、柠檬酸、除此之外的有机酸等)、稳定剂、盐、防氧化剂(抗坏血酸等)、界面活性剂、悬浮剂、等渗剂或保鲜剂等。为了局部给药,优选地,与生物聚合物等的有机物、羟基磷灰石等的无机物组合,具体地,与胶原蛋白基质、聚乳酸聚合物或共聚物、聚乙二醇聚合物或共聚物及其化学衍生物等组合。适合于药学上可接受的载体及制剂详细记载于Remington's Pharmaceutical Sciences(19thed.,1995)。
例如,可在缺血部位的周边的生存肌体(骨骼肌或心肌等)中的1个位置或多个位置投入定量给药量,给药量为1.0×105~1.0×108细胞/kg(体重),更优选地,1.0×106~1.0×107细胞/kg(体重)。但是,给药量可根据患者的体重、年龄、性别、症状、给药组合物的形态、给药方法等不同,本发明所属技术领域的普通技术人员可适当地进行调节。给药次数为1次或者在临床上可允许的副作用的范围内进行多次给药,针对给药部位,也可在1个位置或多个位置进行给药。对人类以外的动物也可按每kg与人类相同的给药量给药。作为本发明的治疗对象动物,可包括人类和用于其它目的的哺乳动物,具体地,包括人类、猴子、小鼠、老鼠、兔、羊、牛、狗、马、猪等。
优选地,本发明的缺血性疾病治疗剂为包括静脉内给药、腹腔内给药、肌肉内给药、皮下给药或局部给药等的非口服给药,更优选地,可利用皮下给药或局部给药进行给药,主要可通过直接向损伤部位注入的方法进行给药。
本细胞治疗剂的形态能够以注射器或盛在设备(装置)的最终注入形态、可冷冻的冷冻管(cryovial)的形态或可盛液态药品的无热源的玻璃瓶、橡胶塞和铝盖形态填充。设备的形态可使用注射器、多功能注射器等,在肢体缺血性疾病的情况下,利用可防止细胞在对细胞进行给药的过程中因剪切(shear)而损伤且最小化患者的疼痛的注射针头,优选地,考虑到在20Guage至31Guage的范围内进行给药的部位或肌肉的深度,注射器或设备使用未对细胞生存能力起到影响的材料。
在本发明的一观点中,涉及具有分化为神经细胞的能力的来源于透明质酸丰富的节点和导管系统的成体干细胞。
本发明的特征在于,具有上述透明质酸丰富的节点和导管系统的哺乳动物选自由小鼠、老鼠、兔、羊、牛、狗、马、猪、猴及人类组成的组。并且,本发明的特征在于,上述透明质酸丰富的节点和导管系统为存在于脏器表面、血管内、淋巴管内及皮肤的节点和导管形成的网状结构。
本发明的特征在于,上述来源于透明质酸丰富的节点和导管系统的成体干细胞具有选自由Sca-1+、Lin-及CD45-组成的组的VSELs(Very small embryonic-like stem cell)的免疫学特性。并且,上述来源于透明质酸丰富的节点和导管系统的成体干细胞具有选自由Oct4+、Sox2+、Nanog+及SSEA-1+组成的组的胚胎干细胞的免疫学特性。
在本发明的再一观点中,涉及如下的来源于透明质酸丰富的节点和导管系统的成体干细胞的分离方法,即,包括:步骤(a)以通过透明质酸丰富的节点和导管系统用染色试样对透明质酸丰富的节点和导管系统进行染色的方式获取透明质酸丰富的节点和导管系统样品;以及步骤(b),从在上述步骤(a)所获取的透明质酸丰富的节点和导管系统样品分离由Sca-1+、Lin-及CD45-形成的来源于透明质酸丰富的节点和导管系统的成体干细胞。
本发明的特征在于,上述透明质酸丰富的节点和导管系统为由存在于脏器表面、血管内、淋巴管内及皮肤的节点和导管形成的网状结构。并且,本发明的特征在于,上述透明质酸丰富的节点和导管系统用染色试样选自由阿尔新蓝、亚甲蓝及杰纳斯绿B组成的组。
本发明的特征在于,上述来源于透明质酸丰富的节点和导管系统的成体干细胞具有选自由Sca-1+、Lin-及CD45-组成的组的VSELs的免疫学特性或选自由Oct4+、Sox2+、Nanog+及SSEA-1+组成的组的胚胎干细胞的免疫学特性。
在本发明的还有一观点中,涉及如下的来源于透明质酸丰富的节点和导管系统的成体干细胞的分化方法,即,包括:步骤(a),以在神经细胞分化培养基与支持细胞共同培养来源于透明质酸丰富的节点和导管系统的成体干细胞的方式形成球体;以及步骤(b),通过单细胞对所形成的上述球体进行游离后,对分化为神经细胞的生长因子进行处理,从而分化为神经细胞。
本发明的特征在于,上述支持细胞为C2C12(小鼠成肌细胞系(Mouse myoblast cell line))。并且,本发明的特征在于,上述球体表达对碱性磷酸酶(AP)、Oct4、Sox2、Nanog及SSEA-1进行表达的胚胎干细胞特异性标记。
本发明的特征在于,上述分化为神经细胞的生长因子选自由rhEGF、FGF-2及NGF组成的组,并且,本发明的特征在于,上述神经细胞表达对NeuN、MAP2、神经胶质酸性蛋白(GFAP)、巢蛋白(nest in)及βIII微管蛋白(tubulin)进行表达的神经细胞特异性标记。
本发明的特征在于,上述神经细胞在活体内对脑部疾病、神经系统的疾病及病症模型具有治疗效果。
在本发明另一观点中,涉及如下的治疗剂,即,作为包含来源于透明质酸丰富的节点和导管系统的成体干细胞作为有效成分的细胞治疗剂,用于治疗神经疾病及病症。
在本发明又一观点中,涉及如下的治疗剂,即,包含来源于透明质酸丰富的节点和导管系统的成体干细胞作为有效成分,用于治疗与组织损伤相关的需要脏器再生的疾病。
在本发明又一观点中,涉及如下的治疗剂,即,包含来源于透明质酸丰富的节点和导管系统的成体干细胞作为有效成分,用于治疗癌、自体免疫性疾病、慢性感染疾病及过敏性的难治性疾病。
在本发明的一实施例中,通过电子显微镜对来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞的形态及细胞内部结构进行观察。其结果,来源于透明质酸丰富的节点和导管系统的成体干细胞可具有未分化的细胞的特性且形成球体。
在本发明的再一实施例中,基于增殖能力及表现型对由来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞形成的球体的特性进行研究,其结果,相对于来源于骨髓的VSELs,来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞具有较高的球体-形成率和平板效率,由此确认上述来源于透明质酸丰富的节点和导管系统的成体干细胞具有旺盛的增殖能力,在全能干细胞标记的表达方面也比骨髓干细胞更接近胚胎干细胞,由此上述来源于透明质酸丰富的节点和导管系统的成体干细胞具有更高的分化能力。
在本发明的还有一实施例中,对来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞的分化为神经细胞的前后特性进行比较的结果,具有干细胞的特性的来源于透明质酸丰富的节点和导管系统的成体干细胞球体因对生长因子(rhEGF、FGF-2及NGF)和神经细胞分化特异性的培养基而在活体外部分化为神经细胞,神经细胞标记对GFAP、巢蛋白、βIII微管蛋白、NeuN及MAP-2进行表达,由此可确认为具有来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞分化能力的成体干细胞。
在本发明的另一实施例中,以在诱导有缺氧缺血性脑部疾病的小鼠移植来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞的方式观察治疗效果的结果,确认到来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞会减少产生脑损伤的梗塞部位的体积且以分布在海马的DG、CA1及CA3的方式分化为神经细胞,从而显示脑的解剖学恢复形态。
然后,对来源于透明质酸丰富的节点和导管系统的造血干细胞进行说明。
“造血细胞”是指造血路径来源的任一细胞。上述细胞对可允许的形态学特征及作为造血系统的特征的表现型学(免疫学)标记进行表达。上述造血细胞包括造血祖细胞、菌落形成细胞及完全分化的细胞。“成血管细胞(前驱体)”、“造血祖细胞”或“造血干细胞”为具有生成完全分化的造血细胞且具有自我复制能力的细胞。
在本发明说明的前体细胞是指包括从未分化状态的细胞到完全分化的成血管细胞及造血祖细胞(Hematopoietic progenitor cells,HSC)的具有所有中间过程的自我复制能力及分化能力的造血细胞。起源于成血管细胞的造血干细胞因各种细胞因子而分化为骨髓系统的巨核细胞、红血细胞、肥大细胞、嗜碱性粒细胞、嗜中性粒细胞、嗜酸粒细胞、单核细胞(巨噬细胞)或淋巴(lymphoid)系统的自然杀伤细胞(natural killer cell)、T-淋巴球及B-淋巴球等的造血细胞。
可从由存在于脏器表面、血管内、淋巴管内及皮肤的节点和导管形成的网状结构提取来源于透明质酸丰富的节点和导管系统的造血干细胞,尤其,在人类的情况下,可从胎盘提取。上述提取方法为理论上可接收的方法,并且还可成为对研究者或患者不起到生物医药负担的迅速且有效的成体干细胞的提取方法。
为了从体内分离出透明的透明质酸丰富的节点和导管系统,优选地,可使用作为对透明质酸丰富的节点和导管系统进行选择性的染色的试样的亚甲蓝、杰纳斯绿B及阿尔新蓝等,具体地,向体内以适当的浓度注入上述染色试剂,来使透明质酸丰富的节点和导管系统的获取实现顺畅地可视化。
在本发明中,用于确定造血干细胞的3种方法包括:1)将细胞特异性表现型标记作为对象来识别细胞的类型的流式细胞分析;2)以平板效率及细胞集落的形态检测复制能力(增殖能力)的方法;以及3)与分化诱导剂及支持细胞的共同培养的分化能力检测方法。可通过记载于本说明书或公知的内容实现上述方法。
为了分离出来源于透明质酸丰富的节点和导管系统的成体干细胞,可使用流式细胞分析。即,可通过FACS(Fluorescence-activated cell sorting)以单独或组合的方式对特异性识别在细胞的表面表达的标记(抗原)的抗体进行标记,通过附着在抗体的荧光物质对抗原的存在与否进行分析,并分离、获取所需的细胞。其中,可使用的荧光物质为FITC、PE、APC、TR、Cy3、Cy5、CyChrome、Red613、Red670、Tri-Color、QuantumRed、Alexa Fluor 647等。
未分化的造血干细胞的普通免疫学表现型标记在小鼠和人类中有所不同,在小鼠的情况下,具有CD34low/-、SCA-1+、Thy1+/low、CD38+、C-kit+及Lin-,在人类的情况下,具有CD34+、CD59+、Thy1+、CD38low/-、C-kit-/low及Lin-(Baum et al[非专利文献16])。
CD135(FLK2、FLT3、STK1)在造血干细胞未进行表达,但在多能干细胞的淋巴系统祖细胞中未进行表达的标记。
成血管细胞的普通免疫学表现型标记为CD31(PECAM-1)、CD34、ECadherin(CD324)、Endoglin(CD105)、EphB4、Tie2(CD202b)、VE-Cadherin(CD144)及VEGFR2(Flk1)等。
在本发明中,使用于造血干细胞的增殖的培养基作为基础培养基,包括最低基础培养基(Minimum Essential Medium,MEM)、DMEM、DMEM-F12、RPMI(Roswell Park MemorialInstitute)、K-SFM(Ker atinocyte Serum Free Medium)、NeuroCult Basal Medium等,除此之外,只要是在本发明所属技术领域利用的培养基,即可使用。
在本发明的又一观点中,涉及来源于透明质酸丰富的节点和导管系统的造血干细胞。
在本发明的特征在于,具有上述透明质酸丰富的节点和导管系统的动物为脊椎动物,可适用的上述脊椎动物为小鼠、老鼠、兔、羊、牛、狗、马、猪、猴及人类,但并不限定于此。
本发明的特征在于,上述透明质酸丰富的节点和导管系统为由存在于脏器表面、血管内、淋巴管内及皮肤的节点和导管形成的网状结构。
本发明的特征在于,来源于透明质酸丰富的节点和导管系统的造血干细胞起源于具有CD45-、B220-及FLK-1+免疫学特性的细胞群的成血管细胞。
本发明的特征在于,来源于透明质酸丰富的节点和导管系统的造血干细胞包括具有起源于上述成血管细胞的Sca-1+、CD59+、Lin-、CD45+、B220+、c-kit+、CD34-及CD135-免疫学特性的细胞群的造血祖细胞。
本发明的特征在于,来源于透明质酸丰富的节点和导管系统的造血细胞选自从上述造血祖细胞分化的骨髓系统的巨核细胞、红血细胞、肥大细胞、嗜碱性粒细胞、嗜中性粒细胞、嗜酸粒细胞及单核细胞(巨噬细胞)或分化为淋巴系统的自然杀伤细胞、T-淋巴球及B-淋巴球的细胞组的细胞。
本发明的又一观点中,涉及如下的来源于透明质酸丰富的节点和导管系统的造血干细胞的分离方法,即,包括:步骤(a),通过透明质酸丰富的节点和导管系统用染色试样对透明质酸丰富的节点和导管系统进行染色,并以提取的方式分离上述透明质酸丰富的节点和导管系统的细胞;以及步骤(b),以在包含血清及细胞因子的集落形成细胞用甲基纤维素培养基培养在上述步骤(a)所分离的透明质酸丰富的节点和导管系统的组织细胞的方式形成集落形成细胞。
本发明的特征在于,上述透明质酸丰富的节点和导管系统为由存在于脏器表面、血管内、淋巴管内及皮肤的节点和导管形成的网状结构。
本发明的特征在于,上述透明质酸丰富的节点和导管系统用染色试样选自由阿尔新蓝、亚甲蓝及杰纳斯绿B组成的组。
本发明的特征在于,上述细胞因子选自由红细胞生成素(erythrop oietin)、SCF、粒细胞-巨噬细胞集落刺激因子(Granulocyte macroph age colony-stimulating factor,GM-CSF)、IL-3/-7、FL((flt3/flt2 ligand)、LIF及TPO。
本发明的特征在于,上述集落形成细胞用甲基纤维素培养基为粒细胞、红细胞、单核细胞及巨核细胞集落形成单位(CFU-GEMM)、甲基纤维素(methylcellulose)。
本发明的特征在于,还包括如下的步骤,即,通过集落形成细胞用染色试样对所形成的上述集落形成细胞进行染色,从而将菌落的类型分为CFU-GEMM、粒细胞巨噬细胞集落生成单位(colonyforming unit-granulocyte macrophage,CFU-GM)、红细胞系爆裂形成单位(burst-forming unit-erythroid colonies,BFUE)及肥大细胞祖细胞(mast cell progenitors,MCPs)。
本发明的特征在于,上述集落形成细胞用染色试样为甲苯胺蓝(或瑞氏-吉姆萨复合染色液)。
在本发明的又一观点中,涉及如下的来源于透明质酸丰富的节点和导管系统的造血干细胞的分化方法,即,包括:步骤(a),在包含血清以及细胞因子的培养基与造血支持细胞共同培养源于透明质酸丰富的节点和导管系统的造血干细胞中的起源于成血管细胞的细胞,并形成卵石区形成细胞;以及步骤(b),以在卵石区形成细胞用甲基纤维素培养基传代培养在上述步骤(a)形成的卵石区形成细胞的方式形成成熟的造血细胞。
本发明的特征在于,上述造血支持细胞为OP9或OP9-DL1。
本发明的特征在于,上述细胞因子选自由红细胞生成素、SCF、GM-CSF、IL-3/-7、FL((flt3/flt2ligand)、LIF及TPO组成的组。
本发明的特征在于,上述集落形成细胞用培养基为CFU-GEMM甲基纤维素。
本发明的特征在于,还包括以通过集落形成细胞用染色试样对上述成熟的造血细胞进行染色的方式区分形成菌落的细胞的大小和分化形态的步骤。
本发明的特征在于,上述集落形成细胞用染色试样为甲苯胺蓝或Wright-Giemsa。
在本发明的又一观点中,涉及如下的治疗剂,即,包含来源于透明质酸丰富的节点和导管系统的造血干细胞作为有效成分,用于治疗需要替换来源于骨髓或脾脏的造血功能的疾病。本发明的特征在于,上述疾病选自由因骨髓的病症而产生的造血功能的麻痹、缺血性疾病以及因脏器移植时产生的骨髓破坏而产生的病症组成的组。
在本发明的又一观点中,涉及治疗剂,包含来源于透明质酸丰富的节点和导管系统的造血干细胞的作为有效成分,用于治疗由肥大细胞及嗜酸粒细胞介导的疾病。本发明的特征在于,上述疾病选自由局部或全身过敏(allergy)、哮喘(Asthma)、癌及寄生虫感染组成的组。
在本发明的又一观点中,涉及治疗剂,包含来源于透明质酸丰富的节点和导管系统的造血干细胞作为有效成分,用于治疗因骨髓引起的免疫功能的低下或亢进而产生的疾病。本发明的特征在于,上述疾病选自由自体免疫、癌、病毒感染及细菌感染组成的组。
在本发明的又一实施例中,为了分析存在于透明质酸丰富的节点和导管系统组织及透明质酸丰富的节点和导管系统的造血细胞的特性,通过对存在于小鼠脏器的表面、静脉及淋巴管内部的透明质酸丰富的节点和导管系统进行分离,来确认了在与作为造血细胞的生产来源的骨髓、外周血及脐带血(脐血)异质的被称为透明质酸丰富的节点和导管系统的系统中分布多种造血细胞及免疫细胞的内容(图1),但不限定于此。
在本发明的又一实施中,在分析来源于透明质酸丰富的节点和导管系统的菌落(细胞集落)的特性的结果,确认了在透明质酸丰富的节点和导管系统存在造血祖细胞,而且若在活体外条件下培养来源于透明质酸丰富的节点和导管系统的细胞,则可形成多种类型的造血菌落,在透明质酸丰富的节点和导管系统存在成血管细胞-样细胞的是指会产生造血现象(图9),但并不限定于此。
在本发明的又一实施例中,为了查明在透明质酸丰富的节点和导管系统获取的造血干细胞的特性,若在来源于透明质酸丰富的节点和导管系统的细胞添加适当的细胞因子,并在造血支持细胞上进行培养,则借助成血管细胞可使全能干细胞从造血干细胞分化为血液细胞(图10),但并不限定于此。
在本发明的又一实施例中,观察以诱导来源于透明质酸丰富的节点和导管系统的造血祖细胞的方式形成的菌落的特征的结果,在借助来源于透明质酸丰富的节点和导管系统的全能干细胞分化为成血管细胞-样细胞后,可额外地分化为造血祖细胞,进而可生产多种造血细胞(图11及表2),但并不限定于此。
以下,通过实施例对本发明进行更详细的说明。这些实施例仅用于例示本发明,本发明的范围并不局限于这些实施例,这对本发明所属技术领域的普通技术人员是显而易见的。
[实施例1]透明质酸丰富的节点和导管系统组织(tissue)及来源于透明质酸丰富的节点和导管系统的造血细胞特性
1-1:透明质酸丰富的节点和导管系统的获取过程
以肌肉注射的方式向具有野生型IFN-γ-/-或IFN-γ+/-C57BL/6的形质的小鼠(Orient,Korea)注射舒泰(Zoletil)(2.5mg/kg)及龙朋(Rompun)(0.5mg/kg),从而完成麻醉。然后,利用立体显微镜(stereomicroscope,Zeiss Stereo Discovery.V20)以如下的方法获取透明质酸丰富的节点和导管系统。
1)为了获取存在于小肠(或肝脏)表面的透明质酸丰富的节点和导管系统,沿着腹部的白线(linea alba)切开,并小心地抬起腹壁,在进行剖腹的过程中获取前壁(anterior wall)与小肠(或肝脏)之间及脏器表面的透明质酸丰富的节点和导管系统。
2)为了获取静脉透明质酸丰富的节点和导管系统,向髂静脉(iliac veins)注射约0.5ml的1%的阿尔新蓝,在用夹子固定上端及下端的腰静脉(lumbar vein)后,以切开血管的方式排放血液,并从静脉内获取形成染色线的透明质酸丰富的节点和导管系统。
3)为了获取淋巴管内部(Intra-lymphatic)的透明质酸丰富的节点和导管系统,以皮下注射(Subcutaneous Injection,SC)的方式向侧面尾基部注射0.5ml的1%阿尔新蓝,在向直肠的1cm末尾和尾静脉中间完成注射后获取透明质酸丰富的节点和导管系统。
其结果,如图1a所示,在对C57BL/6小鼠(5~6周龄)进行麻醉后,若通过1%的阿尔新蓝对存在于静脉和淋巴管内部的透明质酸丰富的节点和导管系统进行染色,则可发现以透明质酸丰富的节点和导管系统的结(星形)为中心以大肠(LI)、小肠(SI)及腹壁(AW)相连接的3个导管(图1a的a部分)。在腰静脉(虚线箭头)内部(图1a的b部分,以波状线显示静脉的边界)及淋巴管中央(图1a的c部分,箭头)观察到透明质酸丰富的节点和导管系统(三角箭头)。在图1a的放大的照片中,以波状线显示了淋巴管(LV)的边界(图1a的d部分),还确认到来源于结(星形)的几条分支(图1a的b部分)。
即,若以向右侧及左侧尾基部注射1%的阿尔新蓝的方式对淋巴管内部(intralymphatic)的透明质酸丰富的节点和导管系统进行染色,则在腰动脉、坐骨及/或者尾骨部的淋巴管内部形成染色线(图1a的a部分,图1a的b部分),通过固定导管的末端,来在淋巴管内部获取完成染色的透明质酸丰富的节点和导管系统。当透明质酸丰富的节点和导管系统已从淋巴管内部分离时,观察到因弹力产生急速卷起(roll up)的现象(图1a的c部分)。
为了分离静脉内部的透明质酸丰富的节点和导管系统,而向左侧尾静脉注射1%的阿尔新蓝的结果,在腰静脉的内部形成染色线(图1b的a部分)或蓝色结(图1b的c部分),固定两个静脉的末端,并以沿着静脉纵向切开的方式排放血液(图1b的b部分),从而可获取完成染色的透明质酸丰富的节点和导管系统。
结果,若以通过肌肉及静脉注射向小鼠注射1%的阿尔新蓝的方式对淋巴管及静脉内部的透明质酸丰富的节点和导管系统进行染色,则可容易地获取透明质酸丰富的节点和导管系统。
1-2:透明质酸丰富的节点和导管系统的电子显微镜观察
利用Karnovsky固定液(2%的多聚甲醛、2%的戊二醛、0.05M的二甲胂酸钠缓冲液(sodium cacodylate buffer,pH7.2)以在4℃的温度下放置2小时左右的方式固定所获取的来源于脏器表面的透明质酸丰富的节点和导管系统。在利用透射电子显微镜(transmission EM)的情况下,利用1%的四氧化锇(EMS,Washington)以在4℃的温度下放置2小时左右的方式最终固定透明质酸丰富的节点和导管系统,使用乙醇进行脱水,插在SURR树脂(ERL、DER、NSA及DMAE混合物)(EMS,华盛顿(Washington)),并在70℃的温度下聚合过夜。在利用超薄切片机(RMC MTX,美国(USA))的钻石刀(戴通钻石刀(Diatome),瑞士(Switzerland))切割超薄(0.5~1.0μm)切片后,利用乙酸铀酰(EMS,Washington)进行20分钟染色后,对柠檬酸铅(leadcitrate)进行10分钟处理。利用以80-kV的加速电压运行的透射电子显微镜(JEM1010,JEOL,日本(JAPAN))分析切片。
在利用扫描电子显微镜(Scanning EM,SEM)的情况下,在以Karnovsky固定液固定透明质酸丰富的节点和导管系统后,以0.05M的二甲胂酸钠缓冲液(pH7.2,4℃)以每次10分钟的方式清洗3次。然后,利用1%的四氧化锇在0.05M的二甲胂酸钠缓冲液(pH7.2)最终固定透明质酸丰富的节点和导管系统后,在常温以蒸馏水清洗2次。利用乙醇在常温中分别进行10分钟的透明质酸丰富的节点和导管系统的脱水过程。使用100%的乙酸异戊酯以每次10分钟的方式在常温中凝固2次透明质酸丰富的节点和导管系统,借助液态二氧化碳在临界点(critical point)进行干燥。将所干燥的上述透明质酸丰富的节点和导管系统安装于金属底座(stubs),利用喷涂刻蚀仪(Sputter Coater)以金进行涂敷后,利用场致发射扫描电子显微镜(Field-Emission SEM;Carl Zeiss SUPRA 55VP,Germany)对透明质酸丰富的节点和导管系统进行观察。
其结果,如图1b所示,可通过扫描电子显微镜观察透明质酸丰富的节点和导管系统的结的表面(图1b的a部分),结的内部(图1b的b部分)及导管(图1b的c、d部分),并且由各子导管(sub-duct)(边界线:波状线(图1b的c部分))的小导管1、2、3(ductules)形成。对图1c的在透射电子显微镜下观察到的HAR-结进行观察的结果,结包含3个导管(图1c的a部分,箭头)及多种细胞。并且,在这些细胞中观察到肥大细胞、多核细胞、单核细胞、嗜酸粒细胞及小型的未成熟的多种细胞(图1c的b部分-g部分)。
1-3:玻尿酸(Hyaluronic acid)定量分析
在获取存在于小鼠的脏器表面的透明质酸丰富的节点和导管系统以及对其进行定量后,浸泡在磷酸缓冲液(Phosphate buffered saline,PBS),并以液氮进行快速冻结。通过粉碎机使所冻结的透明质酸丰富的节点和导管系统均质化,在离心分离(20分钟,4℃,2000xg)后获取上清液。使用小鼠玻尿酸酶联免疫(ELISA)试剂盒(SunRed,上海尚乐生物科技有限公司(Shanghai Sunred Biological Technology))以制造商(SunRed)的实验方法检测存在于上清液的玻尿酸的含量。并且,对血清、小便、腹膜液及淋巴管的玻尿酸进行比较定量检测。
其结果,如图1D所示,对血清、小便、腹腔液、淋巴管进行比较时,在透明质酸丰富的节点和导管系统检测出最高浓度的玻尿酸。
1-4:统计分析
作为统计程序的prism5.0graphpad(圣地亚哥(San Diego),CA)对所有数据进行分析,使用学生t检验来确认组之间的统计学意义(**P<0.01,*P<0.05)。对图1~图13的结果也相同的适用统计分析。
根据上述结果,确认到透明质酸丰富的节点和导管系统在小鼠的脏器表面上形成蛛网形状的节点和导管(图1a的a部分)。为了容易获取透明质酸丰富的节点和导管系统,需要阿尔新蓝染色,对静脉内部(图1a的b部分)及淋巴管(图1a的c、d部分)进行染色的结果,可知,HAR-导管从结分叉(图1a的a、b部分的星号())。
参照利用电子显微镜的透明质酸丰富的节点和导管系统的SEM结果,可知,脏器表面的HAR-结形成椭圆形口袋形状,沿着两侧末端具有细长的导管(图1b的a部分)。并且,可知,在HAR-结内填充有细胞(图1b的b部分),HAR-导管由3个小导管(subducts,duct ules)形成(图1b的c、d部分)。
并且,根据TEM结果,HAR-结的3个泪管(sinuses,箭头)起到3个导管的路径的功能,并且填充有细胞(图1c的a部分),其中,某些为肥大细胞(图1c的b部分)、多形核白细胞(polymorphonucle ar leukocytes)(图1c的c部分)、单核细胞(monocytes)(图1c的d部分)、嗜酸粒细胞(图1c的e部分)及相对于大核具有相对少比率的细胞质的小型未成熟细胞(图1c的f、g部分)。
而且,透明质酸丰富的节点和导管系统、淋巴管、血清、小便及腹腔液中,透明质酸丰富的节点和导管系统具有最大浓度的玻尿酸(图1d)。
结果,具有与作为造血细胞的生产来源的骨髓、外周血及脐带血(脐血)异质的被称为透明质酸丰富的节点和导管系统的高浓度的玻尿酸的组织(tissue)包含多种造血细胞及免疫细胞。
[实施例2]来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞的分离
为了获取来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞(对照组:来源于骨髓的VSEL s),利用表现型标记抗体、流式细胞分析及流式细胞分选机因从包含从透明质酸丰富的节点和导管系统分离的单核细胞(mononuclear cell s)的细胞悬浮物分离来源于透明质酸丰富的节点和导管系统的成体干细胞的方式进行实验。将来源于透明质酸丰富的节点和导管系统的单核细胞悬浮于在包含1%的胎牛血清(FBS)(Gibco,Carlsbad,CA)、1mM的乙二胺四乙酸(EDTA)及25mM的羟乙基哌嗪乙磺酸(HEPE S)的PBS(pH7.4,Ca/Mg++free)后,利用如下的表型标记抗体对上述细胞进行染色,即,抗-Ly-6A/E(Sca-1)-PE(克隆E13-161.7)、抗-CD45-pecy5(克隆30-F11)及生物素化的谱系(lineage)蛋白酶抑制剂、抗-CD45R/B220-生物素(克隆RA-3H57-597)、抗-Gr-1-生物素(克隆RB6-8C5)、抗-TCRαβ-生物素(克隆H57-597)、抗-TCRγδ-生物素(克隆GL-3)、抗-CD11b-生物素(克隆M1/70)及抗-Ter-119-生物素(克隆TER-119)。使用与1次抗体特异性结合的链霉亲和素(Streptavidin)-FITC分离出2次抗体。
分离的细胞悬浮液中添加所有单一抗体,在冰水中孵化(incubati on)30分钟后,以PBS清洗2次,并以悬浮于流式细胞分选机及分离培养基的方式进行分离。在上述实验使用的所有单一抗体购自上海玉博生物科技有限公司BD Pharmingen(San Diego,CA)。使用FACS Aria(BD Biosciences,SanJose,CA)进行细胞分离,使用FACSCali bur(BD Biosciences,SanJose,CA)进行细胞分析。
其结果,可从透明质酸丰富的节点和导管系统分离具有2~5μm大小的Sca-1+Lin-CD45-免疫学标记的细胞,所分离的来源于透明质酸丰富的节点和导管系统的成体干细胞针对7AAD及annexinV具有阴性,从而确认为不具有细胞凋亡现象(图3)。
结果,通过VSELs分离方法获取的来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞在VSELs和大小或形态学方面类似,并且流式细胞分析结果,相对于来源于骨髓的VSELs,来源透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞的比重大~100倍。即,透明质酸丰富的节点和导管系统具有许多数量的作为成体干细胞的来源于透明质酸丰富的节点和导管系统的成体干细胞。
[实施例3]来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞的细胞特性
为了通过SEM及TEM分析来源于透明质酸丰富的节点和导管系统的成体干细胞的形态及细胞内部结构,准备通过流式细胞分选机及分离器获取的来源于透明质酸丰富的节点和导管系统的成体干细胞,并在电子显微镜下进行观察。
透明质酸丰富的节点和导管系统的电子显微镜观察
利用Karnovsky固定液(2%的多聚甲醛、2%的戊二醛、0.05M的二甲胂酸钠缓冲液(pH7.2))以在4℃的温度下放置2小时左右的方式固定通过流式细胞分析及分离器获取的来源于透明质酸丰富的节点和导管系统的成体干细胞。在利用透射电子显微镜的情况下,利用1%的四氧化锇以在4℃的温度下放置2小时左右的方式最终固定透明质酸丰富的节点和导管系统,在按乙醇浓度进行脱水化过程后,种植在SURR树脂(ERL、DER、NSA及DMAE混合物)(EMS,Washington),并在70℃的温度下聚合过夜。在利用超薄切片机(RMC MTX,USA)的钻石刀(戴通钻石刀,Switzerland)切割超薄(0.5~1.0μm)切片后,利用乙酸铀酰(EMS,Washington)进行20分钟染色后,对柠檬酸铅进行10分钟处理。利用以80-kV的加速电压运行的透射电子显微镜(JEM1010,JEOL,JAPAN)分析切片。
在利用扫描电子显微镜的情况下,在以Karnovsky固定液固定透明质酸丰富的节点和导管系统后,以0.05M的二甲胂酸钠缓冲液(pH 7.2,4℃)以每次10分钟的方式清洗3次。利用1%的四氧化锇在0.05M的二甲胂酸钠缓冲液(pH7.2)最终固定已固定的来源于透明质酸丰富的节点和导管系统的成体干细胞后,在常温以蒸馏水清洗2次。并且,按乙醇的浓度对来源于透明质酸丰富的节点和导管系统的成体干细胞进行处理,并在各步骤中在常温的条件下进行10分钟脱水化过程。使用100%的乙酸异戊酯以每次10分钟的方式在常温中凝固2次透明质酸丰富的节点和导管系统,借助液态碳酸在适当的时间进行干燥。将所干燥的上述透明质酸丰富的节点和导管系统安装于金属底座(stubs),利用喷涂刻蚀仪以金进行涂敷后,利用场致发射扫描电子显微镜(Carl Zeiss SUPRA 55VP,Germany)对来源于透明质酸丰富的节点和导管系统的成体干细胞进行观察。
其结果,在SEM及TEM下的NDSC为具有3.5~4.5μm左右的直径且呈圆形的细胞,具有核膜和核小体,并且由巨大的细胞核和略小的细胞质形成。并且,可观察作为细胞小器官的线粒体(mitochondria)。细胞的液胞(vacuoles)及内质网(endoplasmic reticulum)等。由此,可确定NDSC具有未成熟的细胞的特性(图4的A部分及图4的B部分)。
[实施例4]由来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞及来源于骨髓的VSELs形成的球体的的特性
4-1:来源于透明质酸丰富的节点和导管系统的成体干细胞的活体外增殖
在完成放射线照射(在40Gy)的C2C12鼠科成肌细胞(myoblast)支持细胞上对分离的来源于透明质酸丰富的节点和导管系统的成体干细胞(对照组:VSELs)进行分体中柱(1×103cells/well),并以20%的基因敲除血清(KSR,Invitrogen,Carlsbad,CA)、2mM的L-谷氨酰胺(Invitrogen)、100μM的MEMNEAA(Invitrogen)、100μM的β-硫基乙醇(Sigma-Aldrich)及4ng/ml的人类碱性(basic)FGF(bFGF,Sigma-Aldrich)在添加的DMEM-F12培养基(Sigma-Aldrich,St Louis,MO)以共同培养的方式培养7天,以形成球体。在培养后,在上述培养基和C2C12支持细胞重新进行分体中柱,并以共同培养的方式进行培养,从而看观察球体。为了确认干细胞的特性,在4%的多聚甲醛对球体进行15分钟固定后,以TBST(0.15M的NaCl、0.05%的Tw een-20 in 20mM tris-HCl,pH7.4)清洗2次,利用碱性磷酸酶确认用试剂盒(Millipore,Billerica,MA)进行染色。
4-2:免疫荧光染色
在载玻片上以4%的多聚甲醛对小鼠的脑或细胞进行20分钟固定。为了防止产生非特异性结合部位,对包含2%的BSA的PBS(pH 7.4)进行30分钟处理,为了对细胞内蛋白质及核进行染色,使用2%的BSA、0.1%的triton X-100进行30分钟处理。然后,将样品作为1次抗体,在4℃的温度下处理过夜。次日,以PBST(添加有0.05%(v/v)的Tween20的PBS)以每次5分钟的方式对1次抗体进行3次清洗,由此完成去除。作为2次抗体使用抗-兔子650(Ab cam,ab96922)、抗-兔子488(Abcam,ab96883)或抗-小鼠IgG-AlexaFluor546(Invitrogen,Carlsbad,CA)。为了对核进行染色,利用4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI:0.5μg/ml;Invitrogen)进行染色。所使用的上述1次抗体为抗-Oct4(ab18976)、抗-Sox2(ab59776)、抗-Nanog(ab80892)、抗-NeuN(Millipore,ABN78)及抗-MAP-2(Abcam,ab32454),所有干细胞标记的抗体购自艾博抗(Abcam)(CambriDGe,MA)。在1%的BSA分别以1:100及1:1000稀释1次抗体及2次抗体,并在共聚焦荧光显微镜(LSM510,Zeiss)下观察所处理的上述试样。还在实施例10~12使用如上所述的方法。
4-3:反转录酶-聚合酶链锁反应(RT-PCR)及蛋白质印迹分析
利用trIzol剂(Invitrogen,LaJolla,CA)提取VSELs、来源于透明质酸丰富的节点和导管系统的成体干细胞球体、分化的神经细胞、ES-D3、C2C12支持细胞或小鼠脑的总(total)核糖核酸(RNA)。利用cDNA为2μg的总RNA、寡(dT)引物(Promega,Madison,WI)、20单位(units)的核糖核酸酶(RNase)抑制剂(AmbionInc,Austin,TX)及M-MLV逆转录酶以制造商(Promega)方法进行合成。PCR扩增使用PyrohotstartTaq(BioneerInc.,Korea),各个寡核苷酸引物(表1)使用10pmoles,在热循环仪(thermocycler)进行。即,在作为热启动的94℃的温度下使c-DNA变性(denaturation)5分钟,在“94℃-30秒、52℃~62℃-30秒及72℃-30秒”的25~40次循环(cycle)中使c-DNA扩增,在72℃的温度下进行10分钟最后伸长(final extensi on)。以1%的琼脂糖凝胶电泳对在上述反应中扩增的PCR产物进行分析。
为了进行蛋白质印迹分析,以添加有磷酸酶抑制剂的RIPA溶液(50mM的tris-HCl[pH7.2]、150mM的NaCl,1%的NP-40、0.1%的SDS、0.5%的DOC、1mM的PMSF、25mM的MgCl2)溶解细胞。以8~12%的SDS-聚丙烯酰胺凝胶电泳(蛋白质电泳)分解细胞洗脱液,在将所分离的蛋白质移动至NCMEMbrane后,使用下述抗体进行免疫印迹(immunoblotting)。作为1次抗体使用抗-Oct4(Abcam,ab18976)、抗-Sox2(Abcam,ab59776)、抗-Nanog(Abcam,ab80892)、抗-GFAP(Cell Signaling Technology,12389)、抗-巢蛋白(Abcam,ab27952)或抗-βIII微管蛋白(Abcam,ab18207),作为2次抗体使用抗-兔子IgG-HRP(Invitrogen)或抗-小鼠IgG-HRP(Invitrogen)。当进行上述蛋白质电泳时,为了确认等效量的样品是否完成搭载,除去(strip)使用的印迹,用抗-β肌动蛋白(actin)抗体进行再探针(reprobe)。使用BCA assay(Bio-Rad Laboratories,Hercules,CA)进行蛋白质的浓度检测。在上述实验使用的RT-PCR用引物(primer)的序列(sequence)记载于表1。
表1
在C2C12鼠科成肌细胞(myoblast)支持细胞中共同培养VSELs和来源于透明质酸丰富的节点和导管系统的成体干细胞的结果,形成拟胚体(embryoid bodies)类似的球体(图4的a部分),以碱性磷酸酶进行染色的结果,确认到通过阳性反应可具有全能干细胞的特性(图4的d部分)。对VSELs和来源于透明质酸丰富的节点和导管系统的成体干细胞的球体形成效率(sphere forming efficiency)进行比较的结果,若对1000个VSEL及NDSC细胞进行分体中柱,并与支持细胞共同培养,则使来源于透明质酸丰富的节点和导管系统的成体干细胞形成~176个球体,使VSELs形成~14个球体。通过上述结果可知,相对于来源于骨髓的VSELs,来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞具有高~12.5倍左右的球体形成效率(图5的c部分)。并且,为了调查VSELs及来源于透明质酸丰富的节点和导管系统的成体干细胞的增殖潜能,而进行传代培养实验。在球体游离为单一细胞后,每7天对C2C12支持细胞进行再分体中柱,并在共同培养后,观察碱性磷酸酶阳性反应球体的数量的结果,来源于透明质酸丰富的节点和导管系统的成体干细胞越进行传代培养越增加碱性磷酸酶阳性反应球体的数量,相反地,VSELs与传代培养无关地,碱性磷酸酶阳性反应球体的数量几乎没有变化(图5D-a,-b)。
以RT-PCR、蛋白质印迹及免疫荧光染色分析了VSELs或来源于透明质酸丰富的节点和导管系统的成体干细胞是否对作为全能干细胞标记的Oct4、Sox2、Nanog及SSEA-1进行表达。来源于透明质酸丰富的节点和导管系统的成体干细胞对Oct4、Sox2及Nanog的mRNA及蛋白质的表达以与作为对照组的鼠科胚胎干细胞株(ES-D3)的类似的程度进行表达,相反地,VSELs虽然对Oct4及Nanog进行表达,但未对Sox2进行表达(图6的A部分的a、b)。并且,以免疫荧光染色法使VSELs及来源于透明质酸丰富的节点和导管系统的成体干细胞球体对Oct4、Sox2、Nanog及SSEA-1进行染色时,来源于透明质酸丰富的节点和导管系统的成体干细胞球体对Oct4、Sox2、Nanog及SSEA-1发生阳性反应,VSELs球体对Oct4、Nanog及SSEA-1发生阳性反应,而对Sox2发生阴性反应(图6的B部分)。
根据上述结果,与来源于骨髓的VSELs相比,来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞经过传代培养示出更高的球体-形成率和平板效率,从而具有更高的增殖能力。并且,与来源于骨髓的VSELs相比,来源于透明质酸丰富的节点和导管系统的成体干细胞在全能干细胞标记的表达方面也具有更接近胚胎干细胞的特性。
[实施例5]来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞及来源于骨髓的VSELs的分化为神经细胞的能力
对在神经细胞分化条件培养基下对全能干细胞标记进行表达的来源于透明质酸丰富的节点和导管系统的成体干细胞球体是否分化为神经细胞进行调查。首先,为了生成神经细胞的溶生细胞(神经元、少突细胞及胶质细胞),准备10个VSELs或来源于透明质酸丰富的节点和导管系统的成体干细胞球体,并游离为单细胞后,在添加有10ng/ml的rhEGF、20ng/ml的FGF-2及20ng/ml的NGF的NeuroCult Basal培养基(Stem cell Technologies,Vancouver,BC,Canada)进行培养。上述培养为在8-孔培养玻片(SPL Life Science,Korea)上的培养,观察在21~25日后,培养细胞是否分化为神经细胞。每24小时重新添加生长因子(R&DSystem,Minneapolis,MN),而且每3天替换培养基。
以将VSELs作为对照组进行比较的方式,查看在活体外的分化诱导条件下来源于透明质酸丰富的节点和导管系统的成体干细胞是否分化为神经细胞。通过对神经细胞质进行染色的标记NeuN和对神经细胞突起进行染色的标记MAP-2并使用免疫荧光染色法,对在神经细胞分化条件下培养25日的来源于透明质酸丰富的节点和导管系统的成体干细胞及VSELs进行染色。其结果,来源于透明质酸丰富的节点和导管系统的成体干细胞和VSELs均显示NeuN阳性反应且分化为作为MAP-2阳性(positive)的神经细胞(图7的A部分的a、b)。可知,针对作为神经细胞标记的GFAP、巢蛋白及βIII微管蛋白的表达,在球体游离的单细胞NDSC和VSEL进行与ES-D3细胞相同的表达,从VSE Ls或来源于透明质酸丰富的节点和导管系统的成体干细胞分化的被诱导的神经细胞在mRNA及蛋白质水平下对上述标记进行表达(图7的b部分及图7的c部分)。
通过上述结果可知,若向从具有干细胞的特性的来源于透明质酸丰富的节点和导管系统的成体干细胞球体游离的单细胞添加神经细胞生长因子(rhEGF、FGF-2及NGF),则在活体外分化为神经细胞,并对在神经细胞特异性表达的标记(NeuN、MAP-2、GFAP、巢蛋白及βIII微管蛋白)进行表达,并且,根据上述结果,可知,来源于透明质酸丰富的节点和导管系统的成体干细胞具有成体干细胞的特性。
[实施例6]利用来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞的缺氧缺血性脑部疾病小鼠的治疗效果
在对小鼠诱导缺氧缺血性脑损伤的模型移植来源于透明质酸丰富的节点和导管系统的成体干细胞,并以如下的实验过程在活体内进行针对神经细胞分化和脑部疾病治疗效果的实验。首先,对7周大的雄性ICR小鼠进行麻醉,并在颈部的右侧切开小切口。露出右侧颈动脉,以7-0丝缝合线(Ethicon LCC,SanLorenzo,Puerto Rico)进行复扎法(double-ligation)。以5-0尼龙缝合线(Ethicon LCC,San Lorenz o,Puerto Rico)缝合切开部分。在笼子中使所缝合的小鼠恢复2小时左右后,以在8%的O2/balance N2暴露20分钟的方式诱导全省系统性缺氧(systemic hypoxia)。次日,使小鼠以38℃的体温维持5小时左右,每2天反复进行上述过程。上述小鼠模型为以在小鼠通过诱导单侧(unilateral)颈动脉结扎及热衰竭(Heat stoke)来诱导缺氧缺血性脑损伤的方式对对侧(contralateral)及同侧(ipsilateral)大脑半球进行损伤的模型。在诱导缺氧缺血性脑损伤7日后,通过尾静脉注射注入以来源于透明质酸丰富的节点和导管系统的CM-DiI标记的来源于透明质酸丰富的节点和导管系统的成体干细胞(5×103cells)。在对照组动物以尾静脉注射注射相同体积的1×PBS。
在注射来源于透明质酸丰富的节点和导管系统的成体干细胞35日后,牺牲小鼠,并分离大脑,在2%的TTC(2,3,5-三苯基氯化四氮唑(2,3,5-triphenyltetrazolium chloride);Sigma-Aldrich,St Louis,MO)溶液中以37℃的温度对所分离的大脑进行30分钟的处理,在解剖显微镜下进行拍摄。为了确认梗塞部位,通过NIH Image J so ftware(NIH Image,version1.47)对对侧及同侧大脑半球以及梗塞脑部位进行分析。以相对左半球、右半球的总面积所损伤的面积(白色部位)的百分比计算梗塞体积。梗塞体积(%)=[损伤面积(同侧面积+对侧面积)/(总同侧面积+对侧面积)]×100。利用免疫组织化学染色最终固定所牺牲的缺血性小鼠的脑,并种植于石蜡。对脑进行冠状切片(Coronalsections)来形成切片(厚度:10μm),并安装于显微镜用载玻片。在上述载玻片利用免疫荧光染色法进行实验。
其结果,若在小鼠通过诱导单侧颈动脉结扎及热衰竭来诱导大脑低氧血症缺血,则在对侧及同侧半球的皮质、纹状体(striatum)及海马产生细胞凋亡现象。
如上所述地,在诱导脑部疾病的小鼠移植标记为CM-DiI的来源于透明质酸丰富的节点和导管系统的成体干细胞,在5周后,取出小鼠的脑,并以TTC对梗塞部位进行染色的方式进行确认(图8a的a部分)。在作为对照组的注入PBS的老鼠中,梗塞部位的体积为47.5%,在移植来源于透明质酸丰富的节点和导管系统的成体干细胞的老鼠中,梗塞部位的体积为15.8%,由此可知,梗塞体积被减少(图8a的b部分)。
通过脑切片,在海马DG的多个部位可发现标志为CM-DiI(红色)的细胞,并且,可知,上述细胞为作为神经细胞的标记的NeuN阳性细胞(图8b的a、b部分)。而且,可知,在海马角1(cornu ammonis 1,CA1)及海马角3(cornu ammonis 3,CA3)部位也可发现CM-Di I阳性细胞,但NeuN进行弱表达。这些细胞为作为未成熟的神经细胞的处于分化为神经细胞的步骤的细胞(图8b的c部分)。
根据上述实验结果,若将来源于透明质酸丰富的节点和导管系统的来源于透明质酸丰富的节点和导管系统的成体干细胞移植于缺氧缺血性脑部疾病小鼠,则减少显示为脑损伤的梗塞部位的体积,并以向海马的DG、CA1及CA3移动所移植的来源于透明质酸丰富的节点和导管系统的成体干细胞的方式分化为神经细胞。即,通过显示缺氧缺血性脑部疾病的解剖学恢复形态,来证明在活体内来源于透明质酸丰富的节点和导管系统的成体干细胞的干细胞功能。
[实施例7]来源于透明质酸丰富的节点和导管系统的造血菌落(细胞集落)的特性
克隆形成能力检测(Clonogenic assay)
2-1:使用25G针头注射以PBS(pH7.4)对小鼠的颈骨和大腿骨的骨髓腔进行清洗,来获取骨髓单核细胞(Bonemarrow mononuclear cells,BM-MNCs)。以利用细胞过滤器对所获取的上述透明质酸丰富的节点和导管系统进行细胞离解的方式获取透明质酸丰富的节点和导管系统的单细胞悬浮液。在含有0.1mM的血晶质及30%的FBS(胎牛血清(Hyclone))的1%的甲基纤维素培养基以1×105cells/mL浓度对透明质酸丰富的节点和导管系统进行分体中柱,以0.25×105cells/m L的浓度对BM-MNC进行分体中柱。在上述过程中,所使用的细胞因子使用1U/mL的重组人红细胞生成素(STEMCELL Technologies)、50ng/mL鼠科rSCF(R&D Systems)、10ng/mL的鼠科rGM-CSF(STE MCELL Technologies)及10ng/mL鼠科rIL-3(STEMCELL Technolo gies)或者代替GM-CSF和IL-3使用以小鼠的脾脏细胞生成的5%(v/v)的美洲商陆有丝分裂原(pokeweed mitogen)的条件培养基(condi tioned medium)。在7日与14日之间使用倒置显微镜(Inverted micr oscope,Olympus CKX31)对来源于透明质酸丰富的节点和导管系统和BM的菌落进行记数检查(score)。
其结果,如图9的A部分所示,可检测出来源于存在于静脉内部(intravein)、淋巴管内部(intralymphatics)及存在于脏器的表面的透明质酸丰富的节点和导管系统的造血祖细胞菌落,在体外可形成(图9的A部分的a)CFU-GEMM、(图9的A部分的b)CFU-GM、(图9的A部分的c)BFU-E及(图9的A部分的d)MCPs等4种类型的菌落。
2-2:利用甲基纤维素中的克隆形成能力检测形成存在于透明质酸丰富的节点和导管系统及骨髓的造血祖细胞。为了确认细胞形态,在PBS悬浮单一菌落,并以10%的中性缓冲的福尔马林(NBF(Neutral buffered formalin),pH7.4)进行固定。然后,对上述菌落的细胞进行离心分离,重新悬浮于PBS,并安装于载玻片。以Wright-Giemsa或甲苯胺蓝对所获取的上述细胞进行染色后,在光学显微镜(Leica DMD108)下进行观察。
以Wright-Giemsa对上述来源于透明质酸丰富的节点和导管系统的细胞进行染色的结果(图9的b部分),CFU-GEMM菌落含有嗜碱性粒细胞、巨核细胞、嗜酸粒细胞及红血细胞,CFU-GM菌落含有嗜中性粒细胞及巨噬细胞,BFU-E菌落含有红血细胞/成红细胞(erythro cyte/erythroblast),MCPs菌落包含肥大细胞。
2-3:获取由来孕育透明质酸丰富的节点和导管系统的肥大细胞祖细胞形成的菌落,在添加10ng/ml的老鼠和rIL-3(STEMCELL Techn ologies)及10ng/m的老鼠和rSCF(STEMCELL Technologies)的10%的FBS、2mM的L-谷氨酰胺(Gibco)、0.1mM的NEAA(Gibco)、50uM的2-ME及包含青霉素/链霉素的100U/ml的RPMI1640培养基中进行培养。在37℃及5%的CO2的条件下对细胞进行2~4周的培养,并进行流式细胞分析。在FcεRI表达的检测中,能够以在37℃的温度下以1μg/mL的αDNPIgE(Sigma)刺激24小时左右的方式获取强化的FcεRI表达量。
在流式细胞分析使用的抗体包括:1)结合藻红蛋白荧光的Sca-1(E13-161.7);2)结合异硫氰酸荧光素荧光的c-kit(2B8)、IgE(R35-72)、Gr-1(RB3-8C5)、CD11b(M1/70)、CD8(53-6.7)、Flk-1(AVAS12);3)结合藻红蛋白-Cy5荧光的CD45(30-F11)、CD4(H129.19)、B220(RA3-6B2)、CD135(Flt3,A2F10);4)结合Alexa Fluor 647荧光的CD34(RAM34)、CD150(TC15-12F 12.2);以及5)生物素化的谱系蛋白酶抑制剂。生物素化的1次抗体通过利用链霉亲和素-FITC及链霉亲和素-PE来适用于流式细胞分析。除了结合PE-Cy5荧光的CD135(Flt3、A2F10)(eBioscience)以外的所有抗体购自BD Pharmingen(San Diego,CA)。通过使用FACSCalibur或LSR II flow cytometer(Becton Dickinson)来进行流式细胞分析。
其结果,可从小肠(或肝)表面、静脉内部及淋巴管内部获取透明质酸丰富的节点和导管系统。分离上述透明质酸丰富的节点和导管系统的细胞,并适用于分析造血祖细胞的特性的步骤,能够以在体外培养透明质酸丰富的节点和导管系统的细胞的方式形成CFU-GM、BFU-E及CFU-GEMM菌落(图9的a部分的a、b、c)。来源于脏器表面的透明质酸丰富的节点和导管系统的细胞形成上述3种造血祖细胞菌落,静脉内部的透明质酸丰富的节点和导管系统细胞可形成CFU-GEMM及BFU-E,淋巴管内部的透明质酸丰富的节点和导管系统细胞只能够形成CFU-GM。并且,在CFU-GM条件成长的菌落的大多数由肥大细胞形成(图9的a部分的d)。
根据Wright-Giemsa染色结果,可确认形成来源于前驱体的各个菌落的多种种类的造血祖细胞。即,可确认,CFU-GEMM菌落(图9的a部分的a)的嗜碱性粒细胞/巨核细胞/嗜酸粒细胞(图9的b部分);CFU-GM菌落(图9的a部分的b)的巨噬细胞/嗜中性粒细胞(图9的b部分);BFU-E菌落(图9的a部分的c)的成红细胞/红血细胞(图9的b部分);以及MCPs菌落(图9的a部分的d)的肥大细胞(图9的b部分)。
来源于透明质酸丰富的节点和导管系统的CFU-GEMM、CFU-GM及BFU-E菌落的出现频率更小于BM(表2),位于脾脏的CFU-GM及BFU-E菌落的出现频率更高于透明质酸丰富的节点和导管系统,但CFU-GEMM菌落在脾脏和透明质酸丰富的节点和导管系统类似(表2)。
另一方面,根据单位细胞水平(aper-cell basis),相对于BM,来源于透明质酸丰富的节点和导管系统的MCPs的数量大约高5倍,相对于脾脏,高100倍以上(表2及图9的c部分)。此时,限速表2为对骨髓、脾脏及透明质酸丰富的节点和导管系统的造血祖细胞的出现频率进行比较的。
表2
为了确认MCPs菌落是否可发育成肥大细胞,在MCPs分离细胞,并在包含IL-3及rSCF的培养基中培养14天。其结果,来源于MCPs的细胞表示Lin-Sca-1+c-kit+FcεRI+免疫学特性(表现型),从而可确认为肥大细胞(图9的D部分;两侧)。
为了分析未成熟细胞,从脏器的表面(图1a的a部分)获取透明质酸丰富的节点和导管系统后,进行流式细胞分析。根据表现型分析,约2%的透明质酸丰富的节点和导管系统细胞具有lineage-、Sca-1+、c-kit+及CD34-的免疫学特性,从而具有透明质酸丰富的节点和导管系统细胞中的少数的造血干细胞。然后,对透明质酸丰富的节点和导管系统是否具有可持续生成造血祖细胞的成体全能干细胞进行了确认。即,为了确认是否可从透明质酸丰富的节点和导管系统细胞诱导作为未成熟血液细胞的前驱体的成血管细胞,而将整个来源于透明质酸丰富的节点和导管系统的细胞结构物与OP9细胞进行共同培养。
其结果,可检测对CD45-或Flk-1进行表达的成血管细胞(可分化为所有种类的血液细胞和内皮细胞)。
综上述所述的结果,若在体外条件培养来源于透明质酸丰富的节点和导管系统的细胞,则可形成多种种类的造血菌落(细胞集落)。尤其,可从透明质酸丰富的节点和导管系统细胞诱导成血管细胞-样细胞是指在透明质酸丰富的节点和导管系统发生造血现象。
[实施例8]来源于透明质酸丰富的节点和导管系统的全能干细胞的特性
在OP9细胞上对从小肠(或肝)的表面获取的透明质酸丰富的节点和导管系统细胞中的1×105细胞进行分体中柱后,在添加有20%的FBS、抗生剂、细胞因子重组小鼠SCF(50ng/ml、peproTech)、重组小鼠Flt3L(5ng/ml、Prospec)及重组小鼠IL-7(5ng/ml、Prospec)的α-MEM共同培养6天(37℃,5%的CO2)。OP9细胞适用于诱导B-系统及骨髓细胞系的过程,OP9-DL1细胞适用于诱导T-细胞系的过程。
在添加或未添加mSCF的条件下,在OP9上培养卵石区形成细胞,并以CD45(PE-Cy5)及Flk-1(FITC)抗体对所形成的成血管细胞-样细胞进行染色,由此进行流式细胞分析。诱导为细胞因子的骨髓及B-细胞系分别使用Gr-1/CD11b(FITC)、CD45(PE-Cy5)和B220(PE-Cy5)抗体进行流式细胞分析,T-细胞系使用CD4(PECy5)和CD8(FITC)抗体进行流式细胞分析。
其结果,若在OP9细胞上共同培养6天透明质酸丰富的节点和导管系统细胞,则可生成卵石区形成细胞(图10的a部分)。经过6天获取所有卵石区形成细胞,并进行流式细胞分析的结果,约2.3%的细胞为CD45-Flk-1+,约12.4%的细胞为CD45+Flk-1-(图10的b部分a、b)。即,若将透明质酸丰富的节点和导管系统细胞与OP9造血支持细胞进行共同培养,则可生成成血管细胞-样细胞(CD45-Flk-1+细胞)。
还对在来源于透明质酸丰富的节点和导管系统的细胞和OP9(NDS/OP9)的共同培养过程中形成的卵石区形成细胞的免疫学特性(表现型)进行了分析。若进行10日的NDS/OP9共同培养,则使大部分细胞为CD45+Flk1-细胞(图10的c部分的a),若添加rSCF,则增加CD45+Flk-细胞数量。若在第10日对NDS/OP9而培养进行分析,则可知,90%以上的细胞为Lin-CD45+(图10的c部分的a、b),大部分细胞(~70%)为Sca-1+c-kit+及CD34-CD135-。卵石区形成细胞的主要细菌丛具有作为原始HSC的免疫学标记(表现型)的Lin-Sca-1+c-kit+CD34-CD135-(图10的c部分的c、d)。并且,利用slam标记(slamMarkers,图10的c部分的e)进行追加分析的结果,主要细菌丛(~82.5%)为CD48+CD150-,与Lin-Sca-1+c-kit+CD34-CD135-CD150-CD48+(CD150-CD48+LSK)一致,并且少数的细菌丛由CD150-CD48-LSK(14.8%)及CD150+CD48-LSK(0.5%)形成(图10的D部分)。
在添加有rSCF及IL-3的条件下,在OP9上以1×105细胞共同培养9日透明质酸丰富的节点和导管系统细胞时,出现骨髓系统细胞(图10的E部分的a)。在添加有rSCF、IL-7及Flt3L的条件下,在OP9上共同培养15日透明质酸丰富的节点和导管系统细胞时,检测出B220+B淋巴球(图10的E部分的b)。并且,在添加有rSCF、IL-7及Flt3L的条件下,在OP9-DL1上共同培养9日透明质酸丰富的节点和导管系统细胞时,生成CD4+、CD4+CD8+及CD8+T淋巴球(图10E-c)。根据这些结果,来源于透明质酸丰富的节点和导管系统的细胞具有可在适当的培养条件下生成多种种类的造血细胞的潜能。
结果,若向来源于透明质酸丰富的节点和导管系统的细胞添加适当的细胞因子且在造血支持细胞进行培养,则可分化为来源于具有分化能力的全能干细胞的成血管细胞样细胞及多种种类的成熟造血细胞。
[实施例9]来源于透明质酸丰富的节点和导管系统的造血干细胞/祖细胞(Hematopoietic stem/progenitor cell,HSPC)的分化特性
为了从来源于透明质酸丰富的节点和导管系统的造血干细胞诱导造血祖细胞,在基于1%的甲基纤维素的CFU-GEMMM培养基对实施例8的CAFC进行分体中柱,每10日获取一次菌落,并在CFU-GEMM培养基对相同浓度的1×105cells/mL的细胞进行分体中柱。在Wright-Giemsa或甲苯胺蓝染色后,在光学显微镜下观察分化为多种造血细胞的造血干细胞/祖细胞(HSPC)。
其结果,若在CFU-GEMM甲基纤维素培养基多培养10天卵石区形成细胞,则形成均匀且小型的细胞(colony forming cells,CFC)(图11a),存在于菌落的细胞(直径:~5μm)具有Lin-Sca-1+c-kit+CD34-CD135-免疫学特性且维持造血干细胞/祖细胞的分化状态(图11b)。每10日重新进行分体中柱的结果,在50日的培养期间使细胞的数量增加(图11c),以Wright-Giemsa甲苯胺蓝对在5传代培养获取的细胞进行染色的结果,可确认红血细胞(RBC)、未成熟的巨核细胞、肥大细胞及单核细胞(图11d)的出现。
结果,从来源于透明质酸丰富的节点和导管系统的全能干细胞起源的成血管细胞-样细胞还可分化为造血干细胞/祖细胞,从而可生成多种造血细胞。
[实施例10]来源于透明质酸丰富的节点和导管系统-、骨髓-及血液(脾脏)的MCPs的调节机制的比较
若与骨髓或脾脏进行比较,则透明质酸丰富的节点和导管系统的MCPs以高出现频率存在,因此,为了调查透明质酸丰富的节点和导管系统中的MCPs的生成是否以与骨髓或脾脏不同的方式调节,而使用缺乏可明确地显示骨髓、脾脏及透明质酸丰富的节点和导管系统之间的MCPs生成的差异的特定基因的多种种类的变异小鼠。尤其,IFN-γ在体外及体内起到调节肥大细胞的发育及功能的作用,因此使用缺乏上述基因的变异小鼠。
其结果,在IFN-γ-/-小鼠的透明质酸丰富的节点和导管系统中,MCPs的生成急剧减少,这意味着,IFN-γ与透明质酸丰富的节点和导管系统MCPs的生成密切相关(图12的a部分)。相反地,脾脏中的MCPs的生成不依赖于IFN-γ(图12的B部分,表3)。与W-sash杂合子(heterozygote)小鼠比较时,c-kitW-sh/W-sh中的透明质酸丰富的节点和导管系统地MCPs生成显著地减少(图12的c部分),由此可知,与骨髓或脾脏的肥大细胞相同地,c-kitlocus对透明质酸丰富的节点和导管系统肥大细胞的发育起到重要作用。此时,下述表3为对对照组(B6)及IFN-γ缺乏变异小鼠的菌落出现频率进行比较的。
表3
结果,在作为一列实施的结果中,与脾脏不同地,IFN-γ-/-小鼠的透明质酸丰富的节点和导管系统存在急剧的MCPs的生成减少,因此依赖于IFN-γ信号系统。即,可知,在骨髓、血液及透明质酸丰富的节点和导管系统的MCPs生成中,造血调节有所不同。
[实施例11]来源于透明质酸丰富的节点和导管系统-及骨髓的造血细胞的相容性(compatibility)
为了调查来源于透明质酸丰富的节点和导管系统的造血干细胞的造血细胞植入潜力(hematopoietic engraftment potential),以2种方式进行造血细胞植入分析(Hematopoietic engraftment assay)。
即,在竞争性重组造血干细胞分析(competitive repopulation HSC assay)的情况下,将受到严重地放射线照射(1100cGy的吸收线量)的8周龄的C57Bl/6F1小鼠(CD45.1+/CD45.2+)作为受体(recipient),B6(CD45.2+)的来源于透明质酸丰富的节点和导管系统的5×105细胞和B6.BoyJ(CD45.1+)骨髓细胞以相同的比率进行混合,并作为供体细胞(donor cells)使用,向受体以静脉注射(intravenous injection,i.v.)的方式进行注入后,调查造血细胞的重组(reconstitution)与否。
并且,在非竞争性植入分析(engraftment assay)中,向被严重的放射线(1100cGy)照射的同类基因(congenic)小鼠(Thy1.1+)以静脉注射(intravenous injection,i.v.)的方式注入透明质酸丰富的节点和导管系统(Thy1.2+)的5×105细胞,由此进行调查。
在上述竞争性或非竞争性造血细胞重组的植入分析中,在移植1个月或3个月后对寄主(host)小鼠或基于向其注入的细胞的生存(率)进行分析。
其结果,根据竞争性重组(repopulation)HSC分析,透明质酸丰富的节点和导管系统细胞(CD45.2+)未植入被严重地放射线照射的F1(CD45.1+/CD45.2+)小鼠,但BM-MNC(CD45.1+)可实现植入。在非竞争性实验分析中,向被严重地放射线照射的同系(syngeneic)小鼠以多种浓度(doses)移植EGFP+透明质酸丰富的节点和导管系统细胞,直到5×105cells/小鼠浓度为止,此时,所有小鼠在移植后的10~14日以内死亡。根据上述结果,来源于透明质酸丰富的节点和导管系统的造血干细胞/祖细胞不具有针对放射性的防御能力(radioprotection)。
另一方面,调查骨髓细胞(BM-MNC)是否以移动方式植入透明质酸丰富的节点和导管系统。为了调查向透明质酸丰富的节点和导管系统的骨髓细胞的移动形态,向被严重地放射线照射(1100cGy)的B6小鼠以2×106cells/小鼠浓度静脉注射EGFP+同系的BM-MNC。在荧光倒置显微镜(Fluorescence inverted microsco PE;Observer Z1,Zeiss)下观察向EGFP+BM-MNC细胞的透明质酸丰富的节点和导管系统的移动。
其结果,若向同系的被严重地放射线照射的B6小鼠注射作为具有绿色荧光的骨髓细胞的EGFP+BM-MNC(2×106cells/小鼠),则从移植10日后,可在透明质酸丰富的节点和导管系统的导管(图13a的b部分)和结(图13a的c部分)检测出EGFP+细胞(图13a)。并且,在第21日,透明质酸丰富的节点和导管系统完全重组为EGFP+BM-MNC(图13b)。若将所重组的透明质酸丰富的节点和导管系统的细胞与OP9进行共同培养,从生成卵石区形成细胞的方面可知,骨髓及透明质酸丰富的节点和导管系统使成血管细胞-样细胞的回路(移动路径)连接(图13c)。
结果,对于在解剖学方面具有根本上的差异的作为造血生成场所的骨髓及透明质酸丰富的节点和导管系统之间可实现造血细胞的移动及植入而言,这意味着,在造血过程中,透明质酸丰富的节点和导管系统为独立的系统且起到完善骨髓及血液系统的作用。
以上,对本发明内容的特定部分进行了详细说明,对于本发明所属技术领域的普通技术人员而言,这些具体的技术仅仅是优选的实施方式,本发明的范围并不局限于这些技术,这是理所当然地。因此,本发明的实质的范围仅由所附的权利要求保护范围和它们的等同替代物定义。
<110> NATIONAL CANCER CENTER
<120> Stem cells derived from HAR-NDS, isolation method and use thereof
<130> 5036532
<150> KR 2014-0051586
<151> 2014-04-29
<150> KR 2014-0051587
<151> 2014-04-29
<160> 12
<170> KopatentIn 2.0
<210> 1
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Oct4 primer
<400> 1
tggaaagcaa ctcagaggga acct 24
<210> 2
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Oct4 reverse primer
<400> 2
attgagaacc gtgtgaggtg gagt 24
<210> 3
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Sox2 forward primer
<400> 3
aacatgatgg agacggagct gaag 24
<210> 4
<211> 23
<212> DNA
<213> Artificial Sequence
<220>
<223> Sox2 reverse primer
<400> 4
tacagcatgt cctactcgca gca 23
<210> 5
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Nanog forward primer
<400> 5
tcgaattctg ggaacgcctc atca 24
<210> 6
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Nanog reverse primer
<400> 6
aaccaaagga tgaagtgcaa gcgg 24
<210> 7
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> GFAP forward primer
<400> 7
ggagctcaat gaccgctttg 20
<210> 8
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> GFAP reverse primer
<400> 8
tccaggaagc gaaccttctc 20
<210> 9
<211> 21
<212> DNA
<213> Artificial Sequence
<220>
<223> Nestin forward primer
<400> 9
ccctgatgat ccatcctcct t 21
<210> 10
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Nestin reverse primer
<400> 10
ctggaatatg ctagaaactc tagactcact 30
<210> 11
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> tubulin forward primer
<400> 11
tccgttcgct caggtcctt 19
<210> 12
<211> 19
<212> DNA
<213> Artificial Sequence
<220>
<223> tubulin reverse primer
<400> 12
cccagactga ccgaaaacg 19
- 还没有人留言评论。精彩留言会获得点赞!