通过调节抗体的含糖量制备抗体的方法与流程
本公开涉及制备具有调节的糖链含量的抗体的方法,该方法包括在包含甘油作为调节抗体糖链含量的添加剂的介质中培养可表达抗体的细胞的步骤;通过调节抗体含糖量至期望含量制备高质量抗体群的方法;以及通过所述方法制备的抗体群。本发明还涉及调节抗体糖链含量的方法,该方法包括在含甘油作为调节抗体糖链含量添加剂的介质中培养可表达抗体的细胞的步骤。此外,本公开还涉及可调节抗体糖链含量的介质组合物,所述介质组合物包含甘油作为用于调节抗体糖链含量的添加剂。
背景技术:
治疗抗体例如单克隆抗体(mAb)和Fc融合蛋白占当前重组蛋白药物市场的一大份额。
抗体相关药物的治疗效果是通过抑制靶细胞的信号转导系统直接诱导细胞凋亡,或者诱导间接免疫机制例如ADCC(抗体依赖性细胞介导的细胞毒性)或CDC(补体依赖性细胞毒性),所述两种间接免疫机制称为抗体的“效应子功能”。在生物改良药或生物仿制药以及新抗体领域,效应子功能是重要方面,因此进行了持续的研究以优化所述功能或保证效应子功能的体外相似度。
Fc区的半乳糖基化可影响抗体的CDC。在半乳糖基化机制中,半乳糖是糖基化链反应的结构单元并且通过半乳糖基转移酶紧邻结合到N-乙酰葡糖胺糖,并且尿苷通过尿苷激酶转化为UTP(三磷酸尿苷),然后UTP结合到半乳糖-1-磷酸盐(半乳糖-1-P)产生半乳糖基化结构单元,UDP-半乳糖。锰(Mn2+)是半乳糖基转移酶的辅因子,其可提高酶的性能。
提高抗体ADCC的研究大致可分为Fc区本身的设计和抗体Fc区的糖链修饰。本发明人集中于后者Fc区的糖链修饰并且旨在调节糖含量。跨国制药公司和先进生物技术公司通过利用糖链修饰技术开发了具有提高的效应子功能和持久性的下一代抗体并且不断努力占领市场,而该领域的后来者正致力于适应生物仿制药的时代并致力于生产与原产品的糖链及物理化学性质类似的生物仿制药。原因在于糖链的组分和结构很大地影响治疗效果、在人体内的保留时间、药理学活性、免疫应答等。因此,旨在开发生物仿制药产品的公司积极地研究具有与原产品尽可能相似糖链的生物仿制药,从而具有等价的治疗效果和稳定性以及较少的副作用例如免疫应答。
此前,许多文献报道了重组抗体Fc区糖链中的核心岩藻糖基化大大地影响ADCC,并且许多研究人员研究了能够调节核心岩藻糖基化的方法。代表性研究结果如下。
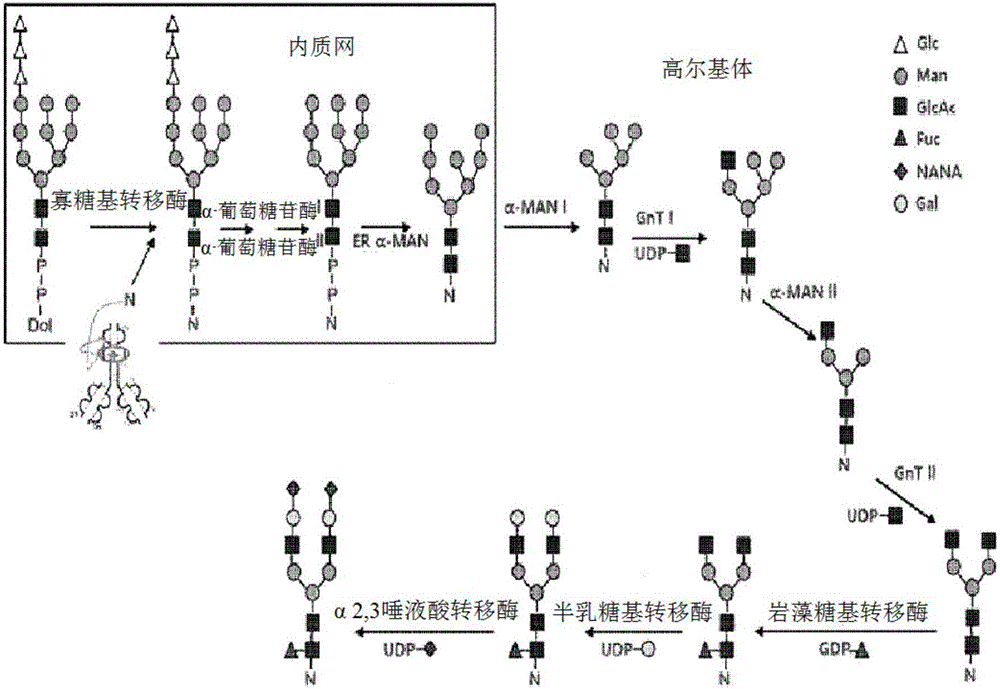
GDP-岩藻糖的生物合成过程是岩藻糖基化途径的结构单元,直接参与抗体的核心岩藻糖基化的酶或结构单元如图1所示(Sawa et al.,“Glycoproteomic probes for fluorescent imaging of fucosylated glycans in vivo”,PNAS,2006,p12372)。通过抑制与岩藻糖基化直接相关的酶或结构单元的合成来调节核心岩藻糖基化的方法已被研究。
已知与核心岩藻糖基化相关的代表性酶基因有GMD(GDP-甘露糖4,6-脱水酶)基因和FUT8(α-1,6-岩藻糖基转移酶)基因,通过抑制所述两个基因的表达或者制备FUT8敲除CHO宿主而在基因水平调节核心岩藻糖基化已被揭示(YAMANE-OHNUKI et al.,“Establishment of FUT8knockout Chinese hamster ovary cells:an ideal host cell line for producing completely defucosylated antibodies with enhanced antibody-dependent cellular cytotoxicity.”,BIOTECHNOLOGY AND BIOENGINEERING,2004,p614~622)。
抑制核心岩藻糖基化的另一种方法是在糖基化途径中加入糖苷酶抑制剂(图2,Hossler et al.,“Optimal and consistent protein glycosylation in mammalian cell culture”,Glycobiology,2009,p939)。也就是说,当细胞中的糖蛋白从ER转移到高尔基体时,其通过葡萄糖苷酶和甘露糖苷酶被高度甘露糖修饰。此时,加入α-甘露糖苷酶I抑制剂例如几夫碱以制备寡甘露糖型糖蛋白,以此抑制岩藻糖基化。该方法比例如建立细胞系等在基因水平的调节方法更容易,并且时间和成本方面也更有利。
其他岩藻糖基化控制方法是调节培养过程中渗透压的方法,其中去岩藻糖基化水平(deFuc%)随着YB2/0细胞系中渗透压增加而下降(Yoshinobu et al.,Cytotechnology,2012,p249~265),并且还有报告显示增加渗透压和延长培养持续时间导致了CHO细胞系中甘露糖5糖型增加(Efren Pacis et al.,BIOTECHNOLOGY AND BIOENGINEERING,2011,p1078~1088)。高甘露糖5糖型水平表明去岩藻糖基化水平高。
另一方面,Abbott关于阿达木单抗的专利(US 2012/0276631和WO2012/149197)公开了通过使用锰和半乳糖调节抗体糖链,并且已有关于尿苷的半乳糖基化文献报道。但是,通过将糖链调节至期望含量来制备抗体还有困难。
在需要通过调节抗体的糖链来增加ADCC活性的技术的背景下,发明人进行了许多努力以开发在制备生物仿制抗体药物时可保持纯化产物中的抗体糖链含量的方法。结果,本发明人开发了一种可用于培养过程中的添加剂,并且发明了通过以期望比率调节抗体糖链含量来一致地制备具有可靠质量的抗体群或等价物的方法,从而完成了本发明。
具体而言,发明人意图通过控制制备重组抗体的培养过程中的添加剂和条件来调节抗体糖链含量(半乳糖基化,α岩藻糖基化(afucosylation))以提高抗体的ADCC活性。结果,本发明人发现,甘油可增加α岩藻糖基化水平,并且在开发生物仿制药的情况下甘油也会将α岩藻糖基化水平增加至与对照药物相似的α岩藻糖基化水平。本发明人还发现,甘油、锰和尿苷可用作添加剂,并且在使用不同介质的旧方法和新的优化方法中可获得相似的效应,并且所述添加剂和条件可广泛用于通过调节抗体的糖链含量制备抗体的方法。
技术实现要素:
本发明的一个目标是提供制备具有调节的糖链含量的抗体的方法,该方法包括在包含甘油作为调节抗体糖链含量添加剂的介质中培养表达抗体的细胞的步骤。
本发明的另一个目标是提供具有调节的糖链含量的抗体群,其是通过所述方法制备的。
本发明的又一个目标是提供调节抗体糖链含量的方法,该方法包括在包含甘油作为调节抗体糖链含量添加剂的介质中培养表达抗体的细胞的步骤。
本发明的又一个目标是提供可用于调节抗体糖链含量的介质组合物,所述介质组合物包含甘油作为调节抗体糖链含量添加剂。
附图说明
图1:示出了岩藻糖基化途径结构单元的GDP-岩藻糖生物合成,以及直接参与抗体的核心岩藻糖基化的酶或结构单元;
图2:示出了糖基化途径;
图3:示出了在可诱导α岩藻糖基化添加剂条件下测定的细胞生长曲线;
图4:示出了在可诱导α岩藻糖基化添加剂条件下测定的细胞存活率;
图5:示出了在可诱导α岩藻糖基化添加剂条件下测定的最终表达水平;
图6:示出了在可诱导α岩藻糖基化添加剂条件下产生的抗体的半乳糖基化糖型的相对含量的图表;
图7:示出了在可诱导α岩藻糖基化添加剂条件下产生的抗体的α岩藻糖基化糖型的相对含量的图表;
图8:示出了与不含添加剂对照相比半乳糖基化抗体和α岩藻糖基化抗体增加和减少的测定结果的图表;
图9:示出了在锰(M)、半乳糖和尿苷(Urd)单因素或者组合处理条件下测定的细胞生长曲线;
图10:示出了在锰(M)、半乳糖和尿苷(Urd)单因素或者组合处理条件下测定的细胞存活率;
图11:示出了在锰(M)、半乳糖和尿苷(Urd)单因素或者组合处理条件下测定的最终表达水平;
图12:示出了在锰(M)、半乳糖和尿苷(Urd)单因素或者组合处理条件下的半乳糖基化含量的图表;
图13:示出了在锰(M)、半乳糖和尿苷(Urd)单因素或者组合处理条件下测定的α岩藻糖基化含量的图表;
图14:示出了与不含添加剂对照相比半乳糖基化抗体和α岩藻糖基化抗体增加和减少的测定结果的图表;
图15:示出了依据甘油浓度的(A)细胞生长和(B)细胞存活率测定结果的图表;
图16:示出了依据甘油浓度的最终抗体表达水平测定结果;
图17:示出了依据甘油浓度的糖链含量测定结果,其中示出了(A)半乳糖基化的糖链含量和(B)α岩藻糖基化的糖链含量;
图18:示出了使用添加剂混合物共诱导半乳糖基化和α岩藻糖基化的新方法在玻瓶培养实验中(A)细胞生长和(B)细胞存活率测定结果的图表;
图19:示出了使用添加剂混合物共诱导半乳糖基化和α岩藻糖基化的新方法在玻瓶培养实验中最终抗体表达水平的测定结果;
图20:示出了使用添加剂混合物共诱导半乳糖基化和α岩藻糖基化的新方法在玻瓶培养实验中糖链含量的测定结果,其中示出了(A)半乳糖基化的糖链含量和(B)α岩藻糖基化的糖链含量;
图21:示出了使用添加剂混合物共诱导半乳糖基化和α岩藻糖基化的新方法在玻瓶培养实验中糖链含量的测定结果,其中示出了测定的半乳糖基化/α岩藻糖基化差异(百分比变化);
图22:示出了在生物反应器培养实验中依据甘油浓度的(A)细胞生长和(B)细胞存活率测定结果的图表;
图23:示出了在生物反应器培养实验中依据甘油浓度的最终抗体表达水平的测定结果的图表;
图24:示出了在生物反应器培养实验中依据甘油浓度的糖链含量测定结果,其中示出了(A)半乳糖基化的糖链含量和(B)α岩藻糖基化的糖链含量;
图25:示出了在生物反应器培养实验中依据甘油浓度的糖链含量测定结果,其中示出了测定的半乳糖基化/α岩藻糖基化差异(百分比变化);
图26:示出了新方法添加剂的最终选择并示出了在3批生物反应器实验中(A)细胞生长和(B)细胞存活率的测定结果的图表;
图27:示出了新方法添加剂的最终选择以及在3批生物反应器实验中最终抗体表达水平的测定结果;
图28:示出了新方法添加剂的最终选择以及在3批生物反应器实验中糖链含量的测定结果,其中示出了(A)半乳糖基化的糖链含量和(B)α岩藻糖基化的糖链含量;
图29:示出了新方法添加剂的最终选择以及在3批生物反应器实验中糖链含量的测定结果,其中示出了测定的半乳糖基化/α岩藻糖基化差异(百分比变化);
图30:示出了在检测应用于旧方法的添加剂组分效应的实验(第I阶段临床试验过程)中(A)细胞生长和(B)细胞存活率的测定结果的图表;
图31:示出了在检测应用于旧方法的添加剂组分效应的实验(第I阶段临床试验过程)中最终抗体表达水平的测定结果的图表;
图32:示出了在检测应用于旧方法的添加剂组分效应的实验(第I阶段临床试验过程)中糖链含量测定结果,其中示出了(A)半乳糖基化的糖链含量和(B)α岩藻糖基化的糖链含量;
图33:示出了在检测应用于旧方法的添加剂组分效应的实验(第I阶段临床试验过程)中糖链含量测定结果,其中示出了相对于对照组的半乳糖基化/α岩藻糖基化差异(百分比变化);
图34:示出了与旧方法(第I阶段临床试验过程)相比在检测添加剂组分效应的实验中糖链含量的测定结果,其中示出了相对于旧方法样本的半乳糖基化/α岩藻糖基化增加(百分比变化);以及
图35:示出了在用于选择可诱导α岩藻糖基化添加剂的玻瓶培养实验中糖链含量测定结果,其中示出了(A)半乳糖基化的糖链含量和(B)α岩藻糖基化的糖链含量。
具体实施方式
为实现上述目标,本发明一方面提供了稳定地制备具有可靠质量的抗体群或等价物的方法,其中抗体的糖链含量是通过加入添加剂至介质中调节的,以此制备包含具有期望的糖链含量抗体的抗体群。具体地,调节抗体糖链含量可以是调节半乳糖基化或α岩藻糖基化。
具体地,本发明的方法可以是在产生抗体的过程中通过加入选自包含甘油、锰、尿苷的组中的一种或多种添加剂至培养介质中以调节抗体的半乳糖基化、α岩藻糖基化或者半乳糖基化/α岩藻糖基化含量的方法,具体地可以是制备具有调节的糖链含量抗体的方法,包括在包含甘油作为调节抗体糖链含量的添加剂的介质中培养表达抗体的细胞的步骤。本发明中,除甘油外,所述介质还可包含选自包括锰和尿苷的组中的一种或多种作为调节抗体糖链含量的添加剂。
本文中,术语“抗体”,通过免疫系统中的抗原刺激产生的物质,是指淋巴和血液中可与具体抗原特异性结合以产生抗原-抗体反应的物质。本发明的抗体可包括但不限于优选地本领域通常使用的所有治疗性抗体,更优选地是作为靶向HER-2(人表皮生长因子受体2)的抗体的曲妥珠单抗或帕妥珠单抗,且最优选地是曲妥珠单抗。曲妥珠单抗也称为赫赛汀,是一种针对HER2的人源化抗体,由Genentech公司(USA)开发,被认为是针对主要在乳腺癌细胞中表达的HER2/neu的治疗性抗体。
本发明中,表达抗体的细胞包括可表达需要的抗体的天然或转染的细胞,没有限制。对于本发明的目标,表达抗体的细胞可以是表达调节糖链含量受试者抗体的细胞。本发明的一个实施方案中,表达抗体的细胞可以是表达曲妥珠单抗的HD201细胞系(登记号:KCTC 12164BP,保藏日期:2012.03.19,保藏机构:韩国生物科学与生物技术研究所/韩国典型培养物保藏中心)。能够产生抗体的细胞优选地可以是动物细胞,例如中国仓鼠卵巢细胞系(CHO)或小鼠骨髓瘤细胞系(NSO)。
本文中,术语“转染”是通过将DNA直接导入培养的动物细胞中而改变细胞遗传性状的方法,并且通常使用通过载体例如质粒等导入靶基因的方法。转染可依据本领域常用的方法进行,优选例如磷酸钙共沉淀、DEAE-葡聚糖处理、电穿孔、重分配等。
本文中,术语“抗体群”意指包含具有不同糖链含量抗体的抗体组合。对于本发明的目标,抗体群意指包含期望比例半乳糖基化抗体、α岩藻糖基化抗体和半乳糖基化/α岩藻糖基化抗体的抗体组。抗体群可包括只一种类型抗体或者半乳糖基化的或非半乳糖基化的所有抗体以及α岩藻糖基化的或非α岩藻糖基化的抗体。对于本发明的目标,抗体群优选地是指通过本发明的制备方法调节了糖链含量的抗体组。
本发明中,糖链含量可以是选自包含半乳糖基化含量和α岩藻糖基化含量的组的一种或多种含量。
本发明中,半乳糖基化含量意指具有半乳糖结合糖链的抗体的含量,而α岩藻糖基化含量意指具有无岩藻糖基糖链的抗体的含量。半乳糖基化和α岩藻糖基化是公知的可大大地影响抗体的ADCC和CDC的重要修饰。
为了开发生物仿制药,与对照药物的质量(糖链含量)高度等效产物的制品是最重要的开发点之一。
本发明人持续研究以改良使用曲妥珠单抗基因表达并获得的重组蛋白和对照药物(原产品)之间的N-聚糖(半乳糖基化和α岩藻糖基化)相似度。已证实,当依据培养条件制备曲妥珠单抗时,N-聚糖含量特别是半乳糖基化含量和α岩藻糖基化含量低于对照药物中的含量。具体地,由于α岩藻糖基化含量是非常重要的抗体活性(ADCC)指标,已进行了对用于培养过程的添加剂的研究以通过提高α岩藻糖基化含量将质量提高至相当于对照药物的质量。
具体而言,测定了开发新方法过程中产生的抗体的ADCC(抗体依赖性细胞介导的细胞毒性)活性,结果其活性低至对照药物活性的60~80%。该结果导致了本发明。如上所述,通过N-聚糖测定检测了对ADCC活性起重要作用的α岩藻糖基化水平,结果显示对照药物的α岩藻糖基化水平在8~10%范围内,HD201抗体的α岩藻糖基化水平仅在5~7%范围内。因此,发明人进行实验以提高半乳糖基化含量和α岩藻糖基化含量。
在本发明以前,在加入糖结构单元条件下进行了实验以诱导半乳糖基化,结果没有显著的半乳糖基化效应,但是在半乳糖+锰(Mn2+)的存在下检测到高α岩藻糖基化含量。基于该状况,通过改变其他条件检测了糖链含量(质量)的变化。
本发明的一个实施方案中,在加入锰(Mn2+)和半乳糖以及可诱导α岩藻糖基化添加剂的条件下和在加入可诱导α岩藻糖基化添加剂但不加入锰(Mn2+)和半乳糖的条件下进行了实验。结果证实,为获得与对照药物等价的半乳糖基化水平,需要加入锰(Mn2+)和半乳糖两种物质,并且甘油可影响α岩藻糖基化。此前没有关于甘油可影响α岩藻糖基化的技术报道,而本发明人首次开发了该技术。
为确定适当的甘油浓度,在0~3.0%(v/v)浓度范围内进行了实验,经证实,抗体的α岩藻糖基化含量随甘油浓度的提高而提高。具体地,当相对α岩藻糖基化含量提高时,在相似甘油浓度范围内检测了相对于无添加条件下的培养效能。结果,当甘油浓度为1%到2%时检测到显著效应。
此外,本发明一个具体的实施方案中,开发锰和半乳糖的替代物作为添加剂用于提高半乳糖含量,将尿苷作为候选并用于进行实验。在3种物质中的单独添加中,单独添加锰与单独添加半乳糖或尿苷相比显示出与对照药物的G0F比率和G1F比率相似的G0F比率和G1F比率,因此可以看出锰是新方法中主要的半乳糖基化因子。相反地,单独加入尿苷,半乳糖基化含量随尿苷浓度提高而提高。但是在高浓度条件(8mM)下,检测到生长抑制和表达水平下降,因此认为在培养早期加入高浓度尿苷对于新方法是不适当的。对于α岩藻糖基化,比较了锰、半乳糖和尿苷3种物质。结果证实,锰和半乳糖之间相关度低,但是α岩藻糖基化含量随尿苷浓度的提高而提高。
新方法中加入锰、半乳糖和尿苷进行的实验结果显示,锰是可影响抗体半乳糖基化最重要的因子,并且发现当尿苷取代半乳糖时,设计提高半乳糖基化和α岩藻糖基化的方法是可能的。因此,本发明人通过加入锰、尿苷和甘油的组合进行实验,以提高与对照药物在α岩藻糖基化和半乳糖基化方面的等价性。
本发明一个具体的实施方案中,通过使用迄今已进行实验的添加剂条件的组合,进行实验以控制抗体(曲妥珠单抗)的半乳糖基化模式和岩藻糖基化模式,使得其与对照药物的那些模式最相似。作为可调节抗体糖链含量的添加剂,可以使用作为可提高半乳糖基化的主要添加剂的锰,作为可诱导α岩藻糖基化的添加剂的甘油,以及作为可替代半乳糖并且作为半乳糖基化和α岩藻糖基化的共同添加剂的尿苷来设计实验。
检测到加入高浓度的尿苷可促进α岩藻糖基化但是通过生长抑制而降低表达水平。因此,将尿苷在培养的第5天单独加入以最小化生长抑制和高甘露糖形式。
经证实,锰具有最高的促进半乳糖基化效应,并且在20μM~120μM浓度范围内显示出相似的效应。此外,在1%到3%浓度范围内的甘油显示出促进α岩藻糖基化效应与其浓度成比例。
将所述3种因素混合并作为添加剂加入,结果证实尿苷具有提高半乳糖基化的效应,因此将尿苷视为半乳糖的替代物,还显示出可提高α岩藻糖基化的效应,虽然该效应是低的。同时,在玻瓶培养实验中,发现与对照药物(H0717)的条件最相似的条件是在40μM锰+1%甘油组合基础上加入尿苷(在培养的第5天加入)。
相反地,生物反应器培养实验的结果显示,向生产介质中加入2%甘油而非1%甘油在α岩藻糖基化方面显示出高等价于对照药物将对照药物的α岩藻糖基化比率视为“1”,旧方法的样本显示出的α岩藻糖基化比率为0.43,添加2%甘油条件显示出的α岩藻糖基化比率为0.86,其略低于对照药物的α岩藻糖基化比率但是旧方法样本的α岩藻糖基化比率的2倍高。
在用于提高糖链调节(半乳糖基化和α岩藻糖基化)添加剂的生物反应器实验结果中,加入2%甘油与旧方法的样本相比显示出可增加N-聚糖谱(profile)中的α岩藻糖基化比率的效应,并且对于半乳糖基化,加入锰和尿苷显示出可增加半乳糖基化的效应。但是,其未显示出完全等价于对照药物因此试图改变甘油和尿苷的浓度以及添加方法。
首先,通过加入2%甘油至进料介质进行进料以提高甘油的添加作用。加入尿苷作为半乳糖的替代物,通过将其浓度从4mM增加到8mM以提高半乳糖基化效应。此外,在通过加入尿苷进行的玻瓶实验中,在培养的最后一天测定了pH。结果,pH值为6.9。因此,加入尿苷后将培养pH从pH 6.8调节到了pH 6.9。为保持生物反应器中pH 6.8,需进料CO2,但是pCO2常常从培养的第4天持续增加,并在培养的第5天快速增加到100mmHg或更高。因此,参考文献中报道的高pCO2可负调节糖基化(Kimura R,1997),在培养的第5天当主培养物的pH升高到pH 6.9时降低pCO2。针对该事实,设计实验如下:所有3个组通过将调节糖链含量(质量提高)的添加剂,40μM锰(M)和2%(v/v)甘油(Gcr)加入生产介质中作为新方法的添加剂选择,并在第5天的主培养物中加入8mM尿苷(Urd),继续培养。因此,设计了包括在培养的第5天加入8mM尿苷,然后加入40μM锰和2%甘油的新方法。此外,检测了相同条件下的3组生物反应器培养物中产生的抗体的糖基化含量,从第8天相应的主培养物组获得的样本的N-聚糖谱与旧方法的相比较。结果,HD201P-1102参照物(内标)的半乳糖基化(所有含半乳糖的低聚糖总和)%是33.9%,新方法的3个组半乳糖基化%在41.8%~42.2%范围,比HD201P-1102的半乳糖基化%高约8%。此外,HD201P-1102的α岩藻糖基化(所有不含岩藻糖的低聚糖总和)%是3.8%,新方法的3个组α岩藻糖基化%在9.1%~9.5%范围,比HD201P-1102的α岩藻糖基化%高约6%。与对照药物相比,对照药物(批号H0717)的半乳糖基化%是43%,因此对照药物和新方法的3组之间半乳糖基化%的差异小于2%;而对照药物的α岩藻糖基化%是8.9%,因此对照药物和新方法之间α岩藻糖基化%的差异小于2%,表明所述条件可有效地等价于对照药物。对照药物的低聚甘露糖型(所有含甘露糖的低聚糖总和)是1.7%,并且新方法的低聚甘露糖型(4%)比对照药物的低聚甘露糖型高2%。
此外,将新方法中设计的可调节糖链含量(改进Fc N-聚糖质量)的添加剂(锰、甘油和尿苷)在小规模生物反应器中应用于旧方法(不同的介质环境),以检测糖基化谱(半乳糖基化/α岩藻糖基化)是否受到调节。将2%甘油加入新方法的生产培养介质和进料基质中,但是该实验中,将甘油浓度提高到3%。从生物反应器中的主培养物收集的样本中,比较了旧方法中加入添加剂条件和不加入添加剂条件之间的N-聚糖谱。加入添加剂条件的半乳糖基化%为43.8%,而不加入添加剂条件的半乳糖基化%为43%,即加入添加剂条件的半乳糖基化%提高了1%。此外,加入添加剂条件的α岩藻糖基化%为18.7%,而不加入添加剂条件的α岩藻糖基化%为9.1%,即加入添加剂条件的α岩藻糖基化%提高了2倍。此外,在新方法中,比较了加入添加剂条件和不加入添加剂条件。结果,加入添加剂条件的半乳糖基化%为40.5%,不加入添加剂条件的半乳糖基化%为31.8%,即加入添加剂条件的半乳糖基化%提高了8%。加入添加剂条件的α岩藻糖基化%为14.1%,而不加入添加剂条件的α岩藻糖基化%为6.1%,即加入添加剂条件的α岩藻糖基化%提高了2倍,与旧方法相似。
经证实,加入本发明开发的可调节糖链含量(改进Fc N-聚糖质量)的添加剂(锰、甘油和尿苷)在新方法和旧方法中产生了相似的效应。
依据抗体依赖性细胞毒性测定的SOP进行了HD201抗体的ADCC活性测定[HD201抗体依赖性细胞毒性测定]。
此外,在本发明一个具体的实施方案中,加入本发明可调节糖链含量的添加剂(锰、甘油和尿苷)制备的抗体的ADCC活性通过相对ADCC测定检测,其是一种体外测定。将目前可获得的原产品用作ADCC活性的参照物质(对照药物)。实验结果表示为由通常使用的EC50值确定的相对ADCC%(A)和使用通过PLA s/w计算的相对活性比率的相对ADCC活性%(B)。可以看出,依据EC50和PLA所得的结果之间略有不同,但整体模式一致。
在小规模的旧方法中,加入添加剂条件的ADCC活性与对照药物相比为217.5%,未加入添加剂条件的ADCC活性为78.7%,低于对照药物的ADCC活性。因此,将所述可调节糖链含量(改进Fc N-聚糖质量)的添加剂(锰、甘油和尿苷)应用到旧方法中时,α岩藻糖基化比率可提高到2倍,导致ADCC活性与未加入添加剂条件相比提高100%或更高。在新方法中,与对照药物相比加入添加剂条件的ADCC活性为130%,与对照药物相比未加入添加剂条件的ADCC活性为42.7%,是最低的活性。因此,由于旧方法使用不同的介质,当向新方法中添加可调节糖链含量(改进Fc N-聚糖质量)的添加剂(锰、甘油和尿苷)时,α岩藻糖基化比率可提高到2倍,导致ADCC活性与未加入添加剂条件相比提高80%或更高。
如本发明的实施例中所证实,当使用本发明可调节糖链含量的添加剂实施曲妥珠单抗的生产过程时,调节抗体糖链含量是可能的。具体地,在韩国或其他国家尚无关于甘油对α岩藻糖基化效应的研究或文献。基于上述实验结果,发明人首次开发了使用甘油调节糖链含量来制备抗体的方法。
本发明中,可通过本领域技术人员公知的方法在适合表达抗体的细胞的温度、介质和气体条件下进行培养。可用于本发明抗体制备的方法例如分批培养、进料分批培养、持续培养或其组合等,但不限于此。
本发明的制备方法可包括步骤(a)在含有甘油和锰的介质中培养表达抗体的细胞;和(b)在还含有尿苷的介质中培养步骤(a)中培养的细胞。具体地,所述方法还可包括步骤(c)通过加入含有甘油和锰的进料介质培养步骤(b)中培养的细胞。步骤(a)可进行3天到8天,并且本发明的实施例中尿苷处理在培养的第5天进行。
本发明的制备方法还可包括步骤(a)在含有甘油和锰的介质中培养表达抗体的细胞;(b)在还含有尿苷的介质中培养步骤(a)中培养的细胞;和(c)使用含有甘油和锰的介质进行进料分批培养。
同时,步骤(a)和步骤(b)可通过分批培养进行,而步骤(c)可通过进料分批培养进行,但不限于此。
此外,本发明的制备方法还可包括从细胞培养液中纯化抗体的步骤,并且纯化抗体的方法可通过本领域公知的多种方法例如蛋白质A/G柱、HPLC等进行。
本发明的介质可包含的甘油在从0%到10%的范围内或者在从0.1%到5%(v/v)的范围内,特别是在0.5%到3%(v/v)的浓度范围内。此外,所述介质可包含的锰在从0μM到250μM的浓度范围内或者从10μM到200μM的浓度范围内,特别是在从20μM到120μM的浓度范围内。此外,所述介质可包含的尿苷在从0mM到20mM的浓度范围内或者从1mM到10mM的浓度范围内,特别是从4mM到8mM的浓度范围内。
具体地,本发明的介质可包含的甘油在从0.5%到3%(v/v)浓度范围内,包含的锰在从20μM到120μM浓度范围内,包含的尿苷在从3mM到10mM浓度范围内。
本发明锰的类型不受限制,只要对人体无毒性即可,例如氯化锰。
对于本发明的介质中包含的可调节糖链含量的添加剂,基于介质的终浓度,甘油(%,v/v):锰(μM)的比率可以是0.5:20、1:20、2:20、3:20、0.5:40、1:40、2:40、3:40、0.5:80、1:80、2:80、3:80、0.5:120、1:120、2:120或3:120。此外,本发明中,基于介质的终浓度,可包含在本发明的介质中并组成可调节糖链含量的添加剂的尿苷可加入的浓度为2到8mM。
本发明一个具体的实施方案中,经证实当本发明的可调节糖链含量的添加剂基于介质的终浓度具有的甘油(%,v/v):锰(μM):尿苷(mM)的比率为1.0:40:80或2.0:40:80时,糖链含量类似于已知的对照药物可获得的糖链含量。
通过本发明的制备方法制备的抗体的糖链含量中,半乳糖基化含量可以在从35%到50%的范围内,α岩藻糖基化含量可在从8%到20%的范围内。
本发明另一方面提供了通过本发明的方法制备的具有调节的糖链含量的抗体群。
所述方法、抗体群和具有调节的糖链含量的抗体群如上所述。
本发明另一方面提供了可调节糖链含量的方法,所述方法包括在含有甘油作为调节抗体糖链含量添加剂的介质中培养可表达抗体的细胞的步骤。所述介质还可包括选自包含作为调节糖链含量的添加剂的锰和尿苷的组中的一种或多种。
糖链含量、抗体、表达抗体的细胞和培养如上所述。
本发明另一方面提供了可调节抗体糖链含量的介质组合物,所述介质组合物包含甘油作为调节抗体糖链含量的添加剂。
糖链含量和抗体如上所述。
本发明的可调节抗体糖链含量的介质组合物还可包含选自包括作为调节抗体糖链含量的添加剂的锰和尿苷的组中的一种或多种。
本文中,术语“介质”广义地是指可为增殖细胞提供营养物的含营养物溶液,所述溶液可包含通常为细胞增殖和/或存活所需要的必须氨基酸和非必须氨基酸、维生素、碳源、脂类、微量元素等,但不限于此。依据要培养的细胞类型,所述介质优选地在适于细胞存活和增殖的pH和盐浓度下依据配方制备。所述介质还可包括本领域广泛用作可增强增殖和/或存活的组分,包括激素和生长因子。
此外,除可调节抗体糖链含量的添加剂外,本发明的介质中的组分还可包含本领域广泛用于产生抗体的任意组分以及本领域技术人员依据常识或实验可容易地构成的组分。
本发明一个具体的实施方案中,主培养是基于介质A通过控制添加剂而进行的,而进料分批培养是基于进料C通过控制添加剂而进行的。
下文中,将参考实施例更详细地描述本发明。但是,所述实施例仅用于说明目的,而不意图通过所述实施例限定本发明的范围。
实施例1:添加剂调节抗体糖链的实验
1-1.用于选择可诱导α岩藻糖基化添加剂的玻瓶培养实验
为诱导半乳糖基化,在加入糖结构单元(葡萄糖胺、N-乙酰葡萄糖胺、N-乙酰甘露糖胺、半乳糖、尿苷、锰(Mn2+)、甘油)的条件下进行实验。如图35实验数据的测定结果所示,检测到显著的半乳糖基化效应,但是也检测到高α岩藻糖基化含量。基于所述结果,在随后的研究中使用已知可产生半乳糖基化相关效应的半乳糖+锰(Mn2+)的组合,并检测变化。此外,为寻找单独使用时具有效应的因子,在排除半乳糖+锰(Mn2+)的条件下进行平行实验。
具体而言,在加入锰(Mn2+)和半乳糖以及可诱导α岩藻糖基化的添加剂的条件下和在加入可诱导α岩藻糖基化的添加剂但不加入锰(Mn2+)和半乳糖的条件下进行实验。
制备并使用200g/L半乳糖储存液,并制备和使用40mM MnCl2·4H2O(Mn2+)储存液。加入生产介质中的锰和半乳糖是基于35mL(主要玻瓶培养物的体积)稀释的,将每种条件的进料介质分别分为20mL,并且基于20mL体积稀释储存液并加入。
对于可诱导α岩藻糖基化的添加剂葡萄糖胺和N-乙酰葡萄糖胺各制备1M储存液,且将纯甘油视为100%并以体积比(v/v,%)加入,制备50mM丁酸钠储存液和50g/L乳糖储存液,并1/100稀释。几夫碱作为α甘露糖苷酶I抑制剂是已知具有α岩藻糖基化效应的物质,并以100μg/mL(Qun Zhou et al.,2008;US 2007/0092521 A1)的浓度制备。
实验条件概述见下表1。
表1可诱导α岩藻糖基化添加剂的玻瓶实验条件
1-2.可诱导α岩藻糖基化的添加剂玻瓶实验的细胞培养结果
在选择可诱导α岩藻糖基化的添加剂的玻瓶实验中,测定了细胞生长谱、细胞存活率谱和最终表达水平谱(效价谱)。
如图3所示,细胞生长谱结果显示,当不加入锰和半乳糖(对照)时检测到最高的细胞生长,当加入0.5mM丁酸钠时检测到生长抑制。
如图4所示,细胞存活率谱结果也显示,当加入丁酸钠时在培养终点细胞存活率减低至80%或更低,当同时加入10ng/mL几夫碱与锰和半乳糖时在培养终点细胞存活率减低至77%。其他添加剂条件显示出相似的细胞生长谱和细胞存活率谱。
同时,测定了在可诱导α岩藻糖基化的添加剂条件下相对于对照组的最终表达水平(效价谱),结果当加入葡萄糖胺和N-乙酰葡萄糖胺或甘油时,与对照组相比表达水平提高1.1倍。相反地,当加入丁酸钠时,表达水平提高0.8倍,这低于其他条件下的值。可能所述表达水平的减低是因为细胞生长和细胞存活率的下降。
1-3.抗体糖链含量测定
为测定抗体糖链含量,进行了抗体N-聚糖测定。具体而言,依据HD201N-聚糖测定的SOP[HD201的N-聚糖NP-UPLC测定]进行N-聚糖测定,使用肽N-糖苷酶(PNGase)处理抗体以只分离N-聚糖结构。测定了半乳糖基化糖型和α岩藻糖基化糖型,每种计算的相对含量如图所示(图6和7)。此外,与未加入添加剂的对照相比,半乳糖基化和α岩藻糖基化的提高和减低如图所示(图8)。
如图6到8所示,加入锰和半乳糖的条件与未加入添加剂的条件最大的差异是半乳糖基化含量的不同,并且与未加入添加剂的对照相比加入所述两种物质时检测到高的相对半乳糖基化含量。相反地,与对照组相比当未加入所述两种物质时检测到相似或者较低的相对半乳糖基化含量。所述结果表明,锰和半乳糖都是提高半乳糖基化含量所需要的。
1-4.根据锰(M)、半乳糖和尿苷(Urd)单独或组合处理产生的抗体糖链改变的实验
作为调节抗体糖链含量的方法,使用锰和半乳糖的方法已被公开(例如Abbott,US 2012/0276631;WO 2012/149197)。本实验意图寻找锰和半乳糖的其他替代物。
旧方法是在开发早期的产生用于第I阶段临床试验的样本的方法,而新方法是通过方法改进开发的用于第III阶段临床试验的方法。新方法和旧方法的区别在于生产介质和进料介质,并且本发明的添加剂意图用于通过制备糖链模式提高抗体活性,具体地,在开发新方法过程中使α岩藻糖基化含量类似于原产品的α岩藻糖基化含量。
制备并使用200g/L半乳糖储存液,以及制备并使用40mM MnCl2·4H2O(Mn2+)储存液。加入到生产介质中的锰和半乳糖是基于35mL(主要玻瓶培养物的体积)稀释的,将每种条件的进料介质分为20mL,并且基于20mL体积稀释储存液并加入。
实验条件见下表2
表2锰(Mn2+)、半乳糖(Gal)和尿苷(Urd)的加入条件
如图9所示,玻瓶培养的结果显示,当加入锰和半乳糖时大多数细胞生长谱是相似的,当不加入添加剂(对照)并只加入40μM锰时检测到最高峰的细胞密度。当加入尿苷(Urd)的浓度为8mM时,在培养早期检测到生长抑制,而当加入尿苷的浓度为4mM时,在培养后期细胞密度减低被大大地提高。
在细胞存活率谱(图10)中,当加入8mM尿苷时存活率迅速减低,而其他条件下显示出相似的模式。
如图11的抗体表达水平谱(效价谱)所示,加入锰的条件与未加入添加剂条件(对照)相比显示出约0.9~1.1的相对含量比率,而加入半乳糖条件显示出0.9~1.0的相对含量比率。当加入尿苷时,相对于未加入添加剂的条件(对照)的表达水平减低随尿苷浓度的升高而升高。与未加入添加剂的条件(对照)相比,当加入8mM尿苷时相对含量比率减低至0.36,表明所述减低归因于由于细胞生长抑制的导致表达水平减低。因此,证实了加入锰的浓度在40μM~120μM范围内时,对所述方法无影响。
1-5.抗体糖链含量的测定
如表2的条件,将不同浓度的锰、半乳糖和尿苷加入玻瓶中,检测了培养产物的糖链含量(糖基化质量)。具体而言,测定了半乳糖基化糖型和α岩藻糖基化糖型,每种计算的相对含量如图表所示(图12和13)。此外,与未加入添加剂的对照相比的半乳糖基化和α岩藻糖基化的提高和减低的测定结果如图表所示(图14)。
如图12所示,计算半乳糖基化含量的结果显示,当同时加入40μM锰和2g/L半乳糖时,与对照(未加入添加剂的条件)相比检测到最高含量,所述三种物质单独加入时加入锰的实验组显示出比加入半乳糖或加入尿苷的实验组更高的值,表明新方法中锰是半乳糖基化的主要因子。相反地,单独加入尿苷时,半乳糖基化含量随尿苷浓度的升高而升高。但是,在高浓度条件(8mM)下,检测到生长抑制和表达水平减低,因此认为新方法中在培养早期加入高浓度尿苷是不适当的。
如图13中计算的α岩藻糖基化含量的结果所示,比较了锰、半乳糖和尿苷三种物质。结果证实了,锰和半乳糖显示出无效果,但是α岩藻糖基化随尿苷浓度的升高而升高。在显示与未加入添加剂的组相比的半乳糖基化/α岩藻糖基化差异的图表(图14)中,证实了与未加入添加剂组相比当加入锰时半乳糖基化提高到10%或更高,并且与未加入添加剂组相比α岩藻糖基化随尿苷浓度的升高而升高。
依据新方法中所述检测锰、半乳糖和尿苷添加作用的结果,证实了锰是抗体半乳糖基化中最重要的因子,并且当尿苷取代半乳糖时,可得到半乳糖基化和α岩藻糖基化的提高。
开发生物仿制药的后续实验中,将锰、尿苷和甘油组合加入,以提高等价于商业对照药物的半乳糖基化/α岩藻糖基化。
1-6.依据甘油加入改变糖链的玻瓶培养实验
该实验中,除锰和半乳糖外,将通过选择可诱导α岩藻糖基化的添加剂得到的甘油(Gcr)以不同浓度加入,并检测其效果。
甘油是众所周知的作为抗冻剂和蛋白质稳定剂的物质,已有文献报道显示甘油可提高重组蛋白的表达水平或唾液酸含量(Rodriguez et al.2005,Chi-Hsien Liu 2007),但是未提及与本发明相关的抗体α岩藻糖基化。
因此,为检测甘油对抗体α岩藻糖基化的影响,进行了实验。具体而言,加入甘油的浓度为0、0.5、1或2%(v/v),并依据甘油加入检测α岩藻糖基化含量。
实验条件如下表3。
表3可诱导α岩藻糖基化添加剂-甘油的玻瓶培养实验条件
测定了依据甘油浓度的细胞生长谱和细胞存活率谱。如图15结果所示,在加入甘油的条件下和未加入甘油的条件下检测到相似的细胞生长和细胞存活率。经证实,在培养的最后一天细胞存活率与未添加的条件相比略低。
此外,如图16的测定最终抗体表达水平的结果所示,与未加入甘油的条件相比,抗体表达水平随甘油浓度升高而升高。当加入2.0%甘油时,表达水平提高1.1倍或更高,其被记为最高相对含量比率。
1-7.抗体糖链含量测定
在表3条件下,测定了依据甘油浓度的半乳糖基化糖链含量和α岩藻糖基化糖链含量。
如图17所示,随着甘油浓度增加,半乳糖基化略微减低,但是半乳糖基化抗体含量保持在40%或更高,表明无大的影响(图17(A)),对于α岩藻糖基化,随着甘油浓度升高α岩藻糖基化抗体含量与对照(未加入甘油组)相比显著升高(图17(B))。
1-8.新方法中可共诱导半乳糖基化和α岩藻糖基化的添加剂混合物玻瓶培养实验
通过使用上述实施例中获得的添加剂条件实验结果的组合,进行实验以检测在何种条件下最终制备的抗体群与对照药物相比显示出最相似的糖链含量,即的半乳糖基化和α岩藻糖基化含量。
本实验中,将可提高半乳糖基化的主要因子锰(M)、可诱导α岩藻糖基化的添加剂甘油(Gcr)以及作为半乳糖基化和α岩藻糖基化的辅因子的半乳糖的替代物尿苷(Urd)用作添加剂。
同时,上述实验(实施例1-4)显示加入4mM或更高浓度的尿苷可促进α岩藻糖基化但通过生长抑制而减低表达水平。因此,本实验中按照下表4的实验条件在主培养的第5天单独加入4mM尿苷以最小化生长抑制和高甘露糖形式。
上述实验(实施例1-4)证实了锰(M)具有最高的促进半乳糖基化效应,并且在40到120μM浓度范围显示出相似的效应。
本实验中,将40μM或更少的锰加入至生产介质或进料介质中。
最后,将甘油以1%和2%的浓度只加入生产介质中,这在上述甘油加入实验中显示出效果(实施例1-6)。
实验条件概述见下表4。
表4新方法中诱导半乳糖基化和α岩藻糖基化添加剂混合物的玻瓶培养条件
图18示出了在表4条件下检测的通过玻瓶培养的细胞生长谱和细胞存活率谱的结果,当加入锰(M)时多数细胞的生长谱是相似的,但是加入2%甘油比加入1%甘油显示出较低的细胞生长速率。在未加入甘油的条件(40μM锰+2.0g/L半乳糖)下和加入1%甘油条件下检测到相似的峰值细胞密度,表明在旧方法中加入1%甘油不影响细胞生长效率。由于尿苷是在主培养的第5天加入的,在培养早期未发生生长抑制,但是与未加入尿苷的条件相比加入尿苷后细胞存活率减低增强了。
检测最终表达水平的结果(图19)显示,除未加入甘油和尿苷的条件(40μM锰+2.0g/L半乳糖)以外,其他条件显示出相似或更高的表达水平。
1-9.抗体糖链含量测定
依据表4条件下的添加剂组合测定了半乳糖基化糖链含量和α岩藻糖基化糖链含量。具体而言,N-聚糖测定谱的峰面积计算为半乳糖基化含量和α岩藻糖基化含量。
如图20所示,与未加入尿苷的条件相比,在基于40μM锰+1%甘油组合在培养的第5天加入尿苷的条件下半乳糖基化含量提高。至于α岩藻糖基化,与未加入尿苷的条件相比,当加入4mM尿苷时α岩藻糖基化含量提高。与未加入尿苷的条件相比,在基于40μM锰+2%甘油组合在培养的第5天加入尿苷的条件下半乳糖基化含量提高。至于α岩藻糖基化,与未加入尿苷的条件相比,当加入4mM尿苷时α岩藻糖基化含量提高。具体地,α岩藻糖基化含量提高与加入的甘油量成比例。
与未加入尿苷的条件相比,在基于20μM锰+1%甘油组合在培养的第5天加入尿苷的条件下半乳糖基化含量提高。至于α岩藻糖基化,与未加入尿苷的条件相比,α岩藻糖基化含量提高。在基于20μM锰+2%甘油组合加入尿苷的条件下检测到相似的模式。
总之,经证实,新方法中加入尿苷可提高半乳糖基化,因此尿苷可替代半乳糖。还证实了尿苷可轻微提高α岩藻糖基化。
作为对照组,只将2.0g/L半乳糖加入新方法中,并依据锰、甘油和尿苷的条件检测了半乳糖基化/α岩藻糖基化差异(百分比变化)。图21的结果显示,加入锰后半乳糖基化含量提高到6~13%,加入甘油后α岩藻糖基化含量提高到1.5~4%。
实施例2:在生物反应器水平的添加剂调节糖链实验
基于实施例1的玻瓶培养实验结果,检测了在生物反应器中是否可以调节抗体糖链。
2-1.通过改变甘油浓度的生物反应器实验
为参照上述实施例1-6玻瓶培养实验的结果通过加入甘油检测α岩藻糖基化,在反应器水平实施本发明。
如实施例1-6,只在生产介质中加入1%和2%(v/v)浓度的甘油,见下表5。加入生产介质中的甘油是通过基于主要反应器培养物的体积3.5L将纯溶液(100%)稀释制备的,并且在进料介质中未加入甘油。意图是将添加剂例如锰和甘油用于在开发新方法的过程中获得类似对照药物的半乳糖基化含量和α岩藻糖基化含量。
反应器水平的实验条件概述见下表5。
表5通过改变甘油浓度的生物反应器实验条件
在生物反应器中在表5条件下进行培养,并测定了细胞生长谱和细胞存活率谱。如图22中的结果,与加入2%甘油相比加入1%甘油显示出高细胞生长谱(约10%差异,基于峰值细胞密度),并且显示出与未加入添加剂条件相似的高细胞生长谱。
最终相对表达水平结果(图23)显示,与未加入添加剂的组相比,在培养的最后一天所有加入甘油的组显示出高最终相对表达水平。
2-2.抗体糖链含量测定
依据表5条件下的添加剂组合测定半乳糖基化糖链含量和α岩藻糖基化糖链含量。具体而言,将在2种单位(加入1%或2%甘油)的生物反应器中培养了8天的培养液中的N-聚糖测定结果计算为半乳糖基化含量(A)和α岩藻糖基化含量(B)。
如图24所示,向生产介质中加入2%甘油而非加入1%甘油的反应器培养实验结果显示出α岩藻糖基化含量提高。
如图25所示,测定相对于对照组(无锰、半乳糖和甘油加入)的半乳糖基化含量/α岩藻糖基化含量结果显示,与未加入添加剂的对照组相比添加剂可提高半乳糖基化至12%或更高,并且可提高α岩藻糖基化至1.5%。如图34所示,提高α岩藻糖基化含量的效应比之前第I阶段临床试验的样本高约2倍。
2-3.新方法最终的添加剂选择及3组生物反应器实验
如实施例2-2所证实,加入2%甘油与未加入添加剂条件相比显示出可提高N-聚糖谱的α岩藻糖基化效应,并且如实施例1所证实,加入锰和尿苷显示出可提高半乳糖基化效应。对于对照药物的等价物,将甘油加入生产介质和进料介质中,并在培养的第5天加入浓度为8mM的尿苷。进行3组重复的培养。
具体而言,在上述实验(实施例2-1)中将甘油只加入生产介质中,但是为了提高添加作用,还将2%甘油加入进料介质中用于进料。当从培养起始就加入高浓度甘油时,关系到生长抑制。因此,向进料介质中等量加入2%甘油,意图消除进料产生的稀释效应。
对于锰和半乳糖,将尿苷取代半乳糖,并且为提高半乳糖基化效应将尿苷浓度从4mM提高到8mM。此外,在加入尿苷的玻瓶培养实验中,测定了培养最后一天的pH。结果,pH约为pH 6.9。在该实验中,加入尿苷后,培养物pH从pH 6.8升高到pH 6.9,因为pH可引起玻瓶培养和生物反应器培养之间添加剂浓度效应的差异。
当意图将反应器中的pH保持在6.8时,从培养的第4天开始倾向于持续增加pCO2,并在培养的第5天迅速升高到100mmHg或更高。因此,参考高pCO2可负调节糖基化的文献报道(Kimura R,1997),预期在培养的第5天当主培养物pH升高到pH 6.9时可减低pCO2。
基于所述事实的实验条件概述见下表6。对于下述条件,所有3组通过加入可调节糖链含量的添加剂而被同样地执行(质量提高),将40μM锰(M)和2%(v/v)甘油(Gcr)加入至生产介质(介质A),并且在主培养的第5天加入8mM尿苷(Urd),继续培养。
表6用于新方法添加剂的最终选择及3组生物反应器实验的条件
如图26,示出了在表6的条件下在生物反应器中培养的细胞生长谱和细胞存活率谱的测定结果,细胞生长谱显示峰值细胞密度是约(18-24)×106个细胞/mL,与未加入添加剂的对照组结果相似。
结果,主培养的最后一天最终相对表达水平(图27)约为1.05,比未加入添加剂的对照组结果略高或与其相似。
2-4.抗体糖链含量测定
测定了通过新方法在表6中的基于40μM锰和2%甘油在培养的第5天加入8mM尿苷的条件下由3组生物反应器培养产生的HD201抗体的半乳糖基化糖链含量和α岩藻糖基化糖链含量。具体而言,将每组和未加入添加剂的对照组的主培养第8天的样本的N-聚糖谱进行比较。结果,对照组的半乳糖基化(所有含半乳糖的低聚糖总和)%是31.8%,新方法3个组的半乳糖基化(所有含半乳糖的低聚糖总和)%是41.8%到42.2%,显示出约10%提高。此外,未加入添加剂对照组的α岩藻糖基化(所有不含岩藻糖的低聚糖总和)%是6.1%,新方法3个组的α岩藻糖基化(所有不含岩藻糖的低聚糖总和)%是9.1~9.5%,显示出约3%提高。
将所述结果与对照药物的结果相比较。结果,对照药物批号H0717)的半乳糖基化%是43%,与新方法3个组的结果相比差异为2%或更低,对照药物的α岩藻糖基化%是8.9%,与新方法的结果相比差异为1%或更低,表明在等价于对照药物方面具有非常优异的效果。
2-5.添加剂组合物应用于旧方法的效果
检测了当将新方法中开发的添加剂组合物(锰、甘油和尿苷)通过上述实施例在小规模生物反应器中应用于旧方法时是否能够调节需要的糖基化谱(半乳糖基化/α岩藻糖基化),从而证实是否添加剂在旧方法中可显示出与新方法相似的效应。
将2%甘油加入新方法中的生产介质和进料介质中,但是在旧方法中将甘油浓度提高到3%,然后检测加入甘油浓度的提高产生的α岩藻糖基化含量的提高。同时,加入与新方法相同浓度的锰和尿苷。
具体而言,在小规模的第I阶段临床试验中,将40μM锰(M)和3%(v/v)甘油(Gcr)作为用于调节糖链含量的添加剂(质量提高添加剂)加入生产介质(介质D)中,并且将与在生产介质中相同浓度的锰和甘油加入进料介质(进料A)中。在新方法中,将40μM锰(M)和3%(v/v)甘油(Gcr)作为用于调节糖链含量(Fc N-聚糖质量提高)的添加剂分别加入生产介质(介质A)和进料介质(进料C)中。将在旧方法和新方法中在主培养的第5天等量加入8mM尿苷(Urd)而培养的实验组与未加入调节糖链含量(提高Fc N-聚糖质量)添加剂的对照组相比较。
实验条件概述见下表7。
表7添加剂应用于新方法和旧方法的条件
在表7的条件下进行生物反应器培养以测定细胞生长谱和细胞存活率谱。如图30所示,未加入添加剂的新方法和加入添加剂的新方法之间峰值细胞密度的差异是约24%细胞生长谱,并且检测到加入添加剂产生的细胞生长抑制。旧方法中也检测到加入添加剂产生的细胞生长抑制。其解释为,细胞生长抑制是由在添加剂中加入3%甘油引起的,并且以前的实验显示细胞生长抑制倾向于随着甘油浓度的提高而提高。
通过比较未加入添加剂的旧方法和未加入添加剂的新方法以及比较加入添加剂的旧方法和加入添加剂的新方法,证实了新方法和旧方法之间细胞生长谱的差异。未加入添加剂条件之间的峰值细胞密度差异是约34%,表明新方法中检测到大细胞量。此外,加入添加剂条件之间的峰值细胞密度差异是约28%,并且新方法显示出比旧方法更高的峰值细胞密度。旧方法中,主培养进行7天,因此在小规模的组中的培养也进行7天。
加入添加剂条件和未加入添加剂条件在培养终点时的细胞存活率(B)保持在80%或更高。据认为,未加入添加剂的旧方法中培养5天后存活率的高减低比率是由于培养3天后葡萄糖消耗。
最终相对表达水平的结果(图31)显示,旧方法无论是否加入添加剂在培养的第7天都显示出相似的模式,而新方法中加入添加剂条件比未加入添加剂条件的表达水平低13%。新方法的表达水平相对于旧方法的表达水平是1.8,表明产率提高80%或更高。
2-6.抗体糖链含量测定
测定了在表7条件下产生的抗体的半乳糖基化糖链含量和α岩藻糖基化糖链含量。进行本实验以比较在新方法和旧方法中加入或者未加入调节糖链含量(质量提高)添加剂(锰、甘油和尿苷)的条件。
具体而言,通过N-聚糖测定检测了生物反应器培养样本产物的糖基化含量(糖基化质量),并说明了半乳糖基化含量和α岩藻糖基化含量的结果。比较了在旧方法中加入添加剂条件和未加入添加剂条件的从主培养物回收的样本的N-聚糖谱。结果,加入添加剂条件的半乳糖基化含量(%)是43.8%,未加入添加剂条件的半乳糖基化含量(%)是43%,显示出加入添加剂条件下提高约1%。加入添加剂条件的α岩藻糖基化含量(%)是18.7%,未加入添加剂条件的α岩藻糖基化含量(%)是9.1%,显示出加入添加剂条件下提高约2倍。
在新方法中,将加入添加剂条件与未加入添加剂条件比较。结果加入添加剂条件的半乳糖基化含量(%)是40.5%,未加入添加剂条件的半乳糖基化含量(%)是31.8%,显示出加入添加剂条件下提高约8%。加入添加剂条件的α岩藻糖基化含量(%)是14.1%,未加入添加剂条件的α岩藻糖基化含量(%)是6.1%,显示出加入添加剂条件下提高约2倍,与旧方法类似。
所述实验结果表明,使用不同介质的情况下加入本发明的包含锰、甘油和尿苷的用于调节抗体糖链含量的添加剂在旧方法和新方法中可产生相似的效应,表明相应的添加剂可用于任意方法中而在介质方面不受限制。
实施例3:检测ADCC活性
依据抗体依赖性细胞毒性测定的SOP进行了HD201抗体的ADCC活性测定[HD201抗体依赖性细胞毒性测定]。
通过相对ADCC测定(体外测定)检测在小规模的旧方法和新方法中加入可调节糖链含量(改进Fc N-聚糖质量)的添加剂(锰、甘油和尿苷)制备的抗体的ADCC活性。将当前可获得的原始产物(H4158B03 150mg)用作ADCC活性的参照物(对照药物)。
表8测定HD201抗体的ADCC活性
实验结果表示为由通常使用的EC50值确定的相对ADCC%(A)和使用通过PLA s/w计算的相对活性比率的相对ADCC活性%(B)。可以看出,依据EC50和PLA所得的结果之间略有不同,但整体模式一致。
在小规模的旧方法中,与对照药物相比,加入添加剂条件的ADCC活性为217.5%,而未加入添加剂条件的ADCC活性为78.7%,低于对照药物的ADCC活性。因此,将所述可调节糖链含量(Fc N-聚糖质量改进)的添加剂(锰、甘油和尿苷)添加到旧方法中时,α岩藻糖基化比率可提高到2倍,致使ADCC活性与未加入添加剂条件相比提高100%或更高。新方法中,与对照药物相比,加入添加剂条件的ADCC活性为130%;与对照药物相比,未加入添加剂条件的ADCC活性为42.7%,是最低的活性。因此,由于旧方法使用不同的介质,当将可调节糖链含量(改进Fc N-聚糖质量)的添加剂(锰、甘油和尿苷)用于新方法时,α岩藻糖基化比率可提高到2倍,致使ADCC活性与未加入添加剂条件相比提高80%或更高。
总之,上述结果显示,本发明首次阐明了通过使用甘油可提高抗体的α岩藻糖基化含量,并且开发了通过使用锰和尿苷以及甘油调节糖链含量的方法。
基于以上说明,本领域技术人员应理解,本发明可应用于不同的具体形式而不改变其技术精神或实质特征。因此,应理解,上述实施方案是非限制性的,而是所有方面都是说明性的。本发明的范围由权利要求书限定,而非由说明书限定,因此落入权利要求书边界和界限范围内的所有改变及修改或所述边界和界限的等价方案都意图包含在权利要求书内。
发明效果
根据本发明的抗体的制备方法可用于通过调节抗体的糖链含量制备高质量的抗体群。此外,对于开发生物仿制药,本发明的方法可用于调节抗体的糖链含量,以此制备高等价于对照药物的抗体。由于糖链含量可通过介质组合物调节,所述调节方法在时间和成本方面是简单、有效的,因此广泛应用于抗体制备领域。
- 还没有人留言评论。精彩留言会获得点赞!
- 抗CD4的抗体及抗CXCR5的抗体在制备评估慢性移植物抗宿主病中的试剂中的应用的制作方法与工艺
- Psoriasin抗体和LL‑37抗体在制备防治银屑病的药物中的应用的制作方法与工艺
- 抗TSLP抗体在制备防治慢性瘙痒药物中的应用的制作方法与工艺
- 白细胞介素抗体在制备子宫内膜异位症药物组合物中的用途的制造方法与工艺
- 白细胞介素(IL-22)抗体在制备子宫腺肌症药物中的用途的制造方法与工艺
- 抗体配制剂的制造方法与工艺
- 通过一步法制备类美登素抗体缀合物的制造方法与工艺
- 一种胸部电阻抗体模及其制备和养护方法与流程
- ICBP90抗体及其表达抑制剂在制备促进糖皮质激素治疗效果的药物中的应用的制造方法与工艺
- 抗下垂基板及其制备和使用的方法与制造工艺