单核苷酸检测方法与流程
遗传物质的下一代测序已经总体上对生物科学尤其是医学产生巨大的影响,因为测序的单位成本随着越来越快的测序仪进入市场而直线下降。
在我们之前的申请WO 2014/053853、WO 2014/053854、WO2014/167323、WO2014/167324和WO2014/111723中,我们已经描述了新的测序方法,其涉及逐步消化多核苷酸分析物,产生有序的单核苷酸流,优选单三磷酸脱氧核糖核苷流,它们中的每一个都可以被逐一捕获入微滴流中相应的小滴。然后,可以对每个小滴进行化学和/或酶法操作,以揭示其原始包含的特定的单核苷酸。在一个实施方案中,这些化学和/或酶法操作包括这样的方法,所述方法包括使用一种或多种两成分的寡核苷酸探针类型,每种类型被修改以能够选择性捕获组成所述分析物的单核苷酸类型中的一种。典型地,在每种这样的探针类型中,两种寡核苷酸成分中的一种包含特征性的荧光团,并且在探针的未使用状态,由于存在位置邻近的猝灭剂或自身猝灭性,这些荧光团发荧光的能力保持熄灭(extinguished)。在使用时,当探针已经捕获其相应的单核苷酸时,使得其对后续的核酸外切敏感,由此从猝灭剂和/或彼此释放荧光团使得它们能够自由发荧光。通过这种方式,可以通过分光镜方式间接鉴定在每个小滴中存在的原始单核苷酸。
Fan等人在Nature Reviews Genetics 7(8)632-644(2006)中提供了研发已经允许用于基因分型、拷贝数测量、测序和检测杂合性损失、等位基因特异性表达和甲基化的高度平行的基因组测定的方法和平台的综合概述。该综述的图2a示意性显示了可环化探针的使用,其具有与分析物上的单核苷酸多态性(SNP)位点的上游和下游退火的3’和5’端,由此产生缺口,该缺口随后被作为该SNP的互补物的核苷酸填充,形成完整的环形探针,然后其可以在释放后被扩增。然而,与我们的方法不同,在填充过程中捕获的核苷酸不是直接从分析物本身获得的。
WO03/080861描述了一种方法,其中在存在当核苷酸被释放时直接与所述核苷酸连接的核苷酸特异性反应标记的条件下,使核苷酸分析物进行逐步焦磷酸解。这不但与我们使用的方法非常不同,而且在实践中,当标记的核苷酸后续被检查(interrogate)时测量的荧光信号可能太弱而使得不能进行高于相关的背景噪声的可靠的鉴定。
最后,WO94/18218教导了一种DNA测序方法,其中使分析物进行逐步核酸外切,产生单二磷酸核苷酸或一磷酸核苷酸的流,然后在检测之前使它们结合在荧光增强性基质中。这不仅是与我们所描述的方法完全不同的方法,而且我们也观察到所产生的任何信号将可能太弱而不能被可靠地检测和鉴定。
现在我们开发了在我们之前的专利申请中所述的方法的改进版本,其具有这样的优点:能够使得每种单核苷酸产生多种比之前得到的更加游离的荧光团,由此使得高于背景噪声的相关的荧光信号的检测更容易。结果,极大地提高了任何使用该方法的测序装置的灵敏性,并且可以极大地缩短准确测序大核酸分子(例如,人DNA片段)所花费的时间。并且,检测所需要的设备更简单,因此,制造起来更便宜。
因此,按照本发明的第一方面,提供一种核酸测序方法,其特征在于,其包括下述步骤:(1)通过核酸的逐步焦磷酸解产生单三磷酸核苷流;(2)通过在存在聚合酶和连接酶的条件下使至少一个所述单三磷酸核苷与相应的探针系统反应产生至少一种基本上双链的寡核苷酸使用的探针,所述相应的探针系统包含:(a)第一单链寡核苷酸,其用处于不可检测状态的特征性可检测元件标记,和(b)第二和第三单链寡核苷酸,其能够杂交于第一寡核苷酸上的互补区;(3)用具有双链核酸外切活性的酶消化所述使用的探针,产生处于可检测状态的可检测元件和单链的第四寡核苷酸,所述第四寡核苷酸至少部分是与第一寡核苷酸互补的序列;(4)使第四寡核苷酸与另一个第一寡核苷酸反应,以产生与所述使用的探针相对应的基本上双链的寡核苷酸产物;(5)循环重复步骤(3)和(4),并且(6)检测在步骤(3)的每次重复中释放的特征性可检测元件。
本发明方法的步骤(1)包括通过焦磷酸解由核酸分析物产生单三磷酸核苷流。用于该步骤的分析物适当地是双链多核苷酸,其长度原则上不受限制,包括多至在人基因组片段中发现的多种数百万个核苷酸碱基。然而,典型地,所述多核苷酸将是至少50个、优选至少150个核苷酸对长;适当地,其将大于500个、大于1000个核苷酸对长,并且在多种情形中,为数千个核苷酸对长。分析物本身适当地是天然来源的RNA或DNA(例如,来源于植物、动物、细菌或病毒),尽管所述方法也可以用于对合成制备的RNA或DNA或全部或部分由在自然中通常遇不到的核苷酸碱基(即除了腺嘌呤、胸腺嘧啶、鸟嘌呤、胞嘧啶和尿嘧啶之外的核苷酸碱基)制成的其它核酸进行测序。这些核苷酸碱基的实例包括4-乙酰基胞嘧啶核苷、5-(羧基羟基甲基)尿嘧啶核苷、2-O-甲基胞嘧啶核苷、5-羧基甲基氨基甲基-2-硫尿嘧啶核苷、5-羧基甲基氨基-甲基尿嘧啶核苷、二氢尿嘧啶核苷、2-O-甲基假尿嘧啶核苷、2-O-甲基鸟嘌呤核苷、次黄嘌呤核苷、N6-异戊基腺嘌呤核苷、1-甲基腺嘌呤核苷、1-甲基假尿嘧啶核苷、1-甲基鸟嘌呤核苷、1-甲基次黄嘌呤核苷、2,2-二甲基鸟嘌呤核苷、2-甲基腺嘌呤核苷、2-甲基鸟嘌呤核苷、3-甲基胞嘧啶核苷、5-甲基胞嘧啶核苷、N6-甲基腺嘌呤核苷、7-甲基鸟嘌呤核苷、5-甲基氨基甲基尿嘧啶核苷、5-甲氧基氨基甲基-2-硫尿嘧啶核苷、5-甲氧基尿嘧啶核苷、5-甲氧基羰基甲基-2-硫尿嘧啶核苷、5-甲氧基羰基甲基尿嘧啶核苷、2-甲基硫代-N6-异戊烯基腺嘌呤核苷、尿嘧啶核苷-5-氧基乙酸-甲酯、尿嘧啶核苷-5-氧基乙酸、wybutoxosine、wybutosine、假尿嘧啶核苷、queuosine、2-硫胞嘧啶核苷、5-甲基-2-硫尿嘧啶核苷、2-硫尿嘧啶核苷、4-硫尿嘧啶核苷、5-甲基尿嘧啶核苷、2-O-甲基-5-甲基尿嘧啶核苷和2-O-甲基尿嘧啶核苷。在DNA的情形中,所产生的单三磷酸核苷是三磷酸脱氧核糖核苷,而在RNA的情形中,它们是三磷酸核糖核苷。
在本发明的一个实施方案中,步骤(1)包括将分析物连接于基板的第一子步骤。通常,所述基板包括微流体表面、微珠(micro-bead)或可渗透膜;例如,由玻璃或不可降解的聚合物制成的微流体表面、微珠或可渗透膜。优选地,所述基板还包括适于接收分析物的表面。有很多可以将分析物连接于这样的表面的方式,原则上这些中的任一种都可以用于该子步骤。例如,一种方法包括将玻璃表面用官能化的硅烷(如环氧硅烷、氨基烃基硅烷或巯基硅烷)预处理。然后可以将这样产生的反应位点用已被修饰包含末端胺、琥珀酰基或巯基的分析物的衍生物处理。
在步骤(1)的一个实施方案中,将分析物焦磷酸解以产生单三磷酸核苷流,所述单三磷酸核苷流的排序对应于所述分析物的序列。焦磷酸解可以在20至90℃范围内的温度,在包含聚合酶的反应介质的存在下进行。优选地,其在连续流动的条件下进行,使得单三磷酸脱氧核苷随着它们被释放而被连续地从反应区移走。最优选地,通过使得包含酶和其它典型的添加剂的含水缓冲介质连续流经结合有分析物的表面来进行所述焦磷酸解。
在一个实施方案中,使用的酶是这样的,其能够使得高保真地且以合理的反应速率对分析物进行逐步3’-5’焦磷酸解降解以产生三磷酸核苷流。优选地,该降解速率尽可能快,并且在一个实施方案中,落在1至50个三磷酸核苷/秒的范围内。关于用于降解多核苷酸的焦磷酸解反应的更多信息可以例如在J.Biol.Chem.244(1969)pp.3019-3028中找到。适当地,焦磷酸解降解在存在进一步包含焦磷酸阴离子和镁阳离子(优选以毫摩尔浓度计)的介质的条件下进行。
在本发明的方法的步骤(2)中,在所述流中的至少一个单三磷酸核苷、优选每个单三磷酸核苷在存在聚合酶和连接酶的条件下与探针系统反应,产生基本上双链的使用的探针。优选地,在进行该步骤之前,使步骤(1)的包含单三磷酸核苷的产物与焦磷酸酶反应,从而将任何残留的焦磷酸根水解成磷酸根阴离子。
用于该步骤的聚合酶适当地选自由在所述反应条件下基本上不显示外切或内切核酸酶活性的那些聚合酶组成的组。可以有利地使用的聚合酶的实例包括,但不限于,获自细菌如大肠杆菌(Escherichia coli)(例如Klenow片段聚合酶)、水生栖热菌(Thermus aquaticus)(例如Taq Pol)和嗜热脂肪芽胞杆菌(Bacillus stearothermophilus)、热速芽孢杆菌(Bacillus caldovelox)和热坚芽孢杆菌(Bacillus caldotenax)的原核pol 1酶或酶衍生物。原则上,在该步骤中可以使用任意适合的连接酶。
步骤(2)中使用的探针系统包含三种成分;(a)第一单链寡核苷酸,其用处于不可检测状态的特征性可检测元件标记,和(b)第二和第三未标记的单链寡核苷酸,其能够杂交于第一寡核苷酸上的互补区。在一个实施方案中,所述第二和第三寡核苷酸是分开的实体,而在另一个实施方案中,它们通过接头区的方式彼此连接。在该后一种情形中,在一个实施方案中,所述接头区连接第二和第三寡核苷酸的末端;优选地,连接第二寡核苷酸的5’端和第三寡核苷酸的3’端。接头区原则上可以是任意二价的基团,但是便利地是另一种单链或双链的寡核苷酸片段。在一个实施方案中,所述接头区不能基本上杂交于第一寡核苷酸。
选择第一、第二和第三寡核苷酸,使得在步骤(2)中,第二和第三寡核苷酸可以分别杂交到第一寡核苷酸上的3’侧和5’侧的侧翼区,它们本身并置在捕获区的每一侧,所述捕获区包含核苷酸碱基与待检测的三磷酸核苷携带的核苷酸碱基互补的单核苷酸。这使得该三成分的探针系统对所述特定的三磷酸核苷有高度选择性。因此,例如,如果分析物来源于DNA,并且第一、第二和第三寡核苷酸是脱氧核糖核苷酸,则当捕获区包含的核苷酸携带胸腺嘧啶碱基时,所述捕获区将对三磷酸脱氧腺苷有高度选择性。在本发明的一个有用的实施方案中,步骤(2)可以在存在多种探针系统类型的条件下进行;例如,一种、两种、三种或四种探针系统类型,它们中的每一种包含具有所寻找的特征为多种不同的核苷酸碱基的不同的捕获区和与其连接的不同的可检测元件的第一寡核苷酸。
典型地,第一寡核苷酸多至150个核苷酸长,优选为20-100个核苷酸。在一个实施方案中,第二寡核苷酸比第一寡核苷酸的互补性3’侧侧翼区长多至10个、优选1-5个核苷酸。在另一个实施方案中,在第一寡核苷酸的3’端与在第二寡核苷酸上与其相反的核苷酸之间存在单个核苷酸错配,以防止所述三磷酸核苷在这一点上被聚合酶捕获。在另一个实施方案中,第三寡核苷酸的3’端包含耐受核酸外切降解的元件,以确保步骤(3)中产生的第四寡核苷酸本身不被接着消化掉。例如,这可以通过在该特定末端处或接近该特定末端处结合一个或多个硫代磷酸酯键、G-四联体、硼酸化的核苷酸、倒置的dT或ddT、C3间隔臂或磷酸基团而实现。
第一寡核苷酸的特征在于其被其本身独特类型的一种或多种可检测元件多重标记,并且这些可检测元件在探针系统处在未使用状态时基本上是不可检测的。适当地,这些可可检测元件是适于在发生光学事件后被检测到的元件。在一个优选的实施方案中,可可检测元件包括荧光团,并且每个未使用的第一寡核苷酸在设计检测所述荧光团的那些波长处基本上不发荧光。因此,尽管荧光团可能呈现跨电磁谱的一个宽的部分的整体的、低水平的背景荧光,但是通常将存在荧光强度处于最大值的一个或少数特定波长或波长封套(envelopes)。在荧光团被特征性检测的这些最大值中的一个或多个处,荧光基本上不应该发生。在本专利的语境中,术语‘基本上不发荧光’或等效用词意为,与第一寡核苷酸连接的荧光团总数在相关特征波长或波长封套处的荧光强度小于相等数量的自由荧光团的相应荧光强度的25%;优选小于10%;更优选小于1%并且最优选小于0.1%。
原则上,任何方法可以用于保证在第一寡核苷酸的未使用状态下,荧光团基本不发荧光。一种方式是在与其紧邻处额外地连接猝灭剂。另一种是基于这样的观察,即当多个荧光团彼此紧邻地连接于第一寡核苷酸时,它们倾向于彼此充分猝灭,以致可以在不需要猝灭剂的情况下实现前一段所述的标准。在本专利的语境中,什么构成荧光团之间或荧光团与猝灭剂之间的‘紧邻’将取决于使用的特定荧光团和猝灭剂并且可能取决于第一寡核苷酸的结构特征。因此,意在表示,应该根据所需结果而不是各种元件的任何特定结构布置来理解该术语。然而,并且仅为了提供例证,要指出的是,当相邻的荧光团或相邻的荧光团和猝灭剂被分开对应于特征距离(通常小于5nm)的距离时,通常将实现充分的猝灭。
适当地,第一寡核苷酸用至少1个、优选多至20个荧光团标记。为了获得最大的优势,优选的是,第一寡核苷酸被标记以至少2个、优选至少3个荧光团。因此,本文中特别地设想由这些最大值和最小值的任意排列构成的范围。如果使用猝灭剂,同样优选的是,第一寡核苷酸用多至20个,优选多至10个并且最优选多至5个猝灭剂标记。
就荧光团自身而言,它们原则上可以从本领域中常规使用的那些中的任一种中选择,其包括但不限于呫吨结构部分例如荧光素,罗丹明和它们的衍生物比如荧光素异硫氰酸酯,罗丹明B等;香豆素结构部分(例如羟基-、甲基-和氨基香豆素)和花青结构部分比如Cy2、Cy3、Cy5和Cy7。具体实例包括从以下常规使用的染料衍生的荧光团:Alexa染料、花青染料、Atto Tec染料和罗丹明染料。实例还包括:Atto 633(ATTO-TEC GmbH)、德克萨斯红TM(Texas RedTM)、Atto 740(ATTO-TEC GmbH)、Rose Bengal、Alexa FluorTM 750 C5-马来酰亚胺(Invitrogen),Alexa FluorTM 532C2-马来酰亚胺(Invitrogen)和罗丹明红C2-马来酰亚胺和罗丹明绿以及亚磷酰胺染料比如Quasar 570。备选地,可以使用量子点或近红外染料如由LI-COR Biosciences提供的那些。荧光团通常使用本领域已知的化学方法经核苷酸碱基连接于第一寡核苷酸。
合适的猝灭剂包括通过共振能量转移(FRET)机制起作用的那些。可商购的可以与以上提及的荧光团联合使用的猝灭剂的实例包括但不限于DDQ-1,Dabcyl,Eclipse,Iowa Black FQ和RQ,IR Dye-QC1,BHQ-0,BHQ-1、-2和-3以及QSY-7和-21。
在一个实施方案中,第二和第三寡核苷酸不用可检测元件标记。
步骤(2)适当地通过将所述流中的每个单三磷酸核苷与一种或多种上述探针系统在20至80℃范围内的温度接触而进行。
本发明的方法的步骤(2)的产物,如上文提及,是基本上双链的使用的探针,其组成链分别是第一寡核苷酸和互补的第四寡核苷酸,当以其5’-3’方向读取时,其包含第二寡核苷酸,然后是来源于单三磷酸核苷的核苷酸,并且最后是第三寡核苷酸。如果第二和第三寡核苷酸之前已经通过接头区连接在一起,那么容易明显可见,第四寡核苷酸将包含高度耐受核酸外切的封闭的环链。
在步骤(3)中,所使用的探针用酶在30-100℃范围内的温度处理。在该步骤中,在该过程中,来源于第一寡核苷酸的所使用的探针的链被消化成其组成核苷酸(一磷酸脱氧核糖核苷或一磷酸核糖核苷,可以根据具体情况而定),将可检测元件彼此分开,并且由此使得它们成为未被猝灭的并且因此是可检测的。因此,如果可检测元件是在第一寡核苷酸中已被猝灭成不可检测状态的荧光团,则步骤(3)将从彼此和任意的猝灭剂释放荧光团,由此使得它们发荧光。随着消化过程发生,由此观察者观察到荧光信号的快速增长,原因在于产生了单核苷酸级联。然后,该荧光的特征间接反映被相关的探针系统最初捕获的单三磷酸核苷的性质。
可以用于步骤(3)的酶包括外切核酸酶或表现出3’-5’核酸外切活性的聚合酶。这种种类的酶包括Q5,Q5热启动(Hot Start),Phusion,Phusion HS,Phusion II,Phusion II HS,DNA酶I(无RNA酶),外切核酸酶I或III(ex大肠杆菌(E.coli)),外切核酸酶T,外切核酸酶V(RecBCD),λ外切核酸酶,微球菌核酸酶,绿豆核酸酶(Mung Bean Nuclease),核酸酶BAL-31,RecJf,T5外切核酸酶和T7外切核酸酶。
在一个实施方案中,在步骤(3)的最后,将反应混合物在相对高和相对低的温度之间循环,以从第四寡核苷酸中去除任何来自第一寡核苷酸的留下的剩余的寡核苷酸片段并且允许新的第二和第三寡核苷酸退火。
在步骤(4)中,使现在以单链形式存在的第四寡核苷酸与另一个第一寡核苷酸分子杂交,由此产生新的基本上双链的寡核苷酸产物,该双链的寡核苷酸产物对应于,即,具有与使用的探针相同的化学和物理结构。然后,重复步骤(3)将该产物消化,由此释放处于可检测状态的其他可检测元件并且同样再次再生第四寡核苷酸。然后,按照步骤(5),允许步骤(3)和(4)以循环方式继续,使得来自游离的可检测元件的信号(例如,荧光信号)进一步富集;原则上,直到已经消耗基本上全部的第一寡核苷酸。结果,观察者观察到比之前获得的大得多的荧光信号富集。
然后,并且在步骤(6)中,检测在步骤(3)的多次重复中释放的可检测元件,并且确定与单三磷酸核苷连接的核苷酸碱基的性质。通过对在步骤(1)中产生的流中的所有单三磷酸核苷有条理地进行本发明的方法,可以产生并分析特征为原始核酸分析物的序列的数据。这样做的方法是本领域中公知的;例如荧光可以使用调至各种荧光团的特征荧光波长或波长封套的光检测器或等效装置来检测。这相应导致光检测器产生可以使用已知的算法在计算机中处理和分析的特征性电信号。在一个实施方案中,允许在步骤(5)与(6)之间经过一段时间,以确保处于可检测状态的可检测元件的数量已经增加至最大值。
在一个尤其优选的实施方案中,本发明的方法完全或部分以微滴流进行,至少它们中的一些包含单三磷酸核苷;适当地是有序的流。这种方法可以例如始于将步骤(1)中产生的三磷酸核苷逐一插入到维持在可混溶的载体溶剂(如烃或硅油)中的含水微滴的相应的流中以帮助保持排序。有利地,这可以通过在焦磷酸解反应区的下游直接产生微滴而实现;例如,通过使得反应介质从合适尺寸的微滴头出来到流动的溶剂流中。备选地,可以有规则且顺序地将来自步骤(1)的小等分试样的反应介质注射入溶剂中悬浮的已存在的含水微滴流中。如果采用后一方式,各微滴可以适当地含有一个或多个探针系统的各种组分连同实现步骤(2)至(5)所需的酶和任何其他试剂(例如缓冲剂)。在另一种方法中,可以使得在前一实施方案中产生的微滴随后与这种已存在的微滴流合并,从而实现类似的结果。在这些微滴方法中,步骤(6)则优选包括检查各小滴以鉴定释放的可检测元件并且因此鉴定其原始包含的三磷酸核苷的性质。
为了避免给定微滴包含多于一种三磷酸核苷的风险,优选在步骤(1)中以使得各填充的微滴间隔以1至20个、优选2至10个空微滴的速率释放每个三磷酸核苷。之后,使得溶剂中填充和未填充的微滴的流沿流动路径(适当地为微流体流动路径),以使得微滴保持离散状态并且没有机会彼此合并的速率和方式流动。适当地,使用的微滴具有小于100微米,优选小于50微米,更优选地小于20微米,并且甚至更优选小于15微米的有限的直径。所有其直径中,最优选的是在2至20微米范围内。在一个实施方案中,微滴经过整个系统的流速在50至3000个微滴/秒的范围内,优选为100至2000个微滴/秒。
按照本发明的第二方面,提供一种探针系统,其特征在于,所述探针系统包括:(a)第一单链寡核苷酸,其用一种或多种处于不可检测状态的荧光团标记,和(b)第二和第三未标记的单链寡核苷酸,它们能够分别杂交到第一寡核苷酸上的互补的3’侧和5’侧的侧翼区,它们并置在单核苷酸捕获区的每一侧,第二寡核苷酸的长度比所述3’侧的侧翼区长至少一个核苷酸。
在本发明的第一方面的第一实施方案中,第二和第三寡核苷酸通过接头区连接,所述接头区通常是单链或双链寡核苷酸区。在另一个实施方案中,在第一寡核苷酸的3’端的核苷酸是与在第二寡核苷酸中的相对应的核苷酸的错配。在另一个实施方案中,第三寡核苷酸在其3’端包含耐受核酸外切降解的元件。在本发明的另一个实施方案中,荧光团位于第一寡核苷酸的5’侧翼区,所述第一寡核苷酸也可以包含猝灭剂。
上文所述的方法和探针系统可以有利地用于在测序装置中,并且考虑所述装置在本发明的范围之内。
现在将参考以下实施例以多个方面说明本发明。
实施例1-探针系统的制备和使用
制备单链的第一寡核苷酸1,其具有下述核苷酸序列:
5′TCGTGCCTCATCGAACATGACGAGGXXQXXGGTTTGTGGT3′
其中A,C,G和T表示携带DNA的相关特征性核苷酸碱基的核苷酸;X表示使用常规的胺连接化学用Atto 655染料标记的脱氧胸苷核苷酸(T),并且Q表示用BHQ-2猝灭剂标记的脱氧胸苷核苷酸。其还包含捕获区(A核苷酸),所述捕获区对捕获三磷酸脱氧核苷酸(dNTPs)混合物中的三磷酸脱氧胸苷核苷酸(dTTPs)具有选择性。
还制备另一种单链的寡核苷酸2,其包含:(1)第二寡核苷酸区,其具有与第一寡核苷酸的3’端互补且具有单个碱基错配的序列;(2)第三寡核苷酸区,其具有与第一寡核苷酸的5’端互补的序列,和(3)一个76个碱基对的单链接头区。其具有下述核苷酸序列:
5′PCATGTTCGATGAGGCACGATAGATGTACGCTTTGACATACGCTTTGACAATACTTGAGCAGTCGGCAGATATAGGATGTTGCAAGCTCCGTGAGTCCCACAAACCAAAAACCTCG3′
其中,另外地,P表示5’磷酸基团。
然后制备包含探针系统的反应混合物。其具有与来源于下述配方的组成相对应的组成:
56uL 5x缓冲液,pH 7.5
28uL寡核苷酸1,100nM
28uL寡核苷酸2,10nM
2.8uL dNTPs(包括dTTP)的混合物,10nM
0.4U Phusion II热启动聚合酶(外切核酸酶)
1.6U Bst大片段聚合酶
20U大肠杆菌连接酶
4U热稳定性无机焦磷酸酶
加水至280uL
其中5x缓冲液包含下述混合物:
200uL三(羟甲基)氨基甲烷盐酸盐(Trizma hydrochloride),1M,pH 7.5
13.75uL MgCl2水溶液,1M
2.5uL二硫苏糖醇,1M
50uL Triton X-100表面活性剂(10%)
20uL烟酰胺腺嘌呤二核苷酸,100uM
166.67uL KCl
加水至1mL
然后,通过将混合物在37℃温育50分钟,然后将温度升高至70℃再温育50分钟而进行dTTPs的捕获和寡核苷酸2与寡核苷酸1连接形成闭环的使用的探针。然后,将反应混合物用Helium-Neon激光器的633nm光线照射,并且在使用的探针的核酸外切与再生的循环开始时,使用摄像机检测产生的Atto 655染料的特征性荧光。
监测在存在和不存在反应混合物的dNTP成分的条件下的荧光强度随时间的增长,并且将结果图示在图1中。由其可以看出,所述探针系统有效地捕获dTTPs,并且本发明的方法的循环性质导致荧光信号的快速增长。相反,在不存在dNTPs的比较实验中,寡核苷酸1上的Atto 655染料没有表现出任何明显程度的荧光。
实施例2-使用探针系统的小滴微流体方法
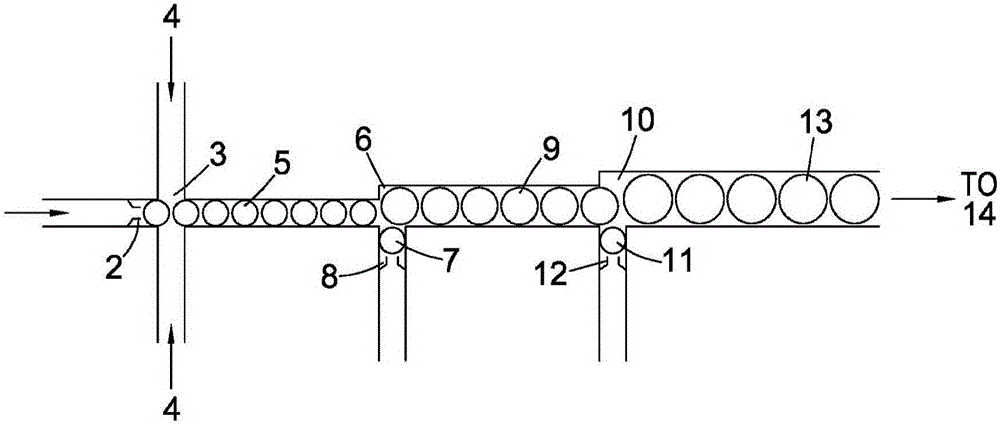
图2示意性显示微流体测序装置,其中使得分别包含单核苷酸碱基的多个微滴与上文所述的上述类型的探针系统进行反应。
使得包含通过对源于人DNA的100个核苷酸碱基的多核苷酸分析物进行逐步焦磷酸解获得的单三磷酸核苷酸流的水性介质1流过由PDMS聚合物制成的十微米直径的微流体管。焦磷酸解反应自身通过以下方式进行:在72℃,使含有Taq Pol和具有2毫摩尔/升浓度的焦磷酸钠和氯化镁中的每种的溶液的水性缓冲的(pH 7.5)反应介质流通过之前已经通过琥珀酰基桥将分析物连接于其上的玻璃微珠。微珠下游的1中单核苷酸的顺序对应于分析物的序列。1从小滴头2中出来进入第一室3,在那里,其与一个以上不可混溶的轻硅油流4接触。选择这些流的速度以避免湍流混合并且用以产生悬浮在油中的水性球形小滴5,其各自具有大约八微米的直径。通常,调节速率以使得在相邻的填充的小滴之间有10个空的小滴。随后,使5的流沿具有相同直径的第二微流体管前进至第二室6,第二个五微米水性球形小滴7的流通过第二小滴头8也进入第二室6中。使得小滴5和7以连续的方式合并,从而形成直径约九微米的放大的水性小滴9。7中的每个含有焦磷酸酶用以破坏存在于每个5中的任何残留的焦磷酸根阴离子。
然后9的流以相同速率前进,通过微流体管道,进入第三室10,在那里,这些小滴与通过相应小滴头12同样进入其中的第三个五微米水性球形小滴11的流相接触。9中的每个在室6和10之间移动所需的时间为大约2分钟。
随后使得小滴9和11在10中合并,从而产生小滴13(直径大约十微米)。11中的每个包含嗜温连接酶(表现出3’-5’双链外切核酸酶活性的嗜热聚合酶)和包含四对与实施例1中所述的那些相似的单链寡核苷酸的探针系统。每种第一寡核苷酸是40个核苷酸长,并且具有特征为DNA的四种特征性核苷酸碱基类型(即A,T,G和C)的不同的第20个核苷酸(从5’端测量)。每种第一寡核苷酸还用彼此紧邻的多种荧光团和猝灭剂标记,以使得在它们结合在一起的状态下,它们基本上不发荧光,并且当被释放时,它们在它们所来源的第一寡核苷酸特有的波长发荧光。所述四种不同的第二寡核苷酸各自的长度为115个核苷酸碱基,在其两端具有与第一寡核苷酸的第20个碱基侧连的区域互补的不同的终止序列,并且具有常见的76个碱基对的接头区。
然后,使这样形成的合并的微滴13的流在37℃温育30分钟,然后在70℃温育30分钟。在这一时间结束时,将13转移到检测系统14中。
检测系统(未显示)通常包括其中用来自激光器的入射光检查每个小滴的检测窗口。然后,该光的作用使每个小滴中的释放的荧光团以原始结合在捕获分子中的单核苷酸碱基特有的方式发荧光(或者,如果小滴原始是空的,则基本上完全没有荧光)。然后,在上文提及的四种荧光团的四种特征波长检测存在或不存在该荧光。由此,当小滴依次被检查时,可以有效地读取原始多核苷酸分析物中的核苷酸碱基的序列。
序列表
<110> 贝斯4创新公司
<120> 单核苷酸检测方法
<130> P61091WO
<150> GB1412977.9
<151> 2014-07-22
<160> 2
<170> PatentIn version 3.5
<210> 1
<211> 40
<212> DNA
<213> 人工序列
<220>
<223> 寡核苷酸1
<220>
<221> misc_feature
<222> (26)..(26)
<223> 用Atto 655染料标记的脱氧胸苷核苷酸(T)
<220>
<221> misc_feature
<222> (27)..(27)
<223> 用Atto 655染料标记的脱氧胸苷核苷酸(T)
<220>
<221> misc_feature
<222> (28)..(28)
<223> 用BHQ-2猝灭剂标记的脱氧胸苷核苷酸
<220>
<221> misc_feature
<222> (29)..(29)
<223> 用Atto 655染料标记的脱氧胸苷核苷酸(T)
<220>
<221> misc_feature
<222> (30)..(30)
<223> 用Atto 655染料标记的脱氧胸苷核苷酸(T)
<400> 1
tcgtgcctca tcgaacatga cgaggttttt ggtttgtggt 40
<210> 2
<211> 115
<212> DNA
<213> 人工序列
<220>
<223> 寡核苷酸2
<220>
<221> misc_feature
<222> (1)..(1)
<223> 连接到胞嘧啶的5'磷酸基团
<400> 2
catgttcgat gaggcacgat agatgtacgc tttgacatac gctttgacaa tacttgagca 60
gtcggcagat ataggatgtt gcaagctccg tgagtcccac aaaccaaaaa cctcg 115
- 还没有人留言评论。精彩留言会获得点赞!
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 一种单核苷酸多态性位点在辅助鉴定大豆花叶病毒抗性中的应用的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 一种判定中国人群rs125055单核苷酸多态性与儿童IBD之间的相关性的方法与制造工艺
- 黄牛ADNCR基因单核苷酸多态性的四引物扩增受阻突变体系PCR检测方法及其应用与制造工艺
- 使用PNA探针的熔解曲线分析、使用熔解曲线分析用于分析核苷酸多态性的方法和试剂盒与制造工艺
- 人KRAS中单核苷酸多态性的检测的制造方法与工艺
- 一种InDel位点基因型分型的方法与制造工艺
- 单核苷酸多态性rs145562243在筛查麻风患者中的应用的制造方法与工艺
- 基于DNA酶嵌合引物的核酸筛查生物传感器的制造方法与工艺
- 一种奶山羊产羔性状相关基因单核苷酸多态性的检测方法与流程
- ALDH2基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- CYP2C9*3基因多态性快速检测的引物、分子信标、试剂盒及其检测方法与流程
- 一种单核苷酸多态性位点在辅助鉴定大豆花叶病毒抗性中的应用的制造方法与工艺
- DHFR基因多态性检测体系及其试剂盒的制造方法与工艺
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 烟酰胺单核苷酸在制备防治动脉硬化、心脑血管疾病的药物中的应用及其药物的制造方法与工艺
- 一种判定中国人群rs125055单核苷酸多态性与儿童IBD之间的相关性的方法与制造工艺
- 预测氨基酸突变的方法及系统与制造工艺
- 一种用于评估皮肤防御情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤防晒情况的引物和探针及试剂盒的制作方法
- 一种用于评估皮肤抗皱情况的引物和探针及试剂盒的制作方法
- 人PLIN1基因rs2289487位点多态性检测方法及试剂盒的制作方法
- 测定人NEFM基因rs12515位点多态性的方法及试剂盒的制作方法
- 一种人TERF1基因rs3863242位点多态性检测技术的制作方法
- 测定人CCNH基因rs3093816位点多态性的方法及试剂盒的制作方法
- 测定人NEFL基因rs2979704位点多态性的方法及试剂盒的制作方法
- 测定人PON1基因rs854560位点多态性的方法及试剂盒的制作方法
- 测定人PON1基因rs662位点多态性的方法及试剂盒的制作方法