一种用于纯化TNFR‑Fc融合蛋白的方法与流程
本发明涉及TNFR-Fc融合蛋白的纯化,特别是减少TNFR-Fc融合蛋白中的宿主细胞蛋白(HCP)。本发明针对的是使用混合式层析和/或亲和层析以得到TNFR:Fc融合蛋白,该TNFR:Fc融合蛋白基本上不含有HCP中的至少一种蛋白质降解酶。
背景技术:
蛋白质在生物药物中非常重要,它们可用于治疗多种疾病,包括糖尿病(例如胰岛素)、癌症(例如干扰素、单克隆抗体)、心脏病、中风、囊性纤维化(例如酶、血液因子)、炎症(例如肿瘤坏死因子)、贫血(例如红细胞生成素)、血友病(例如凝血因子)等。开发有效的、可大规模纯化蛋白质的方法是目前重要的挑战之一。许多方法可用于从收获细胞培养液(HCCF)中大规模纯化目标蛋白质,但是仍有部分杂质保留在经纯化的目标蛋白质中,这对目标蛋白质的质量和其长期稳定性是有害的。可使用一系列层析技术和超滤/渗滤技术从HCCF中纯化目标蛋白质。
虽然已经开发了许多方法以从HCCF中纯化TNFR:Fc融合蛋白,但是由于细胞表达系统的变异性,在通常情况下,一般的纯化方法不能在工艺相关杂质中对目标蛋白质进行充分地纯化。在细胞培养或发酵期间由宿主细胞产生的目标蛋白必须从宿主细胞衍生蛋白(HCP)、宿主细胞DNA、过程添加剂、外来因子、毒素和某些产品相关物质中纯化出来。在经纯化的目标蛋白质中不期望存在这些杂质,并且这些杂质的水平需要保持在可接受的水平内,以使产物安全,可用于人类治疗(Wang et.al.2009Jun 15Biotechnol Bioengineering103(3):446-58)。
肿瘤坏死因子(TNF)是一种有效的细胞因子并且可引发广谱的生物反应,其通过结合细胞表面受体介导,参与许多炎症的发病机理,例如类风湿性关节炎、银屑病关节炎、SLE、克罗恩病等(Hohmannet.al.1989J Biol Chem.25,14927-34)。生物制剂对TNF-α的直接抑制已经在类风湿性关节炎治疗中有显著的进展,并已证实该促炎细胞因子的细胞外抑制可作为有效的治疗手段。重组TNFR:Fc融合蛋白结合细胞因子TNF并阻断TNF的活性。TNF抑制剂的实例包括TNFR:Fc融合蛋白(依那西普)和抗TNF单克隆抗体(Adalimumab、Infliximab、Golimumab和Certolizumabpegol)。
依那西普(Etanercept)是二聚体融合蛋白,由与人IgG1的Fc片段连接的人75kDa(p75)肿瘤坏死因子受体(TNFR,II型)的细胞外配体结合部分组成。依那西普的Fc组分由CH2结构域、CH3结构域和铰链区组成,不存在CH1结构域(US 7648702)。它通过重组DNA技术在中国仓鼠卵巢哺乳动物细胞(CHO)中产生。它由934个氨基酸组成,并且具有约130kDa的表观分子量。比起其内源性受体,由于依那西普独特的结构,其更能有效地结合TNFα(Gofeeetet.al.2003J Am AcadDermatol.49,S105-111,Strober 2005SeminCutan Med Surg.24;28-36)。
US7294481公开了依次通过蛋白A层析和疏水作用层析对TNFR:Fc蛋白进行纯化。
EP2729482A1公开了依次通过蛋白A层析、阳离子交换层析和阴离子交换层析对融合蛋白进行纯化。
WO2004076485教导了依次通过蛋白A层析、阴离子交换层析和阳离子交换层析对抗体进行纯化。
WO2013176754公开了一种通过在流动模式下的疏水作用层析(HIC)减少蛋白质中的至少一种工艺相关杂质和/或产品相关杂质的方法。
技术实现要素:
一实施方式中,本发明涉及一种通过混合式层析以流动模式(flow-through mode)纯化TNFR-Fc融合蛋白的方法。
另一实施方式中,本发明涉及一种通过以流动模式进行的混合式层析减少TNFR-Fc融合蛋白中的HCP的方法。
另一实施方式中,本发明涉及一种通过层析工艺减少HCP的方法,该层析工艺包括蛋白A层析和混合式层析。
另一实施方式中,本发明涉及一种依次通过蛋白A层析、疏水作用层析(HIC)、阴离子交换层析和混合式层析减少TNFR-Fc融合蛋白中的HCP的方法。
另一实施方式中,本发明涉及一种减少HCP、聚集物(aggregates)和错折叠物(misfolds)的方法,通过尺寸排阻-高效液相色谱法(SE-HPLC)得到基本上纯的(99%纯度)TNFR:Fc融合蛋白,通过疏水作用-高效液相色谱法(HI-HPLC)得到纯度大于80%的TNFR:Fc融合蛋白。
另一实施方式中,本发明涉及使用混合式层析得到TNFR:Fc融合蛋白,该TNFR:Fc融合蛋白基本上不含有HCP中的至少一种蛋白质降解酶。
另一实施方式中,本发明涉及一种从含有TNFR:Fc融合蛋白和HCP杂质的蛋白质混合物中纯化蛋白质的方法,包括以下步骤:
(a)从适当的哺乳动物表达系统中获取蛋白质混合物,所述哺乳动物表达系统含有TNFR:Fc融合蛋白和宿主细胞蛋白(HCP)杂质,所述宿主细胞蛋白杂质包括至少一种蛋白质降解酶;
(b)将所述蛋白质混合物施于亲和层析柱上;
(c)从所述亲和层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第二蛋白质混合物中,所述第二蛋白质混合物含有的HCP杂质量减少;
(d)将所述第二蛋白质混合物施于混合式层析柱上;
(e)从所述混合式层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白基本上不含有包括至少一种蛋白质降解酶的HCP杂质。
另一实施方式中,本发明涉及一种从含有TNFR:Fc融合蛋白和包括至少一种蛋白质降解酶的HCP杂质的蛋白质混合物中纯化TNFR:Fc融合蛋白的方法,包括以下步骤:
(a)从适当的哺乳动物表达系统中获取蛋白质混合物,所述哺乳动物表达系统含有TNFR:Fc融合蛋白和宿主细胞蛋白(HCP)杂质,所述宿主细胞蛋白杂质包括至少一种蛋白质降解酶;
(b)将所述蛋白质混合物施于亲和层析柱上;
(c)从所述亲和层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第二蛋白质混合物中,所述第二蛋白质混合物含有的HCP杂质量减少;
(d)将所述第二蛋白质混合物施于疏水作用层析柱上;
(e)从所述疏水作用层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第三蛋白质混合物中,所述第三蛋白质混合物含有的HCP杂质量减少;
(f)将所述第三蛋白质混合物施于混合式层析柱上;
(g)从所述混合式层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白基本上不含有包括至少一种蛋白质降解酶的HCP杂质。
另一实施方式中,本发明涉及一种从含有TNFR:Fc融合蛋白和包括至少一种蛋白质降解酶的HCP杂质的蛋白质混合物中纯化蛋白质的方法,包括以下步骤:
(a)从适当的哺乳动物表达系统中获取蛋白质混合物,所述哺乳动物表达系统含有TNFR:Fc融合蛋白和宿主细胞蛋白(HCP)杂质,所述宿主细胞蛋白杂质包括至少一种蛋白质降解酶;
(b)将所述蛋白质混合物施于亲和层析柱上;
(c)从所述亲和层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第二蛋白质混合物中,所述第二蛋白质混合物含有的HCP杂质量减少;
(d)将所述第二蛋白质混合物施于疏水作用层析柱上;
(e)从所述疏水作用层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第三蛋白质混合物中,所述第三蛋白质混合物含有的HCP杂质量减少;
(f)将所述第三蛋白质混合物施于阴离子交换层析柱上;
(g)从所述阴离子交换层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第四蛋白质混合物中,所述第四蛋白质混合物含有的HCP杂质量减少;
(h)将所述第四蛋白质混合物施于混合式层析柱上;
(i)从所述混合式层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白基本上不含有包括至少一种蛋白质降解酶的HCP杂质。
另一实施方式中,本发明涉及一种通过混合柱层析从蛋白质混合物中纯化TNFR:Fc融合蛋白的方法,该混合柱层析在亲和柱层析后的任一步骤中进行。
另一实施方式中,本发明涉及一种从含有TNFR:Fc融合蛋白和HCP杂质的蛋白质混合物中纯化TNFR:Fc融合蛋白的方法,包括以下步骤:
(a)从适当的哺乳动物表达系统中获取蛋白质混合物,所述哺乳动物表达系统含有TNFR:Fc融合蛋白和宿主细胞蛋白(HCP)杂质,所述宿主细胞蛋白杂质包括至少一种蛋白质降解酶;
(b)将所述蛋白质混合物施于亲和层析柱上;
(c)将亲和层析柱进行多次洗脱;
(d)从所述亲和层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白含有的HCP杂质量相对于未对亲和层析柱进行多次洗脱的方法更少。
另一实施方式中,本发明至少可减少90%的HCP杂质,该HCP杂质含有至少一种蛋白质降解酶。优选地,减少99%。更优选地,减少至可接受的极限。
另一实施方式中,本发明基本上除去包括至少一种蛋白质降解酶的HCP杂质并稳定TNFR:Fc融合蛋白至少两周。优选地,稳定至少一个月。更优选地,稳定至少6个月。最优选地,稳定至少一年。
另一实施方式中,本发明涉及一种通过混合式层析以流动模式进行纯化TNFR:Fc融合蛋白的方法。
附图说明
为更清楚地阐述本发明的特征和优点,下面结合附图与具体实施例来对其进行详细说明。
图1(A)所示的明胶酶谱显示存在于蛋白A洗脱液的蛋白酶活性,其中在蛋白A层析过程中无中间洗脱步骤。
图1(B)所示的明胶酶谱显示不存在于蛋白A洗脱液的蛋白酶活性,其中在蛋白A层析过程中有中间洗脱步骤。
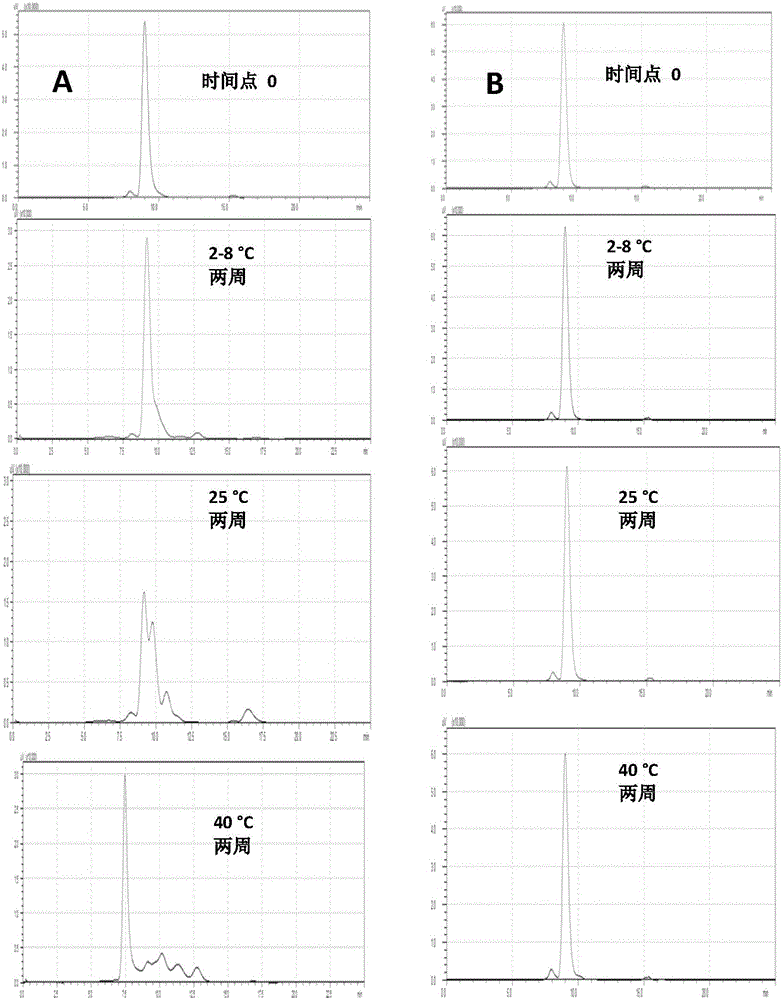
图2(A)所示为通过下游纯化的尺寸排阻-高效液相色谱法对蛋白酶加速降解进行分析,其中未使用混合式层析进行精纯。
图2(B)所示为通过下游纯化的尺寸排阻-高效液相色谱法对蛋白酶加速降解进行分析,其中使用混合式层析进行精纯。
图3示出了加速稳定性、酶谱和ELISA在HCP检测中的灵敏度的比较。
具体实施方式
本发明涉及一种从收获的细胞培养液(HCCF)中纯化TNFR:Fc融合蛋白的方法,该收获的细胞培养液由补料分批(fed-batch)和/或灌注(perfusion)技术获得。
本发明涉及使用混合式层析得到TNFR:Fc融合蛋白,该TNFR:Fc融合蛋白基本上不含有HCP中的至少一种蛋白质降解酶。
本发明涉及一种通过中间层析工艺从目标蛋白质中减少杂质的方法,特别是减少HCP杂质,所述中间层析工艺包括蛋白A层析和混合式层析。HCP可减少90%,更优选地,HCP减少99%。优选地,HCP可减少至可接受的极限。
HCP可以在低至百万分之100(ppm)的水平引起患者的免疫反应。在药物物质和药物产品中,通常会存在少量HCP,因为HCP难以通过常规纯化方法完全消除。本领域花费了大量的努力和成本来尽可能多地去除HCP。
如本文所用,术语“宿主细胞蛋白(HCP)”包括蛋白质降解酶,其是蛋白酶也是来自宿主细胞和其它非目标蛋白相关的蛋白质杂质。当一种或多种HCP是蛋白酶时,由于它可以水解(降解)目标蛋白质,因此HCP的清除率甚为重要。蛋白酶的存在,即使是非常低水平的蛋白酶,会损害目标蛋白质的长期稳定性。除了蛋白质降解酶,HCP还含有其他杂质,包括但不限于聚集物、错折叠的蛋白质和片段。
任何蛋白A层析树脂当用于捕获TNFR:Fc融合蛋白和其他单克隆抗体时,可以清除大部分来自HCCF的杂质,但是少量的包括一种或多种蛋白酶的HCPs由于与蛋白A树脂可以非特异性结合,因此仍可以与目标蛋白共洗脱,例如基质金属蛋白酶(优选明胶酶)。痕量的蛋白酶在经蛋白A层析后仍然存在,不同层析步骤的组合有助于进一步除去痕量的蛋白酶。
如本文所用,术语“结合洗脱模式(bind-elute mode)”是指通过层析法进行纯化的模式,其中,将目标蛋白质装载在柱上,与层析树脂结合,随后用洗脱缓冲液洗脱。
如本文所用,术语“流动模式(flow-through mode)”是指通过层析法进行纯化的模式,其中,高分子量杂质、HCP和内毒素装载结合到层析树脂上,目标蛋白质在流动中跑出。
如本文所使用的,术语“融合蛋白”包括但不限于依那西普、阿巴西普(abatacept)、阿法赛特(alefacept)、利培酮(rilonacept)、贝拉西普(belatacept)和阿柏西普(aflibercept)。
如本文所用,术语“TNFR”是生物活性糖蛋白,其全部或部分包含属于TNF受体家族的蛋白质的细胞外可溶性片段。TNF受体家族的实例包括肿瘤坏死因子受体I(TNFRI)、肿瘤坏死因子受体II(TNFRII)、OX40抗原、CD40L受体和FASL受体。TNFR1由人55kDa(p55)的细胞外配体结合部分组成,TNFRII由人75kDa(p75)的细胞外配体结合部分组成。
如本文所用,术语“约”旨在表示大于或小于参考值10%-20%的范围。在某些情况下,本领域技术人员可知,由于参考值的性质,术语“约”可以意味着该值10%-20%的偏差。
如本文所用,“病毒减少/灭活”意指特定样品中病毒颗粒数量的减少,以及活性降低,例如包括但不限于特定样品中病毒颗粒的感染性或复制能力(失活)。病毒颗粒的数量和/或活性的降低可以是约1%至约99%,优选约20%至约99%,更优选约30%至约99%,更优选约40%至约99%,甚至更优选约50%至约99%,甚至更优选约60%至约99%,还更优选约70%至约99%,还更优选约80%至99%,还更优选约90%至约99%。
如本文所用,术语“聚集体”是指两个或多个单分子的聚集或低聚,包括但不限于蛋白质二聚体、三聚体、四聚体、寡聚体和其它高分子量物质。蛋白质聚集体可以是可溶的或不可溶的。
术语“蛋白质降解酶”是指衍生自宿主细胞蛋白质并降解目标蛋白质的杂质。“蛋白质降解酶”包括但不限于蛋白酶、基质金属蛋白酶、明胶酶。
术语“中国仓鼠卵巢细胞蛋白”和“CHOP”可互换使用,是指来源于中国仓鼠卵巢(CHO)细胞培养物的宿主细胞蛋白(HCP)的混合物。HCP或CHOP通常作为杂质存在于细胞培养基或裂解物中(例如收获细胞培养液,该培养液包含在CHO细胞中表达的TNFR:Fc融合蛋白)。在包含目标蛋白质的混合物中的CHOP的量可用于测量目标蛋白质的纯度。HCP或CHOP包括但不限于由宿主细胞表达的目标蛋白质,例如CHO宿主细胞。通常,蛋白质混合物中CHOP的量以相对于混合物中目标蛋白质的量的百万分之一表示。
如本文所用,术语“线性梯度”指使用至少两种不同pH和/或不同电导率的缓冲液逐渐增加或降低pH值和/或电导率的条件。
如本文所用,术语“梯度洗脱”指使用至少两种不同pH和/或不同电导率的缓冲液增加或降低pH值和/或电导率的条件。
本文使用的术语“纯化”、“分离”和“分开”可互换,指从包含多肽和一种或多种杂质或污染物(包括至少一种蛋白质降解酶)的蛋白质混合物中提高多肽或目标蛋白质的纯度。通常,通过从组合物中除去(完全地或部分地除去)至少一种杂质来提高目标蛋白质的纯度。
“纯化步骤”或“单元操作”可以是产生“均匀”组合物或样品的总体纯化方法的一部分,在本文中,“均匀”组合物或样品指包含目标蛋白质的组合物,且其HCP含量小于1000ppm,或者小于900ppm、小于800ppm、小于700ppm、小于600ppm。本文使用的术语“纯化”、“分离”和“分开”可互换,指从包含多肽和一种或多种杂质或污染物的组合物或样品中提高多肽或目标蛋白质的纯度。
通常,通过从组合物中除去(完全地或部分地除去)至少一种杂质来提高目标蛋白质的纯度。目标蛋白的纯度至少为50%、60%、70%、80%、90%、95%或99%。
如本文所用,术语“蛋白质混合物”是指从本发明中采用的一个或多个层析步骤获得的洗脱组合物。根据所使用的层析柱和杂质范围(例如不完全含Fc的蛋白质片段、聚集体、宿主细胞蛋白质(HCP)和可能存在于蛋白质混合物中的蛋白质降解酶),术语“蛋白质混合物”在本发明中进一步定义为“第一蛋白质混合物”、“第二蛋白质混合物”、“第三蛋白质混合物”、“第四蛋白混合物”和“第五蛋白混合物”。然而,根据纯化策略中层析柱的变动或移除,术语“第一蛋白质混合物”、“第二蛋白质混合物”、“第三蛋白质混合物”、“第四蛋白混合物”和“第五蛋白混合物”可以互换。
在一实施方式中,TNFR:Fc融合蛋白为依那西普(Etanercept)。依那西普等电点为4.8-5.2。
在一实施方式中,收获的细胞培养液(HCCF)来自合适的哺乳类系统,优选CHO细胞培养。可以通过离心和/或过滤技术净化HCCF。使用0.2微米过滤器得到净化的HCCF,还可以通过本发明中描述的层析技术进一步纯化。
在一实施方式中,本发明涉及一种通过混合式层析纯化TNFR:Fc融合蛋白的工艺。在一具体实施方式中,该工艺采用至少一个亲和层析步骤,优选地,采用蛋白A层析和至少一个混合式层析步骤。
在一实施方式中,该工艺采取至少一个亲和层析步骤、至少一个混合式层析步骤和至少一个或多个附加的层析步骤。所述附加的层析步骤选自离子交换层析(优选阴离子交换)和疏水作用层析(HIC)。
在一实施方式中,亲和层析柱选自蛋白A树脂、蛋白G树脂,优选蛋白A树脂。蛋白A树脂层析柱选自MabSelect Sure LX、MabSelectSuRe、MabSelectXtra、ProSep Ultra Plus和Toyopearl AF-rProtein A HC-650F。
在一实施方式中,亲和层析步骤包括:净化来自合适的哺乳类系统收获的细胞培养液(HCCF)。在上样至亲和层析柱前,用2M的tris碱将HCCF的pH值调节至大约8-9,优选pH值为8.5。上样前,用合适的缓冲液对蛋白A层析柱进行平衡。合适的缓冲液选自Tris-Cl缓冲液、HEPES、三乙醇胺、硼酸盐、甘氨酸-氢氧化钠。优选Tris-Cl缓冲液,其中pH约为8-9,优选pH 8.5;电导率为约10-30mS/cm,优选为约18mS/cm。Tris-Cl缓冲液的浓度为约30-60mM,优选50mM的tris-Cl,tris-Cl含有约120-150mM的添加剂。添加剂优选150mM的NaCl和约2-6mM的EDTA,优选5mM的EDTA。使用至少1个柱体积(column volume)的合适的缓冲液平衡蛋白A层析柱,优选2个柱体积的缓冲液。将经过pH调节的蛋白质混合物上样至蛋白A层析柱上,该蛋白质混合物包括目标蛋白质和含有至少一种蛋白质降解酶的HCP。流速可选自约50-300cm/hr,优选为100cm/hr。上样至蛋白A层析柱上后,用平衡缓冲液或不同的缓冲液对柱子进行洗脱一次或多次。蛋白A层析柱首先用至少2个柱体积的平衡缓冲液洗脱,然后可选地再进行一次或多次的洗脱。在一优选的实施方式中,蛋白A层析柱首先用至少2个柱体积的平衡缓冲液洗脱,然后再用洗脱缓冲液A进行中间洗脱,该洗脱缓冲液A包括以下添加剂的至少一种:尿素、吐温80、异丙醇、NaCl和EDTA。缓冲液选自Tris–Cl、HEPES、三乙醇胺、硼酸盐、甘氨酸-氢氧化钠。优选Tris-Cl缓冲液,其中pH约为8-9,优选pH8.5;电导率为约50-75mS/cm,优选为约65mS/cm,用量为1个柱体积以上,优选为3个柱体积,更优选为6个柱体积。洗脱缓冲液A的浓度为约30-60mM,优选50mM的tris-Cl,tris-Cl含有约1-2M的尿素。添加剂优选1.5M的尿素、约1.5%的吐温80EDTA、约7.5%异丙醇、约0.5-2M NaCl,优选为1M的NaCl和约2-6mM的EDTA,优选5mM的EDTA。
经洗脱缓冲液A处理后,蛋白A层析柱进一步由洗脱缓冲液B进行中间洗脱,该洗脱缓冲液B包括柠檬酸钠二水合物、醋酸盐、甘氨酸-盐酸,优选柠檬酸钠二水合物,其中pH值为约pH 4-5,优选pH 4.5;电导率为约8-25mS/cm,优选为约12mS/cm,用量为至少1个柱体积。洗脱缓冲液B的浓度为约30-60mM,优选50mM的柠檬酸钠二水合物。经洗脱缓冲液B处理后,蛋白A层析柱进一步由洗脱缓冲液C进行中间洗脱,该洗脱缓冲液C包括90%的洗脱缓冲液B和10%的洗脱缓冲液。洗脱缓冲液C的pH值约为4。
蛋白A层析柱可以通过合适的缓冲液进行洗脱。洗脱缓冲液可以为一种或多种缓冲液的混合。蛋白质通过线性梯度洗脱和分级梯度洗脱结合,除去氧化杂质。线性梯度由pH值为2-3.5的洗脱缓冲液和pH值为4-5的洗脱缓冲液通过合适地配比使用来实现。
线性梯度通过使用0-100%的洗脱缓冲液来实现。优选地,使用一个柱体积以上的10%-90%的洗脱液。优选地,线性梯度通过使用10%-90%的洗脱缓冲液B来实现,用量为1个柱体积以上,优选为3个柱体积以上,更优选为6个柱体积。分级梯度通过使用包括柠檬酸钠二水合物的洗脱缓冲液来实现,该缓冲液pH值约为2-3.5,优选为pH 3;电导率为约5-15mS/cm,优选为约12mS/cm。柠檬酸钠二水合物的浓度为约30-60mM,优选50mM。收集的组分为第二蛋白质混合物,可选地进行降低pH值处理。
在一实施方式中,本发明可只进行蛋白A柱层析。然而,洗脱的TNFR:Fc融合蛋白的纯度取决于一个或多个洗脱步骤,并且移除或减少洗脱步骤都增加蛋白质降解酶的浓度。
在另一实施方式中,本发明涉及一种从含有TNFR:Fc融合蛋白和HCP杂质的蛋白质混合物中纯化TNFR:Fc融合蛋白的方法,包括以下步骤:
(a)从适当的哺乳动物表达系统中获取蛋白质混合物,所述哺乳动物表达系统含有TNFR:Fc融合蛋白和宿主细胞蛋白(HCP)杂质,所述宿主细胞蛋白杂质包括至少一种蛋白质降解酶;
(b)将所述蛋白质混合物施于亲和层析柱上;
(c)对所述亲和层析柱进行多次洗脱;
(d)从所述亲和层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白含有的HCP杂质量相对于未对亲和层析柱进行多次洗脱的方法更少。
在一实施方式中,在低pH条件下可进行病毒灭活处理。由亲和层析(第二蛋白质混合物)得到的洗脱液的pH约为2-5,优选pH 3.5。pH值可以通过合适的酸进行调节,合适的酸包括但不限于柠檬酸、乙酸、辛酸。如果pH值小于3.5,则用2M的tris碱调节至3.5。pH值适当地达到3.5,然后将蛋白质混合物在室温下培养至少10分钟,优选45分钟。病毒灭活后,用2M的Tris碱将溶液的pH值调至约6.5。用经降低pH处理的组分和杂质分布图制备“人工池”,并且优选地通过蛋白A HPLC检测氧化物质。
在一实施方式中,本发明体现了将疏水作用层析(HIC)工艺用于从混合物中纯化TNFR:Fc融合蛋白,该混合物包括目标蛋白质和含有至少一种蛋白质降解酶的HCP。
第二蛋白质混合物可以进行疏水作用柱层析,该第二蛋白质混合物从亲和层析柱或任选地经降低pH值处理之后获得。从HIC柱获得的洗脱液可以称为第三蛋白质混合物,该第三蛋白质混合物的具有较低水平的HCP和蛋白质降解酶。
在一实施方式中,疏水作用层析选自Toyopearl丁基-650M树脂、Toyopearl苯基-650、丁基琼脂糖凝胶6FF、苯基琼脂糖凝胶6FF(高分辨率)。
在一实施方式中,第二蛋白质混合物进行疏水作用柱层析,该第二蛋白质混合物从亲和层析柱或任选地经降低pH值处理之后获得。HIC在结合洗脱模式下进行。上样前,向第二蛋白质混合物中逐渐加入合适的高盐缓冲液,直至电导率达到约40-70mS/cm,优选50mS/cm。合适的高盐缓冲液选自以下盐的至少一种或任意组合:无水磷酸氢二钠、柠檬酸酸钠二水合物、组氨酸-HCl、咪唑、Bis-Tris、马来酸盐,优选无水磷酸氢二钠、柠檬酸酸钠二水合物,其中pH值为约6-7,优选pH 6.5;电导率为约50-80mS/cm,优选为约65mS/cm。高盐缓冲液的浓度选自0.01-1M的无水磷酸氢二钠,优选0.05M的无水磷酸氢二钠,和0.1-2M的柠檬酸酸钠二水合物,优选0.8M。上样前,用合适的缓冲液对HIC柱进行平衡。合适的平衡缓冲液选自用注射用水(WFI)稀释的高盐缓冲液。电导率达到约40-70mS/cm,优选50mS/cm。第二蛋白质混合物上样至HIC柱。流速为约50-300cm/hr,优选150cm/hr。
上样至HIC柱后,用平衡缓冲液或不同的缓冲液对柱子进行一次或多次洗脱。HIC柱用至少1个柱体积的平衡缓冲液洗脱,优选1.5个柱体积。然后可选地再进行一次或多次的洗脱。在一优选的实施方式中,HIC柱首先用至少1个柱体积的平衡缓冲液洗脱,优选1.5个柱体积,然后再用第二洗脱缓冲液进行中间洗脱,该第二洗脱缓冲液包括至少10%-25%的无水磷酸氢二钠,其中pH值约为6-7,优选pH 6.5;电导率为约5-10mS/cm,优选为约8mS/cm,无水磷酸氢二钠的浓度为约0.01-1M,优选0.05M。第二次洗脱时,缓冲液的用量为至少1个柱体积,优选为3个柱体积,更优选为6个柱体积,或其洗脱直至吸收稳定,或上述任一情况首先发生。HIC柱然后用一合适的缓冲液洗脱。该洗脱缓冲液可以为一种或多种缓冲液的混合。蛋白质通过提供40%-70%的分级梯度进行组合洗脱,优选65%的第二洗脱缓冲液和至少75%的第二洗脱缓冲液。收集经洗脱的蛋白质作为第三蛋白质混合物,并将收集的组分制备“人工池”,通过HI-HPLC检测错折叠物的百分含量(%),用ELISA检测HCP水平。
在一实施方式中,经HIC洗脱的蛋白质(第三蛋白质混合物)可选地通过30kDa截留膜和20mM的组氨酸-盐酸盐pH 5.5缓冲液进行透析过滤,用量为6个渗滤体积,或直到滞留物的pH和电导率分别达到小于5.8和3.0mS/cm。
在一实施方式中,本发明体现了通过阴离子交换层析(HIC)工艺从含有目标蛋白质和HCP杂质的蛋白质混合物中纯化TNFR:Fc融合蛋白的方法,HCP杂质含有至少一种蛋白质降解酶。
从HIC层析得到的第三蛋白质混合物可选地在通过透析过滤后,进行阴离子交换层析,得到的洗脱物称为第四蛋白质混合物,该第四蛋白质混合物的HCP和蛋白质降解酶水平降低。
在一实施方式中,阴离子交换层析选自DEAE琼脂糖凝胶FF、EMD DEAE(M)、Toyopearl DEAE-650、Toyopearl DEAE-650。
在一实施方式中,从HIC层析得到的第三蛋白质混合物可选地在通过透析过滤后,进行阴离子交换层析。阴离子交换在结合洗脱模式下进行。上样前,用合适的平衡缓冲液对阴离子交换柱进行平衡,合适的平衡缓冲液选自组氨酸盐酸盐、磷酸盐、柠檬酸盐,优选组氨酸盐酸盐,其中pH值选自4.5-6,优选pH 5.5;电导率为约1-10mS/cm,优选为约2mS/cm。组氨酸盐酸盐的浓度为约10-50mM,优选20mM。第三蛋白质混合物上样至阴离子交换柱。流速为约50-300cm/hr,优选150cm/hr。
上样至阴离子交换柱后,可以使用平衡缓冲液或不同的缓冲液对柱子进行洗脱一次或多次,用量为至少1个柱体积,优选2个柱体积。然后可任选地进行一次或多次洗脱。在优选的实施方案中,阴离子交换柱用至少1个柱体积的平衡缓冲液洗脱,优选2个柱体积,然后用第二洗脱缓冲液洗脱,第二洗脱缓冲液包括选自乙酸钠的缓冲液,其中pH为约4.5-6,优选pH 5.5;电导率选自1-20mS/cm,优选8.2mS/cm。乙酸钠的浓度选自约50-125mM,优选100mM。阴离子交换柱用至少1个柱体积的平衡缓冲液洗涤,优选3个柱体积,更优选6个柱体积,最优选8个柱体积。
然后可以使用合适的缓冲液洗脱阴离子交换柱。洗脱缓冲液可以是一种或多种缓冲液的混合物。洗脱缓冲液包含选自乙酸钠的缓冲液,其中pH为约4.5-6,优选pH 5.5;电导率选自10-30mS/cm,优选15mS/cm。收集的洗脱液称为第四蛋白质混合物。
在一优选的实施方式中,本发明体现了通过混合式层析(MMC)工艺从含有目标蛋白质和HCP杂质的蛋白质混合物中纯化TNFR:Fc融合蛋白的方法,HCP杂质含有至少一种蛋白质降解酶。
从阴离子交换层析柱得到的第四蛋白质混合物可进行混合式层析,得到的洗脱液称为第五蛋白质混合物,该第五蛋白质混合物的HCP和蛋白质降解酶水平降低。洗脱液(第五蛋白质混合物)中基本上不含至少一种蛋白质降解酶。
混合式层析柱包括含有正电荷部分和疏水部分的配体,其中正电荷部分具有离子交换(IEC)性质,疏水部分具有疏水作用层析(HIC)性质。IEC/HIC混合式层析可同时用于静电和疏水相互作用,因此具有更好的分离能力和选择性。混合式层析可以使用阴离子交换层析和HIC或阳离子交换层析和HIC的组合进行。混合式层析柱选自Capto adhere(N-苄基-N-甲基乙醇胺作为配体)、Capto MMC(MMC配体)、MEP Hypercel(4-巯甲基吡啶作为配体)、HEA Hypercel(己基胺作为配体)、PPA Hypercel(苯丙胺作为配体),表现出许多相互作用的功能。这些树脂可用于多种相互作用。最显着的是离子相互作用、氢键和疏水相互作用。
在一实施方式中,将从阴离子交换层析柱获得的第五蛋白质混合物进行混合式层析。混合式层析法在流通模式下进行。在上样前,将第五蛋白质混合物(样品)的pH调节至约pH 6至pH 7,优选pH 6.5。可以通过使用浓度为约1M至5M,优选2M的tris碱来调节pH。通过使用2M-8M的氯化钠储液将样品的电导率从约30mS/cm调节至约42mS/cm,优选35mS/cm。上样前,混合式柱用合适的缓冲液平衡。合适的平衡缓冲液选自组氨酸-盐酸盐、磷酸盐、柠檬酸盐,优选含有乙酸钠的组氨酸-盐酸盐、NaCl,其中pH为约6-7,优选pH 7,电导率选自约30-42mS/cm,优选35mS/cm。组氨酸氯化物的浓度选自10-50mM,优选20mM。乙酸钠的浓度选自180-300mM,优选254mM。NaCl的浓度选自180-300mM,优选240mM。将第五蛋白质混合物上样到混合式层析柱上。流速选自约20-100cm/hr,优选50cm/hr,并且在流动(FT)模式下收集蛋白质组分。洗脱组分含有基本上纯的目标蛋白质,而工艺相关杂质和产品相关杂质有效地结合到柱上。用收集的FT组分制备“人工池”。
分析“人工池”以通过HI-HPLC检测错折叠物的百分含量(%)并通过ELISA检测HCP水平。
在一实施方式中,从混合式层析柱获得的洗脱液可以进行病毒过滤。病毒过滤通过使用MMC FT与PALL DV20过滤器在2-2.5bar压力下进行。
在一实施方式中,从混合式层析获得的蛋白质通过使用切向流过滤(tangential flow filtration,TFF)来浓缩。TFF可以是Millipore Biomax 30kDa膜,其用于缓冲液交换成制剂缓冲液,并将目标蛋白质浓缩至适当浓度。
在一实施方式中,本发明涉及通过使用混合柱层析从蛋白质混合物中纯化TNFR:Fc融合蛋白的方法,该混合柱层析在亲和柱层析后的任一步骤中进行。
在一实施方式中,本发明涉及一种从含有TNFR:Fc融合蛋白和HCP杂质的蛋白质混合物中纯化蛋白质的方法,包括以下步骤:
(a)从适当的哺乳动物表达系统中获取蛋白质混合物,所述哺乳动物表达系统含有TNFR:Fc融合蛋白和宿主细胞蛋白(HCP)杂质,所述宿主细胞蛋白杂质包括至少一种蛋白质降解酶;
(b)将所述蛋白质混合物施于亲和层析柱上;
(c)从所述亲和层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第二蛋白质混合物中,所述第二蛋白质混合物含有的HCP杂质量减少;
(d)将所述第二蛋白质混合物施于混合式层析柱上;
(e)从所述混合式层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白基本上不含有包括至少一种蛋白质降解酶的HCP杂质。
另一实施方式中,本发明涉及一种从含有TNFR:Fc融合蛋白和包括至少一种蛋白质降解酶的HCP杂质的蛋白质混合物中纯化TNFR:Fc融合蛋白的方法,包括以下步骤:
(a)从适当的哺乳动物表达系统中获取蛋白质混合物,所述哺乳动物表达系统含有TNFR:Fc融合蛋白和宿主细胞蛋白(HCP)杂质,所述宿主细胞蛋白杂质包括至少一种蛋白质降解酶;
(b)将所述蛋白质混合物施于亲和层析柱上;
(c)从所述亲和层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第二蛋白质混合物中,所述第二蛋白质混合物含有的HCP杂质量减少;
(d)将所述第二蛋白质混合物施于疏水作用层析柱上;
(e)从所述疏水作用层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第三蛋白质混合物中,所述第三蛋白质混合物含有的HCP杂质量减少;
(f)将所述第三蛋白质混合物施于混合式层析柱上;
(g)从所述混合式层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白基本上不含有包括至少一种蛋白质降解酶的HCP杂质。
另一实施方式中,本发明涉及一种从含有TNFR:Fc融合蛋白和包括至少一种蛋白质降解酶的HCP杂质的蛋白质混合物中纯化蛋白质的方法,包括以下步骤:
(a)从适当的哺乳动物表达系统中获取蛋白质混合物,所述哺乳动物表达系统含有TNFR:Fc融合蛋白和宿主细胞蛋白(HCP)杂质,所述宿主细胞蛋白杂质包括至少一种蛋白质降解酶;
(b)将所述蛋白质混合物施于亲和层析柱上;
(c)从所述亲和层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第二蛋白质混合物中,所述第二蛋白质混合物含有的HCP杂质量减少;
(d)将所述第二蛋白质混合物施于疏水作用层析柱上;
(e)从所述疏水作用层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第三蛋白质混合物中,所述第三蛋白质混合物含有的HCP杂质量减少;
(f)将所述第三蛋白质混合物施于阴离子交换层析柱上;
(g)从所述阴离子交换层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白存在于第四蛋白质混合物中,所述第四蛋白质混合物含有的HCP杂质量减少;
(h)将所述第四蛋白质混合物施于混合式层析柱上;
(i)从所述混合式层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白基本上不含有包括至少一种蛋白质降解酶的HCP杂质。
另一实施方式中,本发明涉及一种从含有TNFR:Fc融合蛋白和HCP杂质的蛋白质混合物中纯化TNFR:Fc融合蛋白的方法,包括以下步骤:
(a)从适当的哺乳动物表达系统中获取蛋白质混合物,所述哺乳动物表达系统含有TNFR:Fc融合蛋白和宿主细胞蛋白(HCP)杂质,所述宿主细胞蛋白杂质包括至少一种蛋白质降解酶;
(b)将所述蛋白质混合物施于亲和层析柱上;
(c)将亲和层析柱进行多次洗脱;
(d)从所述亲和层析柱洗脱TNFR:Fc融合蛋白,其中经洗脱的TNFR:Fc融合蛋白含有的HCP杂质量相对于未对亲和层析柱进行多次洗脱的方法更少。
在一实施方式中,TNFR:Fc融合蛋白的纯化包括:在结合洗脱模式下进行蛋白A层析,然后在结合洗脱模式下进行疏水作用层析,在结合洗脱模式下进行阴离子交换层析,最后在流动模式下进行混合式层析。
在一实施方式中,离子交换层析(IEC)和HIC条件最接近适于保持生物活性的生理条件,它们的组合广泛用于生物产品的分离。混合式层析柱包括含有正电荷部分和疏水部分的配体,其中正电荷部分具有离子交换(IEC)性质,疏水部分具有疏水作用层析(HIC)性质。IEC/HIC混合式层析可同时用于静电和疏水相互作用,因此具有更好的分离能力和选择性。混合式层析可以使用阴离子交换层析和HIC或阳离子交换层析和HIC的组合进行。混合式层析可以使用市售的树脂如Capto adhere(N-苄基-N-甲基乙醇胺作为配体)、Capto MMC(MMC配体)、MEP Hypercel(4-巯甲基吡啶作为配体)、HEA Hypercel(己基胺作为配体)、PPA Hypercel(苯基丙胺作为配体),表现出许多相互作用的功能。这些树脂可用于多种相互作用。最显着的是离子相互作用、氢键和疏水相互作用。
在流动模式下使用混合式层析法除去含有至少一种蛋白质降解酶和其它杂质的HCP,其它杂质包括经沥滤的蛋白A、聚集体、片段、内毒素、核酸和来自单克隆抗体和TNFR:Fc融合蛋白的病毒,其中目标蛋白质直接通过柱,同时污染物/杂质被吸附。这些污染物/杂质还包括目标蛋白质的错折叠形式,因为它们与目标蛋白质的疏水性不同。
其他替代方法可尝试用于除去HCP,例如用明胶琼脂糖凝胶替代混合式层析,但是在本发明时尚未被监管部门批准。
在一实施方式中,使用更敏感的明胶酶谱检测残余HCP水平。明胶酶谱在检测某些蛋白酶(特别是基质金属蛋白酶,更特别是明胶酶)时具有更高的灵敏度,这些蛋白酶是HCP的一种形式,在细胞培养澄清时分泌到HCCF中。在中间纯化阶段的材料中残留蛋白酶在明胶酶谱法上对阳性明胶酶活性是明显的。商用HCP检测试剂盒或过程特异性HCP ELISA试剂盒具有较低的灵敏度,通常高于1PPM的HCP。然而,明胶酶谱也具有局限性,只能在中间纯化阶段的材料或经纯化的目标蛋白中检测高于0.1PPM水平的蛋白水解活性。
在另一实施方式中,在HCCF和蛋白A层析中从通过明胶酶谱法观察到的表达目标蛋白的各种CHO细胞系中检测残留的蛋白酶活性。
在另一实施方式中,通过使用标记蛋白在培养温度>2℃的条件下进行加速降解的中间纯化,针对残余HCP(对于蛋白酶活性)进行更灵敏的测试(图3)。
在另一实施方式中,本发明基本上减少含有至少一种蛋白质降解酶的HCP杂质至少90%,优选至少99%,更优选减少至可接受的极限。
在另一实施方式中,本发明基本上减少了含有至少一种蛋白质降解酶的HCP杂质,并使TNFR:Fc融合蛋白稳定至少两周,优选至少一个月,更优选至少6个月,最优选至少一年。
以下实施例是本发明的说明,并不用于限制本发明。
实验部分
依那西普(Etanercept)用作TNFR:Fc融合蛋白模型,作为标记蛋白的实例。使用通过重组DNA技术基因工程化的CHO细胞,通过对哺乳动物细胞的培养产生依那西普。CHO细胞用补料分批方法培养。依那西普来自用于实施例中的不同生产批次。通过对标记蛋白的加速降解研究和明胶酶谱来评价蛋白酶的去除效率。
实施例1
蛋白A层析纯化依那西普
对澄清的收获的细胞培养液(HCCF)进行预处理,将pH值调节至8.2-9.2。将经预处理的HCCF上样至蛋白A层析柱(MabSelect Sure LX,GE Healthcare)上,并用平衡缓冲液(50mM Tris-Cl缓冲液)对柱子进行预平衡。使用洗脱缓冲液1(50mM Tris,1.5M尿素,1.5%吐温80和7.5%异丙醇,1M NaCl和5mM EDTA,pH 8.5)和洗脱缓冲液2(50mM柠檬酸三钠脱水缓冲液,pH 4.5)进行中间洗脱,最后用50mM柠檬酸钠脱水缓冲液(pH 3.5)洗脱依那西普。
实施例2
蛋白A层析纯化依那西普
上样至亲和柱之前,用2M Tris碱将经0.2微米过滤的澄清收获细胞培养液(HCCF)调节pH值至8.5±0.2。将经pH值调节的溶液以100cm/hr的流速上载到蛋白A(MabSelect Sure LX,GE Healthcare)柱上,柱床高度20cm(动态结合容量:每ml树脂不超过17mg依那西普),用两个柱体积的平衡缓冲液(50mM Tris-Cl缓冲液,含有150mM NaCl和5mM EDTA,pH 8.5,电导率18±2mS/cm)进行预平衡。上样结束,首先用2个柱体积的平衡缓冲液洗脱柱子,然后用6个柱体积的中间洗脱缓冲液A(50mM Tris,1.5M尿素,1.5%吐温80和7.5%异丙醇,1M NaCl和5mM EDTA pH8.5,电导率65±5mS/cm),再用1个柱体积的中间洗脱缓冲液B(50mM柠檬酸钠二水合物,pH 4.5,电导率12±2mS/cm),最后用1个柱体积的中间洗脱缓冲液C(10%缓冲液B对中间洗脱缓冲液2)。最后,组合利用线性梯度(6CV的10-90%洗脱缓冲液)和阶梯梯度(洗脱缓冲液:50mM柠檬酸钠二水合物,pH 3.0,电导率13±2mS/cm)对依那西普进行洗脱。收集的组分进行降低pH值处理。进行合并,减少的氧化物和HCP为蛋白质混合物的至少10%。
实施例3
混合式层析纯化依那西普
用2M Tris碱调节来自阴离子交换层析的经洗脱的蛋白质溶液的pH值至6.5。用4M NaCl储备溶液将溶液的电导率调节至35mS/cm。混合式层析在Capto Adhere树脂(GE Healthcare)上以负结合模式(negative binding mode)进行,柱床高度为18cm。柱子用20mM组氨酸盐酸盐,240mM乙酸钠和220mM NaCl(pH 6.5,电导率35±2mS/cm)进行平衡。蛋白质溶液以50cm/hr的流速上载到柱上,收集FT组分,因为其含有纯的依那西普,工艺相关杂质和产品相关杂质有效地结合到柱上。用收集的FT组分制备“人工池”并进行分析,通过HI-HPLC检测错折叠物的百分含量(%)并通过ELISA检测HCP的水平。基于分析报告,进行合并,减少的错折叠物和HCP为蛋白质混合物的至少10%。
实施例4
采用蛋白A层析同时不采用混合式纯化依那西普
蛋白A层析在没有进行中间洗脱的情况下进行。观察到蛋白A层析清除了大部分HCP,但是在明胶酶谱上观察到的条带证明蛋白A洗脱液中的阳性明胶酶活性,如图1A,因此推断少量的HCP仍然与依那西普共洗脱。
从蛋白A层析柱获得的蛋白质混合物(第二蛋白质混合物)进一步用HIC层析柱纯化。首先进行上样准备,通过向蛋白质溶液中逐渐加入高盐缓冲液(0.05M无水磷酸氢二钠,0.8M柠檬酸钠二水合物,pH 6.5,电导率65±5mS/cm),以获得50±2mS/cm的电导率。在Butyl Toyopearl 650M树脂上进行疏水作用层析,柱床高度为25±2cm。用平衡缓冲液(用WFI稀释的高盐缓冲液,电导率为50±2mS/cm)对柱子进行平衡。将蛋白质样品以150cm/hr的流速上载到柱子上,用1.5个柱体积的平衡缓冲液洗脱。用6个柱体积的25%的缓冲液B(缓冲液B:0.05M无水磷酸氢二钠,pH 6.5,电导率8±1mS/cm)洗脱,或洗脱至吸收稳定,或上述任一情况首先发生。通过利用65%梯度的B从柱上洗脱目标蛋白。按份收集洗脱的蛋白质(第三蛋白质混合物)。用收集的组分制备“人工池”并分析,通过HI-HPLC检测错折叠物的百分含量(%)并通过ELISA检测HCP水平。
经疏水作用层析洗脱的蛋白质通过30kDa截留膜,用6个渗滤体积的20mM组氨酸盐酸盐,pH 5.5缓冲液进行渗滤,或进行渗滤直至滞留物的pH和电导率分别达到小于5.8和3.0mS/cm。此后,通过使用阴离子交换层析进一步纯化洗脱的蛋白质。
在DEAE Sepharose FF中进行阴离子交换层析,柱床高度为25cm。用平衡缓冲液(20mM组氨酸盐酸盐,pH 5.5,电导率2±1mS/cm)对柱子进行平衡。将缓冲液交换的蛋白质溶液以150cm/hr的流速上载到柱上,并且用2个柱体积的平衡缓冲液洗脱。进一步用8个柱体积的中间洗脱缓冲液(含有100mM乙酸钠,pH 5.5,电导率:8.2±1mS/cm的平衡缓冲液)进行洗脱。最后用洗脱缓冲液(含有240mM乙酸钠,pH 5.5,电导率:15±2mS/cm的平衡缓冲液)洗脱目标蛋白质(第四蛋白质混合物)。
实施例5
采用混合式多柱层析法纯化依那西普
蛋白A柱层析法如本发明的实施例1或实施例2所述进行,有助于从HCP分离紧密结合的依那西普。如图1B所示,分析蛋白A洗脱液时,明胶酶谱没有显示任何明胶酶活性。然而,在蛋白A洗脱液中痕量的HCP(蛋白酶)在对标记蛋白的加速降解研究中较为明显。表1A(实施例4)中所示的数据显示了加速研究中标记蛋白的降解程度(在2℃-8℃为17%,在25℃为51%)。从蛋白A层析柱获得的蛋白质混合物(第二蛋白质混合物)进一步用HIC柱层析法进行纯化。首先进行上样准备,通过向蛋白质溶液中逐渐加入高盐缓冲液(0.05M无水磷酸氢二钠,0.8M柠檬酸钠二水合物,pH 6.5,电导率65±5mS/cm),以获得50±2mS/cmd的电导率。在Butyl Toyopearl 650M树脂上进行疏水作用层析,柱床高度为25±2cm。用平衡缓冲液(用WFI稀释的高盐缓冲液,电导率为50±2mS/cm)对柱子进行平衡。将蛋白质样品以150cm/hr的流速上载到柱子上,用1.5个柱体积的平衡缓冲液洗脱。用6个柱体积的25%的缓冲液B(缓冲液B:0.05M无水磷酸氢二钠,pH 6.5,电导率8±1mS/cm)洗脱,或洗脱至吸收稳定,或上述任一情况首先发生。通过利用大于45%(优选65%)的分级梯度的B从柱上洗脱目标蛋白。按份收集洗脱的蛋白质(第三蛋白质混合物)。用收集的组分制备“人工池”并分析,通过HI-HPLC检测错折叠物的百分含量(%)并通过ELISA检测HCP水平。基于分析报告,进行合并,减少的错折叠物和HCP为第二蛋白质混合物的至少10%。
阴离子交换层析在DEAE琼脂糖凝胶FF中进行,柱床高度为25cm。用平衡缓冲液(20mM组氨酸盐酸盐,pH 5.5,电导率2±1mS/cm)对柱子进行平衡。将第三蛋白质混合物上载到柱子上并用平衡缓冲液洗脱。用中间洗脱缓冲液(平衡缓冲液含有100mM乙酸钠,pH 5.5,电导率8.2±1mS/cm)进一步洗脱。最后用洗脱缓冲液(平衡缓冲液含有240mM乙酸钠,pH 5.5,电导率15±2mS/cm)洗脱目标蛋白质(第四蛋白质混合物)。
如实施例2所述,通过混合式层析法进一步纯化经洗脱的第四蛋白质混合物。加速降解研究结果显示在表1B和图2B中。
表1:用于加速降解研究的标记蛋白的SEC-HPLC分析
混合式层析法有助于进一步除去痕量的蛋白酶,表明通过该步骤去除了更多的HCP(更具体地,去除蛋白酶)。表1B(实施例5)在培养后的两周,用于加速降解研究的标记蛋白没有显示出降解迹象。
表2:不同阶段的纯度
ND–未测出
实施例6
通过HPLC或任何适当的检测工具对实施例4和实施例5纯化的依那西普进行标记蛋白的加速降解研究。将来自两个实验的样品进行加速降解研究,持续时间足以保证其降解,通常在2周内。通过HPLC或任何适当的检测工具分析标记蛋白质的消化。可以观察到,与图2A所示的实施例4相比,图2B所示的实施例5纯化的依那西普没有显示标记蛋白的降解,表明实施例5中描述的纯化方案可以去除更多的HCP,优选去除蛋白酶,甚至更优选去除明胶酶。
从上述实施例可以得出结论,混合式层析通过除去痕量的HCP,为单克隆抗体和TNFR:Fc融合蛋白提供极好的中间纯化和/或精纯,然而使用常规层析法而不使用混合式层析法会使HCP与目标蛋白混在一起。后续步骤为纯化单克隆抗体和TNFR:Fc融合蛋白提供了稳定的层析平台。在这种树脂中使用的配体,例如N-苄基-N-甲基乙醇胺、4-巯甲基吡啶、己胺、苯基丙胺显示出许多用于结合宿主蛋白的功能。
明胶酶谱:
酶谱作为一种电泳技术,通常以十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)为基础,其包含在聚丙烯酰胺凝胶基质内共聚的明胶作为底物,用于检测蛋白酶活性或明胶酶活性。样品通常在非还原条件下,即不存在加热和还原剂[2-巯基乙醇、二硫苏糖醇(DTT)]的情况下通过标准SDS-PAGE处理缓冲液进行准备。电泳后,通过在非缓冲的Triton X-100中培养,从凝胶(酶谱)中浸出SDS,随后在合适的激活缓冲液中培养,较优的时间和温度取决于被测酶的类型和被降解的底物的类型。随后将该酶谱图进行考马斯染色,并且通过蓝色背景中的清除区来区分消化区域。对于具体的蛋白酶(明胶酶),明胶是最常用的底物之一。在这种情况下,在考马斯染色后,蛋白水解活性在深蓝色背景上显现为清晰带。
加速降解研究:
通过在2℃-8℃、25℃和40℃下培养两周经纯化的标记蛋白,进行加速降解研究。培养后,通过SE-HPLC分析蛋白质样品,以在标记蛋白降解时检测LMW种类。
本申请中引用的所有专利、专利申请和公开出版物出于所有目的通过引用并入本文,如同每个单独的专利、专利申请或公开出版物单独地表示。
虽然上面已经详细描述了某些实施例和示例,但是本领域普通技术人员清楚地理解,在不脱离其教导的情况下,可以对实施例和示例进行许多修改。
- 还没有人留言评论。精彩留言会获得点赞!