一种云实稠合呋喃二萜及其制法和用途的制作方法
本发明涉及一种云实稠合呋喃二萜及其制法和用途,具体指7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃及其制法和用途。
背景技术:
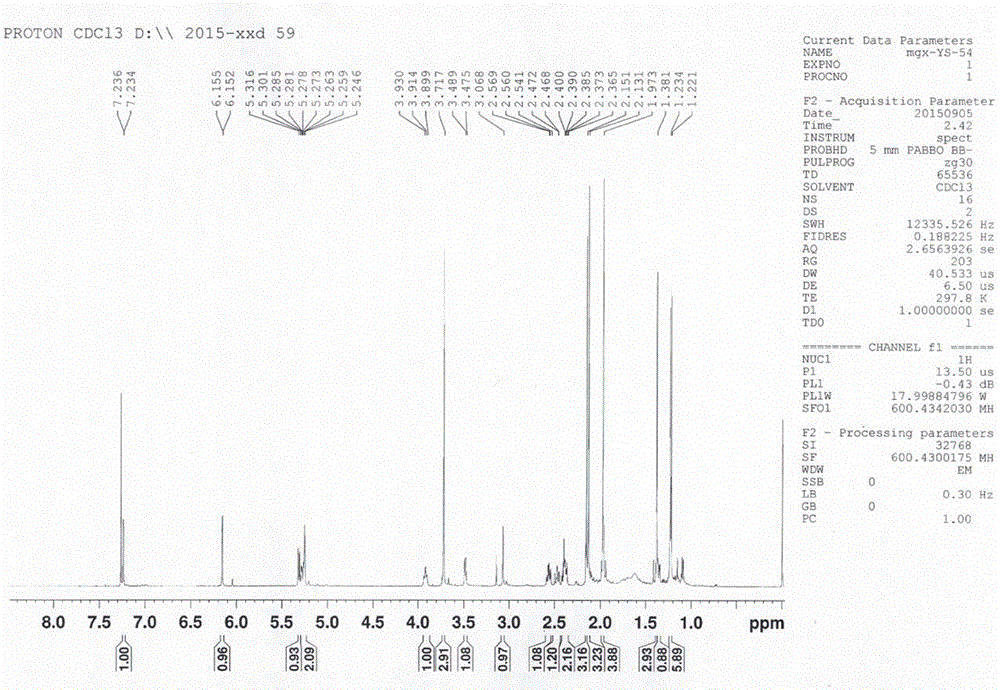
:云实(Caesalpiniadecapetala(Roth)Alston)又名“药王子”,“牛王刺”,“朝天子”,“倒挂刺”等,为豆科(Fabaceae)云实属植物,生于我国南部地区,平原地带长载培,常野生于山坡、岩旁、林边、河边或灌木丛中。云实的果、茎皮含单宁,种子可榨油,根茎及果实供药用,具有清热除湿杀虫之功效,治疗痢疾、疟疾、消渴、小儿疳积等疾病。因此,开发和利用云实中具有生物活性的单体化合物,进一步挖掘其潜在的药用价值,并对其单体化合物的结构和理化性质进行确定和表征,对于开发利用云实资源具有重要意义。技术实现要素:本发明就是克服现有技术的不足,提供一种从云实种子中分离得到的具有重要生物活性和产业化利用价值的云实稠合呋喃二萜单体化合物。该单体化合物为云实种子中首次分离得到,利用现代分析手段表征其结构并确认其生物活性后,根据有关化合物的命名规则命名为7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃。一种从云实种子中分离得到的7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃,具有如下式所示结构:上述从云实种子中分离得到的7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃按下述方法得到:云实种子干燥后粉碎过筛,加乙醇加热回流提取3次,每次1-3小时,合并提取液,减压回收溶剂,浓缩后得总浸膏,总浸膏经100~200目硅胶拌样,依次用石油醚、氯仿、乙酸乙酯、丙酮和甲醇洗脱,洗脱液减压浓缩至干;取氯仿层浸膏用硅胶柱色谱分离,氯仿-甲醇(1:0-0:1)9梯度洗脱,得到9个馏分FrA-I,Fr.D部分经凝胶色谱洗脱后再用氯仿-甲醇作为洗脱液洗脱除去色素,然后样品经反相中压色谱柱经甲醇-水(60:40;80:20;90:10)梯度洗脱,得到三个部份FrD1-3,其中FrD2经高效液相色谱纯化分离,采用甲醇-水洗脱,收集32.8分钟的洗脱液即得。所述加热回流提取中云实种子与乙醇的质量体积比为1:8-1:12。所述氯仿-甲醇洗脱液中氯仿与甲醇的体积比为40:60-55:45。所述甲醇-水洗脱液中甲醇与水的体积比为68:32。7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃为无色粉末,易溶于氯仿,甲醇,将7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃进行体外抗肿瘤药效学实验,体外抗肿瘤药效学实验利用MTT比色法。以7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃为实验组,以Doxorubicin(多柔比星,抗肿瘤药物)为对照组,同时设立空白组,实验组、对照组和空白组选取HeLa(人宫颈癌)细胞、KB(人口腔表皮样癌)和HT-29(人结肠癌)细胞为实验对象,培养基稀释后,以6×104/ml的密度接种于96孔板,每孔100μl,培养箱中正常培养24小时后,各组加入相对应的药物,使各组药物的最终浓度分别为2.5μg/ml(1组),5μg/ml(2组),10μg/ml(3组),20μg/ml(四组),40μg/ml(5组),共设5个浓度,每个浓度3个复孔;培养48小时后,于每孔加MTT10μl染色;继续培养四小时后,吸弃原培养液,每孔加入DMSO100μl,置摇床上低速振荡10min,使结晶物充分溶解,并于酶联免疫检测仪570nm波长处检测光密度值,根据光密度值计算50%抑制浓度(IC50,μg/mL),光密度值计算IC50的计算方法为现有公知技术。实验组、对照组对HeLa细胞、HT-29细胞和KB细胞的IC50如表1所示。表1组别HeLa细胞HT-29细胞KB细胞实验组>10036.2±1.7>100对照组1.4±0.210.97±0.360.82±0.13通过上表的数据可以看出,本发明所述的7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃对HeLa细胞、HT-29细胞和KB细胞均具有一定的抑制作用,能够作为制备防治肿瘤药物的原料,具备较强的产业化应用价值。与现有技术相比,本发明的有益效果在于:首次从云实种子中分离得到了具有重要抗肿瘤活性的7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃,并利用现代分析手段确定了其化学结构和理化性质。经功能性试验证明:7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃对肿瘤细胞具有一定的抑制作用,能够作为制备防治肿瘤药物的原料,具有较强的应用价值和市场前景。附图说明图1是7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃的分子结构示意图。图2是7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃的核磁共振氢谱(1H-NMR)。图3是7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃的核磁共振碳谱(13C-APT)。具体实施方式下面将结合具体实施例对本发明作进一步的说明第一步:云实种子(1.0kg)干燥后粉碎过80目筛。第二步:药材粉末加10倍量乙醇加热回流提取3次,每次2小时,合并提取液,减压回收溶剂,浓缩后得总浸膏62.0g。第三步:云实种子总浸膏经100~200目硅胶拌样,依次用石油醚、氯仿、乙酸乙酯、丙酮和甲醇洗脱,洗脱液减压浓缩至干。最终得到石油醚部位浸膏12.6g,氯仿部位浸膏8.7g,乙酸乙酯部位浸膏6.3g,丙酮部位浸膏5.9g,甲醇部位浸膏17.4g。第四步:取氯仿层浸膏8.7g经硅胶柱色谱(100~200目)分离,氯仿-甲醇(1:0-0:1)9梯度洗脱,得到9个馏分FrA-I。第五步:Fr.D部分经凝胶色谱洗脱,氯仿-甲醇(45-55)作为洗脱液洗脱除去色素,然后样品经反相中压色谱柱经甲醇-水(60:40;80:20;90:10)梯度洗脱,得到三个部份FrD1-3.第六步:其中FrD2经高效液相色谱纯化分离,采用甲醇-水(68:32)等度洗脱,收集32.8分钟的洗脱液结晶得到无色粉末,易溶于氯仿、甲醇。上述无色粉末的结构表征和确认如下:将上述所得无色粉末进行核磁共振氢谱(1H-NMR)和核磁共振碳谱(13C-APT)分析,1H-NMR谱图如图2所示,13C-APT谱图如图3所示。对图2和图3进行图谱解析,将图2和图3各峰进行归属,图2和图3的峰归属如表2所示,通过图2、图3以及表1的数据可知,无色粉末的化学结构式如图1所示,根据有关化合物的命名规则命名为7β-羟基-1α,2α,6α-三乙酰基-14β-羧甲基-卡山烷二萜-12(13),15(16)-双键-12,16-稠合呋喃。英文名为7β-hydroxyl-1α,2α,6α-triacetoxyl-14β-carboxyl-cass-12(13),15(16)-diene-12,16-fusedfuran。表2上述只是本发明的较佳实施例,并非对本发明作任何形式上的限制。任何熟悉本领域的技术人员,在不脱离本发明技术方案范围的情况下,都可利用上述揭示的技术内容对本发明技术方案做出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明技术实质对以上实施例所做的任何简单修改、等同变化及修饰,均应落在本发明技术方案保护的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1