一种人单个核细胞重编程为诱导多能干细胞的方法与流程
本发明涉及一种人单个核细胞重编程为诱导多能干细胞的方法。
背景技术:
人胚胎干细胞(human embryonic stem cells,hESCs)是一类全能性干细胞,它具有体外培养无限增殖、自我更新和多向分化潜能。理论上无论是在体外还是体内环境,hESCs都能被诱导分化为人体几乎所有的细胞类型。hESCs的进一步研究和应用,将为移植疗法和治疗视网膜黄斑变性、帕金森、肌萎缩性侧索硬化症等疑难病症开辟新的途径。然而,由于hESCs难以获得且涉及敏感的伦理道德问题,使得hESCs的临床研究一度陷入尴尬境地而无法大规模开展。
2007年,日本Yamanaka和美国Thomson实验室首次发表了用人体细胞重编程得到人诱导多能干细胞(induced pluripotent stem cells,iPSCs)的方法。诱导多能干细胞成功地避开了人胚胎干细胞无法回避的伦理问题,而且具有与其相似的自我更新能力和向三个胚层分化的能力,有望成为无限获取人自体细胞的工具,用于基础生物学研究、疾病模型、药物筛选、基因矫正、细胞治疗等。而如何进一步安全、高效、低成本地进行重编程技术获得iPSCs细胞是本领域一直在不断努力达到的目标。
2011年,Chou等人成功地运用Episomal质粒介导法将人脐带血单个核细胞重编程为ips细胞,该方法无病毒介导无基因整合,但是单个核细胞培养阶段引入了牛血清白蛋白(BSA),重编程阶段涉及鼠源饲养层细胞(小鼠胚胎成纤维细胞,MEF)等,所以不是一种完全人源化的重编程方法。2015年,Chou等人又成功地运用Vitronectin基质胶替代MEF饲养层建立了全人源化的重编程方法,但是Vitronectin基质胶价格昂贵,配制后4℃保存不能超过一周,需现配现用。
因此,需要进一步开发一种既安全(无病毒、无外源基因整合、全人源化)、高效,又成本相对低廉的重编程体系,对人iPSCs最终走向临床应用显得尤为迫切和需要。
技术实现要素:
为了解决上述问题,本发明提供了一种新用于单个核细胞重编程的基质胶以及将人单个核细胞诱导重编程为人诱导多能干细胞的方法以及人诱导多能干细胞的培养方法。
本发明用于单个核细胞重编程的基质胶,它是羊膜间充质干细胞的裂解物。
其中,所述基质胶按照如下方法制备:
(1)取羊膜间充质干细胞,培养至汇合度超过90%时,裂解;
(2)加入固定液固定,然后去除固定液,晾干,即可。
步骤(1)中,裂解前后用PBS洗涤;和/或,裂解采用的裂解液是RIPA裂解液。其中,裂解液是浓度为1~10%(v/v)的RIPA裂解液,优选裂解液是浓度为5%(v/v)的RIPA裂解液;和/或裂解的时间为5-6min。
步骤(1)中,所述羊膜间充质干细胞为人羊膜间充质干细胞。
步骤(2)中,所述固定液是浓度为80%(v/v)的甲醇;和/或,固定的时间为10min。
本发明将人单个核细胞诱导重编程为人诱导多能干细胞的方法,它是以前述的基质胶为诱导基质胶诱导的。
所述方法的步骤如下:
a、取人单个核细胞,采用红系培养基培养,转染Episomal质粒;所述红系培养基是以H3000培养基为基础培养基,添加了终浓度为100ng/ml的SCF、终浓度为10ng/ml的IL-3、终浓度为2U/ml的EPO、终浓度为40ng/ml的IGF-1、终浓度为1uM的Hydrocortisone;
b、将转染后的细胞转入前述的基质胶中,加入培养基,诱导培养,即可。
SCF:干细胞生长因子;IL-3:白细胞介素-3;EPO:促红细胞生成素;IGF-1:类胰岛素一号增长因子;Hydrocortisone:氢化可的松。
步骤a中,所述人单个核细胞是脐带血单个核细胞或者外周血单个核细胞;采用红系培养基培养8~12天,
步骤b中,诱导培养时,先添加红系培养基培养,第2天每孔补加红系培养基1ml,第3天每孔补加ReproTeSR培养基1ml,第7天更换ReproTeSR培养基,此后每天换液;所述红系培养基是以H3000培养基为基础培养基,添加了终浓度为100ng/ml的SCF、终浓度为10ng/ml的IL-3、终浓度为2U/ml的EPO、终浓度为40ng/ml的IGF-1、终浓度为1uM的Hydrocortisone;
和/或,步骤b中,诱导培养的时间为14-20天。
综上,本发明基质胶的保存时间长,将人单个核细胞诱导重编程为人诱导多能干细胞的诱导率高,应用前景良好。
下面通过具体实施方式对本发明做进一步详细说明,但是并不是对本发明的限制,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
附图说明
图1为人羊膜间充质干细胞基质胶制备前后照片。A为制备前相差照片;B为用5%RIPA制备后相差照片。
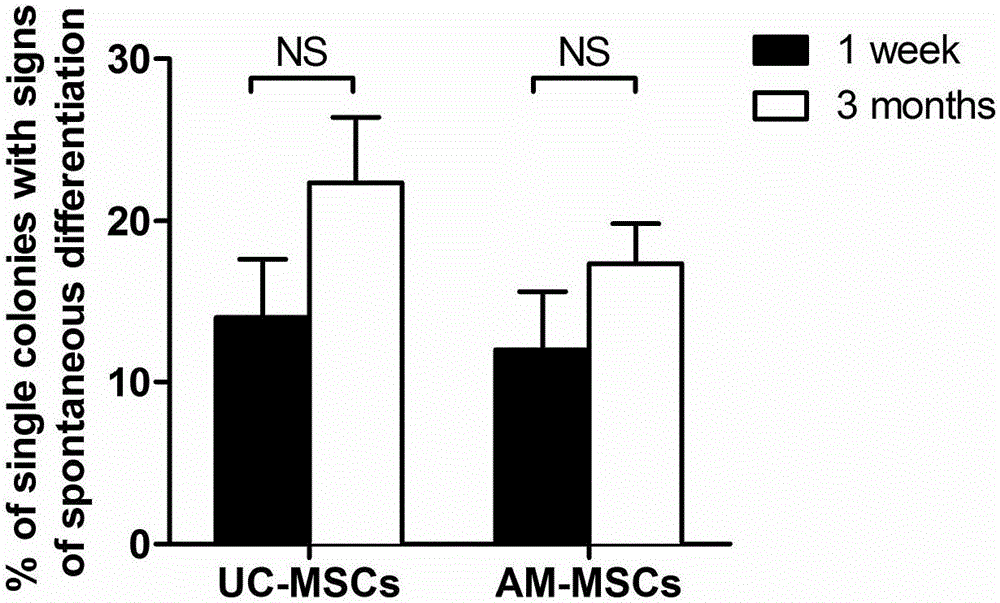
图2为ips细胞系在4℃保存不同时间的间充质干细胞基质胶上培养后的自发分化率统计。
图3为人脐带血单个核细胞和人外周血单个核细胞红系培养扩增不同时间点细胞总数统计。
图4为人脐带血单个核细胞和人外周血单个核细胞经红系培养扩增后流式细胞术分析。
图5为人脐带血单个核细胞和人外周血单个核细胞经红系培养扩增后May-Grunwald Giemsa(MGG)染色。
图6为本发明的实施流程图。
图7为重编程过程中的ips样细胞形态。
A为AM-MSCs基质胶上重编程DAY8相差照片;B为AM-MSCs基质胶上重编程DAY18相差照片;C为AM-MSCs基质胶上连续培养超过10代的iPSCs相差照片。
图8为重编程效率统计。
图9为PCR法检测外源基因整合情况。
图10为Real-time PCR检测内源性基因表达
图11为免疫荧光检测多能marker。
图12为染色体核型分析。
图13为畸胎瘤实验。
具体实施方式
实施例1本发明人羊膜间充质干细胞基质胶的制备
1、试验方法
1.1从分娩胎儿中无菌获取人羊膜组织,然后用PBS清洗3次。以无菌操作方式将组织机械剪成约0.2cm2大小,采用组织块贴壁法将组织块贴于Cellbind细胞培养板中,加入含1%双抗的TheraPEAKTM MSCGM-CDTM Medium,置于37℃5%CO2细胞培养箱中培养。当细胞汇合度大于90%时,用0.05%胰酶消化,按1:4比例传代。
1.2当传代培养P3至P10的人羊膜间充质干细胞(AM-MSCs)(图1A)生长至超过90%汇合时,用PBS洗1次,分别用1%RIPA裂解液、5%RIPA裂解液和10%RIPA裂解液室温裂解5-6min。然后再用PBS洗3次,加入80%甲醇室温固定10min。固定后弃固定液,室温晾干后密封,4℃保存备用。
1.3分别取4℃保存7天、3个月的人羊膜间充质干细胞基质胶,以人脐带间充质干细胞(UC-MSCs)基质胶为对照(用脐带间充质干细胞按照实施例1的方法制备的基质胶),将实验室已构建的人诱导多能干细胞ips细胞株机械法传代至基质胶上培养,培养基为life Technologies公司的Essential 8TM培养基,统计ips细胞在基质胶上的自发分化百分比(计算100个克隆中自发分化的克隆数)。
2、实验结果
显微镜下观察羊膜间充质干细胞(AM-MSCs)经过不同浓度的RIPA裂解前后的形态,结果显示1%RIPA处理组裂解不充分,将裂解时间提高至10min仍不能充分裂解。5%和10%RIPA均能很好的裂解。考虑实验成本问题,优选裂解液RIPA的浓度为5%(图1B)。
ips细胞自发分化率(图2)统计分析证实,间充质干细胞基质胶在4℃保存7天和3个月后,仍然能够很好地维持ips细胞的生长,ips细胞自发分化率并无明显差异(P>0.05)。
实验结果说明,本发明方法制备得到了人羊膜间充质干细胞基质胶,其可以有效培养人诱导多能干细胞,且可以长时间放置。
实施例2采用本发明基质胶诱导人单个核细胞重编程为人诱导多能干细胞
(一)人单个核细胞的分离和培养
1、试验方法
1.1将脐血采集袋或抗凝管中的脐带血(0.5-2ml)或外周血(5-10ml)转移到无菌离心管中,加入等体积PBS稀释并混匀。
1.2取一支新的离心管,加入Ficoll分离液,将等体积的稀释血缓慢转移至Ficoll层表面,600g室温离心20min。
1.3离心后,吸出白膜层细胞,加入PBS洗一遍,600g离心5min。
1.4用全人源化的红系培养基重悬细胞(基础培养基分别为Stemcell公司的H3000和ACF培养基,再分别添加Peprotech公司的细胞因子SCF 100ng/ml、IL-3 10ng/ml、EPO 2U/ml、IGF-1 40ng/ml、Hydrocortisone 1uM),台盼蓝染色计数。
1.5细胞转移至细胞培养板中培养。
2、鉴定方法
2.1采用台盼蓝染色法对人单个核细胞体外向红系培养的细胞总数进行分析。
2.2采用流式细胞术对人单个核细胞体外向红系培养后的表面标志物CD71、GPA、CD34、CD3、CD19、CD15、CD14进行分析鉴定。
2.3采用May-Grunwald Giemsa(MGG)染色法鉴定人单个核细胞体外向红系培养后的细胞类型。
3、实验结果
3.1台盼蓝染色计数证实,细胞总数经过一个先下降再升高的培养阶段(见图3)。脐带血单个核细胞(CBMNC)在培养第3天细胞总数达到最低,随后开始上升,第7天后进入指数增长期;外周血单个核细胞(PBMNC)在培养第5-7天细胞总数达到低谷随后开始上升,H3000培养基组第9天进入指数增长期,ACF培养基组增长缓慢。优选地,取指数增长期细胞进行重编程(CBMNC为红系扩增第8天,PBMNC为红系扩增第12天)。
3.2图4所示,CBMNC经两种培养基培养7天后,绝大多数为有核红细胞(CD71+/GPA+),不含淋巴细胞(CD3-/CD19-),含有少量的造血干祖细胞(CD34)、单核细胞和粒细胞(CD15/CD14);PBMNC经两种培养基培养11天后,CD71+/GPA+比例有差异(H3000组高于ACF组),不含或少量含有淋巴细胞、造血干祖细胞、单核细胞和粒细胞。
如图5所示,MGG染色发现,四个实验组中细胞大多为红细胞,含有少量的巨噬细胞、粒细胞等。
结论:通过本培养方法,人单个核细胞无需细胞分选,经过全人源化的诱导培养后能够得到较纯的有核红细胞。综合分析,H3000培养基更有利于人单个核细胞向红系分化扩增。
(二)重编程
1、实验方法
取步骤(一)经红系培养基培养后的细胞,台盼蓝染色计数,取200万细胞,按照Lonza公司的Human CD34+CellKit操作说明加入82ul基础电转液和18ul电转添加剂。再加入8ug pEB-C5和2ug pEB-Tg,混匀后转入电转杯,使用Lonza公司的细胞核电转仪NucleofectorTM 2b(电转程序U-008)进行转染。转染后细胞悬液分别转入人脐带间充质干细胞基质胶(用脐带间充质干细胞按照实施例1的方法制备的基质胶)、人羊膜间充质干细胞基质胶(本发明实施例1的方法制备)、VTN-N(Vitronectin商品化基质胶,购买于Life Technologies公司)上诱导培养,培养基为红系培养基,并加入终浓度为10uM的Rock通路抑制剂Y-27632。
转染后第2天(DAY2)每孔补加红系培养基1ml,第3天每孔补加ReproTeSR培养基1ml,第7天更换新鲜ReproTeSR培养基,此后每天换液。
整个重编程过程流程图如图6所示。
2、实验结果
2.1转染后第7-10天,所有实验组在显微镜下均可见有细胞聚团生长(图7A)。
2.2转染后第14-20天,所有实验组在显微镜下可见细胞团变大,形成明显的ips样的克隆(图7B)。用无菌枪头将单个克隆轻轻挑取,分别转移至实施例1制备的人间充质干细胞基质胶包被的细胞培养板上,用life Technologies公司的Essential 8TM培养基培养。当细胞培养后5-12天,用0.5mM EDTA消化,在实施例1制备的人羊膜间充质干细胞基质胶上连续培养超过10代,iPSCs仍然能够保持hESCs样的形态(图7C)。
2.3重编程效率统计(图8)分析,UC-MSCs基质胶组的诱导效率明显低于对照组VTN-N,而AM-MSCs基质胶组的诱导效率与对照组VTN-N无明显差异(PBMNC ACF组除外)(*P<0.05,**P<0.01)。由此可见,经筛选后的H3000培养基培养CBMNC和PBMNC后,在AM-MSCs基质胶上重编程效率与VTN-N相似。
实验结果说明,以本发明人羊膜间充质干细胞基质胶作为基质胶,可以有效诱导人单个核细胞重编程为人诱导多能干细胞,且诱导效率与市售的VTN-N相当,显著高于人脐带间充质干细胞基质胶。
实施例3采用本发明人羊膜间充质干细胞基质胶培养本发明重编程得到的iPSCs
1.PCR法检测外源基因整合情况。
实验方法:
将实施例2中重编程得到的ips克隆,在实施例1制备的人羊膜间充质干细胞基质胶上连续培养至P5、P7、P12,用Tiangen公司的细胞基因组DNA提取试剂盒分别提取基因组DNA,用Thermo公司的Nanodrop 2000超微量分光光度计测定浓度。以质粒骨架EBNA为检测对象,以GAPDH为看家基因,PCR法检测外源基因整合至基因组DNA情况。
实验结果:
如图9所示,iPSCs P5和P7代基因组DNA能检测到质粒骨架EBNA,但是iPSCs P7组电泳条带弱于iPSCs P5组,说明外源基因在逐渐丢失。而iPSCs P12未能检测出EBNA,阳性对照组(转染2天后的细胞、质粒pEB-C5、pEB-Tg)均能检测出高表达的EBNA。实验证实经过传代培养后,iPSCs的外源基因逐渐完全丢失。
2.Real-time PCR检测内源性基因表达
实验方法:
将实施例2重编程得到的iPSCs在实施例1制备的人羊膜间充质干细胞基质胶上连续培养至P12,以人胚胎干细胞H1细胞系P60(H1hESCs P60)为对照,trizol法提取两种细胞总RNA,再使用Roche公司的Transcriptor cDNA SynthKit反转录为cDNA,用Thermo公司的Nanodrop 2000超微量分光光度计测定浓度。
设计含有基因3’-UTR区域的引物,扩增内源性OCT4和NANOG基因,以GAPDH为内参基因,以iPSCs P12和H1hESCs P60为模板,Real-time PCR检测内源性基因表达。
实验结果:
如图10所示,两者的OCT4和NANOG基因内源性表达相似,无明显差异(P>0.05)。实验证实,重编程后iPS细胞已启动自身内源性的多能基因OCT4和NANOG的表达。
3.免疫荧光检测多能marker
实验方法:
将实施例2重编程得到的iPSCs在实施例1制备的人羊膜间充质干细胞基质胶上连续培养10代后,用细胞免疫荧光化学法鉴定多能marker:用0.5mM EDTA消化iPSCs,传代至24孔培养板中培养2-3天,弃Essential 8TM培养基,用4%多聚甲醛固定,一抗分别为Abcam公司的兔抗人OCT4、兔抗人SOX2、兔抗人NANOG、鼠抗人SSEA4、鼠抗人TRA-1-60和鼠抗人TRA-1-81。用DAPI染细胞核。染色后细胞避光保存,置于倒置荧光显微镜下观察拍照。
实验结果:
如图11所示,iPSCs多能marker鉴定为阳性(均表达OCT4、SOX2、NANOG、SSEA4、TRA-1-60和TRA-1-81)。
4.染色体核型分析
实验方法:
将实施例2重编程得到的iPSCs在实施例1制备的人羊膜间充质干细胞基质胶上连续培养10代后,用0.5mM EDTA消化iPSCs,传代培养2-3天。加入0.1ug/ml秋水仙素作用2h使细胞停留在细胞分裂中后期,PBS洗2次。0.05%胰酶消化,1000r/min离心10min,经0.075%KCl低渗处理、固定、滴片后,用Giemsa染色。显微镜下观察并记录至少10个分裂相。
实验结果:
如图12所示,核型分析结果未见异常(46,XX),证实iPSCs在人羊膜间充质细胞基质胶中连续培养10代后仍然能够保持正常的染色体核型。
5.畸胎瘤实验
实验方法:
将实施例2重编程得到的iPSCs在实施例1制备的人羊膜间充质干细胞基质胶上连续培养10代后,用Collagenase IV处理细胞。处理后离心,用DMEM/F12重悬,注射至NOD-SCID小鼠背部两侧皮下。注射后饲养9周左右观察成瘤情况。成瘤后处死小鼠,取出畸胎瘤,进行石蜡包埋切片和HE染色。观察其向三个胚层的分化情况。
实验结果:
如图13所示,本发明重编程得到的iPSCs在小鼠体内可以形成畸胎瘤,切片染色发现其有管腺样组织(图13A)、神经样组织(图13B)和肌肉样组织(图13C)形成。
实验结果说明,以本发明人羊膜间充质干细胞基质胶作为基质胶,的确可以有效诱导人单个核细胞重编程为人诱导多能干细胞,而且采用本发明人羊膜间充质干细胞基质胶培养人诱导多能干细胞,可以维持人诱导多能干细胞的全能性。
综上,以本发明人羊膜间充质干细胞基质胶作为基质胶,可以有效诱导人单个核细胞重编程为人诱导多能干细胞,且可以有效维持人诱导多能干细胞的全能性,同时,其保质期长,制备方法简单,成本低廉;另外,本发明方法使用Episomal质粒介导和人羊膜间充质干细胞基质胶包被方法,将人脐带血和外周血单个核细胞重编程为人诱导多能干细胞,即避开了病毒、外源基因对细胞基因组的污染,也免除了非人源化的异种因子污染和动物病原体的传播风险。
- 还没有人留言评论。精彩留言会获得点赞!