一种免疫原HM4‑M2e及其制备方法与应用与流程
本发明涉及一种免疫原HM4-M2e及其制备方法与应用,属于生物
技术领域:
。
背景技术:
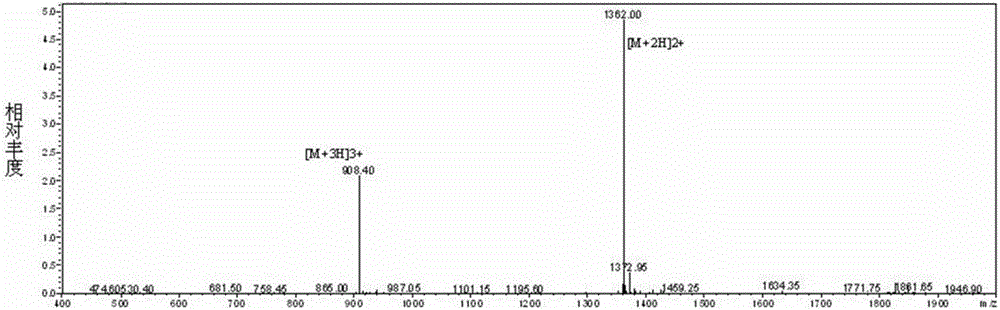
:合成肽疫苗(Syntheticpeptidevaccine)是用化学方法合成的病毒保护性抗原多肽疫苗,其安全性好,不会受到病原微生物的污染,且易保存和控制质量。但是合成肽疫苗一般分子量较小且只针对单一抗原位点,免疫原性较差,对序列依赖性的抗原位点免疫效果较好,对构象依赖性位点则较差。乙肝病毒核心蛋白HBc(HepatitisBviruscoreprotein,HBc)由于其天然的颗粒组装能力和特异性激发针对外源表位的体液免疫和细胞免疫的特性,成为载体蛋白研究的热点。近年来,HBc颗粒的应用方面已经有了较成熟研究结果。乙型肝炎病毒核心抗原HBc蛋白由183-185个氨基酸残基(各亚型之间稍有不同)组成,相对分子质量为21000Da,其C端富含精氨酸,有结合核酸RNA的能力,并与其组装成乙肝核心颗粒有关,同时也含有多种蛋白酶作用位点,N端的1~144位氨基酸残基是真正的颗粒装配区。疫苗研究中以HBc作为载体的疫苗抗原有很多,如乙肝病毒表面抗原、人乳头瘤病毒E7蛋白、B群链球菌CPS糖蛋白等,在临床前实验研究中已观察到肯定的疗效。因此,发展以HBc颗粒为载体的流感病毒表位疫苗研究具有很好的前景和应用价值。甲型流感病毒为分节段的单股负链RNA病毒,基因组含8个节段,第7个节段RNA编码M1和M2蛋白。其中M2蛋白是除HA和NA以外的第3个外膜蛋白,从N端到C端依次为:含23个氨基酸的胞外区(M2e)、含19个氨基酸的疏水性跨膜区和含54个氨基酸的胞内区。天然状态下M2以同源四聚体的形式存在于流感病毒表面,每个病毒粒子仅含14~68个M2分子,但感染流感病毒的细胞表面分布着大量M2分子,具有质子通道的作用,在病毒侵染时能降低病毒颗粒内部的pH值,帮助病毒释放RNA。技术实现要素:本发明的第一个目的是提供一种多肽。本发明提供的多肽是如下a)或b)或c)的蛋白质:a)氨基酸序列是序列表中序列1所示的蛋白质;b)在序列表中序列1所示的蛋白质的N端和/或C端连接标签得到的融合蛋白质;c)将序列表中序列1所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质。本发明的第二个目的是提供一种偶联物。本发明提供的偶联物为将上述多肽与载体蛋白通过交联剂交联得到的物质;所述多肽和所述载体蛋白的结合率为(1-3):1。上述偶联物中,所述交联剂为SMCC;所述载体蛋白为乙肝病毒核心蛋白HM4;所述乙肝病毒核心蛋白HM4的氨基酸是如下d)或e)或f)的蛋白质:d)氨基酸序列是序列表中序列2所示的蛋白质;e)在序列表中序列2所示的蛋白质的N端和/或C端连接标签得到的融合蛋白质;f)将序列表中序列2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质。本发明的第三个目的是一种偶联物的制备方法。本发明提供的偶联物的制备方法为将上述多肽、载体蛋白和交联剂混匀,反应,得到偶联物。上述方法中,所述交联剂为SMCC;所述载体蛋白为乙肝病毒核心蛋白HM4;所述乙肝病毒核心蛋白HM4的氨基酸是如下d)或e)或f)的蛋白质:d)氨基酸序列是序列表中序列2所示的蛋白质;e)在序列表中序列2所示的蛋白质的N端和/或C端连接标签得到的融合蛋白质;f)将序列表中序列2所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有相同功能的蛋白质。上述方法中,所述多肽、所述载体蛋白和所述SMCC的摩尔量比为1:1:30。上述方法中,所述偶联物的制备方法为将多肽溶液、载体蛋白溶液和SMCC溶液混匀,反应,得到偶联物;所述多肽溶液是将上述多肽与PBS缓冲液混匀得到的溶液,所述多肽溶液的浓度为3mg/mL。所述载体蛋白溶液是将所述乙肝病毒核心蛋白HM4与PBS缓冲液混匀得到的溶液,所述载体蛋白溶液的浓度为1.5mg/ml。所述SMCC溶液是将SMCC与DMF(溶剂)混匀得到的溶液,所述SMCC溶液中SMCC浓度为20mg/mL。本发明的第四个目的是提供上述偶联物或由上述方法制备得到的偶联物的新用途。本发明提供了上述偶联物或由上述方法制备得到的偶联物在制备流感疫苗中的应用。本发明的第五个目的是提供一种产品。本发明提供的产品的活性成分为上述偶联物或由上述方法制备得到的偶联物;所述产品具有如下功能:制备流感疫苗。本发明的第六个目的是提供一种流感疫苗。本发明提供的流感疫苗的活性成分为上述产品。上述疫苗中,所述疫苗由权利要求7所述的产品和佐剂组成;所述佐剂为氢氧化铝佐剂;所述产品和所述佐剂的质量比为1:25。上述应用或上述产品或上述流感疫苗中,所述流感疫苗为甲型流感疫苗。本发明以乙肝病毒核心蛋白HM4为载体蛋白,通过SMCC(4-[N-马来酰亚胺甲基]环己烷-1-羧酸琥珀酰亚胺酯)与本发明设计合成的多肽M2e相交联,得到免疫原HM4-M2e。通过实验证明:将制备的免疫原HM4-M2e作为流感疫苗的有效成分,并以适宜的免疫佐剂作为辅料制成的药物有很好的免疫效果。且本发明所使用的载体蛋白适合于大规模工业化生产的优点,同时交联率高,制备时间短,降低了生产成本。附图说明图1为多肽M2A6的纯度检测。图2为多肽M2A6的分子量检测。图3为多肽M2A6与载体蛋白HM4结合的SDS-PAGE图。其中,1:载体蛋白HM4与多肽M2A6结合前样品;2:免疫原HM4-M2A6;3:载体蛋白HM4标品。图4为HM4载体蛋白、免疫原HM4-M2A6和marker的变性毛细管电泳的检测图谱。其中,图4A为Marker的变性毛细管电泳的检测图谱;图4B为载体蛋白HM4的变性毛细管电泳的检测图谱;图4C为HM4-M2A6免疫原的变性毛细管电泳的检测图谱。其中,横坐标为保留时间(min),纵坐标为吸光度值(AU)。图5为多肽M2e、HM4包板检测HM4-M2A6结合疫苗免疫血清ELISA抗体效价。图6为感染A/FM/1/47(H1N1)流感病毒后各组小鼠生存曲线图。图7为感染A/FM/1/47(H1N1)流感病毒后各组小鼠体重变化图。图8为感染A/PR/8/34(H1N1)流感病毒后各组小鼠生存曲线图。图9为感染A/PR/8/34(H1N1)流感病毒后各组小鼠体重变化图。图10为感染A/Victoria/3/75(H3N2)流感病毒后各组小鼠生存曲线图。图11为感染A/Victoria/3/75(H3N2)流感病毒后各组小鼠体重变化图。图12为感染A/Aichi/2/68(H3N2)流感病毒后各组小鼠生存曲线图。图13为感染A/Aichi/2/68(H3N2)流感病毒后各组小鼠体重变化图。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中的主要试剂及其购买处如下:保护氨基酸(Fmoc氨基酸),HCTU和RinkAmide-MBHA树脂:上海吉尔生化有限公司;乙腈和苯甲醚:sigma公司;二甲基甲酰胺(DMF),二氯甲烷,无水乙醚和三氟乙酸:天津科密欧公司;N-甲基吗啉和乙二硫醇:Fluka公司;N,N-二异丙基乙胺和哌啶:国药集团;异型双功能交联剂SMCC:Sigma-Aldrich公司;蛋白marker:Thermo公司;辣根过氧化物酶标羊抗鼠二抗(HRP-IgG鼠二抗:1:40K稀释):Sigma公司;浓缩洗液(20×):北京万泰生物技术有限公司;底物A+B:北京万泰生物技术有限公司;终止液:北京万泰生物技术有限公司;氢氧化铝佐剂:丹麦Brenntag公司;封闭液:美国BD公司。下述实施例中的主要仪器设备及其购买处如下:酶标板:costar公司;Prelude多肽合成仪:美国PTI公司;安捷伦1260制备色谱仪:安捷伦科技有限公司;1525液相色谱仪:Waters公司;RE-52AA旋转蒸发仪:上海亚荣生化仪器厂;SHB-B88多功能循环水真空泵:郑州长城科技工贸有限公司;一次性层析柱:Thermo公司;HYG-A全恒温摇瓶柜:太仓市实验设备厂;电泳仪DYY-6C型:北京市六一仪器厂;紫外分光光度计:美国通用电气医疗公司;酶标仪:美国MD公司;电子天平:德国Sartorius公司;10kDa超滤管:德国Sartorius公司;微量移液器:德国Eppendorf公司产品。实施例1、多肽M2A6的设计及合成一、多肽M2A6的设计本发明通过从NCBI中共比对约13000条流感毒株的序列,设计了一条多肽M2e,其氨基酸序列如序列1所示,并将其命名为多肽M2A6。二、多肽M2A6的合成本发明采用多肽固相合成法合成多肽M2A6,基于Fmoc化学合成,先将所要合成的目标多肽的C-端氨基酸的羧基以共价键形式与一个不溶性的高分子树脂相连,然后以这一氨基酸的氨基作为多肽合成的起点,同其它的氨基酸已经活化的羧基作用形成肽键,不断重复这一过程,由C端向N端合成,即可得到多肽。具体步骤如下:1、树脂选择:使用Rink-AmideMBHA树脂,取代度为0.58mmol/g,树脂用量为86mg。2、氨基酸连接:每轮氨基酸连接的步骤和条件如下:①脱保护:向反应器中加入3mL体积分数为20%哌啶溶液(哌啶溶液为将哌啶溶于DMF中得到的溶液),氮气鼓泡搅拌反应2min,然后排干哌啶溶液;再次向反应器中加入3mL体积分数为20%哌啶溶液,氮气鼓泡搅拌反应2min,然后排干哌啶溶液。②DMF洗涤:向反应器中加入3mLDMF,氮气鼓泡搅拌反应1min,然后排干DMF;再次加入3mLDMF,氮气鼓泡搅拌反应1min,然后排干DMF,重复5次。③先加入2mL浓度为100mMFmoc氨基酸溶液(Fmoc氨基酸溶于DMF中得到的溶液),然后再加入2mL100mMHCTU溶液(HCTU和N-甲基吗啉溶于DMF中得到的溶液,N-甲基吗啉浓度为200mM),氮气鼓泡搅拌反应10min,然后排干溶液。④DMF洗涤:向反应器中加入5mLDMF,氮气鼓泡搅拌反应1min,然后排干DMF。⑤先加入2mL浓度为100mMFmoc氨基酸溶液,然后再加入2mL100mMHCTU溶液,氮气鼓泡搅拌反应10min,然后排干溶液。⑥DMF洗涤:向反应器中加入3mLDMF,氮气鼓泡搅拌反应1min,然后排干DMF;再次加入3mLDMF,氮气鼓泡搅拌反应1min,然后排干DMF,重复5次。3、切割多肽条件:多肽序列中的所有氨基酸连接完成后,按1mL/10mg树脂的比例加入切割液。切割液组成:三氟乙酸:水:苯甲醚:乙二硫醇=95:2:2:1(体积比),氮气鼓泡搅拌反应2h。4、收集粗肽:切割反应结束后,收集切割液,按5毫升无水乙醚/毫升切割液的比例加入经过预冷的无水乙醚,加入无水乙醚后,摇匀,-20℃冰箱中静置8h。然后5000rpm,离心10min,倒去上清液;向沉淀中加入40mL无水乙醚,摇床上震荡洗涤2h;然后5000rpm,离心10min,倒去上清液,下层沉淀使用氮气吹干,然后37℃烘箱中干燥12h,即可获得粗肽。5、粗肽纯化与冻干:使用安捷伦1260制备色谱仪纯化粗肽,柱子为AgilentC18column(21.2×150mm);流动相A:含0.1%TFA的水,流动相B:含0.1%TFA的乙腈;流速10mL/min,梯度洗脱条件为乙腈浓度30min内由16%升至72%,检测器波长为214nm,280nm;收集目标多肽(保留时间约12min时的组分)。收集的目标多肽50℃减压除去乙腈后立刻-80℃冷冻,然后冷冻干燥,干燥后多肽贮存于-80℃备用。6、多肽纯度和分子量检测:使用电喷雾质谱仪(WatersZQ2000质谱仪)检测步骤5纯化获得的多肽的分子量,并使用WatersHPLC检测纯化后的多肽的纯度,柱子SunfireTMC18column(5μm,250×4.6mm),流速0.5mL/min,梯度洗脱条件为乙腈浓度20min内由30%升至60%。多肽的纯度的检测结果如图1所示。根据图1可以看出,合成的多肽M2A6的纯度为99%。多肽分子量的检测结果如图2所示。根据图2可以看出:合成的多肽M2A6的分子量为2723。实施例2、免疫原HM4-M2A6的制备一、免疫原HM4-M2e的制备方法1、溶液的制备(1)载体蛋白溶液的制备:以HM4蛋白(HM4蛋白的氨基酸序列如序列表中序列2所示)作为载体蛋白,PBS缓冲液(20mM磷酸盐、150mM氯化钠,pH7.4)作为溶剂,制备载体蛋白溶液,得到浓度为1.5mg/ml的载体蛋白溶液;(2)SMCC溶液的制备:按30×过量计算,称取3.3mg的异型双功能交联剂SMCC溶于165μL的DMF溶液中,得到浓度为20mg/mL的SMCC溶液;(3)目的肽溶液的制备:按1×计算,称取0.45mg的上述实施例1制备的多肽M2A6溶于150μL的PBS缓冲液中,得到浓度为3mg/mL的目的肽溶液。2、分别取1mL的步骤1中的(1)制备的载体蛋白溶液至编号为1、2、3的2mLEP管中,再取500μL样品作为对照;3、向编号为1、2、3的2mLEP管中分别加入50μL步骤1中的(2)制备的SMCC溶液,常温反应2h或4度过夜;4、利用G25一次性脱盐柱除去过量SMCC溶液,按照0.5mL/管收集洗脱液,并使用紫外分光光度计检测样品蛋白浓度(浓度约为1mg/mL),收集合并目标产物;5、收集后的样品同样对应编号为1、2、3,分别加入50μL步骤1中的(3)制备的目的肽溶液,常温反应3h或4度过夜,得到反应液。其中,多肽M2A6、载体蛋白HM4和SMCC的摩尔量比为1:1:30。6、将步骤5的反应液于12000rpm、4℃离心10min,去除沉淀,收集上清液,并使用10kDa超滤管除去上清液中的多余的多肽、SMCC等小分子物质,得到免疫原HM4-M2A6。利用SDS-PAGE检测免疫原HM4-M2A6,结果如图3所示。其中,M:marker;1:载体蛋白HM4与多肽M2A6结合前样品,上样量1.0mg/ml×7μL=7μg;2:免疫原HM4-M2A6,上样量0.8mg/mL×10μL=8μg;3:载体蛋白HM4标品,上样量1.5mg/mL×5μL=7.5μg。从图中可以看出:免疫原HM4-M2e的大小为17kDa、19kDa、35-40kDa。二、结合率的测定通过毛细管电泳(CE)来分析计算HM4蛋白与多肽M2A6的结合率,本发明所指的结合率是指每一个载体蛋白HM4上所结合的M2A6分子的个数。具体检测的条件如下:30.2cm×50μm裸毛细管;进样条件为60s,5.0kV;分离条件为30min,15.0kV;检测波长为:220nm,检测温度为25℃。处理好的样品含有蛋白的最终浓度应为0.2-2mg/mL。以载体蛋白HM4、HM4-M2A6免疫原和marker的变性毛细管电泳(CE)图谱结果如图4所示。其中,图4A为Marker的变性毛细管电泳的检测图谱,峰值分别为:10kDa(a)、20kDa(b)、35kDa(c)、50kDa(d)、100kDa(e)、150kDa(f)、225kDa(f);图4B为载体蛋白HM4的变性毛细管电泳的检测图谱;图4C为HM4-M2A6免疫原的变性毛细管电泳的检测图谱。从图4中可以看出:载体蛋白HM4的检测图谱线是典型的毛细管电泳图谱,有单体吸收峰14kDa和二聚体吸收峰28kDa;与单纯的载体蛋白HM4图谱相比较,当载体蛋白HM4作为一个载体与M2A6多肽结合形成一个新的结合蛋白即HM4-M2A6免疫原的检测图谱中,HM4-M2A6免疫原出现了新吸收峰,HM4-M2A6免疫原(HM4蛋白与多肽M2A6形成的结合蛋白)比单纯一个HM4蛋白分子其分子量增加了2-6kDa,这说明一个载体蛋白HM4结合了大约2个(1个、2个或3个)M2A6多肽分子。实施例3、HM4-M2A6结合疫苗的制备及其免疫效果一、HM4-M2A6结合疫苗的制备用PBS缓冲液(20mM磷酸盐、150mM氯化钠,pH7.4)将步骤一制备得到的免疫原HM4-M2A6进行稀释,使其浓度为250μg/mL,然后再缓慢加入氢氧化铝佐剂,使氢氧化铝佐剂终浓度为2.5mg/mL,滴加过程中同时缓慢摇晃样品。加完氢氧化铝后,密封好样品,置于2~8℃缓慢摇晃吸附16h后,将其稀释至抗原终浓度为100μg/mL,得到HM4-M2A6结合疫苗。二、抗体滴度的检测(1)免疫方式采用腹腔注射的免疫方式注射步骤1制备的HM4-M2A6结合疫苗。免疫剂量50μg/0.5mL/只/次。实验动物信息如表1所示。表1、实验动物信息表动物品系性别体重周龄数量(只)Balb/c小鼠雌性18~22g6~8周10(2)免疫程序A动物数量:使用HM4-M2A6结合疫苗免疫Balb/c小鼠,共10只;B免疫方式及剂量:腹腔注射,50μg/0.5mL/只/次;C免疫程序:0d、14d两针免疫,21d采血。(3)检测采用酶联免疫吸附法ELISA法分别以多肽M2A6和载体蛋白HM4为抗原包板检测HM4-M2A6结合疫苗免疫小鼠血清ELISA抗体效价(IgG)。具体为:取96孔酶标板,用0.05MTris-NaCl(pH8.5)缓冲液将抗原(多肽M2A6或载体蛋白HM4)稀释至2.5μg/mL,100μL/孔,2~8℃过夜包被。洗板2次。加封闭液200μL/孔、37℃封闭2.5h。洗板2次。加入一抗:一抗为检测用Balb/c小鼠血清,从300倍开始梯度稀释,方法如下:血清样品各150μL加入包被板的第1行中,其余所有孔均加入100μL样品稀释液,之后从第1行吸取50μL各样品从上到下进行3倍倍比梯度稀释,至最后一行混匀后吸取50μL弃去。共稀释8个梯度,37℃反应1h。洗板5次。加入二抗:HRP-IgG鼠二抗:1:10K稀释,37℃反应1h。洗板5次。显色,终止。使用酶标仪在OD450处读数并计算Cutoff值=2.1×OD450值。结果判定:大于Cutoff值判为阳性。使用Excel及GraphPadPrism5软件对实验结果进行分析。(5)结果分析结果如图5所示:从图中可以看出,使用多肽M2A6包板检测HM4-M2A6结合疫苗免疫小鼠血清ELISA抗体效价(IgG),其GMT为113130;使用载体蛋白HM4包板检测HM4-M2A6结合疫苗免疫小鼠血清ELISA抗体效价(IgG),其GMT为35047。结果表明:使用本发明所制备的HM4-M2A6结合疫苗以100μg蛋白/只的剂量经腹腔免疫接种Balb/c小鼠后产生了高滴度的IgG抗体。说明本发明所制备的疫苗能够刺激机体产生较强的免疫原性。三、攻毒保护检测1、攻击毒株攻击毒株1为流感毒株A/FM/1/47(H1N1)(血凝滴度1:1280),批号:W-A1201301,公众可从华兰生物疫苗有限公司获得。该毒株对Balb/c小鼠的毒力:4.0lgMLD50/mL;攻毒剂量:100μL/只。攻击毒株2为流感毒株A/PR/8/34(H1N1)(血凝滴度1:16),批号:PR/8-3,公众可从华兰生物疫苗有限公司获得。该毒株对Balb/c小鼠的毒力:3.0lgMLD50/mL;攻毒剂量:100μL/只。攻击毒株3为流感毒株A/Victoria/3/75(H3N2)(血凝滴度1:640),批号:W-A3201401,公众可从华兰生物疫苗有限公司获得。该毒株对Balb/c小鼠的毒力:2.6lgMLD50/mL;攻毒剂量:100μL/只。攻击毒株4为流感毒株A/Aichi/2/68(H3N2)鼠肺适应株(滴度:3.8×106PFU/ml),批号:20141222,公众可从华兰生物疫苗有限公司获得。该毒株对Balb/c小鼠的毒力:2.6lgMLD50/mL;攻毒剂量:100μL/只。2、实验方法①动物分组:根据免疫样品及攻击毒株不同将小鼠随机分为8组(动物分组如表3所示),10只/组,雌性各半,实验动物信息如表2所示。免疫样品分别为HM4-M2A6结合疫苗组和PBS溶剂组(PBS溶剂的配方:20mM磷酸盐、150mM氯化钠,pH7.4);攻击毒株为上述4株病毒:攻击毒株1、攻击毒株2、攻击毒株3和攻击毒株4。表2实验动物信息表动物品系性别体重周龄数量(只)Balb/c小鼠雌性18~22g6~8周80表3实验分组表②疫苗免疫方式及剂量:腹腔注射,50μg/0.5mL/只/次;③实验操作:0天、14天两针免疫,首次免疫后21天,小鼠经乙醚麻醉后鼻腔攻毒,逐日观察并记录攻毒后14天内小鼠的体重变化和死亡情况。3、结果分析图6和图7分别为感染A/FM/1/47(H1N1)流感病毒后各组小鼠生存曲线图和体重变化图。由图6、图7可知,攻毒后,HM4-M2A6结合疫苗组小鼠体重稍有下降后上升,且小鼠100%存活;PBS溶剂组小鼠体重持续下降,于攻毒后第8天小鼠全部死亡。图8和图9分别为感染A/PR/8/34(H1N1)流感病毒后各组小鼠生存曲线图和体重变化图。由图8、图9可知,攻毒后,HM4-M2A6结合疫苗组小鼠体重降低至第6天后上升,且小鼠100%存活;PBS溶剂组小鼠体重持续下降,于攻毒后第9天小鼠全部死亡。图10和图11分别为感染A/Victoria/3/75(H3N2)流感病毒后各组小鼠生存曲线图和体重变化图。由图10、图11可知,攻毒后,HM4-M2A6结合疫苗组小鼠体重下降,且部分小鼠无法抵抗病毒的攻击而死亡,至攻毒后第7天,小鼠体重开始上升,攻毒观察期结束,小鼠40%存活;PBS溶剂组小鼠体重持续下降,于攻毒后第9天小鼠全部死亡。图12和图13分别为感染A/Aichi/2/68(H3N2)流感病毒后各组小鼠生存曲线图和体重变化图。由图12、图13可知,攻毒后,HM4-M2A6结合疫苗苗组小鼠体重稍有下降后上升,且小鼠100%存活;PBS溶剂组小鼠体重持续下降,于攻毒后第9天小鼠全部死亡。综上所述,HM4-M2A6结合疫苗以100μg蛋白/只的剂量经腹腔免疫接种Balb/c小鼠,首免后21天分别滴鼻感染A/FM/1/47(H1N1)、A/PR/8/34(H1N1)、A/Victoria/3/75(H3N2)和A/Aichi/2/68(H3N2)流感病毒,生存率分别为100%、100%、40%、100%。说明HM4-M2A6结合疫苗可以保护100%小鼠抵抗A/FM/1/47(H1N1)、A/PR/8/34(H1N1)和A/Aichi/2/68(H3N2)三种流感病毒的感染,可以保护40%小鼠抵抗A/Victoria/3/75(H3N2)流感病毒的感染。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1