一种伊曲茶碱新制备方法与流程
本发明涉及医药化工领域,具体涉及一种伊曲茶碱的制备方法。
背景技术:
伊曲茶碱(Istradefylline)是由日本协和发酵麒麟株式会社(Kyowa Hakko Kirin Co., Ltd.)开发的一种新型抗帕金森药物,于2013年在日本批准上市,商品名NOURIAST。伊曲茶碱是选择性腺苷A2A受体(A2A)阻断剂,通过对纹状体苍白球通路的双重调节作用,逆转基底节直接通路和间接通路的失衡,改善帕金森病的运动困难、延长左旋多巴作用时间,但不增加异动症。伊曲茶碱对黑质多巴胺能神经元有神经保护作用。经临床试验证实,伊曲茶碱是有效治疗帕金森病的新型药物。
伊曲茶碱化学名为:(E)-8-(3,4-二甲氧基苯乙烯基)-1,3-二乙基-7-甲基-3,7-二氢-1H-嘌呤-2,6-二酮,其化学结构式为:
。
文献J. Org. Chem. 2004, 69, 3308-3318.和文献Bioorgan. Med. Chem. 2003, 11, 1299-1310.报道了伊曲茶碱目前常用的制备工艺。其中,文献J. Org. Chem. 2004, 69, 3308-3318.的制备方法是将6-氨基-1,3-二乙基-5-亚硝基-1H-嘧啶-2,4-二酮(化合物II)还原成5,6-二氨基-1,3-二乙基-1H-嘧啶-2,4-二酮(中间体A),然后再与3,4-二甲氧基肉桂酰氯反应得到N-(6-氨基-1,3-二乙基-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)-3-(3,4-二甲氧基苯基)丙烯酰胺(中间体B),最后再关环(得中间体C)、甲基化制备伊曲茶碱。而文献Bioorgan. Med. Chem. 2003, 11, 1299-1310.仅是制备中间体B的方法与文献J. Org. Chem. 2004, 69, 3308-3318.不同,其是将中间体A与3,4-二甲氧基肉桂酸以缩合剂1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(EDAC)进行缩合制备中间体B。具体制备路线如下:
。
此工艺中,化合物II还原所得到的中间体A(5,6-二氨基-1,3-二乙基-1H-嘧啶-2,4-二酮)是一种不稳定的胺类化合物,不易保存;制备中间体B的过程中,所用的3,4-二甲氧基肉桂酰氯需使用氯化亚砜制备,其产生的酸雾不仅对设备腐蚀较大,还是造成臭氧空洞的元凶;而通过3,4-二甲氧基肉桂酸反应的话,则需用到昂贵且原子经济性极差的缩合剂1-(3-二甲基氨基丙基)-3-乙基碳二亚胺(EDAC),并且在后处理过程中产生含氮废水;中间体C的制备中用到了溶剂HMDS(六甲基二硅氮烷),该溶剂价格昂贵,易燃易被氧化,反应条件苛刻,在生产上极不常用。
因此,伊曲茶碱现有常用制备工艺具有工艺难度大、原料成本相对较高、原子经济性差等缺陷,无法满足工业化生产的需求。本发明人针对存在的问题,对伊曲茶碱制备方法进行了详细研究,发现一种原料易得,成本低,操作简单,绿色环保的伊曲茶碱制备方法。
技术实现要素:
本发明的目的是提供一种操作简单,成本低,绿色环保,适用于工业化生产的伊曲茶碱制备方法。
本发明的目的是通过如下技术方案实现的:
一种式(Ⅰ)所示伊曲茶碱的制备方法,其特征在于所述制备方法包括如下步骤:
(a)式(Ⅱ)所示的6-氨基-1,3-二乙基-5-亚硝基-1H-嘧啶-2,4-二酮在溶剂中催化加氢,再成盐得到5,6-二氨基-1,3-二乙基-1H-嘧啶-2,4-二酮盐酸盐(化合物Ⅲ);
(b)化合物(Ⅲ)在缚酸剂的作用下以乙酰氯进行乙酰化,得到N-(6-氨基-1,3-二乙基-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)乙酰胺(化合物Ⅳ);
(c)化合物(Ⅳ)在溶剂中关环,得到1,3-二乙基-8-甲基-1H-嘌呤-2,6(3H,7H)-二酮(化合物Ⅴ);
(d)化合物(Ⅴ)甲基化,得到1,3-二乙基-7,8-二甲基-1H-嘌呤-2,6(3H,7H)-二酮(化合物Ⅵ);
(e)化合物(Ⅵ)与式(Ⅶ)所示的藜芦醛在溶剂中缩合,得到终产物伊曲茶碱。
本发明合成路线如下:
。
其中,步骤(a)中,所述溶剂为甲醇、乙醇、正丙醇、异丙醇、正丁醇或异丁醇;所选加氢催化剂为钯碳,其用量为化合物Ⅱ重量的1%-15%;氢气压力为0.10 MPa-1.0 MPa,反应温度为0℃-50℃,反应时间为4小时-24小时。
所述步骤(b)中,化合物Ⅲ与乙酰氯的摩尔比为1:1.05-2.0;所述缚酸剂为三乙胺,N,N-二异丙基乙胺,吡啶或DBU;反应温度为20℃-40℃,反应时间为1小时-16小时。
所述步骤(c)中,所述溶剂为体积比为1:1的氢氧化钠水溶液和正丙醇的混合溶剂,氢氧化钠水溶液的浓度为0.5 mol/L-5 mol/L,反应温度为70℃-100℃,反应时间为1小时-8小时。
所述步骤(e)中,化合物Ⅵ与化合物Ⅶ的摩尔比为1:1.01-1.5;所述溶剂为乙酸/乙酸酐溶剂,溶剂浓度为10%-50%,化合物Ⅵ与乙酸/乙酸酐溶剂的重量体积比为1:2-15,反应温度为70℃-110℃,反应时间为6小时-24小时。
与现有技术相比,本发明具有以下有益效果:
(1)本方法通过将化合物II制备成5,6-二氨基-1,3-二乙基-1H-嘧啶-2,4-二酮的盐酸盐形式,大大提高了其稳定性。
(2)相对于3,4-二甲氧基肉桂酸或3,4-二甲氧基肉桂酰氯,原料藜芦醛和反应试剂乙酰氯更价廉易得,成本大大降低,且更安全环保。
(3)原有工艺路线的总收率在45%左右,而本发明工艺路线的总收率在65%左右,总收率大幅提高。
附图说明
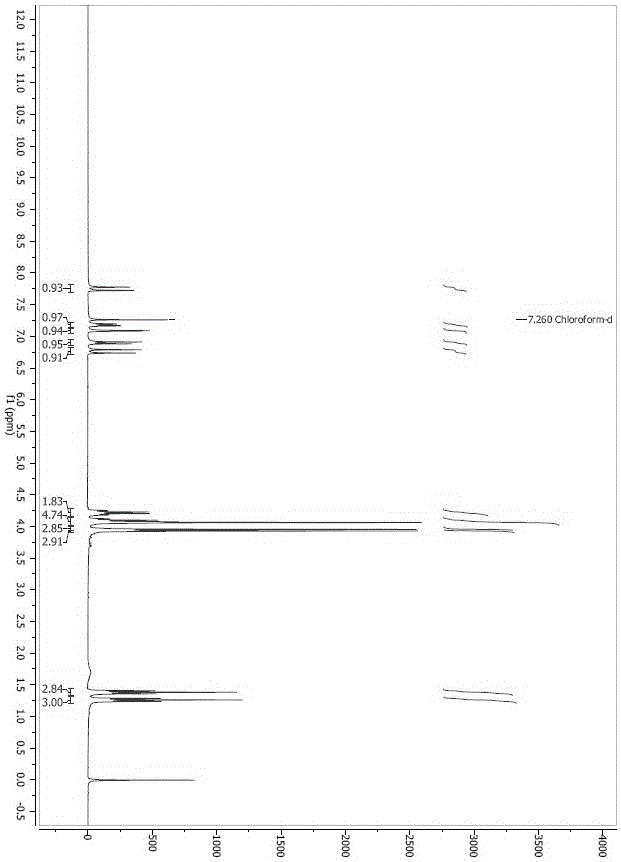
图1为本发明实施例1的伊曲茶碱核磁谱图。
图2为本发明实施例1的伊曲茶碱高效液相色谱图。
具体实施方式
下面结合具体实施例及附图,对本发明作进一步说明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1
化合物III的制备
搅拌下,向反应釜中依次投入6-氨基-1,3-二乙基-5-亚硝基-1H-嘧啶-2,4-二酮(化合物II)(140.0 g, 0.66 mol),甲醇1100 ml和10% Pd/C 20.0 g,控制转速为100 r/min,控制温度在15℃。氢气加压(0.50 MPa-0.60 MPa)反应,TLC监控反应完全。过滤除去Pd/C,并用甲醇洗涤。浓缩后滴加2 mol/L盐酸乙醇溶液。滴毕,10℃以下搅拌析晶。过滤,滤饼用无水乙醇洗涤。收集滤饼,60℃鼓风干燥,得类白色粉末(化合物III)130.1g,收率84%。
化合物IV的制备
搅拌下,向反应瓶中依次加入二氯甲烷500 ml,5,6-二氨基-1,3-二乙基-1H-嘧啶-2,4-二酮盐酸盐(化合物III) (120.0 g, 0.51 mol)和乙酰氯(44.1 g, 0.56 mol)。降温至10 ℃以下。滴加N,N-二异丙基乙胺(230.2 g, 1.78 mol)溶于250 ml的二氯甲烷溶液。滴加完毕,升温至35 ℃,搅拌反应4小时。降温至15 ℃以下,滴加1 mol/L氢氧化钠水溶液1200 ml。滴加完毕,继续搅拌析晶1小时。过滤,滤饼用水洗涤。收集滤饼,80℃鼓风干燥,得类白色固体(化合物IV)115.2 g,收率94%。
化合物V的制备
搅拌下,向反应瓶中依次加入正丙醇315 ml,2 mol/L的氢氧化钠水溶液315 ml和N-(6-氨基-1,3-二乙基-2,4-二氧代-1,2,3,4-四氢嘧啶-5-基)乙酰胺(化合物IV)(105.0 g, 0.44 mol)。升温至回流,搅拌反应5小时。2 mol/L盐酸水溶液调节pH至9-11,控制温度不超过35℃。调节完毕,继续搅拌1.5小时。过滤,滤饼用水洗涤。收集滤饼,80℃鼓风干燥,得淡黄色固体91.2 g(化合物V),收率94%。
化合物VI的制备
搅拌下,向反应瓶中依次加入DMF 400 ml,1,3-二乙基-8-甲基-1H-嘌呤-2,6(3H,7H)-二酮(化合物V)(80.0 g, 0.36 mol)与碳酸钾(99.5 g, 0.72 mol)。滴加碘甲烷(56.2 g, 0.40 mol)溶于100 ml DMF的溶液。滴加完毕,升温至50℃-60℃,搅拌反应3小时。反应完毕,加入浓氨水淬灭反应。冷却析晶4小时。过滤,滤饼用水洗涤。收集滤饼,60 ℃鼓风干燥,得类白色固体(化合物VI)80.5 g,收率95%。
伊曲茶碱的制备
搅拌下,向反应瓶中依次加入乙酸56 ml,乙酸酐560 ml,1,3-二乙基-7,8-二甲基-1H-嘌呤-2,6(3H,7H)-二酮(化合物VI)(70.0 g, 0.30 mol)与藜芦醛(54.2 g, 0.33 mol)。升温至110℃,搅拌反应10小时,TLC监控反应完全。冷却后滴加20%氢氧化钠水溶液调节体系pH=8-9,控制温度不高于30 ℃。滴加完毕,搅拌析晶2小时。过滤,滤饼用水洗涤。收集滤饼,滤饼用400 ml水打浆一次。过滤,滤饼用水、乙醇一次洗涤。收集滤饼,70℃鼓风干燥,得淡黄绿色粉末(化合物I)104.5 g,收率92%,HPLC纯度99.9%。1H NMR (400 MHz, CDCl3) δ 7.75 (d, J = 15.7 Hz, 1H), 7.18 (dd, J = 8.3, 1.6 Hz, 1H), 7.09 (s, 1H), 6.90 (d, J = 8.3 Hz, 1H), 6.76 (d, J = 15.7 Hz, 1H), 4.21 (q, J = 7.0 Hz, 2H), 4.01-4.15 (m, 5H), 3.95 (s, 3H), 3.93 (s, 3H), 1.38 (t, J = 7.1 Hz, 3H), 1.26 (t, J = 7.0 Hz, 3H)。
- 还没有人留言评论。精彩留言会获得点赞!