尖孢镰刀菌甘薯专化型非致病突变菌株的制作方法
本发明具体涉及一种尖孢镰刀菌甘薯专化型非致病突变菌株。
背景技术:
甘薯蔓割病是由尖孢镰刀菌甘薯专化型Fusarium oxysporum f.sp.batatas引起的甘薯维管束真菌病害。此病在我国主要分布在东南沿海各省,其中在浙江、福建危害最为严重,一般能使甘薯减产10%~20%,重者达50%。现有甘薯生产上采用最为主要的防治手段就是选育抗病品种,但是实际育种中总是难以将优良的生产性状与抗病性状相结合,如在福建连城大规模种植的“90日早”、“岩薯7-3”不抗薯割病,需要采用药剂等其他措施进行甘薯蔓割病的防治。随着人们对食品和环境安全要求的提高,生物防治作为一种绿色安全的措施越来越受到人们的重视,因而,探索甘薯蔓割病的生物防治技术有利于促进甘薯产业的发展。
现阶段尖孢镰刀菌生防因子种类包括真菌(木霉Trichoderma、丛枝菌根真菌Arbuscular mycorrhizae、非致病尖孢镰刀菌nonpathogenic Fusarium oxysporum、淡紫拟青霉Paecilomyces lilacinus),细菌(假单胞杆菌Pseudomonas、芽胞杆菌Bacillus)、植物提取物、放线菌等。由于非致病型镰刀菌菌株和致病菌株需要相似的生态条件,有相似的定殖行为和营养需求,可与致病型菌株产生更强的竞争作用,因而镰刀菌非致病菌株是防效最好、最稳定的生防因子之一。
技术实现要素:
本发明要解决的技术问题,在于提供一种尖孢镰刀菌甘薯专化型非致病突变菌株。
本发明是这样实现的:一种尖孢镰刀菌甘薯专化型非致病突变菌株,所述菌株为尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5(Fusarium oxysporum f.sp.batatas MG50-5),于2016年08月29日保藏于中国典型培养物保藏中心,保藏编号为CCTCC M 2016433。
本发明的优点在于:对甘薯蔓割病具有生物防治效果,在PDA培养基上表现出对致病菌营养空间竞争的拮抗效果,此生防菌株处理过甘薯后,能显著降低蔓割病的发病率;在T-DNA中加入了GFP绿色荧光蛋白标记基因,便于生防菌的环境行为监测;本发明为从自然环境中分离生防菌存在的问题提供了解决的方法,也为其它作物上尖孢镰刀菌引起病害的生防菌开发提供借鉴。
附图说明
下面参照附图结合实施例对本发明作进一步的说明。
图1是本发明中pCAMBIA1300-ptrpC-hph-gfp用EcoR I和Sal I酶切后的电泳图。
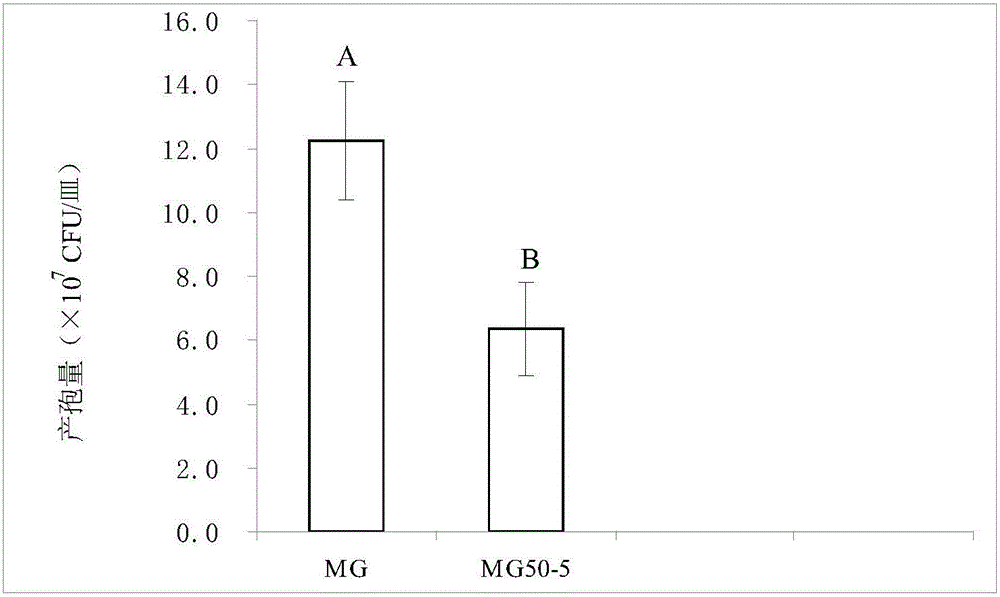
图2是本发明中尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5的产孢能力的示意图。
MG—尖孢镰刀菌甘薯专化型菌株MG
MG50-5—尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5
具体实施方式
菌株保藏
本发明中的生防菌株尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5(Fusarium oxysporum f.sp.batatas MG50-5),于2016年08月29日保藏于中国典型培养物保藏中心(CCTCC),地址为湖北省武汉市武昌区八一路珞珈山,保藏编号为CCTCC M 2016433。
供试菌株:尖孢镰刀菌甘薯专化型菌株MG(Fusarium oxysporum f.sp.batatas MG),于2016年08月29日保藏于中国典型培养物保藏中心(CCTCC),地址为湖北省武汉市武昌区八一路珞珈山,保藏编号为CCTCC M 2016432。
尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5的具体制备方法如下:
1.1试验材料
甘薯品种新种花(蔓割病敏感型)由本研究室保存种植,pCT74(上海北诺生物科技有限公司),pCAMBIA1300(北京华越洋生物科技有限公司),pVOK21由中国农业大学惠赠,pMD18-T购自Takara-宝生物工程(大连)有限公司;所有限制性内切酶BstX I,Sal I,Xho I和EcoR I均购自Takara-宝生物工程(大连)有限公司,潮霉素B购自Roche公司,特美汀购自上海前尘生物科技有限公司,乙酰丁香酮、MES、混合纤维微孔滤膜均购自生工生物工程(上海)股份有限公司,其余农杆菌转化用药品均购自国药集团化学试剂有限公司。
1.2构建双元荧光载体pCAMBIA1300-ptrpC-hph-gfp
首先用EcoR I和Sal I两种限制性内切酶分别酶切质粒pCT74和pCAMBIA1300,回收获得Sal I-ptoxA-gfp-nos-EcoR I和Sal I-pCAMBIA1300-EcoR I,两个片段相连接后构建完成载体pCAMBIA1300-gfp;然后用Xho I和BstX I两种限制性内切酶酶切质粒pCAMBIA1300-gfp(去除CaMV35S-hph片段),并且以质粒pKOV21为模板(用真菌中常用的ptrpC启动子启动潮霉素B抗性基因表达),PCR扩增ptrpC-hph片段,在片段首尾分别加入Xho I和BstX I酶切位点,引物为HphRC-F-Xho I和ptrpCRC-R-BstX I。
HphRC-F-Xho I:5′-CTCGAGCTATTTCTTTGCCCTCGGAC-3′(如SEQ ID NO:1所示);
ptrpCRC-R-BstX I:
5′-CCAACATGGTGGGTCGACAGAAGATGATATTGAAGG-3′(如SEQ ID NO:2所示)。
反应体系:总体积50μL,2×GC Buffer I 25μL,dNTP Mixture(2.5mmol/L each)8μL,引物HphRC-F-Xho I(10μmol/L)1.25μL,引物ptrpCRC-R-BstX I(10μmol/L)1.25μL,模板pKOV21(体系中质粒终浓度为0.1-10ng)1.5μL,LA taq 0.5μL,用ddH2O补齐50μL,其中,试剂均购自Takara-宝生物工程(大连)有限公司。
反应程序:第一步94℃预变性1min;第二步94℃变性30s,57℃退火30s,72℃延伸2min,第二步30个循环;第三步72℃延伸10min。
PCR产物通过连接反应插入pMD18-T载体后,获得pMD18-ptrpC-hph并送往铂尚生物技术有限公司测序,pMD18-ptrpC-hph序列如SEQ ID NO:3所示,进行序列比对,测序结果正确后,用Xho I和BstX I酶切pMD18-ptrpC-hph质粒并回收获得BstX I-ptrpC-hph-Xho I片段。最后将pCAMBIA1300-gfp骨架与BstX I-ptrpC-hph-Xho I片段连接获得pCAMBIA1300-ptrpC-hph-gfp载体。
在pCAMBIA1300-ptrpC-hph-gfp质粒构建完成后,首先对pCAMBIA1300-ptrpC-hph-gfp质粒进行EcoR I和Sal I酶切初步确定SalI-ptoxA-gfp-nos-EcoR I片段已经连入pCAMBIA1300-ptrpC-hph骨架中(见图1,其中标识1代表marker标准分子量,标识2是pCAMBIA1300-ptrpC-hph-gfp质粒经酶切验证的条带),又进行PCR扩增ptrpC-hph片段(具体见1.2的试验方法)和GFP片段。
PCR扩增GFP片段的反应程序和反应体系如下:
引物P28:5′-TAGTGGACTGATTGGAATGCATGGAGGAGT-3′(如SEQ ID NO:5所示);
引物P29:5′-GATAGAACCCATGGCCTATATTCATTCAAT-3′(如SEQ ID NO:6所示)。
反应体系:总体积20μL,试剂均购自Takara-宝生物工程(大连)有限公司):10×PCR Buffer I 2μL,dNTP Mixture(2.5mmol/L each)1.6μL,引物P28(10μmol/L)0.5μL,引物P29(10μmol/L)0.5μL,模板为pCAMBIA1300-ptrpC-hph-gfp(体系中质粒终浓度为0.1-10ng)1μL,rTaq 0.2μL,用ddH2O补齐50μL。
反应程序:第一步94℃预变性4min;第二步94℃变性30s,57℃退火30s,72℃延伸1.5min,第二步35个循环;第三步72℃延伸10min。
两个PCR产物通过1%琼脂糖凝胶电泳及凝胶图像分析系统检测,ptrpC-hph的PCR产物大小为1392bp,GFP的PCR产物大小为417bp,回收目的片段送往铂尚生物技术有限公司测序,并进行序列比对,GFP的PCR产物序列如SEQ ID NO:4所示,确定已经将ptrpC-hph片段和GFP导入到载体pCAMBIA1300中。
1.3农杆菌转化、转化情况检测和转化子单孢分离保存
尖孢镰刀菌农杆菌转化过程和使用的培养基参照文献(Khang C H,Park S Y,Rho H S,et al.Filamentous fungi(Magnaporthe grisea and Fusarium oxysporum)//Agrobacterium Protocols[M].Totowa:Humana Press,2007,403-420.)的方法略作改动,改动之处如下:
将尖孢镰刀菌甘薯专化型菌株MG在PDA固体培养基(1L培养基中含有200g马铃薯,15g葡萄糖,15g琼脂粉)纯化培养7d后,加入无菌水将分生孢子刮洗出来用2层无菌擦镜纸过滤,并用IM液体培养基(见表1)将分生孢子浓度调整到1×106CFU/mL,得尖孢镰刀菌甘薯专化型菌株MG孢子悬浮液,备用。将转入pCAMBIA1300-ptrpC-hph-gfp载体的农杆菌AGL-1在MM液体培养基中(见表1)28℃,250r/min摇培2d后,用含200μmol/L乙酰丁香酮的IM液体培养基将菌液浓度调整为OD600=0.15,接着摇培6h(OD600约为0.6),得农杆菌液。将混合纤维微孔滤膜放置在含有200μmol/L乙酰丁香酮的CM固体培养基(见表1)上,之后将100μL尖孢镰刀菌甘薯专化型菌株MG孢子悬浮液和100μL农杆菌液混匀涂布在混合纤维微孔滤膜上,25℃,暗培养2d。共培养后将混合纤维微孔滤膜用刀划成小块分散摆放到筛选培养基(含潮霉素B浓度100μg/ml,特美汀浓度200μg/ml的PDA培养基)上,28℃暗培养,得转化子。转化过程所用各种菌均放置在隔水式恒温培养箱GNP-9080型中培养。在筛选培养基上培养3d后,将转化子整皿放置在BD-BGC1蓝光切胶仪中,在蓝色激发光下观察菌落颜色。对于能发出绿色荧光的菌落挑取其孢子进行单孢纯化,将单孢形成的菌落再转移到放置无菌滤纸片的筛选培养基上。待菌落长到没过滤纸后再将菌落放在蓝光下观察菌落颜色,若菌落依然发出绿色荧光,则将滤纸片放入无菌信封中保存。
表1农杆菌转化所需试剂及培养基配方表
构建好的pCAMBIA1300-ptrpC-hph-gfp载体通过AGL-1农杆菌转化入尖孢镰刀菌甘薯专化型菌株MG,经过潮霉素抗性筛选3d后长出的转化子在蓝色激发光下会发出绿色荧光,说明带GFP绿色荧光蛋白标记基因的T-DNA已成功整合入尖孢镰刀菌甘薯专化型基因组。转化过程中一张5cm直径混合纤维微孔滤膜膜上约涂布1×106个分生孢子,最终每张膜约长出10个转化子,将发出绿色荧光的菌落挑取少量孢子单孢分离并滤纸片保存后,最终获得了711个纯化培养的尖孢镰刀菌甘薯专化型突变体。
1.4尖孢镰刀菌甘薯专化型非致病突变体的筛选(致病力初步检测)
生产上用5×105CFU/mL尖孢镰刀菌甘薯专化型菌株MG孢子悬浮液做致病力测定可以很好地区分不同抗性水平的甘薯,因此文中所有的尖孢镰刀菌甘薯专化型菌株MG和转化子接菌甘薯试验都是采用5×105CFU/mL的孢子悬浮液浓度。配制好尖孢镰刀菌甘薯专化型菌株MG孢子悬浮液和转化子孢子悬浮液后,在田间剪取健康的新种花主茎顶部约20cm茎段,将伤口朝下浸泡入孢子悬浮液中20min后弃菌液,将茎段插入清水中培养(在赛福冷光源植物气候箱中,温度28℃,光周期16L:8D),以尖孢镰刀菌甘薯专化型菌株MG孢子悬浮液处理后新种花出现4级以上典型发病症状为准开始统计发病情况(在合适条件下接种尖孢镰刀菌甘薯专化型菌株MG孢子悬浮液5d即可发病至4级,7d后死亡),以尖孢镰刀菌甘薯专化型菌株MG孢子悬浮液和清水处理为对照,单个菌株处理10个茎段,3次重复。
蔓割病病情分级标准:以株为单位,0(0.0)级:无病;1(0.1)级:地上部生长正常,茎基部维管束变褐在3cm左右;2(0.2)级:地上部基本正常,茎基部维管束变褐在1/4左右;3(0.5)级:茎基部叶片变黄,维管束变褐在1/2以上;4(0.8)级:植株叶片多数变黄枯死,茎部维管束变褐扩展及顶芽;5(1.0)级:全株枯死。
病情指数=(0.1×n1+0.2×n2+0.5×n3+0.8×n4+1.0×n5)/N×100。
n为各级病株数;N为参试总株数。当病情指数为0.0~20.5,植株表现高抗反应时,认定为突变体是非致病突变体。
对尖孢镰刀菌甘薯专化型711个突变体进行致病力检测试验,获得了40个致病力下降的突变体。对40个致病力下降的突变体非致病突变体的稳定性检测,包括平板转接稳定性和非致病性的稳定性检测,非致病突变体在PDA固体培养基上至少转接6代后,观察菌落形态并放置在蓝光下观察是否能发出绿色荧光。性状稳定的突变体再接种新种花进行致病力重复检测,每次检测10株,3次重复。最终得到尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5,且尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5致病力即病情指数为12.30,相对于野生型尖孢镰刀菌甘薯专化型菌株MG的病情指数95.03显著降低,新种花外观未表现出发病症状。
1.5非致病突变体安全性检测
将以尖孢镰刀菌甘薯专化型菌株MG和尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5均配制成浓度约为2.67×106CFU/mL的孢子悬浮液,分别取150mL与400mL灭菌土壤混匀装盆,设置清水拌土对照。将田间采集的健康“新种花”茎段移栽至盆里,每盆10株,3次重复。将处理过的盆栽放在冷光源培养箱中培养,条件设置为温度28℃,湿度95%,光周期16L:8D。
由于上述步骤1.4的致病力初步检测是仅用以无菌水为介质的突变体孢子悬浮液处理新种花20min,而真正的生物防治菌株需要长时间在土壤中作用于甘薯植株。因此试验又进一步以尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5孢子悬浮液拌营养土的方式接菌新种花以确定其安全性。以尖孢镰刀菌甘薯专化型菌株MG孢子悬浮液拌土和无菌水拌土为对照,结果显示相同培养条件下尖孢镰刀菌甘薯专化型菌株MG处理的新种花在7d后发病在4级以上,无绿叶接近死亡,而尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5处理的新种花和水处理一样未表现出发病症状,病情指数显著降低,相当于甘薯高抗品种对于尖孢镰刀菌甘薯专化型菌株MG的抗性反应水平,结果进一步证实了尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5这个突变体致病力丧失,持续接触新种花依旧不会致病。
1.6转化子产孢情况检测
将单孢分离纯化后的转化子尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5在PDA培养基上于28℃活化培养10~14d,在培养皿里加入无菌水用涂布器将分生孢子刮洗出来。刮洗液用2层无菌擦镜纸过滤制成孢子悬浮液,用血球计数板进行孢子计数,计算1皿(直径为6cm)转化子中所有的孢子数。试验重复3次,每次3皿。
实验结果如下:
在PDA培养基上,无论是尖孢镰刀菌甘薯专化型菌株MG,还是非致病突变体尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5,正面菌丝质地都呈现毛毡状,背面色素分布深浅以及轮纹各不相同,并随着不同培养时间批次有所差别。尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5的菌丝呈放射性束状生长(在挑取菌丝时,也感觉菌丝集结成束),在紧贴培养基一面表现更为明显,其对应的分生孢子产量也显著下降(见图2)。另外,尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5的孢子形态相对于野生型尖孢镰刀菌甘薯专化型菌株MG并没有发生显著变化。
1.7生防效果检测
1.7.1对峙培养试验将28℃暗培养5d的尖孢镰刀菌甘薯专化型菌株MG和尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5的菌饼的边缘用直径为0.5cm的打孔器打孔,将尖孢镰刀菌甘薯专化型菌株MG和尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5的菌饼分别对称放置在PDA培养基上距边缘约直径1/4处,28℃暗培养,试验重复3次。
1.7.2生防效果盆栽试验将尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5孢子配置浓度成5×105CFU/mL的孢子悬浮液,将田间剪取的健康新种花主茎顶部20cm茎段伤口朝下浸泡其中,分别浸泡2、4、8、16、24h后取出,扦插于事先准备好的含菌盆钵中(每盆约400mL的无菌营养土与150mL 2.67×106CFU/mL浓度的尖孢镰刀菌甘薯专化型菌株MG孢子悬浮液均匀混合),每处理10株,重复3次,以清水浸苗扦插于相同尖孢镰刀菌甘薯专化型菌株MG孢子浓度的土壤和无菌土为对照。将处理过的盆栽放在冷光源培养箱中培养,条件设置为温度28℃,湿度95%,光周期16L:8D。
对峙培养结果:
尖孢镰刀菌甘薯专化型菌株MG和尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5在对峙培养5d后可以看到每一皿的两菌落在培养皿中间出现明显的呈直线菌落分界,菌丝间没有互相融合,说明尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5与尖孢镰刀菌甘薯专化型菌株MG存在营养竞争和空间竞争,菌丝扩展速度相当。但是,相对于尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5而言,尖孢镰刀菌甘薯专化型菌株MG菌落更厚更稠密,生长势要更好。
表2不同预处理时长对甘薯蔓割病的防治效果
注:MG指代尖孢镰刀菌甘薯专化型菌株,MG55-7指代尖孢镰刀菌甘薯专化型非致病突变菌株MG55-7;病情指数列和防治效果列的不同大写字母表示差异极显著(P<0.01)
生防效果盆栽试验结果:
非致病突变体尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5在处理新种花2h后,对蔓割病具有防治效果,随着处理时间的延长,尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5的生防效果也逐渐明显,处理16h后,生防效果趋于稳定,在处理24h后,生防效果达到了78.57%(见表2)。
本发明通过构建尖孢镰刀菌甘薯专化型的T-DNA插入突变体库,筛选出非致病突变体作为生防资源,最终获得了针对甘薯蔓割病的生防菌株尖孢镰刀菌甘薯专化型非致病突变菌株MG50-5。由于是直接对尖孢镰刀菌甘薯专化型进行改造,因此获得的生防菌理论上与病原菌生态位重叠性最好,施用后环境适应性最好,营养空间竞争也最为激烈。其次,由于T-DNA插入位置可以通过TAIL-PCR进行定位,因此可以明确了解非致病突变体的遗传背景。再次,本发明还在T-DNA中加入了GFP绿色荧光蛋白标记基因,便于生防菌的环境行为监测。本发明为从自然环境中分离生防菌存在的问题提供了解决的方法,也为其它作物上尖孢镰刀菌引起病害的生防菌开发提供借鉴。
- 还没有人留言评论。精彩留言会获得点赞!