一种以叶肉原生质体为受体的杂交鹅掌楸高效的瞬间基因表达方法与流程
本发明涉及杂交鹅掌楸遗传转化方法,具体涉及一种杂交鹅掌楸高效的瞬间遗传转化方法。
背景技术:
鹅掌楸属于古老的木兰科植物,从系统发生上看,属于原始的被子植物。对木兰科植物基因及其功能的研究,将对阐明被子植物的系统发生有着重要的影响。而目前利用常见的模式植物拟南芥、烟草的转基因体系对鹅掌楸的基因功能和信号传导开展研究可能存在异源系统带来的假阳性等问题,因此建立鹅掌楸的转基因体系对于鹅掌楸及木兰科植物基因功能的研究都有着重要意义。转基因体系主要包括稳定转染的转基因体系和瞬间表达基因体系,受木本植物生长周期长特点的影响,瞬间表达基因体系为植物基因功能高通量研究提供了一个快速方便的操作平台。目前,瞬间转化体系主要有农杆菌介导的遗传转化、基因枪法、PEG介导或者电穿孔法介导的原生质体转化,其中PEG介导的原生质体瞬间转化是最广泛使用的瞬间表达体系。PEG具有细胞粘合及扰乱细胞膜磷脂双分子层的作用,它可使DNA 与膜形成分子桥,促使相互间的接触和粘连;它还可引起膜表面电荷紊乱,干扰细胞识别,有利于细胞膜间的融合和外源DNA进入原生质体。目前在拟南芥、杨树等物种中用PEG介导的叶肉细胞原生质体瞬间表达系统已经被广泛的用于研究基因表达的信号传递、蛋白和蛋白之间的相互作用、亚细胞定位以及蛋白-DNA之间的相互作用等。但PEG介导的原生质体转化的转化频率受很多因素的影响,包括外源基因的浓度和构象,PEG的分子量和浓度,质粒/原生质体的比例,转染时间等。目前仅在拟南芥、水稻、棉花、杨树等植物建立起高效的PEG介导的瞬间表达体系,受物种差异的影响,木兰科植物由于叶片含有大量的蜡质,目前尚未有短时间内快速分离其叶肉原生质体的方法和有效的瞬间表达体系。
技术实现要素:
发明目的:针对现有技术中存在的不足,本发明的目的是提供一种以叶肉原生质体为受体的杂交鹅掌楸高效的瞬间基因表达方法,建立起PEG介导的杂交鹅掌楸叶肉原生质体瞬间转化体系,为鹅掌楸及木兰科植物基因功能的研究提供一个快速方便的操作平台。
技术方案:为了实现上述发明目的,本发明采用的技术方案如下:
一种以叶肉原生质体为受体的杂交鹅掌楸高效的瞬间基因表达方法,包括以下步骤:
1)使用QIAGEN Plasmid Midi Kits抽提纯化质粒,将其调整到2 μg/μL的浓度后,-20℃保存备用;
2)杂交鹅掌楸叶肉细胞原生质体的分离纯化,获得浓度为105/mL的原生质体;
3)取质粒于2 mL离心管中,然后加入原生质体,用手轻轻的将质粒DNA及原生质体溶液混匀;缓慢加入40% PEG-4000溶液,轻柔混匀,放置15 min;加入W5溶液,轻柔混匀;1100 rpm离心2 min后弃上清,加入WI溶液轻轻悬浮原生质体,并转移到细胞培养板上;
4)将细胞培养板放在23℃黑暗静置培养18 h后,置于荧光显微镜下观察。
步骤1)中,具体过程如下:
1)挑取平板中分散良好的单菌落,接种于含有100 mg/L氨苄青霉素的2 mL的LB培养基中,37℃,300 rpm,振荡培养8 h;
2)取摇好的菌液,按1:500的比例加到含有100 mg/L氨苄青霉素的50 mL的LB培养基中,37 ℃,300 rpm,振荡培养12~16 h;
3)在4℃用6000×g离心15分钟收集菌体沉淀,完全弃除上清液;
4)用4 mL Buffer P1重悬菌体;
5)加入4 mL Buffer P2,上下颠倒4-6次完全混匀,室温静置裂解5 min;
6)加入4 mL 预冷的Buffer P3,立即颠倒4-6次混匀,冰浴静置沉淀15min;
7)在4℃用≥20000×g离心30 min,将含有质粒的上清液小心地转移到一个新的干净的离心管中;并在4℃用≥20000×g再次离心15 min;
8)将4 mL Buffer QBT加入到QIAGEN-tip 100离心柱上,靠重力作用待其完全流过离心柱;
9)将7)中含有质粒的上清液立即转移到平衡好的QIAGEN-tip 100离心柱上,依靠重力的作用将质粒结合到离心柱的树脂上;
10)加入2×10 mL Buffer QC 清洗离心柱;
11)加入5 mL Buffer QF将离心柱的树脂上结合的质粒洗脱到一个干净的离心管中;
12)向质粒洗脱液中加入3.5 mL室温放置的异丙醇沉淀质粒DNA,完全混匀后,在4 ℃用≥15000×g离心30 min沉淀质粒DNA,小心弃除上清液;
13)用2 mL 室温放置的70%乙醇洗涤质粒DNA沉淀,用≥15000×g离心10 min,小心弃除上清液不要扰动离心管底部的沉淀;
14)室温干燥5~10 min后;加入30 uL灭菌的ddH2O,溶解质粒;
15)用琼脂糖凝胶电泳和超微量分光光度计检测质粒的浓度和纯度后,将其调整到2 μg/μL后,-20℃保存备用。
步骤2)中,取培养在培养瓶中健康伸展的体胚苗叶片,用刀片切成0.5~1mm的细丝,然后迅速放入准备好的酶解液中,置于28℃黑暗条件下,45 rpm轻微振荡3 hr进行酶解;酶解完成后,加入适量W5溶液,轻轻摇晃,使用300目筛子过滤除去未酶解充分的叶片;滤液经1100 rpm离心2 min,弃上清液,用2 mL冰预冷的W5溶液洗原生质体2次后,加入2 mL冰预冷的W5溶液重悬原生质体,冰上静置30 min,1100 rpm离心2 min,弃上清液,加入MMg溶液悬浮原生质体,并调整原生质体浓度至105/mL。
酶解液的准备:称取Cellulase R-10 0.15 g,Macerozyme R10 0.1 g和Pectolase Y-23 0.01 g 于6.25 mL 0.8 M甘露醇、2.5 mL 80 mM KCl、1 mL 200 mM MES(pH5.7)的溶液中,搅匀,置4℃冰箱过夜充分溶解;再加入0.1 mL 1 M CaCl2、0.01 g BSA,定容至10 mL;用0.45 µm的灭菌过滤器过滤上述溶液,备用。
步骤3)中,20μg质粒转化1×104个细胞。
有益效果:与现有技术相比,本发明以杂交鹅掌楸叶片作为原生质体的来源,通过PEG介导,以GFP基因作为报告基因,建立起了杂交鹅掌楸叶肉细胞原生质体高效的瞬间表达体系,为鹅掌楸及木兰科植物基因功能的研究提供一个快速方便的操作平台。
附图说明:
图1是杂交鹅掌楸叶肉细胞原生质体的显微照片图;
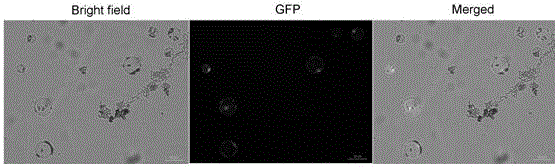
图2是PEG介导杂交鹅掌楸叶肉细胞原生质体转化的的显微照片图;左图是明场视野,中图是GFP视野,右图是叠加后。
具体实施方式
下面结合具体实例对本发明作进一步的说明。
以下实施例用到的试剂的配方为:
PEG溶液(40%,V/V)(10mL):4g PEG4000,3mL H2O,2.5mL 0.8M甘露醇,1mL 1M CaCl2。
W5溶液:154mM NaCl,125mM CaCl2,5mM KCl,2mM MES(pH5.7),5mM葡萄糖。
MMg溶液:0.4M甘露醇,15mM MgCl2,4mM MES(pH5.7)。
WI溶液:4mM MES(pH5.7),0.5M甘露醇,20mM KCl。
实施例1 质粒制备
采用QIAGEN Plasmid Midi Kits抽提纯化质粒(PJIT166-GFP),可以方便快速地获得纯度较高的质粒,具体步骤如下:
1)挑取平板中分散良好的单菌落,接种于含有100 mg/L氨苄青霉素的2 mL的LB培养基中,37℃,300 rpm,振荡培养8 h;
2)取摇好的菌液,按1:500的比例加到含有100 mg/L氨苄青霉素的50 mL的LB培养基中,37 ℃,300 rpm,振荡培养12~16 h;
3)在4℃用6000×g离心15分钟收集菌体沉淀,完全弃除上清液;
4)用4 mL Buffer P1重悬菌体;
5)加入4 mL Buffer P2,上下颠倒4-6次完全混匀,室温静置裂解5 min;
6)加入4 mL 预冷的Buffer P3,立即颠倒4-6次混匀,冰浴静置沉淀15min;
7)在4℃用≥20000×g离心30 min,将含有质粒的上清液小心地转移到一个新的干净的离心管中;并在4℃用≥20000×g再次离心15 min;
8)将4 mL Buffer QBT加入到QIAGEN-tip 100离心柱上,靠重力作用待其完全流过离心柱;
9)将7)中含有质粒的上清液立即转移到平衡好的QIAGEN-tip 100离心柱上,依靠重力的作用将质粒结合到离心柱的树脂上;
10)加入2×10 mL Buffer QC 清洗离心柱;
11)加入5 mL Buffer QF将离心柱的树脂上结合的质粒洗脱到一个干净的离心管中;
12)向质粒洗脱液中加入3.5 mL室温放置的异丙醇沉淀质粒DNA,完全混匀后,在4 ℃用≥15000×g离心30 min沉淀质粒DNA,小心弃除上清液;
13)用2 mL 室温放置的70%乙醇洗涤质粒DNA沉淀,用≥15000×g离心10 min,小心弃除上清液不要扰动离心管底部的沉淀;
14)室温干燥5~10 min后;加入30 uL灭菌的ddH2O,溶解质粒;
15)用琼脂糖凝胶电泳和超微量分光光度计检测质粒的浓度和纯度后,将其调整到2 μg/μL后,-20℃保存备用。
实施例2 杂交鹅掌楸叶肉细胞原生质体的分离纯化
原生质体的质量直接影响转化效率,而植物材料的生长状态、酶的种类和纯度、酶解时间和温度等诸多因素都会影响分离到的原生质体的效率和质量。叶肉细胞原生质体更大程度的保留了植物的许多生理响应和细胞的活性,因此已经被广泛的选作植物细胞原生质体的材料来源。目前拟南芥、烟草、杨树、水稻、玉米、棉花等许多植物的叶肉细胞原生质体已经可以在短时间内被高效的分离,而鹅掌楸属植物的叶片,类似于银杏科和广玉兰,上表皮都含有同源系列的叶片蜡质,因此,它的表皮很难采用像拟南芥、烟草、谷物和一品红等撕的方法去除。通常使用的酶液组合纤维素酶R-10 和离析酶R10不能在短时间内有效分离杂交鹅掌楸叶肉细胞原生质体。
本实例以杂交鹅掌楸叶片作为材料,基于专用的酶解液,建立了有效的制备杂交鹅掌楸叶肉原生质体的方法。具体步骤如下:
1)取培养在培养瓶中健壮的体胚苗做为实验材料,用剪刀将较为伸展并且生长状态良好的第2-5片叶片剪下来(每用一片剪一片),放在干净的白纸上,用单面刀片剪成0.5~1mm的条带,切完后迅速用镊子夹起一端,放入准备好的酶解液中(注:放入时,先将一面浸入酶解液,取出再将另一面浸入,目的使叶片条段完全的蘸上酶解液,酶解更充分)。然后置于28°C黑暗条件下,45rpm轻微振荡3 hr进行酶解。
2)酶解完成后,轻轻摇晃数秒促进消化,加入适量W5溶液,轻轻摇晃,使用300目筛子过滤除去未酶解充分的叶片。
3)滤液经1100rpm离心2min,用枪头吸出上清,可见原生质体沉淀于底部。
4)向所得的沉淀中加入2 mL冰预冷的W5溶液重悬原生质体,1100rpm离心2min,用枪头吸出上清,轻轻摇晃使原生质体悬浮。
5)再重复一次。
6)再次加入2mL冰预冷的W5溶液重悬原生质体,冰上静置30min。1000rpm离心2min,用枪头吸出上清,轻轻摇晃使原生质体悬浮。
7)加入所需体积的MMg溶液(每个反应约需100μL)悬浮原生质体。取一滴重悬液进行镜检,观察原生质体的质量和浓度,并调整原生质体浓度至105/mL。杂交鹅掌楸叶肉细胞原生质体的显微照片,如图1所示。
专用的酶解液的准备:称取Cellulase R-10 0.15 g,Macerozyme R10 0.1 g和Pectolase Y-23 0.01 g 于6.25 mL 0.8 M甘露醇、2.5 mL 80 mM KCl、1 mL 200 mM MES(pH5.7)的溶液中,搅匀,置4℃冰箱过夜充分溶解;再加入0.1 mL 1 M CaCl2、0.01 g BSA,定容至10 mL;用0.45 µm的灭菌过滤器过滤上述溶液,备用。
实施例3 转化
至今,已经在拟南芥、烟草、杨树、胡杨、葡萄、玉米等很多植物中建立起了高效的原生质体瞬间表达体系。但是,不同材料来源的原生质体的PEG介导的瞬间转化体系的参数存在着一定的差异。如最近建立的PEG介导的胡杨悬浮系细胞原生质体瞬间转化体系中,最优参数为:在240μL的转化体系中,1×105的原生质体和20μg质粒在20% PEG-4000的介导下,静置转染20 min,可以获得超过50%的转化率;而葡萄悬浮系细胞原生质体的最优参数为:在220μL的转化体系中,4×105的原生质体加到20μg质粒中,在25% PEG-4000的介导下,静置转染30 min,可以获得超过60%的转化率。因此不同材料来源的PEG介导的原生质体瞬间转化参数差异很大,从目前已经建立的PEG介导的原生质体的瞬间转化体系来看,影响其转化率的因素主要有DNA浓度和数量、质粒/原生质体的比例、PEG分子量和浓度、转染时间等。
本实例以PEG介导的杂交鹅掌楸叶肉细胞原生质体瞬间转化的方法,具体步骤如下:
1)对于单个反应,加入质粒DNA共10μL于2mL离心管中。
2)每个反应吸取100μL上述制备好的原生质体于加入质粒DNA的离心管中,每个反应在吸取前务必重悬一次,否则原生质体会沉在底部。
3)用手轻轻的将质粒DNA及原生质体溶液混匀。
4)加入等体积即110μL的PEG溶液,PEG会沉在溶液底层,每加完一个反应立即用手轻轻的混匀溶液。
5)静置转染15min。
6)每个反应中加入4倍体积即440µL W5溶液,轻轻上下颠倒混匀,终止转染反应。
7)室温下1100 rpm离心2 min,用宽头枪头吸出上清,加入1 mL WI溶液轻轻悬浮原生质体,并转移到6孔细胞培养板上。
8)23℃弱光照条件下培养约18hr。
培养后观察:将细胞培养板放在23℃黑暗静置培养18 h后,置于荧光显微镜下观察。结果如图2所示,在明场下,可以观察到完整的原生质体,在GFP下,可以看到绿色荧光分布在整个原生质体内,以视野下发绿色荧光的原生质体占所观察到的原生质体的比例计算,原生质体的转化率达到了60%。
试验证实,以20μg质粒转化1×104个细胞,可以获得较高的转化率,达60%。
- 还没有人留言评论。精彩留言会获得点赞!