具有温度响应细菌纳米纤维素复合材料及其制备方法和应用与流程
技术领域
本发明属于细菌纤维素复合材料领域,特别涉及一种具有温度响应细菌纳米纤维素复合材料及其制备方法和应用。
背景技术:
细菌纤维素(Bacterial cellulose,BC)是一种由某些细菌分泌的纤维素,其中使用最为广泛的为木葡萄糖醋酸杆菌(Gluconacetobacter xylinus,也曾称为木醋杆菌Acetobacter xylinus)。细菌纤维素微观结构是由宽度为30至100纳米,厚3至8纳米的纤维素条带交织成无规则的纳米网状结构。与植物纤维素相比,细菌纤维素具有高化学纯(不含木质素、半纤维素)、精细纳米结构、高杨氏模量、高持水性、高结晶度、良好的生物相容性等特征,被看作是一种具有广阔应用前景的生物材料。
通过发酵直接获得的细菌纤维素水凝胶含水量极高,以吸收自身干重的60-700倍的重的水凝胶状态存在。但是当细菌纤维素干燥失去水分后,由于细菌纤维素中大量的羟基形成极强的分子内和分子间氢键,使得原本的三维网络结构坍塌、板结,形成致密且薄的细菌纤维素干膜。这类细菌纤维素干膜只能吸收自身干重3-15倍的水,并且无法恢复原本的水凝胶状态,也无法恢复具有大量纤维间孔隙的三维纳米网状结构。现有技术条件下研究者普遍认为,通过简单加热干燥或者蒸发或者挤压作用造成的细菌纤维素水凝胶的完全失水,难以通过简单复水恢复成原凝胶状态。细菌纤维素干膜不具备水凝胶膜的众多优秀性能,使其应用及性能受到极大限制。现有保持细菌纤维素吸水溶胀能力的方式主要是通过将材料冻结成固体下的真空冷冻干燥的方式(参考文章Effect of post-synthetic processing conditions on structural variations and applications of bacterial cellulose,Cellulose,2013,20(1):253-263.),及对细菌纤维素羟基集团进行化学修饰,以减少氢键的作用(参考专利申请200910069371.4高复水性细菌纤维素膜的制备方法)。冷冻干燥的方法,体积上保持了水凝胶态时的体积,同时较好地保留了原有孔隙结构,获得泡沫状细菌纤维素干膜,因此可以吸水,但体积溶胀率不高。同时材料的强度较低,易被折断、压陷,保存困难。另外该干燥技术耗能巨大,使用过程复杂。采用化学修饰方法,将原本大量存在的羟基基团修饰,使得氢键大量减少,使得细菌纤维素干膜的机械强度不可避免的下降,该方法改变了细菌纤维素的原有的表面化学特性,特别是原富羟基表面的亲水特性。材料表面亲水特性的降低直接降低了材料对于细胞的亲和性以及削弱材料的血液相容特性等多种优秀性能。
pH响应水凝胶是一类新型智能材料,其溶胀及退溶胀行根据pH条件的变化而变化。细菌纤维素水凝胶本身并不具备pH响应下的溶胀性能。现有细菌纤维素pH响应智能水凝胶的制备是通过化学接枝的方式改变细菌纤维素表面化学基团(如通过电子束接枝聚丙烯酸参考文献Unique stimuli responsive characteristics of electron beam synthesized bacterial cellulose/acrylic acid composite,Journal of Applied Polymer Science,2010,116(5):2920–2929.)。通过这种方式获得的细菌纤维素材料的表面化学特性及富羟基性能会发生改变,另外丙烯酸、丙烯酸酰胺、丙烯氰这类用于接枝的共聚类单体具有很高生物毒性和很低的生物降解性能,不利于该类复合材料在生物医用领域中的使用。
半互穿双网络(Semi-interpenetrating double networks)是在指在某聚合物网络中,穿透或掺杂缠结了另一种聚合物。这种相互缠结的结构大大提高了凝胶的强度,同时聚合物网络与掺杂的聚合物间几乎无化学键交联,使得聚合物的优良特性可以有效保留。通过化学键交联掺杂的聚合物,形成两个相互缠结但无化学交联的聚合物网络,便形成了互穿双网络(Interpenetrating double networks)。
技术实现要素:
本发明所要解决的技术问题是提供一种具有温度响应的细菌纳米纤维素复合材料及其制备方法和应用,该复合材料具有温度响应性,以温度控制材料网络孔隙大小,控制溶质分子透过率,实现药物可控释放。复合材料同时具备细菌纤维素高强度、高生物相容性等特征,可以用于伤口敷料、智能药物载体、传感器、化学阀等;制备工艺简单,成本低,具有良好的应用前景。
本发明的一种具有温度响应细菌纳米纤维素复合材料,所述复合材料为在细菌纤维素网络结构中掺杂具有温度响应的聚电解质。
所述聚电解质为聚阴离子电解质、聚阳离子电解质或两性聚电解质。
所述聚阴离子电解质为聚丙烯酸、聚丙烯酰胺、羧甲基纤维素或聚酸类高分子;所述聚阳离子电解质为壳聚糖、阳离子淀粉、聚乙烯亚胺、聚乙烯胺或聚乙烯吡啶;所述两性聚电解质为羧甲基壳聚糖、蛋白质或核酸。
所述聚电解质的单体包括N-异乙丙烯基丙烯酰胺或N,N-二甲基丙烯基胺。
所述细菌纤维素基材载有药物。该药物可以根据水凝胶的pH响应溶胀能力,实现特定pH条件下药物快速释放,而在其他pH条件下药物缓慢释放。或者可以根据水凝胶的温度响应能力,实现在高于低温临界溶解温度内的药物缓慢释放,而在低于低温临界溶解温度条件下的药物快速释放。
本发明的一种具有温度响应细菌纳米纤维素复合材料的制备方法,包括:
(1)采用zeta电位测定、pH滴定或电位滴定测定聚电解质水溶液的pI值与强解离pH范围;其pI值附近即是复合材料的退溶胀响应区,聚电解质发生强电离时的pH范围即是其溶胀复水响应pH范围;
(2)采用浸渍法、原位合成法或单体聚合法制备细菌纤维素/聚电解质高分子互穿或半互穿双网络高含水水凝胶;
A、浸渍法制备:将通过静态或动态方法培养所获得的,经过碱煮纯化后的细菌纤维素膜,进行膜片处理,获得指定规格、厚度的细菌纤维素膜。将通过预设所确定的某种聚电解质配制为1%-8%(w/v)的水溶液,将细菌纤维素膜或者冻干膜浸渍于聚电解质高分子溶液中,在30℃至90℃下浸渍2至10天。使聚电解质掺杂于细菌纤维素网络中,获得半互穿双网络复合材料,将所获的半互穿双网络复合材料浸渍于交联剂溶液中1-72h,在交联温度、引发剂或辐射条件下,引发掺杂于细菌纤维素网络中的聚电解质交联获得互穿双网络复合材料。
B、原位合成法制备:将聚电解质添加至细菌纤维素培养基中,静态或转鼓动态培养7-10天,获得聚电解质掺杂的细菌纤维素膜,将获得的细菌纤维素复合膜在0.5%至4%(w/v)的氢氧化钠溶液中50-90℃纯化2到8个小时,后用去离子水浸泡置换细菌纤维素/聚电解质半互穿复合膜至置换的去离子水pH为中性。将纯化后的细菌纤维素/聚电解质半互穿复合膜浸渍于交联剂溶液中,在交联温度、引发剂或辐射条件下,引发掺杂于细菌纤维素网络中的聚电解质交联获得互穿双网络复合材料。
C、单体聚合法制备(适用于聚丙烯酸、聚丙烯酰胺等聚合聚电解质复合材料的制备):将通过静态或动态方法培养所获得的,经过碱煮纯化后的细菌纤维素膜,进行片膜处理,获得指定规格、厚度的细菌纤维素膜。将聚电解质单体(丙烯酸、丙烯酰胺、N,N-2乙基丙烯酰胺、(N,N-二甲氨基)乙基异丁烯酸甲酯等单体中一种或者多种)根据pH的预设按不同添加比例配置成质量分数为1%-8%(w/v)的水溶液。
[C1方法]:将细菌纤维素膜浸泡于聚电解质单体水溶液中,在0-25℃,80-120rpm频率下振荡孵育6h-72h,使得聚电解质单体充分扩散入细菌纤维素膜中至接近于平衡。将浸泡好的细菌纤维素膜用去离子水冲洗去表面的残余溶液,将获得的膜浸入引发剂溶液中(包括偶氮类、过氧类、氧化还原类),聚合反应温度为30-90℃,反应时间为1-12h。或者反过来执行:将细菌纤维素膜浸泡于引发剂溶液中(包括偶氮类、过氧类、氧化还原类),在0-25℃,80-120rpm频率下振荡孵育6h-72h,使得引发剂充分扩散入细菌纤维素膜中至接近于平衡。将浸泡好的细菌纤维素膜用去离子水冲洗去表面的残余溶液,将获得的膜浸入聚电解质单体水溶液中,聚合反应温度为30-90℃,反应时间为1-12h。
[C2方法]:将细菌纤维素膜浸泡于聚电解质单体和引发剂按比例混合的水溶液中(单体:引发剂=50:1~500:1),在0-5℃,80-120rpm频率下振荡孵育6h-72h,使得聚电解质单体和引发剂充分扩散入细菌纤维素膜中至接近于平衡。将浸泡好的细菌纤维素膜用去离子水冲洗去表面的残余溶液,在反应温度为30-90℃条件下,聚合反应1-12h。或者在400-1000W的微波下,辐照反应1-10min,引发自由基聚合反应,冷却至反应充分完成。
单体聚合成聚电解质高分子掺杂于细菌纤维网络中获得细菌纤维素/聚电解质半互穿双网络水凝胶,将获得的半互穿双网络水凝胶浸入去离子水中,充分置换1-24h去除其中残余的单体及引发剂,获得半互穿双网络水凝胶。如在细菌纤维素膜浸没过程中,将单体溶液替换为单体和交联剂(如甲叉双丙烯酰胺)共同混合的溶液,或者在引发剂溶液中加入交联剂,可以获得聚电解质相互交联的互穿双网络水凝胶。
热引发自由基聚合引发反应的步骤可由微波辐照辅助引发反应来替代,即将细菌纤维素膜浸泡于聚电解质单体水溶液中或者聚电解质单体和交联剂混合水溶液中,浸泡6-72h,使得聚电解质单体充分扩散入细菌纤维素膜中至接近于平衡,然后加入引发剂(单体:引发剂=50:1~500:1)继续浸渍30min-2h,将浸渍完的细菌纤维素膜置于400-1000W的微波下,辐照反应1-10min,引发自由基聚合反应,冷却至反应充分完成。
(3)将上述高含水水凝胶完全或者部分脱水,得到干胶或低含水水凝胶。
通过步骤(2)所制备的互穿及半互穿双网络水凝胶,可以直接作为pH响应水凝胶应用,也可以通过脱水,使其先失去部分或全部的水分,获得具备在特定pH值下可以高复水恢复成水凝胶的干胶及低含水水凝胶。
A、热干燥脱水:其制备方法为,将通过步骤(2)获得的半互穿或互穿双网络水凝胶在聚四氟乙烯板(或者玻璃板、木板、塑料板)上在鼓风干燥箱或真空干燥箱中(25-120℃)干燥。获得在特定pH值下可高复水的,具有极小体积的干胶片。
B、冷冻干燥脱水:将其干燥至完全脱水,获得具备pH响应的高复水细菌纤维素复合干膜或者泡沫海绵。冷冻干燥的复合膜虽然普遍具有吸水溶胀特性,仍具有在特定pH值响应下的有差异的溶胀特性。
C、退溶胀脱水:即利用pH响应水凝胶的本身的特性,将其浸泡于复合的聚电解质弱电离或非电离时的pH条件下的水溶液中,使得pH响应水凝胶自然退溶胀失水。获得可以较好恢复水凝胶状态且具pH响应的高复水水凝胶。
本发明的一种具有环境响应细菌纤维素复合材料的应用(示意图见图13),所述复合材料作为多层结构载药体的储药层外侧控制层,当复合材料在该聚电解质强电离pH条件下时高溶胀,可实现储药层内的药物能够快速透过控制层释放;而当在聚电解质弱电离或非电离pH条件下时,复合材料溶胀率低,药物透过率低,可实现储药层的药物缓慢释放。
本发明的一种具有温度响应细菌纳米纤维素复合材料的应用(示意图见图13),所述复合材料作为多层结构载药体的储药层外侧控制层,当复合材料在高于低温临界溶解温度条件下时孔隙率小,药物透过率低,可实现储药层内的药物能缓慢透过控制层释放;而当在低于低温临界溶解温度条件下时,复合材料孔隙率高,药物透过率高,可实现储药层的药物快速透过控制层快速释放。
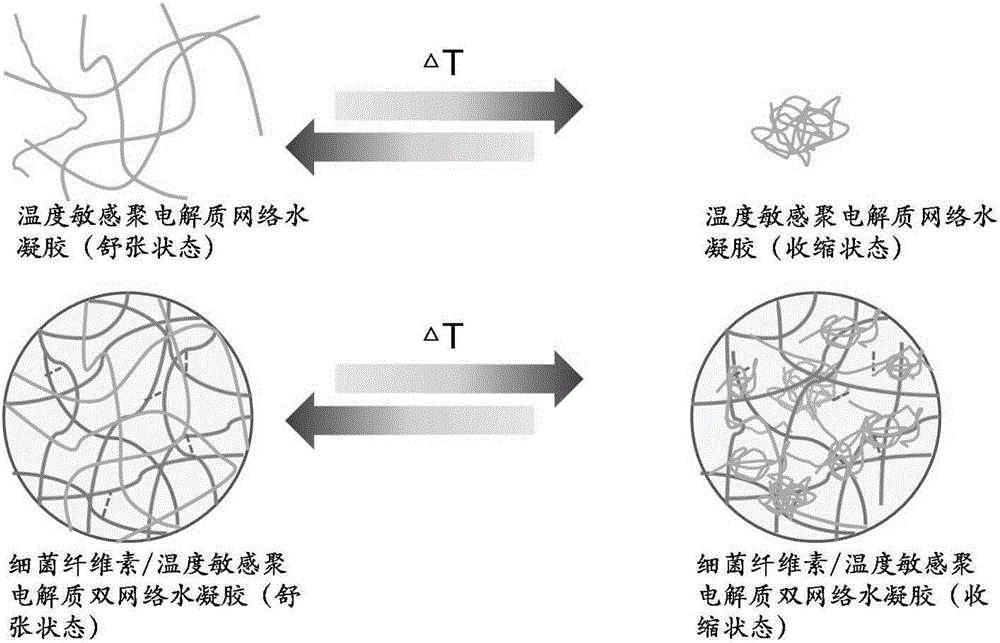
本发明的技术原理(见图1所示):以往纯细菌纤维素水凝胶失水后难以再溶胀的原因在于,纤维间和纤维内的大量氢键的形成使得网络空间结构坍塌压缩,从而形成难以恢复的致密结构。而本发明通过在细菌纤维素空间网络孔隙中添加聚电解质,可以形成细菌纤维素-聚电解质互穿或者半互穿的双网络结构。聚电解质包括聚阴离子电解质(譬如肝素、羧甲基纤维素、聚酸类高分子)、聚阳离子电解质(譬如壳聚糖、阳离子淀粉、聚乙烯亚胺、聚乙烯胺、聚乙烯吡啶等),及聚两性电解质(譬如羧甲基壳聚糖、蛋白质、核酸),其具有大量的羧基、氨基、磷酸基、磺基等带电基团,不同的pH值下这些基团具有不同的解离程度,这使得细菌纤维素网络孔隙中的聚电解质在不同pH下具有不同的带电特性(电荷量及电荷种类)。聚电解质在不同pH下具有不同的静电斥力。当在强电离pH条件下,细菌纤维素纳米网络中的聚电解质纤维间及纤维内部的静电斥力大于细菌纤维素及聚电解质的纤维间及纤维内氢键的作用时,细菌纤维素网络中纤维间紧密结合的氢键被聚电解质的静电斥力打开,紧密聚集结合纤维间出现孔隙,使得原本纤维素在氢键紧密结合下,显现强大的疏水作用,现转为暴露出大量亲水的羟基基团,造成水凝胶开始吸收水份,同时聚电解质本身的溶胀也会加快复合水凝胶的溶胀进程,从而达到在特定pH条件下高复水及溶胀特性。当在弱电离pH条件,聚电解质间的静电斥力因电荷量减少而减弱(两性聚电解质还会发生纤维间及纤维内不同电荷的静电引力增强),聚电解质及细菌纤维素纤维在纤维间氢键及范德华力作用下,纤维发生聚集,水凝胶网络孔隙减小,从而引发水凝胶的退溶胀。
此外,部分聚电解质及其衍生物具有温度响应特性,可以分为低温收缩型和高温收缩型两类,前者在低于低温临界溶解温度时聚电解质高分子产生收缩状态,在高于低温临界溶解温度时聚电解质高分子呈现伸展状态,而后者正好与之相反。这样在细菌纤维素网络结构中掺杂具温度响应的聚电解质或者具有温度响应的聚电解质单体与pH响应聚电解质单体的共聚物,可获得具有温度响应的或者具pH和温度双重响应的细菌纤维素复合物。
具有温度响应细菌纤维素/聚电解质(或其衍生物)复合物的响应原理(如图2所示):当温度处于聚电解质高分子收缩条件下,掺杂于细菌纤维素网络中的聚电解质收缩,使得复合材料网络孔隙减小,溶质分子透过率降低(可用于药物缓释);相反,当温度处于聚电解质高分子伸展状态下时,复合物网络结构的孔隙增加,溶质分子的透过率增加(可用于加快药物释放)。
以上所获的具环境响应细菌纤维素复合物,除了自身可单独作为药物的载体,通过环境响应的溶胀特性及水凝胶纳米纤维网络孔隙的变化,控制药物释放速率外;还可以用于局部或伤口给药系统中常见的多层载药结构系统中,作为控制药物释放速度的控制释放层(图13)或者包衣,利用其具环境响应的溶胀特性和水凝胶纳米纤维网络孔隙的响应变化,影响药物分子的跨膜扩散实现药物分子透过速率的环境响应控制。
有益效果
本发明具有温度响应特性,以温度控制材料网络孔隙大小,控制溶质分子透过率,实现药物可控释放。同时该复合材料保持了细菌纳米纤维素高强度、高生物相容性等特性,可以用于智能伤口敷料、智能药物载体、传感器、化学阀等;制备工艺简单,成本低,具有良好的应用前景。
附图说明
图1为聚电解质/细菌纤维素半互穿(互穿)双网络复合物在pH响应或者温度响应条件下不同溶胀性能的原理示意图;
图2为温度响应聚电解质衍生物/细菌纤维素半互穿(互穿)双网络复合物在温度响应条件下引起膜孔隙率变化的原理示意图;
图3为不同pH响应条件下的复合干膜的平衡溶胀率;
图4为实施例6制备的细菌纤维素/壳聚糖互穿双网络水凝胶湿膜在不同pH下的平衡及复水溶胀率;
图5为实施例7制备的细菌纤维素/聚丙烯酸互穿双网络水凝胶湿膜在不同pH下的平衡及复水溶胀率;
图6为实施例8制备的细菌纤维素/聚丙烯酰胺半互穿双网络水凝胶湿膜在不同pH下的平衡及复水溶胀率;
图7为实施例8制备的细菌纤维素/聚丙烯酰胺半互穿双网络水凝胶湿膜反复溶胀退溶胀循环处理时的溶胀率;
图8为实施例2、4、5、7、8所制备的溶胀前的复合干膜(或湿膜)实物图,及其在不同pH条件下溶胀平衡后的形态效果图;
图9为实施例9制备的细菌纤维素/壳聚糖互穿双网络复合冻干膜I在不同pH下的平衡溶胀率;
图10为载苯扎氯胺药物的复合湿膜F在不同pH环境下的释放速率;
图11为实施例4所制备的细菌纤维素/羧甲基纤维素半互穿水凝胶冻干后的扫描电镜图;
图12为实施例9所制备的细菌纤维素/壳聚糖互穿水凝胶冻干膜扫描电镜图;
图13为多层载药给药系统结构的示意图;
图14为实施例11所制备的细菌纤维素/聚N-异乙丙烯基丙烯酰胺半互穿双网络水凝胶在不同温度下时600nm可见光波长范围内的光透过率;
图15为实施例11所制备的细菌纤维素/聚N-异乙丙烯基丙烯酰胺半互穿双网络水凝胶分别在4℃及37℃温度条件下实物照片;
图16为用于测试药物在水凝胶中的透过率的水平双室扩散池的结构示意图;
图17为实施例11所制备的细菌纤维素/聚N-异乙丙烯基丙烯酰胺半互穿双网络水凝胶在两种不同温度下的药物累计透过量曲线。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
(1)选择的壳聚糖其特征粘度为50-800mPa·S,脱乙酰度为92.0%,测定其等电点pI为4.9,其在pH低于4.9时壳聚糖上的-NH2转变为-NH3+的电离平衡偏向于-NH3+,zata电位测定,随着pH降低,壳聚糖带电性能增加,当pH低于3.5时,zeta电位超过80mv,分子间的静电斥力较大,其响应溶胀pH为pH低于3.5。
(2)将厚度为2mm,含水比为523.9g/g(含水质量:材料干重)的细菌纤维素水凝胶膜通过碱煮和水煮的方式脱除细菌菌体和培养基。将纯化后的细菌纤维素膜用适量的醋酸溶解配置2%(w/v)壳聚糖溶液(pH5.0),50℃下浸泡5天。将浸渍完的细菌纤维素膜,用去离子水冲洗去表面的残余壳聚糖溶液。获得半互穿的细菌纤维素/壳聚糖水凝胶。
(3)将细菌纤维素/壳聚糖水凝胶置于聚四氟乙烯板上,在105℃鼓风干燥箱中干燥6h至完全干燥,获得细菌纤维素/壳聚糖半互穿复合干膜A。
(4)复水溶胀性能测试:配置pH分别为2.2,3.0,4.0,5.0,6.0,7.0的磷酸-柠檬酸钠缓冲液,将干燥后的细菌纤维素/壳聚糖干膜和未复合任何材料处理直接采用步骤3干燥的纯细菌纤维素膜(对照)称量其质量为m1,分别置于上述pH缓冲液中37℃下复水12h,测量复水之后的水凝胶膜的质量m2,膜的复水溶胀率SR(Swelling ratio,SR)按如下公式计算:
复合干膜A的pH响应复水特性:经过测定,细菌纤维素/壳聚糖半互穿双网络干膜A,在pH3.0,pH4.0,pH5.0,pH6.0,pH7.0不发生吸水溶胀,无法恢复为水凝胶态(其溶胀率分别为3.42,3.10,3.41,2.52,3.01g/g,各pH下的溶胀率见图3),而只在pH2.2时发生大量吸水溶胀,恢复成水凝胶状态(其溶胀率达到43.68g/g),作为对照组的纯细菌纤维素干膜,在各pH下,均不会发生快速溶胀,难以恢复成水凝胶状态,其溶胀率均在4.62g/g。
实施例2
(1)按照实施例1,步骤(1)-(2)制备的细菌纤维素/壳聚糖水凝胶,浸泡于2%(w/v)柠檬酸缓冲液中1小时,使得壳聚糖同过柠檬酸根离子交联。然后用去离子水洗去表面的残余交联液。
(2)将获得的细菌纤维素/壳聚糖水凝胶,置于聚乙烯膜上,25℃鼓风干燥箱中,风干,获得了细菌纤维素/壳聚糖互穿复合干膜B。
(3)按照实施例1步骤(4)所述方法进行复水溶胀性能测试。
复合干膜B的pH响应复水特性:(溶胀率见说明书图3,实物图见图8)经过测定,复合干膜B,对在pH4.0-7.0间复合干膜B,不发生吸水溶胀,不能恢复至水凝胶状态,其溶胀率分别为(1.37,1.77,0.80,0.98,0.67g/g),而对照纯细菌纤维素干膜在所有测试pH缓冲液中均不发生溶胀,其在pH2.2-7.0溶胀率分别为(5.72,5.425,6.25,4.6,4.65,4.22g/g),而在目标响应ph范围内的pH2.2和pH3.0时的复合干膜B可以快速吸收溶胀,从新还原成水凝胶状态,溶胀率分别为42.5g/g和12.31g/g。作为对照组的纯细菌纤维素干膜,在各pH下,均不会发生快速溶胀,难以恢复成水凝胶状态,其溶胀率均在4.62g/g。
实施例3
(1)按照实施例1,步骤(1)-(2)制备的的细菌纤维素/壳聚糖水凝胶,浸泡于无水乙醇中1小时,使得壳聚糖沉积于细菌纤维素网络中。在将浸泡后的BC重新浸泡于去离子水中4小时置换水凝胶中的乙醇,将获得的细菌纤维素/壳聚糖水凝胶,置于聚乙烯膜上,25℃鼓风干燥箱或者真空干燥箱中,风干,获得了细菌纤维素/壳聚糖半互穿复合干膜C。
(2)按照实施例1,步骤4所述方法进行复水溶胀性能测试。
复合干膜C的pH响应复水特性:(溶胀率见图3)经过测定,复合干膜C,对在pH4.0-7.0间复合干膜B,不发生吸水溶胀,不能恢复至水凝胶状态,其溶胀率分别为(2.60,2.05,2.24,2.03g/g),而对照纯细菌纤维素干膜在所有测试pH缓冲液中均不发生溶胀,其在pH2.2-7.0溶胀率分别为(5.72,5.425,6.25,4.6,4.65,4.22g/g),而在目标响应ph范围内的pH2.2和pH3.0时的复合干膜B可以快速吸收溶胀,从新还原成水凝胶状态,溶胀率分别为46.57g/g和21.12g/g。作为对照组的纯细菌纤维素干膜,在各pH下,均不会发生快速溶胀,难以恢复成水凝胶状态,其溶胀率均在4.62g/g。
实施例4
(1)选择羧甲基纤维素钠其粘度为300-800mPa·S,其测定其等电点pI为4.5~4.8,其在pH高于4.8时其分子链上的羧基COOH的电离平衡偏向于带负电的-COO-,电位滴定测定,羧甲基纤维素在pH6以上具有高电离度和表面带电特性。其响应溶胀范围是pH6以上。
(2)将厚度为2mm,含水比为523.9g/g(含水质量g:材料干重g)的细菌纤维素水凝胶膜通过碱煮和水煮的方式脱除细菌菌体和培养基。将纯化后的细菌纤维素膜浸泡于预先配置的2%(w/v)羧甲基纤维素干膜溶液中(pH9.0),将细菌纤维素浸泡于该溶液中,50℃下浸泡5天。将浸渍完的细菌纤维素膜,用去离子水冲洗去表面的残余CMC溶液。获得半互穿的细菌纤维素/CMC水凝胶。
(3)将获得的半互穿的细菌纤维素/CMC水凝胶,置于聚乙烯膜上,在37℃鼓风干燥箱中烘干至恒重。获得的细菌纤维素/CMC半互穿复合干膜D。
(4)按照实施例1步骤4进行平衡溶胀率测试。
(5)通过扫描电镜观测显示(如图11)细菌纤维素/羧甲基纤维素半互穿水凝胶保存了原来BC网络的纳米纤维网络结构。
复合干膜D的pH响应复水特性:(溶胀性能见图3,实物图见图8)经过测定,复合干膜D,具有pH响应的高复水溶胀性能,其溶胀性能随着pH值改变,其在pH2.2,3.0,4.0,5.0,6.0,7.0,8.0的缓冲液中的溶胀率分别为10.11,12.63,42.55,68.52,71.59,72.27,50.86g/g。其在pH6.0以上的弱酸至弱碱范围中具有很大的溶胀复水性能,可以恢复为完全的水凝胶状态。在酸性条件下,这复水性能较低,难以完全恢复水凝胶状态。作为对照组的纯细菌纤维素干膜,在各pH下,均不会发生快速溶胀,难以恢复成水凝胶状态,其溶胀率均在4.62g/g。
实施例5
(1)选择羧甲基壳聚糖,即其存在着大量可以解离的氨基和羧基,即存在着两个端点响应,当pH值高于等电点时,羧基COOH的电离平衡偏向于带负电的-COO而-NH3+-的电离平衡偏向于-NH2,高分子链电电性偏向于负电,而当pH低于等点时,则两个电离平衡相反,高分子电性偏向于带正电。酸碱滴定测定其等电点为pH3.4(参考水溶性O-羧甲基壳聚糖的制备及结构表征),而在pH2和pH6~8具有较好的溶解及带电性能。其设计响应pH为2.0及pH高于6.0。
(2)将厚度为2mm,含水比为523.9g/g(含水质量g:材料干重g)的细菌纤维素水凝胶膜通过碱煮和水煮的方式脱除细菌菌体和培养基。将纯化后的细菌纤维素膜浸泡于预先配置的2%(w/v)羧甲基壳聚糖干膜溶液中(pH9.0),50℃下浸泡5天。将浸渍完的细菌纤维素膜,用去离子水冲洗去表面的残余羧甲基壳聚糖溶液。获得半互穿的细菌纤维素/羧甲基壳聚糖水凝胶。
(3)将获得的半互穿的细菌纤维素/羧甲基壳聚糖水凝胶,置于聚四氟乙烯板上,在105℃鼓风干燥箱中烘干至恒重。获得的细菌纤维素/羧甲基壳聚糖半互穿复合干膜E。
(4)按照实施例1步骤4进行平衡溶胀率测试。
复合干膜E的pH响应复水特性:(溶胀性能见图3,实物图见图8)经过测定,复合干膜E,具有pH响应的高复水溶胀性能,其溶胀性能随着pH值改变,其在非设计响应pH范围内(pH3.0-5.0),难以复水溶胀恢复为完全的水凝胶状态,其溶胀率分别为3.00,4.18,7.56g/g,在设计响应pH值范围内,pH2.2,6.0,7.0,8.0的缓冲液中的溶胀率分别为35.86,18.08,32.02,47.20g/g,可以恢复为完全的水凝胶状态且溶胀性能表现为pH响应相关性。作为对照组的纯细菌纤维素干膜,在各pH下,均不会发生快速溶胀,难以恢复成水凝胶状态,其溶胀率均在4.62g/g。
实施例6
(1)按照实施例1,步骤(1)-(2)制备的的细菌纤维素/壳聚糖水凝胶,浸泡于2%(w/v)柠檬酸钠缓冲液中1小时,使得壳聚糖同过柠檬酸根离子交联。同时在该pH条件下,细菌纤维素/壳聚糖水凝胶将发生退溶胀,缩聚。用去离子水冲去水凝胶表面的残余的柠檬酸钠溶液,获得的细菌纤维素/壳聚糖水凝胶,聚乙烯膜上,在37℃鼓风干燥箱干燥5分钟,去除表面的水分,获得了细菌纤维素/壳聚糖互穿复合湿膜F。
(2)复水溶胀性能测试:配置离子强度为0.2M,pH分别为2.2,3.0,4.0,5.0,6.0,8.0,的磷酸氢二钠-柠檬酸-氢氧化钠缓冲液中,将在稀酸性溶液中退水缩聚的细菌纤维素/壳聚糖湿膜质量为m3(g),将退水后的复合湿膜置于不同pH的测试缓冲液中充分溶胀24h,记录其溶胀后复合水凝胶的质量为m2,另外将复水后的水凝胶膜在105℃,鼓风干燥箱中干燥至恒重,记录其干膜质量为m1,膜的复水溶胀率RSR(Re-swelling ratio,RSR),和平衡溶胀率SR(reswelling ratio,SR)按如下公式计算:
复合湿膜F的pH响应复水特性:(见图4)经过测定复合湿膜G的溶胀率与再溶胀率表现出pH响应的高复水特性,其在pH为2.2,3.0,4.0,5.0,6.0,7.0,8.0缓冲液中溶胀24h,可以获得不同的复水溶胀率分别为34.17,20.8,2.07,2.20,2.12,3.35,1.46g/g(相对应的平衡溶胀率为55.34,41.97,23.24,23.37,23.29,24.52,22.63)。其在设计响应pH值范围内(pH2.2,pH3.0)溶胀,而在非设计响应pH范围内基本不发生溶胀复水。
实施例7
(1)将厚度为2mm,含水比为523.9g/g(含水质量g:材料干重g)的细菌纤维素水凝胶膜通过碱煮和水煮的方式脱除细菌菌体和培养基。将纯化后的细菌纤维素膜浸泡于2mol/L丙烯酸水溶液,25℃下避光浸渍3天。
(2)将浸渍完的细菌纤维素水凝胶,浸入过硫酸铵(50mg/L,引发剂)和甲叉双丙烯酰胺(0.1mol/L,交联剂)溶液中,80℃,聚合交联反应6h,使得细菌纤维素水凝胶中的丙烯酸单体聚合成为聚丙烯酸聚电解质穿插于细菌纤维素网络中。将反应后的细菌纤维素/聚丙烯酸互穿双网络水凝胶,用去离子水将表明冲洗干净,并浸泡于去离子水中24h,以除去其中的残余单体和引发剂。将获得的细菌纤维素/聚丙烯酸互穿双网络水凝胶,在低离子强度的酸性稀溶液中(作为优选的0.1g/L的柠檬酸溶液,pH2.0)充分退溶胀24h。获得退溶胀后的细菌纤维素/丙烯酸半互穿双网络水凝胶复合湿膜G.
(3)复水溶胀性能测试:配置离子强度为0.2M,pH分别为3.0,4.0,6.0,8.0,10.0,11.0,12.0的磷酸氢二钠-柠檬酸-氢氧化钠缓冲液中,将在稀酸性溶液中退水缩聚的细菌纤维素/聚丙烯酸湿膜质量为m3(g),将退水后的复合湿膜置于不同pH的测试缓冲液中充分溶胀24h,记录其溶胀后复合水凝胶的质量为m2,另外将复水后的水凝胶膜在105度鼓风干燥箱中干燥至恒重,记录其干膜质量为m1,膜的复水溶胀率RSR(Reswelling ratio,RSR),和溶胀率SR(reswelling ratio,SR)按实施实例6,步骤(2)中所列公式计算。
复合湿膜G的pH响应的复水溶胀特性:(溶胀性能见图5,实物图见图8)经过测定复合湿膜G的溶胀率与再溶胀率表现出pH响应的高复水特性,其在pH为3.0,4.0,6.0,8.0,10.0,11.0,12.0缓冲液中溶胀24h,可以获得不同的平衡溶胀率,分别达到17.01,21.75,21.79,18.79,39.59,35.74,34.67,g/g(相对的复水溶胀率分别为5.44,12.27,15.63,13.85,32.99,28.05,28.06,g/g)。其在碱性条件下(pH10.0,11.0,12.0)由于聚丙烯酸链上的-COOH大量解离成-COO-,聚电解质分子链上带有大量的负电基团,使得分子间及分子间斥力加强,水凝胶可以获得较大的吸水溶胀效果。
实施例8
(1)将厚度为2mm,含水比为523.9g/g(含水质量g:材料干重g)的细菌纤维素水凝胶膜通过碱煮和水煮的方式脱除细菌菌体和培养基。将纯化后的细菌纤维素膜浸泡于单体水溶液中(1.5mol/L丙烯酸,0.5mol/L丙烯酰胺),25℃下避光浸渍3天。
(2)将浸渍完的细菌纤维素水凝胶,浸入过硫酸铵(50mg/L,引发剂)溶液中,80℃,聚合交联反应6h,使得细菌纤维素水凝胶中的丙烯酸及丙烯酰胺单体聚合成为聚丙烯酰胺酸聚电解质穿插于细菌纤维素网络中。将反应后的细菌纤维素/聚丙烯酰胺半互穿双网络水凝胶,用去离子水将表明冲洗干净,并浸泡于去离子水中24h,以除去其中的残余单体和引发剂。将获得的细菌纤维素/聚丙烯酰胺半互穿双网络水凝胶,在低离子强度的酸性稀溶液中(作为优选的0.1g/L的柠檬酸溶液,pH2.0)充分退溶胀24h。获得退溶胀后的细菌纤维素/丙烯酸半互穿双网络水凝胶复合湿膜H。
(3)复水溶胀性能测试:配置离子强度为0.2M,pH分别为2.0,4.0,6.0,8.0,10.0的磷酸-柠檬酸-氢氧化钠缓冲液中,将在稀酸性溶液中退水缩聚的细菌纤维素/聚丙烯酸湿膜质量为m3(g),将退水后的复合湿膜置于不同pH的测试缓冲液中充分溶胀24h,记录其溶胀后复合水凝胶的质量为m2,另外将复水后的水凝胶膜在105度鼓风干燥箱中干燥至恒重,记录其干膜质量为m1,膜的复水溶胀率RSR(Reswelling ratio,RSR),和溶胀率SR(reswelling ratio,SR)按实施实例6步骤(3)中所述方法计算。
(4)反复溶胀测试,将复合湿膜G置于pH10.0的0.2M的磷酸氢二钠-柠檬酸-氢氧化钠缓冲液,溶胀24h至平衡,记录其溶胀率,然后将溶胀后的复合膜置于pH3.0的缓冲液中,充分退溶胀,记录其溶胀率,然后重新置换为浸没与pH10.0的缓冲液中,溶胀24h至平衡,记录其溶胀率,后又反复轮流在pH3.0和pH10.0的缓冲液中退溶胀和溶胀,分别记录每次达到溶胀平衡后的的溶胀率,重复3次。
复合湿膜H的pH响应的复水溶胀特性:(溶胀性能见图6,实物图见图8)经过测定复合湿膜F的溶胀率与再溶胀率表现出pH响应的高复水特性,其在pH为2.0,4.0,6.0,8.0,10.0缓冲液中溶胀24h,可以获得不同的平衡溶胀率,分别达到8.79,15.69,21.24,24.16,49.23g/g(相对的复水溶胀率分别为0.15,5.01,13.34,13.17,37.06,g/g)。其在pH10.0条件下由于聚丙烯酰胺链上的-COOH大量解离成-COO-,。酰胺基团亦带有负电性,聚电解质分子链上带有大量的负电基团,使得分子间及分子间斥力加强,水凝胶可以获得较大的吸水溶胀效果。而在低pH范围内,聚电解质分子间静电斥力较小,从而复水溶胀性能较弱。该复合湿膜H,可以在不同的pH条件下反复溶胀及退溶胀能力(见图7),经过3个回合的溶胀及退溶胀循环后仍然能够保持原来的溶胀特性。
实施例9
(1)按实施例2步骤1制备,制备细菌纤维素/壳聚糖复合水凝胶。
(2)将细菌纤维素/壳聚糖复合水凝胶采用液氮冷冻,然后置于真空冷冻干燥机中脱水干燥至绝干。获得复合冻干膜I。
(3)按实施例1步骤4进行复水性能测试。
(4)扫描电镜显示(如图12所示)该细菌纤维素/壳聚糖复合冻干膜仍然保留了原细菌纤维素的纳米纤维网络结构。
复合冻干膜I的pH响应的复水溶胀特性:比较于实施例2中采用的热风干方式,通过冻干获得的膜均具有较好的复水溶胀特性,在各个pH值下的平衡溶胀率都能能达到20g/g以上,能够恢复成水凝胶,但是其仍然具备pH响应特性。测试结果表明在pH2.2条件下(溶胀率为48.33g/g),可以获得远高于其他pH值的溶胀率(pH3.0-7.0条件下的溶胀率依次为26.06,21.36,20.4,20.30,21.78g/g)(如图9所示)。
实施例10
(1)按照实施例6方法制备细菌纤维素/壳聚糖互穿双网络水凝胶湿膜。不同的是,在浸泡的壳聚糖溶液中还添加了1.7%(w/v)的苯扎氯铵,作为载入的模式药物。
(2)将制备的载有苯扎氯胺的药物的细菌纤维素复合膜,用打孔器制备为直径为1.2mm的小圆片,在模拟胃液(0.1N HCl,约pH=1.2),模拟体液(pH7.2),pH5.0及ph2.0的生理盐水中进行,药物释放试验,1片/5ml,共50ml,控制温度为37℃。采用紫外分光光度法,测定释放出的苯扎氯胺含量变化(参考文献Preparation and evaluation of a kind of bacterial cellulose dry films with antibacterial properties,Carbohydrate Polymers,2011,84(1):533-538.)。
细菌纤维素复合膜药物释放性能:按实施例6方法所制备的细菌纤维素/壳聚糖互穿双网络水凝胶湿膜是一类,设计在酸性条件下发生溶胀的水凝胶,其在酸性条件下,水凝胶网络疏松,孔隙扩大,有利于药物分子的快速扩散,以达到在设计pH值下,快速释放药物。如图10所示,从药物释放过程看,苯扎氯胺在模拟胃液及pH2.0生理盐水中的药物释放速率远高于在pH5.0的生理盐水及模拟体液(pH7.0)中的释放速率,显示该材料可以被用于药物控制释放。
实施例11
(1)将厚度为2mm,含水比为523.9g/g(含水质量g:材料干重g)的细菌纤维素水凝胶膜通过碱煮和水煮的方式脱除细菌菌体和培养基。将纯化后的细菌纤维素膜浸泡于单体水溶液中(1.0mol/L N-异乙丙烯基丙烯酰胺),25℃下避光浸渍6h,然后加入按2.5g/L的浓度加入过硫酸铵(引发剂)继续浸渍30min。
(2)将浸渍完的细菌纤维素水凝胶,在氮气保护下放入微波反应器中,600W微波辐照,聚合交联反应4min,并在30℃下冷却继续反应24h,使得反应充分完成,细菌纤维素水凝胶中的N-异乙丙烯基丙烯酰胺单体聚合成为聚N-异乙丙烯基丙烯酰胺电解质穿插于细菌纤维素网络中。将反应后的细菌纤维素/聚N-异乙丙烯基丙烯酰胺半互穿双网络水凝胶,用去离子水将表明冲洗干净,并浸泡于去离子水中24h,以除去其中的残余单体和引发剂,获得的细菌纤维素/聚N-异乙丙烯基丙烯酰胺半互穿双网络水凝胶J。
(3)或者将经碱纯化的细菌纤维素水凝胶膜或者冻干膜浸泡于含单体(1.0mol/L N-异乙丙烯基丙烯酰胺)和引发剂(过硫酸铵2.5g/L)的水溶液中,0-5℃和80-120rpm下避光振荡浸渍6-12h。将浸渍完的细菌纤维素水凝胶,在氮气保护下,于温度30-90℃反应1-12h;或者在氮气保护下放入微波反应器中,400-800W微波辐照,聚合交联反应4-6min,并在30℃下冷却继续反应24h,使得反应充分完成,细菌纤维素水凝胶中的N-异乙丙烯基丙烯酰胺单体聚合成为聚N-异乙丙烯基丙烯酰胺电解质穿插于细菌纤维素网络中。
(4)将获得的半互穿双网络水凝胶J浸泡于交联剂溶液中(如甲叉双丙烯酰胺、京尼平,或者戊二醛),在20-80℃反应0.5-12h,获得互穿双网络水凝胶。
(5)细菌纤维素/聚N-异乙丙烯基丙烯酰胺半互穿双网络水凝胶J的温度响应特性用分光光度计测定其在不同温度下OD600的光透过率。
细菌纤维素/聚N-异乙丙烯基丙烯酰胺半互穿双网络水凝胶J:(温度响应的透过率变化如图14所示,实物图变化见图15)该水凝胶在4-25℃下光透过率较高,说明孔隙率较大,随温度升高,水凝胶的光透过率降低,说明孔隙结构变致密。
实施例12
(1)利用按照实施例11所示方法,制备细菌纤维素/聚N-异乙丙烯基丙烯酰胺半互穿双网络水凝胶J。该材料可以作为说明书附图13所示结构的多层释要系统的控制层。
(2)采用双室扩散池(图16)测试其不同pH条件下的药物扩散能力,可以模拟测试水凝胶膜作为图13所示结构的多层释要系统的控制层的药物透过能力。在供给池中添加为pH7.0生理盐水配制的10g/L的苯甲酸溶液(苯甲酸作为药物模型),接受池内为生理盐水。供给池模拟储药层提供药物,通过连续检测8h内接收池内苯甲酸的浓度,确定苯甲酸的通过情况。通过控制双室扩散池(图16)中循环水浴温度,控制透膜过程环境温度。
苯甲酸的含量通过反相高效液相检测,药物的累计透膜量如图17所示,在37℃条件下,细菌纤维素/聚N-异乙丙烯基丙烯酰胺半互穿双网络水凝胶J的药物透过速率低于在20℃条件下的药物透过速率。说明细菌纤维素/聚N-异乙丙烯基丙烯酰胺半互穿双网络水凝胶J具有温度响应的药物透过控制能力。
- 还没有人留言评论。精彩留言会获得点赞!