同时检测大鼠五种病原体的引物组、试剂盒及多重免疫荧光分析方法与流程
本发明属于生物检测领域,更具体地,涉及同时检测大鼠五种病原体的引物组、试剂盒及多重免疫荧光分析方法。
背景技术:
实验动物微生物质量检测是评价实验动物质量的重要指标,微生物感染不仅对实验动物本身造成危害,对科研工作也造成潜在干扰。实验大鼠病原微生物多呈隐性感染,没有明显的临床症状,疫病诊断比较困难。而且动物感染病原体往往表现为持续性感染,设施一旦存在病原体感染比较难清除,需要通过检测和淘汰(test-and-removal)方法才能从受污染的设施彻底根除病原体,因此,建立快速高效的实验动物病原体检测方法,及时准确地发现病原感染,控制及清除疫情,对于提高实验动物质量非常重要。
我国实验动物国家标准GB14922.2-2011中规定的SPF级大鼠需排除21种病原微生物。本发明中的大鼠冠状病毒/涎泪腺炎病毒(Rat coronavirus,RCV)、小鼠肺炎病毒(Pneumonia virus of mice,PVM)、肺支原体(Mycoplasma pulmonis,M.pulmonis)是国家标准需要排除的病原。大鼠泰勒病毒(Rat theilovirus,RTV)和小鼠脑脊髓炎病毒(Theiler’s murine encephalomyelitis virus,TMEV)是新发现的感染实验大鼠的病毒,我们调查发现普通环境下饲养的大鼠中RTV、TMEV的感染率分别为37.6%(n=101)和24.8%(n=101)。这两种病毒是国外实验动物健康监测的一个必检项目,我国实验动物国家标准中虽然尚未把RTV和TMEV列入检测项目,但是一些实验动物生产或使用单位、以及一些CRO公司都把其列为筛查项目。
目前,国内病毒感染诊断方法主要是针对抗体检测的血清学检测方法如酶联免疫吸附试验(ELISA)、免疫酶试验(IEA)和免疫荧光试验(IFA)等,但是这些方法中不能应用于免疫功能低下或免疫缺陷大鼠的检测,因为它们不能产生正常的抗体反应。抗原检测方面常规病毒分离鉴定方法既复杂又繁琐,不利于日常检测。传统的检测技术已不能满足实验动物质量检测需求,以PCR为基础的分子生物学诊断方法检测病毒具有快速、灵敏、特异等特点,是目前临床上检测和诊断疾病的常用检测方法。但普通PCR方法需要开盖对产物进行凝胶电泳分析,操作方法不够简化,而且容易产生气溶胶污染,导致出现假阳性。实时荧光定量PCR技术因高精确度,高灵敏性,污染少等优点是目前病毒感染诊断的重要手段。但实时荧光PCR技术受到荧光种类及仪器自身的限制,最多只能对5个靶标进行检测,且实验成功的难度极大,成本也相对较高。
Luminex液相芯片技术是20世纪90年代兴起的一种新型的多重荧光免疫分析方法,该技术有机地整和了荧光编码微球技术、激光分析技术、流式细胞技术、高速数字信号处理技术、计算机运算法则等多项技术。与传统的临床检测方法相比,其主要优点在于可以自由组合、高通量、灵敏度高、重复性好、检测范围广、反应速度快、低成本、操作简便,既能检测蛋白又能检测核酸等。本发明利用Luminex液相芯片技术建立一种同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的多重免疫荧光分析方法,可应用于实验大鼠的质量监测、流行病学调查及早期预警。
技术实现要素:
本发明的目的在于提供同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的引物组、试剂盒及多重免疫荧光分析方法。
本发明所采取的技术方案是:
同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的引物组,包括6对引物,所述6对引物是通过对6对原始引物进行修饰而成;所述修饰为每对原始引物中的一条原始引物的5’端与对应的tag序列的3’端通过间臂连接,另一条原始引物的5’端添加生物素标记;
所述的原始引物对如下:
RTV原始上游引物:5’-GGAAACTTAGAGCAGACATCG-3’,
RTV原始下游引物:5’-TCCACAGAGAACAACCATCG-3’,
TMEV原始上游引物:5’-CGTTGGAAAAGCACCTCTCAC-3’,
TMEV原始下游引物:5’-TCGGAGTCGGTTGACTTAGAT-3’,
RCV原始上游引物:5’-TGGMATCCTCAAGAAGACCACTT-3’,
RCV原始下游引物:5’-ATGCCMGAAAACCARGAGTAATG-3’,
PVM原始上游引物:5’-GCTGGCATTCCACATAACC-3’,
PVM原始下游引物:5’-CCCACAAGGTACACGGAGA-3’,
M.pulmonis原始上游引物:5’-GGAAATGCCCTAAGTATGACGG-3’,
M.pulmonis原始下游引物:5’-CGGATAACGCTTGCACCCTA-3’,
内标MS2原始上游引物:5’-CGCAGAATCGCAAATACAC-3’,
内标MS2原始下游引物:5’-TAACAATAAGCTCGCAGTCG-3’;
所述的tag序列如下:
RTV的tag序列为:5’-ACTTATTTCTTCACTACTATATCA-3’,
TMEV的tag序列为:5’-TTAAACAATCTACTATTCAATCAC-3’,
RCV的tag序列为:5’-CACTTAATTCATTCTAAATCTATC-3’,
PVM的tag序列为:5’-ATACTTTACAAACAAATAACACAC-3’,
M.pulmonis的tag序列为:5’-TACTACTTCTATAACTCACTTAAA-3’,
内标MS2的tag序列为:5’-ATTAAACAACTCTTAACTACACAA-3’。
进一步的,所述间臂为12~18个原子的引物中间修饰物。
优选的,所述间臂为六乙二醇间臂。
同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的试剂盒,其特征在于:所述试剂盒含有同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的引物组、6种编码不同荧光色的荧光编码微球,所述的独立荧光编码微球含有与上述引物中tag序列互补配对的anti-tag序列。
进一步的,上述试剂盒还含有链霉亲和素-藻红蛋白复合物、RT-PCR扩增试剂、内标MS2标准品、混合阳性对照、阴性对照,所述混合阳性对照为同时含有RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的核酸样品;所述阴性对照为不含有RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的核酸样品。
同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的多重免疫荧光分析方法,包括如下步骤:
1)从样品中提取病原体RNA或DNA,作为模板,同时设置空白对照、阴性对照、混合阳性对照;所述空白对照为不添加模板;所述阴性对照为以不含有RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的核酸样品为模板;所述混合阳性对照为以同时含有RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的核酸样品为模板;
2)在样品中加入内标MS2的核酸作为质控,用上述试剂盒内的引物组进行RT-PCR扩增;
3)将扩增产物、上述试剂盒内的6种编码不同荧光色的荧光编码微球、链霉亲和素-藻红蛋白进行杂交;
4)杂交结束后,通过Luminex系统对杂交产物进行检测分析,读取不同病原体的MFI值;
5)结果判断:当样本的MFI值/空白对照的MFI值≥3.0时,判为阳性,否则判为阴性;
上述方法用于非疾病的诊断和治疗。
进一步的,步骤2)中,RT-PCR扩增的20μL反应体系含有:5×buffer4μL、dNTP0.8μL、Enzyme mix0.8μL、引物组内每对引物混合液(10μM)各0.4μL、模板4μL、无RNase水8μL。
进一步的,步骤2)中,RT-PCR扩增的反应程序为:48~52℃反转录25~35min;95℃预变性15min;94℃变性30s,60℃退火90s,72℃延伸30s;循环35次;72℃终延伸10min。
进一步的,步骤3)中,杂交的100μL反应体系含有:6种编码不同荧光色的荧光编码微球20μL、链霉亲和素-藻红蛋白75μL、扩增产物5μL。
进一步的,步骤3)中,杂交的反应程序为:43~47℃反应20~30min。
本发明的有益效果是:
本发明将多重PCR技术和Luminex液相芯片技术相结合,设计了一种可同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis这五种病原体的引物组,利用该引物组通过特定PCR获得目标扩增产物,然后将扩增产物、荧光编码微球和链霉亲和素-藻红蛋白进行杂交,通过Luminex检测仪读取MFI值时,从而分辨不同类型的病原体。该方法具有快速高效、特异性强、灵敏度高、重复性好等有益效果,可应用于实验大鼠的质量监测、流行病学调查及早期预警。具体如下:
1)目前实验动物常规检测方法均是单一项目检测,无法一次检测多种病原,与传统检测方法相比,本发明方法实现了对同一样本中的多种不同目的分子同时进行检测,实现高通量检测,而且可以根据病原的增多灵活增加检测项目;同时样本用量少,操作简单、快速,可大大降低检测成本。
2)通过特异性微球探针捕获PCR产物,优于传统多重检测方法用PCR产物片段长度进行结果判断,检测特异性更强。
3)液相芯片利用生物素-亲和素信号放大系统,其亲和力高达1015L/moL,比单纯的抗体亲和力高104倍以上,使检测结果更灵敏、受环境干扰较小、稳定性高;本发明方法的检测灵敏度比普通PCR高1~2个数量级。
4)Luminex液相芯片技术由于利用微球在溶液中反应,克服了片膜芯片在大分子检测时受表面张力、空间效应等对反应动力学的影响,大大提高了样品检测的重复性,检测结果可靠稳定;检测的重复性往往可以达到90%以上,并且线性范围也很宽。
5)本发明灵活性好,可以根据需要在此基础上加减检测病原的种类。
附图说明
图1:同时检测5种大鼠病原体的RT-PCR电泳图【1:RTV,2:TMEV,3:RCV,4:PVM,5:M.pulmonis,6:IC,7:混合阳性对照模板,8:空白对照,M:DL500DNA marker】;
图2:同时检测5种大鼠病原体的多重荧光免疫分析方法检测实验结果图;
图3:同时检测5种大鼠病原体的多重荧光免疫分析方法检测特异性实验结果图;
图4:同时检测5种大鼠病原体的多重荧光免疫分析方法检测灵敏度实验结果图;
图5:同时检测5种大鼠病原体的多重荧光免疫分析方法临床样本检测实验结果图。
具体实施方式
下面结合具体实施例对本发明作进一步的说明,但并不局限于此。下述实施例中所述试剂原料除特别注明来源外,均为市售的常见原料,试剂的配制采用常规方法。实施例中未详述的方法均为本领域常规操作。
实施例1、同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的引物组
根据发明目的,对大量序列进行分析比较,筛选出下述病毒的特异性保守序列:RTV的5’UTR基因序列(GenBank登录号:EU542581),TMEV的5’UTR基因序列(GenBank登录号:X56019),RCV的N基因序列(GenBank登录号:AF088984),PVM的NS1基因序列(GenBank登录号:AY743910)、M.pulmonis的16sRNA基因序列(GenBank登录号:AF125582)和MS2的包膜蛋白基因序列(GenBank登录号:NC001417,用作内标,internal control,简称IC)。
根据核酸序列设计引物,并进行引物二级结构及互相之间形成引物二聚体的能力进行评价。本发明在设计引物时遵循以下设计原则:引物长度为18~25bp,上下游引物之间不超过5bp,尽量使G+C含量在40%~60%间,引物自身不能有连续的4个碱基互补,尽量避免形成二聚体结构、发卡结构,扩增的片段大小选择在100~250bp之间,这样有利于减少Luminex微球杂交反应时的位阻效应,更有利于后续杂交反应的进行;同时,发明人也对tag序列形成引物二聚体的能力进行了分析,选择了与原始引物序列最合适的tag序列。
由于多重PCR体系中多个引物和模板在同一个反应管里,很容易造成互相干扰,并且引物之间很容易会形成二聚体,生物素化的引物形成二聚体后,在链霉亲和素-藻红蛋白作用后也会激发出很强的荧光信号,这样就会产生很高的阴性背景荧光,影响结果的判定,甚至导致试验失败。因此引物设计是本发明的关键,也是进行Luminex液相芯片检测的基础。
发明人对所设计的引物经过了大量的试验和改进,才克服了上述多重PCR引物设计的难点,优选出如下引物组,其用于多重荧光免疫同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis病原体的特异性和灵敏度最好,该优选引物组由下述原始引物对进一步修饰而成。
原始引物对的碱基序列如下:
RTV原始上游引物:5’-GGAAACTTAGAGCAGACATCG-3’(SEQ ID NO:1),
RTV原始下游引物:5’-TCCACAGAGAACAACCATCG-3’(SEQ ID NO:2),
TMEV原始上游引物:5’-CGTTGGAAAAGCACCTCTCAC-3’(SEQ ID NO:3),
TMEV原始下游引物:5’-TCGGAGTCGGTTGACTTAGAT-3’(SEQ ID NO:4),
RCV原始上游引物:5’-TGGMATCCTCAAGAAGACCACTT-3’(SEQ ID NO:5),
RCV原始下游引物:5’-ATGCCMGAAAACCARGAGTAATG-3’(SEQ ID NO:6),
PVM原始上游引物:5’-GCTGGCATTCCACATAACC-3’(SEQ ID NO:7),
PVM原始下游引物:5’-CCCACAAGGTACACGGAGA-3’(SEQ ID NO:8),
M.pulmonis原始上游引物:5’-GGAAATGCCCTAAGTATGACGG-3’(SEQ ID NO:9),
M.pulmonis原始下游引物:5’-CGGATAACGCTTGCACCCTA-3’(SEQ ID NO:10),
内标MS2原始上游引物:5’-CGCAGAATCGCAAATACAC-3’(SEQ ID NO:11),
内标MS2原始下游引物:5’-TAACAATAAGCTCGCAGTCG-3’(SEQ ID NO:12);
为了对大鼠RTV、TMEV、RCV、PVM、M.pulmonis病原体进行区分,故将上述引物作进一步的修饰,以满足相应的操作要求。在各条原始上游引物的5’端连接相应的tag序列,其中tag序列的3’端和引物序列的5’端之间通过六乙二醇间臂连接。
所连接的tag序列如下:
RTV的tag序列为:5’-ACTTATTTCTTCACTACTATATCA-3’(SEQ ID NO:13);
TMEV的tag序列为:5’-TTAAACAATCTACTATTCAATCAC-3’(SEQ ID NO:14);
RCV的tag序列为:5’-CACTTAATTCATTCTAAATCTATC-3’(SEQ ID NO:15);
PVM的tag序列为:5’-ATACTTTACAAACAAATAACACAC-3’(SEQ ID NO:16);
M.pulmonis的tag序列为:5’-TACTACTTCTATAACTCACTTAAA-3’(SEQ ID NO:17);
内标MS2的tag序列为:5’-ATTAAACAACTCTTAACTACACAA-3’(SEQ ID NO:18)。
另外,各条原始下游引物的5’端还添加有生物素标记。
实施例2、同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的试剂盒
试剂盒包括以下组分:
1)实施例1所设计的同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis病原体的引物组;
2)6种编码不同荧光色的包含有anti-tag序列的荧光编码微球,所述anti-tag序列能相应地与多重荧光免疫分析引物中的tag序列互补配对;6种微球均购自luminex公司,其中RTV、TMEV、RCV、PVM、M.pulmonis和IC分别对应的荧光编码微球号为MTAG-A034、MTAG-A046、MTAG-A028、MTAG-019、MTAG-029和MTAG-036;
3)链霉亲和素-藻红蛋白复合物、RT-PCR扩增试剂、内标MS2标准品、混合阳性对照、阴性对照;所述RT-PCR扩增试剂含有5×buffer、dNTP、Enzyme mix;所述混合阳性对照为同时含有RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的核酸样品;所述阴性对照为不含有RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的核酸样品。
实施例3、同时检测大鼠RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的多重荧光免疫分析方法的建立
(1)核酸提取
用核酸自动抽取仪(天根公司)分别提取RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的RNA或DNA,作为多重荧光免疫分析检测方法的模板。其中内标MS2标准品加到各个样品中,同步参与样品核酸的提取、加样、RT-PCR扩增及信号检测的全过程。
(2)质粒标准品的制备
以RTV、TMEV、RCV、PVM、M.pulmonis五种病原体的RN或DNA为模版,分别用实施例1所设计的原始引物组中相应的原始引物对进行RT-PCR扩增,将扩增产物分别进行琼脂糖凝胶电泳检测,用胶回收试剂盒回收目的片段,将回收的目的片段连接至pMD-19T载体,并转化至DH5α感受态细胞中,用含有Amp的LB琼脂平板筛选阳性克隆,用PCR鉴定阳性克隆菌,并对阳性重组质粒测序验证。用质粒提取试剂盒提取质粒,微量紫外分光光度计测定浓度与纯度,根据下面的公式计算拷贝数。拷贝数(copies/μL)=6.022×1023(copies/moL)×DNA浓度(g/μL)/质量MW(g/moL)。其中,MW=DNA碱基数(bp)×660daltons/bp,DNA碱基数=载体序列碱基数+插入序列碱基数。
(3)多重RT-PCR扩增
用实施例1所设计的引物组,分别对RTV、TMEV、RCV、PVM、M.pulmonis和MS2(内标)进行多重RT-PCR扩增,多重RT-PCR试剂采用Qiangen公司的OneStep RT-PCR Kit,每次试验同时设置阳性对照、阴性对照和空白对照,其中阳性对照以含有上述五种病原体的组织或细胞培养物提取的核酸作为阳性对照模板,其中阴性对照以不含有上述五种病原体核酸样品(可以是正常动物组织或正常细胞培养物)作为阴性对照模板,空白对照即为不加模板对照(No Template Control,NTC),即在反应中用水来代替模板。
RT-PCR扩增反应体系如下:
扩增的反应程序为:50℃反转录30min;95℃预变性15min;94℃变性30s,60℃退火90s,72℃延伸30s;循环35次;72℃终延伸10min。
PCR产物进行琼脂糖凝胶电泳分析,其电泳图如图1所示,可见均扩增出目的条带。
(4)杂交
将多重RT-PCR产物、荧光编码微球、链霉亲和素藻红蛋白(SA-PE)杂交,包括以下步骤:
所述荧光编码微球是包被有特异的anti-tag序列的6种微球,其中anti-tag序列能相应地与RTV、TMEV、RCV、PVM、M.pulmonis五种病原体和内标MS2引物上的tag序列互补配对。6种微球均购自luminex公司,具体的RTV、TMEV、RCV、PVM、M.pulmonis和IC分别对应的荧光编码微球号为MTAG-A034、MTAG-A046、MTAG-A028、MTAG-019、MTAG-029和MTAG-036。
荧光编码微球工作液的制备:将2500个/μL荧光编码微球用1.1×Tm Hybrdization Buffer稀释到1μL约含有125个/种荧光编码微球。
SA-PE工作液制备:将1mg/mL SA-PE用1×Tm Hybrdization Buffer稀释到10μg/μL。
充分重悬荧光编码微球工作液,每个样品孔和对照孔加入微球工作液20μL,随后样品孔中加入5μL PCR产物,对照孔中也分别加入5μL PCR阳性对照、阴性对照和空白对照产物,最后加入75μL的SA-PE工作液,充分混匀,于金属加热器中45℃孵育25min。
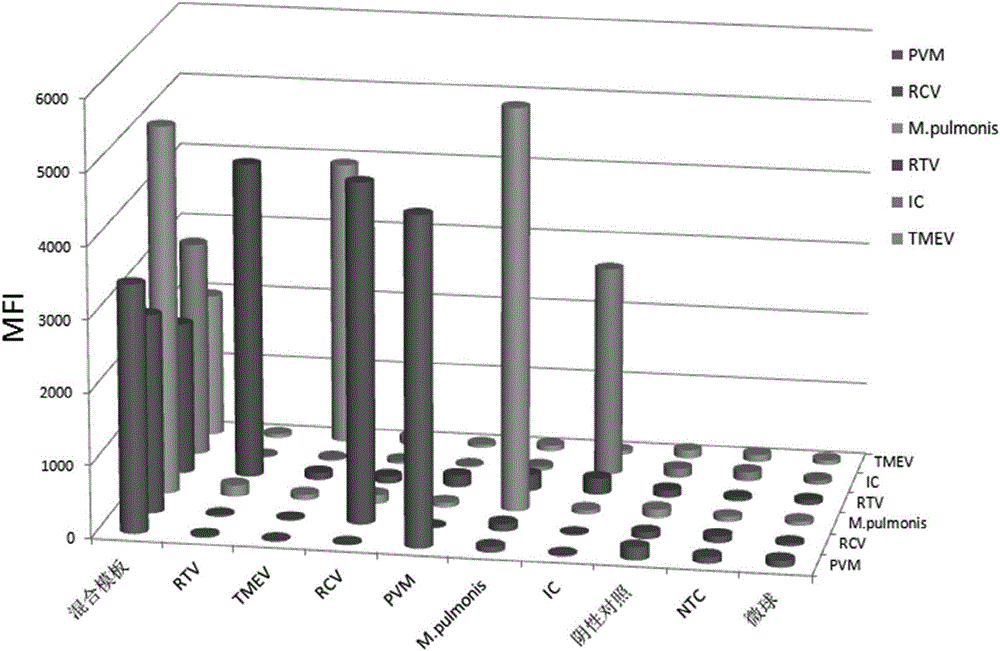
依照Luminex 200检测仪的说明将杂交后的50μL上述反应液进行检测,结果如图2所示。检测仪读取五种病原体的MFI值时,可以明显分辩不同类型的病原体。
结果判断标准:当样本的MFI值大于等于空白对照的MFI值的3倍,即样本的MFI值/空白对照的MFI值≥3.0时判为阳性,否则判为阴性。
实施例4、特异性试验
分别用RTV、TMEV、RCV、PVM、M.pulmonis、小鼠呼肠孤病毒III型(Reo-3)和小鼠细小病毒MVM株(MVM)、小鼠诺如病毒(MNV)、小鼠细小病毒MPV株(MPV)、淋巴细胞性脉络丛脑膜炎病毒(LCMV)、仙台病毒(SV)、小鼠出血热病毒(HV)、鼠痘病毒(Ect)、多瘤病毒(Poly)、小鼠腺病毒(Mad)、大鼠细小病毒KRV株(KRV)、大鼠细小病毒H-1株(H-1)、和小鼠巨细胞病毒(MCMV)的RNA或DNA作为模板进行多重荧光免疫分析检测,各样品添加内标MS2作为质控,同时设置阴性对照和空白对照,用实施例3建立的多重荧光免疫检测分析方法进行检测。
实验结果如图3所示,IC对照成立,根据判断标准:样本的MFI值/空白对照的MFI值≥3.0时判为阳性,否则判为阴性,只有RTV、TMEV、RCV、PVM、M.pulmonis为阳性,且不存在交叉反应,其他病原体均为阴性,说明本发明方法及试剂盒特异性好。
实施例5、灵敏度试验
将制备的RTV、TMEV、RCV、PVM、M.pulmonis五个病原体的质粒标准品用Easy dilution(Takara公司)做10倍系列稀释,得到1×107~1×100copies/μL系列标准模板,用上述建立的多重荧光免疫分析方法进行检测。
表1多重荧光免疫分析灵敏度检测结果
多重荧光免疫分析检测灵敏度实验结果如表1和图4所示,实验结果表明RTV、TMEV、RCV、PVM、M.pulmonis的最低检测限为1×102copies/μL。
实施例6、临床样品的检测
待测样本为广东地区收集的24份大鼠样本(编号为1-24),提取大鼠脏器和盲肠内容物的RNA/DNA,各样品添加内标MS2作为质控,同时设置阳性对照、阴性对照和空白对照,采用上实施例3建立的多重荧光免疫检测分析方法进行检测。
实验结果如图5所示,IC对照成立,根据判断标准:样本的MFI值/空白对照的MFI值≥3.0时判为阳性,否则判为阴性,结果:样本2、5、7、8、11、12、13、22、23为阴性样本;样本9、10、20为RTV核酸阳性样本;样本3、4为TMEV核酸阳性样本;样本16、17、18、19为RCV核酸阳性样本;样本15、21、24为PVM核酸阳性样本;样本1、6、14为M.pulmonis核酸阳性样本。阳性样本通过测序分析,结果一致。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
SEQUENCE LISTING
<110> 广东省实验动物监测所
<120> 同时检测大鼠五种病原体的引物组、试剂盒及多重免疫荧光分析方法
<130>
<160> 18
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> DNA
<213> 人工序列
<400> 1
ggaaacttag agcagacatc g 21
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<400> 2
tccacagaga acaaccatcg 20
<210> 3
<211> 21
<212> DNA
<213> 人工序列
<400> 3
cgttggaaaa gcacctctca c 21
<210> 4
<211> 21
<212> DNA
<213> 人工序列
<400> 4
tcggagtcgg ttgacttaga t 21
<210> 5
<211> 23
<212> DNA
<213> 人工序列
<400> 5
tggmatcctc aagaagacca ctt 23
<210> 6
<211> 23
<212> DNA
<213> 人工序列
<400> 6
atgccmgaaa accargagta atg 23
<210> 7
<211> 19
<212> DNA
<213> 人工序列
<400> 7
gctggcattc cacataacc 19
<210> 8
<211> 19
<212> DNA
<213> 人工序列
<400> 8
cccacaaggt acacggaga 19
<210> 9
<211> 22
<212> DNA
<213> 人工序列
<400> 9
ggaaatgccc taagtatgac gg 22
<210> 10
<211> 20
<212> DNA
<213> 人工序列
<400> 10
cggataacgc ttgcacccta 20
<210> 11
<211> 19
<212> DNA
<213> 人工序列
<400> 11
cgcagaatcg caaatacac 19
<210> 12
<211> 20
<212> DNA
<213> 人工序列
<400> 12
taacaataag ctcgcagtcg 20
<210> 13
<211> 24
<212> DNA
<213> 人工序列
<400> 13
acttatttct tcactactat atca 24
<210> 14
<211> 24
<212> DNA
<213> 人工序列
<400> 14
ttaaacaatc tactattcaa tcac 24
<210> 15
<211> 24
<212> DNA
<213> 人工序列
<400> 15
cacttaattc attctaaatc tatc 24
<210> 16
<211> 24
<212> DNA
<213> 人工序列
<400> 16
atactttaca aacaaataac acac 24
<210> 17
<211> 24
<212> DNA
<213> 人工序列
<400> 17
tactacttct ataactcact taaa 24
<210> 18
<211> 24
<212> DNA
<213> 人工序列
<400> 18
attaaacaac tcttaactac acaa 24
- 还没有人留言评论。精彩留言会获得点赞!
- 一种封闭式病原体检测卡盒的制作方法与工艺
- 检测16种呼吸道病原体的基因芯片检测用试剂盒及方法与流程
- 一种同时检测多种病原体的五重PCR检测方法与流程
- 逆转肿瘤多药耐药的基因组合物h‑R3/PAMAM G5/MDR1 siRNA及其应用的制作方法与工艺
- 用于对肉类、植物或植物部分进行病原体检测和病害治理的方法与流程
- 一种用于检测治疗恶性肿瘤的一线药物耐药基因表达量的试剂盒的制造方法与工艺
- 用于检测植物病原体的装置和方法与流程
- 用于检测多种病原体的荧光实时检测方法及应用与流程
- 一种用于检测手足口病相关病原体的LAMP引物组合物及其相关应用的制造方法与工艺
- 一种用于检测巴氏杆菌氯霉素类药物耐药基因的分子标记及其应用的制造方法与工艺