具有同位素的磷酸化合物的制造方法与流程
本申请是申请日为2012年5月7日、申请号为201280022384.6、发明名称为具有同位素的磷酸化合物的制造方法的申请的分案申请。
本发明涉及具有同位素的磷酸化合物的制造方法。
背景技术:
作为确认生物体内的化合物的动态的方法,通常使用导入了同位素的标记化合物。前述化合物包括例如dna和rna等核酸;前述同位素对生物体没有影响,所以稳定同位素的利用备受瞩目。
其中,导入有稳定同位素的核酸的合成通常预先在单体中导入稳定同位素,将其作为原料而进行多聚核苷酸的合成。并且,为了高灵敏度地检测稳定同位素,前述多聚核苷酸中优选导入多个稳定同位素。然而,根据该方法,为了导入多个稳定同位素,需要对包含a、g、c和t/u的各碱基的全部的单体进行标记化,存在劳力和成本变得极高的问题。
另外,作为稳定同位素的导入方法,公开有将2,2’-环尿苷通过苯甲酸(phc18o2h)进行开环,在糖的2’位导入具有稳定同位素的羟基(-18oh)的方法(非专利文献1)。然而,该方法只能对特定的具有嘧啶碱基的核苷进行标记化,不能得到具有其他的碱基的核苷。
这样,利用稳定同位素进行标记的劳力和成本方面的问题,不限于前述核酸,对于例如:药物、农药等低分子化合物也同样。
现有技术文献
非专利文献
非专利文献1:j.org.chem.2008jan.4;73(1):309-311
技术实现要素:
因此,本发明目的在于提供容易制造具有同位素的磷酸化合物的方法。
为了达成前述目的,本发明的制造方法的特征在于,其为具有同位素的磷酸化合物的制造方法,包含氧化工序:通过将三价磷化合物用包含同位素的氧化剂进行氧化而合成导入有前述同位素的五价的磷酸化合物。
根据本发明的制造方法,只使用前述包含同位素的氧化剂,就能够容易地制造包含同位素的磷酸化合物。本发明的制造方法对于例如具有磷酸基的核酸的合成、具有磷酸基的农药、药物、磷脂等低分子化合物的合成是有用的。
附图说明
图1为实施例1中18o标记化多聚尿苷酸的质谱分析谱图。
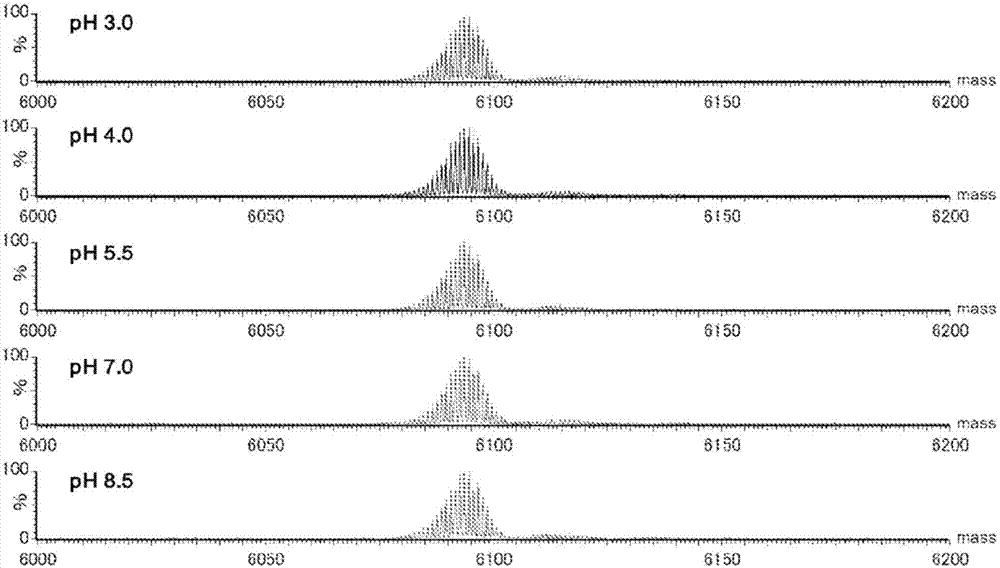
图2为实施例1中在规定的ph下进行了处理的18o标记化多聚尿苷酸的质谱分析谱图。
图3为实施例2中导入了18o的sirna的native-page的照片。
图4为表示实施例2中导入了18o的sirna的圆二色谱的图。
图5为表示实施例2中人gapdh基因的mrna的表达量的相对值的图。
图6为表示实施例3中18o标记化多聚尿苷酸的浓度与δ18o[‰]的关系的图。
图7为实施例4中观察导入了18o的sirna的细胞内定位的照片。
具体实施方式
本发明的制造方法,如前述,其特征在于,其为具有同位素的磷酸化合物的制造方法,其包含氧化工序:通过将三价磷化合物用包含同位素的氧化剂(以下,称为“同位素氧化剂”)进行氧化而合成导入有前述同位素的五价的磷酸化合物。
根据本发明的制造方法,通过前述同位素氧化剂,三价磷化合物的三价磷被氧化为五价磷,与此同时地,来源于前述同位素氧化剂的前述同位素与前述五价磷键合。因此,只进行通过前述同位素氧化剂进行的氧化反应,就能够得到导入有同位素的五价的磷酸化合物。因此,根据本发明,可以说例如:能够将导入有同位素的磷酸化合物的用途进一步推广。
本发明如前述,其特征在于,使用前述同位素氧化剂将三价磷化合物氧化;对于其他的构成以及其他的条件,没有特别的限定。
本发明的制造方法,如前述,优选适用于例如:具有磷酸基的农药、药物、磷脂等的合成,适用于具有磷酸基的rna和dna等核酸、作为单体的核苷单磷酸、核苷二磷酸、核苷三磷酸的合成等;其中,特别优选适用于前述核酸的合成。对于前述核酸的合成方法,没有特别的限制,可列举出例如:磷酸酯法、亚磷酰胺法(或也称为phosphoramidite法)(以下,为amidite法)等。以下,以amidite法为例进行说明,但本发明不受任何限定。核酸的固相合成(solid-phasesynthesis)中,amidite法通常将单体亚磷酰胺的偶联工序、由此产生的三价磷向五价磷(磷酸基)的氧化工序以及将5’末端的糖的保护基脱去的脱保护工序作为1循环;重复进行前述循环直至成为所希望的长度为止。根据本发明,在前述氧化工序中,只使用前述同位素氧化剂就能够容易地在磷酸二酯键的磷酸基上导入同位素。另外,通过只在所希望的循环的氧化工序中使用前述同位素氧化剂,就能够只在所希望的磷酸二酯键上导入前述同位素。进一步,通过在全部的循环的氧化工序中使用前述同位素氧化剂,也能够在全部的磷酸二酯键的磷酸基上导入前述同位素。另外,现有技术如前述,需要合成在每个要标记的碱基上导入了同位素的amidite,所以存在花费劳动力和成本的问题。然而,根据本发明,不论碱基而在磷酸二酯键的磷酸基上导入同位素,所以不需要合成如前述的每个碱基上导入有同位素的amidite。因此,能够将劳动力和成本极大地降低;另外,对目标的合成核酸的碱基序列也没有影响。
本发明中,利用前述氧化剂实施的氧化反应为例如:将前述三价磷化合物中的三价磷氧化为五价磷,并且,使来源于前述氧化剂的原子与前述五价磷键合的氧化反应。因此,本发明中,前述同位素氧化剂只要键合于前述五价磷的前述原子为前述同位素即可。
本发明中,对于前述同位素氧化剂,没有特别的限制,只要是例如:将前述三价磷化合物中的三价磷氧化为五价磷且对前述五价磷供给原子、且具有同位素作为对前述五价磷供给的原子的物质即可。表现这样的氧化反应的氧化剂,只要是本领域技术人员就能够由申请时的技术常识理解,前述具有同位素作为所供给的原子的氧化剂,能够例如购买市售品,或者由申请时的技术常识制造。
对于前述同位素,没有特别的限制,例如:既可以为稳定同位素也可以为放射性同位素,优选为前者。如果是前述稳定同位素,例如暴露于辐射的危险性小、也不需要专用的设施,因而处理性优异、也能够抑制成本。另外,前述稳定同位素例如与荧光标记不同,被标记的化合物的物性变化不存在,作为示踪剂的性质也优异。
对于前述同位素氧化剂,没有特别的限制,可列举出例如:通过氧化向五价磷供给同位素氧的氧供给体。前述同位素可列举出例如:17o、18o等,优选为18o。
前述氧供给体可列举出例如:具有同位素氧的、水或过氧化物(peroxide)。前述过氧化物由例如:化学式r-o-o-r’所表示,r和r’为例如:h或任意的取代基。r和r’既可以相同也可以不同。对于前述取代基,没有特别的限制,可列举出例如:碳原子数1~10的烷基等,既可以为直链也可以为支链。前述烷基可例示出例如:叔丁基等丁基等。前述过氧化物可列举出例如:r和r’的至少一者优选为氢、卤素或一价金属的、更优选为r和r’的至少一者为氢的过氧化氢。前述过氧化氢可列举出例如:叔丁基过氧化氢等。前述一价金属可列举出例如:碱金属,可例示出钠、钾、锂、铷、铯、钫等。
前述氧供给体中,例如:从能够得到纯度高的市售品的角度出发,特别优选为具有18o的h218o。使用前述具有同位素氧的水的情况下,例如:优选组合使用碘(i2)、吡啶(py)和四氢呋喃(thf)。使用前述具有同位素氧的水的情况下,得到的五价的磷酸化合物优选例如:五价的磷上键合有具有同位素氧的羟基(-18oh),前述羟基中的氢也可以例如:用碱金属等一价金属等置换。前述碱金属可列举出例如:钠、钾、锂、铷、铯、钫等。
前述同位素氧化剂除此之外还可列举出例如:通过氧化对五价磷供给同位素硫的硫供给体。前述同位素可列举出例如:33s、34s、36s等,优选为34s。
前述硫供给体优选为例如:具有同位素硫的二硫化物(具有-s-s-的化合物),更优选为有机二硫化物,进一步优选为环状有机二硫化物。作为二硫化物的具体例,可列举出例如:3h-1,2-苯并硫醇3-酮-1,1-二氧化物、5-((二甲基氨基-亚甲基)氨基)-3h-1,2,4-二噻唑-3-硫酮等,优选为3h-1,2-苯并二硫醇3-酮-1,1-二氧化物,更优选为具有34s的3h-1,2-苯并二硫醇3-酮-1,1-二氧化物。使用前述具有同位素硫的硫供给体的情况下,得到的五价的磷酸化合物优选为例如五价的磷上键合有同位素硫,具体而言,优选形成硫代磷酸酯。
另外,前述同位素氧化剂可列举出例如,通过氧化向五价磷供给同位素硼的硼供给体。前述同位素可列举出例如10b等。
前述硼供给体优选为例如:具有同位素硼的、胺-硼烷复合物,更优选为三烷基胺-硼烷复合物。前述三烷基胺-硼烷复合物可列举出例如:c8h19n·bh3所示的二异丙基乙基胺(dipea)-硼烷复合物等,优选为具有10b的dipea-硼烷复合物c8h19n·10bh3。使用前述具有同位素硼的dipea-硼烷复合物的情况下,得到的五价的磷酸化合物优选例如:具有同位素硼的硼烷基(-10bh3-)与五价的磷键合,具体而言,优选形成硼烷化磷酸酯。前述胺-硼烷复合物中,前述硼烷基的氢也可以例如用卤素取代。前述卤素可列举出例如:f、cl、br、i等。另外,前述硼烷基也可以例如与一价金属或二价金属形成盐。前述一价金属为例如碱金属,可例示出钠、钾、锂、铷、铯、钫等。二价金属为例如碱土金属,可列举出例如:钙、锶、钡、镭等。
本发明中,对于前述三价磷化合物没有特别的限定,只要是具有三价的磷的化合物即可。前述三价磷化合物可列举出例如:亚磷酸、亚磷酸酯。
前述亚磷酸除了例如亚磷酸[hp(o)(oh)2]之外,还包括亚磷酸盐、亚磷酸衍生物等。根据本发明的制造方法,通过使用前述亚磷酸作为前述三价磷化合物,能够制造磷上键合有同位素的磷酸。得到的磷酸也包含例如:磷酸盐、磷酸衍生物等的意思。
前述亚磷酸酯可以为例如:亚磷酸单酯[r1o-p(ox2)-ox3]、亚磷酸二酯[r1o-p(or2)-ox3]、亚磷酸三酯[r1o-p(or2)-or3]的任一者。前述x2和x3为例如:氢或一价金属。前述一价金属为例如碱金属,可例示出例如:钠、钾、锂、铷、铯、钫等。对于前述r1、r2和r3,没有任何限定,可列举出后述的烃基等各种有机基团。通过使用前述亚磷酸酯作为前述三价磷化合物,能够制造磷与同位素键合的磷酸酯。
通过本发明的制造方法合成的前述五价的磷酸化合物为前述核酸的情况下,前述核酸例如既可以为单体,也可以为前述单体聚合而成的聚合物。
前述单体可列举出例如:构成rna或dna的核苷酸。前述核苷酸为例如:包含糖和碱基的核苷上键合有五价的磷酸基。前述核苷酸具体而言,具有糖、碱基和五价的磷酸基,前述糖的1’位上键合有前述碱基,前述糖的5’位、3’位或2’位上键合有前述五价的磷酸基。前述核苷酸具体而言,可列举出:核糖核苷酸和脱氧核糖核苷酸。前述核苷酸也包含例如:前述核苷酸的衍生物的意思。前述聚合物为例如前述核苷酸的聚合物;具体而言,可列举出:作为核糖核苷酸的聚合物的rna、作为脱氧核糖核苷酸的聚合物的dna、核糖核苷酸与脱氧核糖核苷酸的聚合物(dna/rna嵌合体)等。前述聚合物中,例如,对前述单体的聚合数没有限定,也包含低聚物的意思。前述聚合物为例如:一者的核苷酸的糖与另一者的核苷酸的糖介由前述磷酸基而键合。具体而言,优选例如:在前述核苷酸残基间,一者的糖的5’位、3’位或2’位与另一者的糖的5’位、3’位或2’位介由前述磷酸基而键合。对于前述一者的核苷酸的糖与前述另一者的核苷酸的糖的键合部位的组合,没有特别的限定,可列举出:5’位与3’位的组合、5’位与5’位的组合、3’位与3’位的组合、2’位与5’位的组合等。
前述核苷酸中,前述糖例如:既可以为2’位的碳原子上键合有羟基的核糖,也可以为前述2’位的碳原子上键合有氢原子的脱氧核糖。前述核糖的例如前述羟基也可以被任意的原子或基团取代(修饰)。前述原子可列举出例如:氢原子、卤素原子等,前述卤素原子可列举出例如:f、cl、br、i等,其中,优选f(氟原子)。前述基团,可列举出例如:烷氧基(-o-烷基)、酰氧基(-o-酰基)以及氨基(nh2基)或其h被取代基取代的取代氨基等。对于前述烷氧基(-o-烷基),没有特别的限制,可列举出例如:甲氧基(-o-me基),对于前述烷基没有限制。对于前述酰氧基(-o-酰基),没有特别的限定,可列举出例如:-o-cho基等,对于前述酰基没有限制。另外,前述脱氧核糖的例如前述氢原子也可以被取代(修饰)为任意的原子。前述原子可列举出例如:前述卤素原子等。
对于前述碱基,没有特别的限定,可列举出:腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶、尿嘧啶等;此外,作为它们的取代碱基,可列举出例如:7-脱氮鸟嘌呤、7-脱氮-8-氮鸟嘌呤、5-丙炔基胞嘧啶、5-丙炔基尿嘧啶、7-脱氮腺嘌呤、7-脱氮-8-氮腺嘌呤、7-脱氮-6-氧代嘌呤、6-氧代嘌呤、3-脱氮腺苷、2-氧代-5-甲基嘧啶、2-氧代-4-甲基硫代-5-甲基嘧啶、2-硫代羰基-4-氧代-5-甲基嘧啶、4-氧代-5-甲基嘧啶、2-氨基嘌呤、5-氟尿嘧啶、2,6-二氨基嘌呤、8-氨基嘌呤、4-三唑-5-甲基胸腺嘧啶、4-三唑-5-甲基尿嘧啶(4-triazolo-5-methylthymine)以及次黄嘌呤等。前述碱基例如既可以为天然的碱基,也可以为非天然的碱基。
制造前述导入有同位素的前述单体的情况下,例如:作为前述三价磷化合物,将具有前述三价磷的核苷通过前述同位素氧化剂进行氧化。根据该方法,键合于前述核苷的前述三价磷通过氧化成为前述五价磷,前述五价磷与来源于前述同位素氧化剂的同位素键合。因此,能够得到具有同位素的单体。
前述具有三价磷的核苷例如包含糖和碱基,前述糖的1’位上键合有碱基,优选前述糖上键合有前述三价磷,更优选前述糖的5’位、3’位或2’位上键合有前述三价磷。
前述具有三价磷的核苷如前述例如为前述亚磷酸酯;具体而言,可以用亚磷酸单酯[r1o-p(ox2)-ox3]、亚磷酸二酯[r1o-p(or2)-ox3]或亚磷酸三酯[r1o-p(or2)-or3]的任一者表示。前述r1、r2和r3的任一者优选为前述核苷。
制造前述导入有同位素的前述聚合物的情况下,可列举出例如:以下所示的第一方法和第二方法。
第一方法为如下方法例如:作为前述三价磷化合物,使用预先合成的包含具有三价磷的核苷残基的聚合物,将其通过前述同位素氧化剂进行氧化而导入同位素。根据该方法,前述聚合物中的前述三价磷通过氧化成为前述五价磷,前述五价磷与前述来源于同位素氧化剂的同位素键合,因而能够得到具有同位素的聚合物。
前述具有三价磷的前述聚合物为包含2个以上核苷残基的聚合物。前述核苷残基包含糖和碱基,前述糖的1’位上键合有前述碱基,在前述核苷残基间,各自的糖介由磷而键合。具体而言,优选例如:前述核苷残基间一者的糖的5’位、3’位或2’位与另一者的糖的5’位、3’位或2’位介由磷而键合。对于前述一者的核苷酸的糖与前述另一者的核苷酸的糖的键合部位的组合,没有特别的限定,可列举出:5’位与3’位的组合、5’位与5’位的组合、3’位与3’位的组合、2’位与5’位的组合等。接着,至少一组的核苷残基间的磷为前述三价磷。前述聚合物中,前述核苷残基间的磷例如可以至少一者为三价磷,也可以全部为三价磷。前者的情况下,只有前述聚合物中的三价磷被氧化为五价磷,前述五价磷上导入有前述来源于同位素氧化剂的同位素;后者的情况下,全部的核苷残基间的三价磷被氧化为五价磷,前述五价磷上被导入前述来源于同位素氧化剂的同位素。
前述三价磷化合物例如如前述,为前述亚磷酸酯。前述亚磷酸酯可以用例如:亚磷酸二酯[r1o-p(or2)-ox3]、亚磷酸三酯[r1o-p(or2)-or3]的任一者表示。前述r1和r2优选为前述核苷残基或前述核苷残基的聚合物,两者既可以相同也可以不同。前述r1和/或r2为前述核苷残基的聚合物的情况下,前述聚合物例如既可以为前述核苷酸残基通过磷酸二酯键合而成的聚合物(多聚核苷酸),也可以为前述核苷酸残基介由三价磷键合而成的聚合物。对于构成前述聚合物的核苷酸残基的个数,没有限制。
第二方法为如下方法,例如:进行核苷的偶联与通过使用前述同位素氧化剂进行的氧化的同位素的导入。由此,任意的核苷残基间的五价磷上导入前述同位素而能够合成具有同位素的聚合物。对于前述聚合物的合成方法,没有特别的限定,可列举出例如:磷酸酯法、amidite法等。这些合成方法例如既可以为固相合成,也可以为液相合成,没有特别的限制。
具体而言,第二方法为如下方法,例如:进一步具有偶联工序:将包含核苷的2分子单体进行偶联而合成前述三价磷化合物;前述氧化工序中,将通过前述偶联工序得到的前述三价磷化合物通过前述同位素氧化剂进行氧化,从而合成导入有前述同位素的五价的磷酸化合物。
对于前述单体的种类,没有特别的限定,可以使用公知的单体。前述一者的单体优选例如:在前述核苷的糖中,在与前述另一者的单体键合的部位键合三价磷;在其他的具有羟基的部位键合前述羟基的保护基。对于前述三价磷键合的部位,没有特别的限制,可列举出:5’位、3’位或2’位;对于前述保护基键合的部位,没有特别的限制,可列举出5’位、3’位或2’位。对于前述三价磷的键合部位与前述保护基的键合部位的组合,没有特别的限制,可列举出例如:5’位与3’位的组合、5’位与5’位的组合、3’位与3’位的组合、2’位与5’位的组合等。作为具体例,前述一者的单体优选在例如前述核苷的糖的3’位上键合有三价磷,在前述糖的5’位上键合有羟基的保护基。前述三价磷优选具有与羟基反应的反应基。对于前述保护基没有特别的限制,可列举出例如:二甲氧基三苯基(dmtr)等。
前述另一者的单体优选:在前述核苷的糖中,与前述一者的单体键合的部位为脱去前述保护基的羟基。对于与前述一者的单体键合的部位,没有特别的限制,可列举出5’位、3’位或2’位。作为具体例,前述另一者的单体优选前述核苷的糖的5’位的保护基脱去而为羟基。前述偶联工序中,将前述2分子单体进行偶联时,前者的前述反应基(例如,3’位)与后者的前述糖的羟基(例如,5’位)反应,前述单体间介由三价磷而键合。通过将前述单体间的三价磷用前述同位素氧化剂氧化,三价磷被氧化成五价磷,合成出前述核苷由具有同位素的磷酸二酯键键合的聚合物。
对于前述键合有保护基的单体,没有特别的限定,可以适用例如:如前述的磷酸酯法、amidite法等中所使用的单体。前述amidite法的单体,可列举出例如:公知的亚磷酰胺,作为具体例,可列举出例如:tbdms-amidite、tom-amidite、ace-amidite等。
对于前述核苷,没有特别的限制,与前述同样地,包含糖和碱基,前述糖的1’位上键合有前述碱基。进行固相合成的情况下,前述后者的单体的例如与前述前者的单体键合的部位以外的部位优选被固定化于固相中。作为具体例,前述后者的单体是例如前述糖的5’位为羟基的单体的情况下,例如,优选前述糖的3’位被固定化于固相。
前述第二方法例如也可以进一步包含脱保护工序,将前述核苷的糖的前述保护基(例如,5’位)脱去。对于脱保护的方法,没有特别的限制,可以例如:根据保护基的种类,通过公知的方法而进行。
另外,前述第二方法也可以重复进行核苷的偶联与通过使用前述同位素氧化剂进行的氧化的同位素的导入。具体而言,也可以为如下方法:进一步具有偶联工序:将前述五价的磷酸化合物与包含核苷的新的单体偶联,合成前述三价的磷化合物;将通过前述偶联工序得到的前述三价磷化合物通过前述同位素氧化剂进行氧化,合成导入有前述同位素的五价的磷酸化合物。
这样,重复进行偶联工序与氧化工序,在所希望的前述氧化工序或全部的氧化工序中使用前述同位素氧化剂,由此能够在所希望的磷酸二酯键上导入同位素。
将前述五价的磷酸化合物与新的单体进行偶联时,例如:对于前述五价的磷酸化合物,优选将5’末端的核苷中的糖的保护基(例如,5’位)脱保护之后,将前述单体偶联。即,前述第二方法优选重复进行前述偶联工序、前述氧化工序和前述脱保护工序。对于该重复的次数,没有任何限定,可以进行至所希望的聚合物的长度为止。
以下,表示使用前述具有同位素的同位素氧化剂向核酸导入同位素的反应的一例。本发明不受这些例子限定。下述式中,对于糖的2’位中的r,没有特别的限制,可列举出例如:前述的烃基。如下述式所示,例如:通过用i2/py/h218o进行氧化,能够在磷酸基上导入-18oh,通过用具有34s的3h-1,2-苯并二硫醇3-酮-1,1-二氧化物进行氧化,能够在磷酸基上导入-34s-,通过用dipea-硼烷复合物进行氧化,能够在磷酸基上导入-10bh3-。
通过本发明的制造方法,也能够制造例如在磷酸基上导入有同位素的农药、药物、磷脂等。前述农药可列举出例如:马拉硫磷(malathion)、杀螟松(fenitrothion)等,前述药物可列举出例如:氢可松磷酸酯钠(商品名:cleiton)等。
以下,表示将醇作为起始原料合成在磷酸基上导入有同位素的低分子磷酸化合物的反应的一例。本发明不限于此。下述式(1)中,对于r没有任何限制,可列举出例如:如前述的烃基。首先,反应1中,使r-oh与三价磷供给体反应合成三价磷化合物。对于前述三价磷供给体,没有特别的限制,例如:作为以下所示的具有氰基的化合物,可列举出:氯(二异丙基氨基)亚膦酸2-氰基乙酯(n,n-diisopropylaminocyanoethylphosphonamidicchloride)或2-氰基乙基n,n,n,n-四异丙基膦(2-cyanoethyln,n,n,n-tetraisopropylphosphane)。并且,通过使用如前述的前述同位素氧化剂进行反应2,能够得到在x上导入有同位素的五价的磷酸化合物。前述同位素氧化剂例如:在x上导入同位素氧的情况下,优选使用前述氧供给体;在x上导入同位素硫的情况下优选使用前述硫供给体;在x上导入同位素硼的情况下,优选使用前述硼供给体。
或者
通过本发明的制造方法得到的含有同位素的磷酸化合物例如:可以代替现有的磷酸化合物而使用,对其用途没有任何限制。
实施例
接着,对本发明实施例进行说明。需要说明的是,本发明不受下述的实施例限定或限制。
[实施例1]
(1)用18o标记的rna的合成
作为合成rna,合成在磷酸二酯键的各磷酸基上导入了1个18o的、碱基长度20mer的18o标记化多聚尿苷酸。作为单体原料使用tbdms-amidite,使用核酸合成机(商品名abiexpedite8909,abiinc.制造),根据亚磷酰胺法,将偶联工序、氧化工序、以及将核糖残基的5’位的保护基二甲氧基三苯基(dmtr)脱去的脱保护工序作为1循环,重复19循环。在全部的氧化工序中,作为同位素氧化剂,使用含有具有同位素氧18o的h218o(water-18o、纯度18oatom%=99.2%、taiyonipponsansocorporation制造)的组合物。前述组合物使用包含0.1mol/l碘的thf/吡啶/水的混合液。前述混合液中,将thf:吡啶:水的混合比(体积比)设为78:20:2。需要说明的是,除了使用前述包含h218o的前述组合物以外,按照常规方法进行。
(2)分子量测定
对于得到的18o标记化多聚尿苷酸,根据常规方法,使用基质辅助激光解析电离飞行时间质谱仪(matrix-assistedlaserdesorption/ionizationtimeofflightmassspectrometry,maldi-tof-ms)(商品名brukerautoflex)测定分子量。
将分析结果示于图1。图1为表示合成rna的质谱分析结果的谱图。18o标记化多聚尿苷酸的实测值为6094.2。
18o标记化多聚尿苷酸如前述,由于进行了19个循环的偶联工序、氧化工序以及脱保护工序,所以理论上导入了19个18o。因此,18o标记化多聚尿苷酸的分子量与未标记多聚尿苷酸的分子量6061.4相比较,经计算增加38(2×19原子)。然而,实际上,使用的h218o的纯度为99.2%,所以分子量增加2×19原子×(纯度0.992)19=32.6。基于此,合成的前述18o标记化多聚尿苷酸的理论分子量为6061.4+32.6=6094.0。如前述,实测值为6094.2,所以与理论分子量6094.0极为近似。因此,由该结果通过实施例可以证明,在20mer的多聚尿苷酸中,在19处的磷酸二酯键的磷酸基上导入有18o。
(3)ph稳定性评价
对于得到的18o标记化多聚尿苷酸,评价ph稳定性。具体而言,在规定ph(ph3、4、5.5、7、8.5)的50mmol/l磷酸缓冲液中,混合18o标记化多聚尿苷酸以成为20μmol/l,37℃下孵育28天。接着,对于孵育后的前述18o标记化多聚尿苷酸,使用lc-esi-q-tof-ms(商品名:waterssynaptg2ms)分析分子量,由此确认其稳定性。
将这些结果示于图2。图2为表示在前述各ph下孵育后的18o标记化多聚尿苷酸的质谱分析结果的谱图。图2中,由上面的图起依次为ph3.0、4.0、5.5、7.0以及8.5下处理后的结果。如图2所示,在任一ph下进行处理,18o标记化多聚尿苷酸的分子量相对于孵育前的分子量(实测值:6094.2)均没有变化。由该结果确认,18o标记化多聚尿苷酸在ph3~8.5中是稳定的。即,可以确认,18o标记在ph3~8.5下不与周边环境的水分子(h216o)交换,是稳定的。这表示18o标记即便在生物体环境下也同样是稳定的,18o标记具有作为示踪剂所需要的稳定性。
[实施例2]
(1)18o标记化sirna的合成
通过与前述实施例1同样的rna合成方法,合成下述序列号1~4所示的21碱基长的rna。需要说明的是,将前述偶联工序、前述氧化工序以及前述脱保护工序作为1循环而重复20循环。这些rna均通过前述rna合成方法在磷酸二酯键的各磷酸基上导入有1个18o。即,各rna导入有20个18o。另一方面,除了使用未标记的h216o作为氧化剂以外,同样地合成序列号1~4的rna。
靶标用有义rna
5’-ccaugagaaguaugacaacag-3’(序列号1)
靶标用反义rna
5’-guugucauacuucucaugguu-3’(序列号2)
对照用有义rna
5’-uacuauucgacacgcgaaguu-3’(序列号3)
对照用反义rna
5’-cuucgcgugucgaauaguauu-3’(序列号4)
将导入有18o的单链rna分别制成为靶标用18o‐有义rna、靶标用18o-反义rna、对照用18o‐有义rna、对照用18o‐反义rna。另外,将未导入18o的具有16o的单链rna分别制成为靶标用16o‐有义rna、靶标用16o-反义rna、对照用16o‐有义rna、对照用16o‐反义rna。
(2)单链rna的分子量测定
对于得到的各单链rna,与前述实施例1同样地测定分子量。下述表1中,合并示出所测定的分子量(observedmass)和理论上的计算值(calculatedmass)。需要说明的是,理论上的计算值是考虑了使用的h218o的18o纯度为99.2%而求出的。
[表1]
如前述表1所示,导入有18o的各rna的实测值与理论值极其近似。由该结果可以证明,导入了18o的21碱基长的rna分别在20处的磷酸二酯键的磷酸基上导入有18o。
前述靶标用有义rna的3’末端的2个碱基(ag)以及前述靶标用反义rna的3’末端的2个碱基(uu)为突出序列,前述靶标用有义rna与前述靶标用反义rna的除前述突出外的19碱基长完全地互补。以下所示的前述靶标用有义rna与前述靶标用反义rna的双链为针对人gapdh的sirna(靶标18o-sirna)。
靶标sirna
5’-ccaugagaaguaugacaacag-3’(序列号1)
3’-uugguacucuucauacuguug-5’(序列号2)
前述对照用有义rna的3’末端的2个碱基(uu)以及前述对照用反义rna的3’末端的2个碱基(uu)为突出序列,前述对照用有义rna与前述对照用反义rna的除前述突出外的19碱基长完全地互补。前述对照用有义rna与前述对照用反义rna的双链为对人gapdh没有表现出rna干涉能力的sirna(阴性对照18o-sirna)。
对照sirna
5’-uacuauucgacacgcgaaguu-3’(序列号3)
3’-uuaugauaagcugugcgcuuc-5’(序列号4)
(3)各单链rna的纯度评价
对于得到的各单链rna,通过下述条件的hplc分析纯度。将前述hplc中的全部峰面积设为100%,用与前述各单链rna的理论分子量相当的保留时间的峰面积的比例表示前述纯度。
(hplc条件)
分析装置:shimadzulc-10asystem(shimadzucorporation.)
柱:xbridgeostc18,2.5μm(waters)
柱尺寸:4.6×50mm
洗脱液:
a:50mmol/l醋酸三乙基铵(ph7.4)+5%乙腈
b:50mmol/l醋酸三乙基铵(ph7.4)+50%乙腈
梯度:%b5%→10%/20min
流速:1.0ml/min
检测器:uv检测器(254nm)
将这些分析结果示于下述表2中。如下述表2所示,导入了18o的各rna均表现出高纯度,与未导入18o的16o-rna相同程度。由该结果证明,标记了18o的rna能够以与未导入18o的rna相同收率、相同纯度合成。
[表2]
*:由波长260nm的吸光度计算出的收量。
(4)双链rna的形成
将得到的各单链rna组合,如以下所示,形成双链rna。
前述对照用有义rna(序列号3)的3’末端的2个碱基(uu)和前述对照用反义rna(序列号4)的3’末端的2个碱基(uu)为突出序列,前述对照用有义rna与前述对照用反义rna的除前述突出外的19碱基长完全地互补。前述对照用有义rna与前述对照用反义rna的双链为对人gapdh没有表现出rna干涉能的sirna。
对照sirna
5’-uacuauucgacacgcgaaguu-3’(序列号3)
3’-uuaugauaagcugugcgcuuc-5’(序列号4)
接着,形成下述组合的对照用sirna。
(c1)前述对照用16o-有义rna与前述对照用16o-反义rna的组合(16o/16o)
(c2)前述对照用16o-有义rna与前述对照用18o-反义rna的组合(16o/18o)
(c3)前述对照用18o-有义rna与前述对照用16o-反义rna的组合(18o/16o)
(c4)前述对照用18o-有义rna与前述对照用18o-反义rna的组合(18o/18o)
另一方面,前述靶标用有义rna(序列号1)的3’末端的2个碱基(ag)以及前述靶标用反义rna(序列号2)的3’末端的2个碱基(uu)为突出序列,前述靶标用有义rna与前述靶标用反义rna的除前述突出外的19碱基长完全地互补。以下所示的前述靶标用有义rna与前述靶标用反义rna的双链为针对人gapdh的sirna。
靶标sirna
5’-ccaugagaaguaugacaacag-3’(序列号1)
3’-uugguacucuucauacuguug-5’(序列号2)
接着,形成下述组合的靶标用sirna。
(t1)前述靶标用16o-有义rna与前述靶标用16o-反义rna的组合(16o/16o)
(t2)前述靶标用16o-有义rna与前述靶标用18o-反义rna的组合(16o/18o)
(t3)前述靶标用18o-有义rna与前述靶标用16o-反义rna的组合(18o/16o)
(t4)前述靶标用18o-有义rna与前述靶标用18o-反义rna的组合(18o/18o)
接着,将前述(c1)~(c4)和(t1)~(t4)的sirna供于电泳,通过电泳确认各自的分子量。电泳使用15%丙烯酰胺凝胶。
图3表示前述各sirna的双链形成的确认结果。图3为确认各sirna的形成的native-page的照片,泳道1~4为前述(c1)~(c4)的对照用sirna;泳道5~8为前述(t1)~(t4)的靶标用sirna。如图3所示,泳道1~4的前述对照用sirna表示同程度的分子量,泳道5~8的前述靶标用sirna表示同程度的分子量。该结果表示,导入了18o的rna与未导入18o的rna同样地形成双链,成为sirna。
(5)sirna的结构
关于前述(4)的各sirna,通过圆二色谱(cd光谱)比较结构。测定使用分光偏光计(商品名j-720w、jascointernationalco.,ltd.制造)而进行。图4表示cd光谱的结果。图4表示前述(c1)~(c4)以及(t1)~(t4)的sirna中,前述(c4)对照用sirna(18o/18o)和前述(t4)靶标用sirna(18o/18o)的结果。图4中,纵轴为ellipticity(椭圆率)(毫度:mdeg),横轴为波长(nm)。图4的(a)为前述(c4)对照用sirna(18o/18o)的结果,图4的(b)为前述(t4)靶标用sirna(18o/18o)的结果。
前述(c1)~(c3)对照用sirna(没有图示)全部表现出与图4的(a)的前述(c4)对照用sirna相同的cd光谱;前述(t1)~(t3)靶标用sirna(没有图示)全部表现出与图4的(b)的前述(t4)靶标用sirna相同的cd光谱。由该结果分别确认,4种对照用sirna具有同样的结构,4种靶标用sirna具有同样的结构。即,表示导入了18o的sirna具有与未导入18o的sirna同样的结构。
(6)sirna的热力学稳定性
对于前述(4)中的各sirna,确认热力学稳定性。前述热力学稳定性(tm值)通过分光光度计(商品名uv-1800uv-vis、shimadzucorporation.)而进行测定。
下述表3表示前述热力学稳定性的确认结果。如下述表3所示,对于靶标用sirna,确认各sirna表现出同样的热力学稳定性。另外,关于对照用sirna,确认各sirna表现出同样的热力学稳定性。由此可知,导入了18o的sirna的热力学稳定性与未导入18o的sirna是相同程度的。
[表3]
(7)sirna的生物活性
对于前述(4)中的各sirna,测定人gapdh基因的mrna表达量,确认表达抑制能力。
细胞使用hct116细胞(来源于人结肠腺癌)。培养条件设为37℃、5%co2。培养基使用添加了10%的钝化仔牛血清的mccoy’s5a培养基。
首先,将细胞在前述培养基中进行培养,将该培养液向24孔板中以成为4×104细胞/孔的方式分别注入400μl。接着,对于前述细胞,使用转染试剂(商品名lipofectamine2000、invitrogen)根据附加操作规程(attachedprotocol),转染前述sirna。具体而言,对于前述每孔添加前述sirna和转染试剂的复合物100μl,将全量设为500μl,将前述sirna的最终浓度制成为0.1nmol/l。
转染后,将前述细胞培养24小时。接着,使用试剂(商品名rneasyminikit、qiagen),根据附加操作规程回收rna。接着,使用逆转录酶(商品名superscriptiii、invitrogen公司制造),根据附加操作规程,由前述rna合成cdna。接着,将得到的cdna作为模板进行pcr,测定人gapdh基因的mrna的表达量以及作为内标物的β-肌纤蛋白基因的表达量。前述人gapdh基因的表达量通过前述β-肌纤蛋白基因的表达量进行校正。前述pcr中,前述gapdh基因和β-肌纤蛋白基因的扩增中,分别使用下述的引物对。表达量将没有添加前述sirna的细胞中的人gapdh基因的表达量设为1,相对地进行比较。
gapdh基因扩增用引物对
5’-ggagaaggctggggctcatttgc-3’(序列号5)
5’-tggccaggggtgctaagcagttg-3’(序列号6)
β-肌纤蛋白基因扩增用引物对
5’-gccacggctgcttccagctcctc-3’(序列号7)
5’-aggtctttgcggatgtccacgtcac-3’(序列号8)
需要说明的是,作为对照1,对于没有添加前述sirna和前述转染试剂的细胞,也测定基因表达量(-)。另外,作为对照2,对于在转染中未添加前述sirna、只添加前述转染试剂的细胞,也测定基因表达量(mock)。
将这些结果示于图5。图5为表示人gapdh基因的mrna的表达量的相对值的图,纵轴为相对基因表达量。如图5所示,导入了18o的靶标用sirna均表现出与未导入18o的靶标用sirna同样的表达抑制活性。该结果可以确认,对于导入了18o的sirna,也能够与未导入18o的具有16o的sirna同样地使用。
[实施例3]
对于前述实施例1中合成的18o标记化多聚尿苷酸,进行血清中浓度的测定。
向小鼠的混合血清中添加前述18o标记化多聚尿苷酸以成为规定浓度,从而调制血清样品。前述规定浓度设为0、0.01、0.02、0.04、0.06、0.08、0.1、0.2、0.4、0.6、0.8、1、2μg/ml。将前述血清样品加入银囊,进行冷冻干燥。接着,将冷冻干燥的前述血清样品供于连接至气化前处理装置的稳定同位素比质谱分析仪。前述气化前处理装置使用thermofisherscientific公司制造的tc/ta,前述稳定同位素比质谱分析仪使用thermofisherscientific公司制造的veltavplus。接着,将前述血清样品的测定值代入下述式中,求出δ18o(千分率:‰)。下述式中,r(s)为前述血清样品的18o/16o比率的测定值;r(r)为标准物质的18o/16o比率的测定值。
δ18o(‰)=[r(s)/r(r)-1]×1000
图6表示δ18o值与18o标记化多聚尿苷酸浓度的相关性的图。图6中,纵轴为δ18o值(‰),横轴为前述18o标记化多聚尿苷酸的浓度。如图6所示,δ18o值和前述18o标记化多聚尿苷酸的浓度为正相关,表现出相关系数(r)为0.999的优异的相关性。
目前,测定rna的血中浓度的方法使用放射性同位素标记过的rna。但是,放射性同位素则存在暴露于辐射的危险性的担心。与此相对,本实施例中使用导入有作为稳定同位素的18o的rna,如图6所示,可确认即使利用18o标记化rna,在血中rna浓度与δ18o值(‰)也表现出相关性。因此可知通过使用导入有18o的rna作为药品等的rna,例如:对生物体投药后,能够维持安全并且测定血中浓度。
[实施例4]
对于前述实施例2中合成的导入了18o的sirna,使用稳定同位素显微镜观察细胞内定位。
(1)sirna
使用前述实施例2中调制的将前述18o-有义rna和18o-反义rna组合而成的前述(c4)对照用sirna(18o/18o)。
(2)样品的调制
将7mm×7mm的硅晶圆置于35mm培养皿的中央。向前述培养皿中以成为5×105cells/培养皿的方式接种来源于人肺的a549细胞,进行培养。培养条件设为37℃、5%co2、24小时。培养基使用含有10%fcs的dulbecco’smodifiedeaglemedium(dmem)(sigma)。培养后,更换为2ml的新鲜培养基,添加sirna以成为最终浓度300nmol/l,使用转染试剂(商品名lipofectamin2000、invitrogen公司制造)进行转染。前述转染后,进一步进行24小时培养。将前述培养后的细胞用pbs进行洗涤,用2.5%戊二醛/pbs溶液37℃下进行1小时处理而将前述细胞固定。之后,将前述固定的细胞以20、40、60、70、80、90、100%乙醇的顺序各浸渍10分钟,由此进行脱水。接着,将叔丁醇添加至前述脱水后的细胞中,冰箱内冷冻后,进行干燥。对于前述冷冻干燥物,实施厚度30nm的金涂敷。这样,制作样品。
(3)通过稳定同位素显微镜的观察
将前述样品用稳定同位素显微镜系统(北海道大学、camecaims-1270+scaps)进行观察。前述观察中使用铯作为原射线束,得到12c14n、16o、18o的二维离子图像。将该观察结果示于图7。图7为观察前述对照用sirna(18o/18o)的细胞内定位的显微镜照片。图7中,左上的照片为16o的二维离子图像;左下的照片为12c14n的二维离子图像;右上的照片为18o的二维离子图像;右下的照片为18o/16o的二维离子图像。
12c14n的二维离子图像为有机物的成像,所以通过图7的左下的照片(12c14n),能够确认细胞的形态。16o的二维离子图像可见16o的强度强的部分发白,弱的部分发黑。图7的左上的照片(16o)整体地发黑,所以能够确认有天然的16o均等地存在。另外,18o的二维离子图像可见18o的强度强的部分发白,弱的部分发黑。图7的右上的照片(18o)中,相当于细胞质的区域可见多个白点,所以能够确认所给予的前述对照用sirna(18o/18o)定位于细胞质。接着,18o/16o的二维离子图像是对将18o的二维离子图像(18o的强度)除以16o的二维离子图像(16o的强度)的结果进行成像,18o比率低的部分变蓝,高的部分变红。图7的右下的照片(18o/16o)中,对应于前述右上的照片(18o)的白点的部位的18o/16o比率高,成像为红色(图中白点);其他的部位的18o/16o比率为天然的0.002前后,所以成像为蓝色。由这些结果可知,只要使用导入了18o的sirna,例如:不使用荧光标记(fluorescentlabel)等而由18o/16o比率可以得到表示前述sirna定位的成像图像。
一直以来,成像中通常使用荧光标记了的核酸。但是,荧光物质通常为疎水性,分子量大,所以通过添加至核酸的末端等,存在前述核酸的物性与没有用荧光标记修饰的未修饰体不同的可能性。另外,也存在前述荧光物质在生物体内被切断的可能性。与此相对,18o的标记例如:核酸的物性变化被抑制、能够对全部的磷酸基进行修饰,并且,也能够抑制修饰的脱落。因此,通过使用导入了18o的核酸,例如:能够更加效率良好地观察细胞内定位。
以上,参照实施方式说明了本发明,但本发明不受上述实施方式限定。本发明的组成、内容,在本发明的范围内,能够进行本领域技术人员能够理解的各种变更。
该申请主张以2011年5月10日所申请的日本申请特愿2011-105722为基础的优选权,将其公开内容全部引入本申请。
产业上的可利用性
如以上所述,通过本发明的制造方法,只使用包含前述同位素的氧化剂,就能够容易地制造包含同位素的磷酸化合物。本发明的制造方法对于例如:具有磷酸基的核酸的合成、具有磷酸基的农药、药物、磷脂等低分子化合物的合成是有用的。
序列表
<110>株式会社博纳克(bonaccorporation)
<120>具有同位素的磷酸化合物的制造方法
<130>tf11052wo
<150>jp2011-105722
<151>2011-05-10
<160>8
<170>siposequencelisting1.0
<210>1
<211>21
<212>rna
<213>人工序列(artificialsequence)
<220>
<221>unsure
<223>sirna
<400>1
ccaugagaaguaugacaacag21
<210>2
<211>21
<212>rna
<213>人工序列(artificialsequence)
<220>
<221>unsure
<223>sirna
<400>2
guugucauacuucucaugguu21
<210>3
<211>21
<212>rna
<213>人工序列(artificialsequence)
<220>
<221>unsure
<223>sirna
<400>3
uacuauucgacacgcgaaguu21
<210>4
<211>21
<212>rna
<213>人工序列(artificialsequence)
<220>
<221>unsure
<223>sirna
<400>4
cuucgcgugucgaauaguauu21
<210>5
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>unsure
<223>引物
<400>5
ggagaaggctggggctcatttgc23
<210>6
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>unsure
<223>引物
<400>6
tggccaggggtgctaagcagttg23
<210>7
<211>23
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>unsure
<223>引物
<400>7
gccacggctgcttccagctcctc23
<210>8
<211>25
<212>dna
<213>人工序列(artificialsequence)
<220>
<221>unsure
<223>引物
<400>8
aggtctttgcggatgtccacgtcac25
- 还没有人留言评论。精彩留言会获得点赞!