一种同人源胶原蛋白氨基酸、基因序列及蛋白氨基酸的制备方法与流程
本发明涉及遗传工程领域,特别涉及一种同人源胶原蛋白氨基酸、基因序列及蛋白氨基酸的制备方法。
背景技术:
胶原蛋白(collagen)是一种生物性高分子物质,是人体的一种白色、不透明、无支链的纤维性蛋白质,对人体皮肤、血管、骨骼、筋腱、牙齿和软骨的形成都十分重要,起着支撑、修复、保护三重抗衰老作用。在分子结构上,胶原蛋白是由平行线型链组成,每一线型链由三条扭曲左旋的α-肽链通过链间相互作用紧密结合而形成的一极强的右旋三重螺旋结构,每条α-肽链由多达300个以上的gly-x-y三联体重复构成,x、y分别为氨基酸,两端连接具有不同结构的其它小片段。分子量在1000道尔顿以下的小分子胶原蛋白无需分解可被人体直接吸收,可以滋润肌肤,赋予其平滑感觉,可以说是真皮层强有力的后盾,其对皮肤的作用不言而喻;胶原蛋白加入护肤类化妆品中,与其它原料配伍性佳,协同效果良好,能对受损肌肤有效好的修复作用;口服纯胶原蛋白1个月后,普遍反映肤感细腻、润滑、细小皱纹得到很好的舒展,肤色有所增白;头发和皮肤一样,也是由胶原蛋白组成,胶原蛋白主要控制着头发的粗细,弹性和湿润度,缺乏胶原蛋白,头发会干枯分叉,灰暗无光泽。由于胶原蛋白可以补充皮肤所需要的营养,使皮肤中胶原活性增强,有滋润皮肤,延缓衰老、美容、消皱、养发等功效,因此被广泛应用在生物医药和化妆品等行业中。胶原蛋白的传统生产方法主要是利用酸、碱、酶解法处理动物来源的组织(猪皮、牛皮、驴皮、鱼皮等),从中提取胶原蛋白,但这些方法提取的胶原蛋白不仅成分复杂纯度低而且丧失了原本的生物学活性,特别是应用于人体时易引起异体异种的排异反应,因此无法应用于生物医学和化妆品领域发挥真正的功能。
随着现代生物技术的发展,人们不断尝试利用转基因技术,在动物、植物和微生物表达体系中制备同人源胶原蛋白,不仅解决了传统生产方法的诸多缺点,也筛选出了当前国内外最佳制备同人源胶原蛋白的方法和表达体系。据报道巴氏毕赤酵母表达系统之所以能够高效地表达外源基因制备同人源胶原蛋白,与其独特的生物学和遗传学特性是分不开的。与开发最早最普遍应用的大肠杆菌表达系统相比,巴氏毕赤酵母表达系统产量高,产物纯化简单,且生物学活性好;与最早开发的酵母类表达系统——酿酒酵母表达系统相比,它营养要求低,重组子稳定性好,且含有严格的甲醇诱导表达机制的相关基因,表达效率高。目前,已有数百种外源蛋白在巴氏毕赤酵母表达系统中成功表达。
虽然巴氏毕赤酵母表达系统具有高效表达外源基因的能力,但并不是每个实验室构建的表达系统都能够高效表达同人源胶原蛋白,它受影响的因素较多,如外源基因、信号肽、基因拷贝数、发酵条件、蛋白稳定性等因素都会对其高效表达产生影响。
技术实现要素:
本发明为了提供一种使用巴氏毕赤酵母表达系统高效表达同人源胶原蛋白的方法,经过对各影响表达因素的综合分析和选择性优化,构建了一套优化的巴氏毕赤酵母高效表达系统。
(一)影响表达的因素优化
a、外源基因的优化
外源基因的特性是决定表达成效的首要因素。5′-utr(untranslatedregions,非翻译区)过长或过短都不利于蛋白质的最优化生产,高效表达的aox1的mrna的前导肽长度为114个氨基酸,且含有丰富的a+u,因此同人源胶原蛋白合成最理想的条件是5′-utr应尽可能靠近aox1启动子基因的mrna,并保持一致;控制a+t的含量在30%-55%之间表达效果最佳,因为过高的a+t有时会造成转录的提前终止;巴氏毕赤酵母在密码子的使用上存在偏爱性,其中phe的ttc、leu的ttg、ile的att、ile的atc、val的gtt、val的gtc、ser的tct、ser的tcc、pro的cca、thr的act、thr的acc、ala的gct、tyr的tac、his的cac、lys的aag、asp的gac、glu的gag、arg的aga、gly的ggt共19个密码子被确认为巴氏毕赤酵母的高表达优越密码子。
b、信号肽的优化
为方便蛋白的分离纯化,同人源胶原蛋白的生产应采用分泌表达的方式。同人源胶原蛋白的分泌表达可以利用巴氏毕赤酵母的α-因子前导肽序列来引导分泌。经过改造过的人α-fucosyltransferase因子在gs115中获得表达,可溶性蛋白产物可以在α-因子信号的引导下,通过高尔基体分泌到胞外。巴氏毕赤酵母细胞膜上有一种kex2样蛋白水解酶,能专一性水解α-因子前体中羧基端的肽键,从而保证了蛋白加工过程中的信号肽的切除。
c、重组质粒的优化
col1基因在克隆到ppic9k之前要导入到ppic9载体中的α-因子信号肽基因之后,是因为虽然ppic9k载体比之前者多了一个抗卡那霉素的基因可以用卡那霉素或是遗传霉素(g418)来做筛选,但其上的xhoi位点非单一。重组质粒ppic9k-col1进行线性化和浓缩来提高同人源胶原蛋白的高效表达。
d、基因拷贝数的优化
适当增加外源基因整合到巴氏毕赤酵母染色体上的拷贝数是提高外源基因表达量的基本策略,但是整合过多外源基因的拷贝数可能导致重组dna的不稳定,目前筛选多拷贝转化子大多采用抗生素的方法,利用基因剂量效应,依靠g418的抗性水平来快速筛选出高拷贝的整合转化子,并通过pcr分析外源基因拷贝数,该方法可以有效提高同人源胶原蛋白表达量、简化实验操作、节约时间。
e、发酵条件的优化
溶氧量是影响表达水平的极为重要的因素,甲醇代谢过程中需要很高的溶氧量,因此在发酵过程中及时补充巴氏毕赤酵母代谢所需要的氧气对于同人源胶原蛋白的产量是至关重要的,一旦溶氧受到限制,同人源胶原蛋白的表达量也将会受到限制;碳源也是影响高效表达的重要因素,巴氏毕赤酵母表达培养基常用的碳源是甘油,但甘油对aox启动子有抑制作用,用山梨糖醇复配甘油作为碳源,可以有效提高同人源胶原蛋白的表达;温度对巴氏毕赤酵母发酵产物的活性、发酵液的物理性质及生物合成方向等都有影响,温度升高,反应速率加大,生长代谢加快,但温度过高,又会使酶易因热而失去活性,菌体易于衰老,发酵周期缩短,影响产物的产量,因此,必须选择合适的温度表达同人源胶原蛋白,在发酵生产中可以采用变温发酵策略来提高产量,即诱导表达时的温度要比菌体生长时的温度低;巴氏毕赤酵母生长的ph值范围比较宽,因此应当选择适宜同人源胶原蛋白表达的ph值,如真菌免疫调节蛋白在ph值5.8-8.0时,随着ph值逐渐增加到8.0,表达量达到最高,但对于巴氏毕赤酵母来说,其生长和表达的最适ph值也并不相同;在发酵过程中,需要定期补加一定量的诱导剂甲醇以补偿甲醇的挥发和消耗,补加甲醇的终浓度、甲醇的诱导方式、诱导温度及诱导时间都会影响同人源胶原蛋白的表达水平,所以具体条件还需要根据具体试验而定。
f、产物稳定性的优化
巴氏毕赤酵母细胞膜上有一种kex-2样蛋白水解酶,能专一性水解a因子前体中羧基端的肽键,即连续两个碱性氨基酸(如lysarg、lyslys、argarg、lysarg),巴氏毕赤酵母基因工程表达产物发生降解现象的原因就在于此。通过降低培养温度、改变培养基的ph值、加入适量的酵母提取物和蛋白胨或酪蛋白水解物,都能够提高同人源胶原蛋白的稳定性。同时,在培养基中加入少量的tritonx-114或蛋白酶抑制剂也可提高同人源胶原蛋白的表达量。
(二)一种同人源胶原蛋白的氨基酸序列和基因序列
同人源胶原蛋白是根据人胶原蛋白gly-x-y重复序列作为最小重复单位,优选亲水性的gly-x-y进行排列组合,并合理控制了5′-utr的长度,包含315个氨基酸残基,本发明同人源胶原蛋白氨基酸序列为序列表中seqidno:1的氨基酸序列,或者与seqidno:1具有至少85%同源性的氨基酸序列。见序列表seqidno:1。
根据上述设计的同人源胶原蛋白氨基酸序列,按照巴氏毕赤酵母对密码子的偏爱性,并适当的对外源基因进行优化,调整a+t的含量在39.667%,设计并人工全基因合成同人源胶原蛋白的基因序列,同时在5’端添加xhoⅰ内切酶切割位点ctcgag和毕赤酵母信号肽切割位点序列aaaaga,3’端添加ecori内切酶切割位点gaattc,本发明同人源胶原蛋白基因序列为序列表中seqidno:2的基因序列,或者与seqidno:2具有至少85%同源性的基因序列。见序列表seqidno:2。
(三)设计出的具体技术方案
一种同人源胶原蛋白氨基酸,所述氨基酸的序列与seqidno:1具有至少85%同源性的氨基酸序列。
优选地,上述的同人源胶原蛋白氨基酸,所述的氨基酸序列如seqidno:1所示。
一种编码如上述同人源胶原蛋白氨基酸的基因序列,所述的基因序列与seqidno:2具有至少85%同源性的基因序列。
优选地,如上述同人源胶原蛋白氨基酸的基因序列,所述的基因序列如seqidno:2所示。
优选地,如上述同人源胶原蛋白氨基酸的基因序列,所述的基因序列a+t的含量介于30%-55%。
一种表达上述同人源胶原蛋白氨基酸的方法,所述方法包括如下步骤:
1)制备质粒;
2)毕赫酵母电转化;
3)多拷贝插入重组子的筛选;
4)基因重组同人源胶原蛋白的发酵;
5)基因重组同人源胶原蛋白的纯化。
优选地,如上述同人源胶原蛋白氨基酸的方法,步骤1)制备质粒具体包括如下步骤:
1)对载体ppic9的酶切;
2)col1基因的酶切;
3)col1基因导入ppic9构建重组质粒;
4)重组质粒ppic9-col1上获得α-因子信号肽基因+col1的片段;
5)酶切载体ppic9k;
6)构建重组质粒ppic9k-col1;
7)ppic9k-col1的线性化和浓缩。
优选地,如上述同人源胶原蛋白氨基酸的方法,步骤3)多拷贝插入重组子的筛选具体包括如下步骤:
1)g418抗性筛选及鉴定;
2)菌落pcr鉴定。
优选地,如上述同人源胶原蛋白氨基酸的方法,步骤5)基因重组同人源胶原蛋白的发酵ph介于5.8-8.0,溶氧量为33%。
优选地,如上述同人源胶原蛋白氨基酸的方法,步骤5)基因重组同人源胶原蛋白的诱导温度为17.5℃,连续诱导时间为46h;每间隔12h向培养基中补加10%的甲醇至终浓度为1.0%。
本发明有益效果如下:本发明设计的基因序列能高效、高产量地表达同人源胶原蛋白氨基酸;所制备的同人源胶原蛋白氨基酸具有纯度高、活性好的特点。
附图说明
图1为ppic9k-col1的质粒图谱;
图2为ppic9k-col1质粒双酶切鉴定电泳图;
图3为重组菌株pcr鉴定结果验证图;
图4为tricine-sds-page蛋白电泳图。
具体实施方式
为详细说明本发明的技术内容、构造特征、所实现目的及效果,以下结合实施方式并配合附图详予说明。
实施例1
一种同人源胶原蛋白高效表达的方法
a、制备质粒
人工全基因合成序列表中的seqidno:2的目的col1基因序列,然后对ppic9载体及人工全基因合成的col1基因进行xhoⅰ和ecorⅰ双酶切,从重组质粒ppic9-col1上获得α-因子信号肽基因+col1的片段,对ppic9k载体进行ecori和bamhi双酶切,回收酶切产物,用t4连接酶连接,并转化tg1,构建重组质粒ppic9k-col1,并对ppic9k-col1进行线性化和浓缩。
a、对载体ppic9的酶切
pcr离心管中加入50μlddh2o,载体ppic920μl,30μl10×tangobuffer,也分别加入xhoi和ecori这两种内切酶各5μl,作为载体酶切体系。移液器抽打混合均匀,在迷你离心机上离心1min,后进行4小时水浴,温度为37℃,期间每60min都要将离心管上下颠倒几次后再次离心1min,4小时后完成酶切过程,在试剂盒的指导下割胶回收,并在-20℃冰箱中保存备用。
b、col1基因的酶切
在pcr离心管中加入54μlddh2o,col1基因所在序列50μl,30μl10×tangobuffer,再分别加入内切酶xhoi和ecori各8μl,作为基因处理酶切体系。处理方式同上步,4小时后完成酶切过程,在试剂盒的指导下割胶回收,并在-20℃冰箱中保存备用。
c、col1基因导入ppic9构建重组质粒
col1基因在克隆到ppic9k之前要导入到ppic9载体中的α-因子信号肽基因之后,是因为虽然ppic9k载体比之前者多了一个抗卡那霉素的基因可以用卡那霉素或是遗传霉素(g418)来做筛选,但其上的xhoi位点非单一。在pcr离心管中加入9μl的col1基因和载体3μlppic9混合,并加入10×t4buffer和t4连接酶各1.5μl使得每离心管的最终体系达到15μl。用泡沫盒中的冰块和水,将水温调制16℃,将离心管漂浮于水中16h,将泡沫盒密封保温。提前将预备好tg1的感受态细胞分为两组,一组每毫升50μl准备好的重组质粒ppic9-col1进行转化,另外一组不做处理直接作为为空白对照,分别将两组菌液涂布于含有氨苄抗生素的lb固体培养基上,正放培养30min待菌液完全干了,倒置放入37℃培养箱过夜培养,12h观察菌体生长情况。将重组质粒从tg1中提取出来(质粒抽提试剂盒),同试剂盒说明书tg1提取步骤。用1.0%的琼脂糖电泳验证。
d、重组质粒ppic9-col1上获得α-因子信号肽基因+col1的片段
为了规避载体ppic9k上的非单一xhoi位点在处理目的基因时将其上游的α-因子信号肽基因一并酶切得到,因此需要更换限制性内切酶。在pcr离心管中加入44μlddh2o,质粒ppic9-col140μl,24μl10×tangobuffer,再分别加入内切酶ecori和bamhi各6μl,作为基因处理酶切体系。移液器抽打混合均匀,在迷你离心机上离心1min,后进行4小时水浴,温度为37℃,期间每60min都要将离心管上下颠倒几次后再次离心1min,4小时后完成酶切过程,取10μl电泳验证准确性,若成功则将剩余产物一同电泳,在试剂盒的指导下割胶回收,并在-20℃冰箱中保存备用。
e、酶切载体ppic9k
在pcr离心管中加入64μlddh2o,将载体ppic9k20μl,24μl10×tangobuffer,与之混合,再分别加入ecori和bamhi这两种内切酶各6μl,作为载体酶切体系。移液器抽打混合均匀,在迷你离心机上离心1min,后进行4小时水浴,温度为37℃,期间每60min都要将离心管上下颠倒几次后再次离心1min,4小时后完成酶切过程,取10μl电泳验证准确性,若成功则将剩余产物一同电泳,在试剂盒的指导下割胶回收,并在-20℃冰箱中保存备用。
f、构建重组质粒ppic9k-col1
在pcr离心管中加入α-因子信号肽基因+col1基因6.5μl和上步酶切的载体1.5μl混合,并加入10×t4buffer和t4连接酶各1μl使得每离心管的最终体系达到10μl。用泡沫盒中的冰块和水,将水温调制16℃,将离心管漂浮于水中16h,将泡沫盒密封保温。提前将预备好tg1的感受态细胞分为两组,一组每毫升50μl准备好的重组质粒ppic9k-col1进行转化,另外一组不做处理直接作为为空白对照,分别将两组菌液涂布于含有氨苄抗生素的lb固体培养基上,正放培养30min待菌液完全干了,倒置放入37℃培养箱过夜培养,12h观察菌体生长情况。将重组质粒从tg1中提取出来(质粒抽提试剂盒),同试剂盒说明书tg1提取步骤。将提取的重组质粒进行电泳验证(1.0%的琼脂糖)。
g、ppic9k-col1的线性化和浓缩
在pcr离心管中加入24μlddh2o,将以ppic9k为载体的重组质粒10μl,24μl10×tangobuffer加入其中,再加入sali内切酶2μl,作为质粒线性化体系。移液器抽打混合均匀,在迷你离心机上离心1min,后进行4小时水浴,温度为37℃,期间每60min都要将离心管上下颠倒几次后再次离心1min,4小时后完成酶切过程,取10μl电泳验证准确性,若成功则将剩余产物一同电泳,在试剂盒的指导下割胶回收,并在-20℃冰箱中保存备用。因为线性化后的总体积是40μl,而其中只有10μl为目标基因所以要将基因浓缩,在体系中加入在线性化产物中加入无水c2h5oh200μl,使产物的体积为无水c2h5oh的1/5,再加入3mol/l的naac4μl,在-20℃冰箱冷冻20min,高速离心机上离心10min转速为10000rmp,使得基因析出沉淀,移液器吸走上清液,用浓度为70%的c2h5oh洗去残留的naac,上述转速再次离心3min,保留沉淀,室温放置待c2h5oh完全挥发,加入20μl去离子水溶解,-20℃冰箱冻存。少量浓缩产物电泳验证。
b、毕赤酵母电转化
a、培养受体菌株gs115菌
在yepd液体培养基中培养gs115菌到od值到0.6-1.0,用冰ddh2o把菌液制备为感受态细胞,将50ml的菌液浓缩为150μl。
b、电转化
用移液器吸取80μl感受态细胞转移到0.2cm预冷的电转杯中,加入预备好的20μl线性化基因,在冰盒中放5min。电压1.5kv,4.8~5.5ms电击,迅速加入1ml的山梨醇1.5ml的离心管中,28℃摇床低速培养1h,涂布。
c、多拷贝插入重组子的筛选
a、g418抗性筛选及鉴定
用灭过菌的牙签挑取单菌落,点到含有不同浓度g418抗生素的yped平板(分别为1、3、5mg/ml)上。28℃培养3-5天后观察。用灭过菌的牙签挑取his+转化子的单菌落点到mm和md平板上,28℃培养两天,观察平板。在mm和md平板上均能正常生长菌落表为mut+(methanolutilizationplus)。
b、菌落pcr鉴定
因为酵母菌是真菌,细胞壁上多为葡聚糖和甘露聚糖较为致密,所以不能直接进行菌落pcr,需要裂解细胞壁。因此,应该挑取单菌落加入40μl蜗牛酶对菌落进行细胞破壁处理,处理后离心保留上清进行pcr鉴定。在pcr管中加入无菌去离子水14.75μl,破壁菌液2μl,选用3’aox和5’aox各1μl作为引物,在分别加入10×buffer,25mmmgcl2,2mmdntp各2μl,最后tag酶0.25μl使得终体积为25μl。为pcr反应设计的程序是:首先94℃预变性3min;94℃60s,52℃60s,72℃1min,30个循环;72℃10min;最后保存16℃10min。取5lpcr产物进行1%琼脂糖凝胶电泳,检测pcr结果。
d、基因重组同人源胶原蛋白的发酵
mut+型菌株酵母诱导表达。单菌落培养在的5mlbmgy的培养基中,在28.5℃,ph值为5.5,250-300rpm培养od值达到2-6(约16-18h)。室温下2800rpm离心5min,倒去上清也收集菌体,40mlbmmy重悬菌体于培养瓶,28.5℃,ph值为5.5,溶氧控制在33%,300rmp的摇床继续培养生长。诱导温度低于生长温度为17.5℃,间隔12h向培养基中补加10%的甲醇至终浓度为1.0%。按时间点取样50μl,置1.5ml离心管中,最大速度离心2min,收集上清和菌体,连续诱导表达46h。
e、基因重组同人源胶原蛋白的纯化
将上述发酵液经离心进行固液分离,取上清液,对发酵上清液用孔径为0.1μm或0.22μm中空纤维微滤系统进行微滤,收集滤过液,再用截留分子量为10kd的中空纤维超滤系统进行超滤脱盐浓缩,收集浓缩液,然后用cmsepharoseff进行离子交换层析,获得纯度为97%以上的同人源胶原蛋白,浓度用bradford方法测定,高达7.65mg/ml。
实验验证及结果
试验例1
a、重组表达载体ppic9k-col1的质粒图谱,如图1所示。
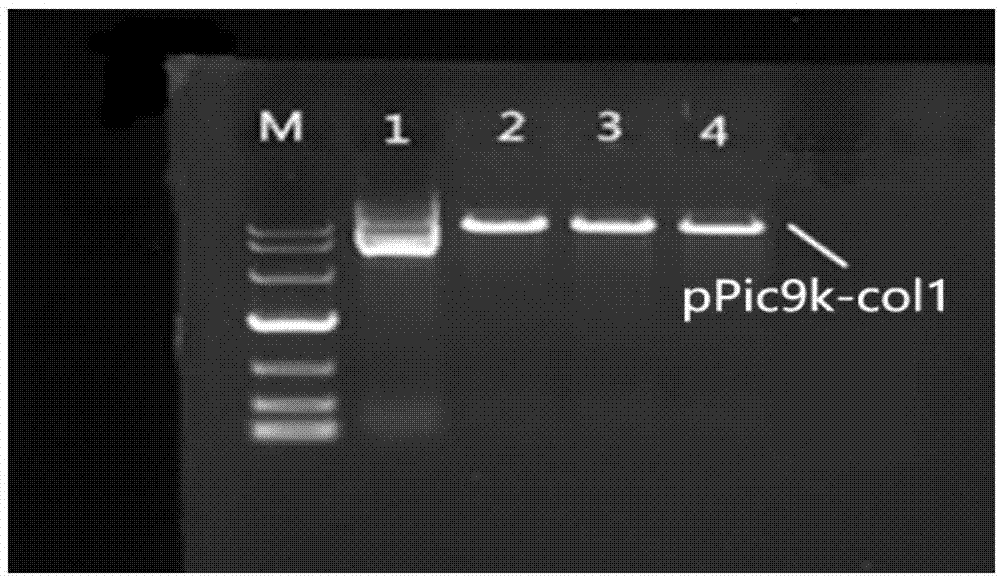
试验例2
b、重组质粒ppic9k-col1的线性化验证,如图2所示。重组质粒ppic9k-col1被sali处理后进行酶切,应为线状。从图2可以看出1号有明显拖尾为对照的未酶切质粒,2至4号已经被线性化,条带明确明亮,没有拖尾。
试验例3
c、重组菌株pcr鉴定结果,如图3所示。从图3中观察到5-10号转化子与11号中的重组质粒在相同的位置都有带,对比表示重组质粒已经和巴氏毕赤酵母结合,转化成功。
试验例4
d、tricine-sds-page电泳图结果,如图4所示。
tricine-sds-page电泳。tricine-sds-page胶配方:分离胶(4.5ml):ddh2o1.25ml,ab-61.395ml,凝胶缓冲液1.5ml,尿素/甘油1.643g/450μl,10%aps(现配)50μl,temed5μl。浓缩胶(3ml):ddh2o2ml,ab-3240μl,凝胶缓冲液745μl,10%aps(现配)30μl,temed5μl。根据上述配方配置蛋白胶,后进行样品处理:将20μl和80μl样品加入pcr管中混合均匀,100℃沸水浴5min。电泳时,样品进入分离胶前电压60v,后换为120v。电泳结束后将蛋白胶放入染色液中染色40min,后在脱色液中过夜脱色。
如图4所示经过诱导表达在29.5kd左右有巴氏毕赤酵母转化子均有同人源胶原蛋白表达,说明实验构建的工程菌株可以高效分泌目标蛋白,同时同人源胶蛋白纯度达97%以上,浓度高达7.65mg/ml。
试验例5
e、同人源胶原蛋白的活性检测
利用紫外吸收法检测同人源胶原蛋白样品浓度,包括对照人ⅰ型胶原蛋白(sigma,c7774),目的蛋白。具体为分别测定样品在215nm和225nm下的紫外吸收,利用检验公式c(μg/ml)=144x(a215-a225)计算蛋白浓度。检测完蛋白浓度用pbs将所有待测蛋白浓度调整到0.5mg/ml。向96孔板中分别加入100μl对照品、目的蛋白和空白pbs溶液对照,室温静置60min。每孔加入105个培养状态良好的3t3细胞,37℃孵育60min后,每孔用pbs清洗4次。用ldh检测试剂盒(roche)检测od492nm的吸光度。根据空白对照数值,计算细胞贴壁程度。细胞的贴壁率即为同人源胶原蛋白活性。以人ⅰ型胶原蛋白贴壁率定义活性为50iu/mg,检测目的蛋白即同人源胶原蛋白活性为59iu/mg,所以本发明获得的同人源胶原蛋白不仅纯度高、产量高、溶解性佳而且活性也有所提高,可以当作活性成分广泛应用在生物医药和化妆品等行业中。
以上所述仅为本发明的实施例,并非因此限制本发明的专利保护范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
序列表
<110>杭州惠博士生物科技有限公司
<120>一种同人源胶原蛋白氨基酸、基因序列及蛋白氨基酸的制备方法
<160>2
<170>siposequencelisting1.0
<210>1
<211>315
<212>prt
<213>同人源胶原蛋白氨基酸序列(seqidno:1)
<400>1
glygluproglylysalaglygluargglyvalproglyproprogly
151015
alavalglyproalaglylysaspglyglualaglyalaglnglypro
202530
proglyproalaglyproalaglygluargglygluglnglyproala
354045
glyserproglypheglnglyleuproglyproalaglyproprogly
505560
glualaglylysproglygluglnglyvalproglyaspleuglyala
65707580
proglyproserglyalaargglygluargglypheproglygluarg
859095
glyvalglnglyproproglyproalaglyproargglyalaasngly
100105110
alaproglyasnaspglyalalysglyaspalaglyalaproglyala
115120125
proglyserglnglyalaproglyleuglnglymetproglygluarg
130135140
glyalaalaglyleuproglyprolysglyaspargglyaspalagly
145150155160
prolysglyalaaspglyserproglylysaspglyvalargglyleu
165170175
thrglyproileglyproproglyproalaglyalaproglyasplys
180185190
glygluserglyproserglyproalaglyprothrglyalaarggly
195200205
alaproglyaspargglygluproglyproproglyproalaglyphe
210215220
alaglyproproglyalaaspglyglnproglyalalysglyglupro
225230235240
glyaspalaglyalalysglyaspalaglyproproglyproalagly
245250255
proalaglyproproglyproileglyasnvalglyalaproglyala
260265270
lysglyalaargglyseralaglyproproglyalathrglyphegly
275280285
glyalaalaglyargvalglyproproglyproserglyasnalagly
290295300
proproglyproproglyproalaglylysglu
305310315
<210>2
<211>963
<212>dna
<213>同人源胶原蛋白dna序列(seqidno:2)
<400>2
ctcgagaaaagaggtgagccaggtaaggctggtgagcgtggtgttccaggtccaccaggt60
gctgttggtccagctggtaaggacggtgaggctggtgctcaaggtccaccaggtccagct120
ggtccagctggtgagcgtggtgagcaaggtccagctggttctccaggtttccaaggtctt180
ccaggtccagctggtccaccaggtgaggctggtaagccaggtgagcaaggtgttccaggt240
gaccttggtgctccaggtccatctggtgctcgtggtgagcgtggtttcccaggtgagcgt300
ggtgttcaaggtccaccaggtccagctggtccacgtggtgctaatggtgctccaggtaat360
gacggtgctaagggtgacgctggtgctccaggtgctccaggttctcaaggtgctccaggt420
cttcaaggtatgccaggtgagcgtggtgctgctggtcttccaggtccaaagggtgaccgt480
ggtgacgctggtccaaagggtgctgacggttctccaggtaaggacggtgttcgtggtctt540
actggtccaattggtccaccaggtccagctggtgctccaggtgacaagggtgagtctggt600
ccatctggtccagctggtccaactggtgctcgtggtgctccaggtgaccgtggtgagcca660
ggtccaccaggtccagctggtttcgctggtccaccaggtgctgacggtcaaccaggtgct720
aagggtgagccaggtgacgctggtgctaagggtgacgctggtccaccaggtccagctggt780
ccagctggtccaccaggtccaattggtaatgttggtgctccaggtgctaagggtgctcgt840
ggttctgctggtccaccaggtgctactggtttcccaggtgctgctggtcgtgttggtcca900
ccaggtccatctggtaatgctggtccaccaggtccaccaggtccagctggtaaggaggaa960
ttc963
- 还没有人留言评论。精彩留言会获得点赞!