提取高纯度核蛋白和膜蛋白的方法与流程
本发明涉及生物技术领域,具体地涉及提取高纯度核蛋白和膜蛋白的方法。
背景技术:
细胞是生物体生命活动的基本结构单位和功能单位,由不同细胞器或者亚细胞结构构成的多区室单位。动物细胞可以粗略地划分为细胞核和细胞浆区室,细胞核内的蛋白统称为核蛋白,细胞浆中的蛋白统称为浆蛋白,细胞浆内细胞器的膜蛋白,细胞核的膜蛋白和细胞质膜蛋白统称为膜蛋白。相应地,如果直接将细胞充分裂解提取细胞内所有的蛋白,则称之为细胞总蛋白提取;如果需要提取细胞内细胞核的蛋白,则称之为核蛋白提取;如果只需要提取细胞内细胞器的膜蛋白,细胞核的膜蛋白和细胞质膜蛋白,则称之为膜蛋白提取。
无论是在科学研究还是在工业生产中,经常需要提取核蛋白和膜蛋白用来满足特定的研发试验。相比于蛋白得率,核蛋白和膜蛋白的纯度往往是更为重要的参数;如果核蛋白和膜蛋白纯度不符合要求,往往会导致研发试验结果的差强人意甚至失败。
评判核膜蛋白和膜蛋白提取优劣,不仅仅要参考蛋白提取效率,还需要评判核蛋白和膜蛋白的纯度,即核蛋白或者膜蛋白中污染其他区域蛋白的程度。理论上核蛋白和膜蛋白的得率越高,其他蛋白污染程度越小(即核蛋白或者膜蛋白纯度越高),说明核蛋白和膜蛋白提取效果越好。
目前文献报道或者商业化试剂盒提供的方法都是分开提取核蛋白或者膜蛋白。对于核蛋白提取,目前的提取方法大同小异,基本都是先用低渗溶液或者等渗溶液加去垢剂破坏细胞质膜,然后低速离心富集细胞核;但都没有后续进一步的细胞核纯化步骤,导致所提取核蛋白纯度并不高。对于膜蛋白提取,一般都是先用低渗溶液使细胞吸水胀破,然后低速离心去除细胞核,再高速离心富集膜碎片,最后使细胞膜溶解;但目前他人的方法对于膜蛋白溶解较为忽视,其实膜蛋白由于存在较多疏水结构域,其溶解方式需要十分注意。
虽然有大量的文献报道核蛋白和膜蛋白的提取方法,也有很多商业化试剂盒专门用于提取核蛋白或者膜蛋白,但他们一般至少存在以下两个弊端:1.核蛋白和膜蛋白的纯度无法保证,对于纯度要求很高的研发试验无能为力;2.核蛋白和膜蛋白需要分开提取,既无法充分有效利用样品,也不能用于需要严格平行对照组的研发试验。
技术实现要素:
针对现有技术的上述两大弊端,本发明通过丰富和优化提取溶液配方和相关实验步骤,能够同时提取得到高纯度的核蛋白和膜蛋白,既能满足特定研发试验对蛋白纯度的要求,也能够明显降低样品需求量和试验成本,还能满足需要核蛋白,膜蛋白和浆蛋白作为严格平行对照组的研发试验要求。
本发明的目的主要用于同时提取高纯度的核蛋白和膜蛋白。
在本发明的第一方面,提供了一种提取核蛋白和/或膜蛋白的方法,包括步骤:
(1)提供细胞样品;
(2)匀浆步骤,对步骤(1)中的细胞样品进行n次匀浆处理,得到匀浆后的细胞悬浮液,其中n为≥1的正整数,优选n为20-100,更优选n为25-50,最优选n为30;
(3)低速离心步骤,对步骤(2)中的细胞悬浮液进行低速离心处理,得到沉淀物1和上清液1;
(4)膜蛋白获取步骤,和/或核蛋白获取步骤;
(5)任选地,核蛋白和膜蛋白定量和质检步骤;
所述膜蛋白获取步骤包括:
(a1)高速离心步骤,对步骤(3)中得到的上清液1进行高速离心处理,得到沉淀物2和沉淀物3;
(b1)膜蛋白溶解和收集步骤,对步骤(4)中得到的沉淀物2进行溶解,得到上清液2,所述上清液2中含有膜蛋白;
所述核蛋白获取步骤包括:
(a2)任选地,细胞核(i)密度梯度离心步骤和(ii)洗涤步骤;
(b2)核蛋白收集和超滤步骤,得到上清液3,所述上清液3中含有核蛋白。
在本发明的第二方面,提供了一种同时提取核蛋白和膜蛋白的方法,包括步骤:
(1)提供细胞样品;
(2)匀浆步骤,对步骤(1)中的细胞样品进行n匀浆处理,得到匀浆后的细胞悬浮液,其中n为≥1的正整数,优选n为20-100,更优选n为25-50,最优选n为30;
(3)低速离心步骤,对步骤(2)中的细胞悬浮液进行低速离心处理,得到沉淀物1和上清液1;
(4)膜蛋白获取步骤和核蛋白获取步骤;
(5)任选地,核蛋白和膜蛋白定量和质检步骤;
所述膜蛋白获取步骤包括:
(a1)高速离心步骤,对步骤(3)中得到的上清液1进行高速离心处理,得到沉淀物2和沉淀物3;
(b1)膜蛋白溶解和收集步骤,对步骤(4)中得到的沉淀物2进行溶解,得到上清液2,所述上清液2中含有膜蛋白;
所述核蛋白获取步骤包括:
(a2)任选地,细胞核(i)密度梯度离心步骤和(ii)洗涤步骤;
(b2)核蛋白收集和超滤步骤,得到上清液3,所述上清液3中含有核蛋白。
在另一优选例中,所述步骤(2)中,细胞匀浆步骤之后,还包括至少一次镜检步骤。
在另一优选例中,所述步骤(2)中匀浆步骤中,加入细胞沉淀体积的10倍,优选2-8倍、更优选3-5倍体积的低渗裂解溶液。
在另一优选例中,所述步骤(2)中,所述低渗裂解溶液为:10mmhepes(ph7.5),1.5mmmgcl2,10mmkcl,5mmedta,1mmdtt,1mmcocktailandpmsf。
在另一优选例中,所述步骤(2)中,匀浆次数n为10-200,优选n为20-100,更优选n为25-50,最优选n为30。
在另一优选例中,所述步骤(2)中,还包括往低渗裂解溶液中添加tritonx-100溶液的步骤。
在另一优选例中,所述tritonx-100在低渗裂解溶液中的终浓度为0.01%-0.2%,优选0.03%-0.15%,更优选0.05%-0.1%。
在另一优选例中,所述步骤(2)中,要使绝大部分细胞被裂解释放出膜碎片和浆蛋白,同时也要保持细胞核完整。
在另一优选例中,所述步骤(3)中,所述低速离心步骤为在2-10℃下离心,优选4℃。
在另一优选例中,所述步骤(3)中,所述低速离心步骤为4℃下2000g离心10分钟。
在另一优选例中,所述沉淀物1中包括细胞核和任选地,没有裂解的完整细胞。
在另一优选例中,所述上清液1中包括浆蛋白,膜碎片,细胞器,细胞骨架和任选地,少量破碎的细胞核。
在另一优选例中,所述步骤(a1)中,所述高速离心步骤为4度下14000rpm离心30分钟。
在另一优选例中,所述步骤(a1)中,所述沉淀物2中包括膜碎片。
在另一优选例中,所述步骤(a1)中,所述沉淀物2为淡黄色沉淀。
在另一优选例中,所述步骤(a1)中,所述沉淀物3中包括细胞骨架。
在另一优选例中,所述步骤(a1)中,所述沉淀物3为白色絮状沉淀。
在另一优选例中,所述步骤(a1)中,所述沉淀物3位于所述沉淀物2上层。
在另一优选例中,所述步骤(b1)中,所述溶解为用1%的sds溶液直接溶解,得到膜蛋白溶液。
在另一优选例中,所述膜蛋白溶液中的膜蛋白已经变性。
在另一优选例中,所述1%的sds溶液溶解于pbs中。
在另一优选例中,所述步骤(b1)中,所述溶解为用1%或者2%tritonx-100溶液溶解,得到膜蛋白溶液。
在另一优选例中,所述膜蛋白溶液中的膜蛋白未变性。
在另一优选例中,所述1%或者2%tritonx-100溶液溶解于pbs中,添加1mmpmsf和dtt。
在另一优选例中,所述步骤(b1)中,所述溶解为冰上溶解20-60分钟,优选30分钟。
在另一优选例中,所述步骤(b1)中,所述上清液2为将膜蛋白溶液在4度下14000rpm高速离心20分钟收集得到。
在另一优选例中,所述步骤(4)中,所述核蛋白获取步骤中,包括用tr等渗洗涤溶液洗涤沉淀物1。
在另一优选例中,所述tr等渗洗涤溶液为10mmhepes(ph7.5),1.5mmmgcl2,10mmkcl,5mmedta,1mmdtt,250mmsucrose,0.1%tritonx-100,0.1mmspermine,0.5mmspermidine,1mmcocktail和pmsf。
在另一优选例中,所述步骤(4)中,所述核蛋白获取步骤中,包括用高盐裂解溶液溶解经tr等渗洗涤溶液洗涤的沉淀物1。
在另一优选例中,所述高盐裂解溶液为:10mmhepes(ph7.5),10mmmgcl2,1.6mkcl,5mmedta,1%tritonx-100,1mmdtt,1mmcocktail和pmsf。
在另一优选例中,所述步骤(a2)中,所述(i)密度梯度离心步骤中,包括步骤(a3)对沉淀物1用tr等渗洗涤溶液洗涤,并离心处理,得到细胞核沉淀1。
在另一优选例中,所述步骤(a3)中,还包括用nt等渗洗涤溶液悬浮细胞核沉淀1,得到细胞核悬浮液1。
在另一优选例中,所述nt等渗洗涤溶液为:10mmhepes(ph7.5),1.5mmmgcl2,10mmkcl,5mmedta,1mmdtt,250mmsucrose,0.1mmspermine,0.5mmspermidine,1mmcocktail和pmsf。
在另一优选例中,所述步骤(a2)中,所述(i)密度梯度离心步骤包括:在ep管最底层铺1.5m-2.3msucrose溶液,然后再铺60%-65%percoll溶液,再将细胞核悬浮液1轻轻铺在最上层。
在另一优选例中,所述步骤(a2)中,所述(i)密度梯度离心步骤包括:在ep管最底层铺2msucrose溶液。
在另一优选例中,所述步骤(a2)中,所述(i)密度梯度离心步骤还包括:4度下2000g离心30分钟。
在另一优选例中,所述步骤(a2)中,所述(i)密度梯度离心步骤还包括:将细胞核聚集物轻轻从percoll溶液中吸取出来,用nt等渗洗涤溶液稀释后,进行离心处理1,然后吸去上清液,保留细胞核沉淀2。
在另一优选例中,所述离心处理1为0-10度(优选4度)下3000g-6000g(优选5000g)离心10-20分钟(优选15分钟)。
在另一优选例中,所述步骤(a2)中,还包括将所述细胞核沉淀2用30%-40%(优选35%)percoll溶液悬浮,然后0到10度(优选4度)下2000g-4000g(优选3000g)离心10-20分钟(优选15分钟),所得沉淀即为细胞核。
在另一优选例中,所述步骤(a2)中,还包括将所述细胞核用tr等渗洗涤溶液洗涤至少一次,离心处理2后收集所得沉淀即为高纯度细胞核沉淀。
在另一优选例中,所述离心处理2为1500g-2500g下离心。
在另一优选例中,所述离心处理2为2000g离心。
在另一优选例中,所述步骤(b2)中,还包括将所述高纯度细胞核用高盐裂解溶液溶解,得到细胞核悬浮液2。
在另一优选例中,所述步骤(b2)中,还包括将所述细胞核悬浮液2放置0-10度(优选4度)冰箱旋转裂解0.75h-3h,优选1h-2h,得到裂解后的细胞核悬浮液2。
在另一优选例中,所述步骤(b2)中,还包括将所述裂解后的细胞核悬浮液2冰上超声处理,得到细胞核悬浮液3,其中染色质中完整dna被打断形成较小的片段。
在另一优选例中,所述冰上超声处理是指冰上200v条件下超声30次,每次超声10秒,中间间隔5秒。
在另一优选例中,所述步骤(b2)中,还包括将所述细胞核悬浮液3在4度下14000rpm离心30分钟,得到上清液3,所述上清液3中为细胞核溶液。
在另一优选例中,所述步骤(b2)中,还包括将所述细胞核溶液进行稀释后超滤浓缩或透析,得到盐离子浓度降低的核蛋白溶液。
在另一优选例中,所述步骤(5)中,还包括对核蛋白和膜蛋白进行考染来确定蛋白抽提的质量。
在本发明的第三方面,提供了一种用于同时提取核蛋白和膜蛋白的试剂盒,所述试剂盒包括低渗裂解溶液、nt(notritonx-100)等渗洗涤溶液、tr(tritonx-100)等渗洗涤溶液、60%percoll和35%percoll溶液和高盐裂解溶液;其中,
所述低渗裂解溶液为:10mmhepes(ph7.5),1.5mmmgcl2,10mmkcl,5mmedta,1mmdtt,1mmcocktail(市售蛋白酶抑制剂)和pmsf;
所述nt(notritonx-100)等渗洗涤溶液为:10mmhepes(ph7.5),1.5mmmgcl2,10mmkcl,5mmedta,1mmdtt,250mm蔗糖(sucrose),0.1mm精胺(spermine),0.5mm亚精胺(spermidine),1mmcocktail和pmsf;
所述tr(tritonx-100)等渗洗涤溶液为:10mmhepes(ph7.5),1.5mmmgcl2,10mmkcl,5mmedta,1mmdtt,250mmsucrose,0.1%tritonx-100,0.1mmspermine,0.5mmspermidine,1mmcocktailandpmsf;
所述60%percoll和35%percoll溶液为:percoll溶液和nt等渗洗涤溶液按照相应比例混合(体积比例);
所述高盐裂解溶液为:10mmhepes(ph7.5),10mmmgcl2,1.6mkcl,5mmedta,1%tritonx-100,1mmdtt,1mmcocktail和pmsf。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1为本发明技术方案的流程图。
图2为本发明技术方案实验操作流程图。
图3为本发明同时提取pc9细胞高纯度核蛋白和膜蛋白实验设计流程图。
图4为本发明同时提取pc9细胞高纯度核蛋白和膜蛋白实验中pc-9核蛋白和膜蛋白westernblot验证结果。
具体实施方式
本发明人通过广泛而深入的研究,意外地的首次设计同时提取核蛋白和膜蛋白的实验方案。本方面中的所有溶液配方,包括“低渗裂解溶液”,“nt(notritonx-100)等渗洗涤溶液”,“tr(tritonx-100)等渗洗涤溶液”,“60%percoll溶液”,“35%percoll溶液”,“膜蛋白溶解溶液”和“高盐裂解溶液”的配方,这些溶液的配方都是本公司经过反复摸索和验证确认的,首次用于同时提取核蛋白和膜蛋白。此外,本发明人将“膜蛋白溶解和收集”步骤、“密度梯度离心和洗涤”步骤、“超声30次”用于提取核蛋白和膜蛋白,并且取得良好效果。在此基础上,完成了本发明。
术语
本发明中,“低渗溶液”和“低渗裂解溶液”可以互换使用,均为:10mmhepes(ph7.5),1.5mmmgcl2,10mmkcl,5mmedta,1mmdtt,1mmcocktail(市售蛋白酶抑制剂)andpmsf。
在本说明书中所有“低渗溶液”和“低渗裂解溶液”均为同一个概念。
本发明的主要优点在于:
(1)由于目前现有的技术无法同时提取核蛋白和膜蛋白,核蛋白和膜蛋白需要分开提取。
首先,显而易见地是,这样会增加细胞样品用量,增加研发成本;
其次,如果研发试验中需要来自同一个细胞的核蛋白和膜蛋白作为实验对照组,目前现有的核蛋白和膜蛋白显然无法实现。
本发明通过优化蛋白裂解条件和核膜分离条件,能够同时有效提取核蛋白和膜蛋白。与目前原有技术相比,能够使细胞需求量降低一半,明显可以提升研发效率和降低研发成本;更为重要地是,本发明所提取的核蛋白和膜蛋白来自同一批细胞样品,可以作为严格的平行实验对照组,满足特定的研发试验要求。
(2)目前的现有技术所提取核蛋白纯度并不高,因为这些方法所富集的细胞核,既没有去除没有被裂解的完整细胞,也没有去除与细胞核偶联的细胞器或者细胞骨架,导致所提取的核蛋白有着比较严重的浆蛋白污染。本发明通过增加“细胞核密度梯度离心和洗涤”实验步骤,能够有效去除细胞核中没有被裂解的完整细胞和与细胞核偶联的细胞器或者细胞骨架,从而保证所提取的核蛋白纯度很高。
(3)目前现有的核蛋白提取技术中,由于低渗溶液(低渗裂解溶液)配方组成不合理,导致所提取的细胞核容易聚集在一起形成细胞核团,这些细胞核团离心时也会将膜碎片或者其他碎片一起沉淀下来,从而导致所提取细胞核蛋白有其他杂质蛋白污染,纯度难以保证;本发明通过优化核蛋白提取相关溶液的配方,比如降低氯化镁浓度,添加spermine和spermidine,从而防止细胞核聚集形成细胞核团,从而减少其他杂质蛋白的污染,保证所提取核蛋白纯度。
(4)目前现有的膜蛋白提取技术中,高速离心富集膜碎片后,对于如何去除上清液和如何溶解膜蛋白描述不清楚,往往导致所提取膜蛋白有较严重的浆蛋白污染并且膜蛋白不能充分溶解;本发明通过规范上清液去除和膜蛋白溶解实验步骤,提供标准明确的操作方法,保证所提取膜蛋白纯度很高,并且膜蛋白能够被充分溶解。
(5)目前现有的核蛋白提取技术中,细胞核直接用高盐溶液溶解,然后离心收集核蛋白。实际上由于染色质中dna依然保持完整状态,很多与dna紧密集合的染色质结合蛋白并没有被释放出来,从而导致所提取核蛋白缺少很多重要组分,其应用价值大打折扣。本发明针对这一弊端,在用高盐溶液裂解细胞核后,增加“冰上超声三十次(200v条件下,每次超声10s,中间间隔5s)”的实验操作来打断染色质dna,保证与染色质紧密结合的核蛋白充分释放,不仅仅提高核蛋白得率,还提升核蛋白的应用价值。
(6)本发明方法是目前已知所有核蛋白提取方法中能够保证核蛋白纯度最高的方法。
下面结合具体实施例,进一步详陈本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明详细条件的实验方法,通常按照常规条件如美国sambrook.j等著《分子克隆实验室指南》(黄培堂等译,北京:科学出版社,2002年)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。以下实施例中所用的实验材料和试剂如无特别说明均可从市售渠道获得。
通用方法
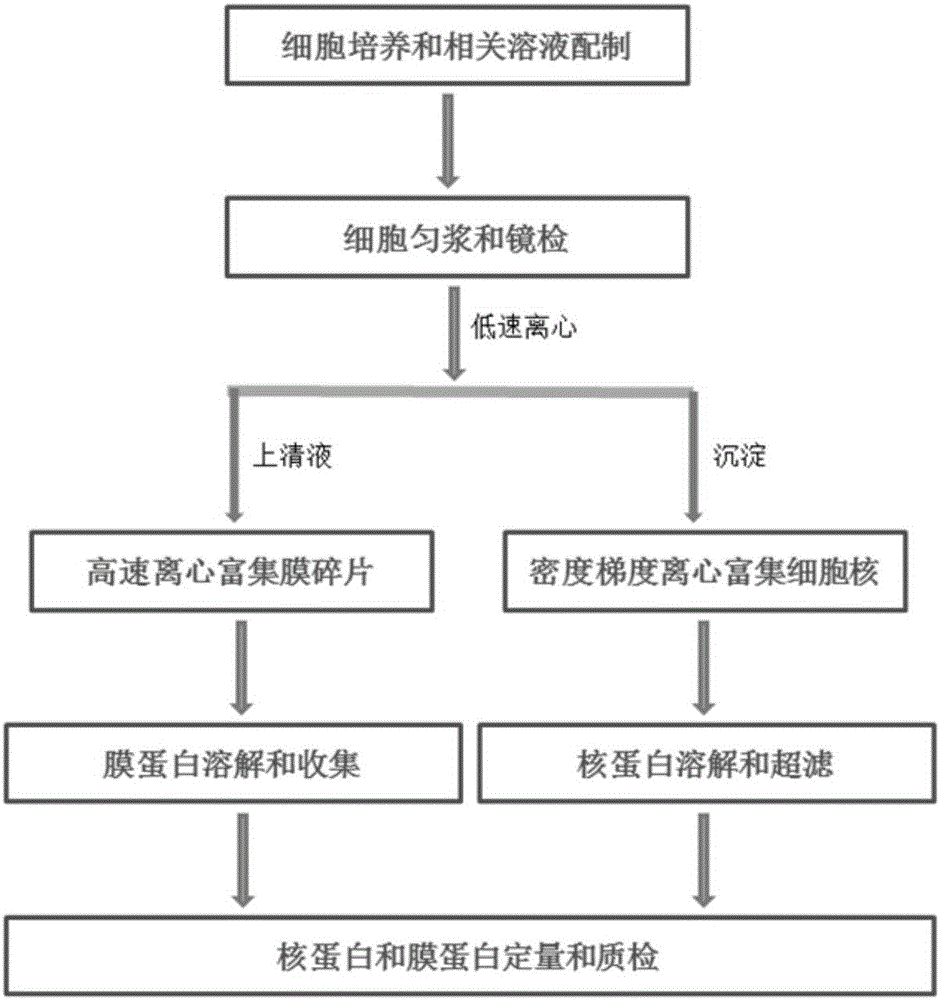
本发明的技术方案见图1,具体实验操作流程见图2。
1.实验原理和相关溶液配制
实验原理:该方法可以同时提取高纯度核蛋白和膜蛋白。首先利用低渗裂解溶液使细胞吸水胀破,然后匀浆使细胞膜碎片,细胞器和细胞骨架与细胞核分离(台盼蓝能进入死细胞中将细胞核染成蓝色,而无法进入活细胞中,可以利用台盼蓝染色后显微镜下观察细胞裂解情况);然后低速离心,可以富集细胞核和没有被裂解的细胞,所得上清液中包含浆蛋白,膜碎片,细胞器和细胞骨架等;上清液高速离心,浆蛋白无法被离心形成沉淀而继续停留在上清液中,膜碎片,细胞器(部分细胞器例如线粒体等)和细胞骨架等可以被沉淀下来,利用此特性可以富集到膜蛋白;所得细胞核粗核包含有完整细胞并且偶联一些细胞器,需要通过密度梯度离心进一步纯化富集。
相关溶液配制:主要有低渗裂解溶液,nt等渗洗涤溶液,tr等渗洗涤溶液,60%percoll溶液,35%percoll溶液,膜蛋白溶解溶液和高盐裂解溶液等。这些溶液都需要现配现用,不过可以提前配置好单成分高浓度母液。
低渗裂解溶液:10mmhepes(ph7.5),1.5mmmgcl2,10mmkcl,5mmedta,1mmdtt,1mmcocktail(市售蛋白酶抑制剂)和pmsf。
nt(notritonx-100)等渗洗涤溶液:10mmhepes(ph7.5),1.5mmmgcl2,10mmkcl,5mmedta,1mmdtt,250mmsucrose,0.1mmspermine,0.5mmspermidine,1mmcocktailandpmsf。
tr(tritonx-100)等渗洗涤溶液:10mmhepes(ph7.5),1.5mmmgcl2,10mmkcl,5mmedta,1mmdtt,250mmsucrose,0.1%tritonx-100,0.1mmspermine,0.5mmspermidine,1mmcocktail和pmsf。
60%percoll和35%percoll溶液:percoll溶液和nt等渗洗涤溶液按照相应比例混合(体积比例)。
膜蛋白溶解溶液:1%或者2%(依据实验用途选择相应的浓度)tritonx-100溶解于pbs溶液中,添加1mmcocktail,pmsf和dtt。
高盐裂解溶液:10mmhepes(ph7.5),10mmmgcl2,1.6mkcl,5mmedta,1%tritonx-100,1mmdtt,1mmcocktailandpmsf。
2.细胞匀浆和镜检
如果是贴壁细胞,细胞先用pbs溶液洗涤两遍,然后edta溶液处理(提取核蛋白和膜蛋白时,不建议用胰酶消化处理细胞;至于edta溶液的处理条件,需要根据细胞特点而定,例如pc-9细胞用2mmedta溶液在37度处理15分钟)后吹打起来;如果是悬浮细胞,则可以直接离心收集;将细胞溶液用塑料吸管转移到50ml离心管中,4度下500g离心10分钟;然后倒掉上清液,离心管倒置,尽量吸干残留液。
估算细胞沉淀体积,加入细胞沉淀体积的5到10倍体积的低渗裂解溶液,用塑料吸管将细胞轻轻吹打悬浮起来;冰上放置15分钟,然后转移至合适容量的玻璃匀浆器中匀浆20下,得到匀浆后的细胞悬浮液,然后取出少量细胞与等体积台盼蓝混匀后在显微镜下检测细胞裂解情况,如果视野下90%以上细胞被台盼蓝染成蓝色,即可停止匀浆继续下一步实验;如果不到90%,可以根据镜检结果继续匀浆,直至达到90%。
说明:
1.如果细胞数量较多,为方便实验操作,可以加入细胞沉淀体积的2到3倍体积的低渗裂解溶液;
2.如果细胞比较顽固,匀浆50次后镜检时绝大部分细胞依然保持完整,则可以采取如下措施:往低渗裂解溶液中添加tritonx-100溶液,使之终浓度为0.05%,混匀后每匀浆5次后再去镜检,直至镜检视野内90%细胞被台盼蓝染成蓝色。总之,细胞匀浆的结果对于实验的成败非常关键,不管怎么处理,既要使绝大部分细胞被裂解释放出膜碎片和浆蛋白,同时也要保持细胞核完整。3.低速离心初步富集细胞核
用塑料吸管轻轻地将细胞溶液转移到1.5mlep管中,然后在4度下2000g离心10分钟,理论上细胞核和没有裂解的完整细胞都会被离心下来形成沉淀物(沉淀物1),而浆蛋白,膜碎片,细胞器,细胞骨架和少量破碎的细胞核则留在上清液(上清液1)中。
4.高速离心富集膜碎片
低速离心富集细胞核后,用移液器将上清液1转移到新的ep管中(注意不要触碰到底层细胞核沉淀),然后4度下14000rpm离心30分钟;理论上,浆蛋白无法被离心下来形成沉淀而停留在上清液中,膜碎片(如果细胞裂解和匀浆过度,膜蛋白会被释放到溶液中而损失),细胞器(比如线粒体等)和部分完整细胞骨架会被沉淀下来。此时,需要用移液器尽量吸干净上清液;膜碎片一般会形成淡黄色沉淀(沉淀物2)处在ep管最底层,而一起沉淀下来的部分细胞骨架是白色絮状沉淀(沉淀物3)飘在膜碎片上层,可以用移液器轻轻吸走白色细胞骨架絮状物从而降低膜蛋白中的浆蛋白污染。
随后,可以利用这个空档期来进一步纯化细胞核。如果所提取的细胞核蛋白纯度要求不高,可以用tr等渗洗涤溶液洗涤一次后即可用高盐裂解溶液溶解,省去“6.细胞核密度梯度离心和洗涤”这一步骤。
5.膜蛋白溶解和收集
高速离心所得沉淀(沉淀物2)即为膜碎片,由于膜蛋白特别是细胞质膜蛋白存在较多疏水结构域,所以膜蛋白的溶解需要特别注意:1.如果变性后的膜蛋白也可以满足下游实验要求,可以用1%的sds溶液(溶解于pbs中)直接溶解膜蛋白;2.如果要求膜蛋白保持天然结构状态,可以用1%或者2%tritonx-100溶液(溶解于pbs中,添加1mmpmsf和dtt)溶解膜蛋白,冰上溶解30分钟后可以在4度下14000rpm高速离心20分钟收集膜蛋白上清液(上清液2),然后直接用于下游实验。
6.细胞核密度梯度离心和洗涤
所得细胞核粗核(沉淀物1)用tr等渗洗涤溶液洗涤一次:一个1.5mlep管用1ml溶液,移液器轻轻吹打混匀后2000g离心10分钟,然后尽量吸去上清液,保留细胞核沉淀;
细胞核沉淀用400μlnt等渗洗涤溶液悬浮起来,取出新的1.5mlep管,最底层铺400μl2msucrose溶液,然后再铺400μl60%percoll溶液(注意percoll溶液要轻轻铺在2msucrose溶液上面),再将细胞核悬浮液轻轻铺在最上层;4度下2000g离心30分钟,理论上没有被裂解的完整细胞会进入2msucrose溶液层,细胞核会聚集在60%percoll溶液层;
将1ml蓝色枪头剪去顶部,然后将细胞核聚集物轻轻从60%percoll溶液中吸取出来,转移到新的1.5mlep管中;用5倍体积nt等渗洗涤溶液稀释后,4度下3000g离心15分钟,然后吸去上清液,保留细胞核沉淀。如果细胞匀浆过度或者洗涤时吹打过度导致细胞核被破坏,在此条件下细胞核无法充分沉淀到ep管底部;此时作为补救,只能将离心速度调整到6000g离心15分钟,但细胞核蛋白的部分损失无法挽回。
离心所得细胞核沉淀用35%percoll溶液悬浮(一个1.5mlep管用1ml溶液),用移液器轻轻吹打起来,然后4度下3000g离心15分钟,所得沉淀即为细胞核。最后用tr等渗洗涤溶液(一个1.5mlep管用1ml溶液)洗涤一次,2000g离心后收集所得沉淀即为高纯度细胞核沉淀。
说明:在纯化细胞核时,保证细胞核的完整性非常重要。如果细胞核被破坏,该步骤所提供的参考离心条件无法将细胞核离心沉淀下来。作为补救,提高离心速度可以富集细胞核沉淀,但核蛋白损失不可避免。
7.核蛋白收集和超滤(透析)
所收集的高纯度细胞核(可取出少量细胞核台盼蓝染色后镜检细胞核纯度)用高盐裂解溶液溶解,并且用移液器反复吹打,使细胞核悬浮起来;然后放置4度冰箱旋转裂解1个小时;细胞核充分裂解后,放置冰上超声三十次(200v,每次超声10s,中间间隔5s),尽力将染色质中完整dna打断形成较小的片段;4度下14000rpm离心30分钟,然后收集核蛋白上清液(上清液3)。
所得细胞核溶液中盐离子浓度很高(kcl浓度高达1.6m),无法用于下游实验比如westernblot,ip或者蛋白芯片;可以利用10倍体积pbs溶液稀释后超滤浓缩,从而降低核蛋白溶液中盐离子浓度;如果核蛋白量很多,也可以利用透析的方式降低核蛋白溶液中盐离子浓度。
8.核蛋白和膜蛋白定量和质检
采取氨基黑的方法来测定核蛋白和膜蛋白浓度,然后根据蛋白溶液的体积来计算所抽提得到的蛋白量;蛋白量和所用细胞数量的比值就是蛋白抽提效率。
如果蛋白提取效率符合常理,或者与文献中所报道的一致,就将所提取蛋白通过考染来进一步确定蛋白条带分布和亮度,从而进一步确定蛋白抽提的质量;
如果考染结果符合预期,可以通过westernblot检测内参蛋白histone,tubulin和atpase的有无来判断核蛋白和膜蛋白提取效果;如果westernblot检测结果符合预期,则可以交由下游实验平台做实验。
实施例1同时提取pc9细胞高纯度核蛋白和膜蛋白
本实施例的目的:提取pc-9核蛋白和细胞质膜蛋白,用于蛋白芯片反应,筛选核蛋白和细胞质膜蛋白抗体。
实验设计如下:高纯度pc-9核蛋白提取方法采用上述方法;至于质膜蛋白,可以先用biotin试剂(thermo公司的ez-linktmsulfo-nhs-ss-biotin试剂溶于水但不能穿透活细胞,可以利用它这一特性标记细胞表面蛋白)先标记细胞质膜蛋白,然后采用上述膜蛋白提取方法提取膜蛋白,再直接用于蛋白芯片反应。整个实验设计流程图如图3所示:
实验结果如下:
1.蛋白得率:6个15cmdishpc-9细胞共提取得到膜蛋白1.2mg,浆蛋白15mg和核蛋白4.2mg;
2.westernblot结果:如图4所示,膜蛋白提取时高速离心的同时也能将部分完整细胞骨架富集下来,所以tubulin信号比较强,但这并不代表膜蛋白中有严重的浆蛋白污染;
3.蛋白芯片结果和免疫荧光验证结果:膜蛋白和核蛋白芯片反应后,膜蛋白阳性点1.5万,挑取前100个阳性点的腹水用于免疫荧光验证时,膜蛋白的膜定位比例高达97%,说明膜蛋白芯片结果比较可靠(结果未展示);同样地,蛋白芯片结果中核蛋白阳性点为2.5万,免疫荧光验证确认核蛋白定位比例高达90%(结果未展示)。
讨论
1.同时提取核蛋白和膜蛋白的实验方案设计,目前没有任何文献报道同时提取核蛋白和膜蛋白的方法,也没有任何商业化试剂盒用于同时提取核蛋白和膜蛋白,本发明的核心创新点是首次设计同时提取核蛋白和膜蛋白的实验方案并且取得良好效果;
2.实验步骤中的“细胞匀浆和镜检”步骤,目前现有的核蛋白或者膜蛋白提取技术中,它们的细胞裂解条件无法同时保证膜碎片保持合适大小和细胞核保持完整,也无法有效分离细胞核和细胞膜碎片,从而导致无法实现细胞核蛋白和膜蛋白的同时成功提取,本发明中该步骤所提供条件经过公司反复试验和优化,成功解决这两大难题,从而为成功提取核蛋白和膜蛋白提供技术基础;
3.本方面中的所有溶液配方,包括“低渗裂解溶液”,“nt(notritonx-100)等渗洗涤溶液”,“tr(tritonx-100)等渗洗涤溶液”,“60%percoll溶液”,“35%percoll溶液”,“膜蛋白溶解溶液”和“高盐裂解溶液”的配方,这些溶液的配方都是本公司经过反复摸索和验证确认的,对于实验的成败有着非常重要的影响;
4.膜蛋白提取部分的“膜蛋白溶解和收集”步骤,由于膜蛋白存在大量疏水结构域,膜蛋白的充分溶解一直是一个难题,同时有效去除细胞骨架蛋白的污染也是一大难题,本公司通过大量探索和实践,有效解决这两个难题,该步骤是解决这些难题的关键步骤,是本发明为提取高质量高纯度膜蛋白的独有发明;
5.核蛋白提取部分的“密度梯度离心和洗涤”步骤,该步骤是保证核蛋白纯度的核心操作步骤,是本发明为了提取高纯度核蛋白的独有发明步骤;
6.核蛋白提取部分的“核蛋白收集和超滤(透析)”步骤,在本发明该步骤中,细胞核用高盐裂解溶液溶解后,特有地增加“超声30次(200v条件下,每次超声10s,中间间隔5s)”的实验操作,使染色质dna被打断,从而使与染色质结合的蛋白释放更为充分,提高核蛋白得率。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!