GAD67及其表观遗传标记作为胎源性双相情感障碍易感的早期标志物的用途的制作方法
本发明属于基因的功能与应用领域,涉及一种谷氨酸脱羧酶67(Glutamate decarboxylase 67,GAD67)基因及其表观遗传作为胎源性双相情感障碍易感的早期预警生物标志物。
背景技术:
抑郁焦虑双相情感障碍是指抑郁和焦虑并存的状态,并不严重到足以诊断为抑郁症,也不能完全诊断为焦虑症,而是抑郁与焦虑中间过程的一种并存状态。人们早已认识到环境因素可导致精神疾病的发生,现在人们从双相情感障碍与下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴、细胞因子、生理节奏、氧化应激等方面开始评估精神问题的诱发原因,并且提出了双相情感障碍强大的基因基础[1]。有研究已证实,孕期外源物(如乙醇、咖啡因、尼古丁、地塞米松)暴露造成的不良宫内环境将会导致胎儿发育毒性,如宫内发育迟缓(IUGR)。IUGR不仅可造成胎儿窘迫、新生儿窒息和围产儿死亡,其危害还将延续到其出生后,表现为出生后体格、智力发育落后,成年后代精神疾病的易感性增加。孕期吸烟和有害药物的使用可使抑郁焦虑双相情感障碍的发生,同时胎儿出生时体重显著低于平均水平[2,3]。还有研究发现,孕期乙醇暴露与这些情感方面的障碍相关度可达90%及以上[4]。由此提示,双相情感障碍等精神疾病存在宫内起源。然而,胎源性成年双相情感障碍的早期预警及诊治技术匮乏,胎源性成年双相情感障碍的发生机制及毒性靶标尚未明确。
HPA轴由下丘脑、脑垂体和肾上腺三部分组成,通过内分泌机制调节体内环境的平衡,参与各种应激反应,面对应激损伤有一定程度的保护作用。糖皮质激素(Glucocorticoid,GC)是机体面对应激时的关键激素,海马通过盐皮质激素受体(mineralocorticoid receptor,MR)和糖皮质激素受体(glucocorticoid receptor,GR)感受血循环GC水平,负反馈调节HPA轴的功能[5]。有研究表明,女性相对男性更易罹患抑郁焦虑等精神疾病,内分泌对应激的反应性不同,情感障碍的发生率也不同[6]。焦虑和抑郁常与机体对应激的反应性有关,HPA轴的功能异常,消极情绪更易出现[7]。高GC和HPA轴功能失调,是情感障碍的关键因素,如果GC水平正常,则慢性刺激诱发双相情感障碍的可能性就很小[8],提示HPA轴的功能异常与双相情感障碍的发生紧密相关。
下丘脑室旁核(paraventricular nucleus of hypothalamus,PVN)是HPA轴活性的直接调控中枢。应激刺激时,PVN通过释放促肾上腺素皮质激素释放激素(corticotrophin-releasing hormone,CRH)和精氨酸加压素(arginine vasopressin,AVP),兴奋垂体分泌促肾上腺皮质激素释放激素(Adrenocorticotropic Hormone,ACTH),促进肾上腺皮质合成和分泌GC。海马是HPA轴的高级负向调控中枢,通过对下丘脑的负调控作用,不仅可抑制HPA轴的应激反应,还可促进应激状态下亢奋的HPA轴恢复到基础水平。谷氨酸(Glu)和γ-氨基丁酸(GABA)分别是哺乳动物脑内重要的兴奋性、抑制性神经递质,两者的动态平衡在维持多脑区(包括海马)功能活动中发挥重要作用。左旋谷氨酸脱羧酶(Glutamatedecarboxylase,GAD)可将Glu脱羧转变为GABA,是GABA合成的限速酶,在调控Glu和GABA的平衡过程中发挥关键作用。GAD在脑内有两种同工酶——GAD67和GAD65,其中GAD67以高饱和的全酶形式存在,与Glu有高的亲和力,参与病理条件下GABA的合成和传递[9]。研究发现,胎海马以表达GAD67为主,是海马GABA能神经元的标记物[10]。以上内容提示,海马中GAD67的表达可影响HPA轴应激功能,进而影响成年后双相情感障碍的发生。
已知GAD67表达调控主要在基因转录水平进行,并受到表观遗传修饰(如DNA甲基化)的调控[11]。研究发现,海马中稳定表达的DNA甲基转移酶1(DNMT1)可使GAD67启动子区部分CpG岛发生甲基化修饰,以维持GAD67的正常表达[12,13];GC可浓度依赖性降低AtT-20细胞的DNMT1表达[14]。截止目前,GAD67启动子区DNA甲基化水平与胎源性双相情感障碍易感的关系尚未见任何相关报道。
有研究显示,血液中白细胞的DNA甲基化水平可作为生物标志物预测乳腺癌风险,帮助女性更好地对该病进行早期预防[15]。以上内容提示,血液中白细胞的DNA甲基化水平可能作为胎源性疾病易感的生物标志物,目前尚未有研究将白细胞GAD67表达及甲基化与双相情感障碍联系在一起。
参考文献
[1]Muneer A.The Neurobiology of Bipolar Disorder:An Integrated Approach.Chonnam medical journal 2016;52:18-37.
[2]Freedman D,Brown AS,Shen L,Schaefer CA.Perinatal oxytocin increases the risk of offspring bipolar disorder and childhood cognitive impairment.Journal of affective disorders 2015;173:65-72.
[3]Chudal R,Brown AS,Gissler M,Suominen A,Sourander A.Is maternal smoking during pregnancy associated with bipolar disorder in offspring?Journal of affective disorders 2015;171:132-6.
[4]Wieczorek L,Fish EW,O'Leary-Moore SK,Parnell SE,Sulik KK.Hypothalamic-pituitary-adrenal axis and behavioral dysfunction following early binge-like prenatal alcohol exposure in mice.Alcohol2015;49:207-17.
[5]Suri D,Vaidya VA.Glucocorticoid regulation of brain-derived neurotrophic factor:relevance to hippocampal structural and functional plasticity.Neuroscience 2013;239:196-213.
[6]Pisu MG,Garau A,Boero G,Biggio F,Pibiri V,Dore R,et al.Sex differences in the outcome of juvenile social isolation on HPA axis function in rats.Neuroscience 2016;320:172-82.
[7]Ikeno T,Deats SP,Soler J,Lonstein JS,Yan L.Decreased daytime illumination leads to anxiety-like behaviors and HPA axis dysregulation in the diurnal grass rat(Arvicanthis niloticus).Behavioural brain research 2016;300:77-84.
[8]Chen J,Wang ZZ,Zuo W,Zhang S,Chu SF,Chen NH.Effects of chronic mild stress on behavioral and neurobiological parameters-Role of glucocorticoid.Hormones and behavior 2016;78:150-9.
[9]Wu H,Jin Y,Buddhala C,Osterhaus G,Cohen E,Jin H,et al.Role of glutamate decarboxylase (GAD)isoform,GAD65,in GABA synthesis and transport into synaptic vesicles-Evidence from GAD65-knockout mice studies.Brain research 2007;1154:80-3.
[10]Bond RW,Wyborski RJ,Gottlieb DI.Developmentally regulated expression of an exon containing a stop codon in the gene for glutamic acid decarboxylase.Proceedings of the National Academy of Sciences of the United States of America 1990;87:8771-5.
[11]Noh JS,Sharma RP,Veldic M,Salvacion AA,Jia X,Chen Y,et al.DNA methyltransferase 1 regulates reelin mRNA expression in mouse primary cortical cultures.Proceedings of the National Academy of Sciences of the United States of America 2005;102:1749-54.
[12]Zhang TY,Hellstrom IC,Bagot RC,Wen X,Diorio J,Meaney MJ.Maternal care and DNA methylation of a glutamic acid decarboxylase 1promoter in rat hippocampus.The Journal of neuroscience:the official journal of the Society for Neuroscience 2010;30:13130-7.
[13]Kundakovic M,Chen Y,Costa E,Grayson DR.DNA methyltransferase inhibitors coordinately induce expression of the human reelin and glutamic acid decarboxylase 67 genes.Molecular pharmacology 2007;71:644-53.
[14]Yang X,Ewald ER,Huo Y,Tamashiro KL,Salvatori R,Sawa A,et al.Glucocorticoid-induced loss of DNA methylation in non-neuronal cells and potential involvement of DNMT1in epigenetic regulation of Fkbp5.Biochemical and biophysical research communications 2012;420:570-5.
[15]Cappetta M,Berdasco M,Hochmann J,Bonilla C,Sans M,Hidalgo PC,et al.Effect of genetic ancestry on leukocyte global DNA methylation in cancer patients.BMC cancer 2015;15:434.
技术实现要素:
为了克服现有技术存在的不足,本发明的目的在于确定胎血/脐带血中白细胞GAD67基因表达及启动子区DNA甲基化水平与胎源性成年双相情感障碍易感间的相互关系,为胎源性成年双相情感障碍易感的早期预警提供研究依据。
本发明的目的通过下述技术方案实现:
本发明第一方面提供胎血/脐带血白细胞GAD67基因表达及启动子区DNA甲基化水平在制备用于早期预警胎源性成年双相情感障碍易感的试剂盒中的应用。
优选的,所述GAD67基因表达在胎血/脐带血白细胞中的水平升高,GAD67基因启动子区DNA甲基化水平在胎血/脐带血白细胞中降低,则有患胎源性成年双相情感障碍的风险。
优选的,所述的试剂盒中包含检测GAD67基因表达的试剂和检测GAD67基因启动子区DNA甲基化水平的试剂。
优选的,所述检测GAD67基因表达的试剂中包含扩增GAD67基因的引物对、检测GAD67基因启动子区DNA甲基化水平的引物对。
优选的,所述扩增GAD67基因的引物对序列如Seq ID No.1和Seq ID No.2所示;所述检测GAD67基因启动子区DNA甲基化水平的引物对如Seq ID No.3和Seq ID No.4所示。
本发明第二方面提供一种早期预警胎源性成年双相情感障碍易感的试剂盒,包含扩增GAD67基因的引物对、检测GAD67基因启动子区DNA甲基化水平的引物对。
优选的,所述扩增GAD67基因的引物对序列如Seq ID No.1和Seq ID No.2所示;所述检测GAD67基因启动子区DNA甲基化水平的引物对如Seq ID No.3和Seq ID No.4所示。
本发明通过研究证实,与对照组相比,孕期外源物(尼古丁、咖啡因、乙醇、地塞米松)暴露组子代大鼠胎海马GAD67表达升高,并持续到出生后;与对照组相比,外源物暴露组胎海马GAD67启动子区DNA甲基化水平显著降低,并持续到出生后;同时发现外源物暴露组胎血白细胞中GAD67表达升高,基因启动子区DNA甲基化水平降低。提示,外源物暴露组大鼠胎血白细胞与胎海马中GAD67表达及DNA甲基化水平具有一致性。
接着,本发明人发现孕期外源物暴露组及对照组在给予慢性不可预测应激后,外源物暴露组相较于对照组,HPA轴呈现明显的高应激敏感性,并且存在双相情感障碍易感性增加的现象。而海马中GAD67在出生后的持续高表达,很可能是介导HPA轴高应激敏感性发生的主要机制,并由此引发了双相情感障碍易感。即外源物暴露组胎血白细胞中GAD67表达升高、甲基化水平降低,出生后双相情感障碍发生风险更高,有较好的一致性。
综上,胎血白细胞中GAD67表达及DNA甲基化水平联合起来可以用于胎源性成年双相情感障碍易感的早期预警。
附图说明
图1:对照组及孕期乙醇暴露(prenatal ethanol exposure,PEE)组子代大鼠出生后给予慢性不可预测性应激,应激前、后的行为学检测结果(*P<0.05,**P<0.01)
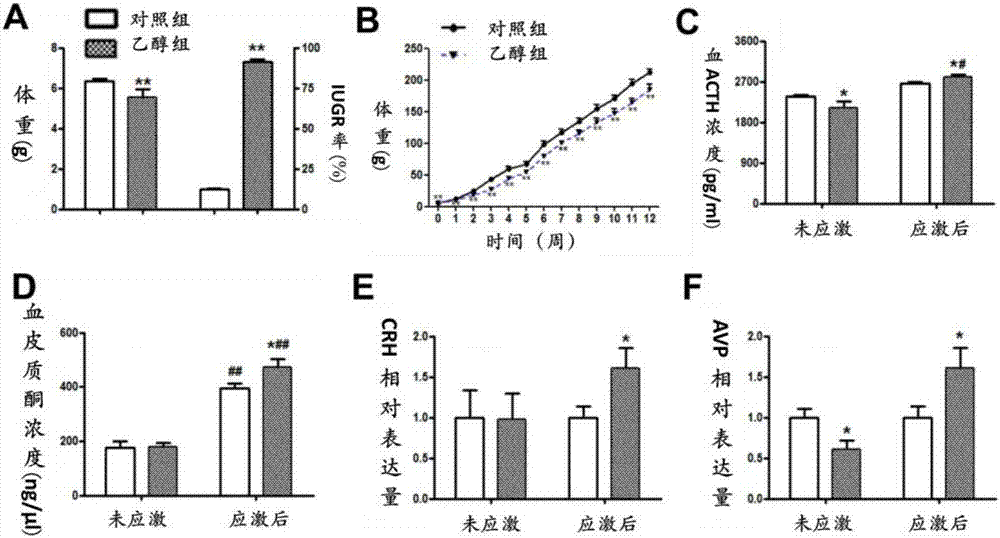
图2:对照组及PEE组子代大鼠IUGR率及给予应激后HPA轴活性变化(*P<0.05,**P<0.01)
图3:对照组及PEE组子代大鼠给予应激后下丘脑潜在兴奋性变化(*P<0.05,**P<0.01)
图4:对照组及PEE组子代大鼠出生后/给予应激后海马兴奋性和抑制性神经元功能变化(*P<0.05,**P<0.01)
图5:对照组及PEE组子代大鼠出生后/给予应激后海马GAD67表达及DNA甲基化变化(*P<0.05,**P<0.01)
图6:对照组及PEE组胎鼠海马/血细胞GAD67表达及DNA甲基化变化(*P<0.05,**P<0.01)
图7:对照组及PEE组胎海马兴奋性和抑制性神经元功能变化(*P<0.05,**P<0.01)
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。【实施例1】
1.动物和处理
雄性Wistar大鼠20只(体重260-300g),雌鼠Wistar大鼠40只(体重200-240g)。由湖北省动物中心提供。自由饮水进食,适应性喂养7天后,按照雄:雌=1:2合笼,次晨阴道涂片,确定受孕大鼠,记为孕0天。将孕鼠随即分为两组:对照组和实验组(乙醇暴露组,PEE),实验组妊娠大鼠在GD9到GD20用4g/kg·d乙醇通过灌胃法处理,而对照组给予相同体积生理盐水。在GD20将每组部分大鼠处死。雌、雄胎鼠被分开和称重,IUGR通过称重诊断。胎血被收集来制备血清及提取白细胞,胎海马和下丘脑在显微镜下被分离。来自2只孕鼠的8个胎鼠样本被合并为一个独立样本贮存在-80℃为了RT-qPCR。每组4个胎鼠大脑被冰冻保存在-80℃,用于病理和免疫荧光分析。另一部分大鼠自然生产,在产后第一天(PD1),同窝仔数平均分配。断奶后,在对照组和PEE组的12窝仔鼠中每窝随机选择2只仔鼠:1只仔鼠于9周龄(postnatal week 9,PW9)时,行旷场试验、糖水试验和强迫游泳测试,记录行为学表现后,给与3周慢性不可预测性刺激,再行旷场试验、糖水试验和强迫游泳测试,记录行为学表现,于次日上午8:00am-10:00am在异氟烷麻醉下处死取血,留取海马及下丘脑组织,每组仔鼠取全脑组织3-5个进行OCT胶包埋,置于-80℃保存;另1只仔鼠12周直接异氟烷麻醉处死,留取海马和下丘脑组织被快速地收集和储存在-80℃,直到后续分析。每组的四个整大脑被冰冻在-80℃为病理和免疫荧光进一步分析。
2.血液白细胞提取
胎血中白细胞的提取使用外周血白细胞分离液试剂盒进行,试剂盒购自北京Solarbio公司。取新鲜抗凝全血或者去纤维蛋白血液,在离心管中加入适量分离液,将血液平铺到分离液液面上方,注意保持两液面界面清晰。室温,水平转子1000g,离心30min。离心后将出现明显的分层,小心的吸取淋巴细胞层及分离液层细胞到15mL洁净的离心管中,加入10mL PBS洗涤细胞,250g,离心10min。弃上清,5mL的PBS或细胞清洗液重悬细胞,250g,离心10min,重复一次。弃上清,细胞重悬备用。
3.血清ACTH和皮质酮的检测
血清ACTH通过放射免疫分析试剂盒测定,血清皮质酮通过ELISA试剂盒测定。血清ACTH和皮质酮增长率的计算如下所述。
4.基因表达检测
从NCBI网站(http://www.ncbi.nlm.nih.gov)下载目的基因和管家基因的mRNA序列,应用primer5.0设计上下游引物,并在NCBI网站上行核苷酸Blast同源比对,确证扩增片段的特异性。将大鼠海马/下丘脑/白细胞用于总RNA提取,之后逆转录为cDNA,并通过RT-PCR进行定量分析相关基因表达情况。各基因引物序列如下表1所示。
表1各基因引物序列
5.海马神经递质GLU和GABA检测
分离海马组织,用预冷的PBS匀浆,在12000rpm离心200min和取上清。海马组织GABA水平用ELISA试剂盒检测(购自上海酶联生物有限公司),在波长450nm采用分光光度法测定颜色变化,样本中GABA的浓度通过比较样本与标准曲线来确定。海马神经递质Glu含量测定参照说明书采用生化试剂盒检测(购自南京建成生物工程研究所)。
6.海马GAD67免疫组化和定量分析
免疫组化过程使用SP方法,根据试剂商提供的步骤完成。石蜡包埋组织被切成5μm厚度,染色用鼠抗-GAD67单克隆抗体。每个海马切片分区统计检测(n=4)。使用光学显微镜成像,通过Image-Pro Plus6.0软件对结果进行定量分析。
7.海马的免疫荧光和定量分析
海马切片在温育后,使用2N HCl进行DNA变性而后使用0.1M硼酸缓冲液中和,之后使用牛血清配置的封闭液封闭120min,而后加入兔抗NEUN一抗或鼠抗GLU、GAD67,4℃过夜,阴性对照组中加入PBS。而后,PBS清洗切片,加入二抗:山羊抗兔IgG或山羊抗鼠IgG。使用荧光显微镜经行拍照,通过Image-Pro Plus 6.0软件对结果进行定量分析。
8.DNA提取和亚硫酸盐测序PCR(BSP)
BSP检测海马GAD67启动子甲基化水平,使用TIANamp基因组DNA试剂盒提取基因组DNA,然后DNA亚硫酸盐被操作使用EZ DNA甲基化试剂盒。亚硫酸盐处理后,DNA被稀释成浓度20ng/L。GAD引物序列被设计如下:
5'-TTAGTATGGGGTTTTTGTGTGTTTG-3',
5'-CTATTTCCC TTTCTC TAAACCCTC-3'
然后,3μL DNA样本在50μL放大反应系统,包括5μL Taq热起动,通过PCR扩增。PCR产物被SanPrep柱纯化,纯化后的PCR产物被连接到pUCm-T载体。感觉态细胞由单步感受态细胞试剂盒制备和改变。质粒被内毒素自由质粒微量制备试剂盒提取和筛选后测序。甲基化状态使用在线BiQ分析仪软件进行分析。
9.统计分析
SPSS 17和Prism 5.0被用于数据分析。计量数据以均值±S.E.M.表示,两组数据间比较采用t检验,多组数据间比较采用方差分析检验,双变量相关采用Pearson单因素相关分析。以P<0.05作为差异有统计学意义。
10.实验结果
10.1对照组及PEE组子代大鼠出生后给予慢性不可预测性应激,应激前、后的行为学检测结果(图1)
糖水偏好实验中,PEE组与对照组相比无显著性差异(P>0.05),刺激前与刺激后相比也无明显改变(P>0.05)(图1A),提示大鼠并未出现典型的抑郁症状。强迫游泳实验与糖水偏好实验类似,可反应抑郁的状态。刺激前PEE组大鼠不动时间明显减少(P<0.05)(图1B),刺激后无明显改变,说明PEE组刺激前处于兴奋状态,刺激后无兴奋状态,相对于对照组更易发生抑郁样行为,也就是对刺激更为敏感。旷场实验刺激前,PW9的仔鼠,PEE组总路程、总速率、直立次数明显增加(P<0.05),相对于对照组,其表现更加活跃和兴奋;刺激后,PW12,对照组和乙醇组总路程、中心路程、总速率和直立次数显著减少(P<0.01),粪便粒数在乙醇组显著增加(P<0.01)(图1C)。刺激前与刺激后差值的比较,可以看到刺激后乙醇组总路程、总速率和直立次数的减少程度和粪便粒数的增加量较为显著(P<0.05,P<0.01)(图1D)。上述结果说明,PEE组大鼠出现一定程度的抑郁,同时伴随有焦虑状态;而在慢性应激后PEE组更易发生焦虑抑郁样行为,且程度更深。
10.2对照组及PEE组子代大鼠IUGR率及给予应激后HPA轴活性变化(图2)
首先,我们观察了PEE对雌性子代大鼠出生体重的影响。结果表明,与对照组相比,PEE组的PD1体重明显降低但IUGR率明显增加(P<0.01,图2A),之后体重持续降低至PW12(P<0.01,图2B),提示PEE可致雌性子代大鼠IUGR发生。进一步,我们通过不可预测性应激,观察对照及PEE组成年雌性子代大鼠HPA轴应激敏感性的高低。结果表明,与对照组相比,PEE组大鼠血ACTH和CORT水平在慢性应激前降低(P<0.05)或不变,但慢性应激后升高(P<0.05)(图2C,2D),且下丘脑CRH和AVP表达在慢性应激前不变或降低(P<0.05),但慢性应激后明显升高(P<0.05)(图2E,2F)。提示,PEE可引起IUGR雌性子代大鼠HPA轴高应激敏感性反应。
10.3对照组及PEE组子代大鼠出生后及给予应激后下丘脑潜在兴奋性变化(图3)
在证实PEE雌性成年子代大鼠存在HPA轴高应激敏感性的同时,我们也观察了HPA轴的直接调控中枢—下丘脑的潜在兴奋性变化。已知VGluT2是主要的Glu转运体,PSD95、α-CaMKII是Glu能神经元标记蛋白,GAD65是GABA主要合成酶,Reelin参与突触传递和可塑性。我们发现,与对照组相比,PEE组下丘脑GAD65、Reelin表达在慢性应激前后均显著降低(P<0.05,图3D,3E),而VGluT2、PSD95、CaMKII表达无明显改变(图3A-C),致使VGluT2/GAD65表达比均明显升高(P<0.05,图3F)。提示,PEE可引起雌性子代大鼠下丘脑潜在兴奋性增加,这是介导HPA轴高应激敏感性的重要原因。
10.4对照组及PEE组子代大鼠出生后/慢性应激后海马兴奋性和抑制性神经元功能变化(图4)
免疫荧光结果分析中,分别以Glu/GAD67代表Glu能/GABA能神经元活性并用红色荧光标记,神经元用绿色荧光标记,红、绿色荧光融合为黄色。其定量分析显示,与对照组相比,无论出生后/慢性应激后PEE组雌性海马Glu能神经元数目(以Glu表示)显著性降低而GABA能神经元数目(以GAD67表示)显著性增加(P<0.05,图4A)。递质检测结果显示,与对照组相比,PEE组海马组织在出生后Glu和GABA浓度均无显著性改变,但PEE组海马组织在慢性应激后Glu浓度显著降低而GABA浓度显著升高(P<0.05,图4B,4C)。提示PEE组海马应激后兴奋性/抑制性神经元比例降低,反映出对下丘脑的抑制功能减弱,可能是引起下丘脑潜在兴奋性增加的原因。
10.5对照组及PEE组子代大鼠给予应激后海马GAD67表达及DNA甲基化改变(图5)
我们在证实PEE组雌性成年大鼠海马组织Glu能和GABA能神经元数目、神经递质浓度变化的基础上,进一步观察了海马组织GR和GAD67的表达变化。结果表明,与对照组相比PEE雌性大鼠海马GR表达在出生后无明显改变但在慢性应激后显著增加(P<0.01,图5A),同时在出生后/慢性应激下海马GAD67的mRNA表达均显著上调(P<0.05,P<0.01,图5B)。GAD67反应产物呈棕褐色,分布于海马神经元胞浆和囊泡中。免疫组化结果表明,与对照组相比,出生后/慢性应激下,PEE组雌性大鼠海马的齿状回区(dentate gyrus,DG)、海马角3区(Cornu ammonis,CA3)的GAD67表达均显著性上调(P<0.05,P<0.01,图5D,5E)。此外,BSP结果显示,与对照组相比,出生后PEE雌性成年大鼠海马GAD67启动子区-1019~-689bp区域总甲基化率即显著降低(P<0.01,图5C)。提示,PEE可引起雌性子代大鼠海马GAD67启动子区发生去甲基化修饰及GAD67高表达(尤以DG、CA3区显著),且慢性应激后GR表达明显增加而GAD67持续高表达。
10.6对照组及PEE组胎鼠海马/血细胞GAD67表达及DNA甲基化变化(图6)
我们观察了胎海马组织中参与调控兴奋与抑制功能平衡状态的GR和GAD67的表达变化。结果见图6,与对照组相比,PEE雌性大鼠海马GR、GAD67的mRNA表达均显著上调(P<0.05,图6A,6B);BSP结果也显示,胎海马GAD67启动子-1019~-689bp区域总甲基化频率较对照组显著降低(P<0.05,图6C)。同时,我们发现与对照组相比,PEE组胎血白细胞中GAD67表达升高,GAD67启动子-1019~-689bp区域总甲基化频率较对照组显著降低,与胎海马中的结果高度一致(P<0.01,图6D,6E)。提示,PEE可引起胎鼠海马GR表达增加,伴有GAD67表达增加,启动子区域DNA甲基化水平降低;同时PEE组胎血中白细胞的GAD67表达也增加,启动子区域DNA甲基化水平降低,与海马中表型一致。
10.7对照组及PEE组胎海马兴奋性和抑制性神经元功能变化(图7)
免疫荧光定量分析显示,与对照组相比,PEE雌性胎海马Glu能神经元数目显著降低(P<0.01,图7A),GABA能神经元数目显著增加(P<0.01,图7B)。提示,PEE可引起雌性胎鼠海马组织Glu能神经元数目降低但GABA能神经元数目增加,这与出生后海马的兴奋/抑制性神经元比例降低保持一致,说明出生后海马兴奋/抑制信号比例失衡所致下丘脑潜在兴奋性增强始于宫内编程。
本实例结果提示,PEE可导致胎海马/胎血白细胞中GAD67表达增加甲基化水平降低,并且PEE子代大鼠出生后在应激后表现出更高的HPA轴应激敏感性及双相情感障碍发生程度。
序列表
<110> 武汉大学
<120> GAD67及其表观遗传标记作为胎源性双相情感障碍易感的早期标志物的用途
<160> 23
<170> SIPOSequenceListing 1.0
<210> 1
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
caagttctgg ctgatgtgga 20
<210> 2
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
gccaccctgt gtagcttttc 20
<210> 3
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
ttagtatggg gtttttgtgt gtttg 25
<210> 4
<211> 24
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
ctatttccct ttctctaaac cctc 24
<210> 5
<211> 25
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 5
ttagtayggg gtttttgtgt gtttg 25
<210> 6
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 6
ggcacagtca aggctgagaa tg 22
<210> 7
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 7
atggtggtga agacgccagt a 21
<210> 8
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 8
agaacaacag tgcgggctca 20
<210> 9
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 9
gctccggttg caagaaattc a 21
<210> 10
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 10
aagagggcca catccgaca 19
<210> 11
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 11
agggcaggta gttctcctcc tg 22
<210> 12
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 12
tccaccgggg tggcaaagtt 20
<210> 13
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 13
tgcgatgtat ccgcccggaa 20
<210> 14
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 14
tatgtaacga agatcatcga agg 23
<210> 15
<211> 23
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 15
gagaatacga ggttgtgatg tct 23
<210> 16
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 16
gcatctgccg cttgttgaa 19
<210> 17
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 17
agtgtagcac agcctccaag 20
<210> 18
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 18
tgcagccttg gggatcggaa 20
<210> 19
<211> 22
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 19
ccccaagcag catccacatg ca 22
<210> 20
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 20
cagcaatggg ctcgtggttt 20
<210> 21
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 21
tgtgggtctt gtccttcttt t 21
<210> 22
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 22
cacccatgac cctgtcagtc 20
<210> 23
<211> 20
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 23
aaagcctccc tctgctaacc 20
- 还没有人留言评论。精彩留言会获得点赞!