一种具有大斯托克斯位移的重组荧光蛋白质及其制备方法与流程
本发明属于生物技术中荧光蛋白质领域,具体的说是涉及一种具有大斯托克斯位移的重组藻蓝蛋白类荧光蛋白质及其制备方法。
背景技术
藻胆蛋白是藻类重要的色素蛋白,具有光能捕获和传递的作用。每分子的藻胆蛋白含有两条结构相似的多肽链α和β,α亚基和β亚基分别含有约160~180个氨基酸残基,二者的比例通常为1:1。亚基中的半胱氨酸残基通过硫醚键与藻胆色素共价结合,藻胆色素的种类及其与脱辅基蛋白的相互作用决定了藻胆蛋白的光谱学性质。根据吸收光谱的不同,可将藻胆蛋白分为4大类:即藻红蛋白pe,λmax=540nm~570nm,藻红蓝蛋白pec,λmax=567nm,藻蓝蛋白pc,λmax=615nm~640nm和别藻蓝蛋白apc,λmax=650nm~655nm。藻胆蛋白具有强烈的荧光特性,已广泛应用于流式细胞分析和免疫荧光检测等领域。
近年来,随着藻胆蛋白生物合成途径的阐明,以及合成生物学技术的发展,在大肠杆菌中人工构建完整藻胆蛋白(含蛋白亚基和色基)的生物合成途径。通过工程菌规模化发酵,实现藻胆蛋白在大肠杆菌中的生物合成与组装,然后通过亲和层析纯化制备重组藻胆蛋白。tooley等人在国际上率先实现了藻蓝蛋白α亚基(2001年)和藻红蓝蛋白α亚基(2002年)在大肠杆菌中藻胆蛋白的组合生物表达,为藻胆蛋白的制备提供了一条全新的途径。在国内,本专利发明人在藻胆蛋白的组合生物表达,藻胆蛋白的分子进化以及新型人工藻胆蛋白荧光探针分子设计和构建方面,展开了系统性的研究工作,已实现多种藻胆蛋白亚基与多聚体在大肠杆菌中的生物合成与组装,通过蛋白分离纯化技术获得的重组藻胆蛋白,具有与天然藻胆蛋白相似的光谱学性质。此外,通过链霉亲和素和藻胆蛋白的融合表达,获得了同时具有生物素结合能力和荧光特性的融合藻胆蛋白荧光探针分子。
通过基因工程方法获得重组藻胆蛋白,具有快速高效、成本较低、不受季节气候影响等突出优势。但是,目前重组合成的藻胆蛋白荧光蛋白质普遍存在的问题是重组藻胆蛋白只结合一个藻胆色素分子,其斯托克斯位移较小,通常为10-25nm。由于激发光波长和荧光检测波长接近,激发光容易对荧光检测造成干扰。而较大的斯托克斯位移,不仅可以增加荧光检测的信噪比,而且可以降低荧光蛋白质分子的自猝灭作用。本发明提供一种具有大斯托克斯位移的藻蓝蛋白类荧光蛋白质的制备方法。
技术实现要素:
本发明目的在于提供一种具有大斯托克斯位移的重组藻蓝蛋白类荧光蛋白质及其制备方法。
为实现上述目的,本发明采用的技术方案为:
一种大肠杆菌中具有大斯托克斯位移的重组藻蓝蛋白类荧光蛋白质的制备方法:利用基因工程方法,将藻胆蛋白裂合酶基因cpcs和cpct,藻蓝蛋白β亚基基因cpcb,血红素氧化酶基因ho1和藻红胆素还原酶基因pebs导入大肠杆菌,构建藻蓝蛋白类荧光蛋白质的合成途径,制备具有大斯托克斯位移的重组荧光蛋白质。
具体为:
1)利用基因工程方法,将藻胆蛋白裂合酶基因cpcs插入第一个表达载体中,将藻蓝蛋白β亚基基因cpcb和藻胆蛋白裂合酶cpct组成多顺反子插入第二个表达载体的一个表达框中,将血红素氧化酶基因ho1和藻红胆素还原酶基因pebs组成多顺反子插入到第二个表达载体的另一个表达框中;
2)将上述两个载体共转化到大肠杆菌中,而后发酵合成获得结合藻尿胆素和藻红胆素的重组藻蓝蛋白类荧光蛋白质,通过亲和层析的方法,纯化得到相应的重组荧光蛋白质。
所述第一个表达载体含有阿拉伯糖诱导启动子;第二个表达载体含有乳糖诱导启动子。
所述第一个表达载体为pbad-hisa,pbad-hisb或pbad-hisc;第二个表达载体为prsfduet-1,pcdfduet-1或pacycduet-1。
一种制备获得大肠杆菌中具有大斯托克斯位移的重组藻蓝蛋白类荧光蛋白质,按所述的方法制备获得共价结合一个藻红胆素分子和一个藻尿胆素分子的斯托克斯位移达68.5nm的重组藻蓝蛋白类荧光蛋白质。
与现有技术相比,本发明具有以下优点:
1.利用两种基于不同诱导物的表达载体,构建藻蓝蛋白类荧光蛋白质的合成途径,通过不同诱导时机分别添加不同诱导物,与传统表达载体构建策略相比,可以调控外源基因的表达顺序,从而实现重组藻蓝蛋白类荧光蛋白质的生物合成;
2.现有重组藻胆蛋白荧光蛋白质只结合一个藻胆色素分子,其斯托克斯位移为10-25nm,本发明制备的重组藻蓝蛋白类荧光蛋白质,同时共价结合藻尿胆素和藻红胆素分子,通过藻尿胆素和藻红胆素分子间的荧光能量共振转移,使斯托克斯位移达到68.5nm,有利于提高荧光检测的信噪比;
3.增加藻胆蛋白斯托克斯位移的常用策略是将其与其他荧光物质偶联,偶联过程复杂,成本较高。本发明中,通过重组大肠杆菌发酵制备,大肠杆菌生长快,生长周期短,易于破碎,由于重组蛋白携带his标签,利用亲和层析可获得高纯度的重组蛋白,纯化过程简单,制备成本较低。
附图说明
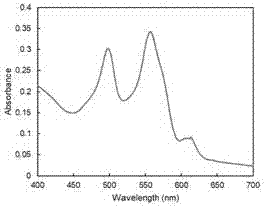
图1是本发明实施例的经过纯化后的藻蓝蛋白类荧光蛋白质的吸收光谱图。
图2是本发明实施例的经过纯化后藻蓝蛋白类荧光蛋白质样品,经过酸性尿素变性后测定的吸收光谱图。
图3是本发明实施例的经过纯化后藻蓝蛋白类荧光蛋白质的荧光发射光谱图。
具体实施方式
下面通过实施例对本发明的具体实施方式进行阐述,所述的实施方式仅仅用来解释和说明本发明,其并不限制本发明的保护范围。任何本领域技术人员根据公知的知识和现有技术能够想到的等价的变体都包含在本发明的保护范围中。
本制备方法是将藻蓝蛋白β亚基(cpcb)基因、藻胆蛋白裂合酶基因(cpcs和cpct)和藻红色素生物合成酶基因(ho1和pebs)分别克隆到两种不同大肠杆菌表达载体。表达载体共转化大肠杆菌后,通过不同诱导时机分别添加乳糖和阿拉伯糖,诱导外源基因的表达,获得同时共价结合藻尿胆素和藻红胆素的藻蓝蛋白类荧光蛋白质。通过两个藻胆色素分子间的荧光能量共振转移,获得具有大斯托克斯位移的重组荧光蛋白质。本发明是利用生物技术方法在大肠杆菌体内生产荧光蛋白质,是一种环境友好、成本低的制备方法。该荧光蛋白质可用于荧光检测等领域。
实施例1
1.基因的克隆
从美国国立生物信息中心(https://www.ncbi.nlm.nih.gov/)数据库获取anabaenasp.pcc7120cpcb,synechococcuselongatusbp-1ho1,prochlorococcusphagep-ssm2pebs(accessno.q58mu6),synechococcuselongatusbp-1cpcs和anabaenasp.pcc7120cpct基因序列。据此分别设计扩增cpcb,ho1,pebs,cpcs和cpct基因的特异引物(表1)。
cpcb基因以anabaenasp.pcc7120基因组dna为模板,利用表1中记载的特异性引物,用过pcr扩增获得;ho1以synechocytissp.pcc6803基因组dna为模板,利用表1中记载的特异性引物,用过pcr扩增获得;cpcs以synechococcuselongatusbp-1基因组dna为模板,利用表1中记载的特异性引物,用过pcr扩增获得;cpct以anabaenasp.pcc7120基因组dna为模板,利用表1中记载的特异性引物,用过pcr扩增获得;所述pcr条件均按常规pcr条件扩增获得。pebs基因由南京金斯瑞生物科技有限公司人工合成。
2.重组质粒的构建
将上述扩增得到的cpcs片段以及载体pbad-hisa用saci和ecori酶切后,回收cpcs片段和载体片段,连接并转化大肠杆菌,得到表达载体pbad-cpcs。
以人工合成的pebs基因为模板,用表1中的引物pebsf和引物pebsr,通过pcr扩增得到pebs产物,在扩增得到pebs产物基因的5’端引入核糖体结合位点(aaggaga),而后将引入核糖体结合位点的扩增得到的pebs产物与上述扩增得到的ho1产物按等摩尔比混合作为模板,以ho1f和pebsr为引物,利用常规重组pcr条件,得到多顺反子ho1-pebs片段。
将上述获得多顺反子ho1-pebs片段以及载体prsfduet-1用ndei和bglii酶切,回收载体片段和ho1-pebs片段,连接并转化大肠杆菌,得到载体prsf-ho1-pebs。
将上述扩增得到的cpcb片段以及上述获得载体prsf-ho1-pebs用bamhi和ecori双酶切后,回收载体片段和cpcb片段,连接并转化大肠杆菌,得到表达载体prsf-ho1-pebs-cpcb。
将上述扩增得到的cpct片段以及上述获得载体prsf-ho1-pebs-cpcb用ecor和saci酶切处理后,回收载体片段和cpct片段,连接并转化大肠杆菌得到表达载体prsf-ho1-pebs-cpcb-cpct。
上述表达载体pbad-hisa需要阿拉伯糖诱导外源基因的表达,含有阿拉伯糖诱导启动子,除了载体pbad-hisa外,还可以使用pbad-hisb,pbad-hisc等含有阿拉伯糖诱导启动子的表达载体,均能实现该目的达到本发明的相应效果。
表达载体prsfduet-1需要乳糖诱导外源基因的表达,含有乳糖诱导启动子,除了可以使用prsfduet-1载体外,还可用pcdfduet-1,pacycduet-1进行替换,实现相应目的达到本发明的相应效果。
3.重组菌株的构建与筛选
将上述构建好的质粒prsf-ho1-pebs-cpcb-cpct和pbad-cpcs通过共转化导入大肠杆菌bl21(de3),转化后的大肠杆菌涂布在含有卡那霉素(100μg/ml)和氨苄青霉素(100μg/ml)的lb平板上,37℃过夜培养后。挑取10个克隆,分别接种于3mllb培养基(培养基中含有卡那霉素和氨苄青霉素)中,37℃培养过夜;而后从中吸取150μl的培养物,转接到含有相应抗生素的5mllb培养基中,加入终浓度为2g/l的乳糖,37℃,200rpm条件下培养至od600为0.6-0.8时,加入终浓度为0.004%的阿拉伯糖诱导,将培养物置于28℃,160rpm继续培养36小时,收集菌落;利用离心机离心收集菌体,利用超声波细胞粉碎机破碎细胞,取上清液,加入loadingbuffer后煮沸处理10分钟,取样进行sds-page电泳。选择重组蛋白表达量高的菌株,保甘油种用于后续发酵与重组蛋白的分离纯化。
4.重组大肠杆菌的发酵与分离纯化
吸取甘油种200μl,接种于含有卡那霉素和壮观霉素的lb培养基中,37℃过夜培养后。吸取6ml过夜培养物,接种于含有卡那霉素和氨苄青霉素的300mllb培养基中。加入终浓度为2g/l的乳糖,37℃,200rpm条件下培养至od600为0.6-0.8时,加入终浓度为0.004%的阿拉伯糖诱导,将培养物置于28℃,150rpm继续培养36小时。菌体中加入结合缓冲液(20mm磷酸钠,500mm氯化钠,50mm咪唑,ph7.4),冰浴中超声破碎30分钟。9000rpm,4℃条件下离心30分钟,收集上清液。上清液经0.22μm滤膜过滤后,上样到镍离子亲和层析柱,用洗杂缓冲液(20mm磷酸钠,500mm氯化钠,90mm咪唑,ph7.4)冲洗层析柱直到紫外吸收值不在发生变化。最后用洗脱缓冲液(20mm磷酸钠,500mm氯化钠,500mm咪唑,ph7.4)洗脱,收集洗脱蛋白溶液。洗脱液用50mm磷酸钾缓冲液经g-25柱脱盐后,得到重组蛋白溶液。
5.重组蛋白的光谱学性质
分别测定重组蛋白的吸收光谱和荧光发射光谱。吸收光谱采用uv1801分光光度计室温条件下测定,测量结果见图1,重组蛋白的最大吸收峰为498.0nm和557nm,表明cpcb上共价结合了两个藻胆色素分子。将重组蛋白样品用8m尿素(ph1.5)处理,再次测定吸收光谱,测量结果如图2,变性后的蛋白样品有两个吸收峰,分别为496.5nm和560nm,这表明重组藻胆蛋白共价结合了藻尿胆素分子和藻红胆素分子。
荧光发射光谱采用f-4500荧光分光光度计,荧光激发波长为490nm,荧光发射光谱见图3,最大荧光发射波长为507.5nm和566.5nm,其中在566.5nm处的荧光值远大于507.5nm处的荧光值,表明藻尿胆素分子捕获的大部分光能通过荧光能量共振转移方式传递到藻红胆素分子,并通过荧光的方式释放能量。重组藻蓝蛋白类荧光蛋白质的斯托克斯位移达到68.5nm。
表1pcr扩增中使用的特异引物
- 还没有人留言评论。精彩留言会获得点赞!
- 用于粘接剂活化的使用光的加热装置及其在预成型装置中的集成的制造方法
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种不依赖激发光强的上转换荧光强度比测温方法与制造工艺
- 一种PEP‑1肽介导绿色荧光蛋白转导水牛胚胎的方法与制造工艺
- 一种利用级联放大效应高敏监测水体PAHs的转荧光蛋白基因斑马鱼的研制方法与制造工艺
- 一株表达绿色荧光蛋白(EGFP)基因的人肠道病毒EV71型重组病毒及其应用的制造方法与工艺
- 一种HPV16型E7蛋白的POCT荧光定量检测试剂盒及其应用的制造方法与工艺
- 一种基于双荧光发色团的力和光双重响应型自组装体及其制备方法与制造工艺
- 基于机器视觉的禽类受精蛋检测方法与制造工艺
- 一种荧光蛋白质染色剂及其制备方法和应用与制造工艺