藉由预靶向的双特异性聚乙二醇结合抗体将聚乙二醇化试剂条件性内吞用于诊断和治疗的制作方法
背景技术:
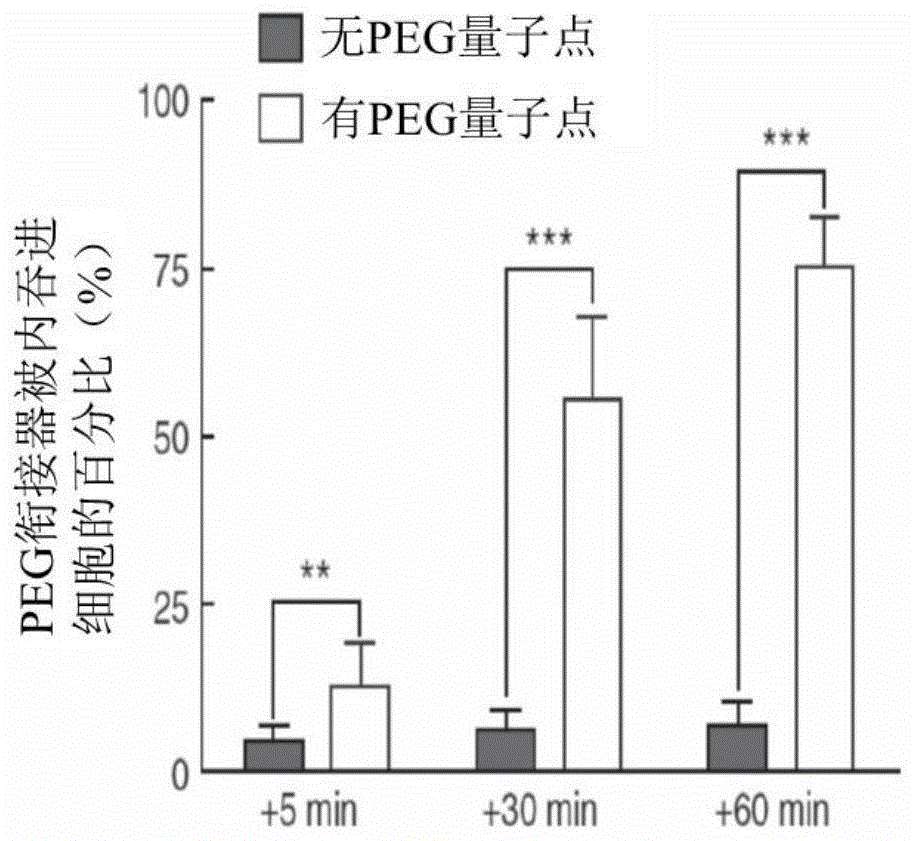
:三阴性乳腺癌(triple-negativebreastcancer,tnbc)占所有乳腺癌的11.2-16.3%。tnbc细胞不表达雌激素受体(estrogenreceptor)、黄体素受体(progesteronereceptor)和人类表皮生长因子受体2(humanepidermalgrowthfactorreceptor2)。tnbc通常具有侵袭性,故与预后不良有关。因为缺乏了明确的治疗标靶,能用的治疗选择有限。直到发现在50%的tnbc肿瘤中会过量表达表皮生长因子受体(epidermalgrowthfactorreceptor,egfr)前,全身性化学治疗一直是tnbc的主要治疗选择。故egfr靶向试剂,例如酪氨酸激酶(tyrosinekinase)抑制剂,正在开发来用于tnbc治疗。然而,egfr靶向的酪氨酸激酶抑制剂,如吉非替尼(gefitinib)和厄洛替尼(erlotinib),在tnbc病患上则显示出最小的有效性。纳米药物(nanomedicines),即纳米化的含药颗粒,对全身性化学治疗来说是具有吸引力的替代方案。纳米药物有利地改变化疗药物的药物动力学特征,减少脱靶毒性(off-targettoxicity)并改善治疗指数。纳米药物会被动地积聚在肿瘤中,这是因为在血管渗漏与淋巴引流受损相结合的肿瘤环境会强化渗透性和停留效应。肺部、乳房和卵巢的肿瘤都展现出高积聚的纳米颗粒。目前正在研究的纳米药物,如聚乙二醇(peg)修饰(即聚乙二醇化)的微脂体阿霉素(liposomaldoxorubicin)是用于tnbc治疗。peg藉由降低网状内皮系统(reticuloendothelialsystem)的辨识和清除来提高半衰期,即聚乙二醇化中的称为“隐形”的特色。纳米药物的有效性可以经由主动靶向的方式来改善,其藉由能与癌细胞上的胞吞受体(endocyticreceptor)结合的靶向配体(targetingligand)来功能化纳米载体表面。这种靶向促进受体介导的胞吞作用,会使细胞摄取纳米药物增加,同时也改善抗肿瘤活性。然而,这都必须克服许多技术障碍才能去生产出新的更有效的纳米载体。例如,靶向配体的附着可以损害聚乙二醇化纳米载体的隐形特色,并阻碍它们被摄入进肿瘤中。故需要开发出对抗癌细胞更有效,并同时具有更少的脱靶副作用的癌症治疗药剂。技术实现要素:为了满足上述的需要,本发明提供一种单体双特异性聚乙二醇衔接器(monomericbispecificpegengager)。它含有一与双硫键稳定单链变异区片段(scfv)融合的抗peg的fab,其中所述双硫键稳定scfv能特异性结合一细胞表面标靶。在缺少聚乙二醇下,所述聚乙二醇衔接器与一细胞上的细胞表面标靶结合后依然呈单体在所述细胞表面上。本发明也揭露一种治疗癌症的方法。所述治疗方法包括(i)鉴别出一罹患癌症的个体;(ii)施予所述个体一单体双特异性聚乙二醇衔接器,其能特异性结合聚乙二醇(peg)和所述个体体内癌细胞上的标靶;以及(iii)接着施予所述个体一聚乙二醇化抗癌剂(pegylatedanti-canceragent)。所述抗癌剂在与已和所述癌细胞结合的所述单体双特异性聚乙二醇衔接器结合后会被内吞进所述癌细胞中,进而杀死所述癌细胞。本发明进一步提供一种用于治疗表皮生长因子(epidermalgrowthfactor)表达(egfr阳性)的癌症的套组,所述套组包含一单体双特异性聚乙二醇衔接器,其能特异性结合聚乙二醇(peg)和一表皮生长因子受体;以及聚乙二醇化抗癌剂。在本发明范围内的另一种套组是用于诊断呈egfr阳性癌症。所述套组包括一单体双特异性聚乙二醇衔接器,其能特异性结合聚乙二醇(peg)和一表皮生长因子受体;以及一聚乙二醇化造影剂(pegylatedimagingagent)。此外,本发明提供一种用于细胞成像的方法,其包括以下步骤:(i)将一细胞与一能和聚乙二醇及所述细胞上的一标靶特异性结合的单体双特异性聚乙二醇衔接器接触;(ii)接着使所述细胞与一聚乙二醇化造影剂接触;以及(iii)检测所述聚乙二醇化造影剂的存在。所述聚乙二醇化造影剂在与已和所述细胞结合的所述单体双特异性聚乙二醇衔接器结合后被内吞进所述细胞中。本发明也揭露一种诊断细胞介导病症(cell-mediateddisorder)的方法。所述方法的实现是藉由施予一个体一单体双特异性聚乙二醇衔接器,其能特异性结合聚乙二醇和介导病症的细胞上的一靶标,接着施予所述个体一聚乙二醇化诊断剂(pegylateddiagnosticagent),并检测所述聚乙二醇化诊断剂的位置。如果所述聚乙二醇化诊断剂在与已和所述细胞结合的单体双特异性聚乙二醇衔接器结合后位于所述细胞中的话,则所述个体被诊断为罹患所述细胞介导病症,例如癌症。以下的叙述和图式中阐述本发明的一个或多个实施例的细节。根据说明、图式和所附的申请专利范围,本发明的其它特征、目的和优点将变得显而易见。本文所引用的所有参考文献均透过引用方式将其整体内容并入本文中。如上所述,本发明揭露一单体双特异性聚乙二醇衔接器(peg衔接器),其包括一与双硫键稳定单链变异区片段(disulfidestabilizedscfv)融合的抗聚乙二醇(peg)的fab。所述抗peg的fab与peg特异性结合。在一特定实施例中,所述fab包括一含有seqidno:3的序列的重链cdr1;一含有seqidno:4的序列的重链cdr2;一含有seqidno:5的序列的重链cdr3;一含有seqidno:6的序列的轻链cdr1;一含有seqidno:7的序列的轻链cdr2;以及一含有seqidno:8的序列的轻链cdr3。上述双硫键稳定scfv特异性结合至一细胞表面抗原。所述细胞表面抗原表达在一目标细胞的表面上,例如癌细胞。所述细胞表面抗原可以是一蛋白质、一碳水化合物或一脂质。例如,所述细胞表面抗原可以是一生长因子受体(growthfactorreceptor)。所述生长因子受体可以是,但不限于表皮生长因子受体(epidermalgrowthfactorreceptor,egfr)、一类胰岛素生长因子受体(insulin-likegrowthfactorreceptor)、人类表皮生长因子受体2(humanepidermalgrowthfactorreceptor2,her2)、her3、her4和c-met。在一特定实施例中,所述细胞表面蛋白是egfr。所述细胞表面抗原的其他实施例包括cd19、cd20、cd5、cd21、cd25、cd37、cd30、cd33、cd45、campath-1、a33、g250、叶酸盐结合蛋白(folate-bindingprotein)、psma、gd2、gd3、gm2、lewisy、ca-125、ca19-9、il2受体、黏蛋白(tenascin)、金属蛋白酶(metalloproteinases)和fap。在缺少聚乙二醇下,所述聚乙二醇衔接器在与一细胞上的细胞表面抗原结合后依然呈单体。例如,如果所述聚乙二醇衔接器包括一能与egfr特异性结合的双硫键稳定scfv,而所述聚乙二醇衔接器结合egfr时并不会活化所述受体且不启动内吞作用,从而依然结合在所述细胞表面上。在这一方面上,所述聚乙二醇衔接器可以包括一用于标记细胞表面的荧光标记,例如alexafluor647。所述单体双特异性聚乙二醇衔接器可用在治疗癌症的方法上。所述癌症可以是以egfr过量表达为特征的任何癌症,包括但不限于乳腺癌、肺癌、卵巢癌、头颈癌,结肠癌、肾癌、前列腺癌、肝癌和子宫颈癌。在一特定实施例中,所述癌症为三阴性乳腺癌(tnbc)。所述癌症治疗方法是通过以下顺序向癌症病患施予至少两种试剂来完成的。所施予的第一种试剂为上述的单体双特异性聚乙二醇衔接器,其能特异性结合peg和所述病患体内癌细胞上的一标靶。所述标靶可以是一生长因子受体,其选自于egfr、一类胰岛素生长因子受体、her2、her3、her4或c-met。在一示例性方法中,所述标靶是egfr。所述单体双特异性聚乙二醇衔接器在缺少peg下,与癌细胞上的标靶结合后依然为单体并停留结合在所述细胞表面上,直到透过与peg结合后启动内吞作用。所施予的第二种试剂是一聚乙二醇化抗癌剂,例如聚乙二醇化的微脂体阿霉素(liposomaldoxorubicin)或聚乙二醇化的微脂体温诺平(liposomalvinorelbine)。所述聚乙二醇化抗癌剂在与已和所述癌细胞结合的所述单体双特异性聚乙二醇衔接器结合后被内吞进所述癌细胞中,进而杀死所述癌细胞。一种用来治疗三阴性乳腺癌(tnbc)的示例性方法是藉由先施予一能与egfr特异性结合的单体聚乙二醇衔接器,接着再施予聚乙二醇化的微脂体阿霉素(liposomaldoxorubicin)来实现。某些癌症肿瘤的特征在于肿瘤内癌细胞的异质性。上述的癌症治疗方法,其藉由施予两种不同的聚乙二醇衔接器,可以适用于治疗这类的肿瘤,而每种聚乙二醇衔接器能特异性结合到癌细胞上的不同标靶。两种聚乙二醇衔接器都能与peg结合,但又可以结合肿瘤中不同的癌细胞亚群。上述提及的聚乙二醇化抗癌剂也是在施予两种聚乙二醇衔接器后再施予。在所述方法的一具体实施例中,一能与egfr特异性结合的聚乙二醇衔接器和一能与一类胰岛素生长因子受体、her2、her3、her4或c-met特异性结合的第二聚乙二醇衔接器一起施予,接着再施予聚乙二醇化的微脂体阿霉素(liposomaldoxorubicin)或聚乙二醇化的微脂体温诺平(liposomalvinorelbine)。如上所述,本发明提供一种藉由上述方法以用于治疗呈egfr阳性癌症的套组。一种用于治疗三阴性乳腺癌的示例性套组,其包含有一单体双特异性聚乙二醇衔接器,其能特异性结合peg以及一生长因子受体,其中所述生长因子受体是选自于egfr、一类胰岛素生长因子受体、her2、her3、her4或c-met。所述套组也包含一聚乙二醇化抗癌剂。一种特定的套组包含(i)一单体双特异性聚乙二醇衔接器,其能特异性结合peg和egfr;以及(ii)聚乙二醇化的微脂体阿霉素(liposomaldoxorubicin)。所述单体双特异性聚乙二醇衔接器可以包含一fab片段,所述fab片段包括一含有seqidno:3的序列的重链cdr1;一含有seqidno:4的序列的重链cdr2;一含有seqidno:5的序列的重链cdr3;一含有seqidno:6的序列的轻链cdr1;一含有seqidno:7的序列的轻链cdr2;以及一含有seqidno:8的序列的轻链cdr3。本发明提供另一种套组,其用于诊断呈egfr阳性癌症。所述套组包括一单体双特异性聚乙二醇衔接器,其能特异性结合peg和一egf受体;以及一聚乙二醇化造影剂,例如一荧光或放射性标记的聚乙二醇化纳米颗粒。所述单体双特异性聚乙二醇衔接器可以是前面段落中描述的那些聚乙二醇衔接器。上述也提到一种细胞成像方法。所述方法可以使用上述的任何单体双特异性聚乙二醇衔接器来实现。藉由检测聚乙二醇化造影剂的存在来完成成像,其中所述聚乙二醇化造影剂可以是,但不限于荧光或放射性标记的聚乙二醇化纳米颗粒。上述讨论另一种诊断细胞介导病症(cell-mediateddisorder)的方法。所述方法的实现是藉由向一个体施予一单体双特异性聚乙二醇衔接器,其能特异性结合聚乙二醇和介导病症的细胞上的一标靶。如同前一段落中所述的方法一样,所述方法可以使用上文中所述的一种或多种单体双特异性聚乙二醇衔接器。所述聚乙二醇化诊断剂可以是如荧光或放射性标记的聚乙二醇化纳米颗粒。无需进一步详述,相信本领域技术人员可以基于以上描述最大限度地利用本发明。下面的特定实施例应被解释为仅是说明性质的,而不以任何方式限制本次公开的其他部分。附图说明图1a为一柱状图,其显示从不同时间下的个体细胞(数量为15)的共轭焦图像去定量出内吞进细胞中的peg衔接器egfr(pegengageregfr)的百分比,其中该细胞以有(空心柱)或无(实心柱)peg量子点655(peg-quantumdot655,peg-qdot655)进行处理。显示的代表性共焦图像是来自于两个独立的实验。数据以平均±标准偏差呈现。**p≦0.001,***p≦0.0001(双因子变异数分析(two-wayanalysisofvariance)),n.s.代表不显著。图1b为一柱状图,其显示从在指定时间下个体细胞(数量为15)的共轭焦图像去定量出lysotrackerreddnd-99所染色的溶酶体(lysosome)与peg衔接器egfr(pegengageregfr)共位(co-localized)的百分比。显著性的数值如上图1a的图所示。图2a为以如该图式所示处理的bt-20细胞的阿霉素(doxorubicin)浓度与以相对控制组的百分比的细胞增殖相对的图。数据是以三个独立的实验为代表。图2b为用于如图2a所示处理的mda-mb-468细胞的阿霉素(doxorubicin)浓度与用相对控制组的百分比呈现的细胞增殖相对的图。图2c为用于如图2a所示处理的mda-mb-231细胞的阿霉素(doxorubicin)浓度与用相对控制组的百分比呈现的细胞增殖相对的图。图2d为一柱状图,其显示peg衔接器egfr(pegengageregfr)加德适舒(doxisome)以及peg衔接器cd19(pegengagercd19)加德适舒用于抑制bt-20、mda-mb-468和mda-mb-231细胞增殖的半最大有效浓度(ec50)。数据以平均±标准偏差呈现。平均ec50值的显著差异如下所示:**p≦0.001,***p≦0.0001(双因子变异量分析)。图3a为患有mda-mb-468肿瘤(数量为8)的scid小鼠的平均肿瘤大小±标准偏差与治疗后天数相对的图。在箭头所指的天数中所施予的治疗方式显示于该图下方。图3b为在标记的天数下以如图3a所示处理的mda-mb-468小鼠(数量为8)的平均体重±标准偏差与时间相对的图。ld为微脂体阿霉素(liposomaldoxorubicin),即德适舒(doxisome)。图3c显示在如图3a所示的治疗(每周一次,持续4周)43天后,6只scid小鼠的群组中肿瘤大小的平均值±标准偏差。藉由单因子变异数分析(anova)和dunnett多重比较进行治疗组与控制组间肿瘤体积差异的统计分析。*p≦0.05,**p≦0.005。具体实施方式实施例1:双特异性聚乙二醇衔接器的表达和纯化藉由将衍生自抗peg抗体6.3(kaoetal.2014,biomaterials35:9930-9940)的人源化抗体的fab片段与对egfr或cd19具有特异性的单链抗体融合以产生单价抗聚乙二醇(peg)双特异性抗体。藉由从6.3融合瘤(参见kaoetal)所制备的cdna克隆出6.3抗体的小鼠vl和vh结构域以产生以抗peg的fab为主的双特异性peg衔接器抗体。藉由先使用igblast程序(可在全球信息网(worldwideweb)ncbi.nlm.nih.gov/igblast/上找到)将小鼠6.3抗体的vh和vl序列与人类免疫球蛋白种系序列进行比对以将抗peg抗体人源化。根据架构同源性(frameworkhomology)的程度选出人类种系vhighv7-4-1*02和vligkv4-1*01的外显子(exons)。然后使用组合式pcr(assemblypcr)将小鼠6.3vh和vl结构域上的互补决定区(complementarity-determiningregions)移植到人类vhighv7-4-1*02和vligkv4-1*01基因上。从提取出的人类周围血液单核球细胞(humanperipheralbloodmononuclearcell)rna所合成的cdna来克隆出人类免疫球蛋白g1(igg1)的ck和ch1的稳定区域(constantdomains)。藉由来自人源化的6.3vl(seqidno:2)和人源化6.3vh(seqidno:1)和人源化ck及ch1片段的重迭聚合酶连锁反应(overlappolymerasechainreaction)来组合人源化6.3vl-ck和6.3vh-ch1结构域。为了构建pas3w.ppuro-peg衔接器的质粒(plasmid),藉由复合内部核糖体进入位点(compositeinternalribosomeentrysite)双顺反子表达多肽连接子(bicistronicexpressionpeptidelinker)来连接人源化6.3vl-ck和6.3vh-ch1,并将其插入进质粒pas3w.ppuro中,其中该质粒是从中国台湾中央研究院的分子生物研究所/基因体研究中心的核糖核酸干扰核心设施所获得。通过组合式pcr(assemblypcr)分别依据来自美国专利公告号:7968687和7598350的专利中hbu12和耐昔妥珠单抗(necitumumab)的vh和vl序列去合成出该hbu12(抗人类cd19)和耐昔妥珠单抗(imc-11f8,抗人类egfr)的单链双硫键稳定fv(disulfide-stabilizedfv,dsfv)。用mfeii和mlui酶切dsfvdna片段,然后将其亚克隆(subclone)到pas3w.ppuro-peg衔接器质粒内去连接至该6.3fab的c端的ggggs(seqidno:9)多肽连接子的下游和聚组氨酸标签(poly-histidinetag)的上游以产生pas3w.ppuro-peg衔接器cd19(pas3w.ppuro-pegengagercd19)和pas3w.ppuro-peg衔接器egfr(pas3w.ppuro-pegengageregfr)。藉由慢病毒转染(lentiviraltransduction)方式以产生稳定分泌peg衔接器cd19和peg衔接器egfr的293ft/peg衔接器cd19和293ft/peg衔接器egfr细胞。藉由使用45μltransit-lt1转染试剂(mirusbio)将pas3w.ppuro-pas3w.ppuro-peg衔接器cd19和pas3w.ppuro-peg衔接器egfr(7.5μg)与包装质粒(packagingplasmid)pcmvdr8.91(6.75μg)和vsv-g包膜质粒(envelopeplasmid)pmd.g(0.75μg)共同转染到在10cm培养皿内293ft细胞中并使其生长至90%汇合度(confluency)来包装重组慢病毒颗粒(recombinantlentiviralparticles)。48小时后,通过超高速离心(beckmansw41tiultracentrifugeswingingbucketrotor,50,000xg,1.5小时,4℃)收集和浓缩慢病毒颗粒。慢病毒颗粒悬浮于含有5μg/ml聚凝胺(polybrene)的培养基中,并通过0.45μm过滤器过滤。在病毒感染前1天将293ft细胞接种于6孔板(每孔1×105个细胞)中。将含慢病毒的培养基加入到细胞中,然后离心1.5小时(500×g,32℃)。用嘌呤霉素(puromycin)(5μg/ml)去挑选细胞以产生稳定的细胞株。在cellineadhere1000生物反应器(integrabiosciencesag)中培养处于15mldmem培养基内的5×107个293ft/peg衔接器cd19或293ft/peg衔接器egfr细胞,并且每7至10天收集该培养基。在co2+-talon管柱(gehealthcarelifesciences)上纯化聚组氨酸标记的单价双特异性抗体。藉由二金鸡钠酸蛋白质测定法(bicinchoninicacidproteinassay)(thermofisherscientific)测定蛋白质浓度。实施例2:双特异性peg衔接器的特征透过基质辅助雷射脱附/离子化飞行时间(matrix-assistedlaserdesorption/ionizationtime-of-fligh,maldi-tof)质谱仪的测定,peg衔接器cd19和peg衔接器egfr分别具有78kda和79kda的分子量。尺寸排阻高效能液相层析分析(size-exclusionhigh-performanceliquidchromatographyanalysis)则显示出一对应于具有最小聚集的单体的主峰。藉由示差扫描量热法(differentialscanningcalorimetry)测定peg衔接器cd19和peg衔接器egfr的解链温度。peg衔接器cd19和peg衔接器egfr分别具有75℃和75.8℃的解链温度,两者均高于fab片段的标准解链温度,即61.9℃至69.4℃,这表示两个衔接器都具有良好的热稳定性。peg衔接器对peg和其特异性配体的平衡结合,其透过微量热泳动仪(microscalethermophoresis)分析如下。样品制备是使用hepes缓冲盐水/chaps缓冲液(10mmhepes,150mm氯化钠,3mmedta,0.05%chaps,ph为7.4)。为确定peg衔接器的peg的结合亲和力,5nm的cy5共轭甲氧基peg5k(cy5-conjugatedmethoxypeg5k)(nanocs)与呈梯度浓度(0.24-500nm)的peg衔接器cd19或peg衔接器egfr抗体以1:1的体积比率混合。为了分析peg衔接器的肿瘤抗原的结合亲和力,2nm的alexafluor647共轭peg衔接器cd19或peg衔接器egfr与呈梯度浓度(0.027-180nm)的重组cd19或egfr蛋白(sinobiologicalinc.)以1:2的体积比率混合。将样本于室温下孵育5分钟,并装入标准毛细管中然后在5%led和40%雷射功率下加热30秒,冷却10秒,并在nanotempermonolithnt.115仪器(nanotempertechnologiesgmbh)上测量。所有实验都进行三重复。结果显示在下表1中。表1.双特异性peg衔接器的解离常数衔接器peg的kd特异性配体的kdpeg衔接器egfr7.55±1.13nm0.96±0.23nmpeg衔接器cd197.6±1.05nm3.6±0.35nm实施例3:利用peg衔接器在peg化纳米颗粒的特异性递送上用egfr表达程度不同的癌细胞株进行测试以确定peg衔接器egfr是否可以将peg化纳米颗粒特异性递送进有egfr表达(egfr+)的癌细胞中。具体而言,通过实时共聚焦显微镜(real-timeconfocalmicroscopy)检查在egfr+和egfr不表达(egfr-)的乳腺癌细胞内藉由peg衔接器egfr所介导的癌细胞特异性摄取peg化纳米颗粒的情况,其如下所述。在细胞培养pocmini室(cellcultivationpocminichamber)(灌注,开启和关闭;pecongmbh)内的盖玻片(30mm)用含10μg/ml聚-l-赖氨酸(poly-l-lysine)(sigma-aldrich)的磷酸盐缓冲生理盐水(pbs)在室温下涂覆30分钟。将盖玻片用pbs洗涤两次,然后将5×104个mda-mb-468(egfr+)、a431(egfr+)和mcf7(egfr-)癌细胞各自接种在分开的盖玻片上。在含有1μg/mlhoechst33342(thermofisherscientific)的培养基中,通过10μg/ml的peg衔接器cd19或peg衔接器egfr抗体于37℃下染色细胞30分钟来检查癌细胞特异性摄取聚乙二醇化纳米颗粒的情况。用pbs洗涤细胞两次以去除未结合的peg衔接器,并在培养基(rpmi-1640,10%fbs)中以8nm聚乙二醇化qtracker655非靶向量子点(pegylatedqtracker655non-targetedquantumdots,peg-qdot655;thermofisherscientific)进行孵育。透过在axiovert200m共轭焦显微镜(carlziessinc.)(对hoechst33342用350nm和461nm的激发以及发射波长,对peg-qdot655用350nm和675nm的激发以及发射波长,5%co2)的实时影像来观察细胞。mda-mb-468三阴性乳腺癌(tnbc)和a431非tnbc细胞均表达egfr,但不表达cd19。mcf7非tnbc细胞既不表达egfr也不表达cd19。在mda-mb-468和a431细胞中peg衔接器egfr介导的peg-qdot655快速累积,但在mcf7细胞则没有出现。相较的下,以控制组的peg衔接器cd19处理的mda-mb-468、a431和mcf7细胞中则没有观察到peg-qdot655的摄取。显然,peg衔接器egfr可以递送peg化纳米颗粒进到有表达egfr的乳腺癌细胞中。实施例4:peg化纳米颗粒的条件性内吞进细胞透过共轭焦显微镜来检查peg衔接器egfr启动peg化纳米颗粒依赖性受体介导的内吞进细胞的能力。将在偶合缓冲液(couplingbuffer)(0.1m碳酸氢钠,ph为8.0)中的5毫克纯化的peg衔接器cd19或peg衔接器egfr抗体与在二甲基亚砜(dimethylsulfoxide)中超过10倍摩尔的alexafluor647琥珀酰亚胺酯(succinimidylester)(thermofisherscientific)于室温下混合2小时以产生alexafluor647共轭peg衔接器cd19和peg衔接器egfr。加入1/10体积的1m甘氨酸(glycine)(ph为8.0)来终止反应。利用pbs透析经标记的peg衔接器(分子量截留12,000-14,000道尔顿(daltons))以去除游离的alexafluor647,无菌过滤并于-80℃下储存。通过在含有1μg/ml的hoechst33342和100nm的lysotrackerreddnd-99(一种溶酶体(lysosome)染色剂)的培养基中于37℃下共同孵育mda-mb-468或bt-20细胞与10μg/ml的alexafluor647共轭peg衔接器egfr(激发/发射,650nm/675nm)30分钟以测定peg化纳米颗粒的条件性内吞进细胞。洗涤后,将细胞于37℃下孵育1小时或9小时,使用axiovert200m共轭焦显微镜进行成像,然后在添加8nm的peg-qdot655溶液后进行实时细胞成像。藉由使用zen2011软件(蓝色版;carlzeiss,jena,德国)根据亮视野细胞影像将细胞内区域的荧光除以整个细胞荧光以计算内吞的peg衔接器与peg-qdot的百分比。结果如图1a和2b所示。数据显示peg衔接器egfr于37℃下停留在mda-mb-468细胞的原生质膜上1小时,几乎没有内吞进细胞中。参见图1a。即使在9小时后,peg衔接器egfr在mda-mb-468细胞上也仅表现出有限的胞吞作用,即内吞进细胞中。向该细胞加入peg-qdot655后,在细胞膜上的peg衔接器egfr与peg-qdot655则一起迅速地被内吞进该细胞中。peg衔接器egfr与peg-qdot655或溶酶体的共位证实peg衔接器egfr可以有条件性地刺激peg化纳米颗粒的胞吞作用,然后定位于溶酶体中。参见图1b。实施例5:peg衔接器引导的微脂体药物的体外功效测试peg衔接器egfr对于在以下不同类型的表达野生型(wild-type)egfr或突变的egfr的癌细胞中增强一载药纳米载体(例如微脂体(liposome))的体外抗增殖活性的能力。mda-mb-231、mda-mb-468和bt-20是表达野生型egfr的tnbc癌细胞株;skbr3是表达野生型egfr的非tnbc乳腺癌细胞株;且pc9是表达egfr和在酪氨酸激酶结构域(tyrosinekinasedomain)中有δe746-a750缺失的非小细胞肺癌(non-smallcelllungcancer)细胞株。peg化微脂体载药纳米载体(pegylatedliposomaldrug-loadednanocarriers)照以下方式生产。将二硬脂酰磷脂酰胆碱(distearoylphosphatidylcholine)、1,2-二硬脂酰基-sn-甘油基-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-2000(1,2-distearoylsn-glycero-3-phosphoethanolamine-n-[methoxy(polyethyleneglycol)-2000)(dspe-peg2000)和胆固醇(avantipolarlipids,inc.)以65:5:30摩尔比分别溶解在氯仿(chloroform)中。通过旋转蒸发(buchi,rotavaporrii)在65℃下形成干燥的脂质膜(lipidfilm),并在65℃下于tris缓冲盐水(tbs;50mmtris-hcl,150mmnacl,ph7.4)中再水合至最终脂质浓度20mg/ml。将这种微脂体悬浮液在液态氮和80℃的热水浴中进行10次冷冻/解冻循环,接着使用微型挤出机(avantipolarlipids,inc.)在75℃下经由400、200和100nm聚碳酸酯膜(polycarbonatemembrane)挤出21次。在使用前,用巴特列特(bartlett)测定法测量最终脂质浓度,并用tbs调整至13.9μmol/ml。本方法也获得类似装载阿霉素(doxorubicin)(即德适舒(doxisomes))或装载温诺平(vinorelbine)的peg化微脂体。游离药物作为阳性控制组。将上述细胞和pc3、skbr3、sk-mes-1、hut125,caski、ht29、h2170、ls174t、hepg2和sw480细胞以每孔10,000个细胞接种在96孔盘中,并培养过夜。将系列稀释的游离的阿霉素或温诺平直接加入细胞中作为阳性控制组。在37℃下加入(i)梯度浓度的peg化微脂体阿霉素(doxisome,13.9μmol/ml脂质浓度,中国台湾微脂体公司,中国台湾台北);(ii)peg-微脂体温诺平(由中国台湾中央研究院细胞与个体生物研究所的研究员吴汉忠博士所提供);或(iii)空的微脂体于三孔重复并在37℃下孵育4小时,30分钟后再将15μg/ml的peg衔接器cd19或peg衔接器egfr加入到细胞中。随后将细胞洗涤一次,并在新鲜培养基中再孵育72小时,然后用3h-胸腺核苷(3h-thymidine)(每孔1μci)脉冲18小时。计算3h-胸腺核苷结合细胞dna的抑制百分比。结果如图2a至2d所示。结果显示,与单独的载药微脂体、载药微脂体加peg衔接器cd19或有peg衔接器egfr的空的微脂体相比,peg衔接器egfr显著增强德适舒(doxisome)对抗egfr+癌细胞的抗增殖活性。参见图2a至2c。peg-微脂体温诺平获得类似的结果。在peg衔接器egfr靶向doxisome在bt-20、mda-mb-468和mdamb-231细胞中的半最大有效浓度(ec50)分别低于控制组中peg衔接器cd19靶向doxisome的ec50101倍、74倍和107倍。参见图2d。peg衔接器egfr和peg衔接器cd19均不改变hepg2细胞(egfr-)对doxisome的敏感性。相对于野生型bt-20细胞,当与单独的载药微脂体或载药微脂体加peg衔接器cd19相比,peg衔接器egfr并没有增强doxisome在bt-20/shegfr癌细胞(以短发夹rna(shorthairpinrna)去敲低egfr表达所处理的bt-20细胞)中的抗增殖活性。总的,peg衔接器egfr显著增加peg化药物(即德适舒(doxisome)和peg-微脂体温诺平)在对抗egfr+癌细胞的抗癌活性。实施例6:预先存在的抗peg抗体不与peg衔接器egfr进行有效竞争健康的供给者(donor)中预先存在的抗peg抗体可能藉由阻断衔接器与纳米药物上peg的结合而对peg化药物的peg衔接器靶向造成负面影响。使用抗peg酶联免疫吸附分析法(enzyme-linkedimmunosorbentassay,elisa)测量健康人体的血浆样本中的抗peg抗体浓度。在386个抗peg阳性样本中,预先存在的抗pegigg浓度范围为0.3μg/ml至237.5μg/ml,平均浓度为5.75±16.0μg/ml。测试含有51.4mg/ml抗pegigg的人类血清样本以确定其是否会改变微脂体抗癌药物的体外抗增殖活性。结果显示,在20%的抗pegigg阳性的人类血清或20%的控制组的人类血清存在下,经测试的peg衔接器egfr加德适舒(doxisome)对于抑制mda-mb-468细胞的增殖具有相似的ec50。这些结果显示病患中预先存在的抗peg抗体不会与peg衔接器egfr进行有效竞争。这并不受理论所束缚,可能是因为peg衔接器和具有丰富的peg链的doxisome具有较高的抗peg亲和力。实施例7:peg衔接器的药物动力学和肿瘤靶向peg衔接器对肿瘤预先靶向可能允许peg化纳米载体随后聚集并被胞吞进癌细胞中。检查peg衔接器的体内药物动力学以决定在施予peg衔接器后再施予peg化纳米载体的合理时间点。于nsg小鼠上静脉注射150μg的peg衔接器cd19或peg衔接器egfr,并定期从该小鼠的尾静脉收集血液样品。透过12,000×g离心5分钟来制备出血浆。藉由以下定量三明治elisa以确定血浆中peg衔接器的量。maxisorp96孔微孔板每孔以50μl的含2mg/ml的抗6his标签抗体(genetex)的碳酸氢盐缓冲液(bicarbonatebuffer)(ph8.0)进行涂覆,并于37℃下孵育4小时,然后于4℃下孵育过夜。以200μl/孔含5%脱脂牛奶的pbs于室温封闭该孔板2小时,然后用pbs洗涤三次。在室温下将梯度浓度的peg衔接器cd19、peg衔接器egfr或稀释缓冲液(含2%脱脂牛奶的pbs)中的血浆样本加入孔洞中2小时。用pbs洗涤4次后,以每孔50μl的5μg/ml辣根过氧化酶(horseradishperoxidase)共轭抗人类iggfab抗体(jacksonimmunoresearchlaboratories)对孔板进行染色。将孔板用pbs洗涤6次后,加入100μl的abts溶液(0.4mg/ml2,2-联氨-双(3-乙基苯并噻唑啉-6-磺酸)(2,2-azino-di(3-ethylbenzthiazoline-6-sulfonicacid)),0.003%h2o2,100mm磷酸柠檬酸盐(phosphatecitrate),ph4.0)并在室温下孵育30分钟。在酶标仪(microplatereader)上测定孔洞在405nm处的吸光度。透过使用prism5软件(graphpadsoftware)将数据与两相指数衰减模型(two-phaseexponentialdecaymodel)进行配适来估算peg衔接器的起始和最终半衰期。peg衔接器egfr和peg衔接器cd19的半衰期分别约为2.1小时和2.2小时。在注射后5小时,两种peg衔接器几乎90%都会从循环中清除。如下所述,在用peg衔接器处理后,检查患有已建立的egfr高表达的肿瘤(mda-mb-468和a431)或egfr低表达的肿瘤(hepg2)的小鼠体内的peg化化合物的摄取和滞留。透过将4arm-peg10k-nh2(laysanbio)溶解于2mg/ml二甲基亚砜(dimethylsulfoxide)中,并将其与在二甲基亚砜中超过6倍摩尔的nir-797异硫氰酸酯(isothiocyanate)(santacruzbiotechnology)于室温下混合2小时以产生4arm-peg10k-nir-797探针来制备出一聚乙二醇化近红外线探针(pegylatednear-infraredprobe)。用5倍体积的ddh2o稀释该探针,并且利用ddh2o对该探针进行透析(截留分子量~12,000-14,000道尔顿(daltons))以除去游离的nir-797异硫氰酸酯。将探针进行无菌过滤并在80℃下保存。患有皮下100mm3的mda-mb-468、a431或hepg2异种移植肿瘤的balb/c裸鼠或nodscid小鼠各自静脉注射6mg/kg的peg衔接器cd19或peg衔接器egfr。在peg衔接器注射5小时后,向小鼠静脉内施予5mg/kg的4arm-peg10k-nir-797探针。在注射后24、48和72小时,用ivis光谱成像系统(激发:745nm;发射:840nm;perkineelmer)对用戊巴比妥(pentobarbital)麻醉后的小鼠进行成像。体内成像结果显示,与peg衔接器cd19控制组相比,peg衔接器egfr靶向肿瘤中的荧光信号显著增强。在患有mda-mb-468肿瘤的小鼠的示例性实验中,peg衔接器egfr靶向肿瘤在24、48和72小时的荧光强度分别与在这些时间点上的控制组是用peg衔接器cd19处理的肿瘤相比高出2.7倍、2.1倍和2.8倍。peg衔接器egfr和peg衔接器cd19都没有显著增强在患有hepg2(egfr低表达量)肿瘤的小鼠中的荧光信号。实施例8:预靶向peg衔接器的抗肿瘤活性根据以下程序在患有人类mdamb-468tnbc或mda-mb-231tnbc异种移植物的小鼠中测试peg衔接器的抗肿瘤活性。在其右侧腹部上患有44.7±10.7mm3的mda-mb-231(数量为6)或84.3±4.3mm3mda-mb-468(数量为8)皮下肿瘤的严重合并性免疫缺失病(severecombinedimmunodeficiency,scid)小鼠的组别中以静脉注射方式注射pbs、或6或18mg/kg的peg衔接器。5小时后,于小鼠静脉内施予游离的阿霉素(doxorubicin)(3mg/kg)或德适舒(doxisome)(1mg/kg或3mg/kg)。这种治疗每周重复一次,总共要4周。每7天测量一次肿瘤大小。结果如图3a至3c所示。以peg衔接器egfr单独治疗的小鼠显示的肿瘤生长与用pbs处理的小鼠中所显示的肿瘤生长相似。如预期的,与用pbs处理的小鼠相比,游离的阿霉素抑制肿瘤生长。与用游离的阿霉素或用pbs媒剂(vehicle)处理的小鼠相比,peg衔接器cd19结合1mg/kg或单独1mg/kgdoxisome显示出类似且更好的肿瘤生长抑制效果。与用治疗的小鼠相比,peg衔接器egfr加显著抑制tnbc肿瘤生长。参见图3a和3c。因为这些小鼠在dna修复上有所缺陷,故scid小鼠对阿霉素的最大耐受剂量一般为2.5-3mg/kg。参见haunetal.2010,nat.nanotechnol.5:660-665。将的剂量增加至3mg/kg并不能提供更好的治疗活性,因为小鼠会遭受显著的体重减轻和早期死亡的情况。参见图3b。以上结果证实了藉由体重减轻分析估计,预靶向peg衔接器egfr对egfr过量表达的tnbc肿瘤可明显提高peg化微脂体阿霉素的治疗功效,且副作用有限。实施例9:peg衔接器介导疗法的脱靶效应细胞上的egfr密度可能是藉由peg衔接器egfr将peg化纳米载体的条件性内吞作用的重要因素。测量癌细胞株上的egfr表达量,并与peg衔接器egfr加对体外癌细胞增殖的ec50值进行比较。藉由以5μg/ml单克隆小鼠igg抗人类egfr(santacruzbiotechnology)在染色缓冲液(含有0.1%牛血清白蛋白的pbs)中于4℃下染色细胞30分钟来测定在人类肝细胞(humanhepatocytes)、pc3、skbr3、sk-mes-1、hut125、caski、ht29、h2170、ls174t、hepg2、sw480、mda-mb-231、mda-mb-468和bt-20细胞表面上的egfr的表达。藉由与5μg/ml的alexafluor647共轭山羊ig抗小鼠igg抗体(thermofisherscientific)共同孵育,接着再用冷的pbs洗涤两次以除去未结合的抗体以检测抗egfr抗体的结合。使用facscaliber流式细胞仪(bectondickinson)并用flowjo软件(treestarinc.)进行分析以测量104个活细胞的表面荧光。以如上文实施例5中所述的方式测定阿霉素/peg衔接器egfr处理的ec50值。数据显示癌细胞上egfr表达量的对数与阿霉素/peg衔接器egfr处理的抗增殖ec50值的对数的间存在线性相关性(r2=0.702)。据报导,egfr靶向疗法的脱靶效应是肝毒性。参见hapuarachchigeetal.2016,sci.rep.6,24298。然而,如上所述在正常人类肝细胞所测量出的egfr表达相对较低(平均荧光强度为38),猜测peg衔接器egfr疗法将具有较低的脱靶毒性。实施例10:peg衔接器egfr可抑制egfr信号传递为了研究peg衔接器egfr是否可以抑制egfr信号传递,egfr阳性a431细胞以未经处理或用5nmegf刺激的方式,然后再与peg衔接器或控制组的抗体共同孵育。使用抗磷酸egfr或抗磷酸erk抗体通过蛋白免疫印迹法(westernblotting)来检测egfr和erk的磷酸化。总egfr和微管蛋白(tubulin)作为装载控制组(loadingcontrol)。如预期的,50nm的阴性控制组抗体贺癌平(herceptin,抗her2igg)和peg衔接器cd19均不抑制egf诱导的egfr和erk的磷酸化。相比的下,50nm的尔必得舒(erbitu,单克隆抗egfrigg)和50nm的peg衔接器egfr在egf处理的细胞中抑制egfr和erk的磷酸化。其他实施例本说明书所公开的所有特征可以任意组合方式组合。本说明书中公开的每个特征可以由用于相同,等同或类似目的的替代特征替代。因此,除非另有明确说明,否则所公开的每个特征仅仅是一系列等同或类似特征的一个实施例。从以上描述中,本领域技术人员可以容易地确定本发明的基本技术特征,并且在不脱离其精神和范围的情况下,可以对本发明进行各种改变和修改以使其适应各种用途和条件。因此,其他实施例也在以下申请专利范围的范围内。序列表<110>中央研究院高雄医学大学<120>藉由预靶向的双特异性聚乙二醇结合抗体将聚乙二醇化试剂条件性内吞用于诊断和治疗<130>pt20193178-dd-p<150>62/510,046<151>2017-05-23<160>9<170>siposequencelisting1.0<210>1<211>114<212>prt<213>人工序列(artificialsequence)<220><223>人源化vh链<400>1glnvalglnleuvalglnserglysergluleulyslysproglyala151015servallysvalsercyslysalaserglytyrthrphelysasntyr202530glymetasntrpvalargglnalaproglyglnglyleuglutrpmet354045glytrpileasnthrtyrthrglyglnproiletyralaasnaspphe505560lysglyargphevalpheserleuaspthrservalserthralatyr65707580leuglnileserserleulysalagluaspthralavaltyrtyrcys859095alaargasptrpglyprotyrtrpglyglnglythrleuvalthrval100105110serser<210>2<211>112<212>prt<213>人工序列(artificialsequence)<220><223>人源化vl链<400>2aspilevalmetthrglnserproaspserleualavalserleugly151015gluargalathrileasncyslysserserglnservalleutyrser202530serasnglnmetasntyrleualatrptyrglnglnlysproglygln354045proprolysleuleuiletyrtrpalaserthrarggluserglyval505560proaspargpheserglyserglyserglythraspphethrleuthr65707580ileserserleuglnalagluaspvalalavaltyrtyrcysleugln859095tyrleusersertrpthrpheglyglyglythrlysleugluilelys100105110<210>3<211>8<212>prt<213>人工序列(artificialsequence)<220><223>h-cdr1<400>3glytyrthrphelysasntyrgly15<210>4<211>8<212>prt<213>人工序列(artificialsequence)<220><223>h-cdr2<400>4ileasnthrtyrthrglyglnpro15<210>5<211>7<212>prt<213>人工序列(artificialsequence)<220><223>h-cdr3<400>5alaargasptrpglyprotyr15<210>6<211>12<212>prt<213>人工序列(artificialsequence)<220><223>l-cdr1<400>6glnservalleutyrserserasnglnmetasntyr1510<210>7<211>7<212>prt<213>人工序列(artificialsequence)<220><223>l-cdr2<400>7trpalaserthrarggluser15<210>8<211>8<212>prt<213>人工序列(artificialsequence)<220><223>l-cdr3<400>8leuglntyrleusersertrpthr15<210>9<211>5<212>prt<213>人工序列(artificialsequence)<220><223>合成接头<400>9glyglyglyglyser15当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法