组氨酸修饰的有机-硅胶杂化整体柱及其制备方法与应用与流程
本发明涉及一种组氨酸修饰的有机-硅胶杂化整体柱,及其制备方法与应用,属于色谱填料技术领域。
背景技术:
目前,大部分关于整体柱材料的应用主要集中在反相色谱分离方面,以c18柱为代表,这些反相色谱柱对非极性化合物具有良好的分离效果,部分相关类型的整体柱已实现商品化,但这类整体柱材料存在的问题是:很难实现对极性化合物的有效分离。另外,在制备时,现有的制备方法普遍采用的是非水溶性的有机功能单体作为修饰剂,这就使得在制备过程中需要大量使用到有机溶剂,制备方法相对复杂,不经济且不环保。
技术实现要素:
针对上述现有技术,为了解决采用现有技术制备方法的复杂、不经济、不环保等问题,同时解决现有整体柱材料对极性化合物不能实现良好分离的问题,本发明提供了一种组氨酸修饰的有机硅胶-杂化整体柱,并提供了其制备方法,并将其应用于实现对一些常见的极性化合物、亲水性化合物的分离分析。
本发明是通过以下技术方案实现的:
一种组氨酸修饰的有机-硅胶杂化整体柱的制备方法,包括以下步骤:
(a)选用四甲氧基硅烷和氯丙基三甲氧基硅烷为前驱体,通过溶胶-凝胶法制备氯丙基-硅胶杂化硅胶整体柱床;
(b)用过量的组氨酸水溶液冲洗氯丙基-硅胶杂化硅胶整体柱床,然后,将氯丙基-硅胶杂化硅胶整体柱床置于恒温箱中反应,即得组氨酸修饰的有机-硅胶杂化整体柱。
所述步骤(a)中,氯丙基-硅胶杂化硅胶整体柱床的制备方法为:先将聚乙二醇(peg,m=10000)溶于乙酸水溶液中,然后向其中分别缓慢加入四甲氧基硅烷(tmos)和氯丙基三甲氧基硅烷(cptms),得混合溶液;将混合溶液置于冰水浴条件下反应,直至形成均一透明的溶胶,然后将其在冰水浴条件下超声,再将其引入处理好的毛细管中至长度为30~35cm;将毛细管两端用硅脂密封,然后放入恒温箱中反应,完成凝胶过程,制得氯丙基-硅胶杂化整体柱床。
进一步地,所述聚乙二醇、四甲氧基硅烷和氯丙基三甲氧基硅烷三者的用量配比关系为:240mg:0.9ml:0.3ml。
优选的,所述乙酸水溶液的浓度为0.01mol/l,每240mg聚乙二醇所用的乙酸水溶液的用量为2.5ml。
优选的,混合溶液在冰水浴条件下反应时间为3~5h。
优选的,在冰水浴条件下超声时间为3~5min。
进一步地,所述处理好的毛细管是通过以下方法处理得到的:取长度为40~50cm的熔融石英毛细管,依次用甲醇、蒸馏水分别冲洗20min,再依次用1mol/l的naoh溶液、水、1mol/l的盐酸分别冲洗2.0h、0.5h、1.5h,然后再用水冲洗至冲出的液体ph呈中性(ph7.0)(约20min),最后用甲醇冲洗20min,120℃条件下用氮气吹干,待用。
优选的,所述放入恒温箱中反应的条件为:反应温度为50℃~70℃,反应时间为12~14h。
所述步骤(b)中,所述组氨酸水溶液的浓度≥10mg/ml。
所述过量是指毛细管体积的2倍以上。
所述将氯丙基-硅胶杂化硅胶整体柱床置于恒温箱中反应的反应条件为:反应温度60℃~80℃,反应时间为23~25小时。
利用上述方法制备得到的组氨酸修饰的有机-硅胶杂化整体柱。
上述组氨酸修饰的有机-硅胶杂化整体柱,在极性、亲水性化合物的分离分析中的应用,将具体的,可在富水色谱条件下实现对一些常见的极性、亲水性化合物的分离分析。
进一步地,所述富水色谱条件为流动相中h2o含量(体积百分数)≥90%。
进一步地,所述极性化合物选自酰胺类化合物、核苷和核苷碱基、氨基酸、苯甲酸衍生物等。
本发明的组氨酸修饰的有机-硅胶杂化整体柱,选用水溶性的有机功能单体对整体柱床进行修饰,可使得制备方法相对简单,减少了需使用有机溶剂冲洗柱子的步骤(在整个修饰过程中都未使用到有机溶剂),制备方法绿色、经济、环保。本发明的组氨酸修饰的有机-硅胶杂化整体柱,能够在富水色谱条件下实现对一些常见极性、亲水性化合物的分离分析,能很好地解决常规整体柱在对这些极性化合物的分离分析方面存在的固有缺陷。由于在富水色谱模式下使用的有机溶剂很少,所以同样也使得本发明的整体柱材料能在相对绿色、经济和环保的条件下实现对极性化合物的分离分析。
附图说明
图1:实施例1的组氨酸修饰的有机-硅胶杂化整体柱的扫描电镜图,其中,a:放大倍数为1200×;b:放大倍数为3000×;c:放大倍数为5000×;d:放大倍数为15000×。
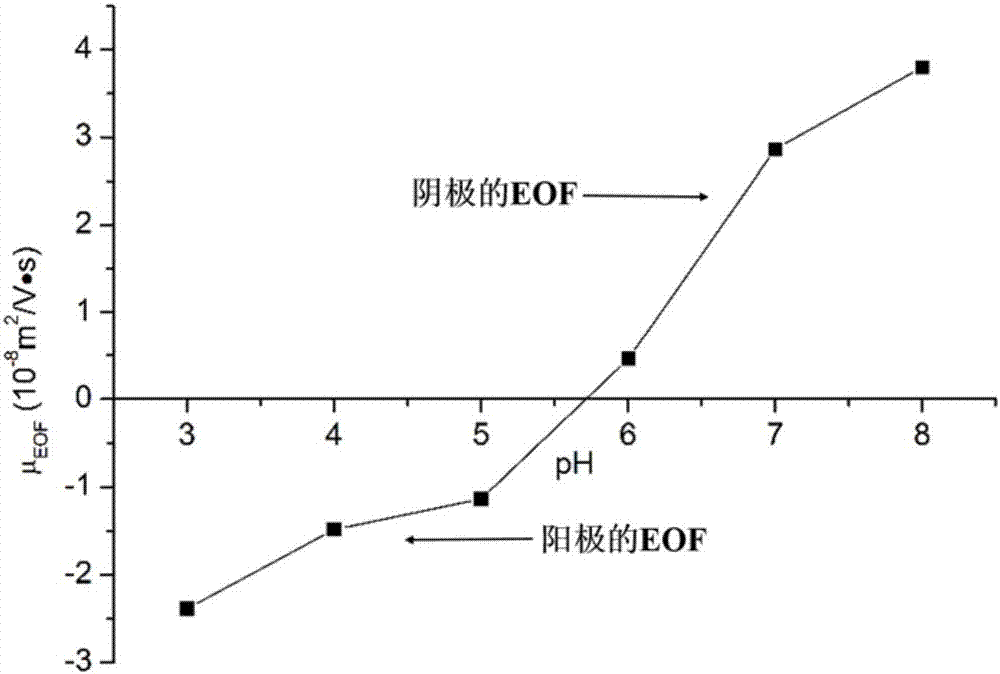
图2:整体柱的电渗流考察结果示意图,ph在3.0~5.0之间时,产生一个阳极的eof,表明整体柱表面的净电荷为正。此时,eof的大小会随着ph的增大而逐渐减小,当ph在5.7左右时,eof的大小接近于零。随着ph的进一步增大,整体柱表面的净电荷由正变为负,从而使eof发生反转,产生一个阴极的eof。此时,eof的大小会随着ph的增大而逐渐增大。上述结果表明,通过改变流动相的ph可轻易实现对eof的大小和方向的调控。分离条件:10mmnah2po4bufferatdifferentphvalues;appliedvoltage,±20kv。eof标记物:硫脲。
图3:不同ph条件下有机-硅胶杂化整体柱对5种酰胺类化合物的色谱分离图,其中,1.甲酰胺;2.丙烯酰胺;3.n,n-二甲基甲酰胺;4.n,n-二甲基乙酰胺;5.己内酰胺。
分离条件:10mmnah2po4缓冲溶液;a:含4%acn,ph3.0,电压:-15kv。b:含4%acn,ph3.0,电压:-20kv。c:含2%acn,ph7.0,电压:+15kv。d:含2%acn,ph8.0,电压:+20kv。
图4:不同乙腈含量条件下有机-硅胶杂化整体柱对5种酰胺类化合物的色谱分离图,其中,1.甲酰胺;2.丙烯酰胺;3.n,n-二甲基甲酰胺;4.n,n-二甲基乙酰胺;5.己内酰胺。
分离条件:10mmnah2po4缓冲溶液,含不同acn含量,ph3.0,电压:-20kv。
图5:不同盐浓度条件下有机-硅胶杂化整体柱对5种酰胺类化合物的色谱分离图,其中,1.甲酰胺;2.丙烯酰胺;3.n,n-二甲基甲酰胺;4.n,n-二甲基乙酰胺;5.己内酰胺。
分离条件:不同浓度nah2po4缓冲溶液,ph3.0,电压:-20kv。
图6:有机-硅胶杂化整体柱对3种苯甲酸衍生物的色谱分离图,其中,a:对3种苯甲酸衍生物的色谱分离图,1.硫脲;2.对羟基苯甲酸;3.对氨基苯甲酸;4.苯甲酸。b:流动相中乙腈含量对苯甲酸衍生物保留的影响。c:流动相中盐浓度对苯甲酸衍生物保留的影响。
分离条件:a:30mmnah2po4缓冲溶液,含6%acn,ph3.0。b:10mmnah2po4缓冲溶液,不同acn含量,ph3.0。c:不同缓冲盐浓度,含6%acn,ph3.0,电压:-15kv。
图7:有机-硅胶杂化整体柱对4种核苷和核苷碱基的色谱分离图,其中,a:对4种核苷和核苷碱基的色谱分离图,1.硫脲;2.对羟基苯甲酸;3.对氨基苯甲酸;4.苯甲酸。b:流动相中乙腈含量对核苷和核苷碱基保留的影响。c:流动相中盐浓度对核苷和核苷碱基保留的影响。
分离条件:a:20mmnah2po4缓冲溶液,ph4.0。b:20mmnah2po4缓冲溶液,ph4.0,不同acn含量。c:不同缓冲溶液浓度,ph4.0.电压:-15kv。
图8:有机-硅胶杂化整体柱对3种氨基酸的色谱分离图,其中,a:对3种氨基酸的色谱分离图,1.酪氨酸;2.苯丙氨酸;3.色氨酸;a.氨基酸在咪唑乙酸修饰的有机硅胶杂化整体柱上的色谱分分离图;b.氨基酸在组氨酸修饰的有机-硅胶杂化整体柱上的色谱分离图。b:流动相中乙腈含量对氨基酸保留的影响。c:流动相中盐浓度对氨基酸保留的影响。
分离条件:aa:10mmnah2po4缓冲溶液,含4%acn,ph3.0;ab:5mmnah2po4缓冲溶液,ph3.0。b:10mmnah2po4缓冲溶液,不同acn含量,ph3.0。c:不同缓冲溶液浓度,ph3.0.电压,-20kv。
具体实施方式
下面结合实施例对本发明作进一步的说明。
下述实施例中所涉及的仪器、试剂、材料等,若无特别说明,均为现有技术中已有的常规仪器、试剂、材料等,可通过正规商业途径获得。下述实施例中所涉及的实验方法,检测方法等,若无特别说明,均为现有技术中已有的常规实验方法,检测方法等。
实施例1组氨酸修饰的有机硅胶-杂化整体柱的制备及应用
步骤如下:
①毛细管的预处理:取长度为45cm的熔融石英毛细管,依次用甲醇、水分别冲洗20min,再依次用1mol/l的naoh溶液、水、1mol/l的盐酸分别冲洗2.0h、0.5h、1.5h,然后再用水冲洗毛细管20min,直至冲出的液体的ph呈中性,最后用甲醇冲洗20min,置于120℃条件下用氮气吹干,待用;
②将240mg聚乙二醇(peg,m=10000)溶于装有2.5ml0.01m乙酸水溶液的玻璃瓶中,然后向其中分别缓慢加入0.9ml四甲氧基硅烷(tmos)和0.3ml氯丙基三甲氧基硅烷(cptms),将混合溶液在冰水浴条件下反应4h,直至形成均一透明的溶胶,然后将溶胶在冰水浴条件下超声3min,再将其引入上述已处理好的毛细管中至长度为30cm;将毛细管两端用硅脂密封,然后放入恒温箱中在55℃条件下反应12h,完成凝胶过程,制得氯丙基-硅胶杂化整体柱;
③将步骤②所制备的氯丙基-硅胶杂化整体柱用水冲洗后,再将过量(毛细管体积的2倍)的组氨酸水溶液(浓度为10mg/ml)冲入整体柱床中,置于75℃烘箱中反应24h,最终制得组氨酸修饰的有机-硅胶杂化整体柱。
④将步骤③所制备的组氨酸修饰的有机-硅胶杂化整体柱应用于富水色谱条件下(水含量>90%),实现对酰胺、核苷和核苷碱基以及氨基酸、苯甲酸衍生物等极性和亲水性化合物的分离分析。
实施例2组氨酸修饰的有机-硅胶杂化整体柱的制备及应用
步骤如下:
①毛细管的预处理:取长度为40cm的熔融石英毛细管,依次用甲醇、水分别冲洗20min,再依次用1mol/l的naoh溶液、水、1mol/l的盐酸分别冲洗2.0h、0.5h、1.5h,然后再用水冲洗毛细管20min,直至冲出的液体的ph呈中性,最后用甲醇冲洗20min,置于120℃条件下用氮气吹干,待用;
②将240mg聚乙二醇(peg,m=10000)溶于装有2.5ml0.01m乙酸水溶液的玻璃瓶中,然后向其中分别缓慢加入0.9ml四甲氧基硅烷(tmos)和0.3ml氯丙基三甲氧基硅烷(cptms),将混合溶液在冰水浴条件下反应4h,直至形成均一透明的溶胶,然后将溶胶在冰水浴条件下超声3min,再将其引入上述已处理好的毛细管中至长度为35cm;将毛细管两端用硅脂密封,然后放入恒温箱中在60℃条件下反应12h,完成凝胶过程,制得氯丙基-硅胶杂化整体柱;
③将步骤②所制备的氯丙基-硅胶杂化整体柱用水冲洗后,再将过量(毛细管体积的3倍)的组氨酸水溶液(浓度为10mg/ml)冲入整体柱床中,置于70℃烘箱中反应24h,最终制得组氨酸修饰的有机-硅胶杂化整体柱。
④将步骤③所制备的组氨酸修饰的有机-硅胶杂化整体柱应用于富水色谱条件下(水含量>92%),实现对酰胺、核苷和核苷碱基、苯甲酸衍生物以及氨基酸等极性和亲水性化合物的分离分析。
实施例3组氨酸修饰的有机-硅胶杂化整体柱的制备及应用
步骤如下:
①毛细管的预处理:取长度为50cm的熔融石英毛细管,依次用甲醇、水分别冲洗20min,再依次用1mol/l的naoh溶液、水、1mol/l的盐酸分别冲洗2.0h、0.5h、1.5h,然后再用水冲洗毛细管20min,直至冲出的液体的ph呈中性,最后用甲醇冲洗20min,置于120℃条件下用氮气吹干,待用;
②将240mg聚乙二醇(peg,m=10000)溶于装有2.5ml0.01m乙酸水溶液的玻璃瓶中,然后向其中分别缓慢加入0.9ml四甲氧基硅烷(tmos)和0.3ml氯丙基三甲氧基硅烷(cptms),将混合溶液在冰水浴条件下反应4h,直至形成均一透明的溶胶,然后将溶胶在冰水浴条件下超声3min,再将其引入上述已处理好的毛细管中至长度为35cm;将毛细管两端用硅脂密封,然后放入恒温箱中在55℃条件下反应14h,完成凝胶过程,制得氯丙基-硅胶杂化整体柱;
③将步骤②所制备的氯丙基-硅胶杂化整体柱用水冲洗后,再将过量(毛细管体积的3倍)的组氨酸水溶液(浓度为8mg/ml)冲入整体柱床中,置于70℃烘箱中反应24h,最终制得组氨酸修饰的有机-硅胶杂化整体柱。
④将步骤③所制备的组氨酸修饰的有机-硅胶杂化整体柱应用于富水色谱条件下(水含量>90%),实现对酰胺、核苷和核苷碱基、苯甲酸衍生物以及氨基酸等极性和亲水性化合物的分离分析。
实施例4组氨酸修饰的有机-硅胶杂化整体柱的制备及应用
步骤如下:
①毛细管的预处理:取长度为50cm的熔融石英毛细管,依次用甲醇、水分别冲洗20min,再依次用1mol/l的naoh溶液、水、1mol/l的盐酸分别冲洗2.0h、0.5h、1.5h,然后再用水冲洗毛细管20min,直至冲出的液体的ph呈中性,最后用甲醇冲洗20min,置于120℃条件下用氮气吹干,待用;
②将240mg聚乙二醇(peg,m=10000)溶于装有2.5ml0.01m乙酸水溶液的玻璃瓶中,然后向其中分别缓慢加入0.9ml四甲氧基硅烷(tmos)和0.3ml氯丙基三甲氧基硅烷(cptms),将混合溶液在冰水浴条件下反应4h,直至形成均一透明的溶胶,然后将溶胶在冰水浴条件下超声3min,再将其引入上述已处理好的毛细管中至长度为32cm;将毛细管两端用硅脂密封,然后放入恒温箱中在60℃条件下反应12h,完成凝胶过程,制得氯丙基-硅胶杂化整体柱;
③将步骤②所制备的氯丙基-硅胶杂化整体柱用水冲洗后,再将过量(毛细管体积的2倍)的组氨酸水溶液(浓度为5mg/ml)冲入整体柱床中,置于75℃烘箱中反应24h,最终制得组氨酸修饰的有机-硅胶杂化整体柱。
④将步骤③所制备的组氨酸修饰的有机-硅胶杂化整体柱应用于富水色谱条件下(水含量>94%),实现对酰胺、苯甲酸衍生物、核苷和核苷碱基以及氨基酸等极性和亲水性化合物的分离分析。
实施例5组氨酸修饰的有机-硅胶杂化整体柱的制备及应用
步骤如下:
①毛细管的预处理:取长度为43cm的熔融石英毛细管,依次用甲醇、水分别冲洗20min,再依次用1mol/l的naoh溶液、水、1mol/l的盐酸分别冲洗2.0h、0.5h、1.5h,然后再用水冲洗毛细管20min,直至冲出的液体的ph呈中性,最后用甲醇冲洗20min,置于120℃条件下用氮气吹干,待用;
②将240mg聚乙二醇(peg,m=10000)溶于装有2.5ml0.01m乙酸水溶液的玻璃瓶中,然后向其中分别缓慢加入0.9ml四甲氧基硅烷(tmos)和0.3ml氯丙基三甲氧基硅烷(cptms),将混合溶液在冰水浴条件下反应5h,直至形成均一透明的溶胶,然后将溶胶在冰水浴条件下超声5min,再将其引入上述已处理好的毛细管中至长度为36cm;将毛细管两端用硅脂密封,然后放入恒温箱中在50℃条件下反应12h,完成凝胶过程,制得氯丙基-硅胶杂化整体柱;
③将步骤②所制备的氯丙基-硅胶杂化整体柱用水冲洗后,再将过量(毛细管体积的4倍)的组氨酸水溶液(浓度为6mg/ml)冲入整体柱床中,置于80℃烘箱中反应24h,最终制得组氨酸修饰的有机-硅胶杂化整体柱。
④将步骤③所制备的组氨酸修饰的有机-硅胶杂化整体柱应用于富水色谱条件下(水含量>90%),实现对酰胺、核苷和核苷碱基、苯甲酸衍生物以及氨基酸等极性和亲水性化合物的分离分析。
实施例6组氨酸修饰的有机-硅胶杂化整体柱的制备及应用
步骤如下:
①毛细管的预处理:取长度为47cm的熔融石英毛细管,依次用甲醇、水分别冲洗20min,再依次用1mol/l的naoh溶液、水、1mol/l的盐酸分别冲洗2.0h、0.5h、1.5h,然后再用水冲洗毛细管20min,直至冲出的液体的ph呈中性,最后用甲醇冲洗20min,置于120℃条件下用氮气吹干,待用;
②将240mg聚乙二醇(peg,m=10000)溶于装有2.5ml0.01m乙酸水溶液的玻璃瓶中,然后向其中分别缓慢加入0.9ml四甲氧基硅烷(tmos)和0.3ml氯丙基三甲氧基硅烷(cptms),将混合溶液在冰水浴条件下反应4h,直至形成均一透明的溶胶,然后将溶胶在冰水浴条件下超声3min,再将其引入上述已处理好的毛细管中至长度为33cm;将毛细管两端用硅脂密封,然后放入恒温箱中在55℃条件下反应12h,完成凝胶过程,制得氯丙基-硅胶杂化整体柱;
③将步骤②所制备的氯丙基-硅胶杂化整体柱用水冲洗后,再将过量(毛细管体积的3倍)的组氨酸水溶液(浓度为10mg/ml)冲入整体柱床中,置于75℃烘箱中反应24h,最终制得组氨酸修饰的有机-硅胶杂化整体柱。
④将步骤③所制备的组氨酸修饰的有机-硅胶杂化整体柱应用于富水色谱条件下(水含量>90%),实现对酰胺、核苷和核苷碱基、苯甲酸衍生物以及氨基酸等极性和亲水性化合物的分离分析。
实施例7组氨酸修饰的有机-硅胶杂化整体柱的制备及应用
步骤如下:①毛细管的预处理:取长度为42cm的熔融石英毛细管,依次用甲醇、水分别冲洗20min,再依次用1mol/l的naoh溶液、水、1mol/l的盐酸分别冲洗2.0h、0.5h、1.5h,然后再用水冲洗毛细管20min,直至冲出的液体的ph呈中性,最后用甲醇冲洗20min,置于120℃条件下用氮气吹干,待用;
②将240mg聚乙二醇(peg,m=10000)溶于装有2.5ml0.01m乙酸水溶液的玻璃瓶中,然后向其中分别缓慢加入0.9ml四甲氧基硅烷(tmos)和0.3ml氯丙基三甲氧基硅烷(cptms),将混合溶液在冰水浴条件下反应4h,直至形成均一透明的溶胶,然后将溶胶在冰水浴条件下超声3min,再将其引入上述已处理好的毛细管中至长度为30cm;将毛细管两端用硅脂密封,然后放入恒温箱中在70℃条件下反应12h,完成凝胶过程,制得氯丙基-硅胶杂化整体柱;
③将步骤②所制备的氯丙基-硅胶杂化整体柱用水冲洗后,再将过量(毛细管体积的5倍)的组氨酸水溶液(浓度为10mg/ml)冲入整体柱床中,置于65℃烘箱中反应24h,最终制得组氨酸修饰的有机-硅胶杂化整体柱。
④将步骤③所制备的组氨酸修饰的有机-硅胶杂化整体柱应用于富水色谱条件下(水含量>96%),实现对酰胺、核苷和核苷碱基、苯甲酸衍生物以及氨基酸等极性和亲水性化合物的分离分析。
实施例8组氨酸修饰的有机-硅胶杂化整体柱的制备及应用
步骤如下:
①毛细管的预处理:取长度为46cm的熔融石英毛细管,依次用甲醇、水分别冲洗20min,再依次用1mol/l的naoh溶液、水、1mol/l的盐酸分别冲洗2.0h、0.5h、1.5h,然后再用水冲洗毛细管20min,直至冲出的液体的ph呈中性,最后用甲醇冲洗20min,置于120℃条件下用氮气吹干,待用;
②将240mg聚乙二醇(peg,m=10000)溶于装有2.5ml0.01m乙酸水溶液的玻璃瓶中,然后向其中分别缓慢加入0.9ml四甲氧基硅烷(tmos)和0.3ml氯丙基三甲氧基硅烷(cptms),将混合溶液在冰水浴条件下反应5h,直至形成均一透明的溶胶,然后将溶胶在冰水浴条件下超声3min,再将其引入上述已处理好的毛细管中至长度为35cm;将毛细管两端用硅脂密封,然后放入恒温箱中在50℃条件下反应14h,完成凝胶过程,制得氯丙基-硅胶杂化整体柱;
③将步骤②所制备的氯丙基-硅胶杂化整体柱用水冲洗后,再将过量(毛细管体积的3倍)的组氨酸水溶液(浓度为2mg/ml)冲入整体柱床中,置于80℃烘箱中反应24h,最终制得组氨酸修饰的有机-硅胶杂化整体柱。
④将步骤③所制备的组氨酸修饰的有机-硅胶杂化整体柱应用于富水色谱条件下(水含量>90%),实现对酰胺、核苷和核苷碱基、苯甲酸衍生物以及氨基酸等极性和亲水性化合物的分离分析。
实施例9组氨酸修饰的有机-硅胶杂化整体柱的制备及应用
步骤如下:
①毛细管的预处理:取长度为50cm的熔融石英毛细管,依次用甲醇、水分别冲洗20min,再依次用1mol/l的naoh溶液、水、1mol/l的盐酸分别冲洗2.0h、0.5h、1.5h,然后再用水冲洗毛细管20min,直至冲出的液体的ph呈中性,最后用甲醇冲洗20min,置于120℃条件下用氮气吹干,待用;
②将240mg聚乙二醇(peg,m=10000)溶于装有2.5ml0.01m乙酸水溶液的玻璃瓶中,然后向其中分别缓慢加入0.9ml四甲氧基硅烷(tmos)和0.3ml氯丙基三甲氧基硅烷(cptms),将混合溶液在冰水浴条件下反应3h,直至形成均一透明的溶胶,然后将溶胶在冰水浴条件下超声3min,再将其引入上述已处理好的毛细管中至长度为30cm;将毛细管两端用硅脂密封,然后放入恒温箱中在55℃条件下反应14h,完成凝胶过程,制得氯丙基-硅胶杂化整体柱;
③将步骤②所制备的氯丙基-硅胶杂化整体柱用水冲洗后,再将过量(毛细管体积的3倍)的组氨酸水溶液(浓度为10mg/ml)冲入整体柱床中,置于80℃烘箱中反应22h,最终制得组氨酸修饰的有机-硅胶杂化整体柱。
④将步骤③所制备的组氨酸修饰的有机-硅胶杂化整体柱应用于富水色谱条件下(水含量>92%),实现对酰胺、核苷和核苷碱基、苯甲酸衍生物以及氨基酸等极性和亲水性化合物的分离分析。
实施例10组氨酸修饰的有机-硅胶杂化整体柱的制备及应用
步骤如下:
①毛细管的预处理:取长度为41cm的熔融石英毛细管,依次用甲醇、水分别冲洗20min,再依次用1mol/l的naoh溶液、水、1mol/l的盐酸分别冲洗2.0h、0.5h、1.5h,然后再用水冲洗毛细管20min,直至冲出的液体的ph呈中性,最后用甲醇冲洗20min,置于120℃条件下用氮气吹干,待用;
②将240mg聚乙二醇(peg,m=10000)溶于装有2.5ml0.01m乙酸水溶液的玻璃瓶中,然后向其中分别缓慢加入0.9ml四甲氧基硅烷(tmos)和0.3ml氯丙基三甲氧基硅烷(cptms),将混合溶液在冰水浴条件下反应4h,直至形成均一透明的溶胶,然后将溶胶在冰水浴条件下超声5min,再将其引入上述已处理好的毛细管中至长度为35cm;将毛细管两端用硅脂密封,然后放入恒温箱中在60℃条件下反应14h,完成凝胶过程,制得氯丙基-硅胶杂化整体柱;
③将步骤②所制备的氯丙基-硅胶杂化整体柱用水冲洗后,再将过量(毛细管体积的2倍)的组氨酸水溶液(浓度为8mg/ml)冲入整体柱床中,置于75℃烘箱中反应26h,最终制得组氨酸修饰的有机-硅胶杂化整体柱。
④将步骤③所制备的组氨酸修饰的有机-硅胶杂化整体柱应用于富水色谱条件下(水含量>96%),实现对酰胺、核苷和核苷碱基、苯甲酸衍生物以及氨基酸等极性和亲水性化合物的分离分析。
下述以实施例1为例,对制备得到的组氨酸修饰的有机-硅胶杂化整体柱的制备进行参数表征,表征的方法和结果如下:
扫描电镜表征:采用场发射扫描电镜(型号:s-4800,购于日本电子公司)对整体柱材料进行扫描电镜表征。所得结果如图1所示。从图1中可以看出,整体柱床具有较为均一的多孔结构,且整体柱基质也很好地连接到了毛细管内壁上。
电渗流表征(化学表征):电渗流是由固定相表面的带电基团所产生的。电渗流的大小取决于所有带电基团的净电荷密度的大小,相应地,电渗流的方向则取决于净电荷的正负。对于硅胶整体柱而言,电渗流主要由其表面的残余硅羟基所产生。由于硅羟基的解离能力较弱,所以这类整体柱往往只能在ph>5.0的流动相中才能产生足够强的电渗流。解决这个问题的方法就是在硅胶整体柱的表面键合更多的带电功能基团。对于组氨酸修饰的有机-硅胶杂化整体柱,ph在3.0~5.0之间时,也能观察到一个阳极的电渗流,这就表明组氨酸被成功键合到了氯丙基-硅胶杂化整体柱上。在较低的ph条件下,整体柱固定相表面的羧基和残余的硅羟基的解离得到抑制,所以其净电荷的大小和正负是由带正电的咪唑盐和氨基决定的,因此在酸性条件下能产生一个阳极的电渗流(如图2所示)。
机械性能和通透性的考察:将一根8cm长的整体柱连接到hplc液相泵上,以(acn/h2o=50/50,v/v)为流动相,通过测试背压来考察组氨酸修饰的有机-硅胶杂化整体柱的机械稳定性。当流速从0.001ml/min增大到0.011ml/min时,背压线性地从0.6mpa增大到1.6mpa,这就表明整体柱具有较好的机械稳定性。此外,整体柱的通透性通过达西定律来计算得知。组氨酸修饰的有机-硅胶杂化整体柱的通透性为2.45×10−12m2,这表明整体柱具有较为满意的通透性。
重现性的考察:通过测量分析物的保留时间的相对标准偏差(rsds)来评价整体柱的重现性。日内(n=5)和日间(n=3)重现性在同一根色谱柱上考察,所获得的结果(日内(n=5):2.688,2.672,2.63,2.637,2.616;日间(n=3):2.772,2.735,2.78;柱与柱(n=3):2.73,2.65,2.81)较为满意,rsds分别小于1.5%和2.8%。柱与柱之间(n=3)的重现性也在可接受范围之内,rsds小于3.6%。
稳定性考察:整体柱在连续使用超过四个星期以后,保留性能和柱效都没有明显的降低。
接下来以实施例1为例,对组氨酸修饰的有机-硅胶杂化整体柱进行色谱性能考察,考察的方法和结果如下:
将整体柱联接到agilentg1600系列毛细管电泳仪中,设定柱温25℃,紫外检测器波长214nm,选择合适的流动相和电压对整体柱的分离性能进行考察。
考察上述整体柱在不同色谱条件下对酰胺类化合物的分离性能。
图3所示为在不同ph条件下,5种酰胺类化合物(甲酰胺,丙烯酰胺,n,n-二甲基甲酰胺,n,n-二甲基乙酰胺,己内酰胺)在组氨酸修饰的有机-硅胶杂化整体柱上的色谱分离图。从图中可以看出,5种酰胺类化合物在酸性、中性和碱性的色谱条件下都能获得较为满意的分离结果。同时,与在咪唑乙酸修饰的有机-硅胶杂化整体柱(除了采用过量的浓度为100mg/ml的咪唑-1-乙酸水溶液外,其它都同实施例1)上获得的分离效果相比,在组氨酸修饰的有机-硅胶杂化整体柱上能够获得更加快速的分离和更高的柱效。而这些酰胺类化合物在常规的反相整体柱上往往很难获得较好的分离效果。
图4和图5所示分别为在不同乙腈含量和不同盐浓度条件下,5种酰胺类化合物在组氨酸修饰的有机-硅胶杂化整体柱上的色谱分离图。
考察上述整体柱对苯甲酸衍生物的分离性能。对于传统的硅胶整体柱而言,由于在酸性条件下所能产生的电渗流很弱,从而导致分析物的保留时间很长,因此它们很难实现对酸性化合物的分离。而在ph小于5.0时,组氨酸修饰的有机-硅胶杂化整体柱能产生一个反转的阳极的电渗流,因而能实现对这些酸性化合物较好的分离,此外,它也能提供疏水和离子交换作用等多种相互作用。如图6a所示,3种常见的苯甲酸衍生物(对羟基苯甲酸,对氨基苯甲酸,苯甲酸)在富水色谱模式下获得了较为满意的分离效果。通过研究流动相中乙腈含量和盐浓度对苯甲酸衍生物保留的影响(如图6b和6c所示)得知,苯甲酸衍生物的分离过程中存在混合模式的疏水和离子交换作用机理。且较高的离子强度更加有利于实现对苯甲酸衍生物较好的分离。
考察上述整体柱对核苷和核苷碱基的分离性能。如图7a所示,4种核苷和核苷碱基(尿苷,肌苷,胸苷,次黄嘌呤)在组氨酸修饰的有机-硅胶杂化整体柱上获得了基线分离。与传统的表面带负电的整体柱相比,由于组氨酸修饰的有机-硅胶杂化整体柱表面带正电,从而可以有效地避免一些不理想的吸附作用,因此能获得更好的分离效果。通过研究流动相中乙腈含量和盐浓度对核苷和核苷碱基保留的影响(如图7b和7c所示)得知,核苷和核苷碱基的保留因子会随着acn含量的增大而明显降低,这就表明在分离过程中存在有疏水相互作用。降低流动相中acn含量将有助于对核苷和核苷碱基的分离,在最优条件下,当流动相中不含acn时,核苷和核苷碱基可获得较好的分离;核苷和核苷碱基的保留因子会随着盐浓度的增大呈现出一种轻微减小的趋势,这就表明在分离过程中存在有弱的离子交换作用。
考察上述整体柱对芳香氨基酸的分离性能。在酸性条件下,组氨酸修饰的有机-硅胶杂化整体柱固定相表面带正电,因此它能对带正电的分析物提供静电排斥作用。如图8a中的b所示,在富水色谱模式下,3种常见的芳香氨基酸(酪氨酸,苯丙氨酸,色氨酸)在组氨酸修饰的有机-硅胶杂化整体柱上获得了较为满意的分离效果。与在咪唑乙酸修饰的有机-硅胶杂化整体柱上获得的分离效果相比(如图8a中的a所示),在组氨酸修饰的有机-硅胶杂化整体柱上能够获得更加快速的分离,且流动相中无需添加乙腈。通过研究流动相中乙腈含量和盐浓度对氨基酸保留的影响(如图8b和图8c所示)得知,氨基酸的保留因子会随着acn含量的增大而减小,这就表明分析物和整体柱固定相之间的疏水相互作用会随着acn含量的增大而减弱;氨基酸的保留因子会随着盐浓度的增大而逐渐增大。随着盐浓度的增大,分析物和整体柱固定相之间的静电排斥作用将较弱,从而导致氨基酸保留的增强。
从图3~图8中可以看出,组氨酸修饰的有机-硅胶杂化整体柱对不同的极性和亲水性化合物都具有良好的分离性能,在实现某些特定的实际分析方面显示出较大的应用前景。
本发明实施例1~10以及整体柱参数表征、色谱性能考察所用的物品如表1所示。
表1
上述虽然结合实施例对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
- 还没有人留言评论。精彩留言会获得点赞!
- 1‑(2‑吡啶)‑9‑(2‑苯基乙基)‑β‑咔啉的硝酸铜配合物及其合成方法和应用与制造工艺
- 1‑(2‑吡啶)‑9‑(3‑苯基丙基)‑β‑咔啉的氯化铜配合物及其合成方法和应用与制造工艺
- 1‑(2‑吡啶)‑9‑(4‑甲基苄基)‑β‑咔啉的硝酸铜配合物及其合成方法和应用与制造工艺
- 以1‑(2‑吡啶)‑9‑丁基‑β‑咔啉为配体的氯化铜配合物及其合成方法和应用与制造工艺
- 以1‑(2‑吡啶)‑9‑己基‑β‑咔啉为配体的氯化铜配合物及其合成方法和应用与制造工艺
- 以1‑(2‑吡啶)‑9‑辛基‑β‑咔啉为配体的氯化铜配合物及其合成方法和应用与制造工艺
- 以1‑(2‑吡啶)‑9‑壬基‑β‑咔啉为配体的氯化铜配合物及其合成方法和应用与制造工艺
- 以1‑(2‑吡啶)‑9‑异戊基‑β‑咔啉为配体的氯化铜配合物及其合成方法和应用与制造工艺
- 1‑(2‑吡啶)‑9‑(萘‑2‑甲基)‑β‑咔啉的氯化铜配合物及其合成方法和应用与制造工艺
- 1‑(2‑吡啶)‑9‑(2‑乙氧基乙基)‑β‑咔啉的氯化铜配合物及合成方法和应用与制造工艺