通过测定AST的含量诊断、预后或监测肝脏疾病的试剂盒和方法与流程
技术领域
本公开涉及基于生物标记的免疫检测来诊断肝癌。
相关技术的描述
肝脏疾病是人类中最常见的病症,存在超过100种已知的形式,其中许多都是致命的。尤其,肝细胞癌(HCC)是全世界癌症相关死亡的第5大原因并且因HCC的死亡率在上升。患有HCC的患者通常在后期之前是无症状的。因此,患者可以大大受益于早期诊断或检测。
在临床实践中,目前使用几个参数检查肝的正常功能。其中之一是测定在肝细胞中以高浓度出现的天冬氨酸转氨酶(AST)的水平。当肝细胞由于各种因素,比如有毒物质、病毒感染、过量饮酒和肥胖受到破坏时,AST从肝细胞中释放进入血液。AST催化将L-天冬氨酸盐和α酮戊二酸盐分别转化为草酰乙酸盐和L-谷氨酸盐的可逆反应,因此用于诊断和监测肝脏疾病,尤其导致肝细胞破坏的疾病。
AST以两种不同的同功酶存在于哺乳动物组织中,一种位于胞浆中(cAST)和另一种位于线粒体中(mAST)。虽然已经进行了数种尝试,但是同工酶的测定还没有被广泛地用于肝脏疾病的临床诊断。这是由于吡哆醛-5-磷酸(AST的辅酶),它对测定产生不利影响,导致不准确的结果。AST与肝脏疾病相关的典型用途是测定cAST和mAST的总酶活性。然而,测定结果或许不能代表组织中存在的AST的精确数量,因为它们被释放到血液中后它们可能会在血流中被降解或修饰。
根据之前的研究,肝脏、心脏、骨骼肌、肾脏和大脑是AST的主要来源,但没有公开关于cAST和mAST的各自分布或存在。
韩国专利公开号2002-0053113涉及定量测定血清中的酶,比如AST的免疫学方法。然而,没有提及关于cAST和mAST的各自测定,用于用于肝脏疾病的诊断。
美国专利号7,981,627涉及监测和诊断肝硬化的方法,包括测定受试者的血液中的AST水平。
美国专利公开号2006-0172286涉及诊断肝癌的方法,包括确定受试者的血清或血液中生物标记,比如AST的活性。
然而,他们没有公开分别测定与肝脏疾病的诊断相关的AST的胞浆和线粒体同种型。
技术实现要素:
本公开涉及cAST和/或mAST用于检测肝脏疾病的用途,因此提供了用于肝脏疾病的诊断、预后或监测而检测生物样品,比如血液中cAST和/或mAST的水平的方法、试剂盒和组合物。
在本公开的一个方面中,提供了肝脏疾病的诊断、预后或监测的试剂盒或组合物,所述试剂盒或组合物包括用于检测生物样品中的胞浆天冬氨酸转氨酶(cAST)和线粒体天冬氨酸转氨酶(mAST)的至少一种的水平的试剂。
本发明的试剂盒或组合物可用于分析生物样品,包括例如全血、血浆或血清中存在的生物标记。在一个实施方式中,使用血清。
在本发明的方法、组合物或试剂盒中所使用的试剂是用于定量或定性分析的材料。在一个实施方式中,所述试剂包括用于分析的试剂,所述分析包括如蛋白质印迹、ELISA、放射免疫测定、免疫扩散测定、免疫层析法、免疫电泳、免疫染色、免疫沉淀反应、补体结合试验、质谱分析或蛋白质微阵列,但不限于此。在其他实施方式中,所述试剂是特异性识别所述cAST或mAST的单克隆抗体、多克隆抗体、抗体片段、适配体、亲和力多聚体(Avimer(avidity multimer))受体、模拟肽、受体、配体或辅因子,但不限于此。
在其他实施方式中,本公开中所使用的抗体为保藏于韩国典型培养物保藏中心,保藏编号为KCTC 12483BP、KCTC 12484BP和KCTC 12485BP的单克隆抗体。
本发明的试剂盒和组合物用于确定生物样品中cAST和mAST的至少一种的存在和/或水平的各种分析中。这样的分析包括但不限于ELISA、免疫层析法或蛋白质微阵列。
本发明的试剂盒、组合物和方法中可能诊断、监测和/或预后的肝脏疾病,包括肝炎、肝硬化或肝癌,但不限于此。此外还包括尚未确认为肝脏疾病,但怀疑为肝脏疾病的病情和状况。
在本公开的其他方面中,提供了基于有需要的样品或受试者中cAST和/或mAST的水平和/或存在来诊断、预后或监测肝脏疾病的方法。在一个实施方式中,本发明的方法包括下述步骤:测定来自有需要的受试者的生物样品中的cAST和mAST的至少一种的水平;比较上述步骤的水平与对照样品的水平或预定的截止值;以及当有变化,尤其与对照的水平相比水平增加时,确定样品或受试者具有肝脏疾病。
本发明的方法中可以使用的分析为如上所述的,包括例如蛋白质印迹、ELISA、放射免疫测定、免疫扩散测定、免疫层析法、免疫电泳、免疫染色、免疫沉淀反应、补体结合试验、质谱分析或蛋白质微阵列,但不限于此。可用本发明的方法诊断的肝脏疾病和本发明的方法可以使用的生物样品为如上文中所公开的。
在本公开的其他方面中,提供了定量分析或检测cAST和/或mAST的至少一种的水平的方法。在一个实施方式中,该方法包括下述步骤:提供对cAST和mAST的至少一种具有特异性的抗体;孵育抗体与来自受试者的血液;以及确定cAST和mAST的至少一种的浓度。可通过如上文所述的现有技术中已知的各种方法,包括例如使用夹心ELISA定量测定cAST和mAST的水平。
在本发明的试剂盒、组合物和方法中,可以使用的抗体是单克隆抗体。例如,抗cAST抗体是如表1中HCC1-10所公开的至少一种,和抗mAST抗体是如表1中HCM1-10所公开的至少一种。在一个实施方式中,对cAST具有特异性的抗体是表1中的HCC4或HCC5,和对mAST具有特异性的抗体是表1中的HCM4或HCM8。在其他实施方式中,所述抗体为保藏于韩国典型培养物保藏中心,保藏编号为KCTC 12483BP、KCTC 12484BP或KCTC 12485BP的单克隆抗体。
在其他方面中,提供了于2013年09月04日保藏于韩国典型培养物保藏中心,保藏编号为KCTC 12483BP或KCTC 12484BP,特异性识别cAST的单克隆抗体。此外还提供了于2013年09月04日保藏于韩国典型培养物保藏中心,保藏编号为KCTC 12485BP,特异性识别mAST的单克隆抗体。本公开的抗体分别以高特异性识别它们各自的抗原cAST和mAST,并且与其他抗原无交叉反应。因此本发明的单克隆抗体可有利地用于检测生物样品中cAST和mAST的存在和/或水平。
有益效果
通过免疫测定cAST和mAST的浓度来诊断或检测慢性肝炎(CH)、肝硬化(LC)和/或HCC的本发明的方法与测定酶活性的常规方法相比显示出更高的特异性。因此,本发明的方法可有利地用于肝脏疾病的诊断、预后或监测。
另外,本发明的方法也显示出cAST和mAST的检测范围是0-400μg/l的高灵敏度。因此,与基于生化分析的常规方法相比,本发明方法可有利地用于检测血清中甚至少量的cAST和/或mAST。本发明的针对cAST或mAST的抗体它们之间没有交叉反应,并且因此可有效地用于准确的区分以及因此可有效地用于准确和分别测定cAST和mAST。
与测定AST的总量的常规方法相比,本发明的方法通过分别测定cAST和mAST可以更有效地用于诊断肝脏疾病。
附图说明
结合附图,从实施方式的以下描述,本发明的这些方面和/或其他方面以及优点变得显而易见且更容易理解,其中:
图1是本发明所制备的纯化的重组cAST和mAST的12%的SDS-PAGE(A和C)和蛋白质印迹分析(B和D)的结果,其中通过添加IPTG诱导具有6个组氨酸标签的重组蛋白,使用鼠抗his标签IgG抗体进行蛋白质印迹。凝胶中,泳道1:未诱导;泳道2:诱导;泳道3:诱导后纯化的。
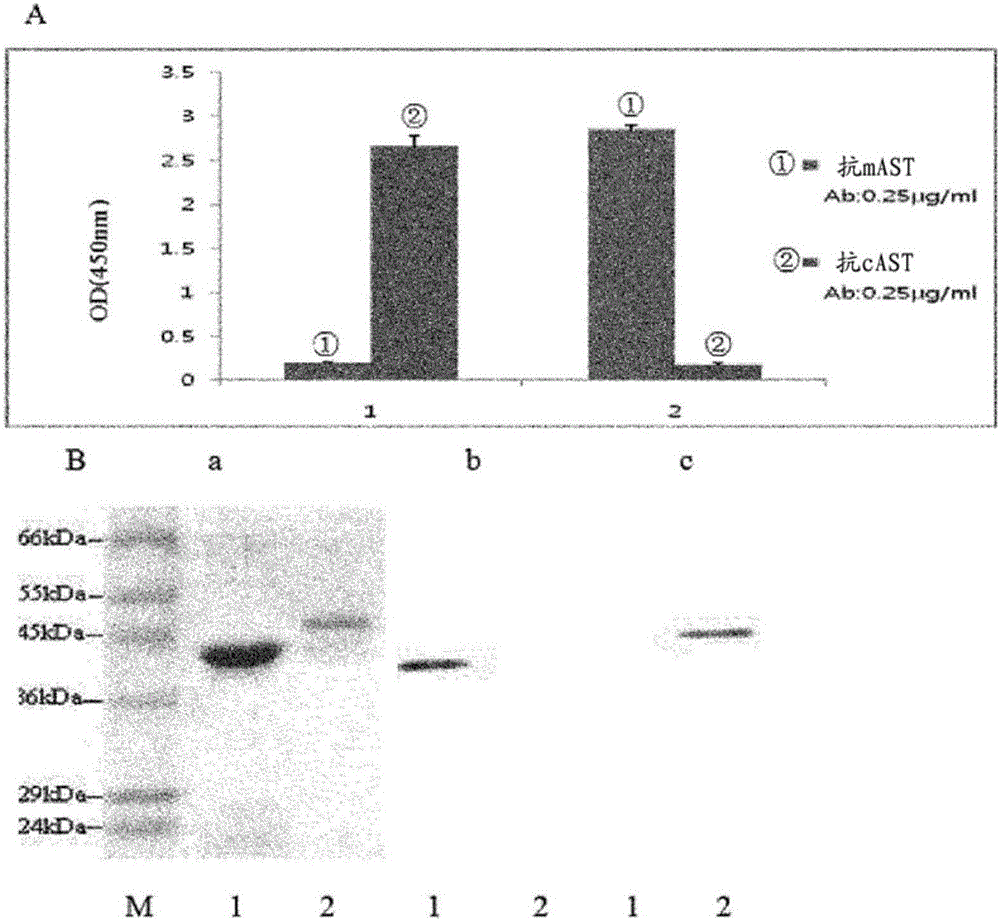
图2是分析抗cAST和抗mAST之间的交叉反应性的结果。(A)是ELISA结果,其中板用抗原cAST和mAST包被,并且抗mAST(HCM4)和抗cAST(HCC4)用作初级抗体:1:cAST包被;2:mAST包被。(B)蛋白质印迹分析结果,其中,a:SDS-PAGE;b:初级抗体HCC4;C:初级抗体HCM4。在凝胶中,泳道1:cAST;泳道2:mAST。结果表明,抗cAST和抗mAST之间没有交叉反应性。
图3是cAST和MAST的肽谱的结果,其中,纯化的重组cAST和mAST蛋白用蛋白酶消化,通过蛋白质印迹法验证根据本发明的单克隆抗体是否识别相同的表位。在该图中,A表示cAST结果,其中泳道1至10分别表示用作初级抗体的HCC1到HCC10。B表示mAST的结果,其中泳道1至10分别表示用作初级抗体的HCM1到HCM10。
图4是分析cAST和mAST在HepG2细胞中表达的结果。对HepG2的整个溶胞产物(泳道1)、上清液(泳道2)和沉淀颗粒(泳道3)的进行蛋白质印迹。(A)是SDS-PAGE的结果。(B)是使用HCC4作为初级抗体的cAST的蛋白质印迹分析的结果。(C)是使用HCM4作为初级抗体的mAST的蛋白质印迹分析的结果。(D)至(I)是对HepG2细胞进行的免疫荧光测定的结果,其中HCC4(D-F)和HCM4(G-I)用作初级抗体(1μg/ml),和FITC缀合物用作次级抗体。在(D)和(G)中,使用Alexa,并且在(E)和(H)中,使用DAPI。在(F)和(I)中是合并的图像。
图5是通过电泳(A和B)和蛋白质印迹(B,D),本发明的针对cAST和mAST的单克隆抗体与正常肝脏或肝脏疾病患者的血清中各自抗原cAST和mAST的特异性结合活性的分析结果,其中泳道表示如下:1:重组蛋白;2:来自健康患者的血清(10IU/L);3:来自患有肝脏疾病的患者的血清(760IU/L)。
图6是通过免疫组织化学分析肝脏细胞中cAST和mAST的表达和定位的结果。放大率:X20。
图7是使用夹心ELISA法分析血清中的cAST和mAST的结果。A是cAST的结果,其中单克隆抗体HCC4和HCC5分别用作捕获抗体和检测抗体,并且cAST用作参照蛋白。用1/5正常血清(10IU/L)和4/5PBS稀释重组蛋白cAST。使用的重组蛋白cAST的浓度为0μg/l、6.25μg/l、12.5μg/l、25μg/l、50μg/l、100μg/l、200μg/l、400μg/l。B是mAST结果,其中单克隆抗体HCM4和HCM8分别用作捕获抗体和检测抗体,并且重组mAST用作参照蛋白。用1/5正常血清(10IU/L)和4/5PBS稀释重组蛋白mAST。使用的重组蛋白mAST的浓度与上述相同。曲线上的各尖峰点代表三次独立实验的结果。
图8是用正常肝脏和肝脏疾病患者(慢性病毒性肝炎(CVH)、LC和HCC)的血清中的cAST的含量和酶活性获得的ROC曲线,以比较两种方法的特异性和灵敏度,一个方法基于cAST的含量,另一个方法基于酶活性,其中使用正常的健康样品和来自肝脏疾病患者的样品。在该图中,(A):所有合并的患者的数据;(B):CVH;(C):LC;和(D):HCC。黑线:cAST的含量;和虚线:AST的酶活性。
具体实施方式
本公开基于以下发现:可以通过检测血液中的胞浆天冬氨酸转氨酶(cAST)和线粒体天冬氨酸转氨酶(mAST)诊断肝脏疾病。
在一个方面中,本公开涉及cAST和mAST作为生物标记诊断肝脏疾病的用途。在本公开中,提供了用于肝脏疾病的诊断、预后或监测的试剂盒或组合物,所述试剂盒或组合物包括以定量或定性水平检测cAST和mAST的至少一种的试剂。
本文所用的术语“诊断”包括确定受试者的疾病或病症的易感性或受试者是否患有特定的疾病或病症。
本文所用的术语“预后”包括在患有特定疾病或病症的受试者中确定,例如,疾病的预过渡或过渡状态,如识别癌症的阶段或进展,或确定对癌症治疗的反应。
本文所用的术语“监测”包括观察正常受试者或怀疑患有疾病的受试者已发展疾病或治疗评价(therametrics)(例如,监测受试者的状态以提供关于治疗功效的信息)。
本公开的生物样品是包含或预计包含/表达一种或多种本发明的生物标记的物质或物质的混合物,并且包括生物体特别是人的细胞、组织或体液,例如全血、尿、血浆、血清,但不限于此。此外,该样品包括体外培养的细胞或组织以及直接来自生物体的细胞或组织。各种样品可以用于根据本发明的生物标记的检测。
在一种实施方式中,使用血液样品。本公开的血液样品包括从包括患者和正常人受试者的血液获得的相似细胞的集合。此外,可在本公开中使用的血液包括新鲜的、冷冻的和/或保存的血液或它们的任何组分。本公开中还包括血清、血浆和全血。
本公开中还包括血液、细胞或组织的部分或其衍生物。当使用细胞或组织时,它们可以原样使用或作为其溶胞产物使用。
本文所用的术语“肝脏疾病”是指因肝脏的全部或部分功能障碍的症状或病情,包括例如病毒源的急性或慢性肝炎、肝硬化、肝癌和肝细胞癌等。本公开还包括未以专用名鉴定,但可通过具有如GOP、GPT和/或γ-GTP异常值来鉴定的疾病。
本文所用的术语生物标记或诊断标志物指的是可以区分患病的组织或细胞与正常细胞或经处理的组织或细胞的试剂,包括蛋白质、mAST和cAST。在一个实施方式中,为了肝脏疾病的诊断、预后或监测,检测mAST和/或cAST的含量、浓度或水平。
本文所用的术语检测(detection)或检测(detecting)是指确定表达和/或表达谱中的数量、质量和/或变化。检测包括确定本发明标记的存在和/或不存在以及水平。可以使用本领域中已知的方法检测本发明的标记,并且本领域技术的人员能够容易地选择用于检测的适当方法。在一个实施方式中,使用特异性识别本公开的cAST或mAST的抗体。
可为各种检测方法使用或提供本公开的试剂盒或组合物。在一个实施方式中,ELISA、基于浸杆快速试剂盒的横向免疫层析、微阵列或免疫测定。
根据本公开的用于诊断肝脏疾病的标记的定量和定性分析可通过本领域已知的可定量或定性检测蛋白的多种方法来完成。例如,这些方法包括蛋白质印迹、ELISA、放射免疫测定、免疫扩散、免疫电泳、免疫染色、免疫沉淀反应、补体结合试验和阵列系统如蛋白质阵列如抗原阵列、在溶液/悬浮液中与跟踪抗体的结合、质谱分析法等。这些方法是本领域中已知的,并且可参考例如Enzyme Immunoassay,E.T.Maggio,ed.,CRC Press,Boca Raton,Florida,1980;Gaastra,W.,Enzyme-linked immunosorbent assay(ELISA),in Methods in Molecular Biology,Vol.1,Walker,J.M.ed.,Humana Press,NJ,1984;mass spectroscopy:Petricoin等.2002.Lancet 359:572-77;eTag systems:Chan-Hui等.2004.Clinical Immunology 111:162-174;microparticle-enhanced nephelometric immunoassay:Montagne等.1992.Eur J Clin Chem Clin Biochem.30:217-22.
在一个实施方式中,使用夹心系统如ELISA(酶联免疫吸附试验)或RIA(放射免疫测定)等的免疫测定可用于本标记的定量和/或定性检测。在该系统中,生物样品与固定于固体基片/载体如玻璃、塑料(例如,聚苯乙烯)、多糖、珠子、尼龙或硝酸纤维素膜或微孔中的初级抗体反应形成复合物,然后使该复合物与通常用可直接或间接地检测的试剂如放射性物质像3H或125I、荧光物质、化学发光物质、半抗原、生物素或毛地黄毒苷等标记的次级抗体反应。在一些情况下,标记物质缀合在存在适当底物的情况下能够产生颜色或颜色变化或发光的酶,如辣根过氧化物酶、碱性磷酸酶或马来酸脱氢酶。
也可以使用基于免疫反应的其它方法。在其他实施方式中,可以使用可基于抗原抗体反应检测生物标记的免疫电泳,如Ouchterlony板、蛋白质印迹、交叉IE、火箭IE、融合火箭IE或亲和IE;放射免疫测定;免疫扩散;免疫电泳;免疫染色;免疫沉淀反应;质谱;蛋白质微阵列或补体结合试验。
取决于所使用的具体方法,本公开的组合物和试剂盒可以包括各种检测试剂。例如,检测试剂如用于确定蛋白质的水平(浓度)和/或生物标记的存在。
在一个实施方式中,检测试剂包括与本发明的生物标记特异性相互作用的抗体、抗体片段、底物、适配体、亲和力多聚体受体或拟肽或受体或配体或辅因子。
在其他实施方式中,该检测试剂包括用于蛋白质印迹、ELISA、放射免疫测定、免疫扩散测定、免疫电泳、免疫组织化学、免疫沉淀反应、补体结合试验、质谱分析或蛋白质微阵列系统的试剂。
用于本文所描述的方法的试剂或材料是本领域中已知的。可以基于抗原-抗体反应;或与特异性识别本发明的生物标记的底物、肽适配体、受体、配体或辅因子反应或通过质谱法来检测本发明的生物标记。
与本发明的生物标记特异性结合或相互作用的试剂或材料可以在基于芯片的分析中使用或与纳米颗粒一起使用。
在一个实施方式中,使用采用单克隆抗体的免疫测定。单克隆抗体可以通过本领域中已知的方法来制备,例如通过融合法(Kohler和Milstein,European Journal of Immunology,6:511-519(1976))、重组DNA技术(美国专利号4,816,56)或噬菌体抗体库法(Clackson等,Nature,352:624-628(1991)和Marks等,J.Mol.Biol.,222:58,1-597(1991))。用于制备抗体的一般程序可见:Harlow,E.和Lane,D.,Using Antibodies:A Laboratory Manual,Cold Spring Harbor Press,New York,1999;Zola,H.,Monoclonal Antibodies:A Manual of Techniques,CRC Press,Inc.,Boca Raton,Florida,1984;和Coligan,CURRENT PROTOCOLS IN IMMUNOLOGY,Wiley/Greene,NY,1991)。例如,产生单克隆抗体的杂交瘤细胞的制备可通过使永生细胞系与产生抗体的淋巴细胞融合来进行,该制备方法是本领域中已知的,并且可以由本领域的普通技术人员毫无困难地实施。
在其他的实施方式中,免疫测定使用表1所列的针对cAST命名为HCC1至10,针对mAST命名为HCM1至10的抗体的任一种。通过将纯化的cAST和mAST重组蛋白注入到balb/c小鼠,随后通过细胞融合和筛选选择产生单克隆抗体的杂交瘤细胞可制备根据本公开的抗体。表征纯化的单克隆抗体并且归类为夹心配对。优选地,抗cAST和抗mAST抗体之间没有交叉反应。通过使用间接ELISA表征抗体、抗体分型和/或蛋白质印迹可选择表1中所列的抗体之间的配对。在一个实施方式中,作为配对抗体,使用作为抗cAST单克隆抗体的HCC4或HCC5,以及作为抗mAST单克隆抗体的HCM4或HCM8,但并不限于此。
在这方面,提供了2013年9月4日以KCTC 12483BP保藏于KCTC,特异性识别cAST的单克隆抗体。
在其他方面中,提供了2013年9月4日以KCTC 12485BP保藏于KCTC,特异性识别cAST的单克隆抗体。
本发明的试剂盒和组合物可用于各种检测方法。例如所述试剂盒或组合物可被提供或配制成ELISA试剂盒、免疫层析条试剂盒、化学发光试剂盒和试剂盒。
在一个实施方式中,本发明的方法、试剂盒和组合物用于ELISA,其中使用对本发明的生物标记特异性的抗体。本发明中使用的抗体以高亲和力特异性识别本发明的生物标记,并且与其他的生物标记无交叉反应性,其包括单克隆抗体、多克隆抗体或重组抗体。此外,当ELISA用于检测本发明的标记时,还可以利用对对照特异性的抗体。也可以使用用来检测捕获抗体的其他试剂,如标记的次级抗体、生色团、结合抗体的酶以及其底物或可以结合抗体的任何材料等。
在其他的实施方式中,本发明的试剂盒、组合物或方法也可以用于方法。
试剂盒,作为使用少量(10至20μl)的未经预处理的样品能够同时测定最多达100种的不同种类的分析物的高通量分析方法,是具有高灵敏度(pg单位)、短分析时间的分析方法,并且可替代现有的ELISA或ELISPOT。分析,作为在96孔板的每个孔中能够同时测定超过100种不同类型的生物材料的多重荧光微孔板测定法,通过使用两种激光检测器实时执行信号传输,区分并定量超过100个不同颜色组的聚苯乙烯珠。100个珠可以构成为可区分的,使得在一侧,红色荧光珠分被成为10个不同水平的荧光强度;在另一侧,橙色荧光珠被分为10个不同水平的荧光强度。此外,其之间的珠根据橙色和红色荧光的混合比具有特定强度,从而生成100种编码颜色的珠集合。此外,对待分析的标记具有特异性的抗体连接于每个珠上,因此通过免疫抗体反应使用这种珠可以定量生物标记。
能够进行本公开的分析的试剂盒包括对生物标记具有特异性的抗体。所使用的抗体对每个生物标记具有高特异性和高亲和力,并且针对其他生物标记几乎没有交叉反应性。这种抗体是单克隆抗体、多克隆抗体或重组抗体。此外,试剂盒还可以包括对对照组中的材料具有特异性的抗体。其他试剂盒还可以包括能够检测结合标记的抗体的试剂,例如,标记的次级抗体、生色团、酶(例如,与抗体缀合的)和其底物或其他能够结合抗体的其他材料。抗体可以是缀合微粒的抗体,并且进一步微粒可以着色胶乳或胶体金颗粒。
在其他实施方式中,本发明的试剂盒用作快速检验试剂盒,包括如用于诊断或检测的浸杆式免疫层析条。为此,试剂盒包括进行快速检验所需的必要要素,该快速检验可在5分钟内显示结果。免疫层析条可以包括(a)吸收样品的样品垫;(b)与感兴趣的样品的生物标记发生结合反应的结合垫;(c)在其上形成包括针对生物标记的单克隆抗体的反应线和对照线的反应膜;(d)吸收残余样品的吸收垫;和(e)支持或支撑材料。所使用的抗体对每个生物标记具有高特异性和高亲和力,并且针对其他生物标记几乎没有交叉反应性。这种抗体是单克隆抗体、多克隆抗体或重组抗体。另外,快速检验试剂盒可以包括对对照材料具有特异性的抗体。其他的快速检验试剂盒可以包括诊断所需要的其他材料,如能够检测结合的抗体的试剂,例如,固定有特异性抗体和次级抗体的硝基纤维素膜、与结合有抗体的珠相结合的膜、吸收垫和样品垫。在一个实施方式中,使用根据本发明的抗体。
本发明的试剂盒可以用于肝脏疾病的诊断、监测和/或预后。此外,通过确定患有肝脏疾病的患者中相应的生物标记的含量在治疗后是否恢复到正常范围内,可能确定和监测所使用的治疗的功效。
在这方面,提供了使用本发明的试剂盒或组合物,检测对有需要的受试者或样品中的肝癌具有特异性的生物标记的方法,以提供关于诊断、监测和/或预后肝脏疾病的信息。
在一个实施方式中,本发明方法包括下述步骤:确定有需要的生物样品和来自对照样品的cAST和/或mAST的至少一种的存在或水平;和比较来自上述步骤的结果与由对照样品确定的相应标记的结果;以及当与对照样品相比受试者中或样品中的生物标记的水平或存在有变化时,诊断或确定该受试者或样品为肝癌。
本文所用的术语“受试者”是指需要治疗的任何单个个体,包括人、牛、狗、豚鼠和兔。还包括未显示临床症状并且参与临床研究的任何受试者,或参与流行病学检验或用作对照的任何受试者。
在本发明的方法中,可以以定量和定性的方式分析生物标记。通过比较分析结果与来自对照的结果,本发明的方法可以有利地用于肝癌的诊断、监测或预后,或确定肝脏疾病的阶段。
根据一个实施方式,通过免疫学方法确定受试者的血清样品中的cAST和/或mAST的水平;并且所测定的值用于肝癌的诊断、监测和/或预后。
例如,参照对照组中确定的值可以确定对于特定的标记的截止值(在怀疑患病的样品中的生物标记的水平增加的情况下的上限)。然后该截止值用于诊断怀疑患病的受试者,当与截止值相比值增加约50%以上,约100%以上,受试者可以诊断为患肝脏疾病。然而,该值并不限于此,取决于分析所使用得特定的试剂和/或样品和/或方法的类型,其可以变化。因此,考虑如上所述的因素,可以确定具体的值。此外,通过确定患有肝脏疾病的患者的相应生物标记的水平在治疗后是否恢复到正常范围内,可能确定和监测所使用的治疗的功效。
本发明的方法可以单独使用或与常规方法组合使用。例如,对于诊断、预后或监测或为其提供信息,除了血液分析,也可使用其他的临床信息。其他的临床信息包括例如患者的年龄、性别、体重、饮食习惯或体重指数;或来自超声、计算机断层扫描、MRI、血管造影术、内镜下逆行胰胆管造影、超声内镜、癌症标记或腹腔镜的信息。
本公开基于测定血液中cAST和mAST的水平来检测受损的肝脏。
在这个方面,本公开涉及测定生物样品中,尤其血液中例如,全血、血清或血浆中cAST和/或mAST的浓度。
根据一个实施方式,本发明的方法包括下述步骤:提供特异性识别mAST和cAST的至少一种的单克隆抗体;有需要的受试者的血液样品与该抗体进行反应;以及确定血液中mAST和/或cAST的含量或浓度。
方法中使用的抗体和其它试剂如上所述。
参考下述实施例,进一步更详细地阐释本公开。但是,这些实施例绝不应解释为限制本发明的范围。
实施例
材料
对于蛋白质纯化,Ni-NTA琼脂糖购自Qiagen(德国),6×his标签抗体购自Takara(日本)。对于产生单克隆抗体,完全弗氏佐剂和不完全弗氏佐剂购自Life Technologies(美国)。胎牛血清(FBS)和Dubellco改良的Eagle培养基粉末购自Invitrogen公司(美国)。对于蛋白质印迹,ECL加蛋白质印迹检测系统购自Amersham Biosciences(瑞典)。X-Omat AR膜购自Kodak(美国)。对于同种型抗体,免疫纯化单克隆抗体分型试剂盒I购自Pierce(美国)。对于酶活性,GO和GP-转氨酶试剂盒购自Sigma diagnostics Inc(美国)。对于免疫荧光显微镜检查,盖玻片和载玻片购自Fisher Scientific(美国)。荧光封固剂购自Dako(丹麦)。
实施例1.天冬氨酸转氨酶的纯化
1-1.天冬氨酸转氨酶的表达和纯化
从人肝脏组织中分离人类肝脏胞浆天冬氨酸转氨酶(cAST)和线粒体天冬氨酸转氨酶(mAST)mRNA,并且通过RT-PCR由mRNA合成cDNA,然后将该产物克隆至TA克隆载体(Thermo Fisher Scientific,美国)中,并且然后克隆至含有6X His标签序列的pET21a(+)载体(Novagen,美国)中。然后,在该条件下(OD值:0.5-0.7;IPTG:0.1mm;孵育时间:3小时,温度:37℃)表达cAST和mAST重组体并通过Ni-NTA树脂纯化。通过蛋白质印迹证实纯化的蛋白质。
人cAST基因的长度为1,245bp,编码分子量为约45kDa的414个氨基酸。人mAST基因的长度为1,293bp,编码分子量为约47kDa的430个氨基酸。使用抗his标签IgG作为初级抗体通过蛋白质印迹证实重组蛋白。结果如图1中所示。
1-2.cAST和mAST重组蛋白的酶活性
人cAST和mAST是催化乙酸盐和α-酮戊二酸盐转化为草酰乙酸盐和谷氨酸盐或催化逆反应的同型二聚体酶。使用试剂盒(Sigma,USA),使用制造商的说明,检测重组蛋白的活性。重组cAST和mAST的活性经确定分别为1086IU/mg和843IU/mg。
实施例2.生成单克隆抗体
通过如下所述的方法,进行免疫、细胞融合和筛选杂交瘤细胞。简言之,用纯化的重组cAST或mAST注射6-8周龄的Balb/c小鼠。然后,进行细胞融合和筛选来选择总数为20个cAST和mAST的单克隆杂交瘤细胞系。然后,将20个细胞系的细胞腹腔注入小鼠(6-8周的Balb/c)中,从小鼠中回收腹水。腹水经纯化以回收20个单克隆抗体。抗cAST抗体命名为HCC1至HCC10,抗mAST单克隆抗体命名为HCM1至HCM10。
2-1.完全和不完全Dulbecco改良的Eagle培养基(DMEM)制备
两袋粉状培养基溶于约1700ml双蒸水(DDW)并用DDW洗袋以确保所有的粉末溶于DDW中,然后将7.4g碳酸氢钠添加到该溶液中。用0.5N HCl将培养基调节到pH6.9,配制成2000ml,并在洁净的工作台中通过0.45μm尺寸的过滤灭菌单元进行灭菌。将450ml培养基、50ml胎牛血清(FBS)和5ml青霉素-链霉素原液添加到四个灭菌瓶中,该培养基是完全Dulbecco改良的Eagle培养基(完全DMEM);将200ml灭菌的培养基添加到一个瓶中,该培养基称为不完全Dulbecco改良的Eagle培养基(不完全DMEM)。在4℃储存这些培养基。
2-2.制备和注射抗原
经上所述纯化重组cAST和mAST蛋白质。分别用经等体积完全弗氏佐剂乳化的0.3ml cAST和mAST(150μg)腹腔内免疫6至8周龄的Balb/c小鼠。第一次注射之后,以2至3周的间隔强化注射相同量的经不完全弗氏佐剂乳化的免疫原三或四次。在第三次注射后,通常从小鼠的尾部取血清,进行抗体效价测定。在细胞融合前3或4天给予无佐剂的最终强化。
2-3.制备用于融合的细胞
2-3-1制备骨髓瘤细胞
在细胞融合前四天,从液氮罐中取出冷冻的SP2/O细胞,并在37℃水浴中尽可能快地解冻,将30ml不完全DMEM添加到解冻后的细胞,然后以1500rpm离心1分钟使细胞旋转沉淀,然后轻轻倒出不完全DMEM,悬浮于完全DMEM中,并转移至75ml烧瓶中,在37℃、5%CO2恒温箱中生长。每隔一天传代细胞。当细胞融合完成时,将SP2/O细胞转移到50ml无菌管中并在1500rpm离心1分钟使细胞旋转沉淀,轻轻倒出所有上清液,用20ml不完全DMEM使沉淀颗粒悬浮。对于每一个融合实验,使用5×107个细胞。
2-3-2制备饲养细胞
在细胞融合的前一天制备饲养细胞。在CO2接触湮灭后通过颈脱位法处死12至18周龄小鼠(任何小鼠品系)并用70%乙醇彻底擦拭,小心地除去其腹部皮肤。将5ml冰冷的11.6%蔗糖溶液注射到腹膜腔中,获得约4ml所注射得溶液,并且通过在1500rpm下离心1分钟收集腹膜细胞。将细胞悬浮于60ml的完全DMEM(添加了50X HAT)中,并且向96孔细胞培养板的各孔中添加2滴溶液,通常需要5个板。如果饲养细胞被红细胞污染,制备新的制剂。在37℃、5%CO2恒温箱中培养饲养细胞。
2-3-3制备脾细胞
在CO2暴露湮灭后通过颈脱位法处死用抗原注射的小鼠,并用70%乙醇彻底擦拭。用无菌剪刀和镊子沿胸部到颈部的中线切割皮肤,去除脾外面的脂肪,然后将脾置于含有10ml不完全DMEM的无菌培养皿中。然后通过用细镊子撕开脾使脾细胞释放到培养基中,将细胞置于15ml无菌离心管中。
2-3-4细胞融合过程
将所制备得脾和SP2/O细胞悬浮液合并在一起并在1500rpm下离心1分钟。然后通过颠倒离心管将上清液完全除去。然后通过敲击管将细胞沉淀颗粒混合,在37℃下恒定涡旋,在90秒内将1ml 50%PEG1500缓慢添加到该管中。使得融合过程在37℃下继续另外90秒。就在添加第一滴PEG溶液后3分钟时,通过添加完全DMEM停止融合反应。为了避免渗透压休克,在头一分钟缓慢添加10ml完全DMEM,在1.5分钟的时间段内添加共30ml完全DMEM。然后通过在1500rpm下离心1分钟收集细胞,除去所有上清液。然后将沉淀颗粒悬浮于60ml HAT完全DMEM中。向所制备的含有饲养细胞的板的各孔中添加两滴该细胞悬浮液。然后在37℃、5%CO2恒温箱中培养细胞。
细胞融合后六天,通过抽吸除去培养上清液,向各孔中添加两滴HAT完全DMEM。从融合后4天开始在倒置显微镜上检测杂交瘤克隆,然后在改变培养基一天后,细胞用于筛选抗体。
2-3-5筛选杂交瘤克隆
进行间接酶联免疫吸附试验(ELISA)以筛选杂交瘤克隆。在PBS中将抗原稀释到2μg/ml的最终浓度,向RIA板的每个孔中添加50μl稀释后的抗原。然后板经覆盖并在恒温箱中在37℃下孵育2小时或4℃过夜。轻轻到出包被溶液,用PBST(PBS中0.3%吐温20)洗涤该板三次。然后通过每孔添加300μl封闭液(通过5μm滤膜过滤后的500ml PBS中11.1ml 45%明胶、25g蔗糖和1ml 10%的叠氮化钠溶液)封闭包被的孔中剩余的蛋白结合位点。平板在37℃下孵育1小时。用PBST洗涤该板三次。将50μl杂交瘤细胞的培养上清液添加到板的每个孔中,并在恒温箱中在37℃下孵育1小时,用PBST洗涤该板三次。然后就在使用前将50μl缀合辣根过氧化物酶(HRP)的次级抗体以(根据制造商的)最佳浓度直接稀释于稀释缓冲液(通过5μm滤膜过滤后的500ml PBS中11.1ml 45%明胶和1.5ml的吐温20)中。用粘附塑料覆盖板,并在恒温箱中在37℃下孵育1小时。用PBST洗涤板三次并且向溶液中添加50μl底物3,3’,5,5'-四甲基联苯胺(TMB)并在室温下孵育15分钟。然后向各孔中添加50μl终止液(0.2N硫酸)。用酶标仪读取OD。
然后将阳性克隆转移至24孔板,向每个孔添加1ml HT完全DMEM。两天后,通过如上所述的间接ELISA筛选克隆。将阳性克隆转移到6孔板,并且最后在组织培养瓶(75cm2)中生长并在液氮中冷冻。冷冻所有的阳性克隆并在克隆前解冻。
2-3-6冷冻细胞
通过在1500rpm下离心1分钟收获并收集培养瓶(75cm2)中生长的细胞,彻底除去上清液。将细胞悬浮于1ml冷冻培养基(90%的FBS混合10%的二甲基亚砜(DMSO))中并转移到冷冻瓶中。将冷冻瓶放入NALGENETM Cryo 1℃冷冻箱中并放置于深度冷冻器(-70℃)中2小时。然后将瓶保存于液氮罐中。发现放置在深度冷冻器中超过3小时的细胞当解冻时具有低的生活力。
2-3-7通过有限稀释克隆
用PBS稀释对数生长期的杂交瘤细胞,并且使用Neubauer细胞计数器确定细胞数,以及通过用HT完全DMEM连续稀释调整到每毫升15个细胞。用10ml移液管将两滴细胞悬浮液施加到96孔板的每孔中,每孔含有100μl在有限稀释前一天制备的饲养细胞。6天后,用100μl HT完全DMEM替换各孔的上清液。第二天,使用间接ELISA筛选杂交瘤细胞。选择阳性菌落并将其转移到24孔板中。两天后,筛选克隆并选择用于第二次有限稀释的阳性克隆。最后,在液氮中冷冻阳性克隆。
2-3-8产生腹水
为了诱导肿瘤,首先用0.5ml姥鲛烷注射BALB/c小鼠。一个星期后,将0.5ml灭菌的PBS中的1×107个细胞腹腔内注射到小鼠中。通常在一周后出现肿胀的腹部。然后在罐中用甲氧氟烷麻醉小鼠3分钟,通过将18号针插入小鼠的腹部将腹水收集在50ml离心管中。最后,通过颈脱位法处死小鼠。在室温下使管静置30分钟,并且在3000rpm下离心10分钟。将上清液移入新的15ml管中,添加0.2%叠氮化钠并在-20℃下储存。
2-3-9从腹水纯化单克隆抗体
对于mAb的纯化,在3000rpm下离心3ml腹水20分钟,并且用PBS2倍稀释上清液。通过添加等体积的饱和硫酸铵并在温和的搅拌下混合30分钟沉淀单克隆抗体(mAb),并且在15,000rpm下离心溶液20分钟。将沉淀颗粒悬浮于3ml的PBS中并用PBS透析四次,每4小时更换PBS。制备柱,在将G蛋白淤泥施加到柱(1ml填充体积)中后,用5体积0.1M甘氨酸(pH 2.6)洗涤G蛋白。然后用磷酸缓冲液(50mM磷酸盐、500mM氯化钠,pH 6.0)彻底洗涤柱。在15000rpm下离心透析后的溶液30分钟,以除去不溶的聚集体,将上清液施加到柱上,允许流通(flow through),以缓慢地流动。用如上所述的相同磷酸缓冲液彻底地洗涤柱,并且用0.1M甘氨酸(pH 2.6)洗脱抗体。通过添加0.5M磷酸(氢二)钠中和洗脱后的抗体。用PBS透析该抗体。通过Bradford检验测定mAb的浓度。
实施例3.单克隆抗体的表征
对如实施例2所制备的抗体进行了表征。由杂交瘤细胞系产生的cAST和mAST单克隆抗体分别命名为HCC1-HCC10和HCM1-HCM10。进行间接ELISA、抗体分型和蛋白质印迹。
结果如表1所示。在10种单克隆抗体中,选择两种单克隆抗体HCC4和HCC5作为检测cAST的最佳匹配对,其中HCC4用作捕获抗体和HCC5用作检测抗体。在mAST的情况下,分别选择HCM4和HCM8作为捕获抗体和检测抗体。然后在此实施例中使用这四种抗体。cAST单克隆抗体HCC4(cAST 1A2C6)、HCC5(cAST,5C3F8)于2013年9月4日保藏于韩国典型培养物保藏中心,保藏编号为KCTC 12483BP和KCTC 12484BP,mAST抗体HCM4(mAST,2E6D1)于2013年9月4日保藏于韩国典型培养物保藏中心,保藏编号为KCTC 12485BP。
表1
在表1中,术语HCC表示抗cAST抗体,HCM表示抗mAST抗体;a和b分别表示在cAST ELISA中使用的捕获和检测;c和d分别表示在mAST ELISA中使用的捕获和检测。
3-1.单克隆抗体的效价
通过间接ELISA检测纯化的Ab的滴度,间接ELISA以如上所述相同的方式进行,不同之处是初级Ab从培养上清液变为纯化的Ab(2μg/ml)。
3-2.mAb同种型
根据制造商的说明书,通过ImmunoPure单克隆抗体分型试剂盒确定mAb的同种型。
3-3.蛋白质印迹分析
通过SDS-PAGE分离蛋白。在此实施例中,使用半干转法将蛋白从凝胶转移到硝酸纤维素膜上。SDS-PAGE完成前20分钟,将四片滤纸和一片硝酸纤维素膜浸入转移缓冲液(50mM Tris、40mM甘氨酸、0.04%SDS、10%甲醇)中,当SDS-PAGE完成时,将凝胶放在硝酸纤维素膜上,在120mA下持续35-40分钟使蛋白质转移至硝酸纤维素膜上,使用TBST(10mM Tris、150mM NaCl 0.3%、20)洗涤膜一次,印迹用封闭液(10mM Tris、150mM NaCl、0.05%Tween 20、5%低脂奶,pH8.0)封闭1小时。用TBST洗涤膜3次(10分钟间隔)之后,在室温下将印迹与初级mAb溶液(0.2-1μg/ml)一起孵育1小时,或4℃下孵育过夜,用TBST洗涤3次(10分钟间隔)。在室温下用缀合HRP的山羊抗小鼠IgG处理印迹小时,并且用TBST洗涤膜3次(10分钟间隔)。在化学发光试剂(SuperSignal化学发光底物,Pierce)中孵育印迹5分钟,转移至暗盒,曝光1分钟。该膜在显影试剂中显影并用固定试剂固定。
3-4.抗cAST抗体和抗mAST抗体的特异性
人天冬氨酸转氨酶同工酶由两个不同的基因编码,但是这两种酶的氨基酸序列具有约46%的同一性。因此,抗cAST Ab可能结合mAST蛋白,抗mAST Ab可能结合cAST蛋白。为了测定抗cAST抗体和抗mAST抗体的交叉反应性,进行间接ELISA和蛋白质印迹。结果如图2所示。在图2中,(A)是间接ELISA的结果,其中将抗原cAST和mAST包被在板上,使用抗cAST(HCC4)和抗mAST(HCM4)作为初级抗体:1:cAST包被;2:mAST包被。(B)是蛋白质印迹分析,其中:a:SDS-PAGE;b:初级抗体HCC4;c:初级抗体HCM4;1:cAST包被;2:mAST包被。结果表明,抗cAST抗体和抗mAST抗体之间没有交叉反应性。
3-5.肽图谱
将30ml重组蛋白溶液(0.1mg/ml,0.45%吐温20、0.5%TritonX-100)添加到1.5ml管中,并且向溶液中添加0.1μL蛋白酶(QIAGEN),并通过移液管吸取进行混合。混合物在37℃下孵育10分钟,并且向其中添加2x处理缓冲液,以及将它煮沸5分钟。然后,向SDS-PAGE的每个孔加载3μl溶液。然后,如实施例3-3所述进行蛋白质印迹。
结果如图3所示。发现针对cAST的单克隆抗体分成4个不同的组(图3A)。HCC1、HCC2、HCC3、HCC5、HCC6、HCC7和HCC9属于一个组。HCC4、HCC8和HCC10的每一个代表一个组。这表明HCC4和HCC5识别不同的肽片段,HCC4和HCC5结合不同的表位,并且可在免疫夹心法中用作一对。
发现针对mAST的单克隆抗体分为2组(图3B)。HCM1、HCM3、HCM4、HCM5、HCM6、HCM7、HCM9和HCM10表现出相同的免疫学染色模式,表明它们属于一个组。HCM2和HCM8形成另一个组。这表明HCM4和HCM8属于两个不同的组,因此它们可在免疫夹心法中用作一对来测定人血清中的mAST。
实施例4.抗cAST和抗mAST分别特异性结合cAST和mAST
4-1.mAb缀合胶体金
用0.05M硼砂-硼酸缓冲液(pH9.0)将胶体金溶液的pH调节至pH 9。测定胶体金溶液与mAb的最佳比例。10ml胶体金溶液(pH9.0)与mAb溶液混合,同时在室温下搅拌15分钟。以1%的最终浓度添加10%BSA,并搅拌该溶液15分钟。然后在4℃,9000rpm下离心该溶液30分钟,除去上清液,并且添加相同体积的缓冲液(经0.2μm尺寸过滤器过滤后的,25mM Tris-Cl、1%BSA、0.02%NaN3)使沉淀颗粒悬浮。在4℃,9000rpm下离心溶液30分钟,除去上清液,添加相同体积的缓冲液,重复如上所述相同的步骤。添加1ml缓冲液,使沉淀颗粒悬浮,并储存于4℃冰箱中直至使用。
4-2.通过胶体金缀合物分别测定血清中的结合重组cAST和mAST、以及cAST和mAST的mAb
将50μl缀合mAb的胶体金添加到6个1.5ml Eppendorf管的每一个中,并且将50μl用PBS稀释的不同浓度的溶液或血清中的重组cAST添加到6个管的每一个中。通过轻敲试管混合该溶液,并且在37℃下恒温箱中孵育2小时。在9000rpm下离心试管30分钟,并且除去上清液。用PBS使沉淀颗粒悬浮,并且在9000rpm下离心30分钟。通过添加200μL天冬氨酸转氨酶的底物稀释沉淀颗粒,并且将该溶液转移到15ml管中,以及在37℃下恒温箱中孵育1小时。将200μl显色试剂添加到反应溶液中以显色并在室温下孵育20分钟。然后将2ml 0.4N NaOH溶液添加到该溶液中停止反应。用紫外分光光度计读取OD。用血清中的重组mAST和cAST完成相同的实验。
4-3.测定人的AST同工酶的活性
从在知情同意的情况下,在Hallym医院登记的肝癌患者中获得用于该研究的血清样品(慢性病毒性肝硬化(CVH)、肝硬化(LC)和肝细胞癌(HCC))。这些血清保存在-70℃直到使用。进行免疫沉淀反应以测定血清中cAST和mAST的活性。含有50μl G蛋白琼脂糖珠(Sigma)的两个管与10μl cAST Ab(1mg/ml)或mAST Ab(1mg/ml)混合,并在4℃下孵育1小时。进行离心以除去上清液,然后用1×PBS洗涤沉淀颗粒并且离心,重复该步骤2次。在4℃用牛奶(在1X PBS中5%)封闭两个缀合的G蛋白抗体复合物1小时,并如上所述洗涤。将这两个复合物与200μl血清一起孵育12小时,同时在4℃下搅拌。在如上所述的离心后,使用上清液测定活性。
4-4.通过蛋白质印迹确定结合血清中AST同工酶的mAb
进行蛋白质印迹分析以确定本发明的mAb可以识别血清中的AST同工酶,并比较正常的和肝癌患者的血清样品中的AST同工酶的含量。
4-5.免疫荧光显微镜
在本实施例中使用表达cAST的肝癌细胞系,HepG2。HepG2细胞在含有10%FBS的完全DMEM中,供给7.0%的CO2生长。对于复苏,用移液管弃去培养基,并且添加10ml PBS洗涤细胞。将3ml 0.05%的胰蛋白酶-EDTA(1X,Invitrogen)添加到培养皿中,并且在37℃下处理细胞3分钟。然后轻轻摇动培养皿直到大部分细胞从底部脱离。通过在1500rpm下离心1分钟收集细胞。彻底地轻轻倒出上清液,并且将细胞悬浮于10ml完全DMEM中,并转移到新的培养皿中。
玻璃盖玻片(12mm圆,Fisher Scientific)经灭菌并被放置在24孔组织培养板中。将HepG2细胞接种在板上,生长直到大约70%的汇合。将培养基从孔中吸出,用PBS简单地漂洗细胞3次,每次5分钟,并且在室温下用PBS中的4%多聚甲醛固定15分钟。用PBS将细胞漂洗三次,每次5分钟,用冷甲醇(-20℃)透化5分钟。用封闭液(PBS中的3%BSA,0.1%Triton X-100)封闭细胞,并且在室温下孵育1小时。用PBS洗涤盖玻片三次,每次5分钟。初级抗体用封闭液稀释并添加到各孔中,并且在室温下孵育1.5小时或在4℃下过夜。如上所述洗涤盖玻片。将在封闭液中稀释的缀合荧光染料的次级抗体添加到各孔中,并且在黑暗条件下在室温下孵育1小时,并且如上所述洗涤。将4',6-二脒基-2-苯基吲哚(DAPI,0.1μg/ml)添加到每个孔中,孵育2分钟,并且如所上洗涤。盖玻片置于具有荧光封固剂(DAKO)的载玻片的顶部,并且在黑暗条件下在室温下孵育1小时。在荧光显微镜(Carl Zeiss,EL-Einsatz,德国)下分析荧光信号。
4-6.用蛋白质印迹定位hepG2细胞中的AST同工酶
如上所述培养HepG2细胞2天并收获。然后将200μl的PBS添加到细胞中,然后将其均质化。然后在15000rpm下离心全部溶胞产物的一半30分钟。将上清液转移到新的管中,并且用等体积的PBS将沉淀颗粒再悬浮。然后,通过蛋白质印迹分析全部溶胞产物、上清和沉淀颗粒。结果如图4所示。如图4所示,在胞浆部分中检测到cAST和在沉淀颗粒中检测到mAST,在细胞染色中cAST存在于胞浆中。
实施例5.人肝脏组织中cAST的分布
为了定位人肝脏组织中的cAST,如下进行免疫组织化学。使用商购的石蜡包埋的人肝脏组织切片(Superbiochip co.Ltd,韩国)。首先,进行脱蜡和水合,将载玻片放入二甲苯,并且在通风橱中轻轻振荡5分钟,然后转移到新鲜的二甲苯中,并且振荡5分钟。载玻片在100%、90%、80%和70%的乙醇中各自水合2分钟,并且浸入自来水中10分钟。将预温热的胃蛋白酶溶液(在37℃水浴中)添加到每个组织载玻片上3分钟,并且用TBST漂洗5次。将过氧化物酶封闭溶液添加到每个载玻片,孵育10分钟,并且用TBST漂洗5次。然后加入封闭血清,培养10分钟,用TBST漂洗5次。然后将用PBS稀释的初级抗体添加到载玻片上,并且在室温下孵育2小时或在4℃下过夜,并且用TBST洗涤5次。然后添加缀合生物素的次级Ab,并且孵育10分钟,以及用TBST漂洗5次。添加抗生物素蛋白HRP溶液,孵育10分钟,用TBST漂洗5次。添加DAB溶液,孵育30-60秒,并且浸入自来水中停止反应。将载玻片浸入苏木精中1分钟,同时振荡孵育,然后用自来水冲洗10分钟。然后将载玻片浸于盐酸溶液(1L 70%乙醇中的1ml原始盐酸)中1秒,并且用自来水冲洗10分钟,然后浸入氨中2分钟。载玻片在80%、90%和100%乙醇中各自脱水2分钟。用二甲苯漂洗载玻片2次,并且振荡的同时孵育2分钟。用纸巾除去过量二甲苯后,将封固剂(Abcam公司)添加到组织上,并且将盖玻璃放置到组织上。最后,在显微镜(Sony,日本)下观察载玻片。结果如图6所示。如图6所示,在肝细胞中检测到强的cAST反应性。
实施例6.测定血清中AST同工酶的含量
6-1.mAb的生物素化
为了用生物素标记mAb,将10μg生物素(EZ-LinkTM NHS-LC-LC-生物素,Pierce)和250μg mAb溶解在500μL PBS中。将混合物在冰上孵育4小时,每半小时进行涡旋。然后在4℃下用PBS透析混合物。
6-2.夹心ELISA
为了确定血清中cAST水平,如下进行夹心ELISA。将50μl由PBS稀释的mAb(2μg/ml)涂覆到EIA板上,并且将该板在37℃孵育2小时或在4℃过夜,并且用PBST洗涤3次。将封闭液添加到每个孔中,并且在37℃下孵育1小时,并且用PBST洗涤3次。将50μl重组cAST或全血清添加到各孔中,并且在37℃下孵育1小时,并且用PBST洗涤3次。将50μl通过稀释缓冲液稀释的缀合生物素的mAb溶液(2μg/ml)添加到孔中,并且在37℃下孵育1小时,并且用PBST洗涤3次。涂覆50μl抗生物素蛋白HRP溶液,并且在37℃下孵育1小时,并且用PBST洗涤3次。使用50μL底物,TMB进行显色,并且静置15分钟,然后添加相同体积的终止溶液。用酶标仪读取OD(波长:450nm)。
实施例7.使用免疫学方法测定血清中cAST和mAST的水平
7-1.用于测定cAST和mAST水平的标准曲线
为了测定血清样品中的cAST和mAST水平,通过夹心ELISA系统,使用不同浓度(从0至400μg/l cAST或mAST)的重组蛋白cAST或mAST获得标准曲线。健康的正常血清,其AST酶活性为10IU/L,用PBS稀释5倍,掺入已知浓度的cAST或mAST,并且用作校准标准血清。在曲线中,在y轴上标绘450nm的OD,而在x轴上标绘重组cAST或mAST浓度。观测到这两个参数之间可靠的相关系数(r:0.999和0.998),以及在整个测定范围内显示良好的线性关系(图7A,B)。发现每个浓度下三次独立实验的变异系数(CV)都<10%。进行不精确性试验和恢复试验来评估夹心ELISA系统的分析性能。对于cAST分析系统,日内和日间不精确性分别为2.54-7.15%(对3个样本10次重复的测试)和3.92-8.34%(对3个样本测试并且连续5天分析),发现分析恢复为93.1-101.3%。对于mAST分析系统,日内和日间不精确性分别为2.95-8.38%(对3个样本10次重复的测试)和6.52-9.08%(对3个样本测试并且连续5天分析),发现分析恢复为94.0-103.3%。这些结果表明,使用抗体测定cAST和mAST的水平提供了可靠的结果,因此可以成功地用于临床样品检验。
7-2.测定健康人和患有肝脏疾病的患者的血清cAST和mAST水平(1)
当人肝脏受损时,cAST和mAST被释放到血流中。从而为了证明用各自的抗体可以检测血清中所释放的cAST和mAST,使用本发明抗体进行蛋白质印迹。结果如图5所示。如图5所示,在健康人的血清中没有检测到带。与此相反,在来自肝癌患者的血清中检测到对应cAST和mAST的带。
7-3.测定健康人和肝脏疾病患者的血清cAST和mAST含量(2)
在从健康人和患有不同肝脏疾病的患者中收集血清样品之后,分别使用夹心免疫测定法和Hitachi 747自动分析仪,并行测定血清AST的水平(含量)和酶活性。就在分析前用PBS将所有的血清样品稀释5倍。如表2所示,健康对照(N=25)、CVH(N=24)、LC(N=21)和HCC(N=22)的cAST水平的平均值(SD)分别为40.5(38.6)、228.9(165.6)、255.3(154.8)和327.6(137.9)μg/l。健康对照(N=25)、CVH(N=24)、LC(N=21)和HCC(N=22)的mAST水平的平均值(SD)分别为10.1(6.1)、11.9(12.8)、9.7(15.9)和10.4(8.7)μg/l。也就是说,发现健康的正常样品中的cAST的平均水平为40.5±38.6μg/L。然而,在CVH、LC和HCC中,发现cAST的平均水平分别为228.9±165.6μg/L、255.3±154.8μg/L和327.6±137.9μg/L。发现健康的正常样品中的mAST的平均水平为10.1±6.1μg/L。然而,在CVH、LC和HCC中,发现cAST的平均水平分别为11.9±12.8μg/L、9.7±15.9μg/L、10.4±8.7μg/L。这些结果表明,可通过测定cAST和mAST的水平来诊断肝脏疾病。
表2
a数据表示连续变量的平均值(SD)。
7-3.血清中的cAST的ROC曲线分析
进行ROC曲线分析以比较本发明的方法和常规酶活性方法的性能。对于酶活性测试,因为cAST占血清中总AST的80-90%,测定AST的酶活性,因此不会影响结果。
为此,针对合并在一个ROC曲线的所有患者或根据肝脏疾病类型的单独的患者群组,分析cAST的水平和酶活性。结果如表3及图8所示。如其中所示,AUC的统计比较表明,两个测定方法之间存在一些不同。基于ROC曲线确定了两个分析方法的最佳截止值。在不同的患者组中酶测定法的截止值彼此相似。测定水平的分析中的截止值,在除了HCC组(108.8μg/l)之外的所有组中无显著变化。借助于所确定的截止值,发现除了HCC组之外测定水平和酶活性之间的特异性相同。对于灵敏度,发现测定水平的灵敏度比测定酶活性的高,特别是对于HCC患者组,其中,所测试的两种方法之间的灵敏度和特异性都显示出显著的差异。通过测定水平和酶活性所确定的灵敏度分别为0.955和0.864,特异性分别为0.96和0.92。这些结果表明,在诊断肝脏疾病时,测定cAST和/或mAST的水平比测定其活性更有效。
表3
在表3中,p<0.001被认为是统计学上显著的。
实施例8.统计分析
使用Microsoft Excel程序获得标准曲线方程和相关系数(r)。使用MedCalc 6.12版本的软件程序(MedCalc,Mariaekerke,比利时)进行ROC曲线分析。使用学生t检验和具有Bonferroni调整的ANOVA计算平均数之间的统计学差异。Pearson相关系数和用最小二乘法的线性回归用来评价患者组和对照组之间的相关性。认为<0.05的p值是统计学上显著的。为了评估并比较用于区分患有肝脏疾病的不同患者组的血清ALT的免疫测定和酶活性测定的诊断准确性,通过绘制真阳性(灵敏度)和假阳性(1-特异性)产生ROC曲线,并且用于计算截止值和曲线下面积(AUC)。
为清楚起见,本文中可能明确阐释了各种单数/复数对换。虽然已示出并描述了本发明的几个实施方式,但本领域技术人员可以理解,在不背离本发明的原理和精神的情况下,这些实施方式可进行变化,本发明的范围由权利要求及其等同方式限定。
除非另外定义或以其它方式解释,本文使用的所有的技术和科学术语以及任何缩写具有与本发明的领域中的普通技术人员一般所理解的相同含义。
抗体保藏信息
保藏机构:韩国典型培养物保藏中心
保藏编号:KCTC12483BP
保藏日期:2013年09月04日
保藏机构:韩国典型培养物保藏中心
保藏编号:KCTC12484BP
保藏日期:2013年09月04日
保藏机构:韩国典型培养物保藏中心
保藏编号:KCTC12485BP
保藏日期:2013年09月04日
- 还没有人留言评论。精彩留言会获得点赞!