牛奶中青霉素药物的表面增强拉曼检测方法与流程
本发明涉及牛奶中青霉素药物的检测方法。
背景技术:
青霉素属于β-内酰胺类抗生素药物,是治疗各种细菌感染性疾病使用最广泛且高效的抗菌药物之一,在人类的疾病治疗和畜牧业养殖方面大量使用。然而,抗生素的滥用现象却普遍存在,青霉素的滥用可以引起严重的过敏反应和细菌耐药性,甚至造成人的死亡。在畜牧养殖方面,青霉素药物常常被用来预防和治疗奶牛乳腺炎等疾病,因此在牛奶中会有青霉素残留,对人类健康构成了潜在的危害。为了确保食品安全,开展食品中痕量青霉素药物分子残留的检测研究是十分必要的,特别是牛奶中青霉素药物分子的检测。从传统意义上讲,牛奶中青霉素药物残留的分析方法主要有高效液相色谱法、生物传感器法及荧光偏振分析法等。但是这些方法却存在一些局限性。
在2002年第468期的《分析化学》(Analytica Chmica Acta)的文章《一种基于羧肽酶活性抑制的生物传感器法定量检测牛奶中的青霉素G》(Biosensor analysis of penicillin G in milk based on the inhibition of carboxypeptidase activity)公开了一种检测牛奶中的青霉素G的方法。该方法利用的是具有羧肽酶活性的微生物受体蛋白作为探针分子,选择性地检测牛奶中具有活性、完整β-内酰胺环结构的青霉素G抗生素药物。他们采用表面活性剂P-20及胺偶联试剂盒对牛奶样品进行纯化处理,其中使用多克隆抗体(R513)作为生物传感器的特异性识别抗体对牛奶中的青霉素G(抗原)进行选择性定量检测。通过这一技术,牛奶中青霉素G药物的检出限可以达到2.6μg kg-1。这种检测方法的缺点在于不仅生物样品制备过程复杂且不易保存,而且样品前处理成本高且检测时间过长。
2013年第141期的《食品化学》(Food Chemistry)报道了一种基于高效液相色谱-二极管阵列(HPLC-DAD)同步检测绵羊奶中的九种抗生素药物的方法(An HPLC-DAD method for the simultaneous determination of nineβ-lactam antibiotics in ewe milk),包括青霉素G、氨苄西林、头孢氨苄、头孢唑林、头孢哌酮、氯唑西林、双氯西林、苯唑西林及青霉素V。其中抗生素残留的提取方法是通过乙腈离心和固相萃取(SPE)及0.45μm微孔滤膜过滤过程对绵羊奶样品中的蛋白质进行纯化处理的。所有这些化合物的定量限(LOQs)均在3.4~8.6μg kg-1范围。这种检测方法的缺点在于实验操作过程复杂,样品前处理过程耗时且检测成本高,大大限制了它在实际分析领域中的应用。
2014年第7期的《美国奶业协会》(American Dairy Science Association)的文章《利用超高效液相色谱-飞行时间质谱联用技术对牛奶中青霉素类药物降解副产物的研究》(Research on degradation of penicillins in milk byβ-lactamase using ultra-performance liquid chromatography coupled with time-of-flight mass spectromety),公开了采用超高效液相色谱-飞行时间质谱联用技术在β-内酰胺酶存在下通过研究牛奶中青霉素类药物(包括青霉素G、青霉素V及氨苄青霉素)的降解副产物反过来定性分析牛奶中含有的青霉素类药物的方法。该方法中加标牛奶样品的预处理操作如下:通过向2mL加标牛奶样品中直接添加10mL乙腈:水(v/v,3:1)混合液,在3050×g下离心10min,取出上清液在40℃氮气流下进行干燥得到固体残余物,再将所获得的残余物溶解于2mL纯化水中并使用0.45和0.22μm的混合纤维树脂微孔滤膜进行过滤。经预处理后方可进行下一步的检测操作;预处理操作主要是为了去除牛奶中的蛋白质等大分子干扰物质。这种检测方法的缺点在于不仅不能进行定量分析,而且操作步骤繁琐、分析检测时间长且成本高。
2016年第190期的《食品化学》(Food Chemistry)的文章《利用荧光偏振方法检测牛奶中青霉素G的方法》(A novel fluorescence polarization assay for determination of penicillin G in milk)报道了一种基于青霉素G与适当红色染料共轭标记生产的青霉素抗体(生物传感器)定量检测牛奶中痕量青霉素G的荧光偏振分析法。他们利用纯化试剂盒对牛奶样品进行预处理,使用羊抗兔多克隆抗体(二次抗体)作为牛奶中青霉素G药物(抗原)的特异性识别抗体。该文献所提出的荧光偏振分析方法可以直接用于牛奶中青霉素G的检测而不受牛奶中其他物质的干扰。通过这种方法,其检出限可以达到1nmol/L,这要比欧盟(EU)规定的最大残留量12.0nmol/L少。这种检测方法利用纯化试剂盒进行前处理,使用辣根过氧化酶标记的羊抗兔多克隆抗体(二次抗体)构建生物传感器,实验成本大大增加。
到目前为止,基于表面增强拉曼散射技术对牛奶中青霉素药物分子进行检测的研究尚未见报道。
技术实现要素:
本发明提供一种牛奶中青霉素药物的表面增强拉曼检测方法,克服现有技术的缺陷,填补SERS技术在牛奶中青霉素药物分子检测方面的空白,为牛奶中青霉素类药物分子及β-内酰胺类药物分子的分析检测提供新的思路。
本发明的牛奶中青霉素药物的表面增强拉曼检测方法,按以下步骤进行:
一、制备具有SERS活性的银纳米粒子(Ag NPs)溶胶,然后利用层层自组装技术在玻璃基片上制备Ag NPs组装基底;
二、向待测牛奶样品中添加有机物/水混合溶剂,超声处理2~5min,再离心分离处理10~20min,移出上清液在室温下自然蒸发至干得到残余物;再向残余物中加入去离子水并超声处理2~5min,再离心分离处理5~10min,移出上清液,依次用0.45μm和0.22μm的水系膜对上清液进行过滤,得到待测牛奶样品上清液;
三、将组装Ag NPs的玻璃基片放到待测牛奶样品上清液中浸渍,然后将玻璃基片取出,用去离子水冲洗并自然晾干,得到待测牛奶样品检测片;
四、用拉曼光谱仪测试步骤三得到的待测牛奶样品检测片的表面增强拉曼光谱,将该光谱与青霉素药物标准品的拉曼图谱比对,实现对待测牛奶样品中青霉素药物的定性检测。
本发明将待测牛奶样品通过水辅助溶剂两步分离技术进行前处理,然后用组装Ag NPs玻璃基片浸渍,待测牛奶样品中的青霉素药物分子吸附在具有SERS活性的贵金属银纳米粒子(Ag NPs)基底上,产生可识别的拉曼光谱信号,通过与青霉素标准品的本体拉曼光谱比对,若牛奶样品中出现青霉素的特征SERS信号峰,即认定牛奶样品中有青霉素药物的存在,从而实现青霉素药物的定性和痕量检测;采用本方法不仅可以检测牛奶中残留的青霉素药物,通过与标准品的光谱比对,也可以实现对青霉素分解产物(如青霉噻唑酸、青霉酸等)进行定性鉴别。
本发明首次将SERS技术应用于牛奶中青霉素药物的检测,采用水辅助溶剂两步分离技术去除牛奶中的大部分干扰物质,减少了干扰组分对SERS信号的抑制(或掩蔽),提高了SERS检测的灵敏度,定性检出限可以达到10-7mol/L。检测无需标记,操作简单;检测快速,需要样品量少而且易得,试剂水不产生干扰,是一种无损检测方法,这种成本低廉、环境友好、方便快速的SERS检测方法易于商业化应用。
附图说明
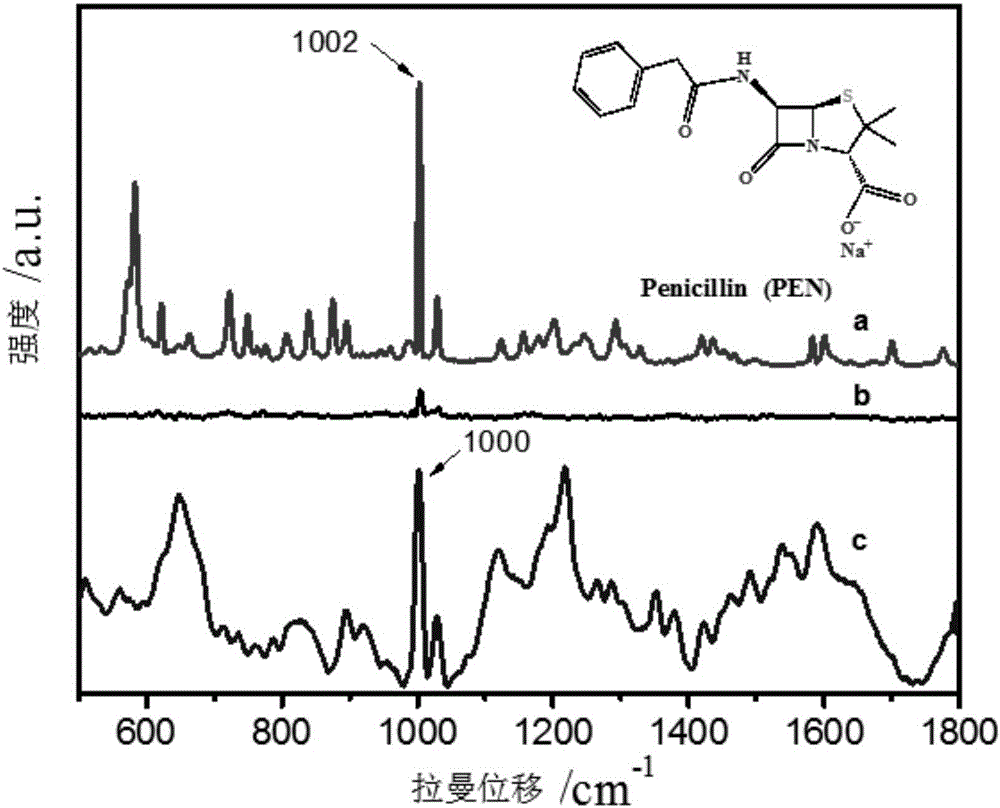
图1是试验1中青霉素G浓度为1×10-4mol/L的加标牛奶样品及对比测试样品的SERS光谱和空白Ag NPs基底的拉曼光谱图;
图2是试验1中青霉素G浓度为1×10-2mol/L的加标牛奶样品的SERS光谱及青霉素G标准品固体粉末和浓度为1×10-1mol/L青霉素G标准品水溶液的拉曼光谱图;
图3是试验1中不同浓度青霉素G加标牛奶样品的SERS光谱;
图4是试验1中加标牛奶样品的青霉素G浓度与峰强度标准曲线;
图5是试验2中不同浓度青霉素G加标牛奶样品的SERS光谱及青霉素G标准品固体粉末的拉曼光谱图。
具体实施方式
具体实施方式一:本实施方式的牛奶中青霉素药物的表面增强拉曼检测方法,按以下步骤进行:
一、制备具有SERS活性的银纳米粒子(Ag NPs)溶胶,然后利用层层自组装技术在玻璃基片上制备Ag NPs组装基底;
二、向待测牛奶样品中添加有机物/水混合溶剂,超声处理2~5min,再离心分离处理10~20min,移出上清液在室温下自然蒸发至干得到残余物;再向残余物中加入去离子水并超声处理2~5min,再离心分离处理5~10min,移出上清液,依次用0.45μm和0.22μm的水系膜对上清液进行过滤,得到待测牛奶样品上清液;
三、将组装Ag NPs的玻璃基片放到待测牛奶样品上清液中浸渍,然后将玻璃基片取出,用去离子水冲洗并自然晾干,得到待测牛奶样品检测片;
四、用拉曼光谱仪测试步骤三得到的待测牛奶样品检测片的表面增强拉曼光谱,将该光谱与青霉素药物标准品的拉曼图谱比对,实现对待测牛奶样品中青霉素药物的定性检测。
具体实施方式二:本实施方式与具体实施方式一不同的是:步骤一中制备具有SERS活性的银纳米粒子(Ag NPs)溶胶,然后利用层层自组装技术在玻璃基片上制备Ag NPs组装基底的具体步骤如下:
a、将AgNO3加入到装有去离子水的三口烧瓶中,在磁力搅拌下加热使其溶解;继续加热,当溶液升温至98~100℃的沸腾状态时加入浓度为1%的柠檬酸钠水溶液,搅拌形成透明溶胶;透明溶胶在温度为93~97℃的微沸状态下保持50~60min,然后停止加热,自然冷却至室温,得到银溶胶;其中AgNO3的质量与浓度为1%的柠檬酸钠水溶液的体积的比是9mg:1mL;
b、将干净玻璃基片先放在硫酸和双氧水的混合溶液中煮沸1~2小时,然后用去离子水冲洗、N2气吹干,得到羟基化玻璃基片;再将该羟基化玻璃基片浸渍在质量浓度为0.3~1%的聚二烯丙基二甲基胺盐酸盐(PDDA)水溶液中保持1~2h,取出后用水冲洗干净,并用N2吹干,得到PDDA衍生化的玻璃基片;再将PDDA衍生化的玻璃基片在银溶胶中浸渍4~8h,取出用水冲洗干净,并用N2吹干,得到Ag NPs组装基底。其它与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一或二不同的是步骤二中有机物/水混合溶剂是无水乙醇、氯仿与水的混合液;或者是无水乙醇、丙酮与水的混合液;其它与具体实施方式一或二相同。
具体实施方式四:本实施方式与具体实施方式三不同的是:步骤二中的混合液是由无水乙醇、氯仿与水按体积比为7:2:3混合而成的;或者由无水乙醇、丙酮与水按体积比为7:3:4混合而成的;其它与具体实施方式三相同。
具体实施方式五:本实施方式与具体实施方式一至四之一不同的是:步骤二中离心分离处理,离心速度为100~10000转/秒;其它与具体实施方式一至四之一相同。
具体实施方式六:本实施方式与具体实施方式一至五之一不同的是:步骤三中组装Ag NPs的玻璃基片放在上清液中浸渍的时间为5~11小时;其它与具体实施方式一至五之一相同。
具体实施方式七:本实施方式与具体实施方式一至六之一不同的是:步骤四中拉曼光谱仪是HORIBA LabRam ARAMIS型,其激发光源的波长为633nm;其它与具体实施方式一至六之一相同。
具体实施方式八:本实施方式与具体实施方式一至七之一不同的是:步骤四中,拉曼光谱仪采集信号的时间为3~5min;其它与具体实施方式一至七之一相同。
具体实施方式九:本实施方式与具体实施方式一至八之一不同的是所述的青霉素为青霉素G、青霉素K或青霉素V;其它与具体实施方式一至八之一相同。
本实施方式的青霉素G、青霉素K和青霉素V均是包括一个β-内酰胺环的典型青霉素类抗生素。
用以下的试验验证本发明的有益效果:
试验1:牛奶中青霉素药物的表面增强拉曼检测方法,按以下步骤进行:
一、将0.3564g青霉素G(PEN)药物直接添加到无青霉素药物的牛奶中并定容至10mL,获得浓度为1×10-1mol/L的PEN加标牛奶母液,然后以无青霉素药物的空白液态牛奶作为溶剂将加标牛奶母液分别稀释成一系列的所需浓度:1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7和1×10-8mol/L,得到加标牛奶样品,将制备好的加标牛奶样品在4摄氏度的冷藏条件下储存7天;该操作的目的是使待测样品更接近于含有药物残留的真实牛奶样品;
二、制备具有SERS活性的银纳米粒子(Ag NPs)溶胶,然后利用层层自组装技术在玻璃基片上制备Ag NPs组装基底;具体的操作步骤如下:a、将36mg AgNO3加入到装有200mL去离子水的三口烧瓶中,在磁力搅拌下加热使其溶解;当溶液加热至98℃的沸腾状态时快速加入4mL浓度为1%的柠檬酸钠水溶液,三口烧瓶中溶液由无色透明逐渐转变成淡黄色、棕色,最终生成灰绿色的透明溶胶;透明溶胶在95℃的微沸状态下保持50min,然后停止加热,自然冷却至室温,得到银溶胶;b、将干净玻璃基片先放在硫酸和双氧水的体积比为7:3的混合溶液中煮沸1.5小时,然后用去离子水冲洗、N2气吹干,得到羟基化玻璃基片;再将该羟基化玻璃基片浸渍在质量浓度为0.5%的聚二烯丙基二甲基胺盐酸盐(PDDA)水溶液中保持1h,取出后用水冲洗干净,并用N2吹干,得到PDDA衍生化的玻璃基片;再将PDDA衍生化的玻璃基片在银溶胶中浸渍4h,取出用水冲洗干净,并用N2吹干,得到Ag NPs组装基底;
三、向各待测加标牛奶样品中添加由无水乙醇、氯仿与水按体积比为7:2:3混合而成的混合溶剂,超声处理2min促进溶解,再在离心速度为10000转/秒的条件下离心分离10min,移出上清液在室温下自然蒸发至干得到残余物;再向残余物中加入去离子水4mL并超声处理3min,再在离心速度为10000转/秒的条件下离心分离处理5min后有沉淀析出,移出上清液,依次用0.45μm和0.22μm的水系膜对上清液进行过滤,得到不同青霉素G浓度的待测加标牛奶样品上清液;
四、将组装Ag NPs的玻璃基片放到不同青霉素G浓度的加标牛奶样品上清液中浸渍8小时,然后将玻璃基片取出,用去离子水冲洗三次并自然晾干,得到一系列不同青霉素G浓度的加标牛奶样品检测片;
五、用HORIBA LabRam ARAMIS型拉曼光谱仪采集步骤四得到的一系列加标牛奶样品检测片的光谱数据,激发光源的波长为633nm,信号采集时间为5min,将该光谱与青霉素G药物标准品的拉曼图谱比对,实现对待测牛奶样品中青霉素G药物的定性检测。
本试验中,青霉素G浓度为1×10-4mol/L的加标牛奶样品的SERS光谱图如图1中的曲线a所示,图1中的曲线b是将组装Ag NPs玻璃基片浸渍到未经混合溶剂前处理的浓度为1×10-4mol/L青霉素G加标牛奶样品中浸渍8小时,再将玻璃基片取出用去离子水冲洗三次并自然晾干,得到的对比测试样品1的SERS光谱图;c是经混合溶剂前处理的空白牛奶样品的SERS光谱;d是Ag NPs基底的拉曼光谱。从图1可以看出,未经前处理的1×10-4mol/L加标牛奶样品在Ag NPs基底上不产生拉曼信号。而经过混合溶剂前处理的加标牛奶样品则表现出了很强的拉曼信号强度和较低的背景干扰。可见,体积比为7:2:3的混合溶剂对加标牛奶中青霉素G的拉曼信号增强有巨大贡献。
本试验中,青霉素G浓度为1×10-2mol/L的加标牛奶样品的SERS光谱图如图2中的曲线c所示,图2中的a为青霉素G标准品固体粉末的本体拉曼光谱,图2中的b为浓度为1×10-1mol/L青霉素G标准品水溶液的本体拉曼光谱。从图2中的c可以看出,青霉素G的特征SERS信号峰出现在1000cm-1处,归属于β-内酰胺环的特征振动。通过与青霉素G固体粉末及水溶液的本体拉曼光谱对比,可以指认加标牛奶样品中的青霉素G在Ag NPs组装基底上的SERS光谱,证明本试验能够定性鉴别牛奶中残留的青霉素G药物分子;也可以通过青霉噻唑酸标准品的谱图判断残留的青霉素G药物分子是否发生了分解反应并产生了对人体有致命危害的青霉噻唑酸等衍生物。
本试验中,青霉素G浓度分别为1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7和1×10-8mol/L的加标牛奶样品的SERS光谱如图3所示。图3中浓度由上到下的a~h曲线依次对应着浓度为1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7和1×10-8mol/L的样品,从图3可以看出,随着牛奶待测样品中加标物青霉素G浓度的变化,加标物的拉曼峰强度也随之变化。由拉曼峰强度随加标牛奶样品青霉素G浓度的变化可以对牛奶样品中青霉素G的含量进行痕量检测。可见,本试验可以实现对牛奶中残留的青霉素G药物进行痕量SERS检测。通过本方法,牛奶中青霉素G残留的最低检出限达到1×10-7mol/L。另外,在青霉素G1×10-3~1×10-7mol/L浓度范围内,以拉曼位移1000cm-1处的峰强度为纵坐标,以加标牛奶中青霉素G浓度为横坐标作图,可以得到标准曲线如图4所示;利用标准曲线可以实现对待测牛奶样品中青霉素G浓度的定量检测。
试验2:牛奶中青霉素药物的表面增强拉曼检测方法,按以下步骤进行:
一、将0.3564g青霉素G(PEN)药物直接添加到无青霉素药物的牛奶中并定容至10mL,获得浓度为1×10-1mol/L的PEN加标牛奶母液,然后以无青霉素药物的空白液态牛奶作为溶剂将加标牛奶母液分别稀释成一系列的所需浓度:1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7和1×10-8mol/L,得到加标牛奶样品,将制备好的加标牛奶样品在4摄氏度的冷藏条件下储存7天使待测样品更接近于含有药物残留的真实牛奶;
二、制备具有SERS活性的银纳米粒子(Ag NPs)溶胶,然后利用层层自组装技术在玻璃基片上制备Ag NPs组装基底;具体的操作步骤如下:a、将36mg AgNO3加入到装有200mL去离子水的三口烧瓶中,在磁力搅拌下加热使其溶解;当溶液加热至98℃的沸腾状态时快速加入4mL浓度为1%的柠檬酸钠水溶液,三口烧瓶中溶液由无色透明逐渐转变成淡黄色、棕色,最终生成灰绿色的透明溶胶;透明溶胶在95℃的微沸状态下保持50min,然后停止加热,自然冷却至室温,得到银溶胶;b、将干净玻璃基片先放在硫酸和双氧水的体积比为7:3的混合溶液中煮沸1.5小时,然后用去离子水冲洗、N2气吹干,得到羟基化玻璃基片;再将该羟基化玻璃基片浸渍在质量浓度为0.5%的聚二烯丙基二甲基胺盐酸盐(PDDA)水溶液中保持1h,取出后用水冲洗干净,并用N2吹干,得到PDDA衍生化的玻璃基片;再将PDDA衍生化的玻璃基片在银溶胶中浸渍4h,取出用水冲洗干净,并用N2吹干,得到Ag NPs组装基底;
三、向各加标牛奶样品中添加由无水乙醇、丙酮与水按体积比为7:3:4混合而成的混合溶剂,超声处理3min促进溶解,再在离心速度为8000转/秒的条件下离心分离10min,移出上清液在室温下自然蒸发至干得到残余物;再向残余物中加入去离子水4mL并超声处理3min,再在离心速度为8000转/秒的条件下离心分离处理5min后有沉淀析出,移出上清液,依次用0.45μm和0.22μm的水系膜对上清液进行过滤,得到一系列不同待测加标牛奶样品上清液;
四、将组装Ag NPs的玻璃基片放到不同青霉素G浓度的加标牛奶样品上清液中浸渍10小时,然后将玻璃基片取出,用去离子水冲洗三次并自然晾干,得到一系列不同的加标牛奶样品检测片;
五、用HORIBA LabRam ARAMIS型拉曼光谱仪采集步骤四得到的加标牛奶样品检测片的光谱数据,激发光源的波长为633nm,信号采集时间为5min;将该光谱与青霉素G药物标准品的拉曼图谱比对,实现对待测牛奶样品中青霉素药物的定性检测。
本试验中,青霉素G浓度分别为1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7和1×10-8mol/L的加标牛奶样品的SERS光谱如图5中的a~h所示,图5中I为青霉素G标准品固体粉末的本体拉曼光谱。图5中浓度由上到下的a~h曲线依次对应着浓度为1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7和1×10-8mol/L的样品,可以看出,青霉素G的特征SERS信号峰出现在1000cm-1处,归属于β-内酰胺环的特征振动。通过与青霉素G固体粉末的本体拉曼光谱对比,可以指认加标牛奶样品中的青霉素G在Ag NPs组装基底上的SERS光谱,证明本试验能够定性鉴别牛奶中残留的青霉素G药物的存在,牛奶中青霉素G残留的最低检出限达到1×10-7mol/L。本发明专利得到了国家自然科学基金项目(21473078)资助。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种便携式智能拉曼光谱采集设备的制造方法与工艺
- 用于改善基底表面硬度及耐磨性的Ni‑WC复合涂层及其制备的制造方法与工艺
- 一种具有SERS活性的金/银/聚合物/银核壳纳米蘑菇材料及其制备方法和应用与制造工艺
- 用于增强使用无执照射频谱带进行的传输的帧结构和先听后讲规程(LBT)的技术的制造方法与工艺
- 一种基于近邻协同增强的高光谱混合像元分类方法与制造工艺
- 一种单分散银壳磁性微球的制备方法及其SERS应用与制造工艺
- 一种大口径材料表面散射的高速测量装置和方法与制造工艺
- 纳米金比色探针的制备方法及其检测碘离子的方法与制造工艺
- 一种复合型纳米结构拉曼增强基底、制备方法及应用与制造工艺
- 一种CaF2光学基底表面和亚表面损伤探测方法与制造工艺