基于量子点比率荧光的分子印迹聚合物检测米托蒽醌的方法与流程
本发明属于米托蒽醌检测技术领域,具体涉及一种基于量子点比率荧光的分子印迹聚合物检测米托蒽醌的方法。
背景技术:
米托蒽醌(MIT),化学名为:1,4-二羟基-5,8-双{2-2[(2-羟乙基)氨乙基]氨基}-9,10-蒽二酮,属于蒽环类抗癌药物,主要用于治疗乳腺癌、白血病、恶性淋巴癌等,其细胞毒性与其它蒽环类抗癌药物如柔红霉素(DAU)和阿霉素(DOX)相比有所降低,但剂量浓度超过了上限允许仍然会引起脱发、贫血,甚至引发骨髓和心脏毒性。此外,通过排泄该药物会到达地下水进而引起微生物中毒和公众健康危害。因此,建立一种简单的检测生物体液中米托蒽醌的方法至关重要。然而很多分析方法如:色谱、电化学和放射法,大都耗时、操作繁琐、需要依赖实验室条件及昂贵的分析仪器等。
技术实现要素:
本发明所要解决的技术问题在于克服现有技术对米托蒽醌检测的不足,提供一种基于量子点比率荧光的分子印迹聚合物检测米托蒽醌的方法。
解决上述问题所采用的技术方案由下述步骤组成:
1、将绿色CdTe量子点和红色CdTe量子点@SiO2加入到pH值为5.6的吗啉乙磺酸缓冲液中,加入3-氨基丙基三乙氧基硅烷和米托蒽醌,常温搅拌30分钟,然后加入正硅酸乙酯,在避光条件下常温搅拌24小时,产物依次用蒸馏水、二甲亚砜离心洗涤,除去未反应的3-氨基丙基三乙氧基硅烷、正硅酸乙酯及模板米托蒽醌,再用蒸馏水离心洗涤除去二甲亚砜,得到具有比率荧光性能的米托蒽醌分子印迹聚合物。
2、将具有比率荧光性能的米托蒽醌分子印迹聚合物分散于pH值为6.0~7.0的磷酸盐缓冲液中,并加入米托蒽醌标准样品,用荧光光谱仪测量不同浓度米托蒽醌对应的荧光光谱,绘制荧光强度比值同米托蒽醌浓度变化的标准曲线。
3、按照步骤2的方法测量待测米托蒽醌样品的荧光光谱,根据待测样品的荧光强度比值,结合标准曲线的线性方程即可确定待测样品中米托蒽醌的浓度。
上述步骤1中,所述米托蒽醌、3-氨基丙基三乙氧基硅烷和正硅酸乙酯的摩尔比为1:3~8:6~18,优选米托蒽醌、3-氨基丙基三乙氧基硅烷和正硅酸乙酯的摩尔比为1:4:12。
上述步骤1中,所述的绿色CdTe量子点和红色CdTe量子点@SiO2、3-氨基丙基三乙氧基硅烷的体积比为1:6:0.01~0.06。
上述步骤2中,所述磷酸盐缓冲液中具有比率荧光性能的米托蒽醌分子印迹聚合物的浓度为15~50mg/L,所述磷酸盐缓冲液的pH值优选为6.5。
本发明以包覆红色CdTe量子点的SiO2为载体,在绿色CdTe量子点存在下,以3-氨基丙基三乙氧基硅烷为功能单体、米托蒽醌为模板、正硅酸乙酯为交联剂,采用溶胶-凝胶法制备成具有比率荧光性能的米托蒽醌分子印迹聚合物,该聚合物具有与模板分子大小、形状和官能团相符合的空穴,可以选择性识别米托蒽醌,直接采用比率荧光法即可实现米托蒽醌的高灵敏检测。与原有的色谱法和电化学法相比,本发明检测方法操作更简单、检测速度更快、成本更低,大大提高了分析速率,且可实现米托蒽醌的痕量检测。
附图说明
图1是具有比率荧光性能的米托蒽醌分子印迹聚合物的透射电子显微镜图。
图2是荧光强度随米托蒽醌浓度变化的荧光光谱图。
图3是荧光强度比值随米托蒽醌浓度变化的标准曲线。
图4是具有比率荧光性能的米托蒽醌分子印迹聚合物和非分子印迹聚合物对不同蒽环药物的荧光响应柱状图。
图5是具有比率荧光性能的米托蒽醌分子印迹聚合物和非分子印迹聚合物对生物体液中共存物质的荧光响应柱状图。
具体实施方式
下面结合附图和实施例对本发明进一步详细说明,但本发明的保护范围不仅限于这些实施例。
实施例1
1、将1mL绿色CdTe量子点和6mL红色CdTe量子点@SiO2加入到13mL pH值为5.6的吗啉乙磺酸缓冲液中,常温搅拌混合均匀,加入20μL(80μmol)3-氨基丙基三乙氧基硅烷和10mg(20μmol)米托蒽醌,常温搅拌30分钟,然后加入200μL(240μmol)正硅酸乙酯,在避光条件下常温搅拌24小时,产物依次用蒸馏水、二甲亚砜离心洗涤,除去未反应的3-氨基丙基三乙氧基硅烷、正硅酸乙酯及模板米托蒽醌,再用蒸馏水离心洗涤除去二甲亚砜,得到具有比率荧光性能的米托蒽醌分子印迹聚合物(见图1)。
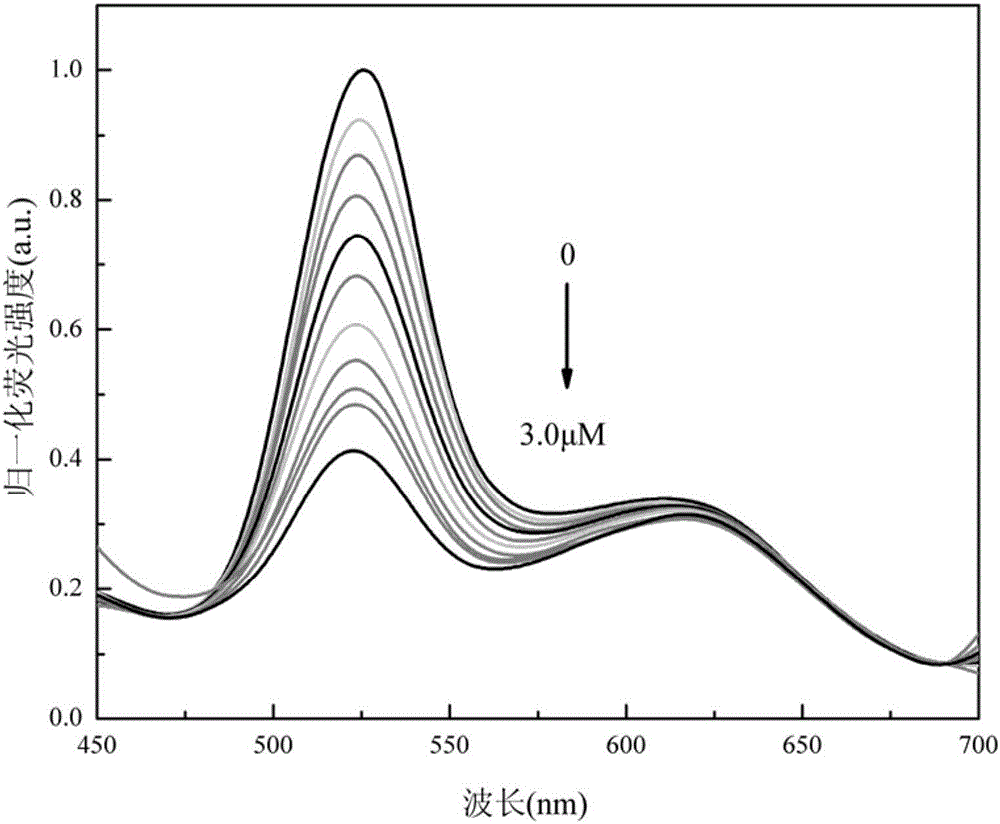
2、将1mg具有比率荧光性能的米托蒽醌分子印迹聚合物分散于20mL pH值为6.5的磷酸盐缓冲液中,分别向100μL该分散液中加入不同体积的5μmol/L米托蒽醌标准样品水溶液,并用pH值为6.5的磷酸盐缓冲液定容至250μL,然后混合均匀,使混合体系中米托蒽醌的浓度分别为0.1、0.3、0.5、0.7、1.0、1.2、1.4、1.6、1.8和3.0μmol/L,常温反应10分钟,采用PE LS55荧光分光光度计在激发波长为365nm、激发和发射狭缝均为10nm下测量不同浓度米托蒽醌对应体系的荧光光谱,见图2,并绘制荧光强度比值随米托蒽醌浓度变化的标准曲线,见图3。
由图2~3可见,在相同的检测条件下,分子印迹聚合物对模板分子米托蒽醌有明显的荧光响应,在米托蒽醌浓度为0.2~2.0μmol/L时,荧光强度比值[(I524/I624)0/(I524/I624)]与米托蒽醌的浓度(CMIT)呈线性关系,线性方程为:
y=0.9581+0.5499x
式中y为[(I524/I624)0/(I524/I624)],x为CMIT,相关系数R2为0.9923,由相关系数可见,荧光强度比值与米托蒽醌浓度的线性关系很好。经测试,该分子印迹聚合物对米托蒽醌的检出限为0.067μmol/L。
3、按照步骤2的方法采用PE LS55荧光分光光度计测量待测米托蒽醌样品的荧光光谱,根据待测样品的荧光强度比值,结合标准曲线的线性方程即可确定待测样品中米托蒽醌的浓度。
对比例
本实施例中,不添加模板分子米托蒽醌,其他步骤与实施例1的步骤1相同,得到非印迹聚合物。
为了验证本发明的有益效果,发明人进行了大量的实验室研究试验,具体试验情况如下:
1、选择性试验
按照实施例1步骤3的方法分别测量实施例1制备的米托蒽醌分子印迹聚合物(MIP)和对比例1制备的非印迹聚合物(NIP)对蒽环类药物(米托蒽醌、阿霉素、柔红霉素)的荧光响应情况,结果见图4。由图4可以看出,米托蒽醌分子印迹聚合物对模板分子的荧光响应大于其他结构类似蒽环类药物,说明米托蒽醌分子印迹聚合物对米托蒽醌有一定的特异选择性,而对其他蛋白不具备识别能力。而对于非印迹聚合物,由于其表面没有形成印迹空穴,因此对所有蒽环类药物均无明显的荧光响应。
2、抗干扰试验
按照实施例1步骤3的方法分别测量实施例1制备的米托蒽醌分子印迹聚合物(MIP)和对比例1制备的非印迹聚合物(NIP)对生物体液中存在物质的荧光响应情况(其中K+、Na+、Cl-、NO3-、HCO3-的浓度均为米托蒽醌的500倍,Ca2+、SO42-、HPO42-的浓度均为米托蒽醌的250倍,Al3+的浓度为米托蒽醌的170倍,各种氨基酸、葡萄糖、尿素的浓度均为米托蒽醌的500倍,牛血清白蛋白和人血清白蛋白的浓度与米托蒽醌一致),结果见图5。由图5可以看出,米托蒽醌分子印迹聚合物对模板分子的荧光响应大于生物体液中存在的物质,而非印迹聚合物对所有物质均无明显的荧光响应,说明米托蒽醌分子印迹聚合物抗干扰能力很强。
3、样品分析
取健康人体血清和尿液均用pH值为6.5的磷酸盐缓冲液稀释100倍,然后分别加入不同体积的5μmol/L米托蒽醌标准样品水溶液和100μL米托蒽醌分子印迹聚合物分散液,用pH值为6.5的磷酸盐缓冲溶液定容至250μL,然后用PE LS55荧光分光光度计测量荧光光谱,按照实施例1中的线性方程计算体系中米托蒽醌的浓度,根据加标量和测定值计算加标回收率,结果如表1所示。
表1加标回收率
由表1可知,米托蒽醌分子印迹聚合物对2种样品3个浓度梯度的米托蒽醌加标的加标回收率在91.5%~102.2%,而且标准偏差均低于5.96%,说明该方法的准确度较高、精密度较好。由此可见,本发明基于量子点比率荧光的分子印迹聚合物检测米托蒽醌的方法可用于检测生物样品,在生物学和临床医学领域具有潜在的应用价值。
- 还没有人留言评论。精彩留言会获得点赞!