一种循环肿瘤细胞分离微流控芯片装置及其使用方法与流程
本发明涉及细胞分选领域,具体的说是涉及一种在微流控芯片上从生物液体样本中进行自动分选循环肿瘤细胞的装置及方法。
背景技术:
在生物医学等领域,经常需要从较为复杂的样品中,分选出特定的目标细胞。如检测、分选并计数癌症患者血液中的循环肿瘤细胞(ctc,circulatingtumorcell)的个数在在癌症诊断与治疗中显得愈发重要。目前ctc检测技术鱼龙混杂,总体上就是利用和不利用标记物两大类,基于标记物捕获的通常包括抗体包被磁珠为基础的阳性富集法和阴性富集法。此类属于第一代ctc捕获技术,代表为强生的cellsearch系统。但其技术缺陷在于抗体捕获仅局限于对特异表达epcam上皮抗原的上皮来源ctc的捕获,并且无法实现活细胞捕获进行后续基因检测。阴性富集法通过cd45磁珠反向去除外周血中白细胞,该方法无法对大体积样本中的微量ctc进行富集检测,以及存在磁珠的非特异性吸附问题。第一代技术过滤膜法只能捕获大粒径肿瘤细胞,漏检小粒径肿瘤细胞,而且捕获的细胞没有细胞活性,只能用于细胞计数、形态学、以及fish检测。
微流控芯片被喻为21世纪生命科学的支撑技术,是便携式生化分析仪器的技术核心。该技术是通过构建微尺度的通道,将生物和化学等领域所涉及的样品制备、生物与化学反应分离与检测等基本操作单元集成到一块几平方厘米的芯片上,用以完成不同的生物或化学反应过程,能够在短时间内分析大量的生物分子,准确获取样品中的大量信息,信息量是传统检测手段的成百上千倍。
在微流控芯片上对血液样品中的循环肿瘤细胞进行分选已有一些研究的报道,如利用介电泳、流体动力、基于免疫磁珠和荧光分选法等。但该方法都存在不同程度的不足,如直流介电泳的方法需要施加较高的电场强度,极容易造成细胞裂解;基于免疫磁珠分离方法虽然提高了对特定抗原表达肿瘤细胞分离效率,但仍然局限于对肿瘤细胞抗原表位的识别,而循环肿瘤细胞异质性决定了采用单一抗体或几种抗体进行基于抗原识别的捕获方法,都存在对非抗原表达ctc的漏检问题。而荧光分选的方法需要对细胞进行荧光标记,并且需要搭建复杂的光学检测系统。
专利201410336948.4公开了一种循环肿瘤细胞分离pdms微流控芯片,包括储液孔a至储液孔f、检测通道、主通道、第一、第二聚焦通道、样品出口通道、目标细胞收集通道、电磁分选通道;当循环肿瘤细胞通过检测通道时,产生的电压信号被检测到并被送至ni采集卡和处理终端,处理终端通过ni采集卡发出电压信号,使电磁继电器闭合,继而使电磁微阀结构压迫其下方pdms层,使其发生形变,从而从储液孔e排出一部分液体,推动循环肿瘤细胞流入目标细胞收集通道中。该芯片装置需要电场和磁场装置实现细胞的分离。该芯片整体制备复杂、操作流程多且成本高。
专利201410345305.6公开了一种双螺旋微流控芯片,其包括红细胞出口、白细胞出口、流体出口和细胞滤膜,根本上还是依赖于8微米孔径过滤膜实现对肿瘤细胞过滤分离,此类方法仍然会漏检小粒径肿瘤细胞。
技术实现要素:
本发明的目的就是为了克服上述现有技术存在的缺陷而提供一种循环肿瘤细胞分离微流控芯片装置及其使用方法。本发明基于循环肿瘤细胞和血细胞核质比和表面电荷上的差异,在微流控芯片上采用流体力学实现对样品中循环肿瘤细胞的非抗体依赖的分离富集。
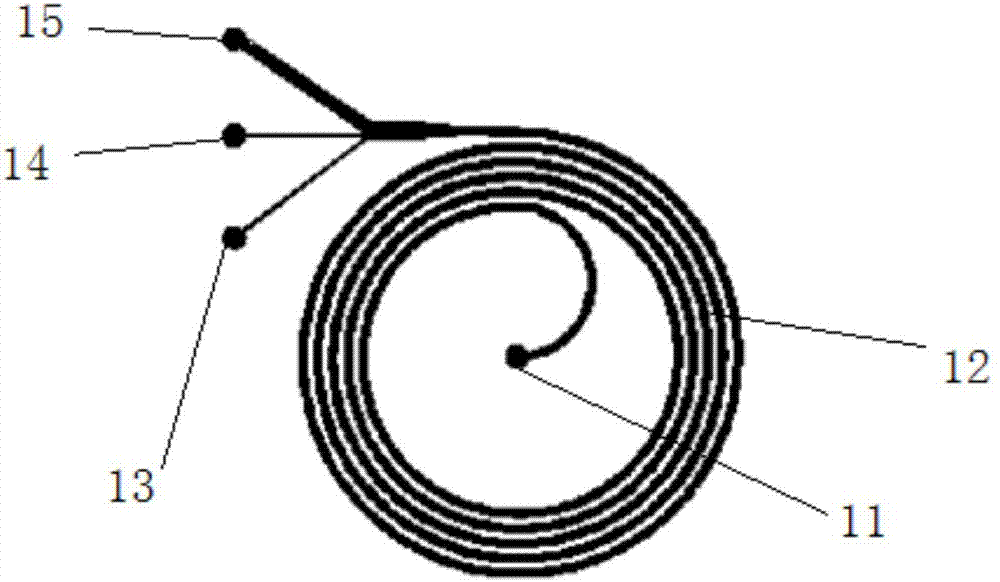
本发明的目的可以通过以下技术方案来实现:一种循环肿瘤细胞分离微流控芯片装置,其特征在于,该装置包括微流控芯片和芯片夹具,所述的微流控芯片包括芯片入口、单螺旋芯片、稀有细胞收集管道和白细胞出口,其中,所述稀有细胞收集管道包括两根,分别连接内侧出口(13)和出口(14);所述的单螺旋芯片由单螺旋型通道构成,所述单螺旋型通道从圆形螺旋通道中心的芯片入口,经半圆形起始通道,进入螺旋形微流控通道,末端包含3个出口:分别收集不同粒径大小稀有细胞的出口(13)和出口(14),以及收集白细胞的废液出口(15);
所述的芯片夹具自动对接微流控芯片的芯片入口、稀有细胞收集管道和废液出口。
所述的内侧出口的宽度为110±50μm,出口的宽度为110±50μm,白细胞出口的宽度为700±100μm。
所述的ctc收集管道出口(13)和出口(14)均采用正电荷聚合物进行表面涂层处理。
所述的正电荷聚合物为阳离子聚合物,包括聚乙烯亚胺、丙烯酰胺经改性后的两亲性聚合物。
所述的单螺旋型通道为主通道,其宽度为500±100μm,高度为120±50μm,每个单一螺旋间距为500±100μm,完整螺旋数大于等于3。
所述的芯片夹具包括样液管接头、ctc收集管接头和废液收集管接头;合上芯片夹具,所述的样液管接头与芯片入口对接,所述的不同粒径ctc收集管接头与所述出口(13)、(14)对接,所述白细胞收集管接头与所述出口(15)对接,使微流控芯片的各出入口和外接导管连接,其中所述样液管接头另一端连接生物样品,通过注射泵或者压力泵装置将生物样品恒速注入芯片装置,其流速为50-300ml/h。
将生物样品恒速注入芯片装置的流速优选为60-200ml/h。
所述的流速更优选为100ml/h,120ml/h或者150ml/h。
所述生物样品为外周血、末梢血、胸腔积液、腹腔积液、脑脊液、骨髓液和/或尿液。
一种循环肿瘤细胞分离微流控芯片装置的使用方法,其特征在于,包括以下步骤:
(1)将待测血样采用红细胞裂解液(该红细胞裂解液为市售产品,如采用无锡纳奥生物医药有限公司生产并销售的裂解液)裂解处理后,加入pbs缓冲液,稀释为进样样本;
(2)通过配套注射泵或压力泵装置,将步骤(1)中进样样本通过导管从芯片夹具的样液管接头注入微流控芯片的芯片入口,根据细胞核质比和表面电荷的差异在单螺旋芯片内实现循环肿瘤细胞的富集分离;
(3)富集分离出的不同粒径ctc细胞从出口(13)、(14)流出,经ctc收集管接头及附带导管导出并接入无菌离心管中,白细胞从外侧白细胞出口流出经白细胞收集管接头及附带导管导出。
步骤(1)所述的pbs缓冲液与待测血样的体积比为10~30:1。
与现有技术相比,本发明生物样本在通过微流控芯片时,利用流体在螺旋流道中的惯性效应和dean流作用,将肿瘤细胞和其它细胞聚焦在距离入口中心原点不同的位置,不同核质比和表面电荷的肿瘤细胞和白细胞,在流体力学作用下,汇聚成不同位置的平行线,在本发明限定的流速范围内,细胞会因其核质比和电荷的差异,承受不同的流体力,不同细胞在管道内形成空间上的差异排列,最终从不同的出口流出。其中,大部分的白细胞在汇聚成线后进入血细胞流道,大部分肿瘤细胞则通过结构流道中的电荷吸附作用分别进入ctc流道。采用上述螺旋流道惯性分选技术结构与电荷吸附技术集成的微流控芯片,克服了已有循环肿瘤细胞分离方法的集成度低、捕获率低等缺陷,实现对肿瘤细胞非抗体依赖的循环肿瘤细胞快速高通量分离;另外,本系统的芯片结构简单、加工方便,具有操作简单、自动化程度高等优,可用于稀有细胞生物学研究、疾病早期诊断与治疗等领域。
附图说明
图1为本发明的微流控芯片结构图;
图2为本发明的芯片夹具开启结构图;
图3为本发明芯片夹具闭合结构图;
图4为本发明的微流控芯片对细胞分离的模拟示意图;
图5为利用本发明微流控装置对添加到正常血液中的gfp转染的mgc803细胞富集效果图(每样本中加入300个mgc803细胞,分选后计数回收的mgc803细胞);
图6为具体实施例1分离出的外周血中循环肿瘤细胞免疫荧光染色图;
图7为具体实施例2分离出的胸积液中分离出的循环肿瘤细胞giemsa染色形态图。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明。
实施例
一种循环肿瘤细胞分离微流控芯片装置,该装置包括微流控芯片1和芯片夹具2。
如图1所述,所述的微流控芯片1包括芯片入口11、单螺旋芯片12、稀有细胞收集管道和白细胞出口15,其中,所述稀有细胞收集管道包括两根,分别连接内侧出口13和出口14;所述的单螺旋芯片12由单螺旋型通道构成,所述单螺旋型通道从圆形螺旋通道中心的芯片入口11,经半圆形起始通道,进入螺旋形微流控通道,末端包含3个出口:分别收集不同粒径大小稀有细胞的内侧出口13和出口14,以及收集白细胞的外侧白细胞出口15;其中,所述的内侧出口13的宽度为110±50μm,出口14的宽度为110±50μm,白细胞出口15的宽度为700±100μm。所述的单螺旋型通道为主通道,其宽度为500±100μm,高度为120±50μm,每个单一螺旋间距为500±100μm,完整螺旋数大于等于3,在本实施例中为5个完整螺旋。
所述的内侧出口13和出口14均采用正电荷聚合物聚乙烯亚胺进行表面涂层处理。该处理方法为常规的液体涂覆法,即采用一定体积的聚合物溶液通过注射器注入出口进行自然涂布方法。
如图2~3所示,所述的芯片夹具2包括样液管接头21、ctc收集管接头22、23和白细胞收集管接头24;合上芯片夹具2,所述的样液管接头21与芯片入口11对接,所述的ctc收集管接头22、23分别与所述出口13、14对接,所述的白细胞收集管接头24与所述白细胞出口15对接,使微流控芯片1的各出入口和外接导管自动对接,其中所述样液管接头21另一端连接生物样品,通过注射泵或者压力泵装置将生物样品恒速注入芯片装置,其流速可以为50-300ml/h。
所述生物样品为外周血、末梢血、胸腔积液、腹腔积液、脑脊液、骨髓液和/或尿液。
下面选取外周血为生物样品,采用上述循环肿瘤细胞分离微流控芯片装置分离血液中的循环肿瘤细胞,包括以下步骤:
(1)将待测血样采用红细胞裂解液(无锡纳奥生物医药有限公司)裂解处理后,加入15mlpbs缓冲液,稀释为进样样本;
(2)将微流控芯片1和芯片夹具2组装后,与外接样液管、以及富集产物的外管、中管、内管,如图4所示,以及配套导管、注射泵或压力泵装置组装在一起;
(3)启动仪器,将步骤(1)中进样样本通过导管从芯片夹具2的样液管接头21按照流速120ml/h注入微流控芯片1的芯片入口11,根据细胞核质比和表面电荷的差异在单螺旋芯片12内实现循环肿瘤细胞的富集分离;富集分离出的ctc细胞从出口13、14流出,经ctc收集管接头22、23及附带导管导出并接入5ml无菌离心管(内管)中,白细胞从外侧白细胞出口15流出经白细胞收集管接头24及附带导管导出收集于外管中(如图4所示)。
(4)将经微流控分离的循环肿瘤细胞进行甩片,制作样本载玻片。4%多聚甲醛固定,用0.25%tritonx-100(pbs配制)对细胞透化处理10分钟,pbs漂洗3遍,5min/遍;2%bsa封闭30min,pbs漂洗3遍,5min/遍;加入epcam(1:200,pbs配制),暗室孵育2小时,pbs漂洗3遍,5min/遍;加入ck-18(1:400,pbs配制),暗室孵育2小时;pbs漂洗三遍,每次5min;加入cd45(1:200,pbs配制),暗室孵育30min,pbs漂洗3遍,5min/遍;加入0.5ug/mldapi(pbs配制)染色10分钟,pbs漂洗3遍,5min/遍;加入20ul封片剂封片;通过荧光显微镜观察。
经本发明的微流控装置分选的肿瘤细胞,在显微镜下可观察到完整的细胞形态,如图6免疫荧光染色显示epcam阳性的细胞数量为5个,细胞核质比大于0.8。
如图5所示,不同进样速度对于微流控芯片分离肿瘤细胞捕获效率结果(gfp阳性mgc803细胞起始添加量为300个),结果表明:在1.0ml/min、1.5ml/min、2.0ml/min进样速度下纳米微流控芯片的平均富集率各为57.7%、66.3%、75.2%。
实施例2
微流控装置分离胸腔积液中的循环肿瘤细胞,装置与实施例1相同,方法如下:
(1)胸腔积液样本被来回轻柔颠倒,使之混匀;用pbs将胸腔积液稀释100倍,用30ml的注射器吸取;然后注射器整体固定于仪器配套恒流泵上,注射器出口与微流控芯片装置的接口相连,胸腔积液泵入的流速为130ml/h。
(2)富集分离液从富集分离出口流出并接入5ml无菌离心管中。
(3)将经微流控分离的循环肿瘤细胞进行甩片,制作样本载玻片。4%多聚甲醛固定,进行giemsa染色,显微镜下观察拍照,如图7所示,分离出的肿瘤细胞显示典型核大、核质比高、粒径大的细胞形态结构。
实施例3
所述的内侧出口13和出口14均采用正电荷聚合物丙烯酰胺进行表面涂层处理。通过注射泵或者压力泵装置将生物样品恒速注入芯片装置,其流速为50ml/h。所述的pbs缓冲液与待测血样的体积比为10:1。其余同实施例1。
实施例4
所述的内侧出口13和出口14均采用正电荷聚合物丙烯酰胺进行表面涂层处理。通过注射泵或者压力泵装置将生物样品恒速注入芯片装置,其流速为300ml/h。所述的pbs缓冲液与待测血样的体积比为30:1。其余同实施例1。
以上所述实施方式仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明的权利要求书确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!