IGF‑1R抗体‑药物‑缀合物和其用于治疗癌症的用途的制作方法
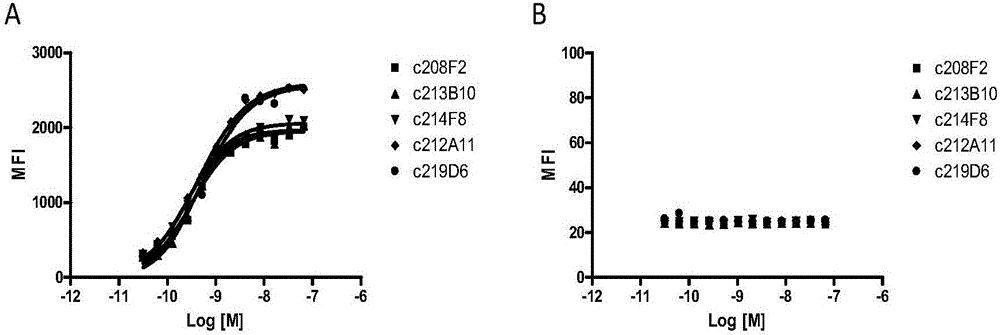
本发明涉及一种能够结合至IGF-1R的抗体-药物-缀合物。一方面,本发明涉及一种抗体-药物-缀合物,其包含能够结合至IGF-1R的抗体,所述抗体与至少一种选自多拉司他汀10(dolastatin10)和奥瑞司他汀(auristatin)的衍生物的药物缀合。本发明还包括治疗的方法,和所述抗体-药物-缀合物用于治疗癌症的用途。
背景技术:
:被称为IGF-1R(或有时被称为IGF1R或IGF-IR)的胰岛素样生长因子1受体是具有酪氨酸激酶活性的受体,其与胰岛素受体IR具有70%同源性。IGF-1R为一种分子量约350,000的糖蛋白。其为一种异四聚体(hetero-tetrameric)受体,其中通过二硫桥连接的每一半由细胞外α-亚基和跨膜β-亚基组成。IGF-1R以非常高的亲和力(Kd#1nM)结合IGF1和IGF2,但同样能够以低100至1000倍的亲和力结合至胰岛素。相反,IR以非常高的亲和力结合胰岛素,尽管IGF仅以低100倍的亲和力结合至胰岛素受体。IGF-1R和IR的酪氨酸激酶结构域具有非常高的序列同源性,尽管同源性较弱的区段分别涉及处于α-亚基上的半胱氨酸富集区和β-亚基的C末端部分。在α-亚基中观察到的序列差异处于配体的结合区段,因此其分别是IGF-1R和IR对IGF和胰岛素的相对亲和力的起源。β-亚基的C-末端部分中的差异导致两个受体的信号通路中的分歧(divergence);IGF-1R介导促有丝分裂、分化和抗凋亡作用,而IR的活化主要涉及代谢通路水平的作用。通过配体与受体的细胞外结构域的结合活化胞质酪氨酸激酶蛋白。激酶的活化依次涉及不同的细胞内底物的刺激,所述底物包括IRS-1、IRS-2、Shc和Grb10。IGF-1R的两种主要底物为IRS和Shc,其通过下游的许多效应子的活化介导大部分生长和分化作用,所述作用与IGF和该受体的连接相关。因此,底物的可用性可以决定与IGF-1R的活化相关的最终生物学作用。当IRS-1占优势时,细胞倾向于增殖和转化。当Shc占优势时,细胞倾向于分化。似乎主要涉及保护以对抗凋亡的作用的途径为磷脂酰基-肌醇3-激酶(PI3-激酶)途径。IGF系统在癌发生(carcinogenesis)中的作用已经成为近十年中深入研究的主题。这种兴趣跟随着事实的发现,即除了其促有丝分裂和抗凋亡性质,IGF-1R似乎是转化表型的建立和维持所必须的。事实上,已经非常确定的是,在许多种细胞中,IGF-1R的过表达或组成性活化导致细胞的生长,所述生长不依赖于缺乏胎牛血清的介质中的支持,并导致裸鼠中肿瘤的形成。这本身不是独特的性质,因为过表达基因的许多种产物可以使细胞转化,包括大量的生长因子受体。然而,已经清楚地证明IGF-1R在转化中发挥的主要作用的关键发现已经证明,IGR-1R-细胞(其中编码IGF-1R的基因已经失活)完全难以通过不同的试剂转化,所述试剂为通常能够使细胞转化的试剂,如牛乳头瘤病毒的E5蛋白、EGFR或PDGFR的过表达、SV40的T抗原、活化的ras或最后两个因子的组合。IGF-1R在许多种肿瘤和肿瘤系中表达,并且IGF经由它们与IGF-1R的连接扩增肿瘤生长。支持IGF-1R在癌发生中的作用的其他争论来自研究,所述研究使用针对受体的鼠单克隆抗体,或使用IGF-1R的显性负突变体(negativedominant)。实际上,针对IGF-1R的鼠单克隆抗体在培养物中抑制多种细胞系的增殖,且在体内抑制肿瘤细胞的生长。同样地,已经显示IGF-1R的显性负突变体能够抑制肿瘤增殖。已经开始大量项目开发用于治疗癌症的裸IGF-1R抗体。然而,到目前为止,这些项目都没有成功,并且市场上没有抗IGF-1R抗体。此外,一系列临床试验已经失败,所述临床试验涉及与抗EGFR抗体组合以靶向EGFR和IGF-1R的抗IGF-1R抗体,因为这些抗体均不能治疗KRAS突变患者。因此,现在IGF-1R不被认为是主要靶点,并且在潜在治疗性抗体的研究中,IGF-1R不再被认为是特别令人关注的。然而,还必须注意,产生IGF-1R抗体的努力集中于裸抗体,即通过其固有性质而有用的抗体。在此意义上,IGF-1R被认为是一个不适合于产生ADC如抗体-药物-缀合物(被称为“ADC”)的靶点,因为IGF-1R被描述为一个也被正常细胞(包括血管)广泛表达的靶点。在此意义上,可以注意到,最近的IGF-1R抗体(即AVE1642)被开发为一种未携带药物的裸抗体。其与目前在开发中的其他IGF-1R抗体和与在临床试验中失败的所有那些抗体相同。在这种背景下,本发明涉及一种ADC或缀合物,和其用于治疗癌症,更特别地表达IGF-1R的癌症的用途。ADC将抗体的结合特异性与药物(例如细胞毒试剂)的效力相结合。近些年来,与单克隆抗体的开发、更有效的药物的使用和将这些组分共价结合的化学接头的设计相关的技术已经迅速进展。ADC的使用允许药物的局部递送,如果所述药物作为未缀合的药物施用,可能对正常细胞产生不可接受水平的毒性。换言之,因此寻找具有最小毒性的最大功效。设计和改进ADC的努力集中于抗体的选择性以及药物作用机制、药物连接、药物/抗体比例(加载或DAR)和药物释放性质上。药物部分可以通过机制发挥其细胞毒性和细胞抑制作用,所述机制包括微管蛋白结合、DNA结合、蛋白酶体、核糖体功能的损害、蛋白质合成和/或拓扑异构酶抑制。当与大的抗体缀合时,一些细胞毒性药物倾向于为无活性的或较低活性的。必须单独表征每种抗体,设计合适的接头,并确定合适的细胞毒试剂,所述试剂在递送至肿瘤细胞后保持其效力。必须考虑癌靶点上的抗原密度,以及正常组织是否表达靶抗原。其他的考虑包括整个ADC是否在结合靶点后被内化;当考虑可能的正常组织暴露和/或所治疗的癌症的类型和阶段时,细胞抑制性或细胞毒性药物是否是优选的;以及连接抗体与药物有效负载的接头是可裂解的还是不可裂解的连接。此外,对于化合物的未来开发过程,抗体与药物部分的缀合比例必须是充分的,而不危及抗体的结合活性和/或药物的效力,并且不改变ADC的物理化学性质而导致聚集或有害性质。ADC是复杂的生物学分子,开发有效的ADC的挑战仍然是重要的问题。技术实现要素:发明概述本发明旨在解决该问题,并涉及下式(I)的ADC:Ab-(L-D)n(I)或其药学上可接受的盐,其中Ab为能够结合至人IGF-1R的抗体或其抗原结合片段,所述Ab选自:i)包含序列SEQIDNo.1、2和3的三条重链CDR和序列SEQIDNo.4、5和6的三条轻链CDR的抗体;ii)与i)的抗体竞争结合至IGF-1R的抗体;和iii)与i)的抗体结合至IGF-1R的相同表位的抗体;L为接头;D为下式(II)的药物部分:其中:R2为COOH、COOCH3或噻唑基;R3为H或(C1-C6)烷基;R9为H或(C1-C6)烷基;m为1至8之间的整数;波浪线表示与L连接的点;和n为1至12。本发明的一个实施方案涉及一种ADC,其中Ab选自:a)包含序列SEQIDNo.7、2和3的三条重链CDR和序列SEQIDNo.9、5和11的三条轻链CDR的抗体;b)包含序列SEQIDNo.7、2和3的三条重链CDR和序列SEQIDNo.10、5和11的三条轻链CDR的抗体;c)包含序列SEQIDNo.7、2和3的三条重链CDR和序列SEQIDNo.9、5和12的三条轻链CDR的抗体;和d)包含序列SEQIDNo.8、2和3的三条重链CDR和序列SEQIDNo.9、5和11的三条轻链CDR的抗体。本发明的一个实施方案涉及一种ADC,其中Ab选自:a)包含序列SEQIDNo.13的重链可变结构域和序列SEQIDNo.9、5和11的三条轻链CDR的抗体;b)包含序列SEQIDNo.14的重链可变结构域和序列SEQIDNo.10、5和11的三条轻链CDR的抗体;c)包含序列SEQIDNo.15的重链可变结构域和序列SEQIDNo.9、5和12的三条轻链CDR的抗体;d)包含序列SEQIDNo.16的重链可变结构域和序列SEQIDNo.9、5和11的三条轻链CDR的抗体;和e)包含序列SEQIDNo.17的重链可变结构域和序列SEQIDNo.9、5和12的三条轻链CDR的抗体。本发明的一个实施方案涉及一种ADC,其中Ab选自:a)包含序列SEQIDNo.18的轻链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体;b)包含序列SEQIDNo.19的轻链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体;c)包含序列SEQIDNo.20的轻链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体;d)包含序列SEQIDNo.21的轻链可变结构域和序列SEQIDNo.8、2和3的三条重链CDR的抗体;和e)包含序列SEQIDNo.22的轻链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体。在一个实施方案中,本发明涉及一种ADC,其中Ab选自:i)抗体208F2、212A11、214F8、219D6和213B10;ii)与i)的抗体竞争结合至IGF-1R的抗体;和iii)与i)的抗体结合至IGF-1R的相同表位的抗体。本发明的一个实施方案涉及一种ADC,其中Ab为人源化抗体。本发明的一个实施方案涉及一种ADC,其中Ab选自抗体,所述抗体包含:a)分别具有序列SEQIDNo.7、2和3的CDR-H1、CDR-H2和CDR-H3的重链,和源自人种系IGHV1-46*01(SEQIDNo.46)的FR1、FR2和FR3,和源自人种系IGHJ4*01(SEQIDNo.48)的FR4;和b)分别具有序列SEQIDNo.9、5和11的CDR-L1、CDR-L2和CDR-L3的轻链,和源自人种系IGKV1-39*01(SEQIDNo.47)的FR1、FR2和FR3,和源自人种系IGKJ4*01(SEQIDNo.49)的FR4。在本发明的一个实施方案中,Ab选自:a)包含序列SEQIDNo.33或与SEQIDNo.33显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.9、5和11的三条轻链CDR的抗体;和b)包含序列SEQIDNo.34或与SEQIDNo.34显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.9、5和11的三条轻链CDR的抗体。在本发明的一个实施方案中,Ab选自:a)包含序列SEQIDNo.35或与SEQIDNo.35显示至少80%同一性的任何序列的轻链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体;和b)包含序列SEQIDNo.36或与SEQIDNo.36显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体。在本发明的一个实施方案中,Ab选自:a)包含或由序列SEQIDNo.37或与SEQIDNo.37显示至少80%同一性的任何序列的重链和序列SEQIDNo.39或与SEQIDNo.39显示至少80%同一性的任何序列的轻链组成的抗体;和b)包含或由序列SEQIDNo.38或与SEQIDNo.38显示至少80%同一性的任何序列的重链和序列SEQIDNo.40或与SEQIDNo.40显示至少80%同一性的任何序列的轻链组成的抗体。在本发明的一个实施方案中,Ab选自:a)包含选自SEQIDNo.56、62、64、66、68、70、72、74、76、78和80的序列或与SEQIDNo.56、62、64、66、68、70、72、74、76、78或80具有至少80%同一性的任何序列的重链可变结构域;和序列SEQIDNo.9、5和11的三条轻链CDR的抗体;b)包含选自SEQIDNo.57和60的序列或与SEQIDNo.57或60具有至少80%同一性的任何序列的轻链可变结构域;和序列SEQIDNo.7、2和3的三条重链CDR的抗体;和c)包含选自SEQIDNo.56、62、64、66、68、70、72、74、76、78和80的序列或与SEQIDNo.56、62、64、66、68、70、72、74、76、78或80具有至少80%同一性的任何序列的重链可变结构域;和选自SEQIDNo.57或60的序列或与SEQIDNo.57或60具有至少80%同一性的任何序列的轻链可变结构域的抗体。在本发明的一个实施方案中,Ab选自:a)选自SEQIDNo.58、63、65、67、69、71、73、75、77、79和81的序列或与SEQIDNo.58、63、65、67、69、71、73、75、77、79或81具有至少80%同一性的任何序列的重链;和b)选自SEQIDNo.59和61的序列或与SEQIDNo.59或61具有至少80%同一性的任何序列的轻链。本发明的一个实施方案涉及一种ADC,其中L为下式(III)的接头:其中L2为(C4-C10)环烷基-羰基、(C2-C6)烷基或(C2-C6)烷基-羰基;W为氨基酸单元;w为0至5之间的整数;Y为PAB-羰基,其中PAB为y为0或1;星号表示与D连接的点;和波浪线表示与Ab连接的点。本发明的一个实施方案涉及一种ADC,其中L2为下式:其中星号表示与(W)w连接的点;和波浪线表示与下式的马来酰亚胺部分的氮原子连接的点:在本发明的一个实施方案中,w=0,或w=2然后(W)w选自:其中星号表示与(Y)y连接的点;和波浪线表示与L2连接的点。本发明的一个实施方案涉及一种ADC,其中L选自:其中星号表示与D连接的点,并且波浪线表示与Ab连接的点。本发明的一个实施方案涉及一种ADC,其中(L-D)选自:其中波浪线表示与Ab连接的点。本发明的一个实施方案涉及一种ADC,其具有选自以下的式:和其药学上可接受的盐,其中Ab选自:i)抗体208F2、212A11、214F8、219D6和213B10;ii)与i)的抗体竞争结合至IGF-1R的抗体;和iii)与i)的抗体结合至IGF-1R的相同表位的抗体。本发明的一个实施方案涉及一种ADC,其中n为2。本发明的一个实施方案涉及一种ADC,其中n为4。本发明的一个实施方案涉及一种ADC,其作为药物的用途。本发明的一个实施方案涉及一种组合物,其包含如上面所描述的ADC。本发明的一个实施方案涉及一种组合物,其进一步包含药学上可接受的载体(vehicle)。本发明的一个实施方案涉及一种组合物,其用于治疗表达IGF-1R的癌症或IGF-1R相关的癌症的用途。表达IGF-1R的癌症或IGF-1R相关的癌症包括在其表面表达或过表达IGF-1R的全部或部分的肿瘤细胞。本发明的一个实施方案涉及一种组合物,其中所述表达IGF-1R的癌症选自乳腺癌、结肠癌、食管癌、肝细胞癌、胃癌、神经胶质瘤、肺癌、黑素瘤、骨肉瘤、卵巢癌、前列腺癌、横纹肌肉瘤、肾癌、甲状腺癌、子宫内膜癌、间皮瘤、口腔鳞状细胞癌和任何耐药的癌症。本发明的一个实施方案涉及一种用于在需要其的受试者中治疗表达IGF-1R的癌症的方法,其包括向受试者施用有效量的至少一种抗体-药物-缀合物或根据本发明的组合物。本发明的一个实施方案涉及一种试剂盒,其至少包含i)抗体-药物-缀合物和/或如上面所描述的组合物和ii)注射器或小瓶或安瓿,将所述抗体-药物-缀合物和/或组合物置于其中。发明详述I-抗体(Ab)术语“抗体(antibody)”、“抗体(antibodies)”、“ab”、“Ab”、“MAb”或“免疫球蛋白”在最广泛的意义上可互换地使用,其包括单克隆抗体,分离的、工程化的或重组的抗体(例如全长的或完整的单克隆抗体),多克隆抗体,多价抗体或多特异性抗体(例如双特异性抗体)和其抗体片段,只要它们显示所期望的生物学活性。在一个实施方案中,本发明的ADC的抗体由重组抗体组成。术语“重组抗体”是指在活细胞中由重组DNA的表达所产生的抗体。通过使用本领域技术人员熟知的基因重组的实验室方法,产生不会在生物有机体中发现的DNA序列,以获得本发明的ADC的重组抗体。在另一个实施方案中,本发明的ADC的抗体由化学合成的抗体组成。更特别地,该分子由糖蛋白组成,所述糖蛋白包含通过二硫键互相连接的至少两条重(H)链和两条轻(L)链。每条重链包含重链可变区(或结构域)(在本文中缩写为HCVR或VH)和重链恒定区。重链恒定区包含三个结构域,即CH1、CH2和CH3。每条轻链包含轻链可变区(在本文中缩写为LCVR或VL)和轻链恒定区。轻链恒定区包含一个结构域,即CL。VH和VL区可以进一步细分为被称作互补决定区(CDR)的高变区(regionofhypervariability),所述高变区中散布着被称作框架区(FR)的更保守的区。每个VH和VL由三个CDR和四个FR组成,从氨基末端至羧基末端按照以下顺序排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。重链和轻链的可变区含有与抗原相互作用的结合域。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子的结合,所述宿主组织或因子包括免疫系统的各种细胞(例如效应细胞)和经典补体系统的第一组分(C1q)。根据本发明的ADC的抗体的“抗原结合片段”或“IGF-1R结合片段”旨在表示任何肽、多肽或蛋白质,其保留结合至抗体的靶点(通常也被称作抗原)的能力。在一个实施方案中,该“抗原结合片段”选自Fv、scFv(sc表示单链)、Fab、F(ab’)2、Fab’、scFv-Fc片段或双抗体、或已通过化学修饰或通过掺入脂质体中延长半衰期的任何片段,所述化学修饰如加入聚(亚烷基)二醇(如聚乙二醇)(“PEG化”)(被称作Fv-PEG、scFv-PEG、Fab-PEG、F(ab’)2-PEG或Fab'-PEG的聚乙二醇化片段)(“PEG”表示聚乙二醇),所述片段具有至少一个根据本发明的抗体的特有CDR。优选地,所述“抗原结合片段”将包含或将由它们来源的抗体的重或轻可变链的部分序列构成,所述部分序列足以保留与其所起源的抗体相同的结合特异性,和充足的对于靶点的亲和力,优选至少等于其所起源的抗体的亲和力的1/100,更优选至少1/10。更优选地,所述“抗原结合片段”至少将包含或将由它们所来源的抗体的重可变链的三个CDR(CDR-H1、CDR-H2和CDR-H3)和轻可变链的三个CDR(CDR-L1、CDR-L2和CDR-L3)构成。“结合(binding)”,“结合(bind)”等是指抗体或其任何抗原结合片段与抗原形成复合物,所述复合物在生理条件下相对稳定。特异性结合的特征在于至少约1x10-6M的平衡解离常数。用于确定两种分子是否结合的方法是本领域技术人员熟知的,所述方法包括例如平衡透析、表面等离子体共振、放射性标记分析等。为了避免疑问,这并不意味着所述抗体不能在低水平结合至或干扰另一种抗原。然而,作为一个实施方案,所述抗体仅结合至所述抗原。如在本说明书中所使用,表述“IGF-1R抗体”应被解释为与“抗IGF-1R抗体”类似,并且是指能够结合至IGF-1R的抗体。在本申请的一个实施方案中,抗体的表位优选定位(localize)于人IGF-1R的细胞外结构域(也被称作IGF-1RECD)。在一个特别的实施方案中,抗体或其任何抗原结合片段能够以10x10-10至1x10-10,更优选8x10-10至2x10-10的EC50结合至IGF-1R。术语半最大有效浓度(EC50)对应于药物、抗体或毒物的浓度,所述浓度在一些特定的暴露时间后诱导在基线和最大值中间的应答。其通常被用作药物效力的量度。因此,分级剂量应答曲线的EC50表示化合物的浓度,在所述浓度观察到所述化合物的最大作用的50%。量化剂量应答曲线的EC50表示化合物的浓度,在所述浓度在特定的暴露持续时间后50%的群体表现出应答。浓度测量典型地遵循S形曲线,在相对小的浓度变化下快速增加。这可以通过最佳拟合线的推导从数学上确定。作为一个优选的实施方案,在本发明中确定的EC50表征抗体结合至暴露于人肿瘤细胞上的IGF-1RECD的效力。使用FACS分析确定EC50参数。EC50参数反映了抗体浓度,在该浓度获得在人肿瘤细胞上表达的人IGF-1R上的最大结合的50%。使用四参数回归曲线拟合程序(PrismSoftware),以剂量应答曲线的中点计算每个EC50值。已选择该参数作为生理/病理情况的代表。术语“表位”是被抗体结合的抗原的区。表位可以被定义为结构性的或功能性的。功能性表位通常为结构性表位的子集,并且具有直接有利于相互作用的亲和力的那些残基。表位还可以为构象性的,即由非直链氨基酸组成。在某些实施方案中,表位可以包括决定簇(determinant),所述决定簇为分子的化学活性表面基团,如氨基酸、糖侧链、磷酰基或磺酰基,并且在某些实施方案中,可以具有特定的三维结构特性,和/或特定的电荷特性。可以通过本领域技术人员已知的任何方法或技术确定IGF-1R结合的竞争,所述方法或技术如但不限于射线、表面胞质共振(Biacore)、ELISA、流式细胞术等。“竞争结合至IGF-1R”是指至少20%,优选至少50%,更优选至少70%的竞争。可以通过本领域技术人员已知的任何方法或技术确定结合至相同表位的确定,所述方法或技术如但不限于射线、表面胞质共振(Biacore)、ELISA、流式细胞术等。“结合至IGF-1R的相同表位”是指至少20%,优选至少50%,更优选至少70%的竞争。如上面所提及,与一般知识相反,本发明集中于特定的IGF-1R抗体,所述抗体在IGF-1R结合后呈现高的内化能力。如本文中所使用,“被内化的”或“内化的”(两种表述是相似的)抗体为在与哺乳动物细胞上的IGF-1R结合后被细胞摄取(意为其“进入”)的抗体。该抗体作为ADC的一部分是令人关注的,因此其将连接的细胞毒素定位或指向靶向的癌细胞。一旦被内化,细胞毒素触发癌细胞死亡。令人惊讶地,根据本发明的抗体对于CDR-H2、CDR-H3和CDR-L2都显示相同的序列,其他3个CDR是不同的。这种观察似乎是条理清楚的(coherent),因为其为关于抗体的结合特异性的公知常识的一部分,CDR-H3被描述为对于表位的识别是最重要的且最相关的。ADC治疗成功的关键被认为是靶抗原特异性和抗原-抗体复合物向癌细胞中的内化。显然,非内化抗原递送细胞毒试剂不如内化抗原有效。在抗原间内化过程是可变的,并且取决于多种参数,所述参数可以受到抗体影响。在ADC中,细胞毒剂赋予细胞毒活性,所使用的抗体负责针对癌细胞的特异性,以及载体(vector)负责进入细胞内以恰当地发挥细胞毒剂。因此,为了改善ADC,抗体可以表现出高的内化至靶向的癌细胞中的能力。抗体介导的内化的效率根据靶向的表位而显著不同。有效内化IGF-1R抗体的选择需要各种实验数据,所述数据不仅研究IGF-1R下调,而且还研究IGF-1R抗体向细胞中的内化。在一个实施方案中,可以通过具体用于内化机制的免疫荧光或FACS(流式细胞术)(如本申请下文中所示例)或本领域技术人员已知的任何方法或过程,评价根据本发明的ADC的抗体的内化。在一个优选的实施方案中,在结合至IGF-1R后,根据本发明的ADC的抗体可以诱导至少30%,优选50%,更优选80%的内化。在抗体与所述IGF-1R的ECD结合后,IGF-1R/抗体复合物被内化,并诱导细胞表面的IGF-1R的量的减少。可以通过本领域技术人员已知的任何方法,如非限制性示例的蛋白质印迹(western-blot)、FACS和免疫荧光,将这种减少量化。在一个实施方案中,优选可以通过FACS测量这种减少(由此反映内化),并将其表示为在4℃测量的平均荧光强度(MFI)和与抗体孵育4小时后在37℃测量的MFI之间的差或Δ。作为非限制性示例,使用i)与本文所描述的抗体孵育4小时后的乳腺癌细胞MCF7,和ii)用Alexa488标记的第二抗体,基于用未处理的细胞和用抗体处理的细胞获得的MFI测定该Δ。此参数被定义为使用下式计算:Δ(MFI4℃–MFI37℃)。这种MFI之间差反映IGF-1R下调,因为MFI与在细胞表面上表达的IGF-1R成比例。在一个有利的方面,抗体由在MCF-7中触发至少280,优选至少400的Δ(MFI4℃–MFI37℃)的抗体组成。更详细地,可以根据以下方法测量上面提及的Δ,所述方法必须被认为是说明性且非限制性的示例:a)在冷的(4℃)或温的(37℃)完全培养介质中,使用本发明的抗体处理并孵育感兴趣的肿瘤细胞;b)使用第二抗体平行地处理步骤a)的经处理的细胞和未处理的细胞;c)测量用第二标记抗体处理的和未处理的细胞的MFI(代表存在于表面的IGF-1R的量),所述第二标记抗体能够结合本发明的抗体;和d)用经处理的细胞获得的MFI减去用未处理的细胞获得的MFI以计算Δ。由该ΔMFI,内化百分比可以被确定为:100x(MFI4℃-MFI37℃)/MFI4℃.在MCF7中,根据本发明的ADC的抗体优选显示50%至99%,70%至90%,优选75%至87%的内化百分比。本文所描述的抗体的特别优点依赖于其内化速率。通常已知对于ADC,期望所使用的抗体显示快的内化速率,优选在施用抗体24小时内,更优选在12小时内,甚至更优选在6小时内。在本发明中,内化速率(也被称作细胞表面结合抗体减少或细胞表面抗体衰减)被表示为t1/2(半衰期),并且对应于获得ΔMFI的50%的减少所需的时间(根据以下示例将清楚地理解该方面)。特别的优点在于本发明的ADC的抗体具有5至25分钟,优选10至20分钟的t1/2。本发明的一个特别的实施方案涉及一种ADC,其中抗体Ab包含具有序列SEQIDNo.2的CDR-H2和序列SEQIDNo.3的CDR-H3的三条重链CDR,和具有序列SEQIDNo.5的CDR-L2的三条轻链CDR。本发明的一个特别的实施方案涉及一种ADC,其中抗体Ab包含序列SEQIDNos.1、2和3的三条重链CDR和序列SEQIDNo.4、5和6的三条轻链CDR。ADC的一个实施方案包含一种抗体,所述抗体包含三条重链CDR和三条轻链CDR,所述重链CDR包含或由序列SEQIDNo.1、2和3或与SEQIDNo.1、2或3显示至少80%,优选85%、90%、95%和98%同一性的任何序列组成,所述轻链CDR包含或由序列SEQIDNo.4、5和6或与SEQIDNo.4、5或6显示至少80%,优选85%、90%、95%和98%同一性的任何序列组成。在另一个实施方案中,抗体或其任何抗原结合片段包含三条重链CDR和三条轻链CDR,所述三条重链CDR包含序列SEQIDNo.1、2和3;三条轻链CDR包含序列SEQIDNo.4、5和6。已经定义IMGT独特编号以比较可变结构域,而不管抗原受体、链类型或物种[LefrancM.-P.,ImmunologyToday18,509(1997)/LefrancM.-P.,TheImmunologist,7,132-136(1999)/Lefranc,M.-P.,Pommié,C.,Ruiz,M.,Giudicelli,V.,Foulquier,E.,Truong,L.,Thouvenin-Contet,V.和Lefranc,Dev.Comp.Immunol.,27,55-77(2003)]。在IMGT独特编号中,保守氨基酸总具有相同的位置,例如半胱氨酸23(第1个CYS)、色氨酸41(保守-TRP)、疏水氨基酸89、半胱氨酸104(第2个CYS)、苯丙氨酸或色氨酸118(J-PHE或J-TRP)。IMGT独特编号提供了框架区的标准化划界(FR1-IMGT:位置1至26,FR2-IMGT:39至55,FR3-IMGT:66至104和FR4-IMGT:118至128),和互补决定区的标准化划界(CDR1-IMGT:27至38,CDR2-IMGT:56至65和CDR3-IMGT:105至117)。由于空位代表未占用的位置,CDR-IMGT长度(在括号中显示,并由点分隔,例如[8.8.13])成为了关键信息。在被称作IMGTColliersdePerles的2D图示中[Ruiz,M.和Lefranc,M.-P.,Immunogenetics,53,857-883(2002)/Kaas,Q.和Lefranc,M.-P.,CurrentBioinformatics,2,21-30(2007)],和IMGT/3D结构-DB的3D结构中[Kaas,Q.,Ruiz,M.和Lefranc,M.-P.,TcellreceptorandMHCstructuraldata.Nucl.Acids.Res.,32,D208-D210(2004)]使用IMGT独特编号。必须理解,在本说明书中没有矛盾的说明情况下,互补决定区或CDR是指如根据IMGT编号系统所定义的免疫球蛋白的重链和轻链的高变区。然而,还可以根据Kabat编号系统定义CDR(Kabat等人,Sequencesofproteinsofimmunologicalinterest,第5版,U.S.DepartmentofHealthandHumanServices,NIH,1991,和后续的版本)。有三条重链CDR和三条轻链CDR。在此处,根据情况,使用术语“CDR”和“CDRs”以指示一个或多个或甚至所有区,所述区含有大部分氨基酸残基,所述氨基酸残基负责抗体对其识别的抗原或表位的结合亲和力。为了简化本申请的阅读,没有定义根据Kabat的CDR。然而,对于本领域技术人员来说,使用根据IMGT的CDR的定义以根据Kabat定义CDR是显而易见的。在本发明的意义上,两个核酸或氨基酸序列之间的“同一性”或“同一性百分比”是指在最佳比对(optimalalignment)后获得的、待比较的两个序列之间的相同核苷酸或氨基酸残基的百分比,该百分比是纯统计学的,并且两个序列之间的差异沿着它们的长度随机分布。传统上通过在已经将两个核酸或氨基酸序列最佳比对后比较序列,进行所述两个核酸或氨基酸序列的比较,能够通过片段或通过使用“比对窗口”进行所述比较。除了手动比较,可以利用Smith和Waterman的局部同源性算法(1981)[Ad.App.Math.2:482],利用Needleman和Wunsch的局部同源性算法(1970)[J.Mol.Biol.48:443],利用Pearson和Lipman的相似搜索方法(1988)[Proc.Natl.Acad.Sci.USA85:2444],或利用使用这些算法的计算机软件(在WisconsinGeneticsSoftwarePackage中的GAP、BESTFIT、FASTA和TFASTA,GeneticsComputerGroup,575ScienceDr.,Madison,WI,或通过比较软件BLASTNR或BLASTP)进行用于比较的序列的最佳比对。通过确定位置的数量,在所述位置氨基酸核苷酸或残基在两个序列之间,优选在两个完整序列之间是相同的,在比对窗口中将相同的位置的数目除以位置的总数,并将结果乘以100计算同一性百分比,以获得两个序列之间的同一性百分比。例如,可以按缺省参数(尤其是对于参数“开放空位罚分”:5,和“延伸空位罚分”:2;所选择的矩阵例如为由程序提出的“BLOSUM62”矩阵)使用BLAST程序“BLAST2序列”(Tatusova等人,“Blast2sequences-anewtoolforcomparingproteinandnucleotidesequences”,FEMSMicrobiol.,1999,Lett.174:247–250),所述程序可在网站http://www.ncbi.nlm.nih.gov/gorf/bl2.html上获得;直接由程序计算待比较的两个序列之间的同一性百分比。对于与参考氨基酸序列显示至少80%,优选85%、90%、95%和98%同一性的氨基酸序列,优选的示例包括含有参考序列,某些修饰尤其是至少一个氨基酸的缺失、添加或替换,截短或延长的那些。在一个或多个连续或非连续氨基酸取代的情况下,优选取代,其中取代的氨基酸被“等价的”氨基酸替代。在此处,表述“等价氨基酸”是指可能取代一个结构性氨基酸的任何氨基酸,而不改变相应抗体和下面定义的那些具体示例的生物活性。等价氨基酸可以根据它们与被它们取代的氨基酸的结构同源性或可能产生的各种抗体之间的生物活性的比较试验的结果来确定。作为非限制性示例,下表1总结了可能进行的可能的取代,所述取代不导致相应的修饰抗体的生物活性的显著改变;在相同条件下逆向取代当然是可能的。表1本发明的一个特别的方面在于ADC的抗体不结合至胰岛素受体(IR)。该方面是令人关注的,因为本文所描述的抗体将不会对IR具有任何负面影响,意味着胰岛素代谢。在另一个实施方案中,本发明的ADC的抗体的另一个有利的方面在于其不仅能够结合至人IGF-1R,而且能够结合至猴IGF-1R,更特别地结合至食蟹猴(cynomolgus)IGF-1R。该方面也是令人关注的,因为其将促进临床试验所需要的毒性评估。在仍然另一个实施方案中,本发明的ADC的抗体由单克隆抗体组成。如本文中所使用的术语“单克隆抗体”或“Mab”是指从基本上均质的抗体群体中获得的抗体,即除了可能天然存在的突变(可以少量存在)之外,群体的单个抗体是相同的。单克隆抗体是高度特异性的,其针对单个表位。可以通过B细胞或杂交瘤的单个克隆产生这种单克隆抗体。单克隆抗体还可以为重组的,即通过蛋白质工程或化学合成产生。还可以从噬菌体抗体库中分离单克隆抗体。此外,与多克隆抗体的制剂相反,所述多克隆抗体典型地包括针对各种决定簇或表位的各种抗体,每种单克隆抗体针对抗原的单个表位。本文的单克隆抗体包括鼠的,嵌合的和人源化的抗体,如以下所描述的。抗体优选源自鼠源的杂交瘤,所述杂交瘤存放在法国国家微生物保藏中心(Frenchcollectionformicroorganismcultures)(CNCM,巴斯德研究所,红色医生街25号,巴黎15区75724,法国),通过融合Balb/C免疫的小鼠脾细胞/淋巴细胞与骨髓瘤Sp2/O-Ag14细胞系的细胞获得所述杂交瘤。在一个实施方案中,本发明的ADC的IGF-1R抗体由鼠抗体组成,然后被称作m[抗体的名称]。在一个实施方案中,IGF-1R抗体由嵌合抗体组成,然后被称作c[抗体的名称]。在一个实施方案中,IGF-1R抗体由人源化抗体组成,然后被称作hz[抗体的名称]。为了避免疑问,在下面的说明书中,表述“IGF-1R抗体”和“[抗体的名称]”是相似的,并且包括(无相反说明)所述IGF-1R抗体或所述“[抗体的名称]”的鼠的、嵌合的和人源化的形式。当必要时,使用前缀m-(鼠的)、c-(嵌合的)或hz-(人源化的)。为了更清楚,下表2阐明了用于优选的抗体的根据IMGT定义的CDR序列。表2对于本领域技术人员显而易见的是,如上面所描述的6个CDR的任何组合应当被认为是本发明的一部分。从该表2可以观察到,本文所描述的所有抗体对于CDR-H2、CDR-H3和CDR-L2具有相同的序列,如上面所描述该性质是特别令人关注的。一个具体的方面涉及一种ADC,其中抗体为鼠抗体,其特征在于所述抗体还包含轻链和重链恒定区,所述恒定区源自与小鼠,尤其是与人异源的物种的抗体。另一个具体的方面涉及一种ADC,其中抗体为嵌合(c)抗体,其特征在于所述抗体还包含轻链和重链恒定区,所述恒定区源自与小鼠,尤其是与人异源的物种的抗体。嵌合抗体为含有源自指定物种的抗体的天然可变区(轻链和重链),以及与所述指定物种异源的物种的抗体的轻链和重链的恒定区的抗体。可以通过使用重组遗传学的技术制备嵌合抗体。例如,可以通过克隆重组DNA生产嵌合抗体,所述重组DNA含有启动子,和编码非人单克隆抗体(尤其是鼠)的可变区的序列,和编码异源物种抗体恒定区(优选人)的序列。由一种这样的重组基因编码的根据本发明的ADC的嵌合抗体可以为,例如小鼠-人嵌合体,该抗体的特异性由源自鼠DNA的可变区决定,其同种型由源自人DNA的恒定区决定。在一个优选的但非限制性的实施方案中,本发明的ADC的抗体选自:a)包含序列SEQIDNo.13或与SEQIDNo.13显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.9、5和11的三条轻链CDR的抗体;b)包含序列SEQIDNo.14或与SEQIDNo.14显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.10、5和11的三条轻链CDR的抗体;c)包含序列SEQIDNo.15或与SEQIDNo.15显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.9、5和12的三条轻链CDR的抗体;d)包含序列SEQIDNo.16或与SEQIDNo.16显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.9、5和11的三条轻链CDR的抗体;和e)包含序列SEQIDNo.17或与SEQIDNo.17显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.9、5和12的三条轻链CDR的抗体。“与SEQIDNo.13至17显示至少80%,优选85%、90%、95%和98%同一性的任何序列”是指序列,所述序列显示三条重链CDRSEQIDNO.1、2和3,此外在对应于CDR的序列(即SEQIDNo.1、2和3)之外显示与全序列SEQIDNo.13至17至少80%,优选85%、90%、95%和98%同一性。在另一个优选的但非限制性的实施方案中,本发明的ADC的抗体选自:a)包含序列SEQIDNo.18或与SEQIDNo.18显示至少80%同一性的任何序列的轻链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体;b)包含序列SEQIDNo.19或与SEQIDNo.19显示至少80%同一性的任何序列的轻链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体;c)包含序列SEQIDNo.20或与SEQIDNo.20显示至少80%同一性的任何序列的轻链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体;d)包含序列SEQIDNo.21或与SEQIDNo.21显示至少80%同一性的任何序列的轻链可变结构域和序列SEQIDNo.8、2和3的三条重链CDR的抗体;和e)包含序列SEQIDNo.22或与SEQIDNo.22显示至少80%同一性的任何序列的轻链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体。“与SEQIDNo.18至22显示至少80%,优选85%、90%、95%和98%同一性的任何序列”分别是指序列,所述序列显示三条轻链CDRSEQIDNO.4、5和6,此外在对应于CDR的序列(即SEQIDNo.4、5和6)之外显示与全序列SEQIDNo.18至22至少80%,优选85%、90%、95%和98%同一性。本发明的一个实施方案涉及一种ADC,其中Ab为选自以下的抗体:a)包含序列SEQIDNo.13或与SEQIDNo.13显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.18或与SEQIDNo.18显示至少80%同一性的任何序列的轻链可变结构域的抗体;b)包含序列SEQIDNo.14或与SEQIDNo.14显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.19或与SEQIDNo.19显示至少80%同一性的任何序列的轻链可变结构域的抗体;c)包含序列SEQIDNo.15或与SEQIDNo.15显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.20或与SEQIDNo.20显示至少80%同一性的任何序列的轻链可变结构域的抗体;d)包含序列SEQIDNo.16或与SEQIDNo.16显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.21或与SEQIDNo.21显示至少80%同一性的任何序列的轻链可变结构域的抗体;和e)包含序列SEQIDNo.17或与SEQIDNo.17显示至少80%同一性的任何序列的重链可变结构域和序列SEQIDNo.22或与SEQIDNo.22显示至少80%同一性的任何序列的轻链可变结构域的抗体。还可以以恒定结构域表征本文所描述的嵌合抗体,更特别地,所述嵌合抗体可以选自或设计为,如但不限于IgG1、IgG2、IgG3、IgM、IgA、IgD或IgE。更优选地,在本发明的上下文中,所述嵌合抗体为IgG1或IgG4。本发明的一个实施方案涉及一种ADC,其中Ab为嵌合抗体,其包含如上面以IgG1形式描述的可变结构域VH和VL。更优选地,所述嵌合抗体包含序列SEQIDNo.43的VH的恒定结构域和序列SEQIDNo.45的VL的κ结构域。本发明的一个实施方案涉及一种ADC,其中Ab为嵌合抗体,其包含如上面以IgG4形式描述的可变结构域VH和VL。更优选地,所述嵌合抗体包含序列SEQIDNo.44的VH的恒定结构域和序列SEQIDNo.45的VL的κ结构域。在另一个优选的但非限制性的实施方案中,本发明的ADC的抗体选自:a)包含或由序列SEQIDNo.23或与SEQIDNo.23显示至少80%同一性的任何序列的重链和序列SEQIDNo.28或与SEQIDNo.28显示至少80%同一性的任何序列的轻链组成的抗体;b)包含或由序列SEQIDNo.24或与SEQIDNo.24显示至少80%同一性的任何序列的重链和序列SEQIDNo.29或与SEQIDNo.29显示至少80%同一性的任何序列的轻链组成的抗体;c)包含或由序列SEQIDNo.25或与SEQIDNo.25显示至少80%同一性的任何序列的重链和序列SEQIDNo.30或与SEQIDNo.30显示至少80%同一性的任何序列的轻链组成的抗体;d)包含或由序列SEQIDNo.26或与SEQIDNo.26显示至少80%同一性的任何序列的重链和序列SEQIDNo.31或与SEQIDNo.31显示至少80%同一性的任何序列的轻链组成的抗体;和e)包含或由序列SEQIDNo.27或与SEQIDNo.27显示至少80%同一性的任何序列的重链和序列SEQIDNo.32或与SEQIDNo.32显示至少80%同一性的任何序列的轻链组成的抗体。为了更清楚,下表3分别阐明了用于优选的嵌合抗体的VH和VL的序列。表3本发明的另一个具体的方面涉及一种ADC,其中“Ab”为人源化抗体,其特征在于源自人抗体的轻链和重链的恒定区分别为λ或κ区和γ-1、γ-2或γ-4区。“人源化抗体”是指含有源自非人源抗体的CDR区的抗体,抗体分子的其他部分源自一种(或几种)人抗体。此外,可以修饰一些骨架片段残基(称为FR)以保留结合亲和力。可以通过本领域技术人员已知的技术制备人源化抗体或其片段。这样的人源化抗体优选在涉及体外诊断或体内预防性和/或治疗性处理的方法中使用。本领域技术人员还已知其他的人源化技术,例如由PDL在专利EP0451216、EP0682040、EP0939127、EP0566647或US5,530,101、US6,180,370、US5,585,089和US5,693,761中描述的“CDR嫁接”技术。还可以引用美国专利5,639,641或6,054,297、5,886,152和5,877,293。作为本发明的一个特别的实施方案,并且其将在下文的实施例中更详细地被说明,本文描述了由hz208F2组成的抗体。这种人源化还可以被应用于本发明的其他抗体部分。在一个优选的实施方案中,根据本发明的ADC的抗体包含重链可变结构域(VH),所述重链可变结构域具有:i)分别地,序列SEQIDNo.7、2和3的CDR-H1、CDR-H2和CDR-H3,和ii)源自人种系IGHV1-46*01(SEQIDNo.46)的FR1、FR2和FR3,和iii)源自人种系IGHJ4*01(SEQIDNo.48)的FR4。在一个优选的实施方案中,根据本发明的ADC的抗体包含轻链可变结构域(VL),所述轻链可变结构域具有:i)分别地,序列SEQIDNo.9、5和11的CDR-L1、CDR-L2和CDR-L3,和ii)源自人种系IGKV1-39*01(SEQIDNo.47)的FR1、FR2和FR3,和iii)源自人种系IGKJ4*01(SEQIDNo.49)的FR4。在本发明的一个优选的但非限制性的实施方案中,抗体包含:a)分别具有序列SEQIDNo.7、2和3的CDR-H1、CDR-H2和CDR-H3的重链,和源自人种系IGHV1-46*01(SEQIDNo.46)的FR1、FR2和FR3,和源自人种系IGHJ4*01(SEQIDNo.48)的FR4;和b)分别具有序列SEQIDNo.9、5和11的CDR-L1、CDR-L2和CDR-L3的轻链,和源自人种系IGKV1-39*01(SEQIDNo.47)的FR1、FR2和FR3,和源自人种系IGKJ4*01(SEQIDNo.49)的FR4。在一个实施方案中,根据本发明的ADC的抗体包含序列SEQIDNo.33的重链可变结构域(VH)和序列SEQIDNo.35的轻链可变结构域(VL)。所述人源化抗体在下文中将被称作hz208F2(“变体1”或“Var.1”)。在另一个实施方案中,根据本发明的ADC的抗体包含序列SEQIDNo.33的重链可变结构域(VH),其中所述序列SEQIDNo.33包含至少1个选自残基20、34、35、38、48、50、59、61、62、70、72、74、76、77、79、82和95的回复突变。表述“回复突变(back-mutation)”或“回复突变(backmutation)”是指存在于种系中的人残基被替代为最初存在于鼠序列中的相应残基的突变或替代。在另一个实施方案中,根据本发明的ADC的抗体包含序列SEQIDNo.33的重链可变结构域(VH),其中所述序列SEQIDNo.33包含2、3、4、5、6、7、8、9、10、11、12、13、14、15、16或17个选自残基20、34、35、38、48、50、59、61、62、70、72、74、76、77、79、82和95的回复突变。为了更清楚,下表4阐明了优选的回复突变。表4残基序号2034353848505961鼠MIYKLWKN人VMHRMISA残基序号627072747677798295鼠ELAKSNAFF人QMRTTSVEY在一个实施方案中,根据本发明的ADC的抗体包含序列SEQIDNo.35的轻链可变结构域(VL),其中所述序列SEQIDNo.35包含至少1个选自残基22、53、55、65、71、72、77和87的回复突变。在一个实施方案中,根据本发明的ADC的抗体包含序列SEQIDNo.35的轻链可变结构域(VL),其中所述序列SEQIDNo.35包含2、3、4、5、6、7或8个选自残基22、53、55、65、71、72、77或87的回复突变。在另一个实施方案中,根据本发明的ADC的抗体包含:a)序列SEQIDNo.33的重链可变结构域(VH),其中所述序列SEQIDNo.33包含至少1个选自残基20、34、35、38、48、50、59、61、62、70、72、74、76、77、79、82和95的回复突变;和b)序列SEQIDNo.35的轻链可变结构域(VL),其中所述序列SEQIDNo.35包含至少1个选自残基22、53、55、65、71、72、77和87的回复突变。为了更清楚,下表5阐明了优选的回复突变。表5残基序号2253556571727787鼠SRHRYSNF人TSQSFTSY在一个这样的实施方案中,根据本发明的ADC的抗体包含上面提及的所有回复突变,并且对应于包含序列SEQIDNo.34的重链可变结构域(VH)和序列SEQIDNo.36的轻链可变结构域(VL)的抗体。所述人源化抗体在下文中将被称作hz208F2(“变体3”或“Var.3”)。在另一个实施方案中,本发明还涵盖变体1和变体3之间包含的所有人源化形式。换言之,根据本发明的抗体对应于包含“共有”序列SEQIDNo.41的重链可变结构域(VH)和“共有”序列SEQIDNo.42的轻链可变结构域(VL)的抗体。总的来说,所述人源化抗体在下文中将被称作hz208F2(“变体2”或“Var.2”)。在一个优选的但非限制性的实施方案中,本发明的ADC的抗体选自:a)包含序列SEQIDNo.33或与SEQIDNo.33显示至少80%,优选85%、90%、95%和98%同一性的任何序列的重链可变结构域和序列SEQIDNo.9、5和11的三条轻链CDR的抗体;和b)包含序列SEQIDNo.34或与SEQIDNo.34显示至少80%,优选85%、90%、95%和98%同一性的任何序列的重链可变结构域和序列SEQIDNo.9、5和11的三条轻链CDR的抗体。“与SEQIDNo.33或34显示至少80%,优选85%、90%、95%和98%同一性的任何序列”是指序列,所述序列显示三条重链CDRSEQIDNO.1、2和3,此外在对应于CDR的序列(即SEQIDNo.1、2和3)之外显示与全序列SEQIDNo.33或34至少80%,优选85%、90%、95%和98%同一性。如果在本说明书的相关段落中未指出,通过任何序列或通过与特定序列显示至少80%的序列,则必须理解,所述序列显示与参考序列至少80%,优选85%,90%、95%和98%同一性。无论这些序列是否含有CDR序列,其意指序列,所述序列显示至少这些与参考序列CDR相同的CDR,与全序列具有80%,优选85%,90%,95%和98%同一性,需要计算位于对应于这些CDR的序列之外的剩余序列。在一个优选的但非限制性的实施方案中,本发明的抗体选自:a)包含序列SEQIDNo.35或与SEQIDNo.35显示至少80%,优选85%、90%、95%和98%同一性的任何序列的轻链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体;和b)包含序列SEQIDNo.36或与SEQIDNo.36显示至少80%,优选85%、90%、95%和98%同一性的任何序列的轻链可变结构域和序列SEQIDNo.7、2和3的三条重链CDR的抗体。“与SEQIDNo.35或36显示至少80%,优选85%、90%、95%和98%同一性的任何序列”是指序列,所述序列显示三条轻链CDRSEQIDNO.4、5和6,此外在对应于CDR的序列(即SEQIDNo.4、5和6)之外显示与全序列SEQIDNo.35或36至少80%,优选85%、90%、95%和98%同一性。还可以以恒定结构域表征本文所描述的人源化抗体,更特别地,所述人源化抗体可以选自或设计为,如但不限于IgG1、IgG2、IgG3、IgM、IgA、IgD或IgE。更优选地,在本发明的上下文中,所述人源化抗体为IgG1或IgG4。本发明的一个实施方案涉及一种ADC,其中“Ab”为人源化抗体,其包含如上面以IgG1形式描述的可变结构域VH和VL。更优选地,所述人源化抗体包含序列SEQIDNo.43的VH的恒定结构域和序列SEQIDNo.45的VL的κ结构域。本发明的一个实施方案涉及一种ADC,其中“Ab”为人源化抗体,其包含如上面以IgG4形式描述的可变结构域VH和VL。更优选地,所述人源化抗体包含序列SEQIDNo.44的VH的恒定结构域和序列SEQIDNo.45的VL的κ结构域。本发明的仍然另一个实施方案涉及一种ADC,其中“Ab”为选自以下的抗体:a)包含或由序列SEQIDNo.37或与SEQIDNo.37显示至少80%同一性的任何序列的重链和序列SEQIDNo.39或与SEQIDNo.39显示至少80%同一性的任何序列的轻链组成的抗体;和b)包含或由序列SEQIDNo.38或与SEQIDNo.38显示至少80%同一性的任何序列的重链和序列SEQIDNo.40或与SEQIDNo.40显示至少80%同一性的任何序列的轻链组成的抗体。为了更清楚,下表6a阐明了人源化抗体hz208F2的变体1(Var.1)和变体3(Var.3)的VH和VL的序列的非限制性示例。其还包含变体2(Var.2)的共有序列。表6a在另一个优选的但非限制性的实施方案中,本发明的ADC的抗体选自:a)包含选自SEQIDNo.56、62、64、66、68、70、72、74、76、78和80的序列或与SEQIDNo.56、62、64、66、68、70、72、74、76、78和80具有至少80%,优选85%、90%、95%和98%同一性的任何序列的重链可变结构域,和序列SEQIDNo.9、5和1的三条轻链CDR的抗体;b)包含选自SEQIDNo.57或60的序列或与SEQIDNo.57或60具有至少80%,优选85%、90%、95%和98%同一性的任何序列的轻链可变结构域,和序列SEQIDNo.7、2和3的三条重链CDR的抗体;和c)包含选自SEQIDNo.56、62、64、66、68、70、72、74、76、78和80的序列或与SEQIDNo.56、62、64、66、68、70、72、74、76、78和80具有至少80%,优选85%、90%、95%和98%同一性的任何序列的重链可变结构域,和选自SEQIDNo.57或60的序列或与SEQIDNo.57或60具有至少80%,优选85%、90%、95%和98%同一性的任何序列的轻链可变结构域的抗体。本发明的仍然另一个实施方案涉及一种ADC,其中“Ab”为选自以下的抗体:a)包含序列SEQIDNo.56、62、64、66、68、70、72、74、76、78和80或与SEQIDNo.56、62、64、66、68、70、72、74、76、78或80显示至少80%同一性的任何序列的重链,和序列SEQIDNo.57或与SEQIDNo.57显示至少80%同一性的任何序列的轻链的抗体;和b)包含序列SEQIDNo.56、64、68和78或与SEQIDNo.56、64、68或78显示至少80%同一性的任何序列的重链和序列SEQIDNo.60或与SEQIDNo.60显示至少80%同一性的任何序列的轻链的抗体。本发明的仍然另一个实施方案涉及一种ADC,其中Ab为选自以下的抗体:a)包含或由序列SEQIDNo.58或与SEQIDNo.58显示至少80%同一性的任何序列的重链和序列SEQIDNo.59或与SEQIDNo.59显示至少80%同一性的任何序列的轻链组成的抗体;b)包含或由序列SEQIDNo.58或与SEQIDNo.58显示至少80%同一性的任何序列的重链和序列SEQIDNo.61或与SEQIDNo.61显示至少80%同一性的任何序列的轻链组成的抗体;c)包含或由序列SEQIDNo.63或与SEQIDNo.63显示至少80%同一性的任何序列的重链和序列SEQIDNo.59或与SEQIDNo.59显示至少80%同一性的任何序列的轻链组成的抗体;d)包含或由序列SEQIDNo.65或与SEQIDNo.65显示至少80%同一性的任何序列的重链和序列SEQIDNo.59或与SEQIDNo.59显示至少80%同一性的任何序列的轻链组成的抗体;e)包含或由序列SEQIDNo.65或与SEQIDNo.65显示至少80%同一性的任何序列的重链和序列SEQIDNo.61或与SEQIDNo.61显示至少80%同一性的任何序列的轻链组成的抗体;f)包含或由序列SEQIDNo.67或与SEQIDNo.67显示至少80%同一性的任何序列的重链和序列SEQIDNo.59或与SEQIDNo.59显示至少80%同一性的任何序列的轻链组成的抗体;g)包含或由序列SEQIDNo.69或与SEQIDNo.69显示至少80%同一性的任何序列的重链和序列SEQIDNo.59或与SEQIDNo.59显示至少80%同一性的任何序列的轻链组成的抗体;h)包含或由序列SEQIDNo.69或与SEQIDNo.69显示至少80%同一性的任何序列的重链和序列SEQIDNo.61或与SEQIDNo.61显示至少80%同一性的任何序列的轻链组成的抗体;i)包含或由序列SEQIDNo.71或与SEQIDNo.71显示至少80%同一性的任何序列的重链和序列SEQIDNo.59或与SEQIDNo.59显示至少80%同一性的任何序列的轻链组成的抗体;j)包含或由序列SEQIDNo.73或与SEQIDNo.73显示至少80%同一性的任何序列的重链和序列SEQIDNo.59或与SEQIDNo.59显示至少80%同一性的任何序列的轻链组成的抗体;k)包含或由序列SEQIDNo.75或与SEQIDNo.75显示至少80%同一性的任何序列的重链和序列SEQIDNo.59或与SEQIDNo.59显示至少80%同一性的任何序列的轻链组成的抗体;l)包含或由序列SEQIDNo.77或与SEQIDNo.77显示至少80%同一性的任何序列的重链和序列SEQIDNo.59或与SEQIDNo.59显示至少80%同一性的任何序列的轻链组成的抗体;m)包含或由序列SEQIDNo.79或与SEQIDNo.79显示至少80%同一性的任何序列的重链和序列SEQIDNo.59或与SEQIDNo.59显示至少80%同一性的任何序列的轻链组成的抗体;n)包含或由序列SEQIDNo.79或与SEQIDNo.79显示至少80%同一性的任何序列的重链和序列SEQIDNo.61或与SEQIDNo.61显示至少80%同一性的任何序列的轻链组成的抗体;和o)包含或由序列SEQIDNo.81或与SEQIDNo.81显示至少80%同一性的任何序列的重链和序列SEQIDNo.59或与SEQIDNo.59显示至少80%同一性的任何序列的轻链组成的抗体。换言之,本发明涉及一种ADC,其中Ab为包含以下的抗体:a)选自SEQIDNo.58、63、65、67、69、71、73、75、77、79和81的序列或与SEQIDNo.58、63、65、67、69、71、73、75、77、79和81具有至少80%同一性的任何序列的重链;和b)选自SEQIDNo.59和61的序列或与SEQIDNo.59和61具有至少80%同一性的任何序列的轻链。为了更清楚,下表6b阐明了人源化抗体hz208F2的不同变体的VH和VL(可变结构域和全长)的序列的非限制性示例。表6b本发明的另一个方面为一种ADC,其中Ab为选自以下的抗体:i)由杂交瘤I-4757、I-4773、I-4775、I-4736或I-4774生产的抗体,所述杂交瘤分别在2013年5月30日、2013年6月26日、2013年6月26日、2013年4月24日和2013年6月26日保藏于CNCM,法国巴斯德研究所;或ii)与i)的抗体竞争结合至IGF-1R的抗体;或iii)与i)的抗体结合至IGF-1R的相同表位的抗体。事实上,在本文中描述了选自杂交瘤I-4757、I-4773、I-4775、I-4736和I-4774的鼠杂交瘤,所述杂交瘤分别在2013年5月30日、2013年6月26日、2013年6月26日、2013年4月24日和2013年6月26日保藏于CNCM,法国巴斯德研究所。还描述了根据本发明的编码抗体或其抗原结合片段的离体的核酸。在本说明书中可互换使用的术语“核酸”、“核酸序列(nucleicsequence)”、“核酸序列(nucleicacidsequence)”、“多核苷酸”、“寡核苷酸”、“多核苷酸序列”和“核苷酸序列”是指精确的核苷酸序列,其为修饰的或未修饰的,其定义核酸的片段或区域,其含有或不含有非天然核苷酸,并且其为双链DNA、单链DNA或所述DNA的转录产物。这些序列已经被分离和/或纯化,即它们被直接或间接采样,例如通过拷贝,其环境已经被至少部分地修饰。在此处还应该提及通过重组遗传学,例如利用宿主细胞获得的离体的核酸,或通过化学合成获得的离体的核酸。还描述了载体,其包含编码根据本发明的ADC的抗体或其抗原结合片段的核酸,还特别描述了含有这样的核苷酸序列的克隆和/或表达载体。载体优选含有元件,所述元件允许指定宿主细胞中的核苷酸序列的表达和/或分泌。因此,载体可以含有启动子,翻译起始和终止信号,以及合适的转录调节区。其必须能够以稳定的方式保持在宿主细胞中,并且可以任选具有特异性信号,所述信号指定经翻译的蛋白质的分泌。由本领域技术人员根据所使用的宿主细胞选择和优化这些不同的元件。为了该目的,核苷酸序列可以被插入所选宿主内的自我复制载体中,或者为所选宿主的整合载体。载体例如为质粒或病毒来源的载体。它们用于转化宿主细胞以克隆或表达本发明的核苷酸序列。通过本领域技术人员通常使用的方法制备这样的载体,并且可以通过标准方法将所得的克隆导入至合适的宿主中,所述标准方法如脂质转染、电穿孔、缀合、热休克或化学方法。通过如上面所描述的载体转化这些离体的宿主细胞,或者这些离体的宿主细胞包含如上面所描述的载体。宿主细胞可以选自原核或真核系统,例如细菌细胞,但也可以选自酵母细胞或动物细胞,尤其是哺乳动物细胞(除了人)。还可以使用昆虫或植物细胞。还公开了用于生产根据本发明的ADC的抗体或其抗原结合片段的方法,其中所述方法包括以下步骤:a)在在介质中于合适的培养条件培养如上面所公开的宿主细胞;和b)从培养介质或从所述培养的细胞中回收由此产生的抗体。在用于制备根据本发明的ADC的重组抗体的方法中使用经转化的细胞。本说明书中还包括用于使用如上面所公开的载体和/或由载体转化的细胞制备重组形式的抗体的方法。优选地,在某种条件下培养如上面所描述的由载体转化的细胞,所述条件允许上述抗体的表达和所述抗体的回收。如已经提及的,宿主细胞可以选自原核或真核系统。特别地,在这样的原核或真核系统中能够鉴定促进分泌的核苷酸序列。因此,如上面所公开的携带这样的序列的载体可以有利地用于待分泌的重组蛋白的生产。事实上,这些令人感兴趣的重组蛋白存在于细胞培养物的上清液中而非在宿主细胞内,这将促进所述重组蛋白的纯化。还可以通过化学合成制备本发明的ADC的抗体。一种这样的制备方法也是本发明的目的。本领域技术人员知道用于化学合成的方法,如通过片段的缩合或通过溶液中的常规合成的固相技术或部分固相技术。还可以引用通过化学合成获得并且能够含有对应的非天然氨基酸的多肽。本发明还包括通过上面所描述的方法可能获得的抗体。根据一个特别的方面,本发明涉及一种ADC,其中AB为如上面所描述的抗体或其抗原结合片段,其用作寻址载体(addressingvehicle)用于在宿主靶位点递送细胞毒试剂,所述宿主靶位点由表位组成,所述表位被定位于IGF-1R,优选IGF-1R细胞外结构域,更优选人IGF-1R(SEQIDNo.50),还更优选人IGF-1R细胞外结构域(SEQIDNo.51),还更优选至人IGF-1R细胞外结构域的N-末端(SEQIDNo.52)或其任何天然变体序列。在一个优选的实施方案中,所述宿主靶位点为哺乳动物细胞的靶位点,更优选人细胞的靶位点,更优选天然表达或通过基因重组表达IGF-1R的细胞的靶位点。在更多的实施方案中,所述宿主靶位点为患有癌症的患者的细胞的靶位点,所述患者优选为人,所述癌症优选为表达IGF-1R的癌症或IGF-1R相关的癌症。表达IGF-1R的癌症或IGF-1R相关的癌症特别地包括癌症,其中肿瘤细胞在其表面表达或过表达全部或部分的IGF-1R。II-药物(D)根据本发明的药物部分具有下式(II)其中:-R2为COOH、COOCH3或噻唑基(如噻唑-2-基),-R3为H或(C1-C6)烷基(如甲基),特别是(C1-C6)烷基,-R9为H或(C1-C6)烷基(如甲基),-m为1至8之间的整数,和-波浪线表示与L连接的点。本发明中的“烷基”是指直链或支链、饱和的烃链。例如,可以提及的是甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基或己基。本发明中的“(Cx-Cy)烷基”是指包含x至y个碳原子的如上面所定义的烷基链。因此,(C1–C6)烷基为具有1至6个碳原子的烷基链。(C1–C6)烷基有利地为(C1–C4)烷基,优选(C1–C2)烷基。在本发明的化合物中,一类特别推荐的药物部分对应于式(II)的药物部分,其中R2表示COOH基团。另一类特别推荐的部分对应于式(II)的部分,其中R2为噻唑(特别是噻唑-2-基)。另一类特别推荐的部分对应于式(II)的部分,其中R2为COOMe。根据本发明的一个特别的实施方案,R2更特别地为COOH、COOMe或噻唑-2-基。根据第一个优选的实施方案,R2为COOH。根据第二个优选的实施方案,R2为COOMe。R3特别地表示(C1-C6)烷基,有利地为甲基。m为1至8之间,特别地1至6之间,有利地1至4之间的整数,优选为1或2。在一个优选的实施方案中,R2为COOH,R3为甲基,且m为1或2。在本发明的药物部分中,一类特别推荐的药物部分对应于式(II)的药物部分,其中R9为甲基或氢。在一个优选的实施方案中:-R2为COOH,R3为甲基,R9为甲基,且m为1或2,或-R2为COOH,R3为甲基,R9为氢,且m为1或2。根据一个优选的实施方案,NR9基团位于苯环上相对于(CH2)m基团的对位。有利地,药物部分选自以下部分:(式DH的)药物的制备:可以使用在下面合成方案中描述的一般方法制备药物,所述一般方法当需要时任选补充任何标准操作,所述操作描述于文献中或对本领域技术人员而言是公知的,或描述于本文实验部分的实施例中。方案1阐明第一种可用于制备药物的一般方法。在上面通式中,R1=H,R2和R3如前面式II中所定义,R4代表R4a代表任选为受保护形式的如前面所定义的R4基团,且G为保护基。第一步由化合物(II)与化合物(III)的缩合组成,所述化合物(II)在其胺官能团上受保护基G保护。X可以代表离去基如氯。在这种情况下,第一步由酰氯(acidchloride)与胺的反应组成。可以使用本领域技术人员熟知的方法和技术进行该反应。在一个特别推荐的方法中,在有机或无机碱,例如Et3N、iPr2NEt、吡啶、NaH、Cs2CO3、K2CO3的存在下,在溶剂如THF、二氯甲烷、DMF、DMSO中,尤其在-20℃至100℃的温度,使这两种实体进行反应。X还可以为羟基(OH)。在这种情况下,第一步为羧酸(II)和胺(III)的缩合反应。可以依据本领域技术人员熟知的方法和技术进行该反应。在一个特别推荐的方法中,在偶联剂如1-(3-二甲基氨基丙基)-3-乙基-碳化二亚胺(EDC)、3-羟基-1,2,3-苯并三嗪-4(3H)-酮、叔胺如二异丙基乙胺的存在下,在极性非质子溶剂如二氯甲烷或DMF中,尤其在-15℃至40℃的温度,使这两种实体进行反应。在另一个特别推荐的方法中,在氰基磷酸二乙酯(DEPC)、叔胺如三乙胺的存在下,在极性非质子溶剂如二氯甲烷或DMF中,在-15℃至40℃的温度,使这两种实体进行反应。另一个特别推荐的方法由以下组成:在O-(7-氮杂苯并三唑-1-基)-1,1,3,3-四甲基-脲六氟磷酸酯(HATU)、叔胺如二异丙基乙胺的存在下,在极性非质子溶剂如二氯甲烷或DMF中,在-15℃至100℃的温度使这两种实体反应。在使用本领域技术人员熟知的技术(《ProtectiveGroupsinOrganicSynthesis》,T.W.Greene,JohnWiley&Sons,2006和《ProtectingGroups》,P.J.Kocienski,ThiemeVerlag,1994)将中间体脱保护后,可以依据上面所描述的方法和技术将化合物(IV)与化合物(V)缩合,以在脱保护步骤后产生化合物(VI)。然后,在与中间体(VII)缩合并任选脱保护后,该化合物可以导致药物的形成。化合物(VI)还可以与化合物(VII’)偶联,其中R’3为R3的前体,特别是受保护基保护的R3基团。基团R’3脱保护产生R3之后,可以依据如前面所描述的相同程序进行偶联。方案2阐明第二种可用于制备药物的一般方法。在上面通式中,G为保护基,R1=H,R2、R3和R4a如前面所定义,且R4b代表在第一步,将在其胺官能团上受保护基G保护的化合物(IX)与化合物(VI)缩合。X可以代表离去基,例如氯。在这种情况下,第一步由酰氯与胺的反应组成。可以使用本领域技术人员熟知的方法和技术进行该反应。在一个特别推荐的方法中,在有机或无机碱,如Et3N、iPr2NEt、吡啶、NaH、Cs2CO3、K2CO3的存在下,在溶剂如THF、二氯甲烷、DMF、DMSO中,尤其在-20°至100℃的温度,使这两种实体进行反应。X还可以代表羟基。在这种情况下,第一步为羧酸(IX)与胺(VI)的缩合反应。可以依据本领域技术人员熟知的方法和技术进行该反应。在一个特别推荐的方法中,在1-(3-二甲基氨基丙基)-3-乙基-碳化二亚胺(EDC)、3-羟基-1,2,3-苯并三嗪-4(3H)-酮、叔胺如二异丙基乙胺的存在下,在极性非质子溶剂如二氯甲烷或DMF中,尤其在-15℃至40℃的温度,使这两种实体进行反应。在另一个特别推荐的方法中,在氰基磷酸二乙酯(DEPC)、叔胺如三乙胺的存在下,在极性非质子溶剂如二氯甲烷或DMF中,尤其在-15℃至40℃的温度,使这两种实体进行反应。在中间体脱保护后,使用技术人员熟知的技术,将所得的化合物(VIII)与R4Y反应后可以产生药物。在这种情况下,Y为离去基如Cl、Br、I、OSO2CH3、OSO2CF3或O-甲苯磺酰基。在有机或无机碱,如Et3N、iPr2NEt、NaH、Cs2CO3、K2CO3的存在下,在极性无水溶剂如二氯甲烷、THF、DMF、DMSO中,尤其在-20°至100℃的温度进行该反应。在另一个特别推荐的方法中,使化合物(VIII)与式R4b-CHO的醛进行反应,其中R4b对应于R4的前体。在这种情况下,该反应为在还原剂如NaBH4、NaBH3CN、NaBH(OAc)3的存在下,在极性溶剂如1,2-二氯乙烷、二氯甲烷、THF、DMF、MeOH中,任选在异丙醇钛(IV)的存在下,在可以通过加入酸如乙酸控制的pH,尤其在-20℃至100℃的温度的还原胺化反应。在前述合成方案中,在附加的反应步骤如皂化反应(例如使用技术人员熟知的方法)之后一种药物可以产生另一种药物,由此将代表酯(COOMe)的R2基团转变为代表羧酸(COOH)的R2基团。如果期望在酸加成盐的状态下分离含有至少一个碱官能团的药物,则可以通过用合适的酸(优选以等同的量)处理药物的游离碱(含有至少一个碱官能团)。合适的酸可以特别地为三氟乙酸。III-接头(L)在本发明中,“接头”、“接头单元”、“L”或“连接(link)”是指包含共价键或原子链的化学部分,其将至少一种药物共价连接至抗体。可以使用各种双功能蛋白质偶联剂制备接头,所述偶联剂如N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯(SPDP)、琥珀酰亚胺基-4-(N-马来酰亚胺基甲基)环己烷-1-羧酸酯(SMCC)、亚氨基四氢噻吩(iminothiolane,IT)、亚氨酸酯的双官能团衍生物(如二甲基己二酰亚胺盐酸盐(dimethyladipimidateHCl))、活性酯(如二琥珀酰亚胺辛二酸酯)、醛(如戊二醛)、双-叠氮化合物(如双(对叠氮苯甲酰基)己二胺)、双-重氮衍生物(如双-(对重氮苯甲酰基)-乙二胺)、二异氰酸酯(如甲苯2,6-二异氰酸酯)和双-活性氟化合物(例如1,5-二氟-2,4-二硝基苯)。碳-14-标记的1-异硫氰酸苄基-3-甲基二亚乙基三胺五乙酸(MX-DTPA)为一种示例性螯合剂,用于将细胞毒试剂缀合至寻址系统。其他交联剂可以为BMPS、EMCS、GMBS、HBVS、LC-SMCC、MBS、MPBH、SBAP、SIA、SIAB、SMCC、SMPB、SMPH、硫代-EMCS、硫代-GMBS、硫代-KMUS、硫代-MBS、硫代-SIAB、硫代-SMCC和硫代-SMPB和SVSB(琥珀酰亚胺基-(4-乙烯基砜)苯甲酸酯),它们是市售可得的(例如,购自PierceBiotechnology,Inc.,Rockford,Ill.,美国)。接头可以为“不可裂解的”或“可裂解的”。在一个优选的实施方案中,其在于“可裂解的接头”促进药物在细胞中的释放。例如,可以使用酸不稳定接头、肽酶敏感接头、光不稳定接头、二甲基接头或含有二硫化物的接头。在一个优选的实施方案中,接头在细胞内条件下是可裂解的,使得在细胞内环境中裂解接头从抗体上释放药物。例如,在一些实施方案中,可以通过裂解剂裂解接头,所述裂解剂存在于细胞内环境中(例如,在溶酶体或核内体(endosome)或胞膜窖内)。接头可以为例如肽基接头,其被细胞内肽酶或蛋白酶(包括但不限于溶酶体蛋白酶或核内体蛋白酶)裂解。典型地,肽基接头包含至少两个连续的氨基酸或至少三个连续的氨基酸,或者为至少两个氨基酸长或至少三个氨基酸长。裂解剂可以包括组织蛋白酶B和D及纤溶酶,所有这些都已知水解二肽药物衍生物,导致活性药物在靶细胞内的释放。例如,可以使用可被硫醇依赖性蛋白酶组织蛋白酶B裂解的肽基接头(例如,包含或为Phe-Leu或Gly-Phe-Leu-Gly的接头),所述组织蛋白酶B在癌性组织中是高表达的。在具体的实施方案中,可被细胞内蛋白酶裂解的肽基接头包含或者为Val-Cit或Phe-Lys。使用细胞内蛋白水解药物释放的一个优点在于,当缀合时药物常被减弱,并且缀合物的血清稳定性通常是高的。在其他实施方案中,可裂解的接头是pH敏感的,即在某些pH值时对水解敏感。典型地,pH敏感接头在酸性条件下是可水解的。例如,可以使用在溶酶体中可水解的酸不稳定接头(例如,腙、缩氨基脲、缩氨基硫脲、顺乌头酰胺、原酸酯、缩醛、缩酮等)。该接头在中性pH条件下(例如在血液中的那些)是相对稳定的,但在低于pH5.5或5.0(接近于溶酶体的pH)时是不稳定的。在某些实施方案中,可水解接头为硫醚接头(例如,经由酰腙键连接至药物的硫醚)。在其他实施方案中,接头在还原条件下是可裂解的(例如二硫化物接头)。各种二硫化物接头是本领域已知的,包括例如,使用SATA(N-琥珀酰亚胺基-S-乙酰基硫代乙酸酯)、SPDP(N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丙酸酯)、SPDB(N-琥珀酰亚胺基-3-(2-吡啶基二硫代)丁酸酯)和SMTP(N-琥珀酰亚胺基-氧羰基-α-甲基-α-(2-吡啶基-二硫代)甲苯)可以形成的那些。在某些优选的实施方案中,接头单元可以具有以下通式:-(T)a-(W)w-(Y)y-其中:T为拉伸子单元(stretcherunit);a为0或1;W为氨基酸单元;w为0至12之间的整数;Y为间隔子单元(spacerunit);y为0、1或2。拉伸子单元(T)(当存在时)将抗体连接至氨基酸单元(W)(当存在时),或连接至间隔子单元(当存在时),或直接连接至药物。有用的官能团包括巯基、氨基、羟基、碳水化合物的异头(anomeric)羟基和羧基,所述官能团可以天然地存在于抗体上,或经由化学改造存在于抗体上。合适的官能团为巯基和氨基。可以通过抗体的分子内二硫键的还原产生巯基(如果存在)。可替代地,可以通过抗体赖氨酸部分的氨基与2-亚氨基四氢噻吩或其他巯基生成试剂的反应产生巯基。在具体的实施方案中,将抗体工程化以携带一个或多个赖氨酸。更优选地,可以将抗体工程化以携带一个或多个半胱氨酸(参见ThioMab)。在某些具体的实施方案中,拉伸子单元与抗体的硫原子形成键。硫原子可以源自经还原的抗体的巯基(-SH)。在某些其他的具体实施方案中,经由抗体的硫原子与拉伸子单元的硫原子之间的二硫键将拉伸子单元连接至抗体。在其他的具体实施方案中,拉伸子的反应性基团含有反应性位点,所述位点与抗体的氨基可以反应。氨基可以为精氨酸或赖氨酸的氨基。合适的胺反应位点包括但不限于活化酯(例如琥珀酰亚胺酯、4-硝基苯酯、五氟苯基酯)、酸酐、酰氯、磺酰氯、异氰酸酯和异硫氰酸酯。在另一个方面,拉伸子的反应性官能团包含反应性位点,所述位点与可存在于抗体上的修饰的碳水化合物基团反应。在一个具体的实施方案中,使抗体酶促糖基化以提供碳水化合物部分,或者使抗体天然糖基化。可以用试剂如高碘酸钠温和地氧化碳水化合物,并且可以将经氧化的碳水化合物的所得的羰基单元与拉伸子缩合,所述拉伸子含有官能团如酰肼、肟、反应性胺、肼、氨基硫脲、羧酸肼或芳基酰肼。根据一个特别的实施方案,拉伸子单元具有下式:其中L2为(C4-C10)环烷基-羰基、(C2-C6)烷基或(C2-C6)烷基-羰基(环烷基或烷基部分被连接至马来酰亚胺部分的氮原子),星号表示与氨基酸单元(如果存在)连接的点,与间隔子单元(如果存在)连接的点,或与药物D连接的点,和波浪线表示与抗体Ab连接的点。本发明中的“(C4-C10)环烷基”是指具有4至10个碳原子的烃环,包括但不限于环戊基、环己基等。L2可以有利地为(C2-C6)烷基-羰基,如下式的戊基-羰基:其中星号表示与氨基酸单元(如果存在)连接的点,与间隔子单元(如果存在)连接的点,或与药物D连接的点;和波浪线表示与马来酰亚胺部分的氮原子连接的点。氨基酸单元(W)(当存在时)将拉伸子单元(T)(如果存在)或要将抗体连接至间隔子单元(Y)(如果存在间隔子单元),或连接至药物(如果不存在间隔子单元)。如上面所提及,(W)w不存在(w=0)或者可以为二肽、三肽、四肽、五肽、六肽、七肽、八肽、九肽、十肽、十一肽或十二肽单元,其中形成肽的氨基酸可以彼此不同。因此,可以通过下式代表(W)w:(W1)w1(W2)w2(W3)w3(W4)w4(W5)w5,其中每个W1至W5彼此独立地代表氨基酸单元,并且每个w1至w5为0或1。在一些实施方案中,氨基酸单元(W)w可以包含氨基酸残基(如天然存在的那些),以及次要(minor)氨基酸和非天然存在的氨基酸类似物,如瓜氨酸。氨基酸单元(W)w的氨基酸残基包括但不限于丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸、苯丙氨酸、色氨酸、脯氨酸、用乙酰基或甲酰基保护的或未保护的赖氨酸、精氨酸、用甲苯磺酰基或硝基保护的或未保护的精氨酸、组氨酸、鸟氨酸、用乙酰基或甲酰基保护的鸟氨酸、和瓜氨酸。示例性的氨基酸接头组分优选包括二肽、三肽、四肽或五肽,尤其是二肽或三肽。示例性的二肽包括:Val-Cit、Ala-Val、Ala-Ala、Val-Ala、Lys-Lys、Cit-Cit、Val-Lys、Ala-Phe、Phe-Lys、Ala-Lys、Phe-Cit、Leu-Cit、Ile-Cit、Trp-Cit、Phe-Ala、Phe-N9-tosyl-Arg、Phe-N9-硝基-Arg。示例性的三肽包括:Val-Ala-Val、Ala-Asn-Val、Val-Leu-Lys、Ala-Ala-Asn、Phe-Phe-Lys、Gly-Gly-Gly、D-Phe-Phe-Lys、Gly-Phe-Lys。示例性的四肽包括:Gly-Phe-Leu-Gly(SEQIDNO.53)、Ala-Leu-Ala-Leu(SEQIDNO.54)。示例性的五肽包括:Pro-Val-Gly-Val-Val(SEQIDNO.55)。根据一个特别的实施方案,(W)w可以为二肽(即w=2)如Val-Cit,或者接头缺少氨基酸单元(w=0)。当接头缺少氨基酸单元时,其优选也缺少间隔子单元。根据一个优选的实施方案,w=0(即(W)w为单键)或w=2(即(W)w为二肽),因此(W)w可以选自:并且特别地为Val-Cit,其中星号表示与间隔子单元(如果存在)连接的点,或与药物D连接的点;和波浪线表示与L2连接的点。氨基酸接头组分可以在其对特定酶的酶切选择性方面被设计和优化,所述酶例如,与肿瘤相关的蛋白酶,组织蛋白酶B、C和D或纤溶酶蛋白酶。接头的氨基酸单元可以被酶(包括但不限于,与肿瘤相关的蛋白酶)酶裂解,以释放药物。氨基酸单元可以在其对特定的与肿瘤相关的蛋白酶的酶切选择性方面被设计和优化。合适的单元为那些单元,其裂解被蛋白酶,组织蛋白酶B、C和D和纤溶酶催化。间隔子单元(Y)(当存在时)将氨基酸单元(如果存在)或拉伸子单元(如果存在)或抗体连接至药物。间隔子单元有两种一般类型:自分解的(self-immolative)和非自分解的。非自分解的间隔子单元为间隔子单元,其中在氨基酸单元从抗体-药物缀合物中的酶裂解之后,部分或全部的间隔子单元依然结合在药物上。非自分解的间隔子单元的示例包括但不限于(甘氨酸-甘氨酸)间隔子单元和甘氨酸间隔子单元。为了释放药物,在靶细胞内应当进行独立的水解反应,以裂解甘氨酸-药物单元键。在一个特别的实施方案中,非自分解的间隔子单元(Y)为Gly。可替代地,含有自分解的间隔子单元的抗体-药物缀合物无需单独的水解步骤即可释放药物。在这些实施方案中,(Y)为对氨基苄醇(PAB)单元的残基,其经由PAB基团的氮原子连接至(W)w,并经由酯、碳酸酯、氨基甲酸酯或醚基直接连接至药物。自分解的间隔子的其他示例包括但不限于与PAB基团在电性上(electronically)等价的芳香族化合物,如2-氨基咪唑-5-甲醇衍生物的残基和邻或对氨基苄基缩醛的残基。可以使用在酰胺键水解后易于经历环化的间隔子,如取代的和未取代的4-氨基丁酸酰胺、适当取代的双环[2.2.1]和双环[2.2.2]环系统和2-氨基苯基丙酸酰胺。在一个替代的实施方案中,间隔子单元为支化的双(羟甲基)苯乙烯(BHMS)单元,其可以用于并入额外的药物。在一个特别的实施方案中,间隔子单元(Y)为PAB-羰基,其中PAB为(PAB单元的氧连接至羰基),并且y=1或接头缺少间隔子单元(y=0)。在一个特别的实施方案中,接头具有下式(III):其中L2为(C4-C10)环烷基-羰基、(C2-C6)烷基或(C2-C6)烷基-羰基(这些部分的羰基(当存在时)连接至(W)w),W表示氨基酸单元,其中w表示0至5之间的整数,Y为PAB-羰基,其中PAB为(PAB单元的氧连接至羰基),并且y为0或1(优选当w为0时,y为0,且当w为1至5时,y为0或1),星号表示与药物D连接的点,和波浪线表示与抗体Ab连接的点。有利地,L2为(C2-C6)烷基-羰基,如下式的戊基-羰基:其中星号表示与(W)w连接的点;和波浪线表示与马来酰亚胺部分的氮原子连接的点。根据一个优选的实施方案,接头L选自:其中星号表示与药物D连接的点,并且波浪线表示与抗体Ab连接的点。IV-抗体-药物缀合物(ADC)在一个优选的实施方案中,可以通过本领域技术人员已知的任何方法制备本发明的抗体-药物缀合物,所述方法如,但不限于,i)抗体的亲核基团与二价接头试剂反应,然后与药物的亲核基团反应,或ii)药物的亲核基团与二价接头试剂反应,然后与抗体的亲核基团反应。抗体上的亲核基团包括但不限于N-末端胺基、侧链胺基(例如赖氨酸)、侧链巯基和当抗体糖基化时糖羟基或氨基。药物上的亲核基团包括但不限于胺基、硫醇基和羟基,优选胺基。胺基、硫醇基和羟基是亲核性的,并且能够反应以与接头部分和接头试剂上的亲电子基团形成共价键,所述接头部分和接头试剂包括但不限于活性酯如NHS酯、HOBt酯、卤代甲酸酯和酰基卤;烷基卤化物和苄基卤化物,如卤代乙酰胺;醛;酮;羧基;和马来酰亚胺基团。抗体可以具有可还原的链间二硫化物,即半胱氨酸桥。可以通过用还原剂如DTT(二硫苏糖醇)处理,使抗体具有与接头试剂缀合的反应性。因此,每个半胱氨酸桥在理论上将形成两个反应性硫醇亲核体(nucleophile)。可以通过本领域技术人员已知的任何反应,将另外的亲核基团引入抗体中。作为非限制性示例,可以通过引入一个或多个半胱氨酸残基将反应性巯基引入抗体中。还可以通过修饰抗体引入亲电部分以产生抗体-药物缀合物,所述亲电部分可以与接头试剂上的亲核取代基反应。可以氧化糖基化抗体的糖,以形成可以与接头试剂或药物的胺基反应的醛基或酮基。所得的亚胺希夫(Schiff)碱基团可以形成稳定的键,或者可以还原形成稳定的胺键。在一个实施方案中,糖基化抗体的碳水化合物部分与半乳糖氧化酶或偏高碘酸钠的反应可以在蛋白质中产生羰(醛和酮)基,其可以与药物上合适的基团反应。在另一个实施方案中,含有N-末端丝氨酸或苏氨酸残基的蛋白质可以与偏高碘酸钠反应,导致产生醛代替第一氨基酸。在一个优选的实施方案中,通过制备药物-接头部分,然后将抗体的亲核基团(例如半胱氨酸部分的SH基团)与药物-接头部分的亲电基团(例如马来酰亚胺)偶联,制备本发明的抗体-药物缀合物。1.药物-接头可以通过以下偶联制备药物-接头部分:-将接头与药物偶联,-在完成接头的合成之前,将接头的一部分与药物偶联,-在完成药物的合成之前,将接头与药物的一部分或前体偶联,或者-在完成接头和药物的合成之前,将接头的一部分与药物的一部分或前体偶联。亲核基团与亲电基团之间的偶联反应是本领域技术人员熟知的反应。亲核基团可以特别地为胺基、硫醇基或羟基。在一个优选的实施方案中,其为伯或仲胺基团。亲电基团可以为任选处于活化形式的羧酸基团(COOH)或活化的碳酸酯部分。羧酸的“活化形式”是指羧酸,其中COOH官能团的OH部分已被活化的离去基(LG)替代,所述离去基(LG)能够将活化的羧酸基团与氨基偶联,以形成酰胺键并释放化合物LG-H。活化形式可以为活化酯、活化酰胺、酸酐或酰基卤,如酰氯(acylchloride)。活化酯包括由羧酸基团与N-羟基苯并三唑或N-羟基琥珀酰亚胺的反应形成的衍生物。“活化的碳酸酯”是指包含-OC(O)OR部分的碳酸酯,其中OR代表好的离去基,所述离去基能够将活化的碳酸酯与氨基偶联,以形成氨基甲酸酯部分并释放化合物ROH。活化的碳酸酯的R基包括但不限于对硝基苯基、五氟苯基、2,5-二氧代-2,5-二氢-1H-吡咯-1-基和苄基,优选对硝基苯基和五氟苯基。当接头具有下式(III)时:药物-接头部分具有下式(IV):并且药物-接头部分的合成的最后步骤通常为下式(V)的化合物与下式(VI)的化合物的偶联:其中L2如前面所定义,并且LG代表离去基,尤其是卤化物如氯化物,或衍生自N-羟基琥珀酰亚胺的基团,H-(W)w-(Y)y-D(VI)。当y=1且Y=PAB-羰基时,可以通过将药物(DH)与下式(VII)的化合物(优选其受保护的形式)偶联,制备式(VI)的化合物:G-(W)w-PAB-CO-OR(VII)其中W和w如前面所定义,R如在“活化的碳酸酯”的定义中所定义,并且G为H或保护基。当式(VII)的化合物为受保护的形式时,最后的脱保护步骤是必要的。当y=0时,化合物(VI)具有式H-(W)w-D,其中(W)w和优选地D由氨基酸单元组成。因此在这种情况下,可以通过本领域技术人员熟知的常规的肽合成方法制备化合物(VI)。2.Ab-接头-药物根据本发明的一个优选的实施方案由存在于抗体上的半胱氨酸与药物-接头部分的亲电基团的偶联组成,优选由存在于抗体上的半胱氨酸与存在于药物-接头部分上的马来酰亚胺部分的偶联组成。可以通过本领域技术人员熟知的方法进行马来酰亚胺-半胱氨酸偶联。通常,抗体不含有许多(如果有的话)游离的和反应性的半胱氨酸硫醇基团,所述基团可以连接至药物部分。抗体中的大部分半胱氨酸硫醇残基作为二硫桥存在,并且必须用还原剂如二硫苏糖醇(DTT)或TCEP,在部分或全部还原条件下还原。可以通过多种不同的方式控制ADC的负载(loading)(药物/抗体比例),包括:(i)限制药物-接头中间体(D-L)或接头试剂相对于抗体的摩尔过量,(ii)限制缀合反应时间或温度,和(iii)用于半胱氨酸巯基修饰的部分或有限还原条件。人IgG的二硫键结构现在已被很好地确定(综述于Liu和May,mAbs4(2012):17-23)。事实上,对于4种人IgG亚类(即IgG1、IgG2、IgG3和IgG4)的二硫键结构,存在许多相似性和一些差异。所有IgG亚类总是含有12个链内二硫桥,并且差异存在于它们在重链和轻链之间形成的链间二硫键中。每个链内二硫键与单个IgG结构域,即可变(VL和VH)和恒定(CL、CH1、CH2和CH3)结构域相关。2个重链在其铰链区通过可变数目的二硫桥相连:IgG1和IgG4有2个,IgG2有4个,IgG3有11个。IgG1的重链和轻链通过轻链的最后的半胱氨酸残基和重链的第五个残基之间的二硫键相连,而对于其他亚类IgG2、IgG3和IgG4,轻链通过轻链的最后的半胱氨酸残基和重链的第三个半胱氨酸残基之间的二硫键连接至重链,所述第三个半胱氨酸残基位于VH和CH1结构域的界面。已经描述了IgG2和IgG4的除了这些经典结构以外的二硫键结构(综述于Liu和May,mAbs4(2012):17-23)。链间二硫键是高度溶剂暴露的,因此其比链内二硫键更加活泼,所述链内二硫键被埋在每个结构域内的反平行β-折叠结构中,并且其不是溶剂暴露的。由于这些原因,无论抗体同种型,在温和还原后,将在链间暴露的半胱氨酸残基上发生偶联。因此,每个链间二硫桥理论上可以形成两个缀合位点。通过赖氨酸与2-亚氨基四氢噻吩(特劳特(Traut's)试剂)的反应,使胺转化为硫醇,可以将额外的亲核基团引入抗体中。还可以通过将一个、两个、三个、四个或更多个半胱氨酸残基工程化(例如,制备包含一个或多个非天然半胱氨酸氨基酸残基的突变抗体),将反应性巯基引入抗体(或其片段)中。US7521541教导了通过反应性半胱氨酸氨基酸的引入将抗体工程化。半胱氨酸氨基酸可以在抗体的反应位点被工程化,并且其不形成链内或分子间二硫键(Junutula,等人,2008bNatureBiotech.,26(8):925-932;Dornan等人(2009)Blood114(13):2721-2729;US7521541;US7723485;WO2009/052249)。工程化的半胱氨酸硫醇可以与本发明的接头试剂或药物-接头试剂反应,以形成具有半胱氨酸工程化的抗体和药物部分的ADC,所述接头试剂或药物-接头试剂具有巯基反应性亲电基团,如马来酰亚胺或α-卤代酰胺。因此,药物部分的位置可以被设计、控制和知晓。药物负载可以被控制,因为工程化的半胱氨酸硫醇基团通常以高产率与巯基反应性接头试剂或药物-接头试剂反应。通过在重链或轻链上的单个位点的取代将IgG抗体工程化,以引入半胱氨酸氨基酸,在对称的抗体上产生了两个新的半胱氨酸。可以用缀合产品ADC的接近同质性(homogeneity)实现接近2的药物负载。当抗体的大于一个亲核基团或亲电基团与药物-接头中间体反应,或者与接头试剂反应然后与药物部分试剂反应时,则所得的产物为ADC化合物的混合物,其具有连接至抗体的药物部分的分布,例如1、2、3等。液相色谱法(如聚合反相(PLRP)和疏水相互作用(HIC))可以按药物负载值分离混合物中的化合物。可以分离具有单一药物负载值(p)的ADC的制剂,然而,这些单一负载值的ADC仍然可能为异质混合物,因为药物部分可以经由接头连接至抗体的不同位点。对于一些抗体-药物缀合物,药物比例可能受到抗体上连接位点的数量的限制。高的药物负载(例如药物比例>5)可以导致某些抗体-药物缀合物的聚集、不溶解、毒性或细胞通透性的丧失。典型地,在缀合反应期间,将比理论最大值小的药物部分缀合至抗体。药物负载(也被称作药物-抗体比例(DAR))为每个细胞结合试剂的平均药物数量。对于抗体IgG1和IgG4同种型,其中药物在部分抗体还原后结合至半胱氨酸,药物负载可以为每个抗体1至8个药物(D),即,其中1、2、3、4、5、6、7和8个药物部分共价连接至抗体。对于抗体IgG2同种型,其中药物在部分抗体还原后结合至半胱氨酸,药物负载可以为每个抗体1至12个药物(D),即,其中1、2、3、4、5、6、7、8、9、10、11和12个药物部分共价连接至抗体。ADC的组合物包括细胞结合试剂(例如抗体)的集合,所述细胞结合试剂与1至8个或1至12个药物缀合。可以通过常规手段如UV、反相HPLC、HIC、质谱、ELISA分析和电泳,表征来自缀合反应的ADC的制剂中每个抗体的药物的平均数量。作为非限制性实施方案,本文提供了与抗体c208F2的缀合。在这种情况下,将药物偶联至至少一个半胱氨酸,所述半胱氨酸选自i)序列SEQIDNo.28的轻链的214位的残基Cys,和ii)序列SEQIDNo.23的重链的223、229和232位的残基Cys。作为非限制性实施方案,本文提供了与抗体c208F2的缀合。在这种情况下,将药物偶联至二、三或四个半胱氨酸,所述半胱氨酸选自i)序列SEQIDNo.28的轻链的214位的残基Cys,和ii)序列SEQIDNo.23的重链的223、229和232位的残基Cys。作为非限制性实施方案,本文提供了与抗体hz208F2(ar.1)的缀合。在这种情况下,将药物偶联至至少一个半胱氨酸,所述半胱氨酸选自i)序列SEQIDNo.39的轻链的214位的残基Cys,和ii)序列SEQIDNo.37的重链的223、229和232位的残基Cys。作为非限制性实施方案,本文提供了与抗体hz208F2(var.3)的缀合。在这种情况下,将药物偶联至二、三或四个半胱氨酸,所述半胱氨酸选自i)序列SEQIDNo.40的轻链的214位的残基Cys,和ii)序列SEQIDNo.38的重链的223、229和232位的残基Cys。一个替代方案由赖氨酸偶联组成。抗体可以含有例如许多赖氨酸残基,所述残基不与药物-接头中间体(D-L)或接头试剂反应。只有最具反应性的赖氨酸基团可以与胺反应性接头试剂反应。此外,只有最具反应性的半胱氨酸硫醇基团可以与硫醇反应性接头试剂反应。当本发明的化合物与赖氨酸结合时,药物负载可以为每个细胞抗体1至80个药物(D),但是优选的上限为40、20、10或8。ADC的组合物包括细胞结合试剂(例如抗体)的集合,所述细胞结合试剂与1至80个、1至40个、1至20个、1至10个或1至8个药物缀合。根据本发明的式(I)的ADC可以为药学上可接受的盐的形式。在本发明中,“药学上可接受的”是指可以在药物组合物的制剂中使用,通常是安全无毒的,既不是生物学上也不是其他不期望的,并且对于兽医用途以及人制药用途是可接受的。化合物的“药学上可接受的盐”是指如本文所定义的药学上可接受的盐,并且其具有母体化合物的期望的药理活性。药学上可接受的盐尤其包含:(1)与药学上可接受的无机酸形成的药学上可接受的酸加成盐,所述无机酸如盐酸、氢溴酸、磷酸、硫酸和类似的酸;与药学上可接受的有机酸形成的药学上可接受的酸加成盐,所述有机酸如乙酸、三氟乙酸、丙酸、琥珀酸、富马酸、苹果酸、酒石酸、柠檬酸、抗坏血酸、马来酸、谷氨酸、苯甲酸、水杨酸、甲苯磺酸、甲磺酸、硬脂酸、乳酸和类似的酸;和(2)当母体化合物中存在的酸质子被金属离子替代时形成的药学上可接受的碱加成盐,所述金属离子例如碱金属离子、碱土金属离子或铝离子;或与药学上可接受的有机碱配位时形成的药学上可接受的碱加成盐,所述有机碱如赖氨酸、精氨酸等;或与药学上可接受的无机碱配位时形成的药学上可接受的碱加成盐,所述无机碱如氢氧化钠、氢氧化钾(potash)、氢氧化钙和类似物。可以使用常规的化学方法,由含有碱或酸官能团的本发明的化合物与相应的酸或碱制备这些盐。V-治疗最后,本发明涉及一种如上面所描述的ADC,其作为药物,特别是用于治疗癌症的用途。本发明的另一个主题为一种如上面所定义的式(I)的化合物,其作为药物产品,特别是用于治疗癌症的用途。本发明还涉及如上面所定义的式(I)的化合物用于生产药物产品,特别是旨在用于治疗癌症的药物产品中的用途。本发明还涉及一种用于治疗癌症的方法,其包括向需要其的人施用有效量的如上面所定义的式(I)的化合物。癌症可以优选选自IGF-1R相关的癌症,所述癌症包括肿瘤细胞在其表面表达或过表达全部或部分的蛋白质IGF-1R。更特别地,所述癌症为乳腺癌、结肠癌、食管癌、肝细胞癌、胃癌、神经胶质瘤、肺癌、黑素瘤、骨肉瘤、卵巢癌、前列腺癌、横纹肌肉瘤、肾癌、甲状腺癌、子宫内膜癌、神经鞘瘤、神经母细胞瘤、口腔鳞状细胞癌、间皮瘤、平滑肌肉瘤和任何耐药的症候或癌症。为了避免疑问,必须理解耐药的表达IGF-1R的癌症不仅指最初表达IGF-1R的耐药的癌症,而且还指最初不表达或不过表达IGF-1R,但当对前面的治疗已经变得耐受后即表达IGF-1R的癌症。本发明的另一个目的为一种药物组合物,其包含如说明书中所描述的ADC。更特别地,本发明涉及一种药物组合物,其包含本发明的ADC和至少一种赋形剂和/或药学上可接受的载体。在本说明书中,表述“药学上可接受的载体”或“赋形剂”旨在表示化合物或化合物的组合,其进入药物组合物中而不引起次级反应,并且其允许例如活性化合物的施用的简化、活性化合物的寿命和/或在体内的功效的增加、活性化合物在溶液中的溶解度的增加或活性化合物的保存的改善。这些药学上可接受的载体和赋形剂是本领域技术人员熟知的,并且本领域技术人员将根据所选择的活性化合物的性质和施用模式改变所述载体和赋形剂。活性成分可以以单位施用形式,与常规药物载体混合施用至动物或人类。合适的单位施用形式包括经由口服途径的形式,和经由胃肠外途径(皮下、皮内、肌内或静脉内)施用的形式。作为用于口服施用的固体组合物,可以使用片剂、丸剂、粉末(硬的或软的明胶胶囊)或颗粒剂。在这些组合物中,在氩气流中,将本发明的活性成分与一种或多种惰性稀释剂如淀粉、纤维素、蔗糖、乳糖或二氧化硅混合。这些组合物还可以包含除稀释剂以外的物质,例如一种或多种润滑剂如硬脂酸镁或滑石,着色剂,包衣(包衣片)或清漆(varnish)。用于胃肠外施用的无菌组合物可以优选为水性或非水性溶液、混悬剂或乳剂。作为溶剂或载体,可以使用水、丙二醇、聚乙二醇、植物油特别是橄榄油、可注射的有机酯例如油酸乙酯或其他合适的有机溶剂。这些组合物还可以含有佐剂,特别是润湿剂、等渗剂、乳化剂、分散剂和稳定剂。可以以多种方式进行灭菌,例如通过消毒过滤,通过向组合物中加入灭菌剂,通过辐射或通过加热。它们还可以被制备成固体无菌组合物的形式,可以在使用时将所述组合物溶解于无菌水或任何其它可注射的无菌介质中。优选地,将通过全身途径,特别是通过静脉内途径、通过肌内、皮内、腹膜内或皮下途径或通过口服途径施用这些ADC。在一个更优选的方式中,将以连续的方式多次施用包含根据本发明的ADC的组合物。因此,本发明还涉及一种试剂盒,其至少包含i)根据本发明的抗体-药物-缀合物和/或根据本发明的药物组合物,和ii)注射器或小瓶或安瓿,其中装有所述抗体-药物-缀合物和/或药物组合物。可以根据在确立适合于患者的治疗时通常考虑的标准,确定它们的施用方式、剂量和最佳药物形式,所述标准例如患者的年龄或体重、他/她的整体病症的严重性、对治疗的耐受性和注意到的副作用。本发明的其它特征和优点随着实施例和附图出现在本说明书的连续部分中,所述附图的说明表示如下。附图说明图1A-1C:通过FACS分析的抗体与人天然IGF-1R的结合。图1A表示在MCF-7细胞系中的滴定曲线。MFI表示荧光强度的平均值。图1B表示在MCF-7细胞系中鼠抗IGF-1R抗体和嵌合抗IGF-1R抗体的EC50。图1C表示在MCF-7细胞系中嵌合抗IGF-1R抗体的Bmax。图2A-2B:使用转染细胞对比于未转染细胞进行的hIGF-1R识别的评价。图2A表示在IGF-1R+细胞系中一种嵌合抗IGF-1RAb的滴定曲线。MFI表示荧光强度的平均值。图2B表示在人IGF-1R-细胞系中嵌合抗IGF-1RAb的结合。图3A-3B:使用转染细胞进行的Ab对IGF-1R对hIR的特异性的评价。图3A表示在hIR+转染细胞系中鼠抗IGF-1RAb的结合。图3B表示在IR+细胞系中嵌合抗IGF-1RAb的结合。MFI表示荧光强度的平均值。引入GRO5抗hIRMab(Calbiochem)作为阳性对照。图4:在IM-9细胞系中鼠抗IGF-1RAb的结合。MFI表示荧光强度的平均值。引入GRO5抗hIRMab作为阳性对照。图5A-5C:猴IGF-1R的识别的评价。图5A表示在COS-7细胞系中嵌合抗IGF-1RAb的滴定曲线。MFI表示荧光强度的平均值。图5B表示在COS-7细胞系中鼠抗IGF-1R抗体和嵌合抗IGF-1R抗体的EC50。图5C表示在NIH3T3转染细胞hIGF-1R+和COS-7细胞系中嵌合抗IGF-1R抗体的EC50。图6:使用CM5传感芯片(sensorchip)在基于SPR技术的BiacoreX100上获得的传感图(sensorgram),所述CM5传感芯片用更多的11000RU的小鼠抗-TagHis抗体活化,所述抗体被化学接枝到羧甲基葡聚糖基质上。使用HBS-EP+作为运行和样品稀释缓冲液,在25℃以30μl/min的流速运行实验。该图显示了4张独立的传感图在分析物的第一次注射开始时,在x轴上对准的叠加,以及通过在该第一次注射之前刚定义的基线在y轴上对准的叠加。用菱形标记通过捕获基于人的重组可溶性IGF1R的序列获得的传感图。用三角形标记通过捕获基于食蟹猴的重组可溶性IGF-1R的序列获得的传感图。白色符号对应于空白循环(运行缓冲液的5次注射),黑色符号对应于增加的浓度范围的c208F2(5、10、20、40和80nM)的注射。图7:与IGF1相比,抗hIGF-1R抗体对受体磷酸化的固有作用的评价。图8:通过鼠抗hIGF-1R的对IGF-1相应的IGF-1R磷酸化的抑制。图9:在37℃孵育细胞后,抗IGF-1R抗体的细胞表面信号强度被下调。将MCF-7细胞与10μg/ml的Ab在4℃或37℃孵育4h。该图表示ΔMFI。图10A-10B:抗体表面衰减(decay)。在37℃,在10、20、30、60和120分钟后评估细胞表面结合的抗体。图10A表示与在4℃测量的信号强度相比剩余IGF-1R的%。图10B表示使用Prism软件和使用指数衰减拟合的半衰期计算。图11:抗hIGF-1RAb被内化。将细胞与10μg/ml鼠Ab在37℃孵育0、30或60min。将细胞通透化(permeabilize)或不将细胞通透化,并与第二抗小鼠IgG-Alexa488孵育。膜对应于信号强度w/o通透化作用(permeabilization)。总计对应于细胞通透化后的信号强度,并且细胞质对应于内化的Ab。每个评价的抗体的名称标注于每张图的顶部。图12A-12B:Ab内化的成像。图12A:MCF-7细胞,其在4℃与m208F2孵育20分钟,并在孵育前(W)、在37℃孵育15min(X)、30min(Y)和60min(Z)时洗涤。将细胞固定并通透化。使用抗小鼠IgGAlexa488和Lamp-1,使用兔抗Lamp-1抗体和第二抗兔IgGAlexa555显示m208F2Ab。图12B:将MCF-7细胞与抗hIGF-1R鼠抗体在37℃孵育30分钟,并如上所述进行染色。使用ImageJ软件的共定位高亮(highliter)插件确定共定位。图13:溶酶体通路在抗体降解中的参与。图14:酸性pH降低五种鼠抗IGF-1R抗体的结合能力。图15A-15D:c208F2Mab的第一人源化形式的结合特征。在人细胞系MCF-7(A)、猴细胞系COS-7(B)和表达人胰岛素受体的转染的鼠细胞系(C)中,评价hz208F2VH3/VL3mAb的结合性质。平行地评价鼠208F2mAb和嵌合208F2mAb的结合。使用抗hIR抗体克隆GRO5以验证hIR在转染的细胞系(D)中的表达。图16:hz208F2VH3/VL3抗体表面衰变。图17:用CM5传感器芯片在25℃的温度用基于SPR的BiacoreX100装置获得的传感图的叠加,所述CM5传感器芯片在两个流动池(flowcell)中用约12.000RU的小鼠抗TagHis单克隆抗体活化,所述抗体被化学接枝到羧甲基葡聚糖基质上,使用HBS-EP+作为运行缓冲液,流速为30μl/min。每张传感图(第一个用三角形标记,第二个用菱形标记)对应于一个完整的周期:1-在一分钟期间,在第二流动池中重组h-IGF-1R的溶液(10μg/ml)的注射。2-对于第一张传感图:运行缓冲液的5次注射,每次90s对于第二张传感图:增加的浓度范围的抗IGF-1Rc208F2抗体溶液的五次注射,每次90s。3-300s的延迟,用于确定解离动力学速率。4-通过10mM甘氨酸,HClpH1.5缓冲液的45s的注射的表面的再生。图18:以灰色显示传感图,所述传感图对应于用增加的浓度范围的抗IGF-1Rc208F2溶液获得的传感图减去空白传感图(HBS-EP+的5次注射)。以细黑线显示对应于1:1模型的理论传感图,所述理论传感图具有以下参数:kon=(1.206±0.036)x106M-1.s-1,koff=(7.81±0.18)x10-5s-1,Rmax=307.6±0.3RU。在图上报告了c208F2的计算的浓度:仅最高浓度(24nM)被认为是常数)。图19:解离常数对应于每种抗体运行的四个实验的平均值,并且对应于以pM单位表达的比例:koff/konx1012。误差条对应于标准误差(n=4)。图20:半衰期对应于每种抗体运行的四个实验的平均值,并且对应于以h单位表达的比例:Ln(2)/koff/3600。误差条对应于标准误差(n=4)。图21:与三种不同的化合物偶联的抗IGF-1R的细胞毒性。将五种嵌合抗体抗IGF-1R与E-13、G-13或F-63偶联。还将不相关的抗体c9G4与相同的化合物偶联。图22A-22C:在MCF-7异种移植模型中,c208F2-E-13(图22A)、c208F2-G-13(图22B)和c208F2-F-63(图22C)的体内评价。图23A-23B:在MCF-7异种移植模型中,c208F2-E-13(图23A)和c208F2-G-13(图23B)相比于ADC对照(c9G4-E13和c9G4-G-13)的体内评价。图24A和B:酸性pH降低人源化IGF-1R抗体hz208F2H076/L024(A)和hz208F2(H077/L018(B))的结合能力。图25:c208F2-G-13对正常细胞的细胞毒性的评价。图26:与G-13偶联的hz208F2的人源化变体的细胞毒性。还将不相关的抗体c9G4与相同的化合物偶联。图27:在MCF-7异种移植模型中,208F2-G-13的人源化形式对比于c208F2-G-13的人源化形式的体内评价。图28A和28B:在MCF-7异种移植模型中,c208F2-G-13(28A)或hz208F2-4-G-13(28B)注射4次相比于注射一次的体内评价。图29A和29B:在CaOV-3异种移植模型中,c208F2-E-13(29A)和c208F2-G-13(29B)的体内评价。具体实施方式实施例实施例1:针对IGF-1RECD的鼠抗体的产生为了产生针对人IGF-1受体(hIGF-1R)的人细胞外结构域(ECD)的鼠单克隆抗体(Mab),将5只BALB/c小鼠用10μg的rhIGF-1R蛋白(R&DSystems,目录号391-GR)皮下免疫3次。作为替代方案,在一些动物中用10μgIGF-1R的鼠细胞外结构域(ECD)(R&DSystems,目录号6630-GR/Fc)进行三次额外的免疫。在完全弗氏(Freund)佐剂(Sigma,StLouis,MD,美国)的存在下进行第一次免疫。加入不完全弗氏佐剂(Sigma)用于随后的免疫。在融合前三天,用10μg的rhIGF-1R蛋白增强被免疫的小鼠。然后,分别通过灌注脾脏,和通过切碎(mince)近端淋巴结节制备脾细胞和淋巴细胞,所述细胞从5只被免疫小鼠中的1只(在所有小鼠的血清滴定后选择)中收获,并将其与SP2/0-Ag14骨髓瘤细胞(ATCC,Rockville,MD,美国)融合。Kohler和Milstein描述了融合方案(Nature,256:495-497,1975)。然后,使融合的细胞经受HAT选择。通常,为了制备单克隆抗体或其功能片段(尤其是鼠源的),能够特别地参考在手册“Antibodies”(Harlow和Lane,Antibodies:ALaboratoryManual,ColdSpringHarborLaboratory,ColdSpringHarborNY,第726页,1988)中描述的技术。在融合后约10天,筛选杂交细胞的群落。对于初次筛选,使用人乳腺MCF7肿瘤细胞(ATCC)和/或猴COS7细胞(非洲绿猴肾-SV40转化的),通过FACS分析,评价杂交瘤上清液中针对IGF-1RECD蛋白的Mab的分泌,所述猴COS7细胞在其细胞表面上表达猴IGF-1R。更精确地,对于通过流式细胞术的选择,在4℃将105个细胞(MCF7或COS7)接种至96孔板的每个孔的PBS中,所述PBS含有1%BSA和0.01%叠氮化钠(FACS缓冲液)。在以2000rpm离心2min后,去除缓冲液,并加入待测的杂交瘤上清液。在4℃孵育20min后,将细胞洗涤两次,加入在FACS缓冲液中稀释的Alexa488-缀合的山羊抗小鼠抗体1/500°(#A11017,MolecularProbesInc.,Eugene,美国),并在4℃孵育20分钟。在用FACS缓冲液的最终洗涤后,在以40μg/ml的终浓度向每个试管中加入碘化丙啶后,通过FACS(Facscalibur,Becton-Dickinson)分析细胞。含有单独的细胞的孔和含有与二级Alexa488-缀合的抗体孵育的细胞的孔被包含作为阴性对照。在每个实验中使用同种型对照(Sigma,参考号M90351MG)。评估至少5000个细胞,以计算荧光强度的平均值(MFI)。此外,进行内化分析,以仅选择内化抗体。对于该分析,在实验前,将MCF7肿瘤细胞系在不含酚红的RMPI1640中培养3天,所述RMPI1640具有1%L-谷氨酰胺和10%FACS。然后,使用胰蛋白酶使细胞分散,并将100μl4.105个细胞/ml的细胞悬浮液接种至96孔板的不含酚红的RPMI1640中,所述RPMI1640具有1%L-谷氨酰胺和5%FBS。在以2000rpm离心2min后,将细胞重新悬浮于50μl的杂交瘤上清液或对照抗体溶液(1μg/ml的阳性和同种型对照)中。在4℃孵育20min后,将细胞以2000rpm离心2min,并重新悬浮于冷的(4℃)或温的(37℃)完全培养介质中。然后,将细胞在37℃或在4℃孵育2小时。然后,用FACS缓冲液将细胞洗涤三次。将Alexa488标记的山羊抗小鼠IgG抗体孵育20分钟,并将细胞洗涤三次,然后在碘化丙锭阴性细胞群体中进行FACS分析。在FACS分析后,确定两个参数:(i)在4℃与一种杂交瘤上清液孵育的细胞的表面上检测到的荧光信号,与在37℃与一种杂交瘤上清液孵育的细胞获得的荧光信号的差异,和(ii)细胞表面上剩余的IGF-1R的百分比。剩余的hIGF1R的百分比计算如下:剩余的IGF-1R%=(MFIAb37℃/MFIAb4℃)x100。此外,进行三次ELISA(在克隆之前或之后),以研究抗体对重组人(hIGF-1R)蛋白和重组鼠(mIGF-1R)蛋白的结合,以及对重组人胰岛素受体(hIR)蛋白的结合。分泌抗体的杂交瘤被保留,所述抗体显示结合至rh-和/或rm-IGF-1R且不结合至rhIR。简言之,用在PBS中的0.6μg/ml的rhIGF-1R蛋白(R&DSystems,目录号391-GR),或1μg/ml的rmIGF-1R蛋白(R&DSystems,目录号6630-GR/Fc),或1μg/ml的rhIR蛋白(R&DSystems,目录号1544-IR/CF),将96孔ELISA板(Costar3690,Corning,NY,美国)以100μl/孔在4℃包被过夜。然后,用含有0.5%明胶的PBS(#22151,ServaElectrophoresisGmbH,Heidelberg,德国)将板在37℃封闭2小时。当通过摇动板弃去饱和缓冲液后,将100μl的每种上清液稀释液加入至每个孔(未稀释的杂交瘤上清液或上清液系列稀释液)中,并在37℃孵育1h。在洗涤三次后,在37℃,加入在含有0.1%明胶和0.05%吐温20(w:w)的PBS中以1/5000稀释的100μl辣根过氧化物酶缀合的多克隆山羊抗小鼠IgG(#115-035-164,JacksonImmuno-ResearchLaboratories,Inc.,WestGrove,PA,美国),持续1小时。然后,将ELISA板洗涤3次,并加入TMB((#UP664782,Uptima,Interchim,法国)底物。在室温孵育10min后,使用1M硫酸终止反应,并测量450nm处的光密度。通过有限的稀释扩增和克隆分泌感兴趣的抗体的杂交瘤。一旦被同种型化,扩增和冷冻每个编码的一种克隆。在被称作CellLine(IntegraBiosciences)的体外生产系统中生产每种感兴趣的抗体,用于进一步的表征。在IM9细胞(表达人IR的B淋巴母细胞)中,以及在hIGF-1R转染细胞中相比于未转染细胞中,进行处理(address)结合特异性FACS分析的额外的分析。将对应于选择的抗体的所有数据总结于表7中,并且证明了五种选择的抗体强烈地识别在MCF-7乳腺癌细胞或转染细胞上表达的天然人IGF-1R。它们还识别COS-7细胞上的猴IGF-1R。这些抗体不与在IM9细胞上高表达的人胰岛素受体交叉反应。必须注意,当直接被包被在ELISA板上时,这些抗体很差地识别rhIGF-1RECD蛋白。实施例2:通过FACS分析的对人天然IGF-1R的抗体结合将5种鼠IGF-1R抗体嵌合。使用增加的抗体浓度,通过在人MCF-7乳腺癌细胞系(ATCC#HTB-22)中进行的FACS分析,评价鼠IGF-1R抗体和嵌合IGF-1R抗体的结合性质。为了这个目的,在FACS缓冲液(PBS,0.1%BSA,0.01%NaN3)中,将细胞(1x106个细胞/ml)与IGF-1R抗体在4℃孵育20min。然后将它们洗涤3次,并在暗处与偶联有Alexa488的合适的第二抗体在4℃孵育另外20分钟,然后在FACS缓冲液中洗涤3次。使用碘化丙啶(其将死细胞染色)鉴定存活的细胞,立即在所述存活的细胞中进行抗IGF-1R抗体的结合。由每种抗体获得的信号强度的最大值被设计为Bmax,并以荧光强度的平均值(MFI)表示。使用非线性回归分析(GraphPadPrims4.0)计算结合的EC50,其以摩尔浓度(M)表示。每种鼠Ab或嵌合Ab的滴定曲线证明,产生的全部抗体都能够以典型的饱和模式(profile)识别天然的IGF-1R形式(图1A)。为了把抗体分等级并比较鼠Ab和嵌合Ab的结合性质,使用非线性回归分析确定每种化合物的结合EC50。每种鼠Ab和其相应的嵌合形式的EC50的比较显示,2种形式显示相同的结合性质,表明Ab嵌合不影响IGF-1R识别(图1B-C)。嵌合抗体的EC50和Bmax值总结于表8中。表8ACBmaxEC50c208F29816.7E-10c212A119916.7E-10c214F810695.0E-10c219D69934.7E-10c213B1011034.4E-10实施例3:通过使用IGF-1R或IR转染的细胞或IM9细胞的抗体特异性的确认,所述IM9细胞表达显著水平的IR为了确认所产生的抗体对IGF-1R相比于IR的特异性,通过FACS分析评价表达hIGF-1R或hIR的稳定的转染子。简言之,在FACS缓冲液(PBS,0.1%BSA,0.01%NaN3)中,将增加浓度的嵌合mAb与细胞在4℃孵育20min。然后将细胞洗涤3次,并与偶联有Alexa488的合适的第二抗体孵育,然后在暗处在4℃孵育另外20分钟,然后在FACS缓冲液中洗涤3次。使用碘化丙啶(其将死细胞染色)鉴定存活的细胞,立即在所述存活的细胞中进行抗IGF-1R抗体的结合。使用非线性回归分析(GraphPadPrims4.0)计算结合的EC50,其以摩尔浓度(M)表示。在hIGH-1R转染的细胞系(图2A)中相比于在未转染的细胞(图2B)中获得的滴定曲线证实了嵌合Ab对人IGF-1R的结合特异性。EC50和Bmax值总结于表9中。表9AcBmaxEC50(M)c208F220083.2E-10c212A1125134.4E-10c214F820942.7E-10c219D625215.5E-10c213B1020293.3E-10为了证实不存在鼠抗体和嵌合抗体对hIR的结合,使用了表达人IR(hIR)的稳定的细胞系。通过FACS分析进行鼠Ab和嵌合Ab对人细胞表面hIR的识别。在FACS缓冲液(PBS,0.1%BSA,0.01%NaN3)中,将增加浓度的鼠mAb或嵌合mAb在hIR+转染的细胞系中在4℃孵育20分钟。然后将细胞洗涤3次,并与偶联有Alexa488的合适的第二抗体孵育,然后在暗处在4℃孵育另外20分钟,然后在FACS缓冲液中洗涤3次。使用碘化丙啶(其将死细胞染色)鉴定存活的细胞,立即在所述存活的细胞中进行抗IGF-1R抗体的结合。使用非线性回归分析(GraphPadPrims4.0)计算结合的EC50,其以摩尔浓度(M)表示。使用抗hIR抗体克隆GRO5作为阳性对照。引入鼠9G4抗体和嵌合9G4抗体作为不相关的抗体。使用市售的抗hIR抗体GRO5确认hIR在转染细胞的细胞表面上的高水平表达(图3A和3B)。即使使用高浓度的鼠hIGF-1RAb(图3A)或嵌合hIGF-1RAb(图3B),也没有观察到在hIR+转染细胞的细胞表面上的结合。这些结果证明,鼠抗hIGF-1RAb和嵌合抗hIGF-1RAb都不识别hIR。通过FACS分析,使用IM9细胞(表达hIR的B淋巴瘤细胞系),还证明了这种hIGF-1R相比于IR的识别的特异性(图4)。对于该FACS分析,方案与上面所描述的方案相同,并且使用鼠抗体,以防止第二抗人Ab的交叉反应性(IM9细胞在其细胞表面上表达人Ig)。图4中呈现的结果再次证明,使用GRO5抗hIR抗体观察到预期的信号,而所评估的鼠抗体没有一个在该细胞系中显示任何显著的结合信号。实施例4:通过FACS和Biacore分析的对猴天然IGF-1R的抗体结合管理毒理学(regulatorytoxicology)研究的第一个先决条件之一是找到相关的动物种类,以评价所选择的化合物。由于本文所描述的一系列抗体不能识别鼠IGF-1R,因此用于毒理学评价的最可能的物种是非人灵长目动物(NHP)。为了评价抗IGF-1R抗体对猴IGF-1R的结合,使用增加的抗体浓度,在COS-7细胞系中通过FACS分析首先评价鼠抗hIGF-1R抗体和嵌合抗hIGF-1R抗体的结合。在FACS缓冲液(PBS,0.1%BSA,0.01%NaN3)中,将细胞(1x106个细胞/ml)与抗IGF-1R抗体在4℃孵育20min。然后将细胞洗涤3次,并与偶联有Alexa488的合适的第二抗体孵育,然后在暗处在4℃孵育另外20分钟,最后在FACS缓冲液中洗涤3次。使用碘化丙啶(其将死细胞染色)鉴定存活的细胞,立即在所述存活的细胞中评价抗IGF-1R抗体的结合。使用非线性回归分析(GraphPadPrims4.0)计算结合的EC50,其以摩尔浓度(M)表示。在COS-7猴细胞系中获得的滴定曲线显示,所有抗hIGF-1RAb特异性地识别在猴细胞系的表面上表达的IGF-1R(图5A)。每种鼠Ab和嵌合Ab的EC50的测定显示,该2种形式在它们对猴IGF-1R的结合性质方面较为符合(图5B)。这些结果表明,所有产生的抗hIGF-1R都识别猴IGF-1R。进行对COS-7细胞相比于对转染的IGF-1R细胞的结合EC50的比较,以验证对人IGF-1R相比于对猴IGF-1R的嵌合抗体识别的量级。图5C中显示的结果证明了所有抗体对人IGF-1R和猴IGF-1R的类似的识别。为了确认对另一种类型的猴的识别,用IGF-1R形式食蟹猴转染细胞,以产生可溶性猴IGF-1RECD,并用嵌合抗体(c208F2)之一进行Biacore实验,以比较其对hIGF-1R或食蟹猴IGF-1R的结合性质。使用由抗TagHis抗体活化的CM5传感器芯片(His捕获试剂盒GEHealthcare目录号28-9950-56),在BiacoreX100装置上运行识别实验。使用胺试剂盒化学,将超过11000RU的抗体化学接枝到羧甲基葡聚糖基质上。使用HBS-EP缓冲液(GEHealthcare)作为运行和样品稀释缓冲液,以30μl/min的流速在25℃进行实验。使用单循环动力学方案,定义208F2抗体的嵌合形式(c208F2)对hIGF-1R相比于对猕猴(Macaca)IGF-1R的结合的动力学参数。在限定为捕获约160RU抗原的稀释度,将IGF-1R异四聚体的可溶性重组形式的溶液在第二流动池中注射1分钟,所述IGF-1R异四聚体由2α链和2β链的细胞外结构域组成,表达额外的C-末端10-His标签,基于人的序列(R&DSystems目录号305-GR-50)或食蟹猴之一的序列(自制(producedinhouse))。在捕获阶段后,在两个流动池中,注射运行缓冲液5次(每次注射90秒),或注射增加的5个浓度范围的c208F2(每次注射90秒)。在第五次注射结束时,使运行缓冲液经过(pass)以定义解离速率。然后,在30s期间注射10mM甘氨酸,HClpH1.5缓冲液使表面再生。计算的信号对应于流动池2的响应(具有捕获的IGF-1R)与流动池1的响应(没有任何IGF-1R分子)之间的差值(图6)。对于每种IGF-1R分子(人或食蟹猴),通过减去缓冲液的5次注射获得的信号(双参比),校正由于增加的浓度范围的c208F2的注射而产生的信号。使用具有1:1模型的Biaevaluation软件分析所得的传感图。独立地(c208F2对每种IGF-1R的结合的2个动力学速率)或共同地(c208F2对人IGF-1R和食蟹猴IGF-1R的结合的相同动力学速率)评价动力学速率。通过低于0.05RU的Chi2/Rmax比例评估拟合的质量。分别为每种IGF-1R定义的结合的动力学速率(参见表10)是接近的,并且具有相同动力学速率的两张传感图的拟合具有良好的质量。c208F2抗体同样地识别重组人IGF-1R和食蟹猴IGF-1R,解离常数(KD)为约0.2nM。在本研究中定义的亲和力对应于约160RU的捕获的人IGF-1R和食蟹猴IGF-1R的水平的抗体的功能亲和力(亲合力(avidity))。表10IGF1Rkon[1/M.s]koff[1/s]Kd[nM]Chi2/Rmax人1.52E+063.40E-040.230.045食蟹猴1.85E+063.10E-040.170.032人和食蟹猴1.52E+063.33E-040.220.039实施例5:产生的抗体对IGF-1R磷酸化的固有作用众所周知,当抗体结合至酪氨酸激酶受体时,所述抗体可以诱导激动(agonistic)作用。由于我们不希望选择这样的激动剂抗体,因此使用嵌合抗体研究hIGF-1R磷酸化的评价。为了这个目的,将MCF-7细胞在无血清介质中孵育过夜。然后,在37℃将IGF-1(100nM)或待测试的Ab加入(10μg/ml)持续10分钟。弃去介质,在裂解缓冲液(pH7.5)中在4℃将细胞刮擦(scrape)90分钟,所述裂解缓冲液含有10mMTrisHCl缓冲液(pH7.5)、15%NaCl(1M)、10%去污剂混合物(10mMTris-HCl,10%Igepal裂解缓冲液)(SigmaChemicalCo.)、5%脱氧胆酸钠(SigmaChemicalCo.)、1蛋白酶抑制剂混合物(cocktail)完全TM片(Roche)、1%磷酸酶抑制剂混合物II套(Calbiochem)。通过在4℃离心使裂解物澄清,在100℃加热5min,并保持在-20℃,或直接装载在4-12%SDS-PAGE凝胶上。在室温将第一抗体孵育2hr,然后在室温与连接HRP的第二抗体孵育1hr。在用ECL使蛋白质显现之前,在TBST中洗涤膜。使用ImageJ软件将印迹定量。用GAPDH将含磷-(phospho-)蛋白质值归一化。响应IGF-1的hIGF-1R的磷酸化被认为是100%的刺激。抗hIGF-1RAb对hIGF-1R的磷酸化的作用被确定为由IGF-1诱导的磷酸化的%。图7中描述的结果表示相比于IGF-1,响应嵌合抗IGF-1RAb的pIGF-1R的3次独立实验的%的平均值+/-S.D.。如图所示,当MCF-7细胞与10μg抗IGF-1RAb孵育时,没有检测到显著或微小(<10%)的hIGF-1R的磷酸化。实施例6:通过鼠IGF-1R抗体的响应IGF-1的IGF-1R磷酸化的抑制为了表征所选择的抗体,研究了它们抑制IGF1诱导的磷酸化的能力。为了这个目的,将MCF-7细胞在无血清介质中孵育过夜。然后,将细胞与鼠抗hIGF-1RAb孵育5分钟,然后在37℃加入IGF-1持续2分钟。弃去介质,在裂解缓冲液(pH7.5)中在4℃将细胞刮擦90分钟,所述裂解缓冲液含有10mMTrisHCl缓冲液(pH7.5)、15%NaCl(1M)、10%去污剂混合物(10mMTris-HCl,10%Igepal裂解缓冲液)(SigmaChemicalCo.)、5%脱氧胆酸钠(SigmaChemicalCo.)、1蛋白酶抑制剂混合物完全TM片(Roche)、1%磷酸酶抑制剂混合物II套(Calbiochem)。通过在4℃离心使裂解物澄清,在100℃加热5min,并保持在-20℃,或直接装载在4-12%SDS-PAGE凝胶上。在室温将第一抗体孵育2h,然后在室温与连接HRP的第二抗体孵育1hr。在用ECL使蛋白质显现之前,在TBST中洗涤膜。使用ImageJ软件将印迹定量。用GAPDH将含磷-蛋白质值归一化。响应IGF-1的hIGF-1R的磷酸化被认为是100%的刺激。抗hIGF-1RAb对hIGF-1R的磷酸化的作用被确定为由IGF-1诱导的磷酸化的%。所有抗IGF-1RAb强烈抑制响应IGF-1的hIGF-1R磷酸化(降低>80%)(图8)。hIGF-1R的IGF1诱导的磷酸化的最佳抑制剂为m208F2、m212A11和m214F8Mab。实施例7:通过FACS分析,在结合所产生的IGF-1R抗体后IGF-1R内化的研究将MCF-7细胞与10μg/ml嵌合抗体在4℃孵育20min。然后,将细胞洗涤,并在4℃或37℃孵育4h。使用第二抗体确定细胞表面结合的抗体的量。ΔMFI对应于内化的Ab的量,所述ΔMFI被定义为4小时孵育时间后在4℃测量的MFI和在37℃测量的MFI之间的差值。ΔMFI呈现于图9和表11中。10μg/mlAb的内化的百分比计算如下:100*(4℃的MFI–37℃的MFI)/4℃的MFI,并呈现于表11中。表11Ab内化%ΔMFIΔMFI_EC50c208F2832881.8E-10c212A11803222.7E-10c214F8874032.2E-10c219D6803534.4E-10c231B10853692.3E-10为了确定抗体(其也识别猴IGF-1R)是否能够内化该受体,进行相同的内化实验。表12中总结的结果证明,所有经测试的抗体都能够介导猴IGF-1R内化。表12进一步评价细胞表面结合抗体减少的动力学。为了这个目的,将MCF-7细胞接种在96孔板中,并与10μg/ml鼠在4℃孵育20min。然后,洗涤细胞以去除未结合的抗体,并在37℃在介质中持续10、20、30、60或120min。在每个时间点,将细胞离心,然后用第二抗小鼠IgG-Alexa488在冰上进行表面标记,以确定细胞表面上剩余的抗体的量。通过4℃的信号(剩余的IGF-1R的%)将每种鼠Ab和每个时间点的荧光强度归一化,并拟合为指数式衰减以确定半衰期(t1/2)。t1/2被认为是获得50%信号减少所需的时间。如图10所阐明,在前30min中所有鼠Ab的表面水平迅速下降,并且在孵育60min后降低几乎是最大的(图10A)。根据鼠Ab的计算的半衰期为10至18min之间(图10B)。为了验证细胞表面信号的降低是由于Ab内化而不是由于受体脱落,将细胞与鼠Ab在37℃孵育0、30和60min(图11)。然后,将细胞固定,并通透化或不通透化,以确定对应于细胞表面结合+内化Ab(通透化的)的细胞表面结合抗体(w/o通透化)和总抗体信号。内化的Ab的量(细胞质)如下确定:通透化后的MFI-w/o通透化的MFI。该实验显示,细胞表面结合的Ab的降低是由于细胞质Ab的增加,证明Ab被内化(图11)。此外,如通透化后信号的降低(总计)所示,Ab的降解在孵育1h后开始。实施例8:通过共聚焦分析,在结合所产生的IGF-1R抗体后IGF-1R内化的研究为了进一步确认抗体内化,进行共聚焦显微镜,以评估细胞运输(cellulartrafficking)后抗体的亚细胞分布。将细胞与抗hIGF-1RAb在37℃孵育,固定并通透化。因此,使用第二抗体Alexa-488和兔抗Lamp-1抗体将细胞染色,使用第二抗兔IgGAlexa555显示所述兔抗Lamp-1抗体。在37℃孵育之前,鼠208F2Ab被定位于MCF-7细胞的膜上(图12A)。使用ImageJ软件的共定位高亮插件,没有注意到与溶酶体标记物lamp-1的共定位。在37℃孵育15min后,细胞表面结合的抗体显著降低。伴随细胞表面结合的抗体的降低,在囊泡中检测到细胞内抗体。可以观察到与lamp-1的少见的共定位。在孵育30min后,几乎检测不到细胞表面结合的抗体。然而,Ab向溶酶体中的共定位增加。在孵育1h后,细胞内Ab染色降低,并且与lamp-1共定位的数量也降低。这种细胞表面结合的抗体的动力学及其细胞内累积与通过FACS的抗体表面衰变测量的动力学相关。此外,如已经用FACS研究所描述,通过共聚焦显微镜,鼠Ab的降解在孵育1h后开始。还评估了所有其它hIGF-1R鼠抗体的内化和它们与Lamp-1的共定位(图12B)。在37℃孵育30min后,检测细胞内抗体,并且可以观察到与lamp-1的共定位,表明所有选择的抗IGF-1R抗体都被有效地内化至溶酶体中。实施例9:使用溶酶体抑制剂巴佛洛霉素A1(BafilomycinA1)的Ab降解的抑制为了确认抗体到达溶酶体(在其中它们被降解),用巴佛洛霉素A1(一种溶酶体功能的有效抑制剂)处理细胞或不处理细胞。然后,将细胞与10μg/ml待测试的Ab在4℃孵育,洗涤并在37℃孵育2h。在细胞通透化后,使用第二抗小鼠IgG-Alexa488Ab检测内化的Ab。巴佛洛霉素A1的加入阻止了细胞内Ab的降解(图13),表明Ab被有效地内化并在溶酶体中降解。实施例10:pH对抗体-IGF-1R结合的作用由于抗体基于其内化潜力被选择,并且上面显示在进入溶酶体区室之前其与早期核内体共定位,所以有趣的方法在于选择抗体,其中根据pH环境调节所述抗体的Ab/hIGF-1R结合的稳定性,并且优选当pH环境变为酸性时优先与IGF-1R解离的抗体。事实上,早期核内体与溶酶体之间的主要区别为它们的腔内pH:在核内体区室中pH约为6,而在溶酶体区室中pH约为4.5。众所周知,一旦在配体结合(IGF1)后被内化,hIGF-1R通过回收通路返回至细胞表面。不通过理论连接,本文所描述的假设为,抗体将可能有利于靶回收至膜,所述抗体更倾向于在酸性pH下提前从它们的靶释放,因此其可以被认为是ADC方法的更好的候选物。为了研究我们的抗体中的一些是否显示这样的性质,并将该性质与细胞毒活性相关联,在不同pH的缓冲液中进行在MCF-7细胞系中鼠抗hIGF-1RMab的结合。在从5至8变动的不同pH下,将增加浓度的鼠mAb在MCF-7细胞系中在4℃孵育20min。然后,将细胞洗涤3次,并在FACS缓冲液中与合适的第二抗体孵育,所述第二抗体与Alexa488偶联。将细胞在4℃在黑暗中孵育另外20分钟,然后在FACS缓冲液中洗涤3次。使用碘化丙啶(其将死细胞染色)鉴定存活的细胞,立即在所述存活的细胞中进行抗hIGF-1R抗体的结合。使用非线性回归分析(GraphPadPrims4.0)计算结合的EC50,其以摩尔浓度(M)表示。如在图14中所阐明,所选择的所有鼠抗IGF-1R抗体在酸性pH下显示较低的结合能力。在不同pH的缓冲液中进行人源化抗IGF-1RMab在MCF-7细胞系中的结合。在从5至8变动的不同pH下,将增加浓度的人源化mAb在MCF-7细胞系中在4℃孵育20min。然后,将细胞洗涤3次,并在FACS缓冲液中与合适的第二抗体孵育,所述第二抗体与Alexa488偶联。将细胞在4℃在黑暗中孵育另外20分钟,然后在FACS缓冲液中洗涤3次。使用碘化丙啶(其将死细胞染色)鉴定存活的细胞,立即在所述存活的细胞中进行抗IGF-1R人源化抗体的结合。使用非线性回归分析(GraphPadPrims4.0)计算结合的EC50,其以摩尔浓度(M)表示。如在图24中所阐明,人源化抗IGFR抗体在酸性pH下显示较低的结合能力。实施例12:208F2Mab的人源化形式的评价12.1第一人源化形式hz208F2VH3/VL3(也被称作hz208F2H026/L024)的结合和内化的评价在MCF-7、COS-7和NIH3T3IR+细胞系中评价c208F2mAb的第一人源化形式的结合。在4℃,在每个细胞系中加入增加浓度的m208F2、c208F2或hz208F2VH3VL3持续20min。然后,洗涤细胞,并使用相应的第二抗体显示经测试的mAb的结合。为了验证人IR在转染细胞系中的表达,使用市售抗hIR抗体克隆GRO5,其识别模式在(图15D)中示例。在MCF-7(图15A)细胞或猴COS-7(图15B)细胞中,人源化形式与鼠形式或嵌合形式的比较显示了经测试的3种形式的紧密模式。人源化过程不改变抗体识别的特异性,就在人胰岛素受体上不存在交叉反应性而论,其完全与鼠形式和嵌合形式可相比(图15C)。在人细胞系MCF-7和猴细胞系COS-7中208F2的第一人源化形式的计算的EC50与用mAb208F2的鼠形式或嵌合形式测定的EC50相似。通过流式细胞术评估待内化的mAbhz208F2VH3/VL3的能力。将MCF-7细胞与10μg/ml抗体在4℃孵育20min。然后,将细胞洗涤,并在4℃或37℃孵育4h。使用第二抗体确定细胞表面结合的抗体的量。ΔMFI对应于内化的Ab的量,所述ΔMFI被定义为4小时孵育时间后在4℃测量的MFI和在37℃测量的MFI之间的差值。ΔMFI呈现于图16和表13中。10μg/mlAb的内化的百分比计算如下:100*(4℃的MFI–37℃的MFI)/4℃的MFI,并呈现于表13中。因此,人源化的hz208F2VH3/VL3具有结合和内化性质,所述结合和内化性质与用相应的鼠208F2抗体和嵌合208F2抗体测量的结合和内化性质是相似的。表13a12.2随后的hz208F2人源化形式的结合的评价mAb208F2被人源化,并评价十六种人源化变体(包括在12.1中所描述的第一形式)的结合性质。使用增加的抗体浓度,在人MCF-7乳腺癌细胞系和猴细胞系Cos-7中,通过FACS分析评价人源化变体的结合性质。为了这个目的,在FACS缓冲液(PBS,0.1%BSA,0.01%NaN3)中,将细胞(1x106个细胞/ml)与抗IGF-1R抗体在4℃孵育20min。然后将它们洗涤3次,并在暗处与偶联有Alexa488的合适的二级抗体在4℃孵育另外20分钟,然后在FACS缓冲液中洗涤3次。使用碘化丙啶(其将死细胞染色)鉴定存活的细胞,立即在所述存活的细胞中进行抗IGF-1R抗体的结合。使用非线性回归分析(GraphPadPrims4.0)计算结合的EC50,其以摩尔浓度(M)表示。人源化变体的EC50显示,所有的人源化变体在人细胞系和猴细胞系中显示等同的结合性质。人源化抗体的EC50总结于表13b中。表13b12.3另一种hz208F2人源化形式的内化的评价将MCF-7细胞与10μg/ml人源化抗体在4℃孵育20min。然后,将细胞洗涤,并在4℃或37℃孵育4h。在FacsCalibur流式细胞仪(BectonDickinson)上,使用第二抗体确定细胞表面结合的抗体的量。ΔMFI对应于内化的Ab的量,所述ΔMFI被定义为4小时孵育时间后在4℃测量的MFI和在37℃测量的MFI之间的差值。ΔMFI呈现于表13c中。10μg/mlAb的内化的百分比计算如下:100*(4℃的MFI–37℃的MFI)/4℃的MFI。人源化抗体hz208F2H077/L018能够诱导IGF-1R的显著的内化。表13cΔMFI内化%hz208F2H077/L01846888实施例13:五种嵌合抗IGF-1R抗体(c208F2、c213B10、c212A11、c214F8和c219D6)和208F2抗体的人源化形式(VH3/VL3)在可溶性重组人IGF-1R中的结合的解离常数(KD)的定义通过解离速率(koff)和结合速率(kon)之间的比例定义抗体在重组可溶性人-IGF-1R中的结合的解离常数(KD)。使用CM5传感器芯片,在BiacoreX100装置中运行动力学实验,通过小鼠抗TagHis单克隆抗体活化所述CM5传感器芯片。使用胺试剂盒化学,将约12000RU的抗体化学接枝到羧甲基葡聚糖基质上。使用HBS-EP+缓冲液(GEHealthcare)作为运行和样品稀释缓冲液,以30μl/min的流速在25℃进行实验。使用单循环动力学方案,以定义由其两个C端10组氨酸标签捕获的抗IGF-1R抗体在可溶性重组人IGF-1R中的结合的动力学参数。1-人IGF-1R异四聚体的可溶性重组形式的溶液:以10μg/ml的浓度,在一分钟期间,在第二流动池中注射表达额外的C-末端10-His标签的2α链和2β链的细胞外结构域(R&DSystems目录号305-GR-50)。在本研究实现的24个周期的每个周期中,捕获平均587RU(具有标准差24RU)的可溶性受体。2-在捕获阶段后,在两个流动池中,注射运行缓冲液5次(每次注射90秒),或注射增加的5个浓度范围的六种抗体之一(每次注射90秒)。在第五次注射结束时,在5分钟期间使运行缓冲液经过以定义解离速率。3-然后,在45s期间注射10mM甘氨酸,HClpH1.5缓冲液使表面生成。计算的信号对应于流动池2的响应(具有捕获的IGF-1R)与流动池1的响应(没有任何IGF-1R分子)之间的差值。对于每种IGF-1R,通过减去缓冲液的5次注射获得的信号(双参比),校正由于增加的浓度范围的一种抗体的注射而产生的信号,参见图17。通过具有1:1模型的Biaevaluation软件分析所得的传感图。对于每种抗体,使用两种不同的浓度范围运行四次实验:对于每个抗体运行,前两个实验为40、20、10、5和2.5nM,后两个实验为24、12、6、3和1.5nM。对于在该实验中测试的6种抗体,当较高的浓度被定义为常数且计算其他四个浓度时,实验数据与具有显著的koff值的1:1模型拟合良好(参见图18)。作为比例koff/kon计算的解离常数(KD),和作为比例Ln(2)/koff计算的复合物的半衰期呈现在图19和20中。它们对应于对每种抗体运行的四次独立实验的平均值。误差条对应于数值的标准误差(n=4)。解离常数在10至100pM的范围内。c208F2抗体呈现对h-IGF-1R的较弱的亲和力(较高的解离常数值)(具有约75pM的KD),并且其人源化形式至少与嵌合形式一样好(具有约60pM的KD)。其他四种抗IGF-1R嵌合抗体表现出对hIGF1-R的非常相似的亲和力(KD约为30pM)。亲和力的差异主要与复合物的解离速率或结果(resultant)半衰期相关。对于208F2,对于嵌合和人源化(VH3/VL3)形式,复合物的半衰期为2至3小时。对于其他四种嵌合抗体,平均半衰期为7.0至9.4h。这些非常慢的解离动力学与抗体的二价结构明显相关,所述二价结构能够通过它们的两个Fab臂同时结合至两个相邻的h-IGF-1R分子。在这种情况下,捕获的IGF-1R分子的水平可能对解离速率产生影响。本研究中定义的亲和力对应于约600RU的捕获的h-IGF-1R的水平的抗体的功能亲和力(或亲合力)。在上面所示的数据(表10)和实施例13中呈现的数值之间观察到的KD的3倍差异与hIGF-1R的捕获水平的变化相关(600RU相比于实施例4中的160RU)。实施例14:本发明的药物的合成在以下实施例中使用以下缩写:aq.水溶液ee对映体过量equiv当量ESI电喷雾电离LC/MS液相色谱与质谱联用HPLC高效液相色谱NMR核磁共振sat.饱和的UV紫外线参考化合物1(S)-2-((S)-2-((3-氨基丙基)(甲基)氨基)-3-甲基丁酰胺基)-N-((3R,4S,5S)-3-甲氧基-1-((S)-2-((1R,2R)-1-甲氧基-2-甲基-3-氧代-3-(((S)-2-苯基-1-(噻唑-2-基)乙基)氨基)丙基)吡咯烷-1-基)-5-甲基-1-氧代庚烷-4-基)-N,3-二甲基丁酰胺双三氟乙酸化合物1A:(4R,5S)-4-甲基-5-苯基-3-丙酰基-1,3-噁唑烷-2-酮在惰性气氛中,将(4R,5S)-4-甲基-5-苯基-1,3-噁唑烷-2-酮(5.8g,32.7mmol,1.00equiv)溶解于四氢呋喃(THF,120mL)中。将混合物冷却至-78℃,滴加入正丁基锂(14.4mL)。在-78℃搅拌30分钟之后,加入丙酰氯(5.7mL)。在-78℃持续搅拌30分钟,然后于环境温度搅拌过夜。将反应混合物浓缩,然后重新溶解于200mL水中。用碳酸氢钠饱和水溶液调节溶液的pH至7。用100mL乙酸乙酯(EtOAc)萃取该水相3次。将有机相合并,经硫酸钠干燥,过滤和浓缩以获得6.8g(89%)黄色油形式的化合物1A。化合物1B:(2S)-2-[(1R,2R)-1-羟基-2-甲基-3-[(4R,5S)-4-甲基-2-氧代-5-苯基-1,3-噁唑烷-3-基]-3-氧代丙基]吡咯烷-1-羧酸叔丁酯在惰性气氛中,将化合物1A(17.6g,75.45mmol,1.00equiv)溶解于二氯甲烷(DCM,286mL)中。用冰浴冷却该溶液。滴加入三乙胺(TEA,12.1mL,1.15equiv)和Bu2BOTf(78.3mL,1.04equiv),同时保持反应混合物的温度在2℃以下。在0℃继续搅拌45分钟,之后将反应冷却至-78℃。滴加入(2S)-2-甲酰基吡咯烷-1-羧酸叔丁酯(8.5g,42.66mmol,0.57equiv)在DCM(42mL)中的溶液。在-78℃继续搅拌2小时,然后在0℃搅拌1小时,最后在环境温度搅拌1小时。用72mL磷酸盐缓冲液(pH=7.2-7.4)和214mL甲醇中和反应,并冷却至0℃。滴加入30%过氧化氢在甲醇(257mL)中的溶液,同时保持温度在10℃以下。在0℃继续搅拌1小时。用142mL水中和反应,然后减压浓缩。用200mLEtOAc萃取所得的水溶液3次。将有机相合并,经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和石油醚的混合物(EtOAc:PE=1:8)纯化以获得13.16g(40%)无色油形式的化合物1B。化合物1C:(2R,3R)-3-[(2S)-1-[(叔丁氧基)羰基]吡咯烷-2-基]-3-羟基-2-甲基丙酸在过氧化氢(水中30%,15.7mL)的存在下,将化合物1B(13.16g,30.43mmol,1.00equiv)溶解于THF(460mL)中,然后用冰浴冷却。滴加入氢氧化锂(0.4mol/L,152.1mL)的水溶液,同时保持反应温度在4℃以下。在0℃搅拌反应混合物2.5小时。滴加入Na2SO3(1mol/L,167.3mL)的水溶液,同时保持温度在0℃。在环境温度搅拌反应混合物14小时,然后用150mL冷的碳酸氢钠饱和溶液中和并用50mLDCM洗涤3次。用1MKHSO4的水溶液调节水溶液的pH至2-3。用100mLEtOAc萃取该水溶液3次。将有机相合并,用饱和NaCl溶液洗涤一次,经硫酸钠干燥,过滤和浓缩以获得7.31g(88%)无色油形式的化合物1C。化合物1D:(2R,3R)-3-[(2S)-1-[(叔丁氧基)羰基]吡咯烷-2-基]-3-甲氧基-2-甲基丙酸在惰性气氛中在碘甲烷(25.3mL)的存在下将化合物1C(7.31g,26.74mmol,1.00equiv)溶解于THF(135mL)中。用冰浴冷却反应介质,之后分批加入NaH(油中60%,4.28g)。在搅拌下在0℃放置反应3天,然后用100mL碳酸氢钠饱和水溶液中和,并用50mL乙醚洗涤3次。用1MKHSO4的水溶液调节水溶液的pH至3。用100mLEtOAc萃取该水溶液3次。将有机相合并,用100mLNa2S2O3(水中5%)洗涤一次,用NaCl饱和溶液洗涤一次,然后经硫酸钠干燥,过滤和浓缩以获得5.5g(72%)无色油形式的化合物1D。化合物1E:N-甲氧基-N-甲基-2-苯基乙酰胺将2–苯乙酸(16.2g,118.99mmol,1.00equiv)溶解于二甲基甲酰胺(DMF,130mL)中,然后冷却至-10℃。加入氰基磷酸二乙酯(DEPC,19.2mL)、甲氧基(甲基)胺盐酸盐(12.92g,133.20mmol,1.12equiv)和三乙胺(33.6mL)。在-10℃搅拌反应混合物30分钟,然后在环境温度搅拌2.5小时。然后,用1升EtOAc萃取两次。将有机相合并,用500mLNaHCO3(sat.)洗涤两次,用400mL水洗涤一次,然后经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:100至1:3)纯化,以获得20.2g(95%)黄色油形式的化合物1E。化合物1F:2-苯基-1-(1,3-噻唑-2-基)乙-1-酮在惰性气氛中,将四甲基乙二胺(TMEDA,27.2mL)溶解于THF(300mL)中,然后在滴加入n-BuLi(67.6mL,2.5M)之前冷却至-78℃。滴加入2–溴–1,3–噻唑(15.2mL)并在-78℃继续搅拌30分钟。滴加入溶解于THF(100mL)中的化合物1E(25g,139.50mmol,1.00equiv)。在-78℃继续搅拌30分钟,然后在-10℃搅拌2小时。用500mLKHSO4(sat.)中和反应,然后用1升EtOAc萃取3次。将有机相合并,用400mL水洗涤两次,用700mLNaCl(sat.)洗涤两次,然后经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:100至1:10)纯化以获得25g(88%)黄色油形式的化合物1F。化合物1G:(1R)-2-苯基-1-(1,3-噻唑-2-基)乙-1-醇在惰性气氛中,将化合物1F(15g,73.8mmol,1.00equiv.)在乙醚(300mL)中的溶液滴加入(+)-B-二异松蒎基氯硼烷((+)–Ipc2BCl,110.8mL)中。在0℃搅拌反应混合物24小时,然后用300mLNaOH(水中10%)和H2O2(水中30%)的混合物(1:1)中和,最后用500mLEtOAc萃取三次。将有机相合并,用300mLK2CO3(sat.)洗涤两次,用500mLNaCl(sat.)洗涤一次,然后经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:20至1:2)纯化以获得6.3g(42%)白色固体形式的化合物1G。化合物1H:2-[(1S)-1-叠氮-2-苯基乙基]-1,3-噻唑在惰性气氛中,在三苯基膦(13g,49.56mmol,1.70equiv.)的存在下,将化合物1G(6g,29.23mmol,1.00equiv.)溶解于THF(150mL)中,然后冷却至0℃。滴加入偶氮二羧酸二乙酯(DEAD,7.6mL),接着滴加入叠氮磷酸二苯酯(DPPA,11mL),然后移走冷浴,搅拌下在环境温度放置溶液48小时。在减压下浓缩介质。将残余物在硅胶柱上用EtOAc和PE的混合物(1:100至1:30)纯化,以获得8g黄色油形式的部分纯化的化合物1H。化合物1H就这样用于以下步骤。化合物1I:N-[(1S)-2-苯基-1-(1,3-噻唑-2-基)乙基]氨基甲酸叔丁酯在惰性气氛中,在三苯基膦(6.5g,33.9mmol,1.20equiv)的存在下,将化合物1H(6.5g,28.2mmol,1.00equiv)溶解于THF(100mL)中,并加热至50℃持续2小时。然后加入氨水(70mL)并继续加热3小时。将反应冷却,用500mL水中和,然后用500mLEtOAc萃取3次。将有机相合并,用500mL1NHCl萃取两次。将水相合并,通过加入氢氧化钠溶液(水中10%)调节至pH8-9,然后用500mLDCM萃取3次。将有机相合并,经硫酸钠干燥,过滤和浓缩以获得4.8g(83%)黄色油形式的(1S)-2-苯基-1-(1,3-噻唑-2-基)乙-1-胺。然后用Boc基团((叔丁氧基)羰基)保护该化合物,以便能够将其纯化。在惰性气氛中,将其溶解于1,4-二氧六环(40mL)中,然后冷却至0℃。滴加入稀释于20mL1,4-二氧六环中的(Boc)2O(10.26g,47.01mmol,2.00equiv)。移走冷浴,搅拌下在环境温度放置溶液过夜,然后用300mL水中和,并用500mLEtOAc萃取两次。将有机相合并,经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:100至1:20,ee=93%)纯化。然后,将其在己烷/丙酮混合物(~5-10/1,1g/10mL)中重结晶,以获得6g(84%)白色固体形式的化合物1I(ee>99%)。化合物1J:(2S)-2-[(1R,2R)-1-甲氧基-2-甲基-2-[[(1S)-2-苯基-1-(1,3-噻唑-2-基)乙基]氨基甲酰基]乙基]吡咯烷-1-羧酸叔丁酯在惰性气氛中,将化合物1I(3g,9.86mmol,1.00equiv)溶解于10mLDCM中。加入三氟乙酸(TFA,10mL),搅拌下在环境温度放置溶液过夜,然后在减压下浓缩,以获得2.0g(64%)黄色油形式的(1S)-2-苯基-1-(1,3-噻唑-2-基)乙-1-胺三氟乙酸盐。将该中间体重新溶解于20mLDCM中,然后加入化合物1D(1.8g,6.26mmol,1.05equiv)、DEPC(1.1g,6.75mmol,1.13equiv)和二异丙基乙胺(DIEA,1.64g,12.71mmol,2.13equiv)。在搅拌下在环境温度放置反应混合物过夜,然后减压下浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:100至1:3)纯化,以获得2.3g(81%)淡黄色固体形式的化合物1J。化合物1K:(2R,3R)-3-甲氧基-2-甲基-N-[(1S)-2-苯基-1-(1,3-噻唑-2-基)乙基]-3-[(2S)-吡咯烷-2-基]丙酰胺三氟乙酸盐在惰性气氛中,将化合物1J(2.25g,4.75mmol,1.00equiv)溶解于10mLDCM中。加入TFA(10mL),并在搅拌下在环境温度将溶液放置过夜,然后减压下浓缩,以获得2.18g(94%)黄色油形式的化合物1K。化合物1L:(2S,3S)-2-(苄基氨基)-3-甲基戊酸在环境温度,将(2S,3S)-2-氨基-3-甲基戊酸(98.4g,750mmol,1.00equiv)分批加入至2N氢氧化钠溶液(375mL)中。快速加入苯甲醛(79.7g,751.02mmol,1.00equiv),将所得溶液搅拌30分钟。分小份加入硼氢化钠(10.9g,288.17mmol,0.38equiv),同时保持温度在5至15℃。在环境温度继续搅拌4小时。用200mL水稀释反应混合物,然后用200mLEtOAc洗涤两次。用2N盐酸溶液调节水溶液的pH至7。通过过滤收集形成的沉淀,得到149.2g(90%)白色固体形式的化合物1L。化合物1M:(2S,3S)-2-[苄基(甲基)氨基]-3-甲基戊酸在惰性气氛中,在甲醛(水中36.5%22.3g)的存在下,将化合物1L(25g112.97mmol,1.00equiv)溶解于甲酸(31.2g)中。在90℃搅拌溶液3小时,然后减压下浓缩。将残余物在250mL丙酮中研磨,然后浓缩。用500mL丙酮重复研磨/蒸发操作两次,以获得21.6g(81%)白色固体形式的化合物1M。化合物1N:(2S,3S)-2-[苄基(甲基)氨基]-3-甲基戊-1-醇在惰性气氛中,在0℃,将LiAlH4(0.36g)悬浮于10mLTHF中。分小份加入化合物1M(1.5g,6.37mmol,1.00equiv),同时保持温度在0至10℃。在65℃搅拌反应混合物2小时,然后再次冷却至0℃,之后依次加入360μL水、1mL15%氢氧化钠和360μL水中和反应混合物。通过过滤去除沉淀出的铝盐。滤液经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:50)纯化,以获得820mg(58%)淡黄色油形式的化合物1N。化合物1O:(2S,3S)-2-[苄基(甲基)氨基]-3-甲基戊醛在惰性气氛中,将草酰氯(0.4mL)溶解于DCM(15mL)中。将溶液冷却至-70℃,经15分钟滴加入二甲基亚砜(DMSO(0.5mL))在DCM(10mL)中的溶液。将反应混合物搅拌30分钟,之后经15分钟滴加入化合物1N(820mg,3.70mmol,1.00equiv)在DCM(10mL)中的溶液。在低温将反应混合物进一步搅拌30分钟,然后缓慢加入三乙胺(2.5mL)。在-50℃搅拌反应混合物1小时,然后移走冷浴,用25mL水中和反应,同时使温度返回到正常。用30mLNaCl饱和水溶液洗涤溶液一次,然后经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:200)纯化,以获得0.42g(52%)黄色油形式的化合物1O。化合物1P:(2S,3S)-N-苄基-1,1-二甲氧基-N,3-二甲基戊-2-胺在0℃,将化合物1O(4.7g,21.43mmol,1.00equiv)溶解于20mL甲醇中。滴加入浓硫酸(4.3mL),在0℃继续搅拌30分钟。加入原甲酸三甲酯(21.4mL),移走冷浴,在搅拌下在环境温度放置反应介质3小时。用200mLEtOAc稀释反应介质,依次用100mL10%Na2CO3和200mL饱和NaCl洗涤,然后经硫酸钠干燥,过滤和减压浓缩,以获得3.4g(60%)淡黄色油形式的化合物1P。化合物1Q:[[1-(叔丁氧基)乙烯基]氧基](叔丁基)二甲基硅烷在惰性气氛中,将二异丙基胺(20g,186.71mmol,1.08equiv)溶解于170mLTHF中,并冷却至-78℃。滴加入nBuLi(2.4M,78.8mL),在低温搅拌溶液30分钟(以获得LDA-二异丙基氨基锂),然后加入乙酸叔丁酯(20g,172.18mmol,1.00equiv)。在-78℃搅拌反应混合物20分钟,然后加入六甲基磷酰胺(HMPA,25.8mL),和叔丁基二甲基氯硅烷(TBDMSCl,28g,185.80mmol,1.08equiv)在35mLTHF中的溶液。在低温继续搅拌另外20分钟,然后移走冷浴。减压下浓缩溶液。将残余物重新溶解于100mL水中,并用100mLPE萃取3次。将有机相合并,用500mLNaCl饱和水溶液洗涤一次,经硫酸钠干燥,过滤和浓缩。将残余物通过蒸馏纯化,以获得16.6g(83%)无色油形式的化合物1Q。化合物1R:(3R,4S,5S)-4-[苄基(甲基)氨基]-3-甲氧基-5-甲基庚酸叔丁酯在惰性气氛中,将化合物1P(2.0g,7.54mmol,1.00equiv)和化合物1Q(2.6g,11.28mmol,1.50equiv)溶解于33mLDCM中。将溶液冷却至0℃。滴加入DMF(1.2g)以及BF3·Et2O(2.1g)在7.5mLDCM中的溶液。在0℃继续搅拌24小时。将反应介质用30mL碳酸钠(10%)洗涤一次,用50mLNaCl饱和水溶液洗涤两次,然后经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:100)纯化,以获得1.82g(91%)黄色油形式的化合物1R。化合物1S:(3R,4S,5S)-3-甲氧基-5-甲基-4-(甲基氨基)庚酸酯盐酸盐在惰性气氛中,在Pd/C(0.12g)和浓盐酸(0.63mL)的存在下,将化合物1R(2.4g,6.87mmol,1.00equiv)溶解于35mL乙醇中。将氮气氛替换为氢气氛,搅拌下在环境温度放置反应介质18小时。将反应介质过滤和减压浓缩。将残余物在50mL己烷中研磨,移走上清液,之后将上清液减压下干燥,获得1.66g(82%)白色固体形式的化合物1S。化合物1T:(3R,4S,5S)-4-[(2S)-2-[[(苄氧基)羰基]氨基]-N,3-二甲基丁酰胺基]-3-甲氧基-5-甲基庚酸叔丁酯在DIEA(38.3mL)和三吡咯烷基溴化鏻六氟磷酸盐(PyBrOP,32.3g)的存在下,将(2S)-2-[[(苄氧基)羰基]氨基]-3-甲基丁酸(15g,0.40mmol,1.00equiv)溶解于300mLDCM中。在环境温度搅拌溶液30分钟,然后加入化合物1S(15.99g,0.42mmol,1.07equiv)。将反应介质搅拌2小时,然后浓缩。将残余物经反相(C18)用乙腈(ACN)和水的混合物(40分钟内30:70至100:0)纯化,以获得17g(58%)无色油形式的化合物1T。化合物1U:(3R,4S,5S)-4-[(2S)-2-氨基-N,3-二甲基丁酰胺基]-3-甲氧基-5-甲基庚酸叔丁酯在惰性气氛中,在Pd/C(0.05g)的存在下,将化合物1T(76mg,0.15mmol,1.00equiv)溶解于10mL乙醇中。将氮气氛替换为氢气氛,在环境温度搅拌反应2小时。将反应介质过滤,并减压浓缩,以获得64mg无色油形式的化合物1U。化合物1V:(3R,4S,5S)-4-[(2S)-2-[[(9H-芴-9-基甲氧基)羰基]氨基]-N,3-二甲基丁酰胺基]-3-甲氧基-5-甲基庚酸酯在碳酸氢钠(12.78g,152mmol,3.00equiv)和9H-芴-9-基甲基氯甲酸酯(Fmoc-Cl,19.69g,76mmol,1.50equiv)的存在下,将化合物1U(18.19g,50.74mmol,1.00equiv)溶解于400mL1,4-二氧六环/水混合物(1:1)中,然后在环境温度搅拌2小时。然后,将反应介质用500mL水稀释,并用200mLEtOAc萃取3次。将有机相合并,用200mLNaCl饱和水溶液洗涤一次,经硫酸钠干燥,过滤和浓缩,以获得40g淡黄色油形式的部分纯化的化合物1V。化合物1W:(3R,4S,5S)-4-[(2S)-2-[[(9H-芴-9-基甲氧基)羰基]氨基]-N,3-二甲基丁酰胺基]-3-甲氧基-5-甲基庚酸在中性气氛中,将化合物1V(40g,68.88mmol,1.00equiv)溶解于600mLDCM中。加入TFA(300mL)。在环境温度搅拌溶液2小时,然后减压浓缩。将残余物在硅胶柱上用甲醇和DCM的混合物(1:10)纯化,以获得23.6g(65%)无色油形式的化合物1W。化合物1X:9H-芴-9-基甲基N-[(1S)-1-[[(3R,4S,5S)-3-甲氧基-1-[(2S)-2-[(1R,2R)-1-甲氧基-2-甲基-2-[[(1S)-2-苯基-1-(1,3-噻唑-2-基)乙基]氨基甲酰基]乙基]吡咯烷-1-基]-5-甲基-1-氧代庚烷-4-基](甲基)氨基甲酰基]-2-甲基丙基]氨基甲酸酯在化合物1K(2.18g,4.47mmol,1.00equiv)、DEPC(875mg,5.37mmol,1.20equiv)和DIEA(1.25g,9.67mmol,2.16equiv)的存在下,将化合物1W(2.53g,4.82mmol,1.08equiv)溶解于20mLDCM中。在搅拌下在环境温度放置反应混合物过夜,然后依次用50mL饱和KHSO4和100mL水洗涤,经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用甲醇和DCM的混合物(1:200至1:40)纯化,以获得2.8g(71%)淡黄色固体形式的化合物1X。化合物1Y:(2S)-2-氨基-N-[(3R,5S)-3-甲氧基-1-[(2S)-2-[(1R,2R)-1-甲氧基-2-甲基-2-[[(1S)-2-苯基-1-(1,3-噻唑-2-基)乙基]氨基甲酰基]乙基]吡咯烷-1-基]-5-甲基-1-氧代庚烷-4-基]-N,3-二甲基丁酰胺在哌啶(3mL)的存在下,将化合物1X(2.8g,3.18mmol,1.00equiv)溶解于乙腈(ACN,12mL)中,并在搅拌下在环境温度放置18小时。将反应用50mL水中和,然后用100mLDCM萃取两次。将有机相合并,经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用甲醇和DCM的混合物(1:100至1:40)纯化,以获得1.2g(57%)黄色固体形式的化合物1Y。化合物1ZA:(2S)-2-[[(叔丁氧基)羰基](甲基)氨基]-3-甲基丁酸在惰性气氛中,在碘甲烷(181mL)的存在下,将(2S)-2-[[(叔丁氧基)羰基]氨基]-3-甲基丁酸(63g,289.97mmol,1.00equiv)溶解于THF(1000mL)中。将溶液冷却至0℃,然后分小份加入氢化钠(116g,4.83mol,16.67equiv)。在0℃搅拌反应混合物1.5小时,然后移走冷浴并继续搅拌18小时。用200mL水中和反应,然后减压浓缩。用4升水稀释残余的水相,用200mLEtOAc洗涤一次,用1N盐酸溶液调节其pH至3到4。用1.2LEtOAc萃取所得的混合物3次。将有机相合并,经硫酸钠干燥,过滤和浓缩,以获得60g(89%)黄色油形式的化合物1ZA。化合物1ZB:(2S)-2-[[(叔丁氧基)羰基](甲基)氨基]-3-甲基丁酸苄酯在Li2CO3(15.8g,213.83mmol,1.05equiv)的存在下,将化合物1ZA(47g,203.21mmol,1.00equiv)溶解于DMF(600mL)中。将溶液冷却至0℃,然后滴加入溴苄(BnBr57.9g,338.53mmol,1.67equiv)。将反应混合物在搅拌下放置过夜,然后用400mL水中和并过滤。用500mLEtOAc萃取所得的溶液两次。将有机相合并,经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:100至1:20)纯化,以获得22.5g(34%)黄色油形式的化合物1ZB。化合物1ZC:(2S)-3-甲基-2-(甲基氨基)丁酸苄酯盐酸盐将化合物1ZB(22.5g,70.00mmol,1.00equiv)溶解于150mLDCM中。气态盐酸鼓泡。在环境温度搅拌反应1小时,然后减压浓缩,以获得17g(94%)黄色固体形式的化合物1ZC。化合物1ZD:N-(3,3-二乙氧基丙基)氨基甲酸叔丁酯在TEA(4.45g,43.98mmol,1.08equiv)的存在下,将3,3-二乙氧基戊-1-胺(6g,40.76mmol,1.00equiv)溶解于1,4-二氧六环(30mL)中,然后冷却至0℃。滴加入稀释于20mL1,4-二氧六环中的(Boc)2O(9.6g,43.99mmol,1.08equiv)。将溶液在0℃搅拌2小时,然后在环境温度搅拌过夜,然后用10mL水中和。用HCl(1%)调节pH至5。用50mLEtOAc萃取溶液3次。将有机相合并,经硫酸钠干燥,过滤和浓缩,以获得8.21g(81%)淡黄色油形式的化合物1ZD。化合物1ZE:N-(3-氧代丙基)氨基甲酸叔丁酯将化合物1ZD(8.20g,33.15mmol,1.00equiv)溶解于18.75mL乙酸中,在搅拌下在环境温度放置过夜。然后,用30mLEtOAc萃取反应介质3次。将有机相合并,用30mL饱和NaCl溶液洗涤3次,经硫酸钠干燥,过滤和浓缩,以获得5g(87%)暗红色油形式的化合物1ZE。化合物1ZF:(2S)-2-[(3-[[(叔丁氧基)羰基]氨基]丙基)(甲基)氨基]-3-甲基丁酸在化合物1ZC(3.56g,13.81mmol,1.00equiv)和DIEA(9.16mL,4.00equiv)的存在下,将化合物1ZE(2.4g,13.86mmol,1.00equiv)溶解于50mLTHF中。在环境温度搅拌反应混合物30分钟,然后加入三乙酰氧基硼氢化钠(5.87g,27.70mmol,2.00equiv)。继续搅拌过夜,然后用100mL水中和反应,并用50mLEtOAc萃取3次。将有机相合并,经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:4)部分地纯化。在Pd/C(1.2g)的存在下,将所得的粗产品重新溶解于20mL甲醇中,并在标准温度和压力下氢化20分钟。将反应介质过滤,并减压浓缩,以获得200mg(5%)白色固体形式的化合物1ZF。化合物1ZG:N-(3-[[(1S)-1-[[(1S)-1-[[(3R,4S,5S)-3-甲氧基-1-[(2S)-2-[(1R,2R)-1-甲氧基-2-甲基-2-[[(1S)-2-苯基-1-(1,3-噻唑-2-基)乙基]氨基甲酰基]乙基]吡咯烷-1-基]-5-甲基-1-氧代庚烷-4基](甲基)氨基甲酰基]-2-甲基丙基]氨基甲酰基]-2-甲基丙基](甲基)氨基]丙基)氨基甲酸叔丁酯在化合物1ZF(26.2mg,0.09mmol,1.20equiv)、DIEA(37.7mL)和O-(7-氮杂苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸酯(HATU,43.3mg,0.11mmol,1.50equiv)的存在下,将化合物1Y(50mg,0.08mmol,1.00equiv)溶解于2mLDMF中。在环境温度将反应在搅拌下放置过夜,然后用10mL水稀释,并用5mLEtOAc萃取3次。将有机相合并,经硫酸钠干燥,过滤和浓缩,以获得100mg部分纯化的无色油形式的化合物1ZG。在中性气氛中,将化合物1ZG(90mg,0.10mmol,1.00equiv)溶解于2mLDCM中,并用冰浴冷却溶液。加入TFA(1mL),在环境温度搅拌反应2小时,然后减压浓缩。将残余物通过制备型HPLC(Pre-HPLC-001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经7分钟18%至31%ACN,然后经2分钟31%至100%ACN;Waters2489UV检测器在254nm和220nm处)纯化。获得白色固体形式的化合物1,产率25%(23mg)。LC/MS/UV(AtlantisT3柱,3μm,4.6×100mm;35℃;1mL/min,水中30%至60%ACN(经6分钟20mM乙酸铵);ESI(C44H73N7O6S,精确质量827.53)m/z:829(MH+),5.84min(93.7%,254nm)。1HNMR(300MHz,CD3OD,ppm):δ(存在旋转异构体)7.85-7.80(m,1H);7.69-7.66(m,1H),7.40-7.10(m,5H),5.80-5.63(m,1H),4.80-4.65(m,2H),4.22-4.00(m,1H),3.89-0.74(m,58H)。参考化合物2(S)-2-((S)-2-(((2-氨基吡啶-4-基)甲基)(甲基)氨基)-3-甲基丁酰胺基)-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((1S,2R)-1-羟基-1-苯基丙烷-2-基)氨基)-1-甲氧基-2-甲基-3-氧代丙基)吡咯烷-1-基)-3-甲氧基-5-甲基-1-氧代庚烷-4-基)-N,3-二甲基丁酰胺三氟乙酸盐化合物2A:(S)-2-((1R,2R)-3-(((1S,2R)-1-羟基-1-苯基丙烷-2-基)氨基)-1-甲氧基-2-甲基-3-氧代丙基)吡咯烷-1-羧酸叔丁酯在惰性气氛中,将化合物1D(2.5g,8.70mmol,1.00equiv)和(1S,2R)-2-氨基-1-苯基丙-1-醇(1.315g,8.70mmol,1.00equiv)溶解于DMF(35mL)中。将溶液冷却至0℃,然后滴加入DEPC(1.39mL)和TEA(1.82mL)。在0℃搅拌反应混合物2小时,然后在环境温度搅拌4小时。用200mL水稀释反应混合物,然后用50mLEtOAc萃取三次。将有机相合并,用50mLKHSO4(1mol/L)洗涤一次,用50mLNaHCO3(sat.)洗涤一次,用50mLNaCl(sat.)洗涤一次,然后经硫酸钠干燥,过滤和减压浓缩,以获得3.6g(98%)黄色固体形式的化合物2A。化合物2B:(2R,3R)-N-((1S,2R)-1-羟基-1-苯基丙烷-2-基)-3-甲氧基-2-甲基-3-((S)-吡咯烷-2-基)丙酰胺2,2,2-三氟乙酸盐在惰性气氛中,将化合物2A(2.7g,6.42mmol,1.00equiv)溶解于DCM(40mL)中,然后冷却至0℃。加入TFA(25mL),在0℃搅拌溶液2小时。将反应混合物减压浓缩,以获得4.4g黄色油形式的化合物2B。化合物2C:(9H-芴-9-基)甲基((S)-1-(((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((1S,2R)-1-羟基-1-苯基丙烷-2-基)氨基)-1-甲氧基-2-甲基-3-氧代丙基)吡咯烷-1-基)-3-甲氧基-5-甲基-1-氧代庚烷-4-基)(甲基)氨基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸酯在惰性气氛中,将化合物2B(4.4g,10.13mmol,1.00equiv)和1W(5.31g,10.12mmol,1.00equiv)溶解于DCM(45mL)中。将溶液冷却至0℃,然后滴加入DEPC(1.62mL)和DIEA(8.4mL)。在0℃搅拌反应混合物2小时,然后在环境温度搅拌过夜。用100mL水稀释反应混合物,并用50mLDCM萃取三次。将有机相合并,用50mLKHSO4(1mol/L)洗涤一次,用50mLNaHCO3(sat.)洗涤一次,用50mLNaCl(sat.)洗涤一次,然后经硫酸钠干燥,过滤和减压浓缩,以获得3.3g(39%)黄色固体形式的化合物2C。化合物2D:(S)-2-氨基-N-((3R,4S,5S)-1-((S)-2-((1R,2R)-3-(((1S,2R)-1-羟基-1-苯基丙烷-2-基)氨基)-1-甲氧基-2-甲基-3-氧代丙基)吡咯烷-1-基)-3-甲氧基-5-甲基-1-氧代庚烷-4-基)-N,3-二甲基丁酰胺在惰性气氛中,将化合物2C(300mg,0.36mmol,1.00eq.)溶解于ACN(2mL)和哌啶(0.5mL)中。在环境温度将溶液搅拌下放置过夜,然后减压蒸发至干。将残余物在硅胶柱上用DCM和MeOH的混合物(1:100)纯化,以获得150mg(68%)白色固体形式的化合物2D。化合物2E:2-((叔丁氧基羰基)氨基)异烟酸甲酯将2-氨基吡啶-4-羧酸甲酯(2g,13.14mmol,1.00equiv)溶解于叔丁醇(20mL)中,然后加入二碳酸二叔丁酯(4.02g,18.42mmol,1.40equiv)。在60℃将反应混合物搅拌过夜,然后通过加入1MNaHCO3水溶液(50mL)使反应终止。通过过滤回收固体,用50mLEtOH洗涤,然后经真空干燥,以获得2.5g(75%)白色固体形式的化合物2E。化合物2F:(4-(羟甲基)吡啶-2-基)氨基甲酸叔丁酯将化合物2E(2.5g,9.91mmol,1.00equiv)和CaCl2(1.65g)溶解于EtOH(30mL)中。将溶液冷却至0℃,然后逐渐加入NaBH4(1.13g,29.87mmol,3.01equiv)。在环境温度将溶液在搅拌下放置过夜,然后加入水(50mL)使反应终止。用20mLEtOAc萃取混合物三次。将有机相合并,用20mLNaCl(sat.)洗涤两次,然后经硫酸钠干燥,过滤和减压浓缩,以获得2.0g(90%)无色固体形式的化合物2F。化合物2G:(4-甲酰基吡啶-2-基)氨基甲酸叔丁酯将化合物2F(2.5g,11.15mmol,1.00equiv)溶解于DCE(25mL)中,然后加入19.4gMnO2(223.14mmol,20.02equiv)。在70℃将混合物在搅拌下放置过夜,然后通过过滤去除固体。将滤液蒸发至干,以获得1.4g(57%)白色固体形式的化合物2G。化合物2H:(S)-2-(((2-((叔丁氧基羰基)氨基)吡啶-4-基)甲基)(甲基)氨基)-3-甲基丁酸苄酯在化合物1ZC(2.93g,11.37mmol,1.10equiv)、DIEA(5.39g,41.71mmol,4.03equiv)和NaBH(OAc)3(4.39g,20.71mmol,2.00equiv)的存在下,将化合物2G(2.3g,10.35mmol,1.00equiv)溶解于25mLTHF中。在环境温度将反应混合物搅拌6小时,然后用60mLNaHCO3(sat.)中和,并用20mLAcOEt萃取3次。将有机相合并,用20mLNaCl(sat.)洗涤两次,经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:15)纯化,以获得2.7g(61%)白色固体形式的化合物2H。化合物2I:(S)-2-(((2-((叔丁氧基羰基)氨基)吡啶-4-基)甲基)(甲基)氨基)-3-甲基丁酸在Pd/C(250mg)的存在下,将化合物2H(500mg,1.17mmol,1.00equiv)溶解于10mLAcOEt和2mL甲醇中,在环境温度和大气压力下氢化3小时。将反应介质过滤,并减压浓缩,以获得254mg(64%)无色固体形式的化合物2I。化合物2J:(4-((3S,6S,9S,10R)-9-((S)-仲丁基)-10-(2-((S)-2-((1R,2R)-3-(((1S,2R)-1-羟基-1-苯基丙烷-2-基)氨基)-1-甲氧基-2-甲基-3-氧代丙基)吡咯烷-1-基)-2-氧代乙基)-3,6-二异丙基-2,8-二甲基-4,7-二氧代-11-氧杂-2,5,8-三氮杂十二烷基)吡啶-2-基)氨基甲酸叔丁酯以相似于化合物1ZG的方式,在DMF(3mL)中,由胺2D(85.2mg,0.14mmol,1.50equiv)、酸2I(31.7mg,0.09mmol,1.00equiv)、HATU(42.9mg,0.11mmol,1.20equiv)和DIEA(36.7mg,0.28mmol,3.02equiv)制备化合物2J。蒸发至干之后,获得100mg白色固体形式的粗产物。将化合物2J(100mg,0.11mmol,1.00equiv)溶解于2mLDCM和1mLTFA中。在环境温度将反应搅拌1小时,然后减压浓缩。将残余物(80mg)通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相;0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;Waters2489紫外检测器在254nm和220nm处)纯化。获得白色固体形式的化合物2,产率6%(6.3mg)。LC/MS/UV(AscentisExpressC18柱,2.7μm,4.6×100mm;40℃;1.8mL/min,经6分钟从10%至95%ACN在水中(0.05%TFA));ESI(C45H73N7O7,精确质量823.56)m/z:824.5(MH+)和412.9(M.2H+/2,100%),3.21min(99.2%,210nm)。1HNMR(400MHz,CD3OD,ppm):δ(存在旋转异构体)7.81-7.79(m,1H);7.39-7.29(m,5H);6.61-6.59(m,2H);4.84-4.52(m,1H);4.32-4.02(m,1H);3.90-2.98(m,10H);2.90-2.78(m,1H);2.55-0.81(m,39H)。参考化合物3((S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-N,3-二甲基-2-((S)-3-甲基-2-(甲基(吡啶-4-基甲基)氨基)丁酰胺基)丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯三氟乙酸盐化合物3A:(S)-2-((1R,2R)-1-甲氧基-3-(((S)-1-甲氧基-1-氧代-3-苯基丙烷-2-基)氨基)-2-甲基-3-氧代丙基)吡咯烷-1-羧酸叔丁酯在惰性气氛中,将化合物1D(3g,10.44mmol,1.00equiv)和(S)-2-氨基-3-苯基丙酸甲酯(2.25g,12.55mmol,1.20equiv)溶解于DMF(40mL)中。将溶液冷却至0℃,然后滴加入DEPC(1.67mL,1.05equiv)和TEA(3.64mL,2.50equiv)。在0℃搅拌反应混合物2小时,然后在环境温度搅拌过夜。用100mL水稀释反应混合物,然后用50mLEtOAc萃取三次。将有机相合并,用100mLKHSO4(1mol/L)洗涤一次,用100mLNaHCO3(sat.)洗涤一次,用100mLNaCl(sat.)洗涤一次,然后经硫酸钠干燥,过滤和减压浓缩,以获得4g(85%)无色油形式的化合物3A。化合物3B:(S)-2-((2R,3R)-3-甲氧基-2-甲基-3-((S)-吡咯烷-2-基)丙酰胺基)-3-苯基丙酸甲酯的2,2,2-三氟乙酸盐在惰性气氛中,将化合物3A(5g,11.15mmol,1.00equiv)溶解于DCM(40mL)中。加入TFA(25mL),并将溶液搅拌2小时。将反应混合物减压浓缩,以获得8g黄色油形式的化合物3B。化合物3C:(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((((9H-芴-9-基)甲氧基)羰基)氨基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯在惰性气氛中,将化合物3B(8.03g,17.36mmol,1.00equiv)和1W(9.1g,17.34mmol,1.00equiv)溶解于DCM(80mL)中。将溶液冷却至0℃,然后滴加入DEPC(2.8mL)和DIEA(12mL)。在0℃将反应混合物搅拌2小时,然后在环境温度搅拌过夜。用200mL水稀释反应混合物,并用50mLDCM萃取三次。将有机相合并,用50mLKHSO4(1mol/L)洗涤一次,用50mLNaHCO3(sat.)洗涤一次,用50mLNaCl(sat.)洗涤一次,然后经硫酸钠干燥,过滤和减压浓缩,以获得5g(34%)黄色固体形式的化合物3C。化合物3D:(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-氨基-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯在惰性气氛中,将化合物3C(5.5g,6.43mmol,1.00equiv)溶解于四丁基氟化铵(TBAF,2.61g,9.98mmol,1.55equiv)的DMF(100mL)溶液中。在环境温度将溶液搅拌2小时,然后用100mL水稀释,并用50mLEtOAc萃取三次。将有机相合并,然后经硫酸钠干燥,过滤和减压浓缩,以获得3.3g(81%)黄色固体形式的化合物3D。化合物3E:(S)-3-甲基-2-(甲基(吡啶-4-基甲基)氨基)丁酸苄酯在化合物1ZC(2.9g,11.25mmol,1.21equiv)和异丙醇钛(IV)(4.19mL,1.40equiv)的存在下,将吡啶-4-甲醛(1g,9.34mmol,1.00equiv)溶解于10mL1,2-二氯乙烷(DCE)中。在环境温度将混合物搅拌30分钟,然后加入2.77gNaBH(OAc)3(13.07mmol,1.40equiv)。将反应介质在搅拌下放置过夜,然后用100mL水中和,并用50mLAcOEt将混合物萃取3次。将有机相合并,并蒸发至干。将残余物在硅胶柱上用EtOAc和PE的混合物(1:20)纯化,以获得1.3g(45%)无色油形式的化合物3E。化合物3F:(S)-3-甲基-2-(甲基(吡啶-4-基甲基)氨基)丁酸在Pd/C(300mg)的存在下,将化合物3E(800mg,2.56mmol,1.00equiv)溶解于30mLAcOEt中,并在环境温度和大气压力下氢化3小时。将反应介质过滤,并减压浓缩。将残余物在硅胶柱上用DCM和MeOH的混合物(100:1至5:1)纯化,以获得100mg(18%)白色固体形式的化合物3F。将化合物3D(50mg,0.08mmol,1.00equiv)和3F(26.34mg,0.12mmol,1.50equiv)溶解于3mLDCM中。将溶液冷却至0℃,然后加入0.018mLDEPC和0.0392mLDIEA。在0℃将反应搅拌2小时,然后在环境温度搅拌过夜。将反应介质减压浓缩,并将残余物(70mg)通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;Waters2545紫外检测器在254nm和220nm处)纯化。获得白色固体形式的化合物3,产率27%(20mg)。LC/MS/UV(AscentisExpressC18柱,2.7μm,4.6×100mm;40℃;1.5mL/min,经8分钟10%至95%ACN在水中(0.05%TFA));ESI(C46H72N6O8,精确质量836.5)m/z:837.5(MH+)和419.4(M.2H+/2(100%)),7.04min(90.0%,210nm)。1HNMR(400MHz,CD3OD,ppm):δ(存在旋转异构体)8.76-8.74(m,2H);8.53-8.48(m,0.4H,NHCO不完全的交换);8.29-8.15(m,0.8H,NHCO不完全的交换);8.01(s,2H),7.31-7.22(m,5H),4.88-4.68(m,3H);4.31-4.07(m,2H);3.94-2.90(m,18H);2.55-0.86(m,38H)。参考化合物4(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-N,3-二甲基-2-((S)-3-甲基-2-(甲基(吡啶-4-基甲基)氨基)丁酰胺基)丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸三氟乙酸盐将化合物3(100mg,0.11mmol,1.00equiv)溶解于水(5mL)、ACN(5mL)和哌啶(2.5mL)的混合物中。将反应混合物在搅拌下放置过夜,然后减压浓缩。将残余物通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;Waters2545紫外检测器在254nm和220nm处)纯化,以获得20mg(20%)白色固体形式的化合物4。LC/MS/UV(AscentisExpressC18柱,2.7μm,4.6×100mm;40℃;1.5mL/min,经8分钟10%至95%ACN在水中(0.05%TFA));ESI(C45H70N6O8,精确质量822.5)m/z:823.5(MH+)和412.4(M.2H+/2,100%),6.84min(89.1%,210nm)。1HNMR(400MHz,CD3OD,ppm):δ(存在旋转异构体)8.79-8.78(m,2H);8.09(m,2H);7.30-7.21(m,5H);4.80-4.80(m,1H),4.36-0.87(m,58H)。参考化合物6(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((3-氨基丙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯双三氟乙酸盐化合物6A:(2S)-2-[(2R)-2-[(R)-[(2S)-1-[(3R,4S,5S)-4-[(2S)-2-[(2S)-2-[(3-[[(叔丁氧基)羰基]氨基]丙基)(甲基)氨基]-3-甲基丁酰胺基]-N,3-二甲基丁酰胺基]-3-甲氧基-5-甲基庚酰基]吡咯烷-2-基](甲氧基)甲基]丙酰胺基]-3-苯基丙酸甲酯在0℃,在惰性气氛中,在羧酸1ZF(78.7mg,0.27mmol,1.10equiv)、DEPC(46μl)和DIEA(124μl)的存在下,将化合物3D(157.5mg,0.25mmol,1.00equiv)溶解于3mLDCM中。在低温将反应混合物搅拌2小时,然后移走冷浴,并继续搅拌4小时。然后减压浓缩,以获得200mg粗黄色油形式的化合物6A。其就这样用于以下步骤。在惰性气氛中,在0℃将化合物6A(200mg,0.22mmol,1.00equiv)溶解于2mLDCM中。滴加入TFA(1mL),移走冷浴。在环境温度将反应混合物搅拌1小时,然后减压浓缩。将残余物通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;Waters2489紫外检测器在254nm和220nm处)纯化,以获得60mg(26%,2个步骤的产率)白色固体形式的化合物6。LC/MS/UV(ZorbaxEclipsePlusC8,3.5μm,4.6×150mm;1mL/min,40℃,经18分钟30至80%甲醇在水中(0.1%H3PO4));ESI(C43H74N6O8,精确质量802.56)m/z:804(MH+);11.50min(91.5%,210nm)。1HNMR(300MHz,CD3OD,ppm):δ(存在旋转异构体)8.52(d,0.3H,NHCO不完全的交换);8.25(d,0.5H,NHCO不完全的交换);7.30–7.22(m,5H);4.9–4.6(m,3H);4.2–4.0(m,1H);4.0–0.86(m,61H)。参考化合物7(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((3-氨基丙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸双三氟乙酸盐将化合物6(70mg,0.08mmol,1.00equiv)溶解于水(5mL)、ACN(2.5mL)和哌啶(5mL)的混合物中。在环境温度将反应混合物在搅拌下放置过夜,然后减压浓缩。将残余物通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;UVWaters2489紫外检测器在254nm和220nm处)纯化,以获得14.6mg(21%)白色固体形式的化合物7。LC/MS/UV(AscentisExpressC18,2.7μm,4.6×100mm;1.5mL/min,40℃,经8分钟0至80%甲醇在水中(0.05%TFA));ESI(C42H72N6O8,精确质量788.54)m/z:790(MH+),5.71min(96.83%,210nm)。1HNMR(300MHz,CD3OD,ppm):δ(存在旋转异构体)8.42(d,0.3H,NHCO不完全的交换);8.15(d,0.2H,NHCO不完全的交换);7.31–7.21(m,5H);4.9–4.6(m,3H);4.25–4.0(m,1H);4.0–0.86(m,59H)。化合物11(S)-N-((3R,4S,5S)-3-甲氧基-1-((S)-2-((1R,2R)-1-甲氧基-2-甲基-3-氧代-3-(((S)-2-苯基-1-(噻唑-2-基)乙基)氨基)丙基)吡咯烷-1-基)-5-甲基-1-氧代庚烷-4-基)-N,3-二甲基-2-((S)-3-甲基-2-(甲基(4-(甲基氨基)苯乙基)氨基)丁酰胺基)丁酰胺三氟乙酸盐化合物11A:N-[4-(2-羟乙基)苯基]氨基甲酸叔丁酯将二碳酸二叔丁酯(16.7g,77mmol,1.05eq.)加入至2-(4-氨基苯基)乙醇(10g,72.9mmol,1eq.)的THF(200mL)溶液中,并将反应在环境温度搅拌过夜。将混合物用EtOAc(200mL)稀释,用水(200mL)洗涤,然后用1MHCl(100mL)洗涤,然后用饱和NaHCO3水溶液(100mL)洗涤,然后用盐水(100mL)洗涤。将有机相用MgSO4干燥,然后减压蒸发至干。将粗产物用庚烷(150mL)研磨两次,并在真空中干燥,以得到为白色固体的化合物11A(14.7g,84%)。化合物11B:N-[4-(2-氧代乙基)苯基]氨基甲酸叔丁酯将化合物11A(2.5g,10.5mmol,1.00equiv)溶解于25mLDCM中,然后冷却至-78℃。滴加入DCM(10mL)中的戴斯-马丁高碘烷溶液(DMP,6.71g,15.8mmol,1.5equiv)。移走冷浴,在环境温度继续搅拌1小时。用60mL碳酸氢钠饱和水溶液和Na2S2O3饱和水溶液的50/50混合物中和反应。用30mLEtOAc萃取所得溶液3次。将有机相合并,用NaCl饱和水溶液洗涤两次,经无水硫酸钠干燥,过滤和减压浓缩。残余物经硅胶纯化(EtOAc/PE1/15),以获得1.0g(40%)淡黄色固体形式的化合物11B。化合物11C:(2S)-2-[[2-(4-[[(叔丁氧基)羰基]氨基]苯基)乙基](甲基)氨基]-3-甲基丁酸苄酯在DIEA(6.4g,49.7mmol,4.0equiv)、醛11B(2.9g,12.3mmol,1.0equiv)和三乙酰氧基硼氢化钠(5.23g,49.7mmol,2.0equiv)的存在下,将化合物1ZC(3.5g,13.6mmol,1.1equiv)溶解于THF(30mL)中。在环境温度将反应混合物在搅拌下放置过夜,然后用60mL碳酸氢钠饱和溶液中和。用30mLEtOAc将所得的溶液萃取3次。将有机相合并,用NaCl饱和水溶液洗涤两次,经无水硫酸钠干燥,过滤和减压浓缩。残余物经硅胶纯化(EtOAc/PE1:20),以获得3.7g(68%)黄色油形式的化合物11C。化合物11D:(2S)-2-[[2-(4-[[(叔丁氧基)羰基]氨基]苯基)乙基](甲基)氨基]-3-甲基丁酸在Pd/C(2g)的存在下,将化合物11C(2g,4.5mmol,1equiv)溶解于10mL甲醇中,并在标准温度和压力下氢化2小时。将反应介质过滤,并减压浓缩,以获得1.2g(75%)黄色油形式的化合物11D。化合物11E:(2S)-2-[[2-(4-[[(叔丁氧基)羰基](甲基)氨基]苯基)乙基](甲基)氨基]-3-甲基丁酸在惰性气氛中,将化合物11D(1.2g,3.4mmol,1.00equiv)溶解于THF(20mL)中。用冰浴冷却反应介质,然后分批加入NaH(在油中的60%,549mg,13.7mmol,4.0equiv),接着加入碘甲烷(4.9g,34mmol,10equiv)。在环境温度将反应在搅拌下放置过夜,然后用水中和,并用100mLEtOAc洗涤。用1NHCl调节水溶液的pH至6-7。用100mLEtOAc将该水溶液萃取3次。将有机相合并,经硫酸钠干燥,过滤和浓缩,以获得800mg(64%)黄色固体形式的化合物11E。化合物11F:N-[4-(2-[[(1S)-1-[[(1S)-1-[[(3R,4S,5S)-3-甲氧基-1-[(2S)-2-[(1R,2R)-1-甲氧基-2-甲基-2-[[(1S)-2-苯基-1-(1,3-噻唑-2-基)乙基]氨基甲酰基]乙基]吡咯烷-1-基]-5-甲基-1-氧代庚烷-4基](甲基)氨基甲酰基]-2-甲基丙基]氨基甲酰基]-2-甲基丙基](甲基)氨基]乙基)苯基]-N-甲基氨基甲酸叔丁酯以相似于化合物6A的方式,由胺1Y(150mg,0.22mmol,1.2equiv)和酸11E(70mg,0.19mmol,1.0equiv)制备化合物11F。经硅胶(EtOAc/PE1:1)纯化之后,获得100mg(52%)淡黄色固体形式的期望的产物。以相同于化合物1的方式,由中间体11F(100mg,0.1mmol)制备化合物11。将残余物通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;Waters2489紫外检测器在254nm和220nm处)纯化。获得白色固体形式的化合物11,产率39%(39.7mg)。LC/MS/UV(EclipsePlusC8,3.5μm,4.6×150mm;1mL/min,40℃,经18分钟50至95%甲醇在水中(0.05%TFA));ESI(C50H77N7O6S,精确质量903.57)m/z:904.5(MH+),7.53min(93.68%,254nm)。1HNMR(300MHz,CD3OD,ppm):δ(存在旋转异构体)8.84(d,0.5H,NHCO不完全的交换);8.7–8.5(m,0.9H,NHCO不完全的交换);7.76–7.73(m,1H);7.55-7.4(m,1H);7.28–7.22(m,7H);7.08–7.05(m,2H);5.51–5.72(m,1H);4.9–4.80(m,2H);4.3–0.7(m,60H)。化合物12(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-N,3-二甲基-2-((S)-3-甲基-2-(甲基(4-(甲基氨基)苯乙基)氨基)丁酰胺基)丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯三氟乙酸盐以合成化合物1最后阶段的相同方式,由胺3D(118mg,0.19mmol)和酸11E(82mg,0.22mmol)经两步骤制备化合物12。将最终残余物通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;Waters2489紫外检测器在254nm和220nm处)纯化。获得白色固体形式的化合物12,产率7%(13.7mg)。LC/MS/UV(EclipsePlusC8,3.5μm,4.6×150mm;1mL/min,40℃,经18分钟40至95%甲醇在水中(0.05%TFA));ESI(C49H78N6O8,精确质量878.59)m/z:879.7(MH+),10.07min(90.6%,254nm)。1H:NMR(300MHz,CD3OD,ppm):δ(存在旋转异构体)7.40(se,2H);7.38–7.22(m,7H);4.95–4.7(m,3H);4.2–4.0(m,1H);3.9–0.86(m,62H)。化合物13(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-N,3-二甲基-2-((S)-3-甲基-2-(甲基(4-(甲基氨基)苯乙基)氨基)丁酰胺基)丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸三氟乙酸盐以相同于化合物7的方式,由化合物12(100mg,0.10mmol)制备化合物13。将残余物通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;Waters2489紫外检测器在254nm和220nm处)纯化。获得白色固体形式的化合物13,产率20%(20mg)。LC/MS/UV(AscentisExpressC18,2.7μm,4.6×100mm;1.5mL/min,40℃,经8分钟10至95%甲醇在水中(0.05%TFA));ESI(C48H76N6O8,精确质量864.57)m/z:865.6(MH+),6.05min(90.9%,210nm)。1HNMR:(300MHz,CD3OD,ppm):δ(存在旋转异构体)7.32–7.19(m,9H);4.9–4.65(m,3H);4.2–4.0(m,1H);3.9–0.86(m,59H)。化合物14(S)-2-((S)-2-((3-氨基苄基)(甲基)氨基)-3-甲基丁酰胺基)-N-((3R,4S,5S)-3-甲氧基-1-((S)-2-((1R,2R)-1-甲氧基-2-甲基-3-氧代-3-(((S)-2-苯基-1-(噻唑-2-基)乙基)氨基)丙基)吡咯烷-1-基)-5-甲基-1-氧代庚烷-4-基)-N,3-二甲基丁酰胺三氟乙酸盐化合物14A:(3-(羟甲基)苯基)氨基甲酸叔丁酯将(3-氨基苯基)甲醇(3g,24.36mmol,1.00equiv)溶解于THF(60mL)中,然后加入二碳酸二叔丁酯(6.38g,29.23mmol,1.20equiv)。在环境温度将反应混合物在搅拌下放置过夜,然后加入200mL水稀释反应。用100mLAcOEt将产物萃取3次,然后将有机相重新合并,经硫酸钠干燥,过滤和减压浓缩,以获得黄色油形式的粗产物(13.85g化合物14A)。化合物14B:(3-甲酰基苯基)氨基甲酸叔丁酯将化合物14A(13.8g,61.81mmol,1.00equiv)溶解于DCE(400mL)中,然后加入MnO2(54g,621.14mmol,10.05equiv)。在环境温度将混合物在搅拌下放置3天,然后通过过滤去除固体。将滤液蒸发至干,将残余物在硅胶柱上用EtOAc和PE的混合物(1:30)纯化,以获得3g(22%)白色固体形式的化合物14B。化合物14C:(S)-2-((3-((叔丁氧基羰基)氨基)苄基)(甲基)氨基)-3-甲基丁酸苄酯在化合物1ZC(1.16g,4.50mmol,1.00equiv)、DIEA(3mL)和NaBH(OAc)3(1.92g,9.06mmol,2.01equiv)的存在下,将化合物14B(1g,4.52mmol,1.00equiv)溶解于20mLTHF中。在环境温度将反应混合物在搅拌下放置过夜,然后用100mL水中和,并用50mLAcOEt萃取3次。将有机相合并,经硫酸钠干燥,过滤和浓缩。将残余物在硅胶柱上用EtOAc和PE的混合物(1:50)纯化,以获得1.9g(99%)白色固体形式的化合物14C。化合物14D:(S)-2-((3-((叔丁氧基羰基)氨基)苄基)(甲基)氨基)-3-甲基丁酸在Pd/C(400mg)的存在下,将化合物14C(1g,2.34mmol,1.00equiv)溶解于30mLAcOEt和4mL甲醇中,在环境温度和大气压力下氢化1小时。将反应介质过滤,并减压浓缩,以获得680mg(86%)白色固体形式的化合物14D。化合物14E:(3-((3S,6S,9S,10R)-9-((S)-仲丁基)-3,6-二异丙基-10-(2-((S)-2-((1R,2R)-1-甲氧基-2-甲基-3-氧代-3-(((S)-2-苯基-1-(噻唑-2-基)乙基)氨基)丙基)吡咯烷-1-基)-2-氧代乙基)-2,8-二甲基-4,7-二氧代-11-氧杂-2,5,8-三氮杂十二烷基)苯基)氨基甲酸叔丁酯以相同于化合物3的方式,在DCM(3mL)中,由胺1Y(100mg,0.15mmol,1.00equiv)、酸14D(102.27mg,0.30mmol,2.00equiv)、DEPC(0.053mL)和DIEA(0.046mL)合成化合物14E。将粗产物(80mg)在硅胶柱上用EtOAc和PE的混合物(1:1)纯化,以获得100mg(67%)淡黄色固体形式的化合物14E。以相同于化合物2的方式,由中间体14E(100mg,0.10mmol,1.00equiv)制备化合物14。将粗产物(80mg)通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;Waters2545紫外检测器在254nm和220nm处)纯化。获得白色固体形式的化合物14,产率10%(10mg)。LC/MS/UV(EclipseplusC8柱,3.5μm,4.6×150mm;40℃;1.0mL/min,经18分钟40%至95%MeOH在水中(0.05%TFA));ESI(C48H73N7O6S,精确质量875.5)m/z:876.5(MH+)和438.9(M.2H+/2,100%),11.35min(95.6%,210nm)。1HNMR(400MHz,CD3OD,ppm):δ(存在旋转异构体)8.92-8.86(m,0.4H,NH不完全的交换);8.70-8.54(m,0.6H,NH不完全的交换);7.88-7.78(m,1H);7.60-7.50(m,1H);7.45-6.97(m,9H);5.80-5.65(m,1H);4.85-4.70(m,1H);4.40-0.80(m,56H)。化合物15(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((3-氨基苄基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯三氟乙酸盐化合物15A:(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((3-((叔丁氧羰基)氨基)苄基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸甲酯以相同于化合物3的方式,在DCM(5mL)中,由胺3D(200mg,0.32mmol,1.00equiv)、酸14D(212.6mg,0.63mmol,2.00equiv)、DEPC(0.1103mL)和DIEA(0.157mL,3.00equiv)合成化合物15A。将粗产物在硅胶柱上用EtOAc和PE的混合物(1:1)纯化,以获得200mg(67%)黄色固体形式的化合物15A。化合物15:以相同于化合物2的方式,由中间体15A(200mg,0.21mmol,1.00equiv)合成化合物15。将粗产物通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;Waters2545紫外检测器在254nm和220nm处)纯化。获得白色固体形式的化合物15,产率19%(38.6mg)。LC/MS/UV(AscentisExpressC18柱,2.7μm,4.6×100mm;40℃;1.5mL/min,经8分钟10%至95%MeOH在水中(0.05%TFA));ESI(C47H74N6O8,精确质量850.5)m/z:851.5(MH+)和426.4(M.2H+/2,100%),6.61min(91.1%,210nm)。1HNMR(400MHz,CD3OD,ppm):δ(存在旋转异构体)7.53-7.42(m,1H);7.35-7.18(m,8H);4.88-4.79(m,2H);4.42-4.00(m,3H);3.93-2.71(m,22H);2.61-0.81(m,33H)。化合物20(S)-2-((S)-2-((4-氨基苄基)(甲基)氨基)-3-甲基丁酰胺基)-N-((3R,4S,5S)-3-甲氧基-1-((S)-2-((1R,2R)-1-甲氧基-2-甲氧-3-氧代-3-(((S)-2-苯基-1-(噻唑-2-基)乙基)氨基)丙基)吡咯烷-1-基)-5-甲基-1-氧代庚烷-4-基)-N,3-二甲基丁酰胺三氟乙酸盐以相同于化合物1的方式,由胺1ZC和相应的醛制备化合物20。在化合物20的制备中涉及的4-硝基苯甲醛是市售的。通过还原硝基完成化合物20的合成。该合成如下进行:将(2S)-N-[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-2-[[(1S,2R)-1-羟基-1-苯基丙烷-2-基]氨基甲酰基]-1-甲氧基-2-甲基乙基]吡咯烷-1-基]-3-甲氧基-5-甲基-1-氧代庚烷-4-基]-N,3-二甲基-2-[(2S)-3-甲基-2-[甲基[(4–硝基苯基)甲基]氨基]丁酰胺基]丁酰胺(40mg,0.05mmol,1.0equiv)溶解于15mL乙醇中。加入二水合的氯化锡(II)(317mg,1.4mmol,30equiv),在环境温度将溶液在搅拌下放置3天。将反应用50mL水中和,然后用50mLEtOAc萃取三次。将有机相合并,经无水硫酸钠干燥,过滤和减压浓缩,以获得粗品状态的化合物20(纯度:93.2%;量:21.6mg)。将化合物通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;Waters2489紫外检测器在254nm和220nm处)纯化,以获得白色固体形式的对应的TFA盐。1HNMR:(400MHz,CD3OD,ppm):δ(存在旋转异构体)7.85–7.80(m,1H);7.6–7.5(m,1H);7.4–7.15(m,5H);7.1–7.05(m,2H);6.73–6.70(m,2H);5.8–5.55(m,1H);5.0–4.7(m,2H);4.25–4.05(m,1H);4.0–0.8(m,54H)。LC/MS/UVESI:(C48H73N7O7S,精确质量875.53)m/z876(MH+),439[75%,(M.2H+)/2];UV:RT=4.83min(96.8%,254nm)。1HNMR(400MHz,CD3OD,ppm):δ(存在旋转异构体)7.85–7.80(m,1H);7.6–7.5(m,1H);7.4–7.1(m,7H);6.76–6.72(m,2H);5.8–5.55(m,1H);4.9–4.65(m,2H);4.25–4.05(m,1H);4.0–0.8(m,54H)。化合物29(S)-2-((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((3-氨基苄基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰胺基)-3-苯基丙酸三氟乙酸盐将化合物15(100mg,0.10mmol,1.00equiv)溶解于水(5mL)、ACN(5mL)和哌啶(2.5mL)的混合物中。在环境温度将反应混合物在搅拌下放置过夜,然后减压浓缩。将残余物通过制备型HPLC(Pre–HPLC–001SHIMADZU,SunFirePrepC18OBD柱,5μm,19×150mm;洗脱相:0.05%TFA缓冲的水/ACN;梯度经10分钟20%至40%ACN,然后经2分钟40%至100%ACN;Waters2545紫外检测器在254nm和220nm处)纯化,以获得20mg(20%)白色固体形式的化合物29。LC/MS/UV(EclipsePlusC8柱,3.5μm,4.6×150mm;40℃;1.0mL/min,经18分钟40%至95%MeOH在水中(0.05%TFA));ESI(C46H72N6O8,精确质量836.54)m/z:837.5(MH+)和419.4(M.2H+/2,100%),10.61min(92.5%,210nm)。1HNMR:(400MHz,CD3OD,ppm):δ(存在旋转异构体)7.38-7.15(m,6H);7.00-6.99(m,3H);4.85-4.68(m,2H);4.37-3.38(m,11H);3.31-2.70(m,8H);2.60-0.82(m,35H)。化合物61(S)-2-((S)-2-((4-氨基苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N-((3R,4S,5S)-3-甲氧基-1-((S)-2-((1R,2R)-1-甲氧基-2-甲基-3-氧代-3-(((S)-2-苯基-1-(噻唑-2-基)乙基)氨基)丙基)吡咯烷-1-基)-5-甲基-1-氧代庚烷-4-基)-N,3-二甲基丁酰胺化合物61A:N-(4-氨基苯乙基)-N-甲基-L-缬氨酸二盐酸盐将化合物11D(962mg,2.75mmol)溶解于10mL市售可得的HCl在丙-2-醇中的溶液(5-6M)中,并在室温搅拌2小时。TLC分析表明起始原料被消耗完全。将溶剂减压蒸发,并用Et2O(2×10ml)研磨所得的黄色固体。将产物真空干燥,以得到为黄色固体的化合物61A(322mg,47%)。化合物61:将羧酸61A(73mg,0.23mmol,1eq.)和胺1Y(150mg,0.23mmol,1eq.)溶解于干燥DMF(2ml)中。加入DIEA(158μl,0.90mmol,4eq.)和DECP(51μl,0.34mmol,1.5eq.),并在室温将反应搅拌4小时。LC-MS分析表明起始原料被消耗完全。将溶剂减压蒸发,并将残余物在硅胶上通过闪式色谱法(DCM/MeOH)纯化,以得到为淡黄色固体的化合物61(83mg,40%)。1HNMR:(500MHz,DMSO-d6,ppm):δ(存在旋转异构体),8.86(d,0.5H,NHCO);8.65(d,0.5H,NHCO),8.11-8.05(m,1H,NHCO),7.80(d,0.5H,噻唑),7.78(d,0.5H,噻唑),7.65(d,0.5H,噻唑),7.63(d,0.5H,噻唑),7.32–7.12(m,5H),6.83(d,J=8.3Hz,2H),6.45(d,J=8.3Hz,2H),5.56–5.49(m,0.5H),5.42–5.35(m,0.5H),4.78(s,2H,NH2),4.74–4.46(m,2H),4.01–0.66(m,57H)。HPLC(XbridgeShieldC18,3.5μm,4.6×50mm;3.5ml/min,40℃,经2.25分钟0至95%MeCN在水中(0.1%TFA),然后95%MeCN持续0.5分钟,Tr=1.31min(96.5%,220nm)。m/z(Q-TOFESI+)890.5558(2%,MH+,C49H76N7O6S要求890.5572),445.7834(100%,(MH2)2+,C49H77N7O6S要求445.7823)。化合物62((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-氨基苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯基丙氨酸甲酯以相同于化合物61的方式,使用羧酸61A(69mg,0.21mmol,1eq.)、胺3D(135mg,0.21mmol,1eq.)、DIEA(75μl,0.43mmol,2eq.)和DECP(49μl,0.32mmol,1.5eq.)制备化合物62。将粗产物在硅胶上通过闪式色谱法(DCM/MeOH)纯化,以得到为黄色固体的化合物62(82mg,45%)。1HNMR:(500MHz,DMSO-d6,ppm):δ(存在旋转异构体),8.50(d,J=8.3,0.5H,NHCO);8.27(d,J=8.0,0.5H,NHCO),8.15-8.04(m,1H,NHCO),7.27–7.13(m,5H),6.86–6.79(m,2H),6.48–6.42(m,2H),4.78(s,2H,NH2),4.74–4.44(m,3H),4.01–3.72(m,1.5H),3.66(s,1.5H,CO2Me),3.63(s,1.5H,CO2Me),3.57-0.65(m,55.5H)。HPLC(XbridgeShieldC18,3.5μm,4.6×50mm;3.5ml/min,40℃,经2.25分钟0至95%MeCN在水中(0.1%TFA),然后95%MeCN持续0.5分钟,Tr=1.29min(95.3%,220nm)。m/z(Q-TOFESI+)865.5800(2%,MH+,C48H77N6O8要求865.5797),433.2937(100%,(MH2)2+,C48H78N6O8要求433.2935)。化合物63((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-氨基苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯基丙氨酸2,2,2-三氟乙酸盐将化合物62(23mg,0.03mmol)溶解于水(1ml)和乙腈(1ml)的混合物中。加入哌啶(0.75ml),并在室温将混合物搅拌5小时。TLC分析表明起始原料被完全消耗。将溶剂减压蒸发,并将残余物通过制备型HPLC(SunFirePrep柱C18OBD,5μm,19×150mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经10分钟20%至40%MeCN,然后经2分钟40%至100%MeCN;紫外检测器Waters2545在254nm和220nm处)纯化。获得为白色固体的化合物63(14mg,66%)。1HNMR:(500MHz,DMSO-d6,ppm):δ(存在旋转异构体),12.7(s(br),1H,CO2H),9.58(m(br),1H);9.04–8.89(m,1H),8.41(d,0.6H,NHCO),8.15(d,0.4H,NHCO),7.27–7.13(m,5H),7.13–6.99(m(br),2H),6.90–6.64(s(br),2H),4.77–3.40(m,10H),3.34–2.75(m,20H),2.34–1.94(m,4H),1.90–0.7(m,25H)。HPLC(XbridgeShieldC18,3.5μm,4.6×50mm;3.5ml/min,40℃,经2.25分钟0至95%MeCN在水中(0.1%TFA),然后95%MeCN持续0.5分钟,Tr=1.24min(100%,220nm)。m/z(Q-TOFESI+)851.5641(6%,MH+,C47H75N6O8要求851.5641),426.2854(100%,(MH2)2+,C47H76N6O8要求426.2857)。实施例15:药物的抗增殖活性方法:细胞培养。将A549(非小细胞肺癌-ATCCCCL-185)和MDA-MB-231(乳腺癌–ATCCHTB-26)细胞分别培养于含有5%胎牛血清(FCS)的最低必需介质Eagle(MEM)和含有10%FCS的Dulbecco改良的Eagle介质(DMEM)中。将MCF7(乳腺导管癌–ATCCHTB-22)和SN-12C(肾癌–ATCC)细胞维持在含有10%FCS的RPMI1640介质中(对于MCF7细胞没有酚红)。所有的介质均补充有两性霉素(1.25μg/mL)和青霉素-链霉素(100U/100μg/mL)。在标准条件下在孵育器中在37℃、5%CO2和95%大气湿度下培养细胞。在4种肿瘤细胞系中的抗增殖活性。使用ATPlite增殖试验(PerkinElmer,VillebonsurYvette,法国)在4种细胞系的综合板上考察所选择的药物的抗增殖活性。在第0天将细胞接种于96孔板上(对于A549为103细胞/孔,对于MCF7、MDA-MB-231和SN12C为2.103),其浓度能够保证细胞在72h药物处理期处于对数细胞生长期。在24h孵育期之后,将所有细胞用系列稀释的受试化合物处理(11μL10X在1%DMSO中的溶液-6孔/条件)。为了避免细胞粘附到枪头(tip)上,在两个连续稀释之间更换枪头。然后,将细胞放置在37℃、5%CO2孵育器中。在第4天,通过计量(dose)活细胞释放的ATP评价细胞活力。与溶剂处理的细胞的数量相比,分析活细胞的数量。使用曲线拟合分析(具有S形剂量响应的非线性回归模型,可变坡面系数)确定EC50值,使用由GraphPadSoftware(GraphPadSoftwareInc.,CA,美国)提供的算法进行所述曲线拟合分析。结果:各种药物:依据上述的方法,测试各种药物,以确定它们在MDA–MB–231细胞系中的抗增殖活性。测量的活性给出EC50<0.1μM的值。选自上面示例药物的数个以下的示例阐明了它们完全显著的抗增殖性质:实施例12:EC50=5.80×10-10M;实施例13:EC50=7.95×10-8M;实施例15:EC50=1.70×10-10M;实施例27:EC50=1.20×10-10M。各种细胞系:依据上面所描述的方法,在不同的细胞系(A549、MDA–MB–231、MCF-7、SN12C)中测试化合物15。测量的活性在所有经测试的细胞系中给出了EC50<0.1μM的值。EC50(M)A549MDA-MB-231MCF-7SN12C化合物151.45x10-101.70x10-107.15x10-102.18x10-10对比实施例:在下面对比实施例中研究了苯环上的取代(氨基相比于羧基),显示包含氨基取代基的根据本发明的药物的改善的抗增殖活性。实施例16:药物-接头部分的合成化合物E-114-((S)-2-((S)-2-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰胺基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基(4-((3R,4S,7S,10S)-4-((S)-仲丁基)-7,10-二异丙基-3-(2-((S)-2-((1R,2R)-1-甲氧基-2-甲基-3-氧代-3-(((S)-2-苯基-1-(噻唑-2-基)乙基)氨基)丙基)吡咯烷-1-基)-2-氧代乙基)-5,11-二甲基-6,9-二氧代-2-氧杂-5,8,11-三氮杂十三烷-13-基)苯基)(甲基)氨基甲酸酯2,2,2-三氟乙酸盐化合物E-11-1:(S)-2-氨基-5-脲基戊酸甲酯盐酸盐在0℃,在搅拌下将乙酰氯(10mL)滴加至MeOH(120mL)中。在20分钟后,加入L-瓜氨酸(10g,57mmol,1.00eq.),并将混合物加热回流过夜。减压蒸发溶剂,以获得15g(116%)为白色固体的化合物E-11-1。产物不经进一步干燥用于下一个步骤。化合物E-11-2:(S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-5-脲基戊酸甲酯在惰性气氛中,在0℃,将化合物E-11-1(13g,57.6mmol,1.1eq.)溶解于DMF(140mL)中。加入DIEA(30mL,173mmol,3.0eq.)、羟基苯并三唑(HOBt-10.59g,69.1mmol,1.2eq.)和Boc-L-缬氨酸羟基琥珀酰亚胺酯(Boc-Val-OSu-18.1g,57.6mmol,1.0eq.)。将反应混合物在环境温度搅拌过夜,然后减压蒸发溶剂。将残余物溶解于水(100mL)中,并用DCM(150mL)萃取两次。合并有机相,用Na2SO4干燥,并减压浓缩。将残余物在硅胶上纯化(DCM/MeOH),以获得18.8g(84%)为白色固体的化合物E-11-2。化合物E-11-3:(S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺)-5-脲基戊酸在0℃,将化合物E-11-2(18.8g,48.4mmol,1eq.)溶解于MeOH(200mL)中。加入1MNaOH溶液(72mL,72mmol,1.5eq.),并将混合物在室温搅拌2小时。减压除去MeOH,并使用1MHCl将残余的水溶液酸化。将水相蒸发至干,并将残余物在硅胶上纯化(DCM/MeOH),以获得18g(99%)为白色固体的化合物E-11-3。化合物E-11-4:((S)-1-(((S)-1-((4-(羟甲基)苯基)氨基)-1-氧代-5-脲基戊烷-2-基)氨基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸叔丁酯将化合物E-11-3(5g,13.4mmol,1eq.)溶解于干燥DCM(65ml)和干燥MeOH(35ml)的混合物中。加入(4-氨基苯基)甲醇(1.81g,14.7mmol,1.1eq.)和N-乙氧羰基-2-乙氧基-1,2-二氢喹啉(EEDQ-6.60g,26.7mmol,2eq.),并将混合物在暗处搅拌过夜。减压蒸发溶剂,并将残余物在硅胶上纯化(DCM/MeOH),以获得5.2g(73%)为灰白色固体的化合物E-11-4。化合物E-11-5:((S)-3-甲基-1-(((S)-1-((4-((((4-硝基苯氧基)羰基)氧基)甲基)苯基)氨基)-1-氧代-5-脲基戊烷-2-基)氨基)-1-氧代丁烷-2-基)氨基甲酸叔丁酯在惰性气氛中,在环境温度,将化合物E-11-4(1.1g,2.29mmol,1eq.)溶解于干燥DMF(5mL)中。加入双(4-硝基苯基)碳酸酯(1.40g,4.59mmol,2eq.),然后加入DIEA(600μl,3.44mmol,1.5eq.),并将所得的黄色溶液搅拌过夜。减压蒸发DMF,并将残余物在硅胶上纯化(DCM/MeOH),以获得1.27g(84%)为灰白色固体的化合物E-11-5。化合物E-11-6:4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基(4-((3R,4S,7S,10S)-4-((S)-仲丁基)-7,10-二异丙基-3-(2-((S)-2-((1R,2R)-1-甲氧基-2-甲基-3-氧代-3-(((S)-2-苯基-1-(噻唑-2-基)乙基)氨基)丙基)吡咯烷-1-基)-2-氧代乙基)-5,11-二甲基-6,9-二氧代-2-氧杂-5,8,11-三氮杂十三烷-13-基)苯基)(甲基)氨基甲酸酯2,2,2-三氟乙酸盐将碳酸酯E-11-5(114mg,0.177mmol,1.2eq.)和苯胺11F(150mg,0.147mmol,1eq.)溶解于干燥DMF(4mL)中。加入HOBt(38mg,0.295mmol,2eq.)和DIEA(54μL,0.295mmol,2eq.),并将混合物在室温搅拌过周末。减压蒸发DMF,并将残余物通过闪式色谱法在硅胶上纯化,用DCM洗脱。通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将产物重新纯化。将选择的级分合并和冻干,以得到为白色固体的化合物E-11-6(89mg,39%)。化合物E-11:将化合物E-11-6(21mg,0.014mmol,1.0eq.)溶解于DCM(0.25mL)中,并加入TFA(40μL)。将溶液在室温搅拌2小时,然后,LC-MS分析表明起始材料完全消耗。将混合物短暂冷却(液氮浴),同时加入DMF(0.5mL),然后加入DIEA(100μL)以中和TFA。然后移除冷却浴,并加入2,5-二氧代吡咯烷-1-基6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酸酯(4mg,0.012mmol,1eq.)。将混合物在室温搅拌48小时,并通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将产物纯化。将选择的级分合并和冻干,以得到为白色固体的化合物E-11(11mg,54%)。m/z(Q-TOFMSESI+)1524.8282(2%,MNa+,C79H115N13NaO14S要求1524.8299),751.9283(100%,(MH2)2+,C79H117N13O14S要求751.9276)。化合物E-12((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((((4-((S)-2-((S)-2-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰胺基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基)氧基)羰基)(甲基)氨基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯2,2,2-三氟乙酸盐化合物E-12-1:((S)-3-甲基-1-氧代-1-(((S)-1-氧代-1-((4-((((全氟苯氧基)羰基)氧基)甲基)苯基)氨基)-5-脲基戊烷-2-基)氨基)丁烷-2-基)氨基甲酸叔丁酯在惰性气氛中,在0℃,将化合物E-11-4(670mg,1.26mmol,1eq.)溶解于干燥DMF(6mL)中。加入双(全氟苯基)碳酸酯(991mg,2.51mmol,2eq.),然后加入DIEA(329μl,1.89mmol,1.5eq.),并将所得的无色溶液在室温搅拌30分钟。减压蒸发DMF,并将残余物在硅胶上纯化(DCM/MeOH),以获得836mg(96%)为灰白色固体的化合物E-12-1。化合物E-12-2:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((((4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基)氧基)羰基)(甲基)氨基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯2,2,2-三氟乙酸盐在惰性气氛中,在0℃,将苯胺12(165mg,0.189mmol,1.0eq.)溶解于DMF(5mL)中。加入碳酸酯E-12-1(194mg,0.282mmol,1.5eq.)、HOBt(51mg,0.375mmol,2eq.)和DIEA(66μL,0.375mmol,2eq.),并将混合物在室温搅拌8小时。减压蒸发溶剂,并通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将残余物纯化。将选择的级分合并和冻干,以得到为白色固体的化合物E12-7(247mg,77%)。化合物E-12-3:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((((4-((S)-2-((S)-2-氨基-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基)氧基)羰基)(甲基)氨基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯双(2,2,2-三氟乙酸盐)将化合物E-12-2(5.6mg,4.04μmol,1.0eq.)溶解于TFA(100μL)中。在5分钟之后,加入2ml水,并将混合物冻干过夜,以获得为灰白色固体的化合物E-12-3(5.6mg,98%)。化合物E-12:将化合物E-12-3(5.6mg,4μmol,1.0eq.)溶解于乙腈(0.5mL)中,并加入DIEA(5μL,7eq.),然后加入2,5-二氧代吡咯烷-1-基6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酸酯(2.5mg,8μmol,2eq.)。将混合物在室温搅拌6小时。在通过LC-MS控制反应后,加入200μL水,并通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将所得的溶液纯化。将选择的级分合并和冻干,以得到为白色固体的化合物E-12(4.6mg,70%)。m/z(Q-TOFMSESI+)739.4389(100%,(MH2)2+,C78H118N12O16要求739.4389)。化合物E-13((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((((4-((S)-2-((S)-2-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰胺基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基)氧基)羰基)(甲基)氨基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸2,2,2-三氟乙酸盐化合物E-13-1:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((((4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基)氧基)羰基)(甲基)氨基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸在室温,将化合物E-12-2(185mg,0.123mmol,1.0eq.)溶解于水(5mL)和乙腈(5mL)的混合物中。加入哌啶(3.67mL,300eq.),并将混合物在室温搅拌6小时。将溶剂减压蒸发至干,并将残余物用Et2O(60mL)研磨。将固体用Et2O(20ml)冲洗两次,并真空干燥,以获得为灰白色固体的化合物E-13-1(175mg,95%)。化合物E-13-2:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((((4-((S)-2-((S)-2-氨基-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基)氧基)羰基)(甲基)氨基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸双(2,2,2-三氟乙酸盐)将化合物E-13-1(175mg,0.128mmol,1.0eq.)溶解于TFA(200μL)中。在5分钟之后,加入水(1ml)和乙腈(1ml),并将溶液冻干过夜,以获得为灰白色固体的化合物E-13-2(180mg,87%)。化合物E-13:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((((4-((S)-2-((S)-2-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰胺基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基)氧基)羰基)(甲基)氨基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸2,2,2-三氟乙酸盐将化合物E-13-2(80mg,0.058mmol,1.0eq.)溶解于乙腈(1.5mL)和DMF(0.4mL)的混合物中。加入DIEA(50μL,0.289mmol,5eq.),然后加入2,5-二氧代吡咯烷-1-基6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酸酯(36mg,0.116mmol,2eq.)。将混合物在室温搅拌3小时。在通过LC-MS控制反应之后,减压蒸发溶剂,并通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将残余物纯化。将选择的级分合并和冻干,以得到为白色固体的化合物E-13(32mg,35%)。m/z(Q-TOFMSESI-)1461.8336(100%,(M-H)-,C77H113N12O16要求1461.8403)。m/z(Q-TOFMSESI+)1463.8565(2%,MH+,C77H115N12O16要求1463.8549),732.4317(100%,(MH2)2+,C77H116N12O16要求732.4311)。化合物E-15((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((3-((((4-((S)-2-((S)-2-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰胺基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基)氧基)羰基)氨基)苄基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯2,2,2-三氟乙酸盐化合物E-15-1:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((3-((((4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基)氧基)羰基)氨基)苄基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯2,2,2-三氟乙酸盐根据与化合物E-11-6相同的方法,在DMF(2mL)中使用碳酸酯E-11-5(28mg,0.044mmol,1eq.)、苯胺15(42mg,0.044mmol,1eq.)、HOBt(3mg,0.022mmol,0.5eq.)和DIEA(15μL,0.087mmol,2eq.)制备化合物E-15-1。分离到为白色固体的化合物E-15-1(8.2mg,13%)。化合物E-15-2:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((3-((((4-((S)-2-((S)-2-氨基-3-甲基丁酰胺基)-5-脲基戊酰胺基)苄基)氧基)羰基)氨基)苄基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯双(2,2,2-三氟乙酸盐)将化合物E-15-1(8.2mg,5.58μmol,1.0eq.)溶解于TFA(200μL)中。在5分钟之后,加入水(1ml),并将溶液冻干过夜,以获得为白色固体的化合物E-15-8(7.6mg,99%)。化合物E-15:根据与化合物E-12相同的方法,在乙腈(0.5mL)中使用胺E-15-2(7.6mg,5.55μmol,1eq.)、2,5-二氧代吡咯烷-1-基6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酸酯(2mg,6.65μmol,1.2eq.)和DIEA(5μL,0.028mmol,5eq.)制备化合物E-15。分离到为白色固体的化合物E-15(4.2mg,48%)。m/z(Q-TOFMSESI+)1471.8169(2%,MNa+,C76H112N12NaO16要求1471.8211),725.4223(100%,(MH2)2+,C76H114N12O16要求725.4232),483.9482(10%,(MH3)3+,C76H115N12O16要求483.9513)。化合物F-13((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((S)-2-((S)-2-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰胺基)-3-甲基丁酰胺基)-N-甲基-5-脲基戊酰胺基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸2,2,2-三氟乙酸盐化合物F-13-1:N-(4-((叔丁氧基羰基)(甲基)氨基)苯乙基)-N-甲基-L-缬氨酸苄酯将化合物11C(250mg,0.567mmol,1eq.)溶解于THF(10ml)中,然后加入NaH(在矿物油中的60%混悬液,68mg,1.702mmol,3eq.)。将混合物搅拌5分钟,然后加入碘甲烷(106μL,1.702mmol,3eq.)。将反应在室温搅拌2小时,然后用水淬灭,并在EtOAc(100mL)和水(50mL)之间分离。将有机相用MgSO4干燥,并蒸发至干,以获得黄色油状物化合物F-13-1(250mg,97%),其不作进一步纯化而使用。化合物F-13-2:N-甲基-N-(4-(甲基氨基)苯乙基)-L-缬氨酸苄酯将Boc-保护的苯胺F-13-1(250mg,0.550mmol,1eq)溶解于MeOH(5mL)中,然后加入1mL市售可得的HCl在iPrOH中的溶液(5-6M)。将溶液在室温搅拌2小时,然后减压蒸发至干。将所得的黄色油状物用Et2O研磨,以获得为黄色固体的化合物F-13-2(202mg,94%)。化合物F-13-3:N-(4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-N-甲基-5-脲基戊酰胺基)苯乙基)-N-甲基-L-缬氨酸苄酯将酸E-11-3(190mg,0.508mmol,1.5eq.)溶解于干燥DMF(1ml)中,然后加入DIEA(118μL,0.677mmol,2eq.)、苯并三唑-1-基-氧基三吡咯烷基鏻六氟磷酸盐(PyBOP-264mg,0.508mmol,1.5eq.)和苯胺F-13-2(120mg,0.339mmol,1eq.)。将混合物在室温搅拌过夜,并减压蒸发溶剂。通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将残余物纯化。将选择的级分合并和冻干,以得到为白色固体的化合物F-13-3(140mg,45%)。化合物F-13-4:N-(4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-N-甲基-5-脲基戊酰胺基)苯乙基)-N-甲基-L-缬氨酸在Pd/C10%(30mg)的存在下,将化合物F-13-3(116mg,0.163mmol,1eq.)溶解于MeOH(5ml)中,并在环境温度和大气压下氢化2小时。将反应介质过滤,并减压浓缩,以获得110mg(99%)为米色固体的化合物F-13-4。化合物F-13-5:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-N-甲基-5-脲基戊酰胺基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯2,2,2-三氟乙酸盐将胺3D(89mg,0.140mmol,1eq.)和酸F-13-4(145mg,0.210mmol,1.5eq.)溶解于干燥DMF(4mL)中,并加入PyBOP(109mg,0.210mmol,1.5eq.)和DIEA(73μL,0.420mmol,3eq.)。将混合物在室温搅拌1小时,并蒸发溶剂。在EtOAc和水之间分离残余物,并将有机相用MgSO4干燥,过滤并减压蒸发。通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将粗产物纯化。将选择的级分合并和冻干,以得到为白色固体的化合物F-13-5(140mg,73%)。化合物F-13-6:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-N-甲基-5-脲基戊酰胺基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸2,2,2-三氟乙酸盐将化合物F-13-5(140mg,0.104mmol,1eq.)溶解于水(4mL)、乙腈(4mL)和哌啶(2mL)的混合物中,并在室温搅拌4小时。减压蒸发溶剂,并通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将残余物纯化。将选择的级分合并和冻干,以得到为白色固体的化合物F-13-6(115mg,83%)。化合物F-13:根据与化合物E-11相同的方法制备化合物F-13,在DCM(0.5mL)和TFA(100μL,30eq.)中使用Boc-保护的胺F-13-6(55mg,0.041mmol,1.0eq.),然后用DMF(1mL)稀释,用DIEA(320μL,45eq)淬灭,然后与2,5-二氧代吡咯烷-1-基6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酸酯(15mg,0.049mmol,1.2eq.)反应。在通过制备型HPLC纯化并冻干后,获得为白色固体的化合物F-13(14mg,24%)。m/z(Q-TOFMSESI+)1314.8067(2%,MH+,C69H108N11O14要求1314.8072),657.9067(100%,(MH2)2+,C69H109N11O14要求657.9072)。化合物F-61N-((S)-1-(((S)-1-((4-((3R,4S,7S,10S)-4-((S)-仲丁基)-7,10-二异丙基-3-(2-((S)-2-((1R,2R)-1-甲氧基-2-甲基-3-氧代-3-(((S)-2-苯基-1-(噻唑-2-基)乙基)氨基)丙基)吡咯烷-1-基)-2-氧代乙基)-5,11-二甲基-6,9-二氧代-2-氧杂-5,8,11-三氮杂十三烷-13-基)苯基)氨基)-1-氧代-5-脲基戊烷-2-基)氨基)-3-甲基-1-氧代丁烷-2-基)-6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰胺2,2,2-三氟乙酸盐化合物F-61-1:N-(4-氨基苯乙基)-N-甲基-L-缬氨酸苄酯二盐酸盐将化合物11C(1.0g,2.27mmol,1eq.)溶解于8mL市售可得的HCl在iPrOH中的溶液(5-6M)中。将混合物在室温搅拌2小时,然后减压蒸发至干。将残余物用Et2O(30ml)研磨两次,并真空干燥,以获得为白色固体的化合物F-61-1(916mg,98%)。化合物F-61-2:N-(4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苯乙基)-N-甲基-L-缬氨酸苄酯将酸E-11-3(769mg,2.05mmol,1.5eq.)溶解于干燥DMF(2.5ml)中,然后加入DIEA(957μL,5.48mmol,4eq.)和PyBOP(1.07g,2.05mmol,1.5eq.)。加入苯胺F-61-1(566mg,1.369mmol,1eq.),并将混合物在室温搅拌过夜。减压蒸发溶剂,并将残余物在硅胶上纯化(DCM/MeOH),以获得969mg(102%)为白色固体的化合物F-61-2。化合物F-61-3:N-(4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苯乙基)-N-甲基-L-缬氨酸在Pd/C10%(270mg)的存在下,将化合物F-61-2(969mg,1.28mmol,1eq.)溶解于MeOH(20ml)中,并在环境温度和大气压下氢化3小时。将反应介质过滤,并减压浓缩,并将残余物在硅胶上纯化(DCM/MeOH/AcOH),以获得520mg(67%)为白色固体的化合物F-61-3。化合物F-61-4:((S)-1-(((S)-1-((4-((3R,4S,7S,10S)-4-((S)-仲丁基)-7,10-二异丙基-3-(2-((S)-2-((1R,2R)-1-甲氧基-2-甲基-3-氧代-3-(((S)-2-苯基-1-(噻唑-2-基)乙基)氨基)丙基)吡咯烷-1-基)-2-氧代乙基)-5,11-二甲基-6,9-二氧代-2-氧杂-5,8,11-三氮杂十三烷-13-基)苯基)氨基)-1-氧代-5-脲基戊烷-2-基)氨基)-3-甲基-1-氧代丁烷-2-基)氨基甲酸叔丁酯2,2,2-三氟乙酸盐将酸F-61-3(67.5mg,0.111mmol,1.5eq.)溶解于干燥DMF(2mL)中,并加入DECP(17μL,0.111mmol,1.5eq.)和DIEA(39μL,0.223mmol,3eq.)。在室温搅拌15分钟后,加入胺1Y(50mg,0.074mmol,1eq.),并将溶液搅拌过夜。减压蒸发溶剂,并通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将残余物纯化。将选择的级分合并和冻干,以得到为白色固体的化合物F61-4(28mg,28%)。化合物F-61-5:(S)-2-((S)-2-氨基-3-甲基丁酰胺基)-N-(4-((3R,4S,7S,10S)-4-((S)-仲丁基)-7,10-二异丙基-3-(2-((S)-2-((1R,2R)-1-甲氧基-2-甲基-3-氧代-3-(((S)-2-苯基-1-(噻唑-2-基)乙基)氨基)丙基)吡咯烷-1-基)-2-氧代乙基)-5,11-二甲基-6,9-二氧代-2-氧杂-5,8,11-三氮杂十三烷-13-基)苯基)-5-脲基戊酰胺双(2,2,2-三氟乙酸盐)将化合物F-61-4(28mg,0.021mmol,1.0eq.)溶解于TFA(200μL)中。在5分钟之后,加入水(2ml)和乙腈(0.5ml),并将溶液冻干过夜,以获得为无色油的化合物F-61-5(38mg,134%)。化合物F-61:将化合物F-61-5(28.3mg,0.020mmol,1eq.)溶解于乙腈(0.5mL)中,然后加入2,5-二氧代吡咯烷-1-基6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酸酯(9mg,0.029μmol,1.4eq.)和DIEA(25μL,0.143mmol,7eq.)。将混合物搅拌4.5小时,然后HPLC分析显示存在起始材料,但琥珀酰亚胺被完全消耗。因此,加入补充的2,5-二氧代吡咯烷-1-基6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酸酯(3mg,0.01μmol,0.5eq.),并将反应搅拌1.5小时。HPLC分析显示起始材料被完全消耗。将溶剂蒸发至干,并将残余物用EtOAc/Et2O(80/20)的混合物研磨两次,以获得为灰白色固体的化合物F-61(19.4mg,70%)。m/z(Q-TOFMSESI+)1361.7725(2%,MNa+,C70H106N12NaO12S要求1361.7666),670.3961(100%,(MH2)2+,C70H108N12O12S要求670.3960)。化合物F-62:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((S)-2-((S)-2-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰胺基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯2,2,2-三氟乙酸盐化合物F-62-1:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯2,2,2-三氟乙酸盐以类似于化合物F-61-4的方式,在DMF(2mL)中,由胺3D(100mg,0.158mmol,0.9eq.)、酸F-61-3(108mg,0.178mmol,1eq.)、DECP(41μL,0.267mmol,1.5eq.)和DIEA(93μL,0.534mmol,3eq.)制备化合物F-62-1。在通过制备型HPLC纯化后,获得为白色固体的化合物F-62-1(93mg,39%)。化合物F-62-2:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((S)-2-((S)-2-氨基-3-甲基丁酰胺基)-5-脲基戊酰胺基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯双(2,2,2-三氟乙酸盐)将化合物F-62-1(35mg,0.026mmol,1.0eq.)溶解于TFA(200μL)中。在10分钟之后,加入水(2ml)和乙腈(0.5ml),并将溶液冻干过夜,以获得为白色固体的化合物F-62-2(34mg,105%)。化合物F-62:将胺F-62-2(34mg,5.55μmol,1eq.)溶解于乙腈(3mL)中。加入DIEA(5μL,0.028mmol,5eq.)和2,5-二氧代吡咯烷-1-基6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酸酯(2mg,6.65μmol,1.2eq.)。HPLC分析显示起始材料被完全消耗。将溶剂蒸发至干,并将残余物用EtOAc/Et2O(80/20)的混合物研磨。通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将粗产物纯化。将选择的级分合并和冻干,以得到为白色固体的化合物F-62(5.5mg,13%)。m/z(Q-TOFMSESI+)1336.7859(2%,MNa+,C69H107N11NaO14要求1336.7891),657.9073(100%,(MH2)2+,C69H109N11O14要求657.9072)。化合物F-63:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((S)-2-((S)-2-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰胺基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸2,2,2-三氟乙酸盐化合物F-63-1:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((S)-2-((S)-2-((叔丁氧基羰基)氨基)-3-甲基丁酰胺基)-5-脲基戊酰胺基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸将化合物F-62-1(157mg,0.118mmol,1eq.)溶解于水(4.5mL)、乙腈(4.5mL)和哌啶(3.5mL)的混合物中,并在室温搅拌5小时。将溶剂减压蒸发,并将残余物用Et2O(60mL)研磨。通过过滤收集固体,并将其用Et2O(10ml)冲洗两次,以获得为灰白色固体的化合物F-63-1(153mg,100%)。化合物F-63-2:((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-((S)-2-((S)-2-氨基-3-甲基丁酰胺基)-5-脲基戊酰胺基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸双2,2,2-三氟乙酸盐将化合物F-63-1(153mg,0.127mmol,1.0eq.)溶解于TFA(200μL)中。在10分钟之后,加入水(2ml)和乙腈(0.5ml),并将溶液冻干过夜,以获得为白色固体的化合物F-63-2(34mg,105%)。化合物F-63:将胺F-63-2(100mg,0.082mmol,1eq.)溶解于乙腈(2mL)和DMF(0.5mL)的混合物中,并加入2,5-二氧代吡咯烷-1-基6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酸酯(45mg,0.147mmol,1.8eq.)和DIEA(71μL,0.409mmol,5eq.)。在室温搅拌4.5小时后,减压蒸发溶剂。通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将粗产物纯化。将选择的级分合并和冻干,然后以得到为白色固体的化合物F-63(42mg,36%)。m/z(Q-TOFMSESI+)1300.7901(2%,MH+,C68H106N11O14要求1300.7915),650.8990(100%,(MH2)2+,C68H107N11O14要求650.8994)。化合物G-12((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)-N-甲基己酰胺基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯2,2,2-三氟乙酸盐化合物G-12-1:N-(4-氨基苯乙基)-N-甲基-L-缬氨酸苄酯二盐酸盐将6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酸(200mg,0.947mmol,1eq.)溶解于草酰氯(3mL)中。将溶液在室温搅拌5小时,然后减压蒸发至干。获得为米色固体的化合物G-12-1(217mg,100%),并且其不经纯化而用于下一个步骤。化合物G-12:在0℃,将苯胺12(40mg,0.045mmol,1eq.)溶解于干燥DCM(1mL)中,并加入DIEA(8μL,0.045mmol,1eq.)。在搅拌30分钟后,引入化合物G-12-1(10mg,0.45mmol,1eq.)在干燥DCM(1mL)中的溶液,并将反应在0℃搅拌1小时。将混合物用DCM(25ml)稀释,并用水(20mL)洗涤两次,用盐水(10mL)洗涤一次。将有机相用Na2SO4干燥,过滤并减压蒸发,以获得为浅棕色固体的粗产物(54mg)。将其通过闪式色谱法在硅胶上纯化(DCM/MeOH),然后通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)纯化。将分离的产物冻干,以获得白色固体(23mg),将其通过制备型HPLC重新纯化,并将选择的级分合并和冻干,以得到为白色固体的化合物G-12(9mg,16%)。m/z(Q-TOFMSESI+)1094.6543(20%,MNa+,C59H89N7NaO11要求1094.6512),1072.6722(16%,MH+,C59H90N7O11要求1072.6693),536.8358(100%,(MH2)2+,C59H91N7O11要求536.8383)。化合物G-13((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((4-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)-N-甲基己酰胺基)苯乙基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸2,2,2-三氟乙酸盐化合物G-13:在0℃,将苯胺13(15mg,0.015mmol,1eq.)溶解于干燥DCM(1.5mL)中,并加入DIEA(8μL,0.046mmol,3eq.)。引入化合物G-12-1(3.5mg,0.046mmol,1eq.)在干燥DCM(0.5mL)中的溶液,并将反应在0℃搅拌1.5小时。减压蒸发溶剂,并通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将粗产物纯化。将选择的级分合并和冻干,以得到为白色固体的化合物G-13(11.4mg,62%)。m/z(Q-TOFMSESI+)1058.6510(30%,MH+,C58H88N7O11要求1058.6536),529.8285(100%,(MH2)2+,C58H89N7O11要求529.8305)。化合物G-15((2R,3R)-3-((S)-1-((3R,4S,5S)-4-((S)-2-((S)-2-((3-(6-(2,5-二氧代-2,5-二氢-1H-吡咯-1-基)己酰胺基)苄基)(甲基)氨基)-3-甲基丁酰胺基)-N,3-二甲基丁酰胺基)-3-甲氧基-5-甲基庚酰基)吡咯烷-2-基)-3-甲氧基-2-甲基丙酰基)-L-苯丙氨酸甲酯2,2,2-三氟乙酸盐化合物G-15:在0℃,将苯胺15(40mg,0.047mmol,1eq.)溶解于干燥DCM(2mL)中,并加入DIEA(10μL,0.056mmol,1.2eq.)。引入化合物G-12-1(108mg,0.47mmol,10eq.)在干燥DCM(1mL)中的溶液,并将反应在0℃搅拌1.5小时。将混合物用DCM(10ml)稀释,并用水(5mL)洗涤两次。将有机相用MgSO4干燥,过滤并减压蒸发,以获得为米色固体的粗产物。通过制备型HPLC(Waters600E,SunFirePrepC18OBD柱,5μm,19×100mm;流动相:0.1%TFA缓冲的水/MeCN;梯度经15分钟5%至100%MeCN;紫外检测器Waters2487在220nm处)将其纯化。将选择的级分合并和冻干,以得到为白色固体的化合物G15(27mg,50%)。m/z(Q-TOFMSESI+)1066.6517(2%,MNa+,C57H85N7NaO11要求1066.6199),522.8224(100%,(MH2)2+,C57H87N7O11要求522.8226)。实施例17:ADC的合成、纯化和表征以下所描述的程序适用于嵌合IgG1形式和人源化IgG1形式。必须理解,对于任何其他形式,例如IgG2、IgG4等,本领域技术人员能够使用一般知识以改变该程序。在37℃,用10mM硼酸盐缓冲液(pH8.4)中的三(2-羧乙基)膦盐酸盐(TCEP)将抗体(1-5mg/ml)部分地还原2h,所述硼酸盐缓冲液含有150mMNaCl和2mMEDTA。典型地,使用2.5-3摩尔当量的TCEP,以分别靶向约4的药物-抗体比例(DAR)。在非还原条件下,通过SDS-PAGE分析确认部分抗体还原。在将接头-药物偶联至释放的链间半胱氨酸残基之前,允许将还原混合物冷却至室温。然后,用10mM硼酸盐缓冲液(pH8.4)将抗体浓度调节至1mg/ml,所述硼酸盐缓冲液含有150mMNaCl和2mMEDTA,并从10mM二甲基亚砜(DMSO)溶液中加入相比于抗体5摩尔过量的药物。将最终的DMSO浓度调节至10%,以在偶联期间维持药物在水性介质中的溶解度。将反应在室温进行1h。通过加入1.5摩尔N-乙酰半胱氨酸每摩尔药物,并在室温孵育1小时,以淬灭药物过量。在4℃对含有150mMNaCl的25mMHis缓冲液(pH6.5)透析过夜后,通过使用本领域技术人员已知的方法纯化抗体-药物-缀合物,所述方法基于市售的色谱柱和超滤单元。首先,通过在S200(GELifeSciences)或TSKG3000SW(Tosoh)柱上的尺寸排阻色谱法(SEC),除去未偶联的药物和ADC聚集体。然后,通过在30或50kDaMWCO过滤单元上的超滤,或通过在蛋白A上的亲和层析,将纯化的ADC单体浓缩至2-3mg/ml。在0.2μm过滤器上无菌过滤后,将纯化的ADC储存于4℃。在还原条件和非还原条件下,通过SDS-PAGE进一步分析它们,以确认药物缀合,并通过在分析型S200或TSKG3000SWXL柱上的SEC进一步分析它们,以确定单体和聚集形式的含量。通过使用以IgG作为标准的二喹啉甲酸(BCA)分析,确定蛋白质浓度。通过HIC和LC-MS估计每种纯化的ADC的DAR。典型地,聚集形式的含量低于5%,并且DAR为3.5至5。实施例18:与不同药物偶联的IGF-1R抗体的细胞毒性评价18.1嵌合抗体在MCF-7细胞中的评价已显示五种IGF-1R抗体被快速内化至溶酶体中,并且在酸性环境中具有较低的结合能力。在这方面,那些Ab具有用作ADC的所有性质。因此,将五种嵌合抗IGF-1R抗体与三种不同的化合物(G-13;E-13和F-63)偶联。这些ADC的药物抗体比例约为4。为了评价非特异性细胞毒性,还将不相关的嵌合抗体c9G4与那些化合物以相同的DAR偶联。在完全培养介质中,将MCF-7细胞与增加浓度的每种ADC在37℃孵育6天。使用荧光细胞活力分析(CellTiter-Glo,Promega)评估细胞活力。使用Mithras读板器(BertholdTechnologies)读取荧光信号。与E-13、G-13或F-63偶联的不相关的嵌合抗体c9G4在MCF-7细胞中不显示细胞毒活性,或显示温和的细胞毒活性(图21)。相反,在将抗IGF-1R抗体与E-13、G-13或F-63偶联后获得的所有其他的ADC的加入显著降低MCF-7细胞活力。18.2嵌合抗体在正常细胞中的评价使用c208F2mAb,在原代正常细胞(PromoCellGmbH)中评价IGF-1R的表达水平。为了这个目的,在FACS缓冲液(PBS,0.1%BSA,0.01%NaN3)中,将细胞(0.5x106个细胞/ml)与10μg/mlc208F2抗体在4℃孵育20min。然后将它们洗涤3次,并在暗处与偶联有Alexa488的合适的二级抗体在4℃孵育另外20分钟,然后在FACS缓冲液中洗涤3次。使用碘化丙啶(其将死细胞染色)鉴定存活的细胞,立即在所述存活的细胞中进行抗IGF-1R抗体的结合。相比于在MCF-7细胞中的IGF-1R表达(参见实施例2,表8),在正常细胞中的表达水平(Bmax)是低的(表14)。表14正常细胞Bmax人主动脉内皮细胞(HAoEC)21人肺微血管内皮细胞(HPMEC)33人支气管平滑肌细胞(HBSMC)26人肾上皮细胞(HREpC)110人尿路上皮细胞(HUG)181在正常细胞中评价ADCc208F2-G-13的细胞毒性。在完全培养介质中,将细胞与增加浓度的c208F2-G-13在37℃孵育6天。使用荧光细胞活力分析(CellTiter-Glo,Promega)评估细胞活力。使用Mithras读板器(BertholdTechnologies)读取荧光信号。在HBSMC、HPMEC、HAoEC和HREpC中,没有观察到较大的细胞毒性(图25)。在HUC中,仅在高浓度的c208F2-G-13处测量到较小的细胞毒性。18.3hz208F2的人源化变体的评价将208F2的十六种人源化变体与化合物G-13偶联。这些ADC的药物抗体比例约为4。为了评价非特异性细胞毒性,还将不相关的嵌合抗体c9G4与那些化合物以相同的DAR偶联。还将嵌合抗体c208F2与G-13偶联。在完全培养介质中,将MCF-7细胞与增加浓度的每种ADC在37℃孵育6天。使用荧光细胞活力分析(CellTiter-Glo,Promega)评估细胞活力。使用Mithras读板器(BertholdTechnologies)读取荧光信号。与G-13偶联的不相关的嵌合抗体c9G4在MCF-7细胞中不显示细胞毒活性,或显示温和的细胞毒活性(图26)。相反,在将抗IGF-1R抗体与G-13偶联后获得的所有其他的ADC的加入显著降低MCF-7细胞活力。十六种人源化变体诱导细胞毒性的能力至少等于甚至优于用嵌合形式c208F2-G-13测量的能力,如表15所示,并且如在图26中用一种人源化变体所阐明。表15实施例19:在MCF-7异种移植模型中,与E-13、G-13或F-63化合物缀合的c208F2抗体的体内活性。为了确认与G-13、E-13或F-63化合物偶联的c208F2的体外功效可以在体内转化(translate),已经在MCF-7异种移植模型中测试了它们。根据2010/63/UE指令(Directive)关于保护用于科学目的的动物的指南,进行所有动物程序。该方案由PierreFabreInstitute的动物伦理委员会(AnimalEthicalCommittee)批准。将五百万个MCF-7细胞皮下注射至7周龄的Swiss/Nude小鼠中。在细胞注射之前,将雌激素颗粒(pellet)(InnovativeResearchofAmerica)植入小鼠的左侧腹,以释放MCF-7肿瘤的体内生长所必需的雌激素。在MCF-7细胞植入后二十天,当肿瘤达到120-150mm3的平均尺寸时,根据肿瘤大小和外观将动物分组,每组5只小鼠。通过腹膜内注射接种不同的处理。每天监测动物的健康状况。每周两次用电子卡尺测量肿瘤体积,直至研究结束。肿瘤体积用下式计算:π/6×长度×宽度×高度。每周三次称量动物的重量后,评价毒性。使用Mann-Whitney检验,在每次测量时进行统计分析。所有化合物均为腹膜内(i.p.)注射。在该实施例中,在D20和D272次注射7mg/kg剂量后,评价约DAR4的与E-13、F-13或F-63偶联的c208F2mAb的抗肿瘤活性(图22A、22B和22C)。平行地,以对应于7mg/kg的DAR约4的c208F2-E-13、c208F2-F-13和c208F2-F-63的剂量的等效剂量,注射加帽的(capped)药物部分E-13、F-13和F-63。c208-E-13(图22A)、c208F2-G-13(图22B)或c208F2-F-63(图22C)的注射显著抑制甚至诱导完全的肿瘤生长消退(p<0.05对比于相应的加帽的药物)。没有注意到c208-E-13、c208F2-G-13和c208F2-F-63之间的统计学活性差异。加帽的药物对MCF-7肿瘤生长没有作用(p>0.05对比于对照组)。如前面所描述,在MCF-7异种移植模型中,使用与E-13或G-13偶联的c208F2和与E-13或G-13偶联的不相关的抗体c9G4进行第二组实验。在D20和D27,将小鼠i.p.注射7mg/kg的每种ADC(图23A和23B)。c9G4-E-13和c9G4-F-13的注射温和地且短暂地影响MCF-7异种移植肿瘤的生长。然而,该第二实验确认,c208-E-13或c208F2-G-13的注射诱导完全的肿瘤消退,因为D43显示这些ADC的高的抗肿瘤活性。实施例20:在3+MCF-7异种移植模型中,与G-13化合物缀合的hz208F2抗体的体内活性。在MCF-7异种移植模型中,已经体内评价了与G-13化合物偶联的208F2的人源化形式。根据2010/63/UE指令(Directive)关于保护用于科学目的的动物的指南,进行所有动物程序。该方案由PierreFabreInstitute的动物伦理委员会批准。将五百万个MCF-7细胞皮下注射至7周龄的Swiss/Nude小鼠中。在细胞注射之前,将雌激素颗粒(InnovativeResearchofAmerica)植入小鼠的左侧腹,以释放MCF-7肿瘤的体内生长所必需的雌激素。在MCF-7细胞植入后二十天,当肿瘤达到120-150mm3的平均尺寸时,根据肿瘤大小和外观将动物分组,每组6只小鼠。通过作为4次注射方案的腹膜内注射接种不同的处理;每四天一次注射(Q4d4)。每天监测动物的健康状况。每周两次用电子卡尺测量肿瘤体积,直至研究结束。肿瘤体积用下式计算:π/6×长度×宽度×高度。每周三次称量动物的重量后,评价毒性。使用Mann-Whitney检验,在每次测量时进行统计分析。所有化合物均为腹膜内(i.p.)注射。在该实施例中,将偶联至G-13化合物的c208F2mAb的抗肿瘤活性,与也偶联至G-13的不同的人源化形式作比较(图27)。在下表16中描述了经测试的人源化形式:表16c208-G-13或208F2人源化形式的注射显著抑制,甚至诱导完全的肿瘤生长消退(p<0.05对比于相应的对照)。没有观察到c208F2-G-13与经测试的人源化形式之间的统计学活性差异。如前面所描述,在MCF-7异种移植模型中,使用与G-13偶联的c208F2或hz208F2-4进行第二组实验(分别地,图28A和28B)。每四天4次注射(Q4d4)或仅一次,将小鼠i.p.注射3mg/kg的每种ADC。在MCF异种移植模型中,当ADC被注射四次或仅一次时,观察到相同的强抗肿瘤活性。实施例21:在2+CaOV-3异种移植模型中,与G-13或E-13化合物缀合的208F2抗体的体内活性。还在2+表达性肿瘤,CaOV-3异种移植模型中研究抗肿瘤活性,所述异种移植模型为卵巢癌细胞系。对于该计划,在D0,将小鼠皮下注射7×106个细胞。当肿瘤达到约120mm3(肿瘤细胞注射后19天)时,将动物分成具有可比较的肿瘤大小的5组,每组5只小鼠,并用与E-13或G-13偶联的c208F2和与E-13或G-13偶联的不相关的抗体c9G4腹膜内处理。将小鼠i.p.注射3mg/kg的每种ADC持续6个注射循环;每四天一次注射。跟踪观察小鼠的异种移植物生长速率。肿瘤体积通过下式计算:π/6×长度×宽度×高度。相比于温和地且短暂地诱导生长减缓的c9G4-E-13,c9G4-G-13的注射不影响CaOV-3异种移植肿瘤的生长。同时,在第50天,c208F2-E-13或c208F2-G-13的注射分别诱导95%和77%的肿瘤生长抑制(图29A和29B)。序列表<110>皮埃尔法布雷医药公司<120>IGF-1R抗体-药物-缀合物和其用于治疗癌症的用途<130>D33593<150>EP14305620.8<151>2014-04-25<160>81<170>PatentInversion3.5<210>1<211>8<212>PRT<213>人工序列<220><223>共有CDR-H1<220><221>MISC_FEATURE<222>(3)..(3)<223>Thr可以被Ser代替<220><221>MISC_FEATURE<222>(8)..(8)<223>Tyr可以被Phe代替<400>1GlyTyrThrPheThrSerTyrTyr15<210>2<211>8<212>PRT<213>人工序列<220><223>共有CDR-H2<400>2IleTrpProGlyAspGlySerThr15<210>3<211>13<212>PRT<213>人工序列<220><223>共有CDR-H3<400>3AlaSerProMetIleThrProAsnTyrAlaMetAspTyr1510<210>4<211>6<212>PRT<213>人工序列<220><223>共有CDR-L1<220><221>MISC_FEATURE<222>(4)..(4)<223>Ser可以被Asn代替<400>4GlnAspIleSerLysTyr15<210>5<211>3<212>PRT<213>人工序列<220><223>共有CDR-L2<400>5TyrThrSer1<210>6<211>9<212>PRT<213>人工序列<220><223>共有CDR-L3<220><221>MISC_FEATURE<222>(5)..(5)<223>Thr可以被Ala代替<400>6GlnGlnGlySerThrLeuProTyrThr15<210>7<211>8<212>PRT<213>人工序列<220><223>CDR-H1<400>7GlyTyrThrPheThrSerTyrTyr15<210>8<211>8<212>PRT<213>人工序列<220><223>CDR-H1<400>8GlyTyrSerPheThrSerTyrPhe15<210>9<211>6<212>PRT<213>人工序列<220><223>CDR-L1<400>9GlnAspIleSerLysTyr15<210>10<211>6<212>PRT<213>人工序列<220><223>CDR-L1<400>10GlnAspIleAsnLysTyr15<210>11<211>9<212>PRT<213>人工序列<220><223>CDR-L3<400>11GlnGlnGlySerThrLeuProTyrThr15<210>12<211>9<212>PRT<213>人工序列<220><223>CDR-L3<400>12GlnGlnGlySerAlaLeuProTyrThr15<210>13<211>120<212>PRT<213>人工序列<220><223>c208F2,重链,VH<400>13GlnValGlnLeuGlnGlnSerGlyProGluLeuValLysProGlyAla151015SerValLysMetSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleTyrTrpValLysGlnArgProGlyGlnGlyLeuGluTrpLeu354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluLysPhe505560LysAspLysThrThrLeuThrAlaAspLysSerSerAsnThrAlaTyr65707580MetPheLeuSerSerLeuThrSerGluAspSerAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyAlaSerValThrValSerSer115120<210>14<211>120<212>PRT<213>人工序列<220><223>c212A11,重链,VH<400>14GlnValGlnLeuGlnGlnSerGlyProGluLeuValLysProGlyAla151015SerValLysMetSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValLysGlnArgProGlyGlnGlyLeuGluTrpIle354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluLysPhe505560LysGlyLysThrThrLeuThrAlaAspLysSerSerSerThrAlaTyr65707580MetPheLeuSerSerLeuThrSerGluAspSerAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyAlaSerValThrValSerSer115120<210>15<211>120<212>PRT<213>人工序列<220><223>c214F8,重链,VH<400>15GlnValGlnLeuGlnGlnSerGlySerGluLeuValLysProGlyAla151015SerValLysLeuSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValLysGlnArgProGlyGlnGlyLeuGluTrpIle354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluArgPhe505560LysGlyLysThrThrLeuThrAlaAspLysSerSerSerThrAlaTyr65707580MetPheLeuSerSerLeuThrSerGluAspSerAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyAlaSerValThrValSerSer115120<210>16<211>120<212>PRT<213>人工序列<220><223>c219D6,重链,VH<400>16GlnValGlnLeuGlnGlnSerGlyProGluLeuValLysProGlyAsp151015SerValLysMetSerCysLysAlaSerGlyTyrSerPheThrSerTyr202530PheIleHisTrpValLysGlnArgProGlyGlnGlyLeuGluTrpIle354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluLysPhe505560LysGlyLysThrThrLeuThrThrAspLysSerSerSerThrAlaTyr65707580MetPheLeuAsnSerLeuThrSerGluAspSerAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyAlaSerValThrValSerSer115120<210>17<211>120<212>PRT<213>人工序列<220><223>c213B10,重链,VH<400>17GlnValGlnLeuGlnGlnSerGlySerGluLeuValLysProGlyAla151015SerValLysMetSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValLysGlnArgProGlyGlnGlyLeuGluTrpIle354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluArgPhe505560LysGlyLysThrThrLeuThrAlaAspLysSerSerSerThrAlaTyr65707580MetPheLeuSerSerLeuThrSerGluAspSerAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyAlaSerValThrValSerSer115120<210>18<211>107<212>PRT<213>人工序列<220><223>c208F2,轻链,VL<400>18AspIleGlnMetThrGlnThrThrSerSerLeuSerAlaSerLeuGly151015AspArgValThrIleSerCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnGlnProAspGlyThrIleLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleSerAsnValGluGln65707580GluAspIleAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysLeuGluIleLys100105<210>19<211>107<212>PRT<213>人工序列<220><223>c212A11,轻链,VL<400>19AspIleGlnMetThrGlnThrThrSerSerLeuSerAlaSerLeuGly151015AspArgValThrIleSerCysArgAlaSerGlnAspIleAsnLysTyr202530LeuAsnTrpTyrGlnGlnGlnProAspGlyThrValLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleSerAsnLeuGluGln65707580GluAspIleAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysLeuGluIleLys100105<210>20<211>107<212>PRT<213>人工序列<220><223>c214F8,轻链,VL<400>20AspIleGlnMetThrGlnThrThrSerSerLeuSerAlaSerLeuGly151015AspArgValThrPheSerCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnGlnProAspGlyThrIleLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleThrAsnLeuGluGln65707580GluAspIleAlaThrTyrPheCysGlnGlnGlySerAlaLeuProTyr859095ThrPheGlyGlyGlyThrLysLeuGluIleLys100105<210>21<211>107<212>PRT<213>人工序列<220><223>c219D6,轻链,VL<400>21AspIleGlnMetThrGlnThrThrSerSerLeuSerAlaSerLeuGly151015AspArgValThrIleSerCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnGlnProAspGlyThrValLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleSerAsnLeuGluGln65707580GluAspIleAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysLeuGluIleLys100105<210>22<211>107<212>PRT<213>人工序列<220><223>c213B10,轻链,VL<400>22AspIleGlnMetThrGlnThrThrSerSerLeuSerAlaSerLeuGly151015AspArgValThrIleSerCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnGlnProAspGlyThrIleLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleThrAsnLeuGluGln65707580GluAspIleAlaThrTyrPheCysGlnGlnGlySerAlaLeuProTyr859095ThrPheGlyGlyGlyThrLysLeuGluIleLys100105<210>23<211>449<212>PRT<213>人工序列<220><223>c208F2,重链,全长<400>23GlnValGlnLeuGlnGlnSerGlyProGluLeuValLysProGlyAla151015SerValLysMetSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleTyrTrpValLysGlnArgProGlyGlnGlyLeuGluTrpLeu354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluLysPhe505560LysAspLysThrThrLeuThrAlaAspLysSerSerAsnThrAlaTyr65707580MetPheLeuSerSerLeuThrSerGluAspSerAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyAlaSerValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>24<211>449<212>PRT<213>人工序列<220><223>c212A11,重链,全长<400>24GlnValGlnLeuGlnGlnSerGlyProGluLeuValLysProGlyAla151015SerValLysMetSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValLysGlnArgProGlyGlnGlyLeuGluTrpIle354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluLysPhe505560LysGlyLysThrThrLeuThrAlaAspLysSerSerSerThrAlaTyr65707580MetPheLeuSerSerLeuThrSerGluAspSerAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyAlaSerValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>25<211>449<212>PRT<213>人工序列<220><223>c214F8,重链,全长<400>25GlnValGlnLeuGlnGlnSerGlySerGluLeuValLysProGlyAla151015SerValLysLeuSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValLysGlnArgProGlyGlnGlyLeuGluTrpIle354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluArgPhe505560LysGlyLysThrThrLeuThrAlaAspLysSerSerSerThrAlaTyr65707580MetPheLeuSerSerLeuThrSerGluAspSerAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyAlaSerValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>26<211>449<212>PRT<213>人工序列<220><223>c219D6,重链,全长<400>26GlnValGlnLeuGlnGlnSerGlyProGluLeuValLysProGlyAsp151015SerValLysMetSerCysLysAlaSerGlyTyrSerPheThrSerTyr202530PheIleHisTrpValLysGlnArgProGlyGlnGlyLeuGluTrpIle354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluLysPhe505560LysGlyLysThrThrLeuThrThrAspLysSerSerSerThrAlaTyr65707580MetPheLeuAsnSerLeuThrSerGluAspSerAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyAlaSerValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>27<211>449<212>PRT<213>人工序列<220><223>c213B10,重链,全长<400>27GlnValGlnLeuGlnGlnSerGlySerGluLeuValLysProGlyAla151015SerValLysMetSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValLysGlnArgProGlyGlnGlyLeuGluTrpIle354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluArgPhe505560LysGlyLysThrThrLeuThrAlaAspLysSerSerSerThrAlaTyr65707580MetPheLeuSerSerLeuThrSerGluAspSerAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyAlaSerValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>28<211>214<212>PRT<213>人工序列<220><223>c208F2,轻链,全长<400>28AspIleGlnMetThrGlnThrThrSerSerLeuSerAlaSerLeuGly151015AspArgValThrIleSerCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnGlnProAspGlyThrIleLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleSerAsnValGluGln65707580GluAspIleAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysLeuGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>29<211>214<212>PRT<213>人工序列<220><223>c212A11,轻链,全长<400>29AspIleGlnMetThrGlnThrThrSerSerLeuSerAlaSerLeuGly151015AspArgValThrIleSerCysArgAlaSerGlnAspIleAsnLysTyr202530LeuAsnTrpTyrGlnGlnGlnProAspGlyThrValLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleSerAsnLeuGluGln65707580GluAspIleAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysLeuGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>30<211>214<212>PRT<213>人工序列<220><223>c214F8,轻链,全长<400>30AspIleGlnMetThrGlnThrThrSerSerLeuSerAlaSerLeuGly151015AspArgValThrPheSerCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnGlnProAspGlyThrIleLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleThrAsnLeuGluGln65707580GluAspIleAlaThrTyrPheCysGlnGlnGlySerAlaLeuProTyr859095ThrPheGlyGlyGlyThrLysLeuGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>31<211>214<212>PRT<213>人工序列<220><223>c219D6,轻链,全长<400>31AspIleGlnMetThrGlnThrThrSerSerLeuSerAlaSerLeuGly151015AspArgValThrIleSerCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnGlnProAspGlyThrValLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleSerAsnLeuGluGln65707580GluAspIleAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysLeuGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>32<211>214<212>PRT<213>人工序列<220><223>c213B10,轻链,全长<400>32AspIleGlnMetThrGlnThrThrSerSerLeuSerAlaSerLeuGly151015AspArgValThrIleSerCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnGlnProAspGlyThrIleLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleThrAsnLeuGluGln65707580GluAspIleAlaThrTyrPheCysGlnGlnGlySerAlaLeuProTyr859095ThrPheGlyGlyGlyThrLysLeuGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>33<211>120<212>PRT<213>人工序列<220><223>hz208F2(var.1)重链,VH<400>33GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyIleIleTrpProGlyAspGlySerThrSerTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>34<211>120<212>PRT<213>人工序列<220><223>hz208F2(var.3),VH<400>34GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysMetSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleTyrTrpValLysGlnAlaProGlyGlnGlyLeuGluTrpLeu354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluLysPhe505560GlnGlyArgValThrLeuThrAlaAspLysSerSerAsnThrAlaTyr65707580MetPheLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>35<211>107<212>PRT<213>人工序列<220><223>hz208F2(var.1),VL<400>35AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrTyrThrSerSerLeuGlnSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>36<211>107<212>PRT<213>人工序列<220><223>hz208F2(var.3),VL<400>36AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleSerCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleSerAsnLeuGlnPro65707580GluAspPheAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>37<211>449<212>PRT<213>人工序列<220><223>hz208F2(var.1),重链,全长<400>37GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyIleIleTrpProGlyAspGlySerThrSerTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>38<211>449<212>PRT<213>人工序列<220><223>hz208F2(var.3),重链全长<400>38GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysMetSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleTyrTrpValLysGlnAlaProGlyGlnGlyLeuGluTrpLeu354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluLysPhe505560GlnGlyArgValThrLeuThrAlaAspLysSerSerAsnThrAlaTyr65707580MetPheLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>39<211>214<212>PRT<213>人工序列<220><223>hz208F2(var.1),轻链,全长<400>39AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrTyrThrSerSerLeuGlnSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysValGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>40<211>214<212>PRT<213>人工序列<220><223>hz208F2(var.3),轻链,全长<400>40AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleSerCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleSerAsnLeuGlnPro65707580GluAspPheAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysValGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>41<211>120<212>PRT<213>人工序列<220><223>hz208F2(var.2)重链,VH<220><221>MISC_FEATURE<222>(20)..(20)<223>Met可以被Val代替<220><221>MISC_FEATURE<222>(34)..(34)<223>Ile可以被Met代替<220><221>MISC_FEATURE<222>(35)..(35)<223>Tyr可以被His代替<220><221>MISC_FEATURE<222>(38)..(38)<223>Lys可以被Arg代替<220><221>MISC_FEATURE<222>(48)..(48)<223>Leu可以被Met代替<220><221>MISC_FEATURE<222>(50)..(50)<223>Trp可以被Ile代替<220><221>MISC_FEATURE<222>(59)..(59)<223>Lys可以被Ser代替<220><221>MISC_FEATURE<222>(61)..(61)<223>Asn可以被Ala代替<220><221>MISC_FEATURE<222>(62)..(62)<223>Glu可以被Gln代替<220><221>MISC_FEATURE<222>(70)..(70)<223>Leu可以被Met代替<220><221>MISC_FEATURE<222>(72)..(72)<223>Ala可以被Arg代替<220><221>MISC_FEATURE<222>(74)..(74)<223>Lys可以被Thr代替<220><221>MISC_FEATURE<222>(76)..(76)<223>Ser可以被Thr代替<220><221>MISC_FEATURE<222>(77)..(77)<223>Asn可以被Ser代替<220><221>MISC_FEATURE<222>(79)..(79)<223>Ala可以被Val代替<220><221>MISC_FEATURE<222>(82)..(82)<223>Phe可以被Glu代替<220><221>MISC_FEATURE<222>(95)..(95)<223>Phe可以被Tyr代替<400>41GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysMetSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleTyrTrpValLysGlnAlaProGlyGlnGlyLeuGluTrpLeu354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAsnGluLysPhe505560GlnGlyArgValThrLeuThrAlaAspLysSerSerAsnThrAlaTyr65707580MetPheLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>42<211>107<212>PRT<213>人工序列<220><223>hz208F2(var.2),轻链,VL<220><221>MISC_FEATURE<222>(22)..(22)<223>Ser可以被Thr代替<220><221>MISC_FEATURE<222>(53)..(53)<223>Arg可以被Ser代替<220><221>MISC_FEATURE<222>(55)..(55)<223>His可以被Gln代替<220><221>MISC_FEATURE<222>(65)..(65)<223>Arg可以被Ser代替<220><221>MISC_FEATURE<222>(71)..(71)<223>Tyr可以被Phe代替<220><221>MISC_FEATURE<222>(72)..(72)<223>Ser可以被Thr代替<220><221>MISC_FEATURE<222>(77)..(77)<223>Asn可以被Ser代替<220><221>MISC_FEATURE<222>(87)..(87)<223>Phe可以被Tyr代替<400>42AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleSerCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleSerAsnLeuGlnPro65707580GluAspPheAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>43<211>329<212>PRT<213>人工序列<220><223>恒定结构域(VH)IgG1<400>43AlaSerThrLysGlyProSerValPheProLeuAlaProSerSerLys151015SerThrSerGlyGlyThrAlaAlaLeuGlyCysLeuValLysAspTyr202530PheProGluProValThrValSerTrpAsnSerGlyAlaLeuThrSer354045GlyValHisThrPheProAlaValLeuGlnSerSerGlyLeuTyrSer505560LeuSerSerValValThrValProSerSerSerLeuGlyThrGlnThr65707580TyrIleCysAsnValAsnHisLysProSerAsnThrLysValAspLys859095ArgValGluProLysSerCysAspLysThrHisThrCysProProCys100105110ProAlaProGluLeuLeuGlyGlyProSerValPheLeuPheProPro115120125LysProLysAspThrLeuMetIleSerArgThrProGluValThrCys130135140ValValValAspValSerHisGluAspProGluValLysPheAsnTrp145150155160TyrValAspGlyValGluValHisAsnAlaLysThrLysProArgGlu165170175GluGlnTyrAsnSerThrTyrArgValValSerValLeuThrValLeu180185190HisGlnAspTrpLeuAsnGlyLysGluTyrLysCysLysValSerAsn195200205LysAlaLeuProAlaProIleGluLysThrIleSerLysAlaLysGly210215220GlnProArgGluProGlnValTyrThrLeuProProSerArgGluGlu225230235240MetThrLysAsnGlnValSerLeuThrCysLeuValLysGlyPheTyr245250255ProSerAspIleAlaValGluTrpGluSerAsnGlyGlnProGluAsn260265270AsnTyrLysThrThrProProValLeuAspSerAspGlySerPhePhe275280285LeuTyrSerLysLeuThrValAspLysSerArgTrpGlnGlnGlyAsn290295300ValPheSerCysSerValMetHisGluAlaLeuHisAsnHisTyrThr305310315320GlnLysSerLeuSerLeuSerProGly325<210>44<211>326<212>PRT<213>人工序列<220><223>恒定结构域(VH)IgG4(S228P)<400>44AlaSerThrLysGlyProSerValPheProLeuAlaProCysSerArg151015SerThrSerGluSerThrAlaAlaLeuGlyCysLeuValLysAspTyr202530PheProGluProValThrValSerTrpAsnSerGlyAlaLeuThrSer354045GlyValHisThrPheProAlaValLeuGlnSerSerGlyLeuTyrSer505560LeuSerSerValValThrValProSerSerSerLeuGlyThrLysThr65707580TyrThrCysAsnValAspHisLysProSerAsnThrLysValAspLys859095ArgValGluSerLysTyrGlyProProCysProProCysProAlaPro100105110GluPheLeuGlyGlyProSerValPheLeuPheProProLysProLys115120125AspThrLeuMetIleSerArgThrProGluValThrCysValValVal130135140AspValSerGlnGluAspProGluValGlnPheAsnTrpTyrValAsp145150155160GlyValGluValHisAsnAlaLysThrLysProArgGluGluGlnPhe165170175AsnSerThrTyrArgValValSerValLeuThrValLeuHisGlnAsp180185190TrpLeuAsnGlyLysGluTyrLysCysLysValSerAsnLysGlyLeu195200205ProSerSerIleGluLysThrIleSerLysAlaLysGlyGlnProArg210215220GluProGlnValTyrThrLeuProProSerGlnGluGluMetThrLys225230235240AsnGlnValSerLeuThrCysLeuValLysGlyPheTyrProSerAsp245250255IleAlaValGluTrpGluSerAsnGlyGlnProGluAsnAsnTyrLys260265270ThrThrProProValLeuAspSerAspGlySerPhePheLeuTyrSer275280285ArgLeuThrValAspLysSerArgTrpGlnGluGlyAsnValPheSer290295300CysSerValMetHisGluAlaLeuHisAsnHisTyrThrGlnLysSer305310315320LeuSerLeuSerLeuGly325<210>45<211>107<212>PRT<213>人工序列<220><223>κ结构域(VL)<400>45ArgThrValAlaAlaProSerValPheIlePheProProSerAspGlu151015GlnLeuLysSerGlyThrAlaSerValValCysLeuLeuAsnAsnPhe202530TyrProArgGluAlaLysValGlnTrpLysValAspAsnAlaLeuGln354045SerGlyAsnSerGlnGluSerValThrGluGlnAspSerLysAspSer505560ThrTyrSerLeuSerSerThrLeuThrLeuSerLysAlaAspTyrGlu65707580LysHisLysValTyrAlaCysGluValThrHisGlnGlyLeuSerSer859095ProValThrLysSerPheAsnArgGlyGluCys100105<210>46<211>98<212>PRT<213>人工序列<220><223>人种系IGHV1-46*01<400>46GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyIleIleAsnProSerGlyGlySerThrSerTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaArg<210>47<211>95<212>PRT<213>人工序列<220><223>人种系IGKV1-39*01<400>47AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerGlnSerIleSerSerTyr202530LeuAsnTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrAlaAlaSerSerLeuGlnSerGlyValProSerArgPheSerGly505560SerGlySerGlyThrAspPheThrLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrTyrCysGlnGlnSerTyrSerThrPro859095<210>48<211>15<212>PRT<213>人工序列<220><223>人种系IGHJ4*01<400>48TyrPheAspTyrTrpGlyGlnGlyThrLeuValThrValSerSer151015<210>49<211>12<212>PRT<213>人工序列<220><223>人种系IGKJ4*01<400>49LeuThrPheGlyGlyGlyThrLysValGluIleLys1510<210>50<211>1367<212>PRT<213>人工序列<220><223>IGF-1R(人)<400>50MetLysSerGlySerGlyGlyGlySerProThrSerLeuTrpGlyLeu151015LeuPheLeuSerAlaAlaLeuSerLeuTrpProThrSerGlyGluIle202530CysGlyProGlyIleAspIleArgAsnAspTyrGlnGlnLeuLysArg354045LeuGluAsnCysThrValIleGluGlyTyrLeuHisIleLeuLeuIle505560SerLysAlaGluAspTyrArgSerTyrArgPheProLysLeuThrVal65707580IleThrGluTyrLeuLeuLeuPheArgValAlaGlyLeuGluSerLeu859095GlyAspLeuPheProAsnLeuThrValIleArgGlyTrpLysLeuPhe100105110TyrAsnTyrAlaLeuValIlePheGluMetThrAsnLeuLysAspIle115120125GlyLeuTyrAsnLeuArgAsnIleThrArgGlyAlaIleArgIleGlu130135140LysAsnAlaAspLeuCysTyrLeuSerThrValAspTrpSerLeuIle145150155160LeuAspAlaValSerAsnAsnTyrIleValGlyAsnLysProProLys165170175GluCysGlyAspLeuCysProGlyThrMetGluGluLysProMetCys180185190GluLysThrThrIleAsnAsnGluTyrAsnTyrArgCysTrpThrThr195200205AsnArgCysGlnLysMetCysProSerThrCysGlyLysArgAlaCys210215220ThrGluAsnAsnGluCysCysHisProGluCysLeuGlySerCysSer225230235240AlaProAspAsnAspThrAlaCysValAlaCysArgHisTyrTyrTyr245250255AlaGlyValCysValProAlaCysProProAsnThrTyrArgPheGlu260265270GlyTrpArgCysValAspArgAspPheCysAlaAsnIleLeuSerAla275280285GluSerSerAspSerGluGlyPheValIleHisAspGlyGluCysMet290295300GlnGluCysProSerGlyPheIleArgAsnGlySerGlnSerMetTyr305310315320CysIleProCysGluGlyProCysProLysValCysGluGluGluLys325330335LysThrLysThrIleAspSerValThrSerAlaGlnMetLeuGlnGly340345350CysThrIlePheLysGlyAsnLeuLeuIleAsnIleArgArgGlyAsn355360365AsnIleAlaSerGluLeuGluAsnPheMetGlyLeuIleGluValVal370375380ThrGlyTyrValLysIleArgHisSerHisAlaLeuValSerLeuSer385390395400PheLeuLysAsnLeuArgLeuIleLeuGlyGluGluGlnLeuGluGly405410415AsnTyrSerPheTyrValLeuAspAsnGlnAsnLeuGlnGlnLeuTrp420425430AspTrpAspHisArgAsnLeuThrIleLysAlaGlyLysMetTyrPhe435440445AlaPheAsnProLysLeuCysValSerGluIleTyrArgMetGluGlu450455460ValThrGlyThrLysGlyArgGlnSerLysGlyAspIleAsnThrArg465470475480AsnAsnGlyGluArgAlaSerCysGluSerAspValLeuHisPheThr485490495SerThrThrThrSerLysAsnArgIleIleIleThrTrpHisArgTyr500505510ArgProProAspTyrArgAspLeuIleSerPheThrValTyrTyrLys515520525GluAlaProPheLysAsnValThrGluTyrAspGlyGlnAspAlaCys530535540GlySerAsnSerTrpAsnMetValAspValAspLeuProProAsnLys545550555560AspValGluProGlyIleLeuLeuHisGlyLeuLysProTrpThrGln565570575TyrAlaValTyrValLysAlaValThrLeuThrMetValGluAsnAsp580585590HisIleArgGlyAlaLysSerGluIleLeuTyrIleArgThrAsnAla595600605SerValProSerIleProLeuAspValLeuSerAlaSerAsnSerSer610615620SerGlnLeuIleValLysTrpAsnProProSerLeuProAsnGlyAsn625630635640LeuSerTyrTyrIleValArgTrpGlnArgGlnProGlnAspGlyTyr645650655LeuTyrArgHisAsnTyrCysSerLysAspLysIleProIleArgLys660665670TyrAlaAspGlyThrIleAspIleGluGluValThrGluAsnProLys675680685ThrGluValCysGlyGlyGluLysGlyProCysCysAlaCysProLys690695700ThrGluAlaGluLysGlnAlaGluLysGluGluAlaGluTyrArgLys705710715720ValPheGluAsnPheLeuHisAsnSerIlePheValProArgProGlu725730735ArgLysArgArgAspValMetGlnValAlaAsnThrThrMetSerSer740745750ArgSerArgAsnThrThrAlaAlaAspThrTyrAsnIleThrAspPro755760765GluGluLeuGluThrGluTyrProPhePheGluSerArgValAspAsn770775780LysGluArgThrValIleSerAsnLeuArgProPheThrLeuTyrArg785790795800IleAspIleHisSerCysAsnHisGluAlaGluLysLeuGlyCysSer805810815AlaSerAsnPheValPheAlaArgThrMetProAlaGluGlyAlaAsp820825830AspIleProGlyProValThrTrpGluProArgProGluAsnSerIle835840845PheLeuLysTrpProGluProGluAsnProAsnGlyLeuIleLeuMet850855860TyrGluIleLysTyrGlySerGlnValGluAspGlnArgGluCysVal865870875880SerArgGlnGluTyrArgLysTyrGlyGlyAlaLysLeuAsnArgLeu885890895AsnProGlyAsnTyrThrAlaArgIleGlnAlaThrSerLeuSerGly900905910AsnGlySerTrpThrAspProValPhePheTyrValGlnAlaLysThr915920925GlyTyrGluAsnPheIleHisLeuIleIleAlaLeuProValAlaVal930935940LeuLeuIleValGlyGlyLeuValIleMetLeuTyrValPheHisArg945950955960LysArgAsnAsnSerArgLeuGlyAsnGlyValLeuTyrAlaSerVal965970975AsnProGluTyrPheSerAlaAlaAspValTyrValProAspGluTrp980985990GluValAlaArgGluLysIleThrMetSerArgGluLeuGlyGlnGly99510001005SerPheGlyMetValTyrGluGlyValAlaLysGlyValValLys101010151020AspGluProGluThrArgValAlaIleLysThrValAsnGluAla102510301035AlaSerMetArgGluArgIleGluPheLeuAsnGluAlaSerVal104010451050MetLysGluPheAsnCysHisHisValValArgLeuLeuGlyVal105510601065ValSerGlnGlyGlnProThrLeuValIleMetGluLeuMetThr107010751080ArgGlyAspLeuLysSerTyrLeuArgSerLeuArgProGluMet108510901095GluAsnAsnProValLeuAlaProProSerLeuSerLysMetIle110011051110GlnMetAlaGlyGluIleAlaAspGlyMetAlaTyrLeuAsnAla111511201125AsnLysPheValHisArgAspLeuAlaAlaArgAsnCysMetVal113011351140AlaGluAspPheThrValLysIleGlyAspPheGlyMetThrArg114511501155AspIleTyrGluThrAspTyrTyrArgLysGlyGlyLysGlyLeu116011651170LeuProValArgTrpMetSerProGluSerLeuLysAspGlyVal117511801185PheThrThrTyrSerAspValTrpSerPheGlyValValLeuTrp119011951200GluIleAlaThrLeuAlaGluGlnProTyrGlnGlyLeuSerAsn120512101215GluGlnValLeuArgPheValMetGluGlyGlyLeuLeuAspLys122012251230ProAspAsnCysProAspMetLeuPheGluLeuMetArgMetCys123512401245TrpGlnTyrAsnProLysMetArgProSerPheLeuGluIleIle125012551260SerSerIleLysGluGluMetGluProGlyPheArgGluValSer126512701275PheTyrTyrSerGluGluAsnLysLeuProGluProGluGluLeu128012851290AspLeuGluProGluAsnMetGluSerValProLeuAspProSer129513001305AlaSerSerSerSerLeuProLeuProAspArgHisSerGlyHis131013151320LysAlaGluAsnGlyProGlyProGlyValLeuValLeuArgAla132513301335SerPheAspGluArgGlnProTyrAlaHisMetAsnGlyGlyArg134013451350LysAsnGluArgAlaLeuProLeuProGlnSerSerThrCys135513601365<210>51<211>932<212>PRT<213>人工序列<220><223>IGF-1RECD(人)<400>51MetLysSerGlySerGlyGlyGlySerProThrSerLeuTrpGlyLeu151015LeuPheLeuSerAlaAlaLeuSerLeuTrpProThrSerGlyGluIle202530CysGlyProGlyIleAspIleArgAsnAspTyrGlnGlnLeuLysArg354045LeuGluAsnCysThrValIleGluGlyTyrLeuHisIleLeuLeuIle505560SerLysAlaGluAspTyrArgSerTyrArgPheProLysLeuThrVal65707580IleThrGluTyrLeuLeuLeuPheArgValAlaGlyLeuGluSerLeu859095GlyAspLeuPheProAsnLeuThrValIleArgGlyTrpLysLeuPhe100105110TyrAsnTyrAlaLeuValIlePheGluMetThrAsnLeuLysAspIle115120125GlyLeuTyrAsnLeuArgAsnIleThrArgGlyAlaIleArgIleGlu130135140LysAsnAlaAspLeuCysTyrLeuSerThrValAspTrpSerLeuIle145150155160LeuAspAlaValSerAsnAsnTyrIleValGlyAsnLysProProLys165170175GluCysGlyAspLeuCysProGlyThrMetGluGluLysProMetCys180185190GluLysThrThrIleAsnAsnGluTyrAsnTyrArgCysTrpThrThr195200205AsnArgCysGlnLysMetCysProSerThrCysGlyLysArgAlaCys210215220ThrGluAsnAsnGluCysCysHisProGluCysLeuGlySerCysSer225230235240AlaProAspAsnAspThrAlaCysValAlaCysArgHisTyrTyrTyr245250255AlaGlyValCysValProAlaCysProProAsnThrTyrArgPheGlu260265270GlyTrpArgCysValAspArgAspPheCysAlaAsnIleLeuSerAla275280285GluSerSerAspSerGluGlyPheValIleHisAspGlyGluCysMet290295300GlnGluCysProSerGlyPheIleArgAsnGlySerGlnSerMetTyr305310315320CysIleProCysGluGlyProCysProLysValCysGluGluGluLys325330335LysThrLysThrIleAspSerValThrSerAlaGlnMetLeuGlnGly340345350CysThrIlePheLysGlyAsnLeuLeuIleAsnIleArgArgGlyAsn355360365AsnIleAlaSerGluLeuGluAsnPheMetGlyLeuIleGluValVal370375380ThrGlyTyrValLysIleArgHisSerHisAlaLeuValSerLeuSer385390395400PheLeuLysAsnLeuArgLeuIleLeuGlyGluGluGlnLeuGluGly405410415AsnTyrSerPheTyrValLeuAspAsnGlnAsnLeuGlnGlnLeuTrp420425430AspTrpAspHisArgAsnLeuThrIleLysAlaGlyLysMetTyrPhe435440445AlaPheAsnProLysLeuCysValSerGluIleTyrArgMetGluGlu450455460ValThrGlyThrLysGlyArgGlnSerLysGlyAspIleAsnThrArg465470475480AsnAsnGlyGluArgAlaSerCysGluSerAspValLeuHisPheThr485490495SerThrThrThrSerLysAsnArgIleIleIleThrTrpHisArgTyr500505510ArgProProAspTyrArgAspLeuIleSerPheThrValTyrTyrLys515520525GluAlaProPheLysAsnValThrGluTyrAspGlyGlnAspAlaCys530535540GlySerAsnSerTrpAsnMetValAspValAspLeuProProAsnLys545550555560AspValGluProGlyIleLeuLeuHisGlyLeuLysProTrpThrGln565570575TyrAlaValTyrValLysAlaValThrLeuThrMetValGluAsnAsp580585590HisIleArgGlyAlaLysSerGluIleLeuTyrIleArgThrAsnAla595600605SerValProSerIleProLeuAspValLeuSerAlaSerAsnSerSer610615620SerGlnLeuIleValLysTrpAsnProProSerLeuProAsnGlyAsn625630635640LeuSerTyrTyrIleValArgTrpGlnArgGlnProGlnAspGlyTyr645650655LeuTyrArgHisAsnTyrCysSerLysAspLysIleProIleArgLys660665670TyrAlaAspGlyThrIleAspIleGluGluValThrGluAsnProLys675680685ThrGluValCysGlyGlyGluLysGlyProCysCysAlaCysProLys690695700ThrGluAlaGluLysGlnAlaGluLysGluGluAlaGluTyrArgLys705710715720ValPheGluAsnPheLeuHisAsnSerIlePheValProArgProGlu725730735ArgLysArgArgAspValMetGlnValAlaAsnThrThrMetSerSer740745750ArgSerArgAsnThrThrAlaAlaAspThrTyrAsnIleThrAspPro755760765GluGluLeuGluThrGluTyrProPhePheGluSerArgValAspAsn770775780LysGluArgThrValIleSerAsnLeuArgProPheThrLeuTyrArg785790795800IleAspIleHisSerCysAsnHisGluAlaGluLysLeuGlyCysSer805810815AlaSerAsnPheValPheAlaArgThrMetProAlaGluGlyAlaAsp820825830AspIleProGlyProValThrTrpGluProArgProGluAsnSerIle835840845PheLeuLysTrpProGluProGluAsnProAsnGlyLeuIleLeuMet850855860TyrGluIleLysTyrGlySerGlnValGluAspGlnArgGluCysVal865870875880SerArgGlnGluTyrArgLysTyrGlyGlyAlaLysLeuAsnArgLeu885890895AsnProGlyAsnTyrThrAlaArgIleGlnAlaThrSerLeuSerGly900905910AsnGlySerTrpThrAspProValPhePheTyrValGlnAlaLysThr915920925GlyTyrGluAsn930<210>52<211>512<212>PRT<213>人工序列<220><223>IGF-1RECDN末端(人)<400>52MetLysSerGlySerGlyGlyGlySerProThrSerLeuTrpGlyLeu151015LeuPheLeuSerAlaAlaLeuSerLeuTrpProThrSerGlyGluIle202530CysGlyProGlyIleAspIleArgAsnAspTyrGlnGlnLeuLysArg354045LeuGluAsnCysThrValIleGluGlyTyrLeuHisIleLeuLeuIle505560SerLysAlaGluAspTyrArgSerTyrArgPheProLysLeuThrVal65707580IleThrGluTyrLeuLeuLeuPheArgValAlaGlyLeuGluSerLeu859095GlyAspLeuPheProAsnLeuThrValIleArgGlyTrpLysLeuPhe100105110TyrAsnTyrAlaLeuValIlePheGluMetThrAsnLeuLysAspIle115120125GlyLeuTyrAsnLeuArgAsnIleThrArgGlyAlaIleArgIleGlu130135140LysAsnAlaAspLeuCysTyrLeuSerThrValAspTrpSerLeuIle145150155160LeuAspAlaValSerAsnAsnTyrIleValGlyAsnLysProProLys165170175GluCysGlyAspLeuCysProGlyThrMetGluGluLysProMetCys180185190GluLysThrThrIleAsnAsnGluTyrAsnTyrArgCysTrpThrThr195200205AsnArgCysGlnLysMetCysProSerThrCysGlyLysArgAlaCys210215220ThrGluAsnAsnGluCysCysHisProGluCysLeuGlySerCysSer225230235240AlaProAspAsnAspThrAlaCysValAlaCysArgHisTyrTyrTyr245250255AlaGlyValCysValProAlaCysProProAsnThrTyrArgPheGlu260265270GlyTrpArgCysValAspArgAspPheCysAlaAsnIleLeuSerAla275280285GluSerSerAspSerGluGlyPheValIleHisAspGlyGluCysMet290295300GlnGluCysProSerGlyPheIleArgAsnGlySerGlnSerMetTyr305310315320CysIleProCysGluGlyProCysProLysValCysGluGluGluLys325330335LysThrLysThrIleAspSerValThrSerAlaGlnMetLeuGlnGly340345350CysThrIlePheLysGlyAsnLeuLeuIleAsnIleArgArgGlyAsn355360365AsnIleAlaSerGluLeuGluAsnPheMetGlyLeuIleGluValVal370375380ThrGlyTyrValLysIleArgHisSerHisAlaLeuValSerLeuSer385390395400PheLeuLysAsnLeuArgLeuIleLeuGlyGluGluGlnLeuGluGly405410415AsnTyrSerPheTyrValLeuAspAsnGlnAsnLeuGlnGlnLeuTrp420425430AspTrpAspHisArgAsnLeuThrIleLysAlaGlyLysMetTyrPhe435440445AlaPheAsnProLysLeuCysValSerGluIleTyrArgMetGluGlu450455460ValThrGlyThrLysGlyArgGlnSerLysGlyAspIleAsnThrArg465470475480AsnAsnGlyGluArgAlaSerCysGluSerAspValLeuHisPheThr485490495SerThrThrThrSerLysAsnArgIleIleIleThrTrpHisArgTyr500505510<210>53<211>4<212>PRT<213>人工序列<220><223>四肽(接头)<400>53GlyPheLeuGly1<210>54<211>4<212>PRT<213>人工序列<220><223>四肽(接头)<400>54AlaLeuAlaLeu1<210>55<211>5<212>PRT<213>人工序列<220><223>四肽(接头)<400>55ProValGlyValVal15<210>56<211>120<212>PRT<213>人工序列<220><223>hz208F2重链H037,VH<400>56GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspLysSerSerSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>57<211>107<212>PRT<213>人工序列<220><223>hz208F2轻链L018,VL<400>57AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrTyrThrSerArgLeuGlnSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>58<211>449<212>PRT<213>人工序列<220><223>hz208F2重链H037全长<400>58GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspLysSerSerSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>59<211>214<212>PRT<213>人工序列<220><223>hz208F2轻链L018全长<400>59AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrTyrThrSerArgLeuGlnSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspTyrSerLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysValGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>60<211>107<212>PRT<213>人工序列<220><223>hz208F2轻链L021,VL<400>60AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspPheSerLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysValGluIleLys100105<210>61<211>214<212>PRT<213>人工序列<220><223>hz208F2轻链L021全长<400>61AspIleGlnMetThrGlnSerProSerSerLeuSerAlaSerValGly151015AspArgValThrIleThrCysArgAlaSerGlnAspIleSerLysTyr202530LeuAsnTrpTyrGlnGlnLysProGlyLysAlaProLysLeuLeuIle354045TyrTyrThrSerArgLeuHisSerGlyValProSerArgPheSerGly505560ArgGlySerGlyThrAspPheSerLeuThrIleSerSerLeuGlnPro65707580GluAspPheAlaThrTyrPheCysGlnGlnGlySerThrLeuProTyr859095ThrPheGlyGlyGlyThrLysValGluIleLysArgThrValAlaAla100105110ProSerValPheIlePheProProSerAspGluGlnLeuLysSerGly115120125ThrAlaSerValValCysLeuLeuAsnAsnPheTyrProArgGluAla130135140LysValGlnTrpLysValAspAsnAlaLeuGlnSerGlyAsnSerGln145150155160GluSerValThrGluGlnAspSerLysAspSerThrTyrSerLeuSer165170175SerThrLeuThrLeuSerLysAlaAspTyrGluLysHisLysValTyr180185190AlaCysGluValThrHisGlnGlyLeuSerSerProValThrLysSer195200205PheAsnArgGlyGluCys210<210>62<211>120<212>PRT<213>人工序列<220><223>hz208F2重链H047,VH<400>62GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerSerAsnThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>63<211>449<212>PRT<213>人工序列<220><223>hz208F2重链H047全长<400>63GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerSerAsnThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>64<211>120<212>PRT<213>人工序列<220><223>hz208F2重链H049,VH<400>64GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspLysSerSerSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>65<211>449<212>PRT<213>人工序列<220><223>hz208F2重链H049全长<400>65GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspLysSerSerSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>66<211>120<212>PRT<213>人工序列<220><223>hz208F2重链H051,VH<400>66GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerSerAsnThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>67<211>449<212>PRT<213>人工序列<220><223>hz208F2重链H051全长<400>67GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerSerAsnThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>68<211>120<212>PRT<213>人工序列<220><223>hz208F2重链H052,VH<400>68GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>69<211>449<212>PRT<213>人工序列<220><223>hz208F2重链H052全长<400>69GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>70<211>120<212>PRT<213>人工序列<220><223>hz208F2重链H057,VH<400>70GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspLysSerThrAsnThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>71<211>449<212>PRT<213>人工序列<220><223>hz208F2重链H057全长<400>71GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspLysSerThrAsnThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>72<211>120<212>PRT<213>人工序列<220><223>hz208F2重链H068,VH<400>72GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrAsnThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>73<211>449<212>PRT<213>人工序列<220><223>hz208F2重链H068全长<400>73GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrAsnThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>74<211>120<212>PRT<213>人工序列<220><223>hz208F2重链H070,VH<400>74GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>75<211>449<212>PRT<213>人工序列<220><223>hz208F2重链H070全长<400>75GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>76<211>120<212>PRT<213>人工序列<220><223>hz208F2重链H071,VH<400>76GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrAsnThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>77<211>449<212>PRT<213>人工序列<220><223>hz208F2重链H071全长<400>77GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrMetHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrAsnThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>78<211>120<212>PRT<213>人工序列<220><223>hz208F2重链H076,VH<400>78GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>79<211>449<212>PRT<213>人工序列<220><223>hz208F2重链H076全长<400>79GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrTyrCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly<210>80<211>120<212>PRT<213>人工序列<220><223>hz208F2重链H077,VH<400>80GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSer115120<210>81<211>449<212>PRT<213>人工序列<220><223>hz208F2重链H077全长<400>81GlnValGlnLeuValGlnSerGlyAlaGluValLysLysProGlyAla151015SerValLysValSerCysLysAlaSerGlyTyrThrPheThrSerTyr202530TyrIleHisTrpValArgGlnAlaProGlyGlnGlyLeuGluTrpMet354045GlyTrpIleTrpProGlyAspGlySerThrLysTyrAlaGlnLysPhe505560GlnGlyArgValThrMetThrArgAspThrSerThrSerThrValTyr65707580MetGluLeuSerSerLeuArgSerGluAspThrAlaValTyrPheCys859095AlaSerProMetIleThrProAsnTyrAlaMetAspTyrTrpGlyGln100105110GlyThrLeuValThrValSerSerAlaSerThrLysGlyProSerVal115120125PheProLeuAlaProSerSerLysSerThrSerGlyGlyThrAlaAla130135140LeuGlyCysLeuValLysAspTyrPheProGluProValThrValSer145150155160TrpAsnSerGlyAlaLeuThrSerGlyValHisThrPheProAlaVal165170175LeuGlnSerSerGlyLeuTyrSerLeuSerSerValValThrValPro180185190SerSerSerLeuGlyThrGlnThrTyrIleCysAsnValAsnHisLys195200205ProSerAsnThrLysValAspLysArgValGluProLysSerCysAsp210215220LysThrHisThrCysProProCysProAlaProGluLeuLeuGlyGly225230235240ProSerValPheLeuPheProProLysProLysAspThrLeuMetIle245250255SerArgThrProGluValThrCysValValValAspValSerHisGlu260265270AspProGluValLysPheAsnTrpTyrValAspGlyValGluValHis275280285AsnAlaLysThrLysProArgGluGluGlnTyrAsnSerThrTyrArg290295300ValValSerValLeuThrValLeuHisGlnAspTrpLeuAsnGlyLys305310315320GluTyrLysCysLysValSerAsnLysAlaLeuProAlaProIleGlu325330335LysThrIleSerLysAlaLysGlyGlnProArgGluProGlnValTyr340345350ThrLeuProProSerArgGluGluMetThrLysAsnGlnValSerLeu355360365ThrCysLeuValLysGlyPheTyrProSerAspIleAlaValGluTrp370375380GluSerAsnGlyGlnProGluAsnAsnTyrLysThrThrProProVal385390395400LeuAspSerAspGlySerPhePheLeuTyrSerLysLeuThrValAsp405410415LysSerArgTrpGlnGlnGlyAsnValPheSerCysSerValMetHis420425430GluAlaLeuHisAsnHisTyrThrGlnLysSerLeuSerLeuSerPro435440445Gly当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1