一种牛支原体灭活疫苗的制备方法及应用与流程
本发明涉及一种牛支原体灭活疫苗的制备方法。
背景技术:
牛支原体(mycoplasmabovis)是引起牛呼吸道炎症、乳腺炎和关节炎等多系统炎症的重要致病性病原体之一。1961年hale等在美国首次从患乳腺炎牛的乳汁中分离得到该病原;此后在爱尔兰、南美洲及欧洲等地区均分离到牛支原体。2008年,我国湖北省暴发了以坏死性肺炎为主要特征的“传染性牛支原体肺炎”疫情,以后相继在湖北、贵州、宁夏、内蒙古、广西、重庆等地区引进犊牛中发现该病,发病率为50%~100%,病死率高达10%~50%,给我国养牛业造成了巨大的经济损失。牛支原体的免疫机制非常复杂且特殊,至今尚未完全清楚。研究表明牛支原体与宿主免疫细胞相互作用能产生两种现象:免疫增强和免疫抑制。由于牛支原体基因的dna高频率重组,表面脂蛋白具有高度的特异性,这就使牛支原体表型多变,也使得国内外有关疫苗的研究进程缓慢,只有美国将商品化的牛支原体疫苗投放市场,目前只有唯一的呼吸道合胞病毒、副流感2型和3型、特异支原体和牛支原体四联灭活苗用于牛支原体感染,能提供短暂的保护作用且副作用大。近年来有人用福尔马林灭活牛支原体后研制出了牛支原体全细胞灭活苗,但它对由牛支原体引发的乳房炎没有效果。据1981年和1987年的牛支原体疫苗保护性试验发现,当时存在的疫苗对牛的支原体性肺炎具有一定效果,但有的疫苗反而会加剧牛支原体的感染。1987年barite等用仓鼠对牛支原体菌苗和福尔马林灭活苗做了检测,两种疫苗可以预防牛支原体肺炎,但是两者的交互作用无法辨别。美国虽有两种商品化疫苗,但2011年有人对这两种疫苗的保护性做了测试,通过27d小牛免疫试验表明,两种疫苗中一种可以明显提高抗体水平,但是对牛的保护率约44%;另外一种疫苗的免疫效果不显著。
技术实现要素:
本发明公开了一种牛支原体灭活疫苗的制备方法。本发明从牛支原体灭活疫苗的制备的甲醛灭活条件,牛支原体灭活疫苗免疫剂量,牛支原体灭活疫苗的免疫方式,牛支原体灭活疫苗使用的佐剂及临床应用上进行探究,探寻出了最佳的牛支原体甲醛灭活条件、牛支原体灭活疫苗的免疫剂量、牛支原体灭活疫苗的免疫方式和免疫佐剂。
本发明主要是制备一种牛支原体疫苗。其主要包括牛支原体灭活疫苗的制备的甲醛灭活条件的筛选,牛支原体灭活疫苗免疫剂量筛选,牛支原体灭活疫苗的免疫方式筛选,牛支原体灭活疫苗使用的佐剂筛选。
牛支原体灭活疫苗的制备的甲醛灭活条件研究
将冻存的m.bovis菌株复苏后,接种到m.bovis液体培养基,在一定条件下进行培养,3d后传代,测出第四代m.bovis培养物中ccu含量,按一定比例浓缩后得到1.0×1010ccu/ml的m.bovis培养物备用,在培养物中加入甲醛(分析纯)使其终浓度分别为0.3%、0.4%、0.5%,充分混合后在同样的条件下培养,每隔12h测定m.bovisccu含量,每个浓度测定3次,取平均值。当ccu含量为0时将培养物以16000r/min离心30min,将得到的沉淀用0.1mol/l的pbs洗涤3次,然后以1:10在液体培养基中盲传3代同时接种固体培养基观察灭活效果。
牛支原体灭活疫苗免疫剂量研究
将12只试验动物分为a、b、c、d4组,每组3只(雌雄搭配,体重搭配),以免疫前一天记为0d,在实验第1d用试验三中保存的未加佐剂1.0×1010ccu/ml的疫苗通过肌注的方式对a、b、c组试验动物进行免疫,a组1ml/只,b组2ml/只,c组3ml/只;第15d时以同样的方式和剂量进行加强免疫,d组不做任何处理为阴性对照。从0d起每隔10d颈静脉采血,连续7次,每次采血1ml以3000r/min的转速离心20min分离血清,将血清置于-80℃的冰箱保存备用。
牛支原体灭活疫苗的免疫方式研究
将试验动物隔离饲养一周适应实验环境,将9只试验动物分为a、b、c3组,每组3只(雌雄搭配,体重搭配),以免疫前一天为0d,在实验第1d用试验三中保存的未加佐剂1.0×1010ccu/ml的疫苗对试验动物进行免疫,a组以滴鼻的方法注射1ml/只,b组以肌注的方法注射1ml/只,c组以皮下注射的方法进行1ml/只;第15d时以同样的方式和剂量加强免疫,从0d起每隔10d颈静脉采血,连续7次,每次采血1-2ml以3000r/min的转速离心20min分离血清,将血清于-80℃的冰箱保存备用。
牛支原体灭活疫苗使用的佐剂研究
将试验动物隔离饲养一周观察临床症状,待试验动物适应新环境后开始实验,将12只试验动物分为a、b、c、d4组,每组3只(雌雄搭配,体重搭配),以免疫前一天为0d,在实验第1d用试验三中保存的疫苗对试验动物进行免疫,a组肌注5×109ccu/ml的氢氧化铝佐剂灭活苗1ml/只,b组肌注5×109ccu/ml的弗式完全佐剂灭活苗1ml/只,c组肌注5×109ccu/ml的白油佐剂灭活苗1ml/只,d组肌注×109ccu/ml的未加佐剂灭活苗1ml/只,第15d时以同样的方式和剂量注射同种疫苗来加强免疫,从0d起每隔10d颈静脉采血一次,连续采血7次,每次采血1ml以3000r/min的转速离心20min分离血清,将血清于-80℃的冰箱保存备用。
牛支原体疫苗的制备及临床应用
将牛支原体以1:100的比例接种到牛支原体thiaucourt’s液体培养基中,5%c02,37℃条件下培养3d得到f1代菌液,再将f1菌液以1:100接种到液体培养基中,5%c02,37℃条件下培养3d得到f2,将f2培养物以1:10接种到液体培养基中,5%c02,37℃条件下培养3d得到f3代菌液;然后测定f3代菌液浓度(ccu/ml)并在f3代菌液中加入甲醛溶液,使菌液中甲醛终浓度为0.4%,37℃条件下灭活,2d后抽取灭活菌液接种于thiaucourt’s固体培养基进行检活。将灭活后并未检测到活菌的f3代灭活菌液16000r/min离心30min,将得到的沉淀物经用理盐水缓冲液洗涤3次,然后用生理盐水将沉淀物稀释至原来浓度。洗涤后的灭活菌液与白油佐剂进行等体积混合,100w,间隔2s,10min超声乳化。然后接种于牛只进行临床观察、病理组织学观察和抗体水平检测。
附图说明
图1为支原体含量随不同灭活时间的变化曲线。
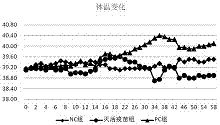
图2为体温变化趋势。
图3为pc组病理剖检病变组织。
图4为pc组肺脏:细支气管缩小,皱襞增多,官腔内有少量脱落的上皮细胞100×。
图5为pc组肺脏:细支气管缩小,皱襞增多400×。
图6为pc组肺脏:肺泡塌陷、肺泡隔增厚,组织增生100×。
图7为pc组肺脏:肺泡塌陷,肺泡隔增厚,肺泡腔内有少量细胞脱落400×。
实施例1:
1、牛支原体灭活疫苗的制备的甲醛灭活条件研究
将冻存的m.bovis菌株复苏后,接种到m.bovis液体培养基,在一定条件下进行培养,3d后传代,测出第四代m.bovis培养物中ccu含量,按一定比例浓缩后得到1.0×1010ccu/ml的m.bovis培养物备用,在培养物中加入甲醛(分析纯)使其终浓度分别为0.3%、0.4%、0.5%,充分混合后在同样的条件下培养,每隔12h测定m.bovisccu含量,每个浓度测定3次,取平均值。当ccu含量为0时将培养物以16000r/min离心30min,将得到的沉淀用0.1mol/l的pbs洗涤3次,然后以1:10在液体培养基中盲传3代同时接种固体培养基观察灭活效果。
由图1可知:不同浓度的甲醛都能将m.bovis菌株彻底灭活,浓度越大灭活时间越短。
由表1所示:三种浓度的甲醛处理后,0.4%的甲醛处理后甲醛含量最低。
综上所述,0.4%的甲醛进行48h灭活,效果最好。
2、牛支原体灭活疫苗免疫剂量研究
将12只新西兰大白兔分为a、b、c、d4组,每组3只(雌雄搭配,体重搭配),以免疫前一天记为0d,在实验第1d用试验三中保存的未加佐剂1.0×1010ccu/ml的疫苗通过肌注的方式对a、b、c组试验动物进行免疫,a组1ml/只,b组2ml/只,c组3ml/只;第15d时以同样的方式和剂量进行加强免疫,d组不做任何处理为阴性对照。从0d起每隔10d颈静脉采血,连续7次,每次采血1ml以3000r/min的转速离心20min分离血清,将血清置于-80℃的冰箱保存备用。
由表2可知,3ml/只剂量的试验组在免疫后10d牛支原体抗体水平最高,免疫效果最好。
3、牛支原体灭活疫苗的免疫方式研究
将新西兰大白兔隔离饲养一周适应实验环境,将9只试验动物分为a、b、c3组,每组3只(雌雄搭配,体重搭配),以免疫前一天为0d,在实验第1d用试验三中保存的未加佐剂1.0×1010ccu/ml的疫苗对试验动物进行免疫,a组以滴鼻的方法注射1ml/只,b组以肌注的方法注射1ml/只,c组以皮下注射的方法进行1ml/只;第15d时以同样的方式和剂量加强免疫,从0d起每隔10d颈静脉采血,连续7次,每次采血1-2ml以3000r/min的转速离心20min分离血清,将血清于-80℃的冰箱保存备用。
由表3可知:三种免疫方式都能达到一定的免疫效果,其中通过滴鼻免疫后效果最差,皮下和肌肉注射后都能在十天内达到较高的抗体水平但通过皮下注射较肌肉注射维持时间较短,因此肌注为最佳的免疫方式。
4、牛支原体灭活疫苗使用的佐剂研究
将新西兰大白兔隔离饲养一周观察临床症状,待试验动物适应新环境后开始实验,将12只试验动物分为a、b、c、d4组,每组3只(雌雄搭配,体重搭配),以免疫前一天为0d,在实验第1d用试验三中保存的疫苗对试验动物进行免疫,a组肌注5×109ccu/ml的氢氧化铝佐剂灭活苗1ml/只,b组肌注5×109ccu/ml的弗式完全佐剂灭活苗1ml/只,c组肌注5×109ccu/ml的白油佐剂灭活苗1ml/只,d组肌注5×109ccu/ml的未加佐剂灭活苗1ml/只,第15d时以同样的方式和剂量注射同种疫苗来加强免疫,从0d起每隔10d颈静脉采血一次,连续采血7次,每次采血1ml以3000r/min的转速离心20min分离血清,将血清于-80℃的冰箱保存备用。
由表4和表5可知:所有试验组在初免10d后都出现阳性,b、c组在初免10d后抗体水平达到最高,在整个实验过程中一直保持较高的抗体水平,a、d组结果相似,虽然抗体水平都能达到最高,但与b、c组相比阳转速度缓慢,抗体水平较弱,高抗体水平维持时间相对较短,可见b、c组的免疫效果较a、d组强。取b、c组兔子二免15d后的血清倍比稀释后测定抗体滴度,结果显示b组兔子血清稀释102倍时抗体水平开始直线下降,稀释到106时即表现为阴性,即抗体滴度为105,c组兔子抗体滴度为106,血清稀释到107时表现为阴性,显然c组抗体水平较b组较高,c组的免疫性较b组强。因此白油佐剂免疫效果最佳。
5、牛支原体疫苗的制备及临床应用
将牛支原体以1:100的比例接种到牛支原体thiaucourt’s液体培养基中,5%c02,37℃条件下培养3d得到f1代菌液,再将f1菌液以1:100接种到液体培养基中,5%c02,37℃条件下培养3d得到f2,将f2培养物以1:10接种到液体培养基中,5%c02,37℃条件下培养3d得到f3代菌液;然后测定f3代菌液浓度(ccu/ml)并在f3代菌液中加入甲醛溶液,使菌液中甲醛终浓度为0.4%,37℃条件下灭活,2d后抽取灭活菌液接种于thiaucourt’s固体培养基进行检活。将灭活后并未检测到活菌的f3代灭活菌液16000r/min离心30min,将得到的沉淀物经用理盐水缓冲液洗涤3次,然后用生理盐水将沉淀物稀释至原来浓度。洗涤后的灭活菌液与白油佐剂进行等体积混合,100w,间隔2s,10min超声乳化。
购买的15头2月龄荷斯坦犊牛,购买前采集公牛鼻拭子进行支原体的分离鉴定并采集血液样本分离血清,利用牛支原体抗体检测试剂盒进行牛支原体抗体检测。选取检测为阴性并未检测到支原体病原的犊牛作为试验对象。将15头合格的公牛分为3组每组5头。分别为阴性对照组(nc)、阳性对照组(pc)、疫苗组。疫苗组的每头牛均间隔两周肌肉注射5ml1ˣ1010ccu/ml的牛支原体灭活疫苗1次,共2次;pc组肌肉注射5ml1ˣ1010ccu/ml剂量的牛支原体毒株进行感染。在第2次疫苗免疫后第15d,疫苗组肌肉注射5ml1ˣ1010ccu/ml剂量的牛支原体毒株进行感染试验,连续感染3d,nc组肌肉注射同等剂量的thiaucourt’s液体培养基,持续观察28d。
在0-15d,每天7:00-8:00测量体温一次,15d以后每隔一天测一次体温,直至感染试验结束;0d(第一次免疫)前一周采集血清1次,0d后,每隔1周分别对3组试验牛采集血液并分离血清1次,直至感染结束后3周结束。感染后28d,将pc、nc和试验组牛只进行病理剖检,并采集牛只肺脏、气管、喉头、心脏、肾脏组织固定于10%福尔马林溶液,固定7d后,石蜡包埋,he染色,光学显微镜下观察。
动物感染后开始,每周对3组试验牛采集鼻拭子1次,并用pbs进行稀释。将鼻拭子接种在thiaucourt’s液体培养基中和固体培养基co2培养箱5%co237℃培养,培养2d后镜检固体培养基上的菌落形态;,利用0.22μm细菌过滤器过滤菌液,并接种于液体培养基进行培养,培养2d后提取培养物dna并利用16srrna引物进行支原体鉴定和uvrc引物进行牛支原体和无乳支原体鉴定。动物感染试28d后进行牛只病理剖检,采集牛只关节液、胸腔积液、心包液和肺脏组织。将采集的肺脏组织表面用火焰灭菌,剪取肺脏深部组织一小块,然后无菌操作条件下接种于牛支原体thiaucourt’s液体筛选培养基中和牛支原体thiaucourt’s固体筛选培养基,每份病料样品接种3个液体培养基和3个固体培养基。固体培养基置于co2培养箱5%co237℃培养2d后,显微镜下观察菌落形态;液体培养基于37℃恒温摇床培养2d后观察培养基颜色变化情况,将变黄的培养液用0.22um除菌滤膜过滤,重复培养过滤液后提取dna进行牛支原体分子生物学鉴定。
在试验期间,nc组体温一直维持39.10℃~39.50℃之间,在牛正常体温之内;pc组从第15d开始高于39.50℃,并呈升高的趋势,最高体温40.40℃,与nc组的最大体温差为1.15℃,差异显著(p<0.05);灭活疫苗组第1次接种疫苗体温变化不明显,第2次接种疫苗后体温略有升高,最高体温39.60℃,与nc组差异不显著(p>0.05),感染试验后最高体温39.6℃,与nc组相比差异不显著(p>0.05)(图2)。
灭活疫苗组剖检发现:肺脏、喉头、心脏、肝脏、气管、肾脏和关节组织均无肉眼可见病变。pc组剖检发现:肺脏组织黏连、肺脏出血淤血、肺脏组织发生实质性肉变及大小不等的灰白色干酪样或化脓性坏死灶、肺脏组织内部出血并有化脓性和干酪样坏死灶,其他组织均无肉眼可见病理变化(图3)。
灭活疫苗组肺脏和气管组织无明显病理组织学变化(图4-图7),pc组可见细支气管缩小,皱襞增多,官腔内有少量脱落的上皮细胞,肺泡塌陷、肺泡隔增厚,组织增生,肺泡腔内有少量细胞脱落。
灭活疫苗组在接种牛支原体灭活疫苗后1周抗体水平开始升高,与0周差异不显著(p>0.05),第2周牛支原体抗体呈阳性并持续升高,与0周差异极显著(p<0.01),第3周达到最大值,第4周-第6周牛支原体抗体水平处于较为稳定状态;第6周牛支原体病原感染以后,牛支原体抗体水平在第7周达到最大值,并处于稳定状态。nc组牛只牛支原体抗体水平较为稳定呈阴性,差异不显著(p>0.05)。nc组在整个试验阶段牛支原体抗体检测均为阴性且抗体水平较稳定,差异不显著(p>0.05)。pc组牛只牛支原体抗体在感染一周后一直处于较高的水平,在整个试验阶段呈阳性。
综上所述:牛支原体灭活疫苗在临床应用中与阴性和阳性对照相比,抗体可维持在较高水平;动物感染试验后,灭活疫苗组犊牛无病理组织学变化,而且未检测到牛支原体病原的存在。说明,本发明的牛支原体灭活疫苗对于牛支原体病原的预防具有良好的效果。
- 还没有人留言评论。精彩留言会获得点赞!