放射性纳米颗粒及其制造和使用方法与流程
相关申请的交叉引用
本申请要求于2015年5月22日提交的美国专利申请序列号14/719,921的优先权,其为于2011年6月15日提交的美国专利申请序列号13/161,251的部分继续申请,其依照35u.s.c.§119(e)要求于2010年6月16日提交的美国临时专利申请序列号61/355,364的优先权,这些专利申请各自据此以引用的方式整体并入。
关于联邦资助研究的声明
本发明得到由美国国家科学基金会提供的合同eccs-0901849的政府资助。政府对本发明享有某些权利。
发明领域
本发明涉及放射性纳米颗粒以及制造和使用放射性纳米颗粒的方法,包括用于近距离放射疗法。
背景
放射性同位素在治疗如癌症的疾病中的使用可追溯到20世纪初。具体说来,局部放射疗法变为许多癌症的标准治疗选择。为了将放射线限制于肿瘤位点,两种通用方法目前应用于临床实践中:(1)使用放射性药物的全身放射性同位素疗法,和(2)“密封源”放射疗法或近距离放射疗法。在第一种方法中,向患者全身施用放射性构建体。然后将施用的构建体通过代谢或特定的生物事件靶向肿瘤。发射β-粒子、α-粒子或俄歇电子(augerelectron)的放射性核素已用于此方法中。遗憾的是,许多放射性药物在肿瘤位点内的靶向功效和滞留率仍是尚待解决的主要问题。正常组织对放射性药物的非所需的摄取也仍然是全身放射疗法存在的一个问题。
在近距离放射疗法中,将放射源放入肿瘤体积中或紧挨着肿瘤体积。在先前的近距离放射疗法方法中,将放射性同位素包封于毫米尺寸的金属容器或胶囊中以确保辐射源保持在所需位置处,如植入位点。另外,由于对穿透金属胶囊的需要,发射γ或x射线的放射性同位素通常用于先前的近距离放射疗法方法中。对于临床应用,近距离放射疗法胶囊或“种子”通过手术操作永久地放入肿瘤中。由近距离放射疗法种子发射的放射线因此用于“由内向外地”治疗肿瘤,而不会与外放射疗法横穿同样多的正常组织。然而,毫米尺寸的近距离放射疗法种子的手术植入可引起许多不良副作用且极大地限制了近距离放射疗法对于不同肿瘤类型、大小和位置的应用。
因此,仍需要改进的放射性组合物,包括用于医学应用,如疾病的放射治疗。
概述
一方面,本文描述了放射性纳米颗粒,其在一些情况下可提供与一些其它纳米颗粒相比的一个或多个优点。例如,在一些情况下,本文所述的放射性纳米颗粒能够实现非手术的近距离放射疗法。具体说来,本文所述的放射性纳米颗粒可作为高度分散的和均匀的溶液或胶体被注射到肿瘤位点中。此外,放射性纳米颗粒可保留在注射位点处持续很长时间。以此方式,本文所述的组合物可避免与手术有关的一些并发症和不良影响,同时还提供改进的疗效。此外,本文所述的放射性纳米颗粒还可扩展有待用于具有小尺寸的肿瘤和/或位于更难通过手术方式安全进入的患者区域内的肿瘤的近距离放射疗法的能力。另外,本文所述的放射性纳米颗粒也可允许使用放射性同位素(其为β-发射体而非γ射线或x射线发射体)进行近距离放射疗法。因此,本文所述的组合物可大体上扩大近距离放射疗法模式的范围。本公开的放射性纳米颗粒的其它优点在下文中进一步描述。
在一些实施方案中,本文所述的放射性纳米颗粒包括金属纳米颗粒核心、设置在所述金属纳米颗粒核心上方的金属外壳、及设置在所述金属纳米颗粒核心内或所述金属外壳内的金属放射性同位素。另外,在一些实施方案中,本文所述的放射性纳米颗粒还包括设置在金属纳米颗粒核心与金属外壳之间的金属内壳。如下文中进一步描述,金属纳米颗粒核心、金属外壳及金属内壳可包括多种金属或由多种金属形成。此外,所述核心、外壳及内壳可具有相同或不同的金属组成。另外,在一些情况下,本文所述的放射性纳米颗粒具有约30-500nm或约80-200nm的三维尺寸。此外,在一些情况下,本文所述的组合物包含多个或一群放射性纳米颗粒,且所述多个或放射性纳米颗粒群展现窄的尺寸分布。
另一方面,本文描述了制造放射性纳米颗粒的方法。在一些实施方案中,制造放射性纳米颗粒的方法包括提供金属纳米颗粒核心并且通过第一金属或金属组合的无电沉积在所述金属纳米颗粒核心上方形成金属内壳。具体说来,第一金属或金属组合可沉积到金属纳米颗粒核心的外表面上。所述方法还包括在所述金属纳米颗粒核心上方形成金属外壳。具体说来,金属外壳可通过用第二金属或金属组合电流置换金属内壳的至少一部分而形成,其中第二金属或金属组合包含金属放射性同位素。另外,在一些情况下,第二金属或金属组合还包含非放射性金属同位素。此外,在一些情况下,形成金属外壳包括在金属内壳与金属放射性同位素之间进行第一电流置换反应,且随后在金属内壳与非放射性金属同位素之间进行第二电流置换反应。此外,如下文中进一步描述,金属放射性同位素的量与用于形成外壳的非放射性金属同位素的量相比可较小。另外,在一些实施方案中,制造本文所述的放射性纳米颗粒的方法可在不使用非金属还原剂的情况下进行。
又一方面,本文描述了进行近距离放射疗法的方法。在一些情况下,这种方法包括将本文所述的组合物设置在生物区室(如肿瘤)内。具体说来,所述组合物可包含多个本文所述的放射性纳米颗粒。例如,在某些情况下,多个放射性纳米颗粒中的至少一个包括金属纳米颗粒核心、设置在所述金属纳米颗粒核心上方的金属外壳、及设置在所述金属纳米颗粒核心内或所述金属外壳内的金属放射性同位素。此外,在一些情况下,所述放射性纳米颗粒具有约30-500nm的三维尺寸。此外,在一些实施方案中,所述组合物为多个放射性纳米颗粒的胶态分散体。另外,在一些情况下,在放射性纳米颗粒设置在肿瘤或其它生物区室中之后,至少约80%的放射性纳米颗粒保留在肿瘤或其它生物区室内持续至少3周。
在发明详述及下面的实施例中更详细地描述这些及其它实施方案。
附图简述
图1a示出了适用于本文所述的一些方法中的三电极槽。图1b为图1a的槽中的堆叠膜中的几个通道的放大图。
图2a为示出了适用于本文所述的一些方法中的氧化铝膜的顶视图的扫描电子显微术(sem)图像。图2b为示出了适用于本文所述的一些方法中的氧化铝膜的横截面的sem图像。
图3a为适用于本文所述的一些方法中的氧化铝膜的sem图像。比例尺=1μm。插图是放大图。插图比例尺=200nm。图3b为适用于本文所述的一些方法中的氧化铝膜的sem图像。比例尺=1μm。
图4为在电沉积金属上的根据本文所述的一些实施方案的中空金(au)纳米颗粒的sem图像。比例尺=1μm。
图5a为根据本文所述的一些实施方案的中空au纳米颗粒的透射电子显微术(tem)图像。比例尺=100nm。图5b为根据本文所述的一些实施方案的中空纳米颗粒的tem图像。比例尺=10nm。图5c为根据本文所述的一些实施方案的中空纳米颗粒的tem图像。比例尺=5nm。图5d为根据本文所述的一些实施方案的中空au纳米颗粒的选区电子衍射(saed)图。
图6a为在离子铣削之前根据本文所述的一些实施方案的中空au纳米颗粒的sem图像。比例尺=100nm。图6b为在离子铣削之后根据本文所述的一些实施方案的中空au纳米颗粒的sem图像。比例尺=100nm。
图7a为如通过动态光散射(dls)所测量的根据本文所述的一些实施方案的中空au纳米颗粒群的粒度分布图。平均半径为53±5nm。图7b为根据本文所述的一些实施方案的中空au纳米颗粒的sem图像。比例尺=200nm。
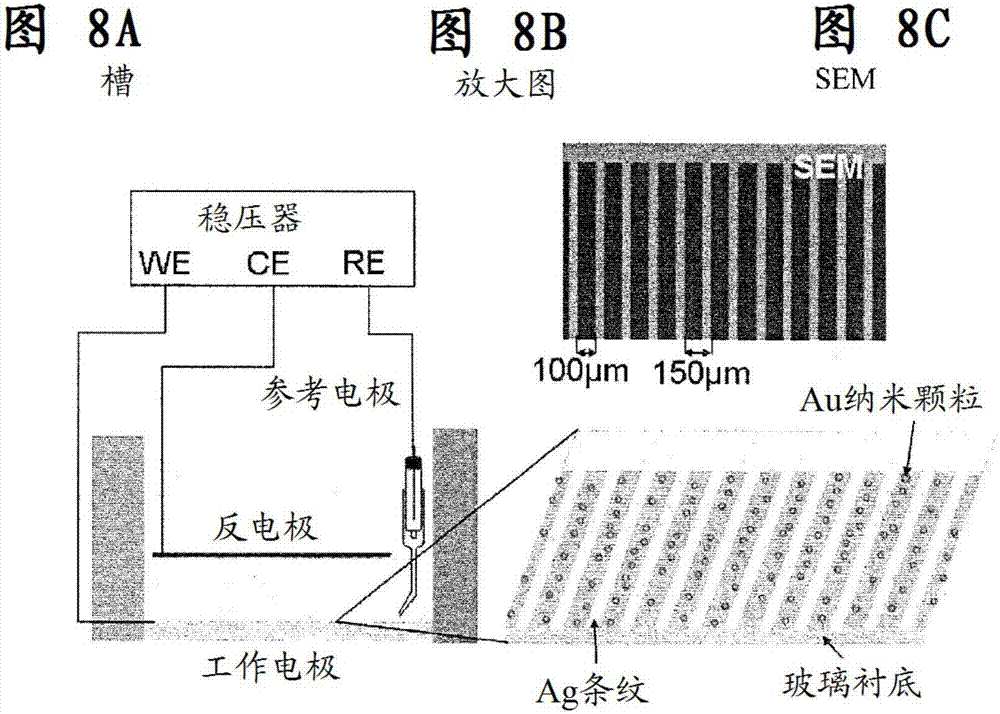
图8a示出了适用于本文所述的一些方法中的三电极槽。图8b为图8a的槽中的银/玻璃衬底的放大图。图8c为适用于本文所述的一些方法中的图案化衬底的sem图像。
图9a示出了适用于本文所述的一些方法中的衬底的光刻光掩模图案。图9b示出了适用于本文所述的一些方法中的图案化衬底,包括在二氧化硅(sio2)上的银(ag)条纹。比例尺=100μm。
图10a为在ag/sio2衬底上的根据本文所述的一些实施方案的au纳米颗粒的sem图像。比例尺=1μm。图10b为在ag/sio2衬底上的根据本文所述的一些实施方案的au纳米颗粒的sem图像。比例尺=1μm。
图11a示出了适用于本文所述的一些方法中的tem栅格,包括铜网和碳膜。图11b为在适用于本文所述的一些方法中的tem栅格的碳膜上的根据本文所述的一些实施方案的au纳米颗粒的sem图像。比例尺=1μm。
图12a为根据本文所述的一些实施方案具有多孔壳的中空au纳米颗粒的tem图像。比例尺=10nm。图12b为根据本文所述的一些实施方案具有多孔壳的中空au纳米颗粒的高分辨率tem(hr-tem)图像。比例尺=2nm。
图13为在离子铣削处理之后根据本文所述的一些实施方案的双壳纳米颗粒的sem图像。比例尺=200nm。
图14a为根据本文所述的一些实施方案的双壳纳米颗粒的sem图像。比例尺=100nm。图14b为根据本文所述的一些实施方案的双壳纳米颗粒的sem图像。比例尺=100nm。图14c为根据本文所述的一些实施方案的双壳纳米颗粒的sem图像。比例尺=100nm。图14d为根据本文所述的一些实施方案的双壳纳米颗粒的tem图像。比例尺=20nm。
图15a为根据本文所述的一些实施方案的多孔纳米颗粒的tem图像。比例尺=20nm。图15b示出了制造根据本文所述的一个实施方案的复合颗粒的方法。
图16a为根据本文所述的一些实施方案在用其它纳米颗粒装载之前根据本文所述的一些实施方案的多孔纳米颗粒的tem图像。比例尺=200nm。图16b为根据本文所述的一些实施方案在装载之后图16a的纳米颗粒的tem图像。比例尺=200nm。图16c为来自图16b的一个复合纳米颗粒的能量色散x射线光谱法(eds)光谱。图16d为来自图16b的三个复合纳米颗粒的saed图案。
图17a为含有根据本文所述的一些实施方案的复合纳米颗粒的小瓶的一系列照片。图17b为根据本文所述的一些实施方案的纳米颗粒的水性悬浮液的吸收光谱。
图18为根据本文所述的一些实施方案的纳米颗粒的干燥粉末的迟滞回线。
图19示出了制造根据本文所述的一个实施方案的复合颗粒的方法。
图20示出了制造根据本文所述的一个实施方案的纳米颗粒的方法。
图21为根据本文所述的一些实施方案的复合颗粒的拉曼光谱。
图22为根据本文所述的一些实施方案的纳米颗粒在水中和在10mm磷酸盐缓冲盐水(pbs)中的吸收光谱的比较。
图23a为通过dls测量的根据本文所述的一些实施方案的纳米颗粒的粒度分布图。图23b为根据本文所述的一些实施方案的纳米颗粒的sem图像。比例尺=5nm。
图24a为根据本文所述的一些实施方案的中空au纳米颗粒的sem图像。图24b为根据本文所述的一些实施方案的中空au纳米颗粒的sem图像。图24c为根据本文所述的一些实施方案的中空au纳米颗粒的sem图像。
图25a为根据本文所述的一些实施方案的中空au纳米颗粒的实验(实线)与模拟(虚线)吸收光谱的比较。图25b为根据本文所述的一些实施方案的中空au纳米颗粒的实验(实线)与模拟(虚线)吸收光谱的比较。图25c为根据本文所述的一些实施方案的中空au纳米颗粒的实验(实线)与模拟(虚线)吸收光谱的比较。
图26a为根据本文所述的一些实施方案的纳米颗粒的sem图像。比例尺=100nm。图26b为根据本文所述的一些实施方案的纳米颗粒的sem图像。比例尺=100nm。
图27示出了根据本文所述的一些实施方案测量光热性质的实验。
图28a为根据本文所述的一些实施方案的中空au纳米颗粒和水在不同测量距离下的一些光热性质的比较。图28b为根据本文所述的一些实施方案的中空au纳米颗粒在不同距离和时间下测量的一些光热性质的比较。图28c为水在不同距离和时间下测量的一些光热性质的比较。
图29为含有根据本文所述的一些实施方案的中空au纳米颗粒的比色皿的红外吸收图像。
图30为与实心au纳米颗粒、根据本文所述的一些实施方案的中空au纳米颗粒及水有关的温度增加的比较。
图31为一系列循环伏安测量。数据是在5mv/s的扫描频率下从开路电位至-1.0v(相对于ag/agcl)记录。测量是用不同电解质进行,包括10%亚硫酸金钠(na3au(so3)2)(水溶液)并且展现约6的ph。与用三角形标记的数据有关的电解质进一步包括氨基磺酸镍(ni(so3nh2)2)。与用圆形标记的数据有关的电解质进一步包括ni(so3nh2)2和乙二胺(eda)。
图32为根据本文所述的一些实施方案的中空au纳米颗粒尺寸相对于外加电位的图。
图33为根据本文所述的一些实施方案的中空au纳米颗粒尺寸相对于反应时间的图。
图34为水比色皿与含有根据本文所述的一些实施方案的中空au纳米颗粒的水性悬浮液(1.9×109个粒子/ml)的比色皿作为辐照时间的函数的测量温度的比较,其中使用指向比色皿中心处的近红外(nir)激光(800nm)进行辐照,入射激光功率为350mw且准直高斯光束(gaussianbeam)直径为3mm。入射光通量为1.2w/cm2。含有根据本文所述的一些实施方案的中空au纳米颗粒的比色皿的温度升高在10分钟辐照之后为38度。
图35a示出了使用米氏理论计算得出的同心中空纳米球的出的总消光、散射和吸收效率。图35b示出了具有不同尺寸的根据本文所述的一些实施方案的中空au纳米颗粒的实测吸收光谱。
图36示意性地示出了制造根据本文所述的一个实施方案的放射性纳米颗粒的方法。
图37为对应于根据本文所述的一个实施方案的放射性纳米颗粒的非放射性纳米颗粒的tem图像。插图比例尺对应于50nm。
图38为对应于根据本文所述的一个实施方案的放射性纳米颗粒的非放射性纳米颗粒的sem图像。插图比例尺对应于200nm。
图39示出了用根据本文所述的一些实施方案的放射性纳米颗粒治疗的携带肿瘤的小鼠的连续spect/ct成像。图39中的白色箭头表示肿瘤的位置。
图40示出了用根据本文所述的一些实施方案的放射性纳米颗粒治疗的小鼠的肿瘤、肝脏及脾脏的放射性(量化为注射剂量百分比/克,%id/g)的定量spect分析的结果。
图41示出了用对照组合物及根据本文所述的一些实施方案的放射性纳米颗粒治疗的小鼠的肿瘤体积。
图42示出了用对照组合物及根据本文所述的一些实施方案的放射性纳米颗粒治疗的小鼠的体重。
图43示出了用对照组合物及根据本文所述的一些实施方案的放射性纳米颗粒治疗的小鼠的连续fdg-pet/ct图像。图43中的白色箭头表示肿瘤位点。
图44示出了用对照组合物及根据本文所述的一些实施方案的放射性纳米颗粒治疗的小鼠的定量pet分析的结果。
图45示出了用对照组合物及根据本文所述的一些实施方案的放射性纳米颗粒治疗的小鼠如通过ct扫描分析所测定的肿瘤体积变化(平均值±sem)。
发明详述
参照以下详细描述、附图和实施例以及先前和之后对它们的描述可更容易理解本文所述的实施方案。然而,本文所述的要素、装置及方法不限于详细描述、附图和实施例中提出的具体实施方案。应认识到这些实施方案仅为本发明原理的说明。在不背离本发明的精神和范围的情况下,许多修改和改编将为本领域技术人员所显而易见。
另外,本文所公开的所有范围应理解为包括其中所含的任何及所有子范围。举例来说,“1.0至10.0”的所述范围应被视为包括从1.0或更大的最小值开始且以10.0或更小的最大值结束的任何及所有子范围,例如,1.0至5.3、或4.7至10.0、或3.6至7.9。
除非另外明确指出,本文所公开的所有范围还应被视为包括范围的端点。举例来说,“介于5与10之间”、“5至10”或“5-10”的范围一般应被视为包括端点5和10。
此外,当短语“至多”与数量或量相关联使用时,应理解,该量为至少可检测的数量或量。举例来说,以“至多”规定量的量存在的材料可以可检测的量且至多并包括规定量存在。
i.中空纳米颗粒
一方面,本文描述了中空纳米颗粒,在一些实施方案中,其可提供优于先前纳米颗粒的一个或多个优点。在一些实施方案中,例如,本文所述的中空纳米颗粒展现从约600nm至约900nm可调的spr峰值,由此提供适用于各种成像、治疗、治疗性诊断及感测应用的性质。在一些实施方案中,本文所述的中空纳米颗粒展现所需的磁和/或光热性质。在一些实施方案中,本文所述的中空纳米颗粒适用于磁共振成像(mri)和正电子发射断层摄影(pet)。在一些实施方案中,本文所述的中空纳米颗粒展现所需的催化性质。在一些实施方案中,本文所述的中空纳米颗粒为无毒的。在一些实施方案中,本文所述的中空纳米颗粒可操作用于光热疗法。
在一些实施方案中,中空金属纳米颗粒包括金属壳和大体上由所述壳限定的腔,其中所述壳具有大于或等于约5nm的厚度且所述腔具有弯曲表面。在一些实施方案中,中空金属纳米颗粒包括金属壳和大体上由所述壳限定的腔,其中所述壳具有大于或等于约5nm的厚度且所述腔具有弯曲表面。在一些实施方案中,中空纳米颗粒包括多晶金属壳和大体上由所述壳限定的腔,其中所述腔具有弯曲表面。在一些实施方案中,中空纳米颗粒包括多晶金属壳和大体上由所述壳限定的腔,其中所述腔具有弯曲表面。
在一些实施方案中,本文所述的中空金属纳米颗粒具有展现各种形态的腔。在一些实施方案中,例如,所述腔大致呈球形或半球形。在一些实施方案中,所述腔大致呈抛物线形、椭圆形或椭圆体形。在一些实施方案中,所述腔包括多边形或小面表面。在一些实施方案中,所述腔展现各种尺寸。在一些实施方案中,所述腔具有约50nm至约300nm的直径。在一些实施方案中,所述腔具有约50nm的直径。
在一些实施方案中,本文所述的中空金属纳米颗粒展现各种形态。在一些实施方案中,本文所述的中空金属纳米颗粒大致呈半球形。在一些实施方案中,纳米颗粒大致呈管状。在一些实施方案中,纳米颗粒包括弯曲的外表面。在一些实施方案中,纳米颗粒大致呈球形。在一些实施方案中,纳米颗粒包括抛物线形外表面。在一些实施方案中,纳米颗粒大致呈椭圆形或椭圆体形。
在一些实施方案中,本文所述的中空金属纳米颗粒展现各种尺寸。在一些实施方案中,包括金属壳和大体上由所述壳限定的腔的中空金属纳米颗粒具有约50nm至约1000nm的直径。在一些实施方案中,中空纳米颗粒具有以下直径:约50nm至约160nm、约60nm至约160nm、约80nm至约160nm、或约100nm至约150nm。在一些实施方案中,所述中空纳米颗粒具有约60nm至约100nm的直径。
在一些实施方案中,大致管状的中空纳米颗粒具有在约100nm至约400nm范围内的直径和在约500nm至约2μm范围内的长度。在一些实施方案中,大致管状的中空纳米颗粒具有约1μm的长度。
在一些实施方案中,本文所述的多个中空纳米颗粒具有窄的尺寸分布。在一些实施方案中,本文所述的多个中空纳米颗粒具有标准偏差不大于约20%的尺寸分布。在一些实施方案中,本文所述的多个中空纳米颗粒具有标准偏差不大于约15%、不大于约10%或不大于约5%的尺寸分布。在一些实施方案中,本文所述的多个中空纳米颗粒具有106nm±10nm的尺寸分布,其中106nm为平均直径且10nm为标准偏差。
在一些实施方案中,本文所述的中空金属纳米颗粒展现各种壳结构。在一些实施方案中,中空金属纳米颗粒的壳为多孔的。在一些实施方案中,例如,所述壳具有尺寸在约0.5nm与约3nm之间的孔。在一些实施方案中,所述壳具有尺寸在约2nm与约3nm之间的孔。在一些实施方案中,中空金属纳米颗粒的壳为无孔的。在一些实施方案中,所述壳为多晶的。在一些实施方案中,所述壳具有约3nm至约8nm的粒度。在一些实施方案中,所述壳具有约5nm至约8nm的粒度。在一些实施方案中,所述壳具有小于约5nm的粒度。在一些实施方案中,所述壳为单晶的。
在一些实施方案中,本文所述的中空金属纳米颗粒展现各种壳厚度。在一些实施方案中,中空金属纳米颗粒的壳具有约5nm至约1000nm的厚度。在一些实施方案中,所述壳具有大于约20nm的厚度。在一些实施方案中,所述壳具有约5nm至约8nm的厚度。在一些实施方案中,所述壳具有以下厚度:约5nm至约20nm、约8nm至约25nm、约8nm至约45nm、约25nm至约45nm、约25nm至约500nm、约25nm至约1000nm、约45nm至约300nm、约45nm至约500nm、或约45nm至约1000nm。
在一些实施方案中,本文所述的中空金属纳米颗粒展现各种表面粗糙度。在一些实施方案中,本文所述的表面粗糙度值是基于通过hr-tem测量的表面粒度。在一些实施方案中,例如,约5nm的表面粗糙度对应于约5nm的实测粒度。在一些实施方案中,本文所述的中空金属纳米颗粒具有小于约5nm的表面粗糙度。在一些实施方案中,纳米颗粒具有介于约3nm与约8nm之间的表面粗糙度。在一些实施方案中,纳米颗粒具有约5nm至约8nm的表面粗糙度。在一些实施方案中,纳米颗粒具有小于约3nm或大于约8nm的表面粗糙度。
在一些实施方案中,本文所述的中空金属纳米颗粒包括具有各种组成的壳。在一些实施方案中,例如,本文所述的中空金属纳米颗粒的壳包含铁(fe)、钴(co)、镍(ni)、钯(pd)、铂(pt)、铜(cu)、银(ag)、金(au)、锌(zn)及锡(sn)中的一种或多种。在一些实施方案中,所述壳包含au。在一些实施方案中,所述壳包含能够通过氧化还原反应经受沉积的金属。在一些实施方案中,所述壳包含能够经受无电沉积的金属。在一些实施方案中,所述壳包含具有基本相似的还原电位的多种金属。
在一些实施方案中,本文所述的中空金属纳米颗粒展现各种光学性质。在一些实施方案中,本文所述的中空金属纳米颗粒展现包括表面等离子体共振(spr)峰的吸收分布。在一些实施方案中,例如,包括本文所述的金属壳的中空金属纳米颗粒展现介于约600nm与约900nm之间的表面等离子体共振峰。在一些实施方案中,纳米颗粒展现介于约600nm与约750nm之间的表面等离子体共振峰。在一些实施方案中,纳米颗粒展现介于约650nm与约900nm之间的表面等离子体共振峰。在一些实施方案中,纳米颗粒展现介于约700nm与约800nm之间的表面等离子体共振峰。
在一些实施方案中,本文所述的中空纳米颗粒包括在由金属壳限定的腔内的各种材料。在一些实施方案中,可使用与本发明的目标一致的任何材料。在一些实施方案中,所述腔包含气体、纳米颗粒、治疗剂、酶、催化剂及染料中的一种或多种。在一些实施方案中,所述腔包含气体。在一些实施方案中,所述气体包括还原气体。在一些实施方案中,还原气体能够将一种或多种金属从较高氧化态还原到较低氧化态。在一些实施方案中,还原气体能够将一种或多种金属从正氧化态还原到零氧化态。在一些实施方案中,例如,所述气体包括h2。在一些实施方案中,所述气体包括nh3。在一些实施方案中,所述气体包括用电化学方式产生的气体。
在一些实施方案中,本文所述的中空金属纳米颗粒还包括至少部分设置在由金属壳限定的腔中的一个或多个额外的纳米颗粒。在一些实施方案中,本文所述的中空金属纳米颗粒还包括至少部分设置在由金属壳限定的腔中的多个第二纳米颗粒。在一些实施方案中,本文所述的中空金属纳米颗粒还包括至少部分设置在由金属壳限定的腔中的至少一个第二纳米颗粒。在一些实施方案中,至少一个第二纳米颗粒包括一簇纳米颗粒。在一些实施方案中,至少一个第二纳米颗粒包括有机纳米颗粒。在一些实施方案中,至少一个第二纳米颗粒包括无机纳米颗粒。在一些实施方案中,至少一个第二纳米颗粒包括半导体纳米颗粒。在一些实施方案中,第二纳米颗粒包括金属纳米颗粒。在一些实施方案中,至少一个第二纳米颗粒包括金属氧化物纳米颗粒。在一些实施方案中,至少一个第二纳米颗粒包括陶瓷纳米颗粒。在一些实施方案中,至少一个第二纳米颗粒包括量子点。在一些实施方案中,至少一个第二纳米颗粒包括磁性纳米颗粒。在一些实施方案中,所述磁性纳米颗粒为超顺磁性的。在一些实施方案中,所述磁性纳米颗粒为铁磁性的。
在一些实施方案中,至少一个第二纳米颗粒可展现各种组成。在一些实施方案中,至少一个第二纳米颗粒包括氧化铁。在一些实施方案中,至少一个第二纳米颗粒包括掺杂的fe3o4。在一些实施方案中,掺杂的fe3o4包含适用于正电子发射断层摄影(pet)的一种或多种核素。在一些实施方案中,掺杂的fe3o4包含64cu、89zr、11c、18f及67ga中的一种或多种。在一些实施方案中,掺杂的fe3o4包含64cu和89zr中的一种或多种。
在一些实施方案中,至少一个第二纳米颗粒包括第二中空金属纳米颗粒。在一些实施方案中,第二中空金属纳米颗粒具有与壳基本相同的化学组成。
在其中所述中空金属纳米颗粒包括至少一个第二纳米颗粒的一些实施方案中,至少一个第二纳米颗粒具有小于约50nm的直径。在一些实施方案中,至少一个第二纳米颗粒具有小于约20nm的直径。在一些实施方案中,至少一个第二纳米颗粒具有介于约5nm与约20nm之间或介于约30nm与约50nm之间的直径。在一些实施方案中,所述壳为多孔的并且至少一个第二纳米颗粒具有大于所述孔径的直径。
在一些实施方案中,本文所述的中空金属纳米颗粒的腔包含治疗剂。在一些实施方案中,所述治疗剂包括气体。在一些实施方案中,所述治疗剂包括水溶液。在一些实施方案中,所述治疗剂包括药物。
在一些实施方案中,本文所述的中空金属纳米颗粒还包括与纳米颗粒的一个或多个外表面缔合的各种物质。在一些实施方案中,一种或多种物质与外表面直接缔合。在一些实施方案中,一种或多种物质与外表面间接缔合。在一些实施方案中,一种或多种物质通过与外表面直接缔合的一种或多种物质与外表面间接缔合。在一些实施方案中,与外表面缔合的至少一种物质包括靶向剂。在一些实施方案中,与外表面缔合的至少一种物质包括拉曼活性物质(ramanactivespecies)。在一些实施方案中,与外表面缔合的至少一种物质包括聚乙二醇部分。在一些实施方案中,与外表面缔合的第一物质包括拉曼活性物质并形成第一层并且与外表面缔合的第二物质包括聚乙二醇部分并形成第二层,其中第二层基本上包围第一层。在一些实施方案中,与外表面缔合的第一物质包括聚乙二醇部分并且与外表面缔合的第二物质包括靶向剂。
ii.制造中空纳米颗粒的方法
另一方面,本文描述了制造中空纳米颗粒的方法,在一些实施方案中,其可提供优于先前制造纳米颗粒的方法的一个或多个优点。在一些实施方案中,例如,本文所述的制造中空纳米颗粒的方法为简单、高效、可升级、廉价及可再现的。在一些实施方案中,制造中空纳米颗粒的方法包括形成多个气泡并在所述多个气泡的至少一个的表面上形成壳以形成中空纳米颗粒,其中用电化学方式产生至少一个气泡。在一些实施方案中,形成多个气泡包括用电化学方式形成多个气泡。在一些实施方案中,在所述多个气泡的至少一个的表面上形成壳以形成中空纳米颗粒包括在至少一个用电化学方式产生的气泡的表面上形成壳。在一些实施方案中,所述壳为金属的。
在一些实施方案中,本文所述的制造中空纳米颗粒的方法包括形成多个具有各种物理和化学性质的气泡。在一些实施方案中,至少一个所述气泡包含还原气体。在一些实施方案中,至少一个所述气泡包含h2。在一些实施方案中,至少一个所述气泡包含nh3。在一些实施方案中,至少一个所述气泡包含氧化气体。在一些实施方案中,至少一个所述气泡包含o2。在一些实施方案中,至少一个所述气泡包含相对惰性气体。在一些实施方案中,至少一个所述气泡包含co2。
在一些实施方案中,本文所述的制造中空纳米颗粒的方法包括在至少一个具有各种尺寸的气泡上形成壳。在一些实施方案中,例如,其上形成壳的至少一个所述气泡具有介于约40nm与约60nm之间的直径。在一些实施方案中,其上形成壳的至少一个所述气泡具有介于约50nm与约300nm之间的直径。在一些实施方案中,其上形成壳的至少一个所述气泡具有约50nm的直径。
在一些实施方案中,本文所述的制造中空纳米颗粒的方法包括在各种外加电位下电化学形成至少一个气泡。在一些实施方案中,至少一个所述气泡是在比平衡电位更负的电位下以电化学方式产生。在一些实施方案中,至少一个所述气泡是在比气体逸出的平衡电位更负的电位下以电化学方式产生。在一些实施方案中,例如,至少一个所述气泡是在比相对于ag/agcl约-0.6v更负的电位下以电化学方式产生。在一些实施方案中,至少一个所述气泡是在相对于ag/agcl介于约-0.7v与-0.85v之间的电位下以电化学方式产生。在一些实施方案中,至少一个所述气泡是在相对于ag/agcl介于约-0.55v与-0.8v之间的电位下以电化学方式产生。在一些实施方案中,至少一个所述气泡是在约25℃和介于约5与约8之间的ph下在比相对于ag/agcl约-0.6v更负的电位下以电化学方式产生。在一些实施方案中,至少一个所述气泡是在约25℃和介于约5与约8之间的ph下在相对于ag/agcl介于约-0.7v与-0.85v之间的电位下以电化学方式产生。在一些实施方案中,至少一个所述气泡是在约25℃和介于约5与约8之间的ph下在相对于ag/agcl介于约-0.55v与-0.8v之间的电位下以电化学方式产生。
在一些实施方案中,制造中空纳米颗粒的方法包括形成多个气泡并在所述多个气泡的至少一个的表面上形成壳以形成中空纳米颗粒,其中用电化学方式产生至少一个所述气泡且其中形成壳包括通过一个或多个氧化还原反应沉积材料。在一些实施方案中,形成壳包括通过无电沉积沉积材料。
在一些实施方案中,本文所述的制造中空纳米颗粒的方法还包括提供具有各种性质和组成的电解质。在一些实施方案中,形成多个气泡和形成壳是在电解质存在下发生。在一些实施方案中,电解质展现介于约5与约8之间的ph。在一些实施方案中,电解质展现介于约6与约7之间的ph。
在一些实施方案中,电解质包含含金属物质。在一些实施方案中,电解质包含含金属物质,该物质能够通过氧化还原反应经受沉积。在一些实施方案中,电解质包含含金属物质,该物质能够经受无电沉积。在一些实施方案中,电解质包含含金属物质,该物质包含能够被h2还原的金属。在一些实施方案中,电解质包含含金属物质,该物质包含能够被nh3还原的金属。在一些实施方案中,电解质包含含金属物质,该物质能够被水性还原剂还原。在一些实施方案中,电解质包含具有基本上相似的还原电位的多种含金属的物质。在一些实施方案中,例如,多种含金属的物质各自能够被相同的还原剂还原。在一些实施方案中,电解质包含含金属物质,该物质包含能够被o2氧化的金属。在一些实施方案中,电解质包含含金属物质,该物质能够被水性氧化剂氧化。在一些实施方案中,含金属的物质包含以下中的一种或多种:fe、co、ni、pd、pt、cu、ag、au、zn及sn。在一些实施方案中,含金属的物质包含au。在一些实施方案中,含金属的物质包含以下中的一种或多种:钛(ti)、锆(zr)、fe、co、ni、cu、zn及sn。
在一些实施方案中,电解质包含还原剂。可使用与本发明的目标一致的任何还原剂。在一些实施方案中,还原剂包括以下中的一种或多种:亚磷酸盐、次磷酸盐、肼、硼氢化物、氰基硼氢化物、三烷基胺及三烷基膦。在一些实施方案中,还原剂包括以下中的一种或多种:二羟乙酸、次磷酸钠(na2h2po2)、次磷酸钠一水合物(na2h2po2·h2o)、甲醛、硼氢化钠(nabh4)、氰基硼氢化钠(nabh3(cn))、肼(n2h4)、肼一水合物(n2h4·h2o)、肼-硼烷、盐酸羟胺、甲酸、三甲胺硼烷(dmab)、硫脲、抗坏血酸、三氯化钛、氢化锂铝、三乙基硅烷、巯基琥珀酸、9-硼杂二环[3.3.1]壬烷、明胶及柠檬酸钠。在一些实施方案中,电解质包含氧化剂。可使用与本发明的目标一致的任何氧化剂。在一些实施方案中,氧化剂包括以下中的一种或多种:高锰酸盐、铬酸盐、重铬酸盐、高氯酸盐及过氧化物。
在一些实施方案中,电解质包含稳定配体。在一些实施方案中,所述稳定配体可操作来使一个或多个中空纳米颗粒稳定以免聚集或结块。在一些实施方案中,所述稳定配体包含具有可操作以与一个或多个中空纳米颗粒的表面缔合的第一端和可操作以与溶液相互作用的第二端的物质。在一些实施方案中,所述稳定配体包括表面活性剂。在一些实施方案中,所述稳定配体包括硫醇。在一些实施方案中,所述稳定配体包括胺、膦、羧酸和羧酸盐中的一种或多种。适用于一些实施方案中的稳定配体的非限制性实例包括巯基乙酸、巯基丙酸、十六烷基胺、三苯基膦、溴化十六烷基三甲基铵、柠檬酸及柠檬酸钠。
在一些实施方案中,制造中空纳米颗粒的方法包括形成多个气泡且在所述多个气泡的至少一个的表面上形成壳以形成中空纳米颗粒,其中至少一个所述气泡以电化学方式产生且其中形成所述多个气泡和形成所述壳是在电解质存在下发生,所述电解质包含含金属物质及一种或多种促进剂。在一些实施方案中,至少一种促进剂包括乙二胺(eda)。在一些实施方案中,至少一种促进剂包括乙二胺四乙酸(edta)。在一些实施方案中,至少一种促进剂包括(so3)2-。在一些实施方案中,至少一种促进剂包括ni2+、pd2+及pt2+中的一种或多种。在一些实施方案中,至少一种促进剂包括ni2+。
在一些实施方案中,本文所述的制造中空纳米颗粒的方法包括提供一个或多个成核衬底。在一些实施方案中,形成多个气泡包括在至少一个成核衬底上形成至少一个气泡。在一些实施方案中,至少一个成核衬底包括固体表面。在一些实施方案中,至少一个成核衬底包括用作工作电极的表面。在一些实施方案中,成核衬底包括不用作电极的至少一个表面。
在一些实施方案中,至少一个成核衬底包括有机聚合物。在一些实施方案中,至少一个成核衬底包括无机材料。在一些实施方案中,至少一个成核衬底包括纳米颗粒。在一些实施方案中,至少一个成核衬底包括银(ag)。在一些实施方案中,至少一个成核衬底包括硅(si)。在一些实施方案中,至少一个成核衬底包括二氧化硅(sio2)。在一些实施方案中,至少一个成核衬底包括二氧化钛(tio2)。在一些实施方案中,至少一个成核衬底包括氧化铝(al2o3)。在一些实施方案中,至少一个成核衬底包括铜(cu)。在一些实施方案中,至少一个成核衬底包括碳(c)。在一些实施方案中,至少一个成核衬底包括图案化衬底。在一些实施方案中,至少一个成核衬底包括图案化玻璃衬底。在一些实施方案中,至少一个成核衬底包括sio2衬底,该衬底包括至少一个ag条纹。在一些实施方案中,至少一个成核衬底包括tem栅格。
在一些实施方案中,至少一个成核衬底包括膜。在一些实施方案中,所述膜具有高表面积。在一些实施方案中,所述膜包括径迹蚀刻的膜。在一些实施方案中,所述膜包括聚碳酸酯。在一些实施方案中,所述膜包括聚酯。在一些实施方案中,所述膜包括纤维素。在一些实施方案中,所述膜包括再生纤维素、醋酸纤维素、硝酸纤维素及混合纤维素酯中的一种或多种。在一些实施方案中,所述膜包括聚四氟乙烯(ptfe)。在一些实施方案中,所述膜包括聚酰胺。在一些实施方案中,所述膜包括尼龙。在一些实施方案中,所述膜包括聚醚砜(pes)。在一些实施方案中,所述膜包括聚丙烯。在一些实施方案中,所述膜包括多孔玻璃。在一些实施方案中,所述膜包括阳极氧化铝(aao)。在一些实施方案中,所述膜包括具有约100nm至约3000nm的直径的孔。在一些实施方案中,所述膜包括具有约100nm至约500nm的直径的孔。
在一些实施方案中,本文所述的制造中空纳米颗粒的方法包括提供多个成核衬底。在一些实施方案中,所述多个成核衬底包括堆叠膜。在一些实施方案中,所述多个成核衬底包括包含阳极氧化铝的堆叠膜。在一些实施方案中,本文所述的制造中空纳米颗粒的方法还包括在形成壳之后选择性地溶解一个或多个成核衬底。
在一些实施方案中,制造中空纳米颗粒的方法包括形成多个气泡,在所述多个气泡的至少一个的表面上形成壳以形成中空纳米颗粒,提供至少一个第二纳米颗粒的一种或多种前体,以及在由壳限定的腔内由一种或多种前体形成至少一个第二纳米颗粒,其中以电化学方式产生至少一个所述气泡。在一些实施方案中,所述壳基本上包围至少一个第二纳米颗粒。在一些实施方案中,提供至少一个第二纳米颗粒的一种或多种前体包括在提供第二前体之前提供第一前体。在一些实施方案中,提供至少一个第二纳米颗粒的一种或多种前体包括提供一种或多种前体的至少一种水溶液。
在一些实施方案中,制造中空纳米颗粒的方法包括形成多个气泡,在所述多个气泡的至少一个的表面上形成壳以形成中空纳米颗粒,提供多个第二纳米颗粒的一种或多种前体,以及在由壳限定的腔内由一种或多种前体形成多个第二纳米颗粒,其中以电化学方式产生至少一个所述气泡。在一些实施方案中,所述壳基本上包围所述多个第二纳米颗粒。
在一些实施方案中,本文所述的制造中空纳米颗粒的方法还包括使一种或多种物质与壳的一个或多个外表面缔合。在一些实施方案中,一种或多种物质与壳的外表面直接缔合。在一些实施方案中,一种或多种物质与外表面间接缔合。在一些实施方案中,一种或多种物质通过与外表面直接缔合的一种或多种物质而与外表面间接缔合。在一些实施方案中,与壳的外表面缔合的一种或多种物质包括聚乙二醇部分。在一些实施方案中,与壳的外表面缔合的一种或多种物质包括靶向剂。在一些实施方案中,与壳的外表面缔合的一种或多种物质包括拉曼活性物质。
在本文所述的制造中空纳米颗粒的方法的一些实施方案中,所述方法为一锅法。在一些实施方案中,一锅法包括在一锅中或在单一反应容器中由一种或多种起始材料形成纳米颗粒。在一些实施方案中,在单一反应容器中的起始材料都不包含预成形的纳米颗粒。在一些实施方案中,在单一反应容器中的起始材料都不包含实心预成形的纳米颗粒。在本文所述的制造中空纳米颗粒的方法的一些实施方案中,所述方法为一步法。在一些实施方案中,一步法包括在不首先使中空纳米颗粒实心的情况下形成中空纳米颗粒。
在一些实施方案中,根据本文所述的一种或多种方法制造的中空纳米颗粒可具有在本文中针对中空纳米颗粒所述的任何性质。例如,在一些实施方案中,本文所述的制造中空纳米颗粒的方法包括制造具有本文所述的尺寸或形状的腔的中空纳米颗粒。在一些实施方案中,本文所述的制造中空纳米颗粒的方法包括制造具有本文所述的厚度或组成的壳的中空纳米颗粒。
iii.复合颗粒
另一方面,本文描述了复合颗粒,在一些实施方案中,其可提供优于先前复合颗粒的一个或多个优点。在一些实施方案中,例如,本文所述的复合颗粒展现治疗性诊断和/或双重成像性质。在一些实施方案中,本文所述的复合颗粒适用于磁共振成像(mri)和正电子发射断层摄影(pet)。在一些实施方案中,本文所述的复合颗粒为无毒的。在一些实施方案中,本文所述的复合颗粒可操作用于光热疗法。
在一些实施方案中,复合颗粒包含至少一个纳米颗粒和基本上包封至少一个纳米颗粒的多晶金属壳,其中至少一个纳米颗粒的至少一个表面不与所述壳接触。在一些实施方案中,复合颗粒包含至少一个纳米颗粒和基本上包封至少一个纳米颗粒的金属壳,其中所述金属壳具有约10nm至约200nm的厚度且至少一个纳米颗粒的至少一个表面不与所述壳接触。在一些实施方案中,至少一个纳米颗粒的表面不与所述壳接触。在一些实施方案中,任何纳米颗粒的表面都不与所述壳接触。在一些实施方案中,所述壳为金属的。
在一些实施方案中,复合颗粒包含多个纳米颗粒和基本上包封所述多个纳米颗粒的多晶金属壳,其中至少一个纳米颗粒的至少一个表面不与所述壳接触。在一些实施方案中,复合颗粒包含多个纳米颗粒和基本上包封所述多个纳米颗粒的金属壳,其中所述金属壳具有约10nm至约200nm的厚度且至少一个纳米颗粒的至少一个表面不与所述壳接触。在一些实施方案中,至少一个纳米颗粒的表面不与所述壳接触。在一些实施方案中,任何纳米颗粒的表面都不与所述壳接触。在一些实施方案中,所述壳为金属的。
在一些实施方案中,本文所述的复合物可展现各种尺寸和形态。在一些实施方案中,复合颗粒大致呈球形。在一些实施方案中,复合颗粒大致呈球形并且具有约60nm至约1000nm的直径。在一些实施方案中,复合颗粒具有以下直径:约80nm至约160nm、约100nm至约150nm、约50nm至约100nm、或约50nm至约160nm。
在一些实施方案中,本文所述的复合物包括具有各种厚度、形态及组成的壳。在一些实施方案中,所述壳为多孔的。在一些实施方案中,所述壳具有小于至少一个纳米颗粒的孔。在一些实施方案中,所述壳具有尺寸在约0.5nm至约3nm范围内的孔。在一些实施方案中,所述壳具有尺寸在约2nm至约3nm范围内的孔。在一些实施方案中,所述壳为无孔的。
在一些实施方案中,所述壳为多晶的。在一些实施方案中,所述壳为多晶的并具有约3nm至约8nm的粒度。在一些实施方案中,所述壳为多晶的并具有约5nm至约8nm的粒度。在一些实施方案中,所述壳为多晶的并具有小于约5nm的粒度。在一些实施方案中,所述壳为单晶的。
在一些实施方案中,所述壳具有约10nm至约100nm的厚度。在一些实施方案中,所述壳具有大于约20nm的厚度。在一些实施方案中,所述壳具有介于约10nm与约20nm之间的厚度。在一些实施方案中,所述壳具有以下厚度:约10nm至约45nm、约25nm至约45nm、或约45nm至约200nm。
在一些实施方案中,所述壳具有小于约5nm的表面粗糙度。在一些实施方案中,所述壳具有介于约5nm与8nm之间的表面粗糙度。在一些实施方案中,所述壳具有介于约3nm与约8nm之间的表面粗糙度。在一些实施方案中,所述壳具有小于约3nm的表面粗糙度。在一些实施方案中,所述壳具有大于约8nm的表面粗糙度。
在一些实施方案中,所述壳包含以下中的一种或多种:fe、co、ni、pd、pt、cu、ag、au、zn及sn。在一些实施方案中,所述壳包含au。
在一些实施方案中,本文所述的复合颗粒展现各种光学性质。在一些实施方案中,本文所述的复合颗粒展现包括表面等离子体共振峰的吸收分布。在一些实施方案中,复合颗粒展现介于约600nm与约900nm之间的表面等离子体共振峰。在一些实施方案中,复合颗粒展现介于约600nm与约750nm之间的表面等离子体共振峰。在一些实施方案中,复合颗粒展现介于约650nm与约900nm之间的表面等离子体共振峰。在一些实施方案中,复合颗粒展现介于约700nm与约800nm之间的表面等离子体共振峰。
在一些实施方案中,本文所述的复合颗粒包括具有各种尺寸、形态、组成及性质的纳米颗粒。在一些实施方案中,至少一个纳米颗粒大致呈球形。在一些实施方案中,至少一个纳米颗粒大致呈球形并且具有小于约50nm的直径。在一些实施方案中,至少一个纳米颗粒具有小于约20nm的直径。在一些实施方案中,至少一个纳米颗粒具有介于约5nm与约20nm之间的直径。在一些实施方案中,至少一个纳米颗粒具有介于约30nm与约50nm之间的直径。在一些实施方案中,至少一个纳米颗粒包括一簇纳米颗粒。
在一些实施方案中,至少一个纳米颗粒包括磁性纳米颗粒。在一些实施方案中,所述磁性纳米颗粒为超顺磁性的。在一些实施方案中,所述磁性纳米颗粒为铁磁性的。在一些实施方案中,至少一个纳米颗粒包括氧化铁。在一些实施方案中,所述纳米颗粒包括掺杂的fe3o4。在一些实施方案中,掺杂的fe3o4包含适用于正电子发射断层摄影(pet)的一种或多种核素。在一些实施方案中,掺杂的fe3o4包含64cu、89zr、11c、18f及67ga中的一种或多种。在一些实施方案中,掺杂的fe3o4包含64cu和89zr中的一种或多种。
在一些实施方案中,至少一个纳米颗粒包括有机纳米颗粒。在一些实施方案中,至少一个纳米颗粒包括无机纳米颗粒。在一些实施方案中,至少一个纳米颗粒包括半导体纳米颗粒。在一些实施方案中,至少一个纳米颗粒包括金属纳米颗粒。在一些实施方案中,至少一个纳米颗粒包括金属氧化物纳米颗粒。在一些实施方案中,至少一个纳米颗粒包括陶瓷纳米颗粒。在一些实施方案中,至少一个纳米颗粒包括量子点。
在一些实施方案中,本文所述的复合颗粒还包含与复合颗粒的外表面缔合的各种物质。在一些实施方案中,一种或多种物质与外表面直接缔合。在一些实施方案中,一种或多种物质与外表面间接缔合。在一些实施方案中,一种或多种物质通过与外表面直接缔合的一种或多种物质而与外表面间接缔合。在一些实施方案中,与外表面缔合的至少一种物质包括拉曼活性物质。在一些实施方案中,与外表面缔合的至少一种物质包括聚乙二醇部分。在一些实施方案中,与外表面缔合的至少一种物质包括靶向剂。在一些实施方案中,与外表面缔合的第一物质包括拉曼活性物质并形成第一层并且与外表面缔合的第二物质包括聚乙二醇部分并形成第二层,其中第二层基本上包围第一层。在一些实施方案中,与外表面缔合的第一物质包括聚乙二醇部分并且与外表面缔合的第二物质包括靶向剂。
iv.制造复合颗粒的方法
另一方面,本文描述了制造复合颗粒的方法,在一些实施方案中,所述方法可提供优于先前制造复合颗粒方法的一个或多个优点。在一些实施方案中,例如,本文所述的制造复合颗粒的方法为简单、高效、可升级、廉价及可再现的。在一些实施方案中,制造复合颗粒的方法包括提供多孔中空纳米颗粒,提供至少一个第二纳米颗粒的一种或多种前体,将所述一种或多种前体与中空纳米颗粒混合,以及在中空纳米颗粒内由所述一种或多种前体形成至少一个第二纳米颗粒。在一些实施方案中,制造复合颗粒的方法包括提供多孔中空纳米颗粒,提供多个第二纳米颗粒的一种或多种前体,将所述一种或多种前体与中空纳米颗粒混合,以及在中空纳米颗粒内由所述一种或多种前体形成多个第二纳米颗粒。在一些实施方案中,中空纳米颗粒包括本文所述的任何多孔中空纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属氧化物纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空半导体纳米颗粒。
在一些实施方案中,本文所述的制造复合颗粒的方法包括以各种形式和方式提供并混合至少一个第二纳米颗粒的一种或多种前体。在一些实施方案中,提供至少一个第二纳米颗粒的一种或多种前体包括提供一种或多种前体的至少一种水溶液。在一些实施方案中,混合至少一个第二纳米颗粒的一种或多种前体包括在将第二前体与中空纳米颗粒混合之前将第一前体与中空纳米颗粒混合。在一些实施方案中,将至少一个第二纳米颗粒的一种或多种前体与中空纳米颗粒混合包括将中空纳米颗粒浸没在至少一种水溶液中。在一些实施方案中,将至少一个第二纳米颗粒的一种或多种前体与中空纳米颗粒混合包括使至少一个第二纳米颗粒的一种或多种前体的一种或多种水溶液流动穿过包含中空纳米颗粒的膜。在一些实施方案中,使一种或多种水溶液流动穿过膜包括使用真空过滤使一种或多种水溶液流动穿过膜。
在一些实施方案中,本文所述的制造复合颗粒的方法还包括密封多孔中空纳米颗粒。在一些实施方案中,密封包括提供含金属物质,该物质能够通过氧化还原反应沉积于多孔中空纳米颗粒的表面上。在一些实施方案中,密封包括提供含金属物质,该物质能够无电沉积于多孔中空纳米颗粒的表面上。
在一些实施方案中,本文所述的制造复合颗粒的方法还包括使一种或多种物质与复合颗粒的外表面缔合。在一些实施方案中,一种或多种物质与外表面直接缔合。在一些实施方案中,一种或多种物质与外表面间接缔合。在一些实施方案中,一种或多种物质通过与外表面直接缔合的一种或多种物质而与外表面间接缔合。在一些实施方案中,与外表面缔合的一种或多种物质包括聚乙二醇部分。在一些实施方案中,与外表面缔合的一种或多种物质包括靶向剂。在一些实施方案中,与外表面缔合的一种或多种物质包括拉曼活性物质。
在一些实施方案中,制造复合颗粒的方法包括提供多孔中空纳米颗粒,提供一种或多种治疗剂,以及将所述一种或多种治疗剂与中空纳米颗粒混合以将至少一种所述治疗剂设置在中空纳米颗粒内。在一些实施方案中,中空纳米颗粒包括本文所述的任何多孔中空纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属氧化物纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空半导体纳米颗粒。
本文描述了制造复合颗粒的方法,在一些实施方案中,所述方法包括以各种形式和方式提供并混合一种或多种治疗剂。在一些实施方案中,提供一种或多种治疗剂包括提供一种或多种治疗剂的至少一种水溶液。在一些实施方案中,将一种或多种治疗剂与中空纳米颗粒混合包括将中空纳米颗粒浸没在至少一种水溶液中。在一些实施方案中,将一种或多种治疗剂与中空纳米颗粒混合包括使一种或多种治疗剂的一种或多种水溶液流动穿过包含中空纳米颗粒的膜。在一些实施方案中,使一种或多种水溶液流动穿过膜包括使用真空过滤使一种或多种水溶液流动穿过膜。在一些实施方案中,将一种或多种治疗剂与中空纳米颗粒混合包括在高于约25℃的温度下混合。在一些实施方案中,将一种或多种治疗剂与中空纳米颗粒混合包括在高于约37℃的温度下混合。在一些实施方案中,将一种或多种治疗剂与中空纳米颗粒混合包括在以下温度下混合:高于约40℃、高于约50℃、高于约60℃、高于约70℃、高于约80℃、或高于约90℃。
在一些实施方案中,制造复合颗粒的方法包括提供多孔中空纳米颗粒,提供一种或多种治疗剂,将所述一种或多种治疗剂与中空纳米颗粒混合以将至少一种所述治疗剂设置在中空纳米颗粒内,以及密封所述多孔中空纳米颗粒。在一些实施方案中,密封包括提供含金属物质,该物质能够通过氧化还原反应沉积于多孔中空纳米颗粒的表面上。在一些实施方案中,密封包括提供含金属物质,该物质能够无电沉积于多孔中空纳米颗粒的表面上。
在一些实施方案中,制造复合颗粒的方法包括提供多孔中空纳米颗粒,提供一种或多种治疗剂,将所述一种或多种治疗剂与中空纳米颗粒混合以将至少一种所述治疗剂设置在中空纳米颗粒内,以及使一种或多种物质与复合颗粒的外表面缔合。在一些实施方案中,与外表面缔合的至少一种物质包括聚乙二醇部分。在一些实施方案中,与外表面缔合的至少一种物质包括靶向剂。在一些实施方案中,与外表面缔合的至少一种物质包括拉曼活性物质。
在一些实施方案中,制造复合颗粒的方法包括提供中空纳米颗粒,提供一种或多种拉曼活性物质,以及将所述一种或多种活性拉曼物质与中空纳米颗粒混合以将至少一种所述拉曼活性物质与中空纳米颗粒的外表面缔合。在一些实施方案中,中空纳米颗粒包括本文所述的任何中空纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属氧化物纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空半导体纳米颗粒。
本文描述了制造复合颗粒的方法,在一些实施方案中,所述方法包括以各种形式和方式提供并混合一种或多种拉曼活性物质。在一些实施方案中,提供一种或多种拉曼活性物质包括提供一种或多种拉曼活性物质的至少一种水溶液。在一些实施方案中,至少一种水溶液包含浓度大于或等于约1μm的至少一种拉曼活性物质。在一些实施方案中,至少一种水溶液包含以下浓度的至少一种拉曼活性物质:大于或等于约10μm、大于或等于约100μm、或大于或等于约1000μm。在一些实施方案中,至少一种水溶液包含浓度介于约1μm与约1mm之间的至少一种拉曼活性物质。在一些实施方案中,至少一种水溶液包含浓度介于约30μm与约50μm之间的至少一种拉曼活性物质。在一些实施方案中,将一种或多种拉曼活性物质与中空纳米颗粒混合包括将中空纳米颗粒浸没在包含至少一种拉曼活性物质的至少一种水溶液中。在一些实施方案中,将一种或多种拉曼活性物质与中空纳米颗粒混合包括将包含中空纳米颗粒的膜浸没在包含至少一种拉曼活性物质的至少一种水溶液中。在一些实施方案中,将一种或多种拉曼活性物质与中空纳米颗粒混合包括使包含至少一种拉曼活性物质的至少一种溶液流动穿过包含中空纳米颗粒的膜。在一些实施方案中,使一种或多种水溶液流动穿过膜包括使用真空过滤使一种或多种水溶液流动穿过膜。
在一些实施方案中,制造复合颗粒的方法包括提供中空纳米颗粒,提供一种或多种拉曼活性物质,将所述一种或多种拉曼活性物质与中空纳米颗粒混合以使至少一种所述拉曼活性物质与中空纳米颗粒的外表面缔合,提供一种或多种包含聚乙二醇部分的物质,以及混合所述一种或多种包含聚乙二醇部分的物质以使至少一种包含聚乙二醇部分的物质与中空纳米颗粒的外表面缔合。在一些实施方案中,与中空纳米颗粒的外表面的缔合为直接缔合。在一些实施方案中,与中空纳米颗粒的外表面的缔合为间接缔合。在一些实施方案中,拉曼活性物质形成第一层且包含聚乙二醇部分的物质形成第二层,其中第二层基本上包围第一层。在一些实施方案中,所述方法为一锅法。在一些实施方案中,所述方法为一步法。
在一些实施方案中,根据本文所述的一种或多种方法制造的复合颗粒可具有在本文中针对复合颗粒或中空纳米颗粒所述的任何性质。例如,在一些实施方案中,本文所述的制造复合颗粒的方法包括制造具有拥有如本文所述的尺寸或形状的腔的复合颗粒。在一些实施方案中,本文所述的制造复合颗粒的方法包括制造具有拥有如本文所述的厚度或组成的壳的复合颗粒。在一些实施方案中,本文所述的制造复合颗粒的方法包括制造具有一种或多种与如本文所述的外表面缔合的物质的复合颗粒。
v.成像和处理生物环境的方法
另一方面,本文公开了成像和处理生物环境的方法。本文描述了对生物环境成像的方法,在一些实施方案中,所述方法包括提供本文所述的中空纳米颗粒并用电磁辐射辐照所述中空纳米颗粒。本文描述了处理生物环境的方法,在一些实施方案中,所述方法包括提供本文所述的中空纳米颗粒并用电磁辐射辐照所述中空纳米颗粒。在一些实施方案中,成像并处理生物环境可基本上同时进行。在一些实施方案中,至少一部分所述电磁辐射是通过中空纳米颗粒非弹性地散射。在一些实施方案中,至少一部分所述电磁辐射与中空纳米颗粒的表面等离子体相互作用。在一些实施方案中,辐照诱导光热加热。在一些实施方案中,辐照诱导中空纳米颗粒的破裂。在一些实施方案中,为生物环境成像包括用表面等离子体共振(spr)成像的成像。在一些实施方案中,为生物环境成像包括用表面增强拉曼光谱法(sers)的成像。在一些实施方案中,为生物环境成像包括用磁共振成像(mri)的成像。在一些实施方案中,为生物环境成像包括用正电子发射断层摄影(pet)的成像。在一些实施方案中,为生物环境成像包括用spr成像、sers、mri及pet中的两个或更多个的组合的成像。在一些实施方案中,处理生物环境包括处理癌症。
vi.传递有效负载的方法
另一方面,本文描述了传递有效负载的方法,在一些实施方案中,所述方法可提供优于先前传递有效负载方法的一个或多个优点。在一些实施方案中,例如,本文所述的传递有效负载的方法是安全和有效的。在一些实施方案中,传递有效负载的方法包括:提供中空纳米颗粒,所述中空纳米颗粒包括壳、基本上由壳限定的腔及在腔内的有效负载;和释放所述有效负载。在一些实施方案中,中空纳米颗粒包括本文所述的任何中空纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空金属氧化物纳米颗粒。在一些实施方案中,中空纳米颗粒包括中空半导体纳米颗粒。
在一些实施方案中,本文所述的传递有效负载的方法包括以各种方式释放有效负载。在一些实施方案中,释放包括使壳破裂。在一些实施方案中,使壳破裂包括指引辐射于纳米颗粒上。在一些实施方案中,指引辐射包括指引可见辐射。在一些实施方案中,指引辐射包括指引近红外(nir)辐射。在一些实施方案中,释放有效负载包括允许有效负载从纳米颗粒中扩散出来。在一些实施方案中,所述有效负载包括气体。在一些实施方案中,所述气体包括h2。在一些实施方案中,所述有效负载包括治疗剂。在一些实施方案中,所述有效负载包括基因。
在本文所述的传递有效负载的方法的一些实施方案中,通过将中空纳米颗粒浸没在包含有效负载的溶液中在腔内提供所述有效负载。在一些实施方案中,通过将包含中空纳米颗粒的膜浸没在包含有效负载的溶液中在腔内提供所述有效负载。在一些实施方案中,通过使包含有效负载的一种或多种溶液流动穿过包含中空纳米颗粒的膜在腔内提供所述有效负载。在一些实施方案中,通过在高压下将中空纳米颗粒与有效负载混合提供所述有效负载,其中中空纳米颗粒具有多孔壳。在一些实施方案中,在高温下于腔内提供有效负载。在一些实施方案中,在以下温度下于腔内提供有效负载:高于约25℃、高于约37℃、高于约40℃、高于约50℃、高于约60℃、高于约70℃、高于约80℃、或高于约90℃。
在一些实施方案中,本文所述的传递有效负载的方法包括提供本文所述的任何中空纳米颗粒或复合颗粒。
vii.选择性沉积中空纳米颗粒于表面上的方法
另一方面,本文描述了选择性地沉积中空纳米颗粒于表面上的方法,在一些实施方案中,所述方法可提供优于先前方法的一个或多个优点。在一些实施方案中,例如,本文所述的选择性地沉积中空纳米颗粒于表面上的方法为简单和有效的。在一些实施方案中,选择性地沉积中空纳米颗粒于表面上的方法包括:提供具有带有不同疏水性的多个结构域的衬底,形成多个气泡,以及在至少一个所述多个气泡的表面上形成壳以形成中空纳米颗粒。在一些实施方案中,中空纳米颗粒被选择性地沉积在具有第一疏水性的一个或多个结构域上。在一些实施方案中,所述衬底包括图案化衬底。
在一些实施方案中,本文所述的选择性地沉积中空纳米颗粒于表面上的方法包括沉积本文所述的任何中空纳米颗粒。
本文所述的一些实施方案包括具有各种尺寸的腔的纳米颗粒。在一些实施方案中,腔尺寸可通过改变众多综合参数中的一个或多个而变化:包括电解质组成和ph、外加电位、外加电位时间分布、及成核衬底组成。不希望受理论束缚,据信腔尺寸受相应气泡尺寸的影响。在一些实施方案中,本文所述的气泡尺寸可通过改变以下一个或多个综合参数而变化:包括电解质组成、稳定性及ph;外加电位;外加电位时间分布;工作电极组成;以及成核衬底的疏水性和表面形态。也不希望受理论束缚,据信本文所述的气泡的尺寸和尺寸分布受电化学气体产生的效率和程度的影响。在一些实施方案中,改变一个或多个上述综合参数改变了电化学气体产生的效率。在一些实施方案中,改变一个或多个上述综合参数改变了交换电流密度。
本文所述的一些实施方案包括具有各种尺寸的中空纳米颗粒和复合颗粒。在一些实施方案中,中空纳米颗粒或复合颗粒尺寸可通过改变众多综合参数中的一个或多个而变化:包括电解质组成和ph、外加电位、外加电位时间分布、成核衬底组成、及反应时间。不希望受理论束缚,据信中空纳米颗粒或复合颗粒尺寸受相应气泡尺寸的影响。因此,在一些实施方案中,中空纳米颗粒或复合颗粒尺寸可通过改变影响气泡在衬底上的成核的综合参数来控制。在一些实施方案中,中空纳米颗粒或复合颗粒尺寸受壳厚度的影响。因此,在一些实施方案中,中空纳米颗粒或复合颗粒尺寸可通过改变壳厚度来控制。
本文所述的一些实施方案包括具有各种厚度的壳。在一些实施方案中,壳厚度可通过改变众多综合参数而变化:包括电解质组成和ph、外加电位、外加电位时间分布、及反应时间。
本文所述的一些实施方案包括展现各种表面等离子体共振峰的中空纳米颗粒或复合颗粒。在一些实施方案中,spr峰值波长可通过改变以下众多参数中的一个或多个而变化:包括中空纳米颗粒或复合颗粒组成、表面粗糙度及壳厚度。
本文所述的一些实施方案包括具有各种表面粗糙度的壳、中空纳米颗粒或复合颗粒。在一些实施方案中,表面粗糙度可通过改变以下一个或多个而变化:电解质组成和ph、反应时间、外加电位、及外加电位时间分布。
本文所述的一些实施方案包括具有各种组成的壳。在一些实施方案中,壳组成可通过改变电解质组成而变化。在一些实施方案中,电解质组成可通过改变一种或多种含金属物质的特性而变化。不希望受理论束缚,在一些实施方案中,具有各种组成的壳可通过使用包含一种或多种含金属物质的电解质来提供,其中至少一种含金属物质可被至少一种以电化学方式产生的气体还原或氧化。也不希望受理论束缚,在一些实施方案中,具有各种组成的壳可通过使用包含一种或多种含金属物质的电解质来提供,其中至少一种含金属物质可操作以通过氧化还原反应经受沉积。在一些实施方案中,至少一种含金属物质可操作以经受无电沉积。在一些实施方案中,多种含金属物质具有基本上相似的还原电位。在一些实施方案中,具有各种组成的壳可通过使用包含一种或多种含金属物质的电解质来提供,其中至少一种含金属物质可操作以通过氧化还原反应沉积于气泡的表面上。在一些实施方案中,具有各种组成的壳可通过使用包含一种或多种含金属物质的电解质来提供,其中至少一种含金属物质可操作以无电沉积于气泡的表面上。在一些实施方案中,具有各种组成的壳可通过使用包含一种或多种含金属物质的电解质来提供,其中至少一种含金属物质可操作以通过氧化还原沉积于金属壳的表面上。在一些实施方案中,具有各种组成的壳可通过使用包含一种或多种含金属物质的电解质来提供,其中至少一种含金属物质可操作以无电沉积于金属壳的表面上。
本文所述的一些实施方案包括各种尺寸的孔。在一些实施方案中,孔尺寸可通过改变以下一个或多个来控制:反应时间、电解质组成和ph、外加电位、及外加电位时间分布。在一些实施方案中,改变电解质组成包括改变含金属物质在电解质中的浓度。在一些实施方案中,改变电解质组成包括改变还原剂在电解质中的浓度。
本文所述的一些实施方案包括在多孔壳内形成至少一个第二纳米颗粒,其中所述至少一个第二纳米颗粒具有各种尺寸。在一些实施方案中,所述至少一个第二纳米颗粒的尺寸可通过改变以下一个或多个来控制:反应时间、至少一个第二纳米颗粒的一种或多种前体的浓度、孔尺寸、及腔尺寸。
本文所述的一些实施方案包括治疗剂。可使用与本发明的目标一致的任何合适的治疗剂。在一些实施方案中,所述治疗剂包括气体。在一些实施方案中,所述治疗剂包括液体。在一些实施方案中,所述治疗剂包括溶液。在一些实施方案中,所述治疗剂包括药物。在一些实施方案中,所述治疗剂包括水溶性药物。适用于一些实施方案中的治疗剂的非限制性实例包括米托蒽醌和吉西他滨。合适的治疗剂可购自商业来源或根据本领域中已知的方法来制备。
本文所述的一些实施方案包括靶向剂。可使用与本发明的目标一致的任何合适的靶向剂。在一些实施方案中,靶向剂包括可操作以便与分析物或生物标记物选择性地相互作用的物质。在一些实施方案中,靶向剂包括可操作以便与抗原选择性地相互作用的物质。在一些实施方案中,靶向剂包括蛋白质(包括天然存在的蛋白或改造的蛋白)、抗体、抗体片段、肽及小分子中的一种或多种。在一些实施方案中,靶向剂包括蛋白质。在一些实施方案中,靶向剂包括抗体。在一些实施方案中,靶向剂包括肽。在一些实施方案中,靶向剂包括小分子。靶向剂还可为微型抗体、双抗体、三抗体、四抗体、适体、亲和体或类肽。适用于一些实施方案中的靶向剂的特定非限制性实例包括链霉亲和素、生物素、抗psma、nh2gr11及c(rgdyk)。合适的物质可购自商业来源或根据本领域中已知的方法来制备。
本文所述的一些实施方案包括拉曼活性物质。可使用与本发明的目标一致的任何合适的拉曼活性物质。在一些实施方案中,拉曼活性物质包括正电荷。在一些实施方案中,拉曼活性物质包括离域的π系统。在一些实施方案中,拉曼活性物质包括硫醇部分。在一些实施方案中,拉曼活性物质包括可操作以与表面形成硫金属键的硫醇部分。适用于一些实施方案中的拉曼活性物质的非限制性实例包括甲酚紫、尼罗蓝、罗丹明6g、四氟硼酸、二乙基噻三羰花青(dttc)、dttc碘化物、结晶紫、ir140(内消旋二苯胺取代的七-次甲基)、hitc碘化物(1,1’,3,3,3’,3’-六甲基吲哚羰花青碘化物)、及dotc碘化物(3-乙基-2-[7-(3-乙基-2(3h)-亚苯并噁唑基)-1,3,5-七-三烯基]-苯并噁唑鎓碘化物)。合适的物质可购自商业来源或根据本领域中已知的方法来制备。在包括拉曼活性物质的一些实施方案中,中空纳米颗粒检测的动态范围达到约30db。在一些实施方案中,中空纳米颗粒检测的动态范围为约10pm至约10nm。
本文所述的一些实施方案包括包含聚乙二醇(peg)部分的物质。可使用与本发明的目标一致的任何合适的包含聚乙二醇部分的物质。在一些实施方案中,物质包含单官能的甲醚peg(mpeg)部分。在一些实施方案中,物质包含硫醇化聚乙二醇部分。在一些实施方案中,物质包含聚乙二醇部分和羧酸部分。在一些实施方案中,物质包含硫醇化聚乙二醇部分和羧酸部分。在一些实施方案中,物质包括含有聚乙二醇部分且具有两个末端的低聚或聚合物质,其中一末端包含硫醇部分且另一末端包含羧酸部分。在一些实施方案中,物质具有式hs-(och2ch2)n-cooh。合适的物质可购自商业来源或根据本领域中已知的方法来制备。
本文所述的一些实施方案包括将一种或多种物质与外表面缔合。可使用与本发明的目标一致的任何合适的缔合方法。在一些实施方案中,缔合包括在外表面与同外表面缔合的一种或多种物质之间形成一个或多个共价键。在一些实施方案中,缔合包括形成一个或多个金属-硫键。在一些实施方案中,缔合包括形成一个或多个au-s键。在一些实施方案中,缔合包括在外表面与同外表面缔合的一种或多种物质之间形成一个或多个非共价键。在一些实施方案中,形成一个或多个非共价键包括形成一个或多个氢键。在一些实施方案中,缔合包括形成一个或多个离子键。在一些实施方案中,缔合包括在外表面与同外表面缔合的一种或多种物质之间形成一个或多个静电相互作用。在一些实施方案中,缔合包括在外表面与同外表面缔合的一种或多种物质之间形成一个或多个疏水性相互作用。在一些实施方案中,缔合包括形成一个或多个范德华相互作用。
在一些实施方案中,缔合包括在外表面与同外表面缔合的一种或多种第一物质之间形成一种或多种直接缔合(如共价键、非共价键、氢键、离子键、静电相互作用或范德华相互作用)且还在至少一种第一物质与不与外表面直接缔合的至少一种第二物质之间形成一种或多种缔合。在一些实施方案中,第一物质与第二物质通过一个或多个共价键、非共价键、氢键、离子键、静电相互作用或范德华相互作用而缔合。在一些实施方案中,第一物质与第二物质通过共价偶联化学缔合。在一些实施方案中,第一物质与第二物质通过碳化二亚胺化学缔合。在一些实施方案中,第一物质与第二物质通过点击化学缔合。在一些实施方案中,第一物质形成基本上包围外表面的第一层且第二物质形成基本上包围第一层的第二层。
本文所述的一些实施方案包括以电化学方式产生的气泡。在一些实施方案中,以电化学方式产生的气泡包括包含在电极的表面上形成的一种或多种物质的气泡。在一些实施方案中,以电化学方式产生的气泡包括包含一种或多种物质的气泡,所述一种或多种物质是由在电极的表面上发生的氧化或还原反应形成。
本文所述的一些实施方案包括电解质。可使用与本发明的目标一致的任何合适的电解质。在一些实施方案中,电解质包括可操作用于一种或多种金属的电沉积的电解质。在一些实施方案中,电解质包括可操作用于一种或多种金属通过一个或多个氧化还原反应沉积的电解质。在一些实施方案中,电解质包括可操作用于一种或多种金属的无电沉积的电解质。在一些实施方案中,电解质包括商用电解质。在一些实施方案中,电解质包括改性的商用电解质。
本文所述的一些实施方案包括包含促进剂的电解质。在一些实施方案中,促进剂可操作来促进气泡的高效生成。在一些实施方案中,促进剂可操作来促进气体的高效电化学生成。在一些实施方案中,促进剂可操作来促进氢气的高效电化学生成。在一些实施方案中,促进剂可操作来促进大致球形气泡的成核。在一些实施方案中,促进剂可操作来改变成核衬底的疏水性。在一些实施方案中,促进剂可操作来减小成核衬底的疏水性。在一些实施方案中,促进剂可操作来增大成核衬底的疏水性。在一些实施方案中,促进剂可操作来增大包含氧化铝的衬底的疏水性。
在一些实施方案中,促进剂可操作以使含金属物质稳定。在一些实施方案中,促进剂可操作以抑制含金属物质的歧化。在一些实施方案中,促进剂可操作以从电极表面上除去污染物。在一些实施方案中,促进剂可操作以从电极表面上除去氧化物。在一些实施方案中,促进剂可操作以在电极表面上经受电沉积。在一些实施方案中,促进剂可操作以增大电极的交换电流密度。在一些实施方案中,促进剂可操作以增大电极的氢交换电流密度。在一些实施方案中,促进剂可操作以使气体逸出的电流密度增大约50%至约400%。在一些实施方案中,促进剂可操作以使气体逸出的电流密度增大约100%至约300%。在一些实施方案中,促进剂包含至少一个能够与金属结合的孤对电子。在一些实施方案中,促进剂包含至少一个能够与氧结合的孤对电子。在一些实施方案中,促进剂包括多齿物质。在一些实施方案中,促进剂包括二齿物质。在一些实施方案中,促进剂包括与包含于含金属物质中的一个或多个离子相同的一个或多个液相离子的来源。
本文所述的一些实施方案包括成核衬底。可使用与本发明的目标一致的任何合适的成核衬底。在一些实施方案中,成核衬底包括可操作以支持一个或多个气泡的成核的表面。在一些实施方案中,成核衬底包括可操作以支持一个或多个纳米颗粒的成核和生长的表面。在一些实施方案中,成核衬底包括多个通道。在一些实施方案中,成核衬底包括至少一个裂纹、孔隙、隆起或缺损。在一些实施方案中,成核衬底包括粗糙表面。在一些实施方案中,成核衬底包括多个结构域。在一些实施方案中,所述结构域是由边界或接合点来分隔。在一些实施方案中,一个或多个结构域展现不同的性质。在一些实施方案中,一个或多个结构域展现不同的疏水性。在一些实施方案中,一个或多个结构域展现不同的表面处理。在一些实施方案中,成核衬底包括ag。在一些实施方案中,成核衬底包括si。在一些实施方案中,成核衬底包括sio2。在一些实施方案中,成核衬底包括tio2。在一些实施方案中,成核衬底包括al2o3。在一些实施方案中,成核衬底包括cu。在一些实施方案中,成核衬底包括c。在一些实施方案中,成核衬底包括图案化衬底。在一些实施方案中,成核衬底包括图案化玻璃衬底。在一些实施方案中,成核衬底包括sio2衬底,其包括至少一个ag条纹。在一些实施方案中,成核衬底用作工作电极。在一些实施方案中,成核衬底包括膜。在一些实施方案中,膜包括阳极氧化铝。
viii.放射性纳米颗粒
另一方面,本文描述了放射性纳米颗粒。在一些实施方案中,本文所述的放射性纳米颗粒包括金属纳米颗粒核心和设置在金属纳米颗粒核心上方的金属外壳。此外,至少一种金属放射性同位素被设置在金属纳米颗粒核心内和/或金属外壳内。另外,在一些情况下,本文所述的放射性纳米颗粒还包括设置在金属纳米颗粒核心与金属外壳之间的金属内壳。
现在来看放射性纳米颗粒的特定组分,本文所述的放射性纳米颗粒包括金属纳米颗粒核心。可使用与本公开的目标一致的任何金属纳米颗粒核心。在一些情况下,例如,金属纳米颗粒核心包括在上文部分i中所述的中空金属纳米颗粒或在上文部分iii中所述的复合颗粒。例如,在某些情况下,金属纳米颗粒核心包括复合颗粒,其中复合颗粒包括本文所述的中空金属纳米颗粒和设置在由中空金属纳米颗粒的金属壳限定的腔中的本文所述的磁性纳米颗粒。在一些此类情况下,磁性纳米颗粒包括或由氧化铁如fe3o4形成,所述氧化铁可为无掺杂的或以上文所述的方式掺杂的。在其它实施方案中,金属纳米颗粒核心包括实心金属纳米颗粒,如包括过渡金属或“d区”金属或由过渡金属或“d区”金属形成的实心纳米颗粒:如fe、co、rh、ir、ni、pd、pt、cu、ag或au,或由两种或更多种上述金属元素的混合物或合金形成。在一些情况下,金属纳米颗粒核心包括镧系金属如sm或由镧系金属如sm形成。此外,在一些情况下,本文所述的放射性纳米颗粒的金属纳米颗粒核心可由呈元素态或“零”氧化态的一种或多种金属形成,与之相反,由其中金属呈氧化态的物质形成,如可发生在金属氧化物中。
本文所述的放射性纳米颗粒的金属纳米颗粒核心还可具有与本公开的目标一致的任何尺寸、形状和结构。例如,在某些情况下,本文所述的放射性纳米颗粒的金属纳米颗粒核心呈球形或大致呈球形。在其它实施方案中,金属纳米颗粒核心呈扁圆形。金属纳米颗粒核心还可具有多面或小面形或不规则形。此外,在一些实施方案中,金属纳米颗粒核心本身可具有核-壳结构或其它复合构造。例如,在一些实施方式中,本文所述的放射性纳米颗粒的金属纳米颗粒核心为具有核-壳结构的纳米棒。此外,这种核-壳结构可为交替的核-壳结构,如通过由以下组成的纳米棒所展现:au纳米棒核心(例如,具有10-30nm的直径),所述核心被第一co壳(例如,具有5-10nm的厚度)、第二au壳(例如,具有10-20nm的厚度)、第三co壳(例如,具有5-10nm的厚度)和第四au壳(例如,具有10-20nm的厚度)所包围。也可使用其它复合金属纳米颗粒核心。另外,在一些情况下,本文所述的放射性纳米颗粒的金属纳米颗粒核心具有约30-500nm的二维或三维的总尺寸。在一些实施方案中,金属纳米颗粒核心各自上具有以下的二维或三维尺寸:约30-400nm、30-300nm、50-500nm、50-400nm、50-300nm、50-250nm、50-200nm、50-150nm、80-500nm、80-300nm、80-200nm、100-500nm、100-400nm、100-300nm、100-200nm、120-450nm、120-300nm、120-200nm或120-180nm。
本文所述的放射性纳米颗粒还包括金属外壳。金属外壳可包括与本公开的目标一致的任何金属或金属的组合或由所述金属或金属的组合形成。在一些情况下,金属外壳包括以下过渡金属或由以下过渡金属形成:包括fe、co、rh、ir、ni、pd、pt、cu、ag及au中的一种或多种。在一些实施方案中,金属外壳包括镧系金属如sm或由镧系金属如sm形成。另外,在一些情况下,金属外壳是由两种或更多种上述金属的混合物或合金形成。此外,形成金属外壳的金属或金属的组合可呈元素态。此外,如下文中进一步描述,本文所述的放射性纳米颗粒的金属外壳可包括或由与金属纳米颗粒核心相同的金属(或金属的组合)或不同的金属(或金属的组合)形成。因此,在一些实施方案中,金属纳米颗粒核心和金属外壳是由相同的金属或金属的组合形成,而在其它情况下,金属纳米颗粒核心和金属外壳是由不同金属或金属的组合形成。此外,在一些情况下,金属纳米颗粒核心是由具有比金属外壳的金属更高的还原电位的金属形成。例如,在一些实施方案中,金属纳米颗粒核心是由au形成且金属外壳是由pd形成。或者,金属纳米颗粒核心的金属还可能具有比金属外壳的金属更低的还原电位。
此外,本文所述的放射性纳米颗粒的金属外壳可具有与本公开的目标一致的任何厚度。在一些情况下,例如,金属外壳具有以下平均厚度:约1-50nm、1-20nm、1-10nm、1-5nm、5-50nm、5-20nm、5-20nm、5-10nm、或10-50nm。其它厚度也是可能的。另外,本文所述的放射性纳米颗粒的金属外壳可为完全金属壳或大致完全的金属壳,其中“大致”完全的金属壳覆盖至少约80%、至少约85%、至少约90%、至少约95%或至少约98%下面的金属纳米颗粒核心的外表面。或者,在其它情况下,金属外壳不是完全或大致完全的金属壳。此外,本文所述的放射性纳米颗粒的金属外壳可为多孔或非多孔的。
在一些实施方案中,本文所述的放射性纳米颗粒还包括设置在金属纳米颗粒核心与金属外壳之间的金属内壳。金属内壳可由与本公开的目标一致的任何金属或金属的组合形成。例如,在某些情况下,金属内壳包括以下过渡金属或由以下过渡金属形成:包括fe、co、rh、ir、ni、pd、pt、cu、ag及au中的一种或多种。在一些实施方案中,金属内壳包括镧系金属如sm或由镧系金属如sm形成。此外,形成金属内壳的金属或金属的组合可呈元素态。
此外,在一些情况下,金属内壳包括金属或金属的组合或由金属或金属的组合形成,所述金属能够通过无电金属沉积在金属纳米颗粒核心的表面上形成金属壳或如下面部分ix中进一步所述来电镀。另外,在一些此类情况下,金属内壳还包括或由具有比放射性纳米颗粒的金属外壳的金属更低的还原电位的金属形成。如在下面部分ix中进一步描述,由这种金属或金属的组合形成的金属内壳在放射性纳米颗粒形成期间可至少部分被金属外壳置换。例如,在某些情况下,金属内壳经受与金属外壳的电离金属的电流置换反应。在本文所述的放射性纳米颗粒的一个非限制性实例中,金属纳米颗粒核心是由au形成,金属内壳是由cu形成,且金属外壳是由pd、rh、au或其组合形成。金属的其它组合也是可能的。
此外,本文所述的放射性纳米颗粒的金属内壳当存在时可具有与本公开的目标一致的任何厚度。在一些情况下,金属内壳具有以下平均厚度:小于约10nm、小于约5nm、小于约3nm、或小于约1nm。其它厚度也是可能的。
本文所述的放射性纳米颗粒还包括金属放射性同位素。可使用与本公开的目标一致的任何金属放射性同位素。此外,如本领域普通技术人员所理解,金属放射性同位素可为具有放射性或具有不稳定核的金属的同位素,如半衰期小于1022年的同位素。另外,本文所述的放射性纳米颗粒的金属放射性同位素可包括或由与本公开的目标一致的任何金属元素形成。在一些情况下,例如,金属放射性同位素包括以下过渡金属的放射性同位素:如钇(y)、铼(re)、fe、co、铑(rh)、铱(ir)、ni、pd、pt、cu、ag及au。金属放射性同位素也可包括镧系金属或锕系金属的放射性同位素。可用于本文所述的一些实施方案中的金属放射性同位素的非限制性实例包括cu-64、cu-67、y-90、pd-103、rh-105、re-186、re-188、ir-192及au-198。也可使用其它放射性同位素。在一些实施方案中,本文所述的放射性纳米颗粒的金属放射性同位素可被选出以提供所需类型的放射性衰变。例如,在一些情况下,金属放射性同位素为β-发射体。另外,在一些实施方式中,金属放射性同位素可基于其半衰期来选择。例如,在一些情况下,金属放射性同位素被选出以具有相对较短的半衰期,如72小时或更短的半衰期。或者,在其它实施方案中,金属放射性同位素被选出以具有相对较长的半衰期,如10天或更长的半衰期。此外,在一些情况下,本文所述的放射性纳米颗粒包括多种不同的金属放射性同位素。在一些此类情况下,不同的金属放射性同位素可组合以提供相对较快的衰变分布和相对较慢的衰变分布。例如,在某些情况下,第一金属放射性同位素可包括y-90(具有64h的半衰期),且第二金属放射性同位素可包括pd-103(具有17天的半衰期)。更一般地说,这种放射性纳米颗粒的第二金属放射性同位素可具有与第一金属放射性同位素的半衰期相比至少约5倍、至少约10倍或至少约20倍的半衰期。在一些情况下,包括如上所述的不同金属放射性同位素的组合的放射性纳米颗粒可尤其适用于对生物区室提供低剂量率(ldr)和高剂量率(hdr)处理,如下文中进一步所描述。此外,在一些情况下,这种放射性纳米颗粒也可提供协同效应。
进一步应理解的是,在一些情况下,第二金属放射性同位素或其它额外的放射性同位素可包括在本文所述的放射性纳米颗粒中不作为放射性纳米颗粒的外壳的一部分,而是作为放射性标记的有机配体或螯合配合物的一部分。这种配体或螯合配合物可包括用于与放射性纳米颗粒的外表面连接或缔合的第一部分(以上文部分vii中所述的方式包括以便与外表面缔合)和用于螯合或结合金属放射性同位素的第二部分。例如,在一些实施方案中,配体或螯合配合物可包括硫醇化1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(dota)。在这种情况下,硫醇化dota的一个或多个硫醇部分可键结或连接到放射性纳米颗粒的表面(如外壳的外表面),且四乙酸部分可螯合金属放射性同位素(如y-90)。其它这种配体或配合物也可用于向本文所述的放射性纳米颗粒提供额外的放射性同位素。
此外,在一些实施方案中,本文所述的放射性纳米颗粒的金属放射性同位素的化学特性是基于放射性纳米颗粒的以下一种或多种其它组分的化学组成和/或还原电位来选择:如金属纳米颗粒核心、金属内壳和金属外壳中的一种或多种。例如,在其中金属放射性同位素被设置在金属外壳内的一些情况下,金属放射性同位素包括具有比金属内壳的金属更高的还原电位和/或与金属外壳的金属相同的金属。或者,在其它情况下,金属放射性同位素和金属外壳是由不同金属元素形成。
此外,与呈离子态相对照,本文所述的放射性纳米颗粒的金属放射性同位素可呈元素态。因此,金属放射性同位素可与金属外壳的金属整合,与之对照,仅存在于金属外壳的表面上,或与之对照,作为放射性标记的或放射性的有机金属化合物或分子金属配合物的一部分存在。另外,金属放射性同位素可以与本公开的目标一致的量存在于金属外壳中。在一些情况下,例如,放射性金属同位素以如下量存在于外壳中:0.001-10ppb、0.001-1ppb、0.01-10ppb、0.01-1ppb、0.1-10ppb或0.1-1ppb。放射性同位素也可以大于10ppb的量存在于外壳中。例如,在一些情况下,放射性金属同位素以如下量存在于外壳中:100-1000ppb、1-1000ppm、1-100ppm、1-10ppm、10-1000ppm、10-100ppm或100-1000ppm。其它量也是可能的。
本文所述的放射性纳米颗粒可具有与本公开的目标一致的任何总尺寸和形状。在一些情况下,例如,本文所述的放射性纳米颗粒呈球形或大致呈球形。在其它情况下,放射性纳米颗粒呈扁圆形。放射性纳米颗粒还可具有多面或小面形或不规则形。此外,在一些实施方案中,本文所述的放射性纳米颗粒具有约30-500nm的三维尺寸。在一些情况下,放射性纳米颗粒各自上具有以下的二维或三维尺寸:30-400nm、30-300nm、50-500nm、50-400nm、50-300nm、50-250nm、50-200nm、50-150nm、80-500nm、80-300nm、80-200nm、100-500nm、100-400nm、100-300nm、100-200nm、120-450nm、120-300nm、120-200nm、或120-180nm。此外,应理解的是放射性纳米颗粒在特定维度上的尺寸在一些情况下不包括可由有机或无机配体壳、生物分子或可存在于放射性纳米颗粒的外表面上或与所述外表面缔合的其它物质提供的任何尺寸贡献。在其它情况下,本文所述的放射性纳米颗粒的尺寸是流体动力学尺寸,包括在水溶液、缓冲液和/或血清中的流体动力学尺寸。此外,应理解的是放射性纳米颗粒在特定方向上的“尺寸”是放射性纳米颗粒在那个方向上的最大长度或直径。不希望受理论束缚,据信具有本文所述的尺寸的放射性纳米颗粒在一些情况下可保留在生物区室如肿瘤内持续治疗有效的时期。
另外,在一些实施方案中,本文所述的放射性纳米颗粒可存在于组合物中,包括包含多个或一群本文所述的分散放射性纳米颗粒的组合物。这种组合物例如可为放射性纳米颗粒的胶体或溶液。在这种实施方案中,多个或一群放射性纳米颗粒可展现窄的尺寸分布。此外,在一些情况下,多个放射性纳米颗粒的尺寸分布与用于形成放射性纳米颗粒的金属纳米颗粒核心的尺寸分布相同或基本相同。例如,在某些情况下,本文所述的放射性纳米颗粒群展现标准偏差不大于约20%、不大于约15%、不大于约10%或不大于约5%的单峰尺寸分布,其中标准偏差是基于平均尺寸。此外,应理解的是本文所述的尺寸分布可为在一维、二维或三维上测量的尺寸分布。
此外,在一些实施方案中,本文所述的放射性纳米颗粒可具有负表面电荷,包括负外表面电荷。本文所述的放射性纳米颗粒也可具有正表面电荷,包括正外表面电荷。在一些情况下,例如,放射性纳米颗粒具有以下ζ电位:至少±5mv、至少±10mv、至少±20mv或至少±25mv。在一些情况下,本文所述的放射性纳米颗粒具有以下ζ电位:介于约±5mv与约±100mv之间、介于约±5mv与约±50mv之间、介于约±10mv与约±100mv之间、介于约±10mv与约±50mv之间、介于约±10mv与约±30mv之间、或介于约±15mv与约±35mv之间。
不希望受理论束缚,据信具有本文所述的负表面电荷的放射性纳米颗粒可展现改进的溶液中的稳定性和/或长“半衰期”,其中“溶液”中的稳定性可包括在放射性纳米颗粒的胶体以及溶液中的稳定性。例如,在一些情况下,本文所述的放射性纳米颗粒的溶液或胶体可不展现或基本上不展现絮凝持续至多90天、至多60天或至多30天,其中“基本上不絮凝”是指小于10重量%、小于5重量%或小于1重量%的絮凝,基于存在于溶液或胶体中的放射性纳米颗粒的总重量。在一些情况下,本文所述的放射性纳米颗粒的溶液或胶体不展现或基本上不展现絮凝持续15-90天、15-45天、30-90天、30-45天、或30-60天。此外,还注意到发生絮凝的本文所述的放射性纳米颗粒的溶液或胶体一般可在以本文所述的方式使用之前再分散。
本文所述的放射性纳米颗粒也可具有与本公开的目标一致的任何放射性。在一些情况下,例如,单一放射性纳米颗粒可具有约0.4至400bq或约4至40bq的放射性。在一些情况下,放射性纳米颗粒的溶液或胶体具有以下放射性:约37至3700mbq、37至370mbq、或37至185mbq。其它放射性水平也是可能的。
ix.制造放射性纳米颗粒的方法
另一方面,本文描述了制造放射性纳米颗粒的方法。在一些实施方案中,本文所述的制造放射性纳米颗粒的方法包括提供金属纳米颗粒核心并在金属纳米颗粒核心上方形成金属内壳,所述金属内壳包括第一金属或金属的组合。此外,所述方法还包括在金属纳米颗粒核心上方形成金属外壳,所述金属外壳包括第二金属或金属的组合,所述金属包括至少一种金属放射性同位素。在一些情况下,第二金属或金属的组合还包括非放射性金属同位素。
现在来看本文所述的方法的具体步骤,本文所述的制造放射性纳米颗粒的方法包括提供金属纳米颗粒核心。金属纳米颗粒核心可以与本公开的目标一致的任何方式提供。在一些实施方案中,例如,提供金属纳米颗粒核心包括以上文部分ii中所述的方式制造中空金属纳米颗粒或以上文部分iv中所述的方式制造复合颗粒。在其它情况下,提供金属纳米颗粒核心包括提供具有上文部分viii中所述的尺寸、形状和/或化学组成的金属纳米颗粒核心。例如,在某些情况下,提供金属纳米颗粒核心包括提供由以下过渡金属形成的实心纳米颗粒:如fe、co、rh、ir、ni、pd、pt、cu、ag或au,或由两种或更多种上述金属元素的混合物或合金形成。此外,在一些情况下,提供金属纳米颗粒核心包括提供包含多个金属纳米颗粒核心的溶液、胶体或其它组合物。
本文所述的方法还包括在金属纳米颗粒核心上方形成金属内壳。金属内壳可以与本公开的目标一致的任何方式形成于金属纳米颗粒核心上方。在一些情况下,金属内壳是通过将第一金属或金属的组合无电沉积或电镀于金属纳米颗粒核心的外表面上而形成。如本领域普通技术人员所理解,第一金属或金属的组合的这种无电沉积或电镀可以是第一金属或金属的组合与金属纳米颗粒核心的外表面之间的自动催化氧化还原反应。第一金属或金属的组合因此可包括能够经受金属纳米颗粒核心表面上的无电沉积的任何金属或金属的组合。因此,在一些实施方案中,形成金属内壳包括添加第一金属或金属组合的溶液到金属纳米颗粒核心中,其中第一金属或金属的组合呈非零或正氧化态。在一些此类情况下,第一金属或金属的组合是以一种或多种金属盐、有机金属化合物或金属配合物的形式提供。
另外,在一些情况下,第一金属或金属的组合包括在上文部分viii中针对放射性纳米颗粒的内壳所述的金属。例如,在一些实施方案中,第一金属或金属的组合包括过渡金属或镧系金属,包括以下一种或多种:fe、co、rh、ir、ni、pd、pt、cu、ag、au及sm。此外,如上所述,金属内壳可包括或由与金属纳米颗粒核心相同的金属(或金属的组合)或不同的金属(或金属的组合)形成。
本文所述的方法还包括在金属纳米颗粒核心上方形成金属外壳。金属外壳可以与本公开的目标一致的任何方式形成。例如,如同金属内壳的形成一样,本文所述的放射性纳米颗粒的金属外壳可通过在金属内壳已形成之后将第二金属或金属组合的溶液与金属纳米颗粒核心混合而形成。可使用第二金属或金属组合的任何溶液。例如,在一些情况下,所述溶液包括呈正或非零氧化态的第二金属或金属的组合的盐或其它配合物。
此外,在一些情况下,金属外壳是通过用第二金属或金属的组合电流置换至少一部分金属内壳而形成。在一些此类情况下,形成金属外壳包括进行一系列或一连串的电流置换反应。例如,在某些情况下,第一电流置换反应是在金属内壳与金属放射性同位素之间进行,且随后第二电流置换反应是在金属内壳与非放射性金属同位素之间进行。在一些实施方案中,进行这种一连串的电流置换反应可允许借助于相对较小量的金属放射性同位素将放射性同位素掺入放射性纳米颗粒的金属外壳中。因此,在一些情况下,金属放射性同位素的量与用于形成外壳的非放射性金属同位素的量相比较小。例如,在一些情况下,非放射性金属同位素与放射性金属同位素的摩尔比大于10:1、大于100:1、大于1000:1、大于10,000:1、或大于100,000:1。在一些情况下,非放射性与放射性金属同位素的比率介于10:1与100,000:1之间、100:1与100,000:1之间、1000:1与100,000:1之间、1000:1与10,000:1之间、或10,000:1与100,000:1之间。此外,在一些实施方案中,放射性金属同位素是在约10-7mol/l至约10-9mol/l的浓度下使用。
此外,第二金属或金属组合的金属放射性同位素与非放射性金属同位素可为相同金属或不同金属的同位素。例如,在一些情况下,金属放射性同位素包括pd-103,且非放射性金属同位素包括pd的非放射性同位素,如pd-106。在其它情况下,金属放射性同位素包括pd-103,且非放射性金属同位素包括au的非放射性同位素,如au-197。此外,金属放射性同位素可为在上文部分viii中所述的任何金属放射性同位素。此外,在一些情况下,金属放射性同位素的化学特性是基于放射性纳米颗粒的以下一种或多种其它组分的化学组成和/或还原电位来选择:如金属纳米颗粒核心、金属内壳及金属外壳中的一种或多种。例如,在某些情况下,金属放射性同位素包括具有比金属内壳的金属更高的还原电位的金属。可用于本文所述的一些实施方案中的金属放射性同位素的非限制性实例包括cu-64、cu-67、pd-103、rh-105、ir-192及au-198。也可使用其它放射性同位素。
更一般地说,第二金属或金属的组合可包括与本公开的目标一致的任何金属。在一些情况下,第二金属或金属的组合包括一种或多种具有比形成金属内壳的第一金属或金属的组合更高的还原电位的金属。在一些实施方案中,第二金属或金属的组合包括以下过渡金属,包括fe、co、rh、ir、ni、pd、pt、cu、ag及au中的一种或多种。在一些实施方案中,第二金属或金属的组合包括镧系金属,如sm。也可使用其它金属。
此外,如上文部分viii中所述,根据本文所述的方法用于形成金属纳米颗粒核心、金属内壳及金属外壳的金属或金属的组合一般可基于它们的相对反应性或还原电位来选择,包括以促进如上所述的容易和/或高效的无电沉积和/或电流置换反应的方式。例如,在一些实施方案中,金属纳米颗粒核心是由au形成,第一金属或金属的组合包括cu,且第二金属或金属的组合包括pd、rh或au的放射性同位素及pd、rh或au的非放射性同位素。如本领域普通技术人员所理解,在不背离本公开的教导的情况下,金属的其它组合也是可能的。
另外,在本文所述的一些情况下,在放射性纳米颗粒形成期间,金属外壳完全或基本上完全置换金属内壳。在本文中为了参照目的,“基本上完全”置换金属内壳的金属外壳置换至少约90摩尔%、至少约95摩尔%、至少约98摩尔%、或至少约99摩尔%的金属内壳,以置换步骤之前存在的金属内壳的总量计。在这种实施方案中,金属内壳可不存在于或基本上完全不存在于最终的放射性纳米颗粒中。然而,在其它情况下,若干量的金属内壳可保留在完整的放射性纳米颗粒中并且是可检测的。
如本文所述,制造根据本公开的放射性纳米颗粒的方法可以容易和/或高效的方式进行。此外,在一些情况下,制造本文所述的放射性纳米颗粒的方法可在不对材料系统施加电流下和/或不使用外部或非金属氧化或还原剂下进行,其中“外部”还原剂可指的是本身不是放射性纳米颗粒的金属纳米颗粒核心、金属内壳或金属外壳的一部分的还原剂。例如,在某些情况下,本文所述的放射性纳米颗粒的金属内壳和金属外壳是在不使用非金属还原剂的情况下形成。类似地,形成金属外壳可在不使用除金属物质(如金属盐或其它含金属配合物)以外的任何其它反应物或还原剂下进行,所述金属物质充当用于金属外壳的金属的来源。此外,这类反应可在水溶液中进行。
放射性纳米颗粒也可以不同于如上所述的方法的方式来制造。例如,在一些实施方案中,金属内壳不能在通过一个或多个电流置换反应形成金属外壳之前在金属纳米颗粒核心上方形成。反之,在一些情况下,制造放射性纳米颗粒的方法包括提供金属纳米颗粒核心和通过用第二金属或金属的组合电流置换至少一部分金属纳米颗粒核心在金属纳米颗粒核心上方形成金属外壳,其中第二金属或金属的组合包括金属放射性同位素。第二金属或金属的组合还可包括非放射性金属同位素。此外,第二金属或金属的组合可具有比金属纳米颗粒核心更高的还原电位。另外,在一些实施方案中,外壳是由一连串的电流置换反应形成。例如,在某些情况下,形成金属外壳包括在金属纳米颗粒核心与金属放射性同位素之间进行第一电流置换反应,且随后在金属纳米颗粒核心与非放射性金属同位素之间进行第二电流置换反应。以此方式,至少一部分所述金属纳米颗粒核心(如外表面部分)可被第二金属或金属的组合置换以提供具有核-壳结构的放射性纳米颗粒。例如,在一个非限制性实例中,包括放射性pd同位素和非放射性pd同位素的放射性pd壳可在由cu形成的金属纳米颗粒核心上方形成。也可使用金属的其它组合。
在又一些情况下,放射性纳米颗粒可通过将放射性同位素掺入金属纳米颗粒核心内而制成,而非以下或除以下之外:将放射性同位素掺入设置在金属纳米颗粒核心上方的外壳内。例如,在一些实施方案中,制造放射性纳米颗粒的方法包括:提供多孔中空纳米颗粒(如上文中所述的多孔中空纳米颗粒),将一种或多种放射性同位素与中空纳米颗粒混合以将所述放射性同位素设置在中空纳米颗粒内,以及密封所述多孔中空纳米颗粒。在一些情况下,密封多孔中空纳米颗粒包括提供含金属物质,所述物质能够通过氧化还原反应沉积于多孔中空纳米颗粒的表面上,如上文部分iv中所述。例如,在一些实施方案中,密封包括提供含金属物质,该物质能够无电沉积于多孔中空纳米颗粒的表面上。用于这类方法中的放射性同位素可为金属放射性同位素如lu-177或ac-225或在上文部分viii中所述的金属放射性同位素、或非金属放射性同位素,如b-10、p-32、1-125或1-131。
x.进行近距离放射疗法的方法
另一方面,本文描述了进行近距离放射疗法的方法。在一些实施方案中,进行近距离放射疗法的方法包括将本文所述的组合物设置在生物区室内。在一些情况下,例如,所述组合物包含多个分散的放射性纳米颗粒,其中“分散的”放射性纳米颗粒是非团聚或基本上非团聚的纳米颗粒,包括具有上文部分viii中所述的平均尺寸的纳米颗粒。例如,在一些实施方案中,所述组合物为多个放射性纳米颗粒的胶态分散体。如本领域普通技术人员所理解,这类胶态分散体还可包括其中分散了纳米颗粒的溶剂或载体流体。可使用与本公开的目标一致的任何溶剂或载体流体。在一些情况下,例如,胶态分散体为水分散体。另外,在一些实施方案中,放射性纳米颗粒被分散在血清或缓冲液中。如在上文中所进一步描述的,放射性纳米颗粒的这类胶态分散体可提供优于用于先前进行近距离放射疗法的方法的相对较大的包封放射治疗剂的许多优点。
此外,在一些情况下,设置在生物区室中的组合物包含多个放射性纳米颗粒,其中至少一个所述多个放射性纳米颗粒为具有上文部分viii中所述的核-壳或核-壳-壳结构的放射性纳米颗粒。一般说来,可使用在上文部分viii中所述的任何放射性纳米颗粒。例如,在一些实施方案中,放射性纳米颗粒包括金属纳米颗粒核心、设置在所述金属纳米颗粒核心上方的金属外壳、及设置在所述金属纳米颗粒核心内或所述金属外壳内的金属放射性同位素。另外,在一些情况下,放射性纳米颗粒具有约30-500nm的三维尺寸。在其它情况下,放射性纳米颗粒各自上具有以下的二维或三维尺寸:30-400nm、30-300nm、50-500nm、50-400nm、50-300nm、50-250nm、50-200nm、50-150nm、80-500nm、80-300nm、80-200nm、100-500nm、100-400nm、100-300nm、100-200nm、120-450nm、120-300nm、120-200nm、或120-180nm。不希望受理论束缚,据信具有本文所述的尺寸的放射性纳米颗粒可保留在其中设置了纳米颗粒的生物区室内持续较长时间,如长达5周、长达8周或长达10周的时间。这种保留可尤其为其中生物区室是肿瘤或癌性组织的实施方案所需。例如,在其中多个放射性纳米颗粒设置在肿瘤或癌性生物区室中的一些实施方案中,至少约70%或至少约80%的放射性纳米颗粒保留在肿瘤内持续至少3周。在一些情况下,约70-99%、70-95%、70-90%、70-80%、80-99%、80-95%、80-90%、85-99%或85-95%的放射性纳米颗粒保留在肿瘤内持续1-10周、1-5周、1-3周、3-10周、3-8周、3-5周、5-10周或5-8周的时间。
此外,包含具有本文所述的尺寸的放射性纳米颗粒的组合物也可允许通过注射而非通过手术将组合物设置在生物区室中。因此,在一些情况下,本文所述的进行近距离放射疗法的方法包括将组合物注射到生物区室如肿瘤或紧邻肿瘤的区域中,其中“紧邻”肿瘤的区域可在肿瘤的约5cm内、约2cm内或约1cm内。此外,在一些情况下,将组合物注射到血管中,如与生物区室相关的动脉中。例如,在一些实施方式中,将组合物作为经动脉输注治疗的一部分来注射,如在下文实施例中所述。
进一步应理解的是,本文所述的进行近距离放射疗法的方法可用于治疗与本公开的目标一致的任何肿瘤或癌性组织。例如,在某些情况下,生物区室包括实体癌、肉瘤、淋巴瘤、白血病、胚细胞瘤或生殖细胞肿瘤。更具体地,在一些情况下,生物区室包括乳腺癌组织、前列腺癌组织、肺癌组织、胰腺癌组织、结肠癌组织、肝癌组织、食道癌组织、妇科癌组织、肛门或直肠癌组织、头或颈癌组织、脑癌组织或骨癌组织。此外,在一些实施方案中,本文所述的方法可用于治疗不可切除或另外对于手术摘除不理想的恶性肿瘤。如果肿瘤粘附到患者的重要器官结构或如果摘除肿瘤的手术将对患者造成不可逆的伤害,那么该肿瘤可被视为“不可切除的”。本文所述的方法还可用于在手术中治疗相对较小的肿瘤,如具有以下尺寸的肿瘤:5cm或更小、2cm或更小、1cm或更小、或0.5cm或更小。另外,如上文中所述,本文所述的方法可用于进行放射性纳米颗粒的动脉内输注,由此允许治疗任何尺寸的肿瘤。
类似地,在一些情况下,本文所述的方法可用于对残留的微观疾病的潜在区域提供近距离放射疗法,包括在较大疾病位点的切除术或其它治疗之后。因此,在一些情况下,本文所述方法的生物区室为先前由此摘除肿瘤或其它患病组织的位点。生物区室也可为潜在患病组织的微观区域,其中“微观”区域可具有小于10mm3或小于1mm3的体积。在其它实施方案中,其中注射或设置了放射性纳米颗粒的生物区室紧邻这类微观区域。
如本领域普通技术人员所理解,在如肿瘤的生物区室中设置本文所述的放射性组合物可借助于由放射性组合物发出的辐射对生物区室提供近距离放射疗法。此外,在一些实施方案中,本文所述的方法也可通过除涉及对生物区室提供内辐射的那些步骤之外还进行其它治疗步骤而对生物区室提供治疗或疗法。例如,在一些情况下,本文所述的方法还包括用外部电离辐射束辐照生物区室。如本领域普通技术人员所理解,“电离辐射”可包括各种类型的辐射,其具有足以通过从原子或分子释放电子来电离原子或分子的能量。还应理解,释放电子所需的能量水平可根据原子或分子的特性或环境而变化。在一些实施方案中,电离辐射可为电离电磁辐射,如包括以下的辐射:γ射线、x射线和/或hydrogenlyman-alpha(hlyman-α)中的紫外线、光谱的真空紫外线(vuv)、或远紫外线(euv)区。在其它情况下,电离辐射可包括放射性衰变产物,如α粒子、β粒子或中子。此外,在一些情况下,本文所述的放射性纳米颗粒可为用于生物区室的辐射敏化剂。因此,在一些情况下,本文所述的组合物可用于通过提供内辐射疗法或近距离放射疗法并且还通过增强外辐射疗法的作用治疗如癌症的疾病。此外,还应理解,在一些实施方案中,放射性纳米颗粒可为由放射性纳米颗粒本身发出的辐射的辐射敏化剂,以便由放射性纳米颗粒提供的内辐射疗法的作用得到增强。
此外,在一些情况下,本文所述的组合物还可为高热剂。在这类实施方案中,组合物的放射性纳米颗粒可吸收适当波长的电磁辐射且随后将吸收的电磁辐射的至少一部分能量转化为热能,从而造成放射性纳米颗粒和纳米颗粒周围环境的温度的升高。因此,在一些情况下,本文所述的方法还包括将其中设置了放射性纳米颗粒的生物区室暴露于一束具有可被放射性纳米颗粒吸收的波长的电磁辐射束。在一些情况下,电磁辐射包括可见光或集中于电磁光谱的可见光谱区,如介于450nm与750nm之间。在一些情况下,电磁辐射包括红外(ir)光或集中于电磁光谱的ir区域的光。例如,在一些实施方案中,电磁辐射集中于近-ir(nir,750nm-1.4μm)、短波ir(swir,1.4-3μm)、中波ir(mwir,3-8μm)或长波ir(lwir,8-15μm)。此外,在一些实施方案中,电磁辐射与水和/或生物组织具有最小吸收的光谱波长重叠,如介于约700nm与约800nm之间或介于约1.25μm与约1.35μm之间的波长。
此外,在一些实施方案中,本文所述的组合物也可为能够提供成像和治疗的成像剂或治疗性诊断剂。例如,在一些情况下,本文所述的组合物包括还具有mri活性和/或pet活性的本文所述的放射性纳米颗粒。在一些这类实施方案中,放射性纳米颗粒包括在上文部分iii中所述的复合颗粒,如包括在由金属纳米颗粒核心限定的腔内的磁性纳米颗粒的复合颗粒。在一些实施方式中,复合颗粒包括氧化铁,如fe3o4。
本文所述的一些实施方案进一步在以下非限制性实施例中说明。
实施例1
使用堆叠膜形成的中空au纳米颗粒
与本文的一些实施方案一致的中空au纳米颗粒提供如下。使用具有在3mnacl溶液中的ag/agcl电极作为参考和铂网作为反电极的三电极电极沉积槽形成纳米颗粒,如图1中所示。使用princetonappliedresearch273a稳压器/恒流器将电位施加于工作电极上。二至五个商用氧化铝膜(whatmancorp.)的堆叠提供多个成核衬底。每个膜厚约60μm,其中通道延伸穿过整个厚度。每个膜的一侧还展现小分支。通道直径为约300nm且分支的直径在约20nm至约200nm之间变化。通道密度为大约109/cm2。膜的俯视图和横截面视图示于图2中。膜被堆叠起来以使得每个膜的分支侧(如果有的话)最靠近膜下方而非膜上方(即,分支侧定向于膜堆叠中每层的底部而非顶部)。将500nmcu层溅射沉积在堆叠中的底部膜的底侧上并充当工作电极。将具有直径为1cm的o形环的特氟隆槽置于膜堆叠的顶部上。
电解质被设置于如上所述的电极沉积槽中。电解质是通过首先制备包含以下的水溶液来制备的:~3%(按体积计)硫酸(18m,alfaaesar)、~3%(按体积计)乙二胺(eda,从99%稀释来的50%溶液,sigma-aldrich)、~10%(按体积计)亚硫酸金钠(na3au(so3)2,由购自colonialmetals,inc.的ph10.5溶液稀释来的10%溶液)及~7%(按体积计)亚硫酸钠(na2so3)(2m水溶液,sigma-aldrich)。溶液具有约7.0的ph。然后通过以下操作来改变溶液:添加0.01m硫酸(h2so4)或0.4m氨基磺酸镍水溶液(ni(so3nh2)2,使用去离子水和购自sigma-aldrich的98%氨基磺酸镍四水合物(ni(so3nh2)2)·4h2o)制备)以使ph降至~6.0。
在将电解质设置于电极沉积槽中之后,施加比-0.6v(相对于ag/agcl)更负的电位,由此形成大的au纳米棒和较小的中空au纳米颗粒。在所有膜的孔内壁表面上观察到中空au纳米颗粒。在更靠近底部电极的膜中观察到更多中空纳米颗粒。这些中空纳米颗粒的数目随着距底部电极的距离而逐渐减少,如图3所示。在图4的底部可见一些电沉积的au纳米棒,而在图3和4中可见一些中空au纳米颗粒。在图3a和图3b的底部可见在每个膜的底部处的分支。
中空au纳米颗粒是通过首先从槽中倾倒出电解质并使用去离子水洗涤来分离的。然后将去离子水添加到槽中并且保持在那里至少半小时以允许电解质完全扩散到膜外。重复此过程至少三次。然后使用1m氢氧化钠(naoh)溶液单独溶解堆叠中的膜。通过在去离子水中的几个分散循环继之以离心来纯化剩余的中空au纳米颗粒。图4示出了在溶解第一膜之后中空au纳米颗粒在工作电极上的电沉积金属的顶部上的积聚。
使用扫描电子显微术(sem)、透射电子显微术(tem)和动态光散射(dls)表征中空au纳米颗粒。使用在300kv下操作的hitachih9500hr-thm获取明视场图像和选区电子衍射(saed)图。样品是通过以下操作来制备的:将一滴中空au纳米颗粒悬浮液置于碳涂覆的铜栅格上,等待10分钟以便颗粒沉积在格栅上,然后除去过量溶液。图5示出了中空au纳米颗粒的tem显微图(a-c)和选区衍射图(d)。将离子铣削用于开放中空au纳米颗粒以便于进一步表征。使用zeisssupra55vpsem采集sem显微图。样品是通过以下操作来制备的:将中空au纳米颗粒的稀释的水性悬浮液散布在一块硅晶片上,由此在表面上形成单层纳米颗粒。使用具有倾斜4度的4.5kev离子枪的gatan精密离子减薄仪(gatanprecisionionpolishingsystem)进行离子铣削持续5分钟。两个束电流是36μa和48μa,并且在4rpm下旋转样品。图6示出了经处理的中空au纳米颗粒。图7示出了使用dls的中空au纳米颗粒群的尺寸分布。
实施例2
使用图案化衬底形成的中空au纳米颗粒
与本文的一些实施方案一致的中空au纳米颗粒提供如下。使用具有在3mnacl溶液中的ag/agcl电极作为参考和铂网作为反电极的三电极槽形成中空au纳米颗粒,如图8中所示。由玻璃衬底(光学显微镜载玻片)上的ag条纹组成的光刻图案化电极被用作工作电极。将光学显微镜载玻片用去离子水冲洗,然后在使用之前用等离子体处理清洁。将光刻法用于对玻璃衬底进行图案化。光掩模设计示于图9a中。条纹的宽度是50μm,且每100μm重复一次条纹。ag条纹图案化的衬底示于图9b中。衬底的未涂覆的玻璃区域提供用于中空au纳米颗粒的成核和生长的表面。使用princetonappliedresearch273a稳压器/恒流器将电位施加至工作电极。
电解质被设置于如上所述的电极沉积槽中。用于制备各种电解质的试剂级化学品包括以下。ph~10.5的亚硫酸金钠(na3au(so3)2)水溶液购自colonialmetalsinc.,并用去离子水稀释至10%或5%。用去离子水将乙二胺(eda,99%,sigma-aldrich)稀释至50%或5%。使用去离子水和购自sigma-aldrich的98%氨基磺酸镍四水合物(ni(so3nh2)2·4h2o)制备ph~5.8的0.4m氨基磺酸镍(ni(so3nh2)2)水溶液。为了制备一系列电解质,将表1中所示的组分混合,并且将电解质用5%硫酸进一步酸化以达到约6的ph。
表1:电解质.
在将电解质设置于电极沉积槽中之后施加电位。当将比氢逸出平衡电位更负的电位施加于ag条纹上时,在玻璃区域上形成大量金纳米颗粒,如图10所示(比例尺为1μm)。使用无ni2+的电解质形成图10a中的纳米颗粒。使用包括ni2+的电解质形成图10b中的纳米颗粒。
实施例3
使用tem栅格的中空au纳米颗粒
与本文的一些实施方案一致的中空au纳米颗粒提供如下。使用类似于实施例2中所述方法的方法形成中空au纳米颗粒,例外的是tem栅格被用作工作电极和成核衬底。tem栅格包括涂覆有碳膜的铜网。如图11所示,在碳膜上观察到中空au纳米颗粒。比例尺为1μm。在电沉积之后且无任何进一步处理的情况下进行通过高分辨率tem(hr-tem)的表征。
实施例4
具有多孔壳的中空au纳米颗粒
与本文的一些实施方案一致的中空au纳米颗粒提供如下。使用类似于实施例1中所述方法的方法形成纳米颗粒。使用如实施例1中所述的电极沉积槽,例外的是使用两个而非五个阳极氧化铝过滤膜的堆叠,并且将700nm的cu层溅射沉积以堵塞底部膜的孔并充当工作电极。商用亚硫酸au溶液(来自technic,inc.的techni-gold25esrtu)被用作电解质。溶液的初始ph为约7.0。通过添加0.4m氨基磺酸ni溶液以使ph变为约6.0来改变溶液。使用princetonappliedresearch273a稳压器/恒流器将-0.80v(相对于ag/agcl参考)的电位施加于工作电极上。在此电位下发生氢逸出。为了获得具有多孔壳的中空au纳米颗粒,反应时间保持小于10分钟。如实施例1中所述纯化并分离具有多孔壳的中空au纳米颗粒。
实施例5
包含中空au纳米颗粒的中空au纳米颗粒
与本文的一些实施方案一致的中空au纳米颗粒提供如下。使用类似于实施例1中所述方法的方法形成中空au纳米颗粒,例外的是施加的电位是脉冲的。用-0.8v(相对于ag/agcl)的施加电位持续600秒继之以开路持续300秒来起始纳米颗粒的制造。再重复脉冲电位两个循环。如图13所示,获得双壳纳米颗粒。内腔的平均直径为约50nm,且总尺寸为约300nm。比例尺为200nm。其它双壳纳米颗粒示于图14中。图14a-c中的比例尺为100nm。图14d中的比例尺为20nm。
实施例6
包含fe3o4纳米颗粒的中空au纳米颗粒
与本文的一些实施方案一致的包含fe3o4纳米颗粒的中空au纳米颗粒提供如下。以类似于实施例4中所述方式的方式制备具有多孔壳的中空au纳米颗粒。用0.2m亚硫酸钠调节电解质的ph值以达到约6.5的ph,并且反应时间在400与600秒之间。所得的中空au纳米颗粒具有直径为约50nm的腔和厚度小于约25nm的壳。壳为多孔的并且展现约2-3nm的孔尺寸,如通过hr-tem所测量。
为了在中空au纳米颗粒内产生氧化铁纳米颗粒,在剧烈搅拌下将5.2g(0.032mol)无水fecl3和2g(0.016mol)fecl2添加到25ml含有0.85mlhcl(12.1n)的去离子水中。此后,用去离子水稀释fecl2和fecl3在hcl中的混合溶液40次。将所得的水溶液使用真空过滤传送到载有如上所述的中空au纳米颗粒的氧化铝膜的通道中,其中氧化铝膜充当真空过滤操作中的“过滤器”。然后将润湿的氧化铝膜浸没在fecl3/fecl2溶液中约30分钟。随后将膜转移到5ml30%nh4oh水溶液中并且留在那里再持续10-20分钟。黄橙色出现,表明氧化铁纳米颗粒形成。通过使去离子水在真空过滤下穿过该膜除去氧化铝膜内但在中空au纳米颗粒外形成的游离氧化铁纳米颗粒(直径为约10nm)。接着使用1-2mnaoh(水溶液)溶解该膜,并且将fe3o4/au核/壳纳米颗粒释放到溶液中。通过在去离子水中的几个分散循环继之以离心来纯化纳米颗粒。此过程描绘于图15中。
通过能量色散x射线光谱法(eds)和tem(包括选区电子衍射(saed))表征复合纳米颗粒。还检查了复合颗粒的光学和磁学性质。图16示出了在将氧化铁纳米颗粒装载到中空au纳米颗粒中之前(图16a)和之后(图16b)的tem图像。在fe3o4纳米颗粒在中空au纳米颗粒的腔内沉淀期间,fe3o4纳米颗粒也在腔外形成。但tem图像显示小的氧化铁纳米颗粒没有附着于中空au纳米颗粒的外表面。游离的(即不截留在中空au纳米颗粒腔内)fe3o4纳米颗粒的直径小于20nm并且使用过滤和离心容易从fe3o4/au复合颗粒中分离。fe3o4装载到多孔中空au纳米颗粒的核心中是通过单一复合颗粒的eds分析(图16c)和源自三个复合颗粒的选区电子衍射(saed)图(图16d)来证实的。
fe3o4/au复合颗粒的水性悬浮液示于图17a中。该悬浮液呈青色,表明悬浮液吸收红光。图17b中示出的吸收峰对应于中空au纳米颗粒的spr波长。中空au纳米颗粒的吸收分布在fe3o4装载之前和之后几乎无变化。不希望受理论束缚,吸收分布的维持可能是由于au壳的厚度(>20nm)导致的。因此,有可能独立地选择和维持中空纳米颗粒主体的光学性质。
此外,如图17a所示,复合颗粒可移向永久磁体。包含fe3o4/au复合颗粒的干燥粉末的磁化曲线表现出迟滞,如图18所示。曲线形状提示在中空au纳米颗粒的腔内存在一些较小的(<20nm)超顺磁性fe3o4纳米颗粒以及一些较大的(>30nm)铁磁fe3o4纳米颗粒。
实施例7
包含掺杂的fe3o4纳米颗粒的中空au纳米颗粒
与本文的一些实施方案一致的包含掺杂的fe3o4纳米颗粒的中空au纳米颗粒提供如下。包含fe3o4纳米颗粒的中空au纳米颗粒以类似于实施例6中所述方式的方式制备,例外的是掺杂剂离子的来源还连同fe2+和fe3+离子的来源一起提供。掺杂剂离子包括可用于正电子发射断层摄影(pet)成像的核素,如64cu2+或89zr4+。一旦au/掺杂的fe3o4纳米复合材料以类似于实施例6中所述方式的方式制备和纯化,便如下对表面进行官能化。在氧化铝膜溶解之前,将硫辛酸或二氢硫辛酸(dhla)的溶液添加到膜中,从而造成此配体与中空au纳米颗粒表面的缔合。接着进一步用去离子水冲洗该膜。然后使用与n-(3-二甲基氨基丙基)-n”-乙基碳二亚胺盐酸盐(edc)和n-羟基磺基琥珀酰亚胺(磺基-nhs)偶联的碳化二亚胺将硫辛酸/dhla配体的羧酸基团偶联到nh2gr11,其中nh2gr11为在例如gao等人,aminoacids,2010年3月11日:20221650中所述的前列腺癌特异性聚精氨酸肽,该文献据此以引用的方式整体并入。随后通过尺寸排阻高效液相色谱法(hplc)或使用分子量截断值为约30kda的centricon过滤器的三个离心过滤循环纯化包含肽靶向剂的纳米复合颗粒。此过程描绘于图19中。
实施例8
包含治疗剂的中空au纳米颗粒
与本文的一些实施方案一致的中空au纳米颗粒提供如下。以类似于实施例4或实施例6中所述方式的方式制备具有多孔壳的中空au纳米颗粒。然后将装载有多孔中空au纳米颗粒的氧化铝膜浸没到治疗剂(如药物)的浓缩溶液中。将膜保持在溶液中持续足够的时间(如10-600分钟)以允许治疗剂扩散到au纳米颗粒腔中。接着将含金属前体(如na3au(so3)2)添加到膜中的溶液以允许多孔au壳生长,由此密封至少一些孔。所得的包含治疗剂的中空au纳米颗粒可随后用于医学处理。包封的治疗剂过使au壳破裂来释放。通过用具有在壳的spr频率处或附近的波长的光辐照壳使该壳破裂。
实施例9
包含拉曼活性物质的中空au纳米颗粒
与本文的一些实施方案一致的中空au纳米颗粒提供如下。中空金纳米颗粒如实施例4中所述来合成。中空金纳米颗粒具有直径为约50nm且外径为约100nm的腔,其吸收峰集中在730nm。将含有约1.1×1011个纳米颗粒/ml的阳极氧化铝膜浸没在新鲜制备的5μm二乙基噻三羰花青(dttc)拉曼报告染料的20ml溶液中并且在室温下保持3小时。接着用去离子水冲洗氧化铝膜若干次。然后在4℃下将装载有纳米颗粒的膜浸没在20μmsh-mpeg(mw5kda,其中mpeg是指甲氧基聚乙二醇)的溶液中过夜。随后使用1mnaoh溶液溶解氧化铝膜。通过在去离子水中的几个分散循环继之以离心来纯化纳米颗粒。此过程示出于图20中。
所得到的包含拉曼活性物质(也称为“拉曼纳米标签(ramannanotags)”)的中空au纳米颗粒是通过拉曼光谱法来表征的。在具有785nm激光的自制装置中进行拉曼光谱法测量。激光通过光纤(600μm,na=0.39)传播到拉曼模块。在拉曼模块处,来自此光纤的光被中性密度滤光片(nd=0.2)削弱并且在其入射到分色镜上之前准直,该分色镜将光反射到工作距离为8.4cm的20x,0.4na物镜上。将含有拉曼纳米标签悬浮液的槽置于此透镜的焦点处以供表面增强的拉曼光谱法(sers)测量。被悬浮液反射和散射的光由物镜收集并且通过分色镜传播到陷波滤波器,之后通过10x,2.5na透镜聚焦到光纤(600μm,na=0.39)中,随后光纤将光传播到分光计。以8秒的暴露时间获取光谱。具有5.8×1010个纳米颗粒/ml的浓度的50μl拉曼纳米标签溶液的拉曼光谱显示在379、489、622、778、843、1017、1074、1103、1129、1232、1329、1405、1460及1513cm-1处的dttc的主要振动模式,如图21所示。拉曼纳米标签在10mm磷酸盐缓冲盐水(pbs)中是稳定的,如图22所示。拉曼纳米标签在室温下在3mnacl中也能稳定长达一个月。通过uv-vis光谱法未观察到聚集。通过pbs中的dls来测量拉曼纳米标签的尺寸。如图23所示,pbs中的测量尺寸比通过sem所示的尺寸大约10nm。比例尺为500nm。
使用pc-3细胞系(即,人前列腺癌细胞系(美国典型培养物保藏中心(americantypeculturecollection),manassas,va))评估拉曼纳米标签的细胞毒性。将细胞保存于补充有5%fbs(胎牛血清)和1x青霉素/链霉素的gibcot培养基中。将细胞在37℃下于5%co2环境中孵育并且在p150板中在75%汇合下传代。使用pbs和胰蛋白酶/edta从单层中收集培养的pc-3细胞并将其悬浮于具有5%fbs的t-培养基中。使用[3h]-胸苷掺入进行细胞毒性评价,[3h]-胸苷掺入是作为细胞增殖标记的dna合成速率的测量。将大约3000个细胞接种于平底96孔聚苯乙烯涂覆的板中并且在37℃下在5%co2孵育箱中孵育24小时。将具有不同涂层(仅peg对比具有peg的拉曼报告染料)的中空金纳米颗粒悬浮于t-培养基中。评价的浓度为960、480、96及9.6mm。将装载有中空金纳米颗粒的t-培养基一式六份添加到板中。在孵育细胞和纳米颗粒24小时之后,从每个孔中吸出t-培养基,并且用完全生长t-培养基冲洗细胞层3次,然后将[3h]-胸苷溶液(1μci/100μlt-培养基)添加到每个孔中。2小时孵育之后,从每个孔中吸出培养基并用完全生长t-培养基冲洗细胞层3次。接着用100μl的2nnaoh溶液溶解细胞。从孔中收集溶液并且添加到含有5mlbudget-solve完全计数混合物的闪烁小瓶中。最终,通过液体闪烁β-计数器(beckmanls6500)量化掺入dna中的[3h]-胸苷。统计上,经处理的细胞显示与对照相同的活力。
实施例10
包含靶向物质的中空au纳米颗粒
与本文的一些实施方案一致的中空au纳米颗粒提供如下。如实施例9中所述制备拉曼纳米标签,例外的是如下进行拉曼报告染料和聚乙二醇的添加。使新鲜制备的拉曼报告染料溶液流过装载有多孔中空au纳米颗粒的氧化铝膜,接着流过容积比为2:7的sh-mpeg(10μm,mw5kda)与sh-peg-cooh(1μm,mw2kda)溶液的混合物的膜。向1ml纯化的拉曼纳米标签的溶液中添加edc和磺基-nhs并且孵育30分钟。然后通过三个离心循环继之以pbs中的再分散来纯化复合颗粒。随后将抗psma(其中“psma”是指在前列腺癌中过度表达的ii型跨膜糖蛋白)添加到活化酯纳米标签的溶液中,并允许混合物在4℃下反应过夜。通过尺寸排阻柱分离或centricon离心来纯化所得到的抗体-纳米标签缀合物。
实施例11
具有粗糙表面的中空au纳米颗粒
与本文的一些实施方案一致的中空au纳米颗粒提供如下。以类似于实施例1中所述方式的方式制备具有粗糙表面的中空au纳米颗粒,例外的是电解质的ph改变如下。使用具有约6.0的ph的电解质制备的中空au纳米颗粒展现相对光滑的壳。为了增加表面粗糙度,通过添加2mna2so3(ph约9.0)使电解质的ph增至约6.5或7.0。不希望受理论束缚,粗糙度的ph依赖性可归因于随着ph的na3au(so3)2的自动催化反应速率(及由此的颗粒生长和最终粒度)的提高。图24示出了使用具有不同ph值的电解质合成的中空金纳米颗粒的表面形态。图24a示出了在约6.0的电解质ph下形成的光滑壳。图24b示出了具有约5nm的表面粗糙度和在约6.5的电解质ph下形成的壳。图24c示出了具有约8nm的表面粗糙度和在约7.0的电解质ph下形成的壳。图25示出了中空au纳米颗粒的水性悬浮液的相应吸收光谱。图25中的虚线对应于模拟吸收分布。等离子体峰随着电解质ph的增加移向更长波长。当ph从约6.0变至6.5变至7.0时,spr峰从约600nm移向630nm移向730nm。
实施例12
半球形和管形au纳米颗粒
与本文的一些实施方案一致的半球形和管形au纳米颗粒提供如下。使用类似于实施例1中所述的电化学沉积槽。将电解质设置在电极沉积槽中。电解质是通过首先制备包含以下的水溶液来制备的:~3%硫酸、~3%乙二胺(eda)、~10%亚硫酸金钠(na3au(so3)2)及~7%亚硫酸钠(na2so3)。该溶液具有约7.0的ph。然后通过添加0.01m硫酸(h2so4)以降低ph至约4.0来改变溶液。在将电解质设置在电极沉积槽中之后,施加比-0.6v(相对于ag/agcl)更负的电位持续约10-60分钟。在约10分钟的沉积时间下,在孔壁上观察到半球形金纳米颗粒(图26a)。在约60分钟的沉积时间下,观察到管形纳米颗粒(图26b)。图26中的比例尺为200nm。不希望受理论束缚,据信纳米颗粒形态受孔壁表面上的h2气泡的接触角的影响,而接触角继而受到孔壁表面的疏水性的影响。
实施例13
中空au纳米颗粒的光热性质
研究在近红外(nir)激光辐照下中空au纳米颗粒在类似组织的假想图中的光热性质。使用1%intralipid、明胶粉末和多聚甲醛制备凝胶假想图。简言之,将2400mg高度纯化的明胶粉末与228ml去离子水混合。然后通过微波在间歇混合下加热混合物2-4分钟(至约900℃)直到明胶溶解并且溶液看起来澄清和无色。通过室温下的连续混合,使明胶溶液冷却至600℃,此时添加12ml1%intralipid(20%脂肪乳液,sigma-aldrich)和140mg多聚甲醛(95%,sigma-aldrich),由此造成溶液变为白色和浑浊的。形成凝胶假想图之后,在假想图中生成薄袋。将具有集中在750nm处的spr峰的中空au纳米颗粒(50μl,3.0×109个纳米颗粒/ml)的悬浮液经由移液管设置在袋中。还将二极管激光纤维(平均波长810nm)置于与纳米颗粒悬浮液接触的袋中心中。将激光纤维用于辐照中空au纳米颗粒。通过温度计记录作为距离和时间函数的假想图中的温度变化。图27示出了实验设置。
在300w/cm2的功率密度下进行来自nir二极管激光的辐照持续1分钟。在1分钟的辐照时间下,温度在距离辐照点1、3和4mm处分别上升了23、13和8℃。因为水也在810nm下吸收,所以使用水而非中空au纳米颗粒的悬浮液进行对照实验。在对照实验中温度在1、3和4mm的距离处分别上升了12、7和5℃。结果示于图28中。
还使用具有8-9.6μm的检测窗的红外焦平面阵列摄像机(flir型号sc6000,640×513像素,25μm间距)研究中空au纳米颗粒的光热性质。该方法比较含有两种不同纳米颗粒悬浮液的两个比色皿的光热性质:(1)具有约80nm的直径的实心球形金纳米颗粒(1.0×1010个颗粒/ml),及(2)具有约50nm的腔直径和约100nm的外径的中空金纳米颗粒(1.0×1010个颗粒/ml)。将每个比色皿置于摄像机镜头的焦平面处,并且将准直激光(集中在800nm处)导向在比色皿的中心上。入射激光功率为350mw,且准直高斯光束的直径为3mm。在金悬浮液中的入射光通量为1.2w/cm2。图像获取速率为每秒1帧,从辐照开始起。每10分钟辐照比色皿。记录图像30分钟。为了使温度与每个图像像素的测量的红外辐射强度相关联,进行校准实验。通过记录水从加热水浴循环通过的比色皿的图像进行校准。置于水浴中的热电偶与图像获取同步连续地测量温度。图29示出了用中空金纳米颗粒填充的比色皿的红外吸收图像。最大温度升高发生在比色皿的中心处。与实心球形金纳米颗粒相比,中空金纳米颗粒的温度升高明显增强,如图30所示。
实施例14
放射性纳米颗粒
根据本文所述的一些实施方案的放射性纳米颗粒制备如下。
首先,为了提供金属纳米颗粒核心,如实施例1中一般所述制备中空au纳米颗粒。更具体地说,将具有1cm直径和300nm直径通孔的阳极氧化铝(aao)膜用于收集中空au纳米颗粒。所得到的中空au纳米颗粒是单分散的并且具有大于100nm的外径。中空au纳米颗粒还具有50-70nm直径腔和厚度小于25nm的多晶au壳。
然后在金属纳米颗粒核心上依次形成金属内壳和金属外壳,如图36中示意性地示出。出于说明目的,图36中的纳米颗粒是以剖视图描绘。然而,应理解的是这种描绘仅出于说明目的并且不表明存在不完整的金属内壳或金属外壳。如图36所示,首先通过无电沉积工艺用cu涂覆中空au纳米颗粒。具体来说,用9mlcu2+电镀液(含有在5%w/vedta中的0.4mcuso4、37%v/v甲醛及1.0mnaoh,比例为1:1:1v/v)处理含有截留的中空au纳米颗粒的每个氧化铝膜20min。20分钟之后,用水洗涤含有电镀cu的中空au纳米颗粒的膜三次。
接着通过电流置换反应用pd置换cu层。更具体地,进行两个连续的电流置换反应。在第一电流置换反应中,在将铜无电电镀于金属纳米颗粒核心上之后将含有金属放射性同位素pd-103的溶液添加到组合物中。在第二电流置换反应中,将非放射性pd添加到组合物中。具体来说,首先排干每个aao膜并使用真空过滤装置用0.1m柠檬酸溶液(三次)冲洗以便用柠檬酸完全浸泡膜通道,然后添加含有4.37mcipd-103的3ml0.1m柠檬酸溶液。接着继续“热”pd-103的电镀持续24h,随后添加“冷”pd电镀液(含有在0.4m柠檬酸溶液中的0.0025mpdcl2)。1h之后,添加2mnaoh以溶解膜并且通过在14000rpm下离心(legendmicro21,fl,usa)10min用水洗涤所生成的纳米颗粒悬浮液三次,在每轮离心之后进行超声处理(branson2510,ct,usa)。以此方式,制备具有中空au纳米颗粒核心及包含pd-103和非放射性pd的金属外壳的放射性纳米颗粒。这些放射性纳米颗粒可表示为“103pd@au纳米种子”。通过在pbs(ph=7.4)中超声处理来分散103pd@au纳米种子的沉淀。如通过剂量校准器(capintechinc,pa,usa)所测定,整个过程以大于80%的放射性标记效率产生103pd@au纳米种子,其中效率百分比基于所用的pd-103的总量。动态光散射(dls)评估证实合成的103pd@au纳米种子为单分散的,平均粒度为140.5±7.6nm。另外,103pd@au纳米种子为高度带负电的(-25.81±1.8mv)。此外,如图37所示,tem显微术显示纳米颗粒的核-壳结构。如图38所示,sem显微术表明纳米颗粒群具有近乎完美的球形和极窄的尺寸分布。注意到出于安全性和依从性原因,图37和图38中所示的显微镜图像具有非放射性纳米颗粒,其是此实施例中所述的放射性纳米颗粒的对应物。具体来说,图37和图38的非放射性纳米颗粒是以相同方式制备的并且具有与本文针对放射性纳米颗粒所述的相同结构,例外的是不使用放射性同位素。发现103pd@au纳米种子极其稳定并且甚至在8±2℃下贮存于溶液中2个月之后保留它们的原始尺寸。虽然在贮存期间观察到103pd@au纳米种子的结块,但纳米种子可通过温和的超声处理30秒再分散于pbs中。
对于以上工序,pdcl2和cuso4·5h2o分别获自sigma-aldrich(st.louis,mo)和alfaaesar(wardhill,ma)。放射性pd-103购自nordion(ontario,canada)。pbs购自invitrogencorporation(carlsbad,ca)。所有其它溶剂和试剂均为分析纯度级的并购自vwr(brisbane,ca)。所有水溶液是在获自milliporegradientmilli-q水系统(billerica,ma)的milliporemilli-q水(18mω-cm)中制备的。
实施例15
进行近距离放射疗法的方法
实施例14的放射性纳米颗粒在近距离放射疗法中的使用在动物模型中如下评价。
a.动物研究
对于实施例14的放射性纳米颗粒或“纳米种子”的体内评价,包括其在肿瘤位点中的滞留、毒性和治疗功效,使用携带人前列腺癌肿瘤的scid小鼠。根据以下文献,仅在略微改动下进行肿瘤诱导:matsuno等人,“inductionoflastingcompleteregressionofpreformeddistinctsolidtumorsbytargetingthetumorvasculatureusingtwonewanti-endoglinmonoclonalantibodies,”clinicalcancerresearch,5,371-382(1999);及vanweelden等人,“apoptoticregressionofmcf-7xenograftsinnudemicetreatedwiththevitamind3analog,eb1089,”endocrinology,139,2102-2110(1998)。更多细节在下文中提供。将含有3×106个pc3细胞的细胞悬浮液皮下植入scid小鼠的双肩中。使得肿瘤生长4周以达到约181.67±62.14mm3的可触及的尺寸。在第0天将动物随机分到三个组(n=6)中,其中(a)pbs溶液,(b)“冷”pd@au纳米颗粒pbs悬浮液(其中这种“冷”纳米颗粒与实施例14的纳米种子相同,例外的是排除放射性pd-103),或(c)“热”纳米种子pbs悬浮液被注射到由scid小鼠携带的肿瘤中。组(a)和(b)充当对照。注射在6-9个随机选定的位置处进行以便将剂量均匀地分布在整个肿瘤性肿块中。对于实验样品(即,热纳米种子样品),将1.5mci含有pd-103的热纳米种子注射到肿瘤中。悬浮液体积为40μl,其中纳米颗粒浓度为2.03×1010个纳米颗粒/ml。将相同量的pbs溶液和冷纳米种子组合物注射到两个对照组的肿瘤中。
b.放射性纳米颗粒在肿瘤位点中的滞留
对于用实施例14的热纳米种子处理的组,在肿瘤内注射之后,(在第0天、注射后第1、2、4天(d.p.i)以及在注射后第1、2、4及5周(w.p.i.))以纵向方式进行spect/ct成像以便通过在小动物spect/ct扫描器上获取pd-103的低能x射线发射来非侵入性地监测纳米种子的滞留。结果示于图39和图40中。在1d.p.i.时进行的定量spect分析(图40)显示注射剂量停留在施用位点处(101.50±23.72%id/g),在肝脏(0.11±0.06%id/g)和脾脏(0.14±0.01%id/g)中观察到可忽略量的放射性。随着研究的进行,通过定量spect分析所测定的肿瘤中的摄取水平在5w.p.i时逐渐增至274.48±77.62%id/g,这是由于肿瘤体积因纳米种子的放射治疗效果而缩小。
通过平行离体测定进一步研究纳米种子的生物分布。在研究期间的不同时间点(注射后第1天、第1周、第2周、第3周及第5周),处死三只用热纳米种子处理的小鼠,并且将目标器官(血液、心脏、肺、肌肉、骨、脂肪、肝脏、脾脏、肾脏、胃、小肠、大肠、脑、尾及肿瘤)切除、称重,然后通过γ-计数器测量其放射性。此后,使用王水溶解组织并使用icp-ms进行分析以测量au和pd含量。在γ-计数器与icp-ms结果之间存在良好的一致性(无统计上显著的差异,p=0.88),表明在五周的治疗性研究期间放射性pd-103随纳米种子一起停留。离体生物分布研究显示95.19±0.94%的纳米种子仍在肿瘤内,而3.31±1.11%和0.39±0.24%分别去了肝脏和脾脏。在其它组织中未观察到有意义的摄取。此外,肿瘤摄取在五周的研究期间保持基本上相同(p=0.35)。
c.放射性纳米颗粒的毒性
评估实施例14的放射性纳米颗粒的毒性并且将其与对照组和如上所述的“冷”纳米种子相比较。在5周处理期的过程中,在10和30d.p.i.时监测全血细胞计数(cbc)、丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)、血液尿素氮(bun)和肌酐水平。红细胞(rbc)计数和平均血红蛋白体积/rbc(mch)在整个研究期间保持未受影响,提示疗法没有引起溶血效应。还注意到,放射性纳米颗粒最初在10d.p.i.时降低白细胞(wbc)计数,这是放射疗法所常见的。然而,发现该效应是可逆的,如在30d.p.i之后wbc计数恢复正常可见。在血小板计数及其它参数的情形下观察到类似的效应。bun、alt、ast和肌酐测试在三组小鼠中显示无显著变化,表明没有与放射性纳米颗粒有关的肾和肝相关毒性。
d.放射性纳米颗粒的治疗功效
使用卡尺每隔一天以双盲方式测量三组携带肿瘤小鼠的肿瘤体积(图41)。15d.p.i之后,观察到肿瘤生长趋势的明显分离(p<0.0001)。在用放射性纳米颗粒处理的受试者中注意到肿瘤体积明显减小,而在pbs和冷纳米种子组中观察到肿瘤体积的进行性增加。值得注意的是,在放射性纳米颗粒测试组中的两只小鼠的两个肿瘤的体积缩小到35d.p.i之后所不能发现的程度。在pbs和冷纳米种子组中的平均肿瘤尺寸从67.08±30.96mm3和58.75±35.29mm3分别增至187±80.11mm3和122.14±4.082mm3。另一方面,在放射性纳米颗粒组中,观察到肿瘤尺寸的显著减小:82.75±46.25mm3至处理35天后的19.83±20.12mm3(p<0.001)。
还采用[f18]fdg(2-[18f]氟-2-脱氧葡萄糖)正电子发射断层摄影(pet)成像来评估实施例14的放射性纳米颗粒的治疗功效。图43示出了在不同的时间点时三个小鼠研究组的典型fdg-pet/ct扫描图像。可见在第0天,来自所有三个组的小鼠在类似的fdg摄取下具有大致相同的肿瘤尺寸,而随着研究进行持续35天,在放射性纳米颗粒处理过的组(上图)中观察到与pbs(下图)和冷纳米种子(中图)处理过的组中相比显著的肿瘤fdg摄取减少。定量pet分析示于图44中,作为最大标准化的摄取值(suvmax)对比时间。suv表示肿瘤中的放射性浓度,其针对注射的fdg剂量和体重来归一化。显示用放射性纳米颗粒处理的小鼠的suvmax从第0天至第35天减小了62%(p=0.00041),且在第35天与pbs和冷纳米种子处理过的组中的suvmax相比分别小了65%(p=0.00019)和66.5%(p=0.00028)。放射性纳米颗粒处理过的组的suvmax减至这种低水平是肿瘤对放射性纳米颗粒的放射疗法的病理反应的证据。还利用ct图像来确定肿瘤体积,如图45所示。
e.方法
使用pd-103的低能发射的spect成像方法
在nanospect/ctplus系统(bioscan,washington,dc,usa)中开发了使用pd-103的spect成像方法。通过将能量峰值和宽度分别设为18kev和60%将pd-103同位素添加到nanospect/ctplus同位素文库中。随后使用3ml注射器和1.2mcipd-103进行定量校准。
放射性纳米颗粒的肿瘤内施用和spect分析
在pbs(ph7.4)中制备放射性纳米颗粒剂量(≈1.5mci)并且肿瘤内注射到携带pc3肿瘤的scid小鼠中。在6-9个随机选定的位置处小心地进行肿瘤内注射。注射之后,使用nanospect/ctplus系统进行小动物成像。在每个剂量的肿瘤内注射之后,在0、1、2、4、7、14、21及35d.p.i时获取spect和ct图像。spect/ct的视场(fov)集中在小鼠的肩部。在55kvp,1000ms暴露和1:1的面元因子下使用360投影/旋转进行ct成像。用4个检测器阵列收集spect数据,该检测器阵列用多针孔孔径来准直,得到0.73mm的重建后分辨率。使用具有35%平滑、100%分辨率和3x3迭代(标准模式)的hispectng(sciviswissenschaftlichebildverarbeitunggmbh,germany)进行spect图像重建。使用invivoscope2.0软件包(bioscan,washington,dc,usa)进行肿瘤活性的量化。在ct和spect图像的配准之后,绘出圆柱形目标区域(roi),包括在含有器官的所有平面中的肿瘤和肝脏。
fdg-pet/ct成像
使用在视场(fov)中心处的有效空间分辨率为1.4mm的siemensinveonpet/ct多峰性系统(siemensmedicalsolutions,knoxville,tn)进行小鼠pet/ct成像。在pet成像之前使所有动物禁食12小时。每只小鼠经由尾静脉注射静脉内接受在150μl盐水中的150μcifdg。在图像获取之前和期间将小鼠置于热垫上。在注射后(p.i)1小时获取pet图像,持续15分钟,其中动物在2.5%异氟烷下。使用3dorderedsubsetsexpectationmaximization(osem3d/map)算法将pet图像重建到单帧中。在pet之后立即获取ct图像,其中fov集中在小鼠的肩部。在80kvp的功率、500μa的电流、145ms的暴露时间、4的面元及102μm的有效象素大小下获取ct投影(360步/旋转)。使用下采样因子为2的ct重建方案被设定为双线性内插,并且使用shepp-logan滤波器。在inveonacquisitionworkplace(siemensmedicalsolutions,knoxville,tn)中配准pet和ct图像以供分析。手动绘出目标区域(roi),包括在含有组织的所有平面中的肿瘤。靶活性计算为注射剂量百分比/克。
各种器官中的放射性及au和pd含量的离体测量
在注射放射性纳米颗粒之后第1天、第1周、第2周、第3周及第5周,处死三只小鼠,并且将所需器官(包括血液、心脏、肺、肌肉、骨、脂肪、肝脏、脾脏、肾脏、胃、小肠、大肠、脑、尾及肿瘤)收集、称重并转移到20ml小瓶中。为了测量与每个器官有关的放射性,在γ-计数器(perkinelmer2480wizard)中测量每个小瓶的活性并将其记录为每分钟计数。接着添加王水到小瓶中并留置过夜以消化器官。24h之后,使王水在150℃下沸腾出来。沸腾之后,添加10ml1%hcl溶液到小瓶中,接着超声处理30分钟。然后在感应耦合等离子体质谱仪(icp-ms,agilent7700x)中测量au和pd浓度。为每个样品重复测量至少三次。
统计分析
定量数据表示为平均值±平均值标准误差(sem)。通过单向anova进行平均值的比较和显著性评价,其中p值<0.05被视为统计上显著的。比较在不同的时间点下来自不同组和在每个个别组内的数据以确定它们是否为统计上可区分的。使用spss16.0版软件(ibmspssstatistics)进行所有数据分析。
实施例16
放射性纳米颗粒及进行近距离放射疗法的方法
如下制备根据本文所述的一个实施方案的放射性纳米颗粒并将其用于进行近距离放射疗法。
首先,如上文实施例14中所述来制备103pd@au纳米种子。其次,将硫醇化1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(dota)缀合至纳米种子的表面。最终,缀合的dota配体被y-90放射性标记,造成放射性纳米颗粒具有复合辐射分布,包括来自两种不同放射性同位素的两个不同的辐射分布:(1)由y-90提供的更快衰变分布,和(2)由pd-103提供的较慢衰变分布。然后将这些双重发射的放射性纳米颗粒动脉内施用至肝脏。具体来说,将放射性纳米颗粒注射到肝动脉中以便用低剂量率(ldr)和高剂量率(hdr)两者来治疗原发性肝癌或肝细胞癌(hcc)。
实施例17
放射性磁性纳米颗粒以及进行近距离放射疗法和成像的方法
如下制备根据本文所述的一个实施方案的放射性纳米颗粒并将其用于进行近距离放射疗法和mri,包括以同时或治疗性诊断方式。
磁性纳米种子的制备
首先,制备复合磁性纳米颗粒。具体来说,如上文实施例6中所述制备包含fe3o4纳米颗粒的中空au纳米颗粒。然而,在使用naoh溶解膜之前,原位复合磁性纳米颗粒被用作上文实施例14中所述的方法的金属纳米颗粒核心。另外,在进行实施例14中所述的额外步骤之前,充分洗涤设置在aao膜内的通道壁上的中空au纳米颗粒(其包含在au纳米颗粒的腔内的fe3o4纳米颗粒),而所述中空au纳米颗粒仍在aao膜内。以此方式,冲洗掉合成工序期间形成的小(<20nm)fe3o4纳米颗粒。
接着,使cu和pd溶液穿过aao膜的通道以便如上文实施例14中所述进行cu电镀和pd置换反应。在最终的pd置换反应发生之后,将膜溶于naoh溶液中,从而使最终的放射性磁性纳米颗粒释放到溶液中。这些纳米颗粒可称为“磁性纳米种子”。
为了提高磁性纳米种子的胶体稳定性,使用聚乙二醇化。具体来说,将硫醇封端的聚(乙二醇)(或类似物质)用于处理磁性纳米种子的外(pd)表面。铂族金属与软的硫基“配体”供体之间的强相互作用使得含硫配体成为用于磁性纳米种子的高效稳定剂。因此,具有pd表面的磁性纳米种子穿过硫醇-pd键被聚乙二醇化。此聚乙二醇化过程可在溶解氧化铝膜之前或之后进行,而纳米种子在膜内或它们在溶液中。如果聚乙二醇化发生在膜溶解之前,那么聚乙二醇化可通过将装载有纳米种子的膜浸没在200μmsh-mpeg(mw5kda)中伴随在40℃下的过夜搅拌来进行。然后使用1mnaoh溶液溶解氧化铝膜,并且通过在di水中的几个分散循环继之以离心来纯化游离的纳米种子。
作为上述过程的替代方案,注意到可使用钴(co)来代替如上所述的过程中及实施例14中的cu。此外,在这样一种情况下,co可形成金属内壳,该金属内壳不被如上所述的电流置换反应全部置换以便形成金属外壳(例如pd)。反而,co壳的足够部分可保留以便co壳充当磁性组分(例如,超顺磁性组分),包括用于mri或其它磁性成像目的。此外,在一些此类实施方案中,可省去在中空金属纳米颗粒的腔内形成磁性纳米颗粒(如fe3o4)的步骤。在此情况下,磁性纳米种子具有图36的最终产物的通用结构,例外的是cu内壳被co内壳替代,且此co内壳的一部分甚至在用于向纳米种子赋予放射性的后续电流置换反应之后还保留。保留的co内壳而非包封的磁性纳米颗粒由此向磁性纳米种子提供磁性官能度。
近距离放射疗法及成像
具有上述结构中的一种的磁性纳米种子可用于成像和/或治疗性诊断学应用,包括其中近距离放射疗法与近距离放射治疗剂的实时成影结合的应用。例如,在一些情况下,如上所述的磁性纳米种子被用作体内mri的造影剂。如本领域普通技术人员所理解,超顺磁性颗粒的磁矩通常比顺磁性材料的磁矩高104倍,并且可在局部磁场中产生实质性干扰,从而导致质子的快速移相(t2弛豫)。t2*-加权mr成像方法最常用于使用其它超顺磁性纳米颗粒的成像。然而,使用其它超顺磁性剂的t2*-w图像常具有低信噪比。t2*-wmr成像还对由一些试剂的存在所产生的磁化率高度灵敏,从而产生比积聚剂的实际尺寸更大的信号空隙。另外,来自这种试剂的图像空隙可难以与其它组织空隙或空隙样信号(由可出现在组织界面处的严重磁各向异性造成)区别开。为了克服这些限制,可使用偏共振饱和(ors)成像方法。ors方法可以大大提高的成像精确度产生来自基于超顺磁性纳米颗粒的试剂(如本文所述的磁性纳米种子)的“阳性”mri对比度。此项技术一般涉及在偏共振频率下rf脉冲的应用。通过在饱和及不饱和下收集图像的比例或减影获得阳性对比。此项技术允许在无对比前获取下图像对比的可视化。因此,ors-mri可用于追踪组织内部的磁性纳米种子。
作为动物模型,rg-2大鼠神经胶质瘤肿瘤模型被用于本发明的实施例中,该模型是开发用来研究神经胶质瘤的良好建立的动物模型。如通过mri所证实在所需受试者中的平均肿瘤直径达到3-4mm之后,在麻醉下立体定向地进行磁性纳米种子悬浮液的肿瘤内施用。具体来说,将10μl的剂量为1mci的纳米种子注射到肿瘤区域中。然后(例如在几周过程中)使用ors-mri以监测磁性纳米种子在肿瘤内的分布。另外,将t1-加权的对比度增强的(使用钆特醇)mr成像用于评价近距离放射疗法效果。
本文中提及的所有专利文献以引用的方式整体并入。在本发明的各种目标的实现中描述了本发明的各个实施方案。应该认识到这些实施方案仅为说明本发明的原理。在不背离本发明的精神和范围的情况下,其许多修改和改编将为本领域技术人员所显而易见。
- 还没有人留言评论。精彩留言会获得点赞!