一种负载聚苯胺的γ‑PGA纳米水凝胶的制备方法与流程
本发明属于纳米水凝胶的制备领域,特别涉及一种负载聚苯胺的γ-PGA纳米水凝胶的制备方法。
背景技术:
对于癌症,目前治疗的方法有手术治疗,放射治疗和化学药物治疗,这些传统的治疗方法仍然存在缺陷。光热治疗是治疗肿瘤的一种新技术,具有精确性、可控性和高效性,通过近红外光选择性照射肿瘤组织,其区域产生热量,温度升高,导致癌细胞死亡。因此,新型高效光热治疗的生物医学材料在肿瘤治疗中具有重要意义。光热的材料分为有机和无机材料,无机材料如金属纳米粒子的生物代谢差、长期毒性,以及碳纳米材料诱发的毒性反应。而有机材料具有良好的生物相容性、光学稳定性、较高的光热转化效率,使其脱颖而出成为新型光热试剂。
聚苯胺是一类用于研究细胞增殖的导电高分子,具有非常好的生物兼容性。其吸收峰容易受到掺杂剂(如强酸、路易士酸、过渡金属以及碱粒子等)的影响而发生移动,因为这些掺杂能在聚苯胺的价带与导带之间产生一个能带,从而迫使电子发生移动,降低了激发态能级,所以当聚苯胺上的亚胺基团转变成亚胺盐时,其吸收峰将红移到近红外区域。而这种具有近红外吸收的聚苯胺的亚胺盐就可以很好地用于光热治疗(J.Mater.Chem.B,2015,3,3767)。
在诸多纳米颗粒的修饰方法中,纳米水凝胶具有独特的优势。相比于单个纳米颗粒,纳米凝胶具有良好的胶体稳定性,生物相容性、高负载能力、易于合成、尺寸可控、易于多功能化等特点。γ-聚谷氨酸(γ-PGA)是一种天然多聚氨基酸,具有优良的水溶性和生物相容性,是一种优良的环保型高分子材料,目前已广泛应用于纳米水凝胶的制备。根据之前报道的纳米水凝胶具有更好的柔性和流动性易被肿瘤细胞吞噬的特点,因此本发明以胱胺二盐酸盐为交联剂合成γ-PGA纳米水凝胶,构建了负载聚苯胺的γ-PGA纳米水凝胶用作光热试剂。
检索国内外文献发现,目前尚没有关于以胱胺二盐酸盐为交联剂制备γ-PGA水凝胶用于负载聚苯胺作为光热试剂研究的相关报道。
技术实现要素:
本发明所要解决的技术问题是提供一种负载聚苯胺的γ-PGA纳米水凝胶的制备方法,该方法工艺简单,反应温和,易于操作分离,原料来源广泛,成本低廉;制备的γ-PGA纳米水凝胶能稳定地分散于水溶液中,粒径分布均匀,光声成像效果显著,具有良好的医用前景。
本发明的一种负载聚苯胺的γ-PGA纳米水凝胶的制备方法,包括:
(1)将EDC活化的γ-聚谷氨酸γ-PGA经过双乳化反应,得到W/O/W聚合物乳液;
(2)将胱胺二盐酸盐Cys溶于超纯水中,然后滴加到步骤(1)中的W/O/W聚合物乳液中,反应2~3h,除去溶剂(过夜蒸发除去有机溶剂),透析纯化,冻干,得到胱胺二盐酸盐交联的γ-PGA纳米水凝胶,即γ-PGA/Cys纳米水凝胶;
(3)将步骤(2)中的γ-PGA/Cys纳米水凝胶溶于pH至3.00超纯水中,然后加入水溶性的苯胺盐酸盐,冰浴静置45min~1h,再加入过硫酸铵反应1.75h~2.25h,透析纯化3天,得到负载聚苯胺的γ-PGA纳米水凝胶,即γ-PGA/Cys@PANI纳米水凝胶。
所述步骤(1)中双乳化反应为:将经过EDC活化的γ-PGA中加入碳酸氢钠NaHCO3反应30min~45min,然后滴加到磺基琥珀酸二辛酯钠AOT的二氯甲烷DCM溶液中,搅拌10min,形成W/O乳液;将得到的W/O乳液滴加到聚乙烯醇PVA的超纯水溶液中,搅拌15min,形成W/O/W聚合物乳液;其中,EDC活化γ-PGA的方法为:取γ-PGA溶于超纯水中,加入EDC活化1-2h。
所述AOT的DCM溶液的浓度为33.5mg/mL;PVA的超纯水溶液的浓度为20.4mg/mL。
所述γ-PGA的超纯水溶液、AOT的DCM溶液和PVA水溶液的体积比为1:2:15。
所述步骤(2)中胱胺二盐酸盐与γ-PGA的质量比为3:1。
所述步骤(2)中胱胺二盐酸盐Cys溶于超纯水中得到的溶液的浓度为50mg/mL。
所述步骤(2)透析纯化为:用截留分子量为10万的透析袋透析纯化3天,步骤(3)透析纯化为:用截留分子量为10万的透析袋透析纯化3天,第一天中每隔25~30min透析一次。
所述步骤(3)中γ-PGA/Cys纳米水凝胶溶于超纯水中得到的溶液的浓度为0.8mg/mL。
所述步骤(3)中苯胺盐酸盐和γ-PGA/Cys纳米水凝胶的质量比为4.3:1。
所述步骤(3)中苯胺盐酸盐和过硫酸铵的质量比为104:184。
所述步骤(3)中苯胺盐酸盐的水溶液浓度为104mg/mL;过硫酸铵的水溶液浓度为184mg/mL。
所述步骤(3)中γ-PGA/Cys@PANI纳米水凝胶的尺寸为650~700nm。
本发明中γ-PGA的水溶液先经EDC活化,然后经过双乳化的方法反应形成W/O/W的聚合物乳液;将交联剂胱胺二盐酸盐(Cys)加入到的聚合物乳液中发生交联反应,除去有机溶剂和表面活性剂后,即得到交联的γ-PGA/Cys的纳米水凝胶(γ-PGA/Cys NGs);γ-PGA/Cys NGs与苯胺单体(aniline)混合,合成原位聚合PANI掺杂的γ-PGA NGs(γ-PGA/Cys@PANI)。本发明工艺简单,易于操作分离,原料来源广泛,成本低廉;制备的γ-PGA水凝胶粒径分布均匀,具有良好的水溶性、胶体稳定性、生物相容性,对生物体无不良影响,在光热治疗领域具有潜在的应用价值。
本发明所制备的负载聚苯胺的γ-PGA纳米水凝胶是由γ-PGA与胱胺二盐酸盐化学交联,并且苯胺单体在过硫酸铵的催化下发生原位聚合而成。本发明将胱胺二盐酸盐加入到经EDC活化和双乳化的γ-PGA溶液中,再加入苯胺单体和催化剂过硫酸铵发生氧化聚合反应形成负载聚苯胺的γ-PGA纳米水凝胶。本发明操作简单,反应温和,原料来源广泛。制备的γ-PGA纳米水凝胶粒径分布均匀,具有良好的水溶性、胶体稳定性和细胞相容性,易于被肿瘤细胞吞噬。肿瘤光声成像、光热成像和光热治疗结果显示,本发明制备的负载聚苯胺的γ-PGA纳米水凝胶能有效作为光热试剂用于肿瘤的光声成像、光热成像和光热治疗。
本发明使用Zeta电势及动态光散射分析(DLS)、紫外吸收光谱分析(UV-Vis)、透射电子显微镜(TEM)、热重分析(TGA)、扫描电子显微镜(SEM)等手段表征制备的负载聚苯胺的γ-PGA纳米水凝胶。然后利用CCK8细胞活力测试法来评价纳米水凝胶的细胞毒性,随后评价了肿瘤细胞对该纳米水凝胶的吞噬能力。最后进行体外细胞、裸鼠体内肿瘤模型的光声成像及光热成像实验,考察γ-PGA/Cys@PANI纳米水凝胶的体外、体内光热治疗效果。
有益效果
本发明采用胱胺二盐酸盐作为交联剂,负载聚苯胺的γ-PGA纳米水凝胶粒径分布均匀,具有良好的水溶性、胶体稳定性和细胞相容性,同时工艺简单、反应温和、原料来源广泛价廉、生物可降解,具有良好的应用前景。另外,本发明得到的纳米水凝胶表面拥有大量的活性基团为其进一步的修饰和深入开发提供了良好的条件。
附图说明
图1为实施例2中γ-PGA/Cys@PANI纳米水凝胶在不同溶液中不同储存时间的水动力直径变化;
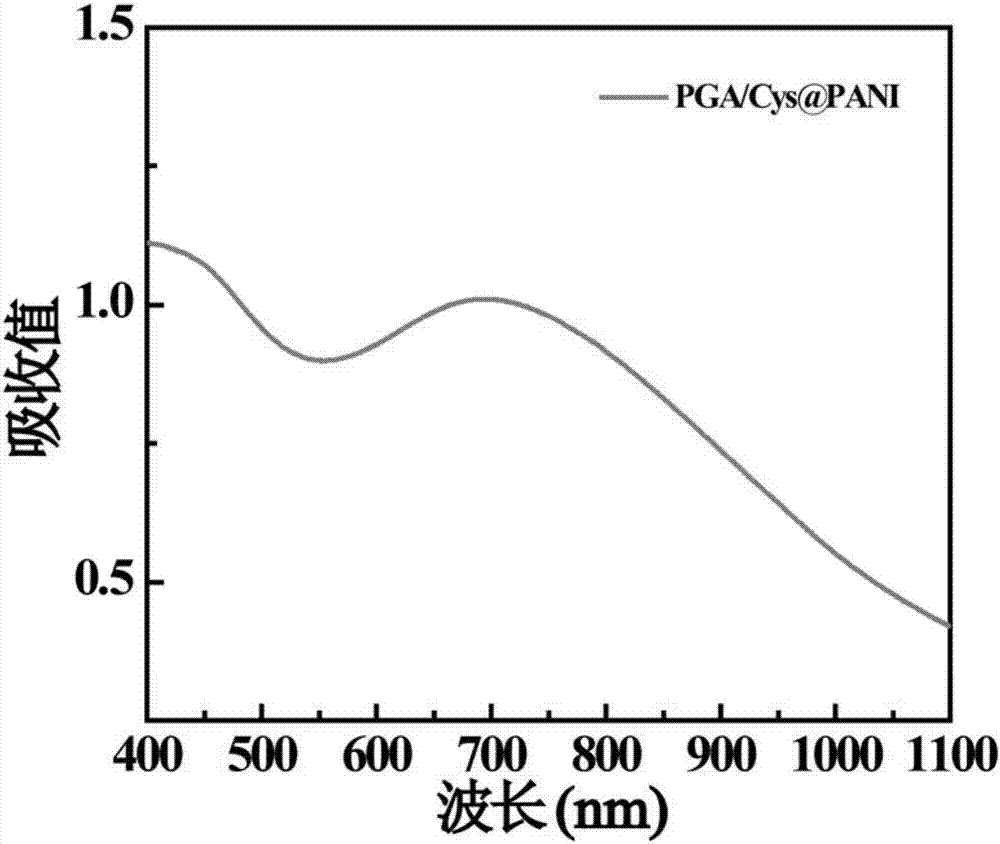
图2为实施例3中γ-PGA/Cys@PANI纳米水凝胶的UV-Vis图谱;
图3为实施例3中γ-PGA/Cys@PANI纳米水凝胶经过785nm激光照射不同时间后吸收值的变化;
图4为实施例3中γ-PGA/Cys@PANI纳米水凝胶的TEM图片;
图5为实施例3中γ-PGA/Cys,γ-PGA/Cys@PANI纳米水凝胶的热重分析图片;
图6为实施例4中γ-PGA/Cys@PANI纳米水凝胶的细胞吞噬变化图;
图7为实施例5中CCK8法测试的4T1细胞0.9%NaCl(对照)和γ-PGA/Cys@PANI纳米水凝胶(浓度范围在0.1-5mg/mL)处理24小时后的细胞活力;
图8为实施例6中γ-PGA/Cys@PANI纳米水凝胶在不同浓度下经过785nm激光照射后的PA成像图(a)和PA值随γ-PGA/Cys@PANI纳米水凝胶浓度变化的线性关系图(b);
图9为实施例7中γ-PGA/Cys@PANI纳米水凝胶在不同浓度下(0-4mg/mL)经过785nm激光照射后的升温曲线图;
图10为实施例7中在γ-PGA/Cys@PANI纳米水凝胶相同浓度下(1mg/mL)经过不同功率的激光照射后升温曲线图;
图11为实施例8中CCK8法测试的4T1细胞在与γ-PGA/Cys@PANI纳米水凝胶(浓度0-4mg/mL)共培养6小时后,不经过和经过的激光照射后细胞的存活率;
图12为实施例9中瘤内注射制备的γ-PGA/Cys@PANI纳米水凝胶(4mg/mL,100μL)到裸鼠肿瘤部位前后经785nm激光照射后的PA成像(a)和PA信号值(b)的变化;
图13为实施例10中瘤内注射制备的γ-PGA/Cys@PANI纳米水凝胶(4mg/mL,100μL)(Bx1)和PBS(0.1mL)(Bx2)到裸鼠肿瘤部位后的肿瘤部位的温度变化曲线;
图14为实施例11中经过不同方式处理后裸鼠肿瘤的体积变化;荷瘤鼠分为四组:不做任何处理;瘤内注射0.9%NaCl(0.1mL)且经过激光照射;瘤内注射制备的γ-PGA/Cys@PANI纳米水凝胶(4mg/mL,100μL)但不经过激光照射;瘤内注射制备的γ-PGA/Cys@PANI纳米水凝胶(4mg/mL,100μL)且经过激光照射;
图15为实施例11中经过不同方式处理后裸鼠的生存率变化。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
(1)取20mgγ-PGA溶于1mL超纯水中,加入30mg EDC活化1-2h,再加入26mg NaHCO3继续反应0.5h;然后将上述溶液逐滴加入到溶有134mg AOT的DCM溶液中(4mL),搅拌10min,形成W/O乳液;然后将该W/O乳液逐滴加入到30mL含有612mg PVA(醇解度87-89%,Mw=85-124kDa)的超纯水溶液中,搅拌15min,形成W/O/W的聚合物乳液;(2)将60mg胱胺二盐酸盐溶于1.2mL超纯水中,并逐滴加入到上述步骤制备的W/O/W的聚合物乳液中,搅拌12h,过夜蒸发除去有机溶剂,然后用截留分子量为10万的透析袋透析纯化3天,并且冻干,即得到胱胺二盐酸盐交联的γ-PGA/Cys纳米水凝胶。(3)取γ-PGA/Cys纳米水凝胶48mg溶于60mL的pH=3.0的超纯水中,搅拌至完全溶解,加入苯胺盐酸盐208mg,冰浴静置45min至1h,加入过硫酸铵368mg,反应2h,用截留分子量为10万的透析袋纯化,第一天中每隔30min透析一次,透析3天即可得到γ-PGA/Cys@PANI纳米水凝胶。
实施例2
取实施例1中制备的γ-PGA/Cys@PANI纳米水凝胶,将其用超纯水稀释至适当浓度后,用于测表面电势和水动力直径。Zeta电势测定结果表明γ-PGA/Cys@PANI纳米水凝胶的表面电势为-4.32±0.16mV。γ-PGA/Cys@PANI纳米水凝胶水动力学直径为669.03±14.99nm,粒径分布均一,且水动力直径能长时间保持几乎不变,并且在不同溶剂中均能稳定保存一定时间(参见图1),从而说明实施例1制备的γ-PGA/Cys@PANI纳米水凝胶具有良好的胶体稳定性。
图1为将γ-PGA/Cys@PANI纳米水凝胶分散于水、0.9%NaCl、PBS和细胞培养基中,存放不同时间后测水动力粒径,发现其在水中的粒径保持在660nm左右,在0.9%NaCl、PBS和细胞培养基中的粒径保持在900nm左右(图1)。说明合成的γ-PGA/Cys@PANI纳米水凝胶具有良好的稳定性。
实施例3
取实施例1中得到的γ-PGA/Cys@PANI纳米水凝胶测紫外吸收(见图2:γ-PGA/Cys@PANI纳米水凝胶在400到1100nm的紫外吸收图谱)。从图2中可以看出,所制备的水凝胶在700nm处出现明显的吸收峰,在785nm处有一个很强的紫外吸收值,从而为近红外的成像和光热治疗提供了可行性。此外,在785nm激光(1.5W/cm2)分别照射不同时间后,该纳米凝胶在785nm处的吸收值没有明显的变化,表明制备的纳米颗粒具有较好的光热稳定性,能够长期暴露于激光下进行疾病的光热治疗(图3)。通过TEM观察实施例1中制备γ-PGA/Cys@PANI纳米水凝胶的形貌(参见图4),结果表明所形成的γ-PGA/Cys@PANI纳米水凝胶的形貌呈球形,尺寸较均匀,凝胶直径大小约为71.9±15.8nm(随机测量300个纳米颗粒的直径),没有明显的团聚现象。之后对γ-PGA/Cys@PANI纳米水凝胶进行了TGA分析(参见图5),在温度升至900℃时,γ-PGA/Cys纳米水凝胶重量为19.20%,γ-PGA/Cys@PANI纳米水凝胶重量为73.70%,经过计算,聚苯胺负载量为54.50%(图5),由此表明γ-PGA/Cys纳米水凝胶已成功负载了聚苯胺。
实施例4
通过高压细胞破碎测定实施例1制备的γ-PGA/Cys@PANI纳米水凝胶是否被4T1细胞吞噬。配制γ-PGA/Cys@PANI纳米水凝胶浓度为0.74mg/mL,用六孔板培养4T1细胞,每孔10万。每孔加入培养基溶解的γ-PGA/Cys@PANI纳米水凝胶2mL。分别培养0min,30min,60min,120min,240min,480min。通过胰酶消化离心后用0.9%的NaCl溶解,在高压细胞破碎仪破碎之后用紫外测出在700nm下的紫外吸收值(见图6)。可以发现随着时间的增加,吸收值也逐渐增加,说明γ-PGA/Cys@PANI纳米水凝胶在细胞中的吞噬量随时间延长而增加,同时说明γ-PGA/Cys@PANI纳米水凝胶能被细胞吞噬。
实施例5
通过CCK8细胞活力实验测定4T1细胞的活力来评价实施例1制备的γ-PGA/Cys@PANI纳米水凝胶的细胞相容性。配制不同浓度的实施例1制备的γ-PGA/Cys@PANI纳米水凝胶的0.9%NaCl溶液。收集对数生长期4T1细胞,按照10000细胞每孔的密度接种在96孔细胞培养板上,加入200μL DMEM培养基,细胞培养板置于CO2浓度为5%和温度为37℃的环境中培养24h。弃掉培养基后,每孔更换180μL DMEM培养基,并分别添加20μL不同浓度的γ-PGA/Cys@PANI纳米水凝胶(浓度为0.1、0.2、0.5、1、2、3、4和5mg/mL)和纯0.9%NaCl(对照组),每种浓度设定6个平行样。将细胞培养板继续放置在5%CO2,37℃继续孵育24h。倒掉原有培养基并用无菌0.9%NaCl清洗3遍,每孔加入20μL CCK8溶液,避光环境下37℃恒温培养4h。按顺序每孔吸取上层培养液100μL于96孔板中,在MK3型酶标仪上检测各孔在激发波长490nm处的吸收值,吸收值的大小可以反映活细胞的数量(参见图7)。结果显示,与对照组相比,γ-PGA/Cys@PANI纳米水凝胶在实验浓度为0到4mg/mL范围内对4T1细胞的存活率的影响没有显著性差异,细胞存活率均在90%以上,即使实验浓度高达5mg/mL,细胞存活率也在80%以上。这充分说明γ-PGA/Cys@PANI纳米水凝胶具有良好的细胞相容性。
实施例6
由于γ-PGA/Cys@PANI纳米水凝胶(实施例3)在700nm左右有明显的近红外吸收峰,据此可一步探究γ-PGA/Cys@PANI纳米水凝胶的PA成像效应,测量了该γ-PGA/Cys@PANI纳米水凝胶的785nm激光照射下的光声信号增强特性(如图8所示)。配制成γ-PGA/Cys@PANI纳米水凝胶浓度依次为0、0.1、0.25、0.5和1.0mg/mL,各取20μL进行PA值的测定,利用光声成像系统在785nm波长激光下测定γ-PGA/Cys@PANI纳米水凝胶光声效应(见图8a)。结果表明,随着浓度的增加(0-1mg/mL),γ-PGA/Cys@PANI纳米水凝胶的PA信号强度也随之增强。而且,复合纳米颗粒的PA值随着γ-PGA/Cys@PANI纳米水凝胶浓度的变化具有很好的线性关系(见图8b)。说明了γ-PGA/Cys@PANI纳米水凝胶有望用作PA成像的造影剂。
实施例7
在EP管中用超纯水配制γ-PGA/Cys@PANI纳米水凝胶(实施例1中制备)浓度依次为0.5、1、2、4mg/mL的水溶液100μL,以等体积的水做对照,用785nm激光照射(输出功率1.5W/cm2,照射5分钟),观察温度变化情况(见图9)。结果表明,水在照射5分钟后,温度仅稍微的升高。而对于γ-PGA/Cys@PANI纳米水凝胶,随着照射时间的延长,纳米颗粒水溶液的温度明显升高。而且随着浓度的增加,温度的升高更加明显。在相同浓度下(1mg/mL),分别用输出功率为0.5、1.0、1.5、2.0和2.5W/cm2的785nm的激光照射,观察温度变化情况(见图10)。结果表明,随着对γ-PGA/Cys@PANI纳米水凝胶水溶液照射时间的延长,水溶液的温度明显升高;而且随着输出功率的增加,温度的升高更加明显。
实施例8
以4T1细胞为模型细胞,在785nm激光照射下评价γ-PGA/Cys@PANI纳米水凝胶(实施例1)对肿瘤细胞的杀伤作用。用无菌0.9%NaCl配置不同浓度的γ-PGA/Cys@PANI纳米水凝胶,并用紫外照射杀菌过夜。将4T1细胞种植于96孔板(1×104细胞/孔),在37℃和5%CO2条件下过夜培养,贴壁后弃去培养基,再用200μL含γ-PGA/Cys@PANI纳米水凝胶(实施例1)(浓度为0、0.2、0.5、1、2和4mg/mL)的DMEM培养基培养6小时,用0.9%NaCl洗涤3次,用785nm激光器照射(输出功率1.5W/cm2,照射5分钟),未照射的细胞用作对照组。然后,向培养板孔中加入20μL CCK8,继续在37℃下培养4小时后,在MK3型酶标仪上检测各孔在激发波长490nm处的吸收值,吸收值的大小可以反映活细胞的数量(见图11)。结果表明随着浓度的增加,未照射的细胞仍然保持很高的细胞存活率;而经过激光照射5分钟,细胞表现出死亡趋势,并且随着浓度的增加,细胞的存活率越低,在浓度为4mg/mL时,仅有29.2%的细胞存活。该实验结果说明γ-PGA/Cys@PANI纳米水凝胶在近红外激光照射下能引起肿瘤细胞的死亡。
实施例9
为了探索γ-PGA/Cys@PANI纳米水凝胶(实施例1)用作PA成像造影剂的潜力,将4T1荷瘤裸鼠麻醉后,瘤内注射γ-PGA/Cys@PANI纳米水凝胶NaCl溶液(浓度为4mg/mL,100μL),然后用光声成像系统在785nm波长激光下观察γ-PGA/Cys@PANI纳米水凝胶注射后肿瘤的光声效果(见图12a)。结果表明,注射γ-PGA/Cys@PANI纳米水凝胶30min后,裸鼠肿瘤较注射前(0min)PA信号强度明显增强。对信号强度定量测量可知,肿瘤部位的PA值从注射前的496.47升高到5707.69(见图12b)。结果说明,γ-PGA/Cys@PANI纳米水凝胶具有良好的PA成像性能。
实施例10
为了探索γ-PGA/Cys@PANI纳米水凝胶(实施例1)在体内光热升温能力,将4T1荷瘤裸鼠麻醉后,直接瘤内注射γ-PGA/Cys@PANI纳米水凝胶0.9%NaCl溶液(4mg/mL,0.1mL)。接着,使用785nm激光照射(输出功率1.5W/cm2,照射5分钟),并通过红外摄像机来评价体内肿瘤部位的热成像效果,同时以注射相同体积NaCl的裸鼠作为对照(见图13)。结果表明,注射后2.5分钟,注射γ-PGA/Cys@PANI纳米水凝胶的裸鼠肿瘤部位(Bx2)的温度明显升高,达到了57.2℃,而此时注射0.9%NaCl的裸鼠的肿瘤部位(Bx1)的温度仅仅达到39.3℃。在随后的一段时间内,注射γ-PGA/Cys@PANI纳米水凝胶的裸鼠肿瘤部位的温度一直保持在50℃以上。注射5min后,注射γ-PGA/Cys@PANI纳米水凝胶的裸鼠肿瘤部位温度高达58.1℃,而对照裸鼠肿瘤部位的温度仅仅达到在40.5℃左右。实验结果说明制备的γ-PGA/Cys@PANI纳米水凝胶能使肿瘤部位的温度升高,从而达到杀死肿瘤细胞的作用。
实施例11
将负荷肿瘤的裸鼠分为四组,分别经过不同方式处理:不经过任何处理;瘤内注射0.9%NaCl(0.1mL)且经过785nm激光照射(输出功率1.5W/cm2,照射5分钟);瘤内注射γ-PGA/Cys@PANI纳米水凝胶(实施例1)0.9%NaCl溶液(4mg/mL,0.1mL)但不经过激光照射;瘤内注射γ-PGA/Cys@PANI纳米水凝胶(实施例1)0.9%NaCl溶液(4mg/mL,0.1mL)且经过785nm激光照射(输出功率1.5W/cm2,照射5分钟)。各组荷瘤裸鼠均在第0,2和4天各处理一次。结果表明,只有瘤内注射γ-PGA/Cys@PANI纳米水凝胶(实施例1)NaCl溶液(4mg/mL,0.1mL)且经过激光照射的裸鼠肿瘤才完全消失(处理后第9天),其余三组裸鼠肿瘤均继续快速生长(见图14)。而且,只有瘤内注射纳米凝胶且经过激光照射的裸鼠未出现死亡现象,其余三组在45天内均完全死亡(见图15)。该实验结果说明制备的γ-PGA/Cys@PANI纳米水凝胶在近红外激光的照射下能引起肿瘤的消融,从而达到治疗肿瘤的目的。
- 还没有人留言评论。精彩留言会获得点赞!