曲贝替定药物组合物及其制备方法与流程
本发明涉及一种曲贝替定组合物,具体涉及曲贝替定组合物的处方、冻干制剂及制备方法和工艺。本发明属于医药
技术领域:
。
背景技术:
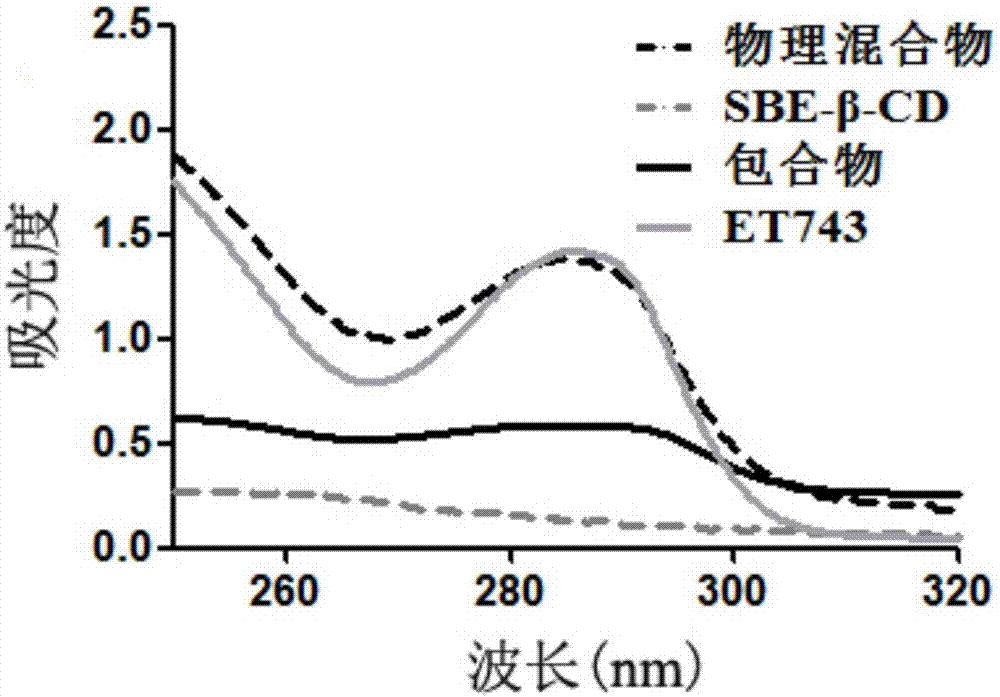
:曲贝替定(海鞘素743,简写ET-743或ET743)是从海生的被囊动物中分离的的四氢异喹啉生物碱,具体结构如下。其抗肿瘤活性主要是通过自身形成亚胺正离子或类似中间体对DNA进行烷基化修饰来实现的(Chem.Rev.2002,102,1669),ET-743对乳腺癌、非小细胞肺癌、结肠癌、肾癌、卵巢癌、子宫内膜癌、黑色素癌、骨肉瘤和前列腺癌等有抑制活性,是一种新颖的能与DNA结合的抗癌药物。海鞘素-743由西班牙法马马(PharmMar)公司开发,于2007年在欧盟批准上市的作为治疗软组织肉瘤的罕见药,用于治疗传统化疗无效的晚期软组织肉瘤患者。ET-743是一种复杂的化合物,具有有限的水溶性,将调节溶液pH值至4,可以增加ET-743在水中溶解度。但是,ET-743在生物相容的形式和制剂中的稳定性,是难以预测和实现的。因此,制备一种稳定、有效的ET-743制剂对于本领域的技术人员是一种挑战。曲贝替定中主要的杂质为ET-743、ET-745、ET-759B及ET-789A(SynthesisofNaturalEcteinascidins(ET-729,ET-745,ET-759B,ET-736,ET-637,ET-594)fromCyanosafracinB,JournalofOrganicChemistry200368(23)第8859-8866页),其中杂质ET-701为制剂冻干过程和储藏中主要杂质,为水解产物;杂质ET-745为曲贝替定被还原产物,其结构分别如下:WO0069441公开了一种无菌的冻干制剂,含有ET-743、甘露醇和磷酸盐缓冲剂。该冻干制剂可以重构和稀释用于静脉注射。然而,该制剂在冰箱和室温下长期贮存不稳定,必须避光保存于-15至-25℃。CN102018714A公开了一种含有选自乳糖、蔗糖等二糖的ET-743冻干制剂,对于一些乳糖不耐受的病人可能无法使用,另外这些制剂在40℃/70%RH的加速条件下储藏3个月时仍然显示出大量的活性成分降解,暗示该制剂如果长期储存,仍然不太稳定。因此,有必要开发新的稳定的ET-743制剂,能够进一步地减少活性成分的降解,更好地应用于临床治疗。包合物是一种分子被包藏在另一种分子空穴结构内而形成的特殊的络合物。包合物由主分子和客分子两种组分组成,具有包合作用的外层分子称为主分子,被包合到主分子空间中的小分子物质称为客分子。药物作为客分子经包合后,溶解度增大,稳定性提高,液体药物可粉末化,可防止挥发性成分挥发,掩盖药物的不良气味,调节释放速率,提高药物的生物利用度,降低药物的刺激性与毒副作用。环糊精具有特殊的环状分子结构,外围具有亲水性,内部具有疏水性,因此,疏水性的药物可以通过范德华力、疏水相互作用、氢键等与环糊精形成包合物,从而提高药物的稳定性和水溶性。药物被环糊精包合后,可以免受外部环境中反应性分子的进攻,避免药物分子发生水解、氧化、异构化、聚合及酶降解等。环糊精是淀粉经环糊精葡萄糖基转移酶作用后形成的环状低聚糖,其中,β环糊精分子内腔大小适中,可与多数化合物形成包合物且生产成本低,因此应用最为广泛。(1)羟丙基-β环糊精(HP-βCD)HP-βCD作为药物的增溶剂、稳定剂以及吸收促进剂已广泛用于固体口服制剂、注射剂、透皮给药制剂、鼻腔给药制剂及直肠给药制剂中。它是FDA批准的第一个用于静脉注射的环糊精类衍生物,已被美国药典收载为注射用辅料。FDA已经批准了以羟丙基-β环糊精为增溶剂的伊曲康唑注射液以及左炔诺孕酮长效皮下植入剂;在我国羟丙基-β环糊精作为药用辅料也已批准生产。(2)磺丁基-β环糊精(SBE-βCD)SBE-βCD是由美国Cydex公司研发的一种高水溶性的β环糊精磺酸基衍生物。作为一种新型的药用辅料,SBE-βCD具有无可比拟的优点:1)内部疏水空腔尺寸增大,对客体分子的包合作用增强;2)亲水性更强,解决β-CD水溶性低的缺点;3)具有负电荷支链,使其对易形成正电荷的含氮药物具有特殊的亲和作用。同时,它还具有低肝、肾毒性,低溶血性等优点。因此,作为一种很有潜力的优良药用辅料,SBE-βCD得到了广泛而深入的研究。辉瑞公司已成功开发以SBE-βCD作为包合材料的抗精神病药Ziprasidone(齐拉西酮,商品:名卓乐定)注射剂并在美国、瑞典上市。此外,还有其它类型β环糊精的衍生物,如甲基化-β环糊精、羟乙基-β环糊精、葡萄糖基环糊精、麦芽糖基环糊精、羧甲基环糊精等也得到了广泛的关注和研究。技术实现要素:本发明提供了一种曲贝替定药物组合物,包含曲贝替定和环糊精。所述环糊精可选自羟丙基-β环糊精、磺丁基-β环糊精、甲基化-β环糊精、羟乙基-β环糊精、葡萄糖基-β环糊精、二葡糖基-β环糊精、麦芽糖基-β环糊精、二麦芽糖基-β环糊精、羧甲基-β环糊精中一种或几种,优选自羟丙基-β环糊精、磺丁基-β环糊精、二葡糖基-β环糊精、二麦芽糖基-β环糊精、羧甲基-β环糊精中的一种或几种。组合物中曲贝替定和环糊精质量比为1:20~1:3000,优选1:20~1:1500,更优选1:20~1:1200。本发明提供了曲贝替定和环糊精的组合物,药物活性成分曲贝替定包合在环糊精中,从而形成包合物,即曲贝替定以疏水相互作用存在于环糊精衍生物的空腔中,组合物中曲贝替定作为客体分子被环糊精衍生物包合后,溶解度增大,稳定性提高,提高药品冷藏保存时的稳定性。本发明的组合物还可以包含缓冲剂,例如可以选自磷酸盐缓冲剂、乳酸盐缓冲剂、柠檬酸盐缓冲剂、乙二酸四乙酸盐缓冲剂、甘氨酸/盐酸缓冲液中一种或几种,可优选磷酸二氢钾、磷酸二氢钠中一种或几种。本发明还公开了制备含曲贝替定和环糊精组合物的方法,包括以下步骤:1)将曲贝替定与低级醇或水混合,所述低级醇可以为C1-C4为制剂中或药学上可用的醇,选自如甲醇、乙醇、异丙醇、丁醇、叔丁醇、丙醇等,优选自甲醇、乙醇、异丙醇、丁醇;所述水溶液可为酸或中性,若呈酸性,pH值为3.5~7.0,优选自为5.0~7.0。2)将环糊精衍生物与低级醇或水混合,所述低级醇为C1-C4为制剂中或药学上可用的醇,选自如甲醇、乙醇、异丙醇、丁醇、叔丁醇、丙醇等,优选自甲醇、乙醇、异丙醇、丁醇;所述水溶液可为酸或中性,若呈酸性,pH值为3.5~7.0,优选自为5.0~7.0。。3)将步骤1)、2)混合得组合物;为了增加环糊精对曲贝替定包裹效果,还可包括将步骤3)得到的混合溶液pH值至设定值。本发明组合物可以制备成冻干制剂的形式,为了获得冻干制剂,还包括将由3)或4)步骤所得混合物冷冻干燥的步骤。在冻干前,先将前述成分配制成冻干前溶液形式,所述冻干前溶液或溶液pH可以为4.0~8.0,优选为5.0~7.0,更优选5.0~6.5。如果仅使用前述成分配置后pH值不在所需范围内,可使用pH值调节剂进行调节,例如可以使用包括磷酸、醋酸、酒石酸、柠檬酸、枸橼酸、氢氧化钠、氢氧化钾中的一种或几种pH调节剂,优选磷酸和氢氧化钾。在前述冻干前溶液中曲贝替定含量为0.1~0.5mg/mL,优选0.2~0.3mg/mL,更优选0.25mg/mL;缓冲剂含量为1~10mg/mL,优选4~8mg/mL,更优选6~7mg/mL或相对于曲贝替定的质量比为10:1~100:1,优选为15:1~50:1,更优选为20:1~40:1。本发明还提供了一种制备用于超静脉输注含曲贝替定的注射液,其由前述的冻干制剂复溶后获得。本发明中的曲贝替定及其杂质可以是半合成的或合成的来源,包括这些来源的组合,参考文献如WO0069862和WO0187895;另一方面,曲贝替定的杂质也可以外购获得对照品或根据高效液相方法定位曲贝替定杂质的种类;本发明中所用环糊精衍生物可从通常的药物辅料供货渠道获得。本发明中有关“物理混合物”的描述为曲贝替定和环糊精经常规机械混合手段或各自配制成溶液后混合、无需搅拌包合或混合时间短而达不到包合的效果过程。本发明中紫外检测,为常规、有效检测药物活性成分是否与环糊精衍生物形成包合物的一种方法,其检测期间,所用样品被配制溶液状态,分析不同物质在同一条件下紫外吸收的强度,可以判断药物活性成分与环糊精的关系。本发明的冻干制剂可采用本领域常规的冻干工艺制备得到。例如,本发明的冻干工艺包括预冻、一次干燥、二次升华三个阶段。预冻温度为-25~-50℃,一次干燥温度-10~-40℃,二次干燥温度15~30℃,一次干燥和二次干燥过程中,真空度为0.1-0.5mbar。整个冷冻干燥过程中充入氮气,优选在冷冻干燥结束前5-10分钟充入氮气。本发明提供的药物组合物具有很高的稳定性,且容易大规模生产。附图说明图1:pH5.5条件下制备的磺丁基-β环糊精/曲贝替定包合物紫外扫描图;图2:pH6.5条件下制备的磺丁基-β环糊精/曲贝替定包合物紫外扫描图;图3:3%磺丁基-β环糊精/曲贝替定包合物紫外扫描图;图4:乙醇溶解药物法制备的羟丙基-β环糊精/曲贝替定紫外扫描图;图5:乙醇溶解药物法制备的二葡糖基-β环糊精/曲贝替定紫外扫描图。具体实施方式实施例1以磺丁基-β环糊精为主体分子制备曲贝替定包合物,其中磺丁基-β环糊精的浓度为30%,冻干前溶液处方及方法如下:组成作用批次规模6mL用量曲贝替定活性成分0.25mg/mL1.5mg磷酸,0.1N溶解/pH调节0.043mg/mL0.258mL磺丁基-β环糊精主体分子300mg/mL0.18g磷酸二氢钾pH调节6.8mg/mL40.8mg磷酸,1N/氢氧化钾,0.1MpH调节pH5.5适量注射用水溶剂适量至体积适量至体积制备方法:1、取1.5mg曲贝替定,加入0.258mL0.1N磷酸溶液,搅拌使药物完全溶解;2、取0.18g磺丁基-β环糊精和40.8mg磷酸二氢钾加入4mL注射用水,搅拌使其溶解;3、将1中的溶液加入到2中,混合均匀,室温搅拌0.5~2h后,采用0.1M氢氧化钾溶液将溶液pH调节至5.5;4、室温搅拌继续0.5~2h,制备得到冻干前溶液;5、将冻干前溶液过滤,灌装半加塞后冷冻干燥。将上述冻干前溶液并进行冷冻干燥制备曲贝替定冻干包合物。考察外观、水分、复溶性、pH值(如表1所示),采用紫外分光光度法表征包合物的形成(详见说明书附图1),并检测冻干后杂质含量变化及在25℃加速条件下的放置稳定性(如表2所示)。表1冻干后制品外观、水分、复溶性和pH值外观水分复溶性pH值复溶后溶液白色饼状2.12%良好5.49澄清透明溶液表2杂质含量检测及放置稳定性结论:以磺丁基-β环糊精为主体分子制备得到的冻干制品,外观、水分合格,pH值变化不大,产品复溶性好,冻干制剂杂质检测结果符合限度要求;紫外扫描图谱结果显示,冻干制品中药物紫外吸收峰降低,表明磺丁基-β环糊精与曲贝替定形成了包合物,曲贝替定位于磺丁基-β环糊精疏水空腔中;冻干后的包合物放置稳定性良好。说明包合物可以提高曲贝替定在冻干过程及长期放置过程中的稳定性。实施例2以磺丁基-β环糊精为主体分子制备曲贝替定包合物,其中磺丁基-β环糊精的浓度为10%,冻干前溶液处方及方法如下:组成作用批次规模6mL用量曲贝替定活性成分0.25mg/mL1.5mg磷酸,0.1N溶解/pH调节0.043mg/mL0.258mL磺丁基-β环糊精主体分子100mg/mL0.06g磷酸二氢钾pH调节6.8mg/mL40.8mg磷酸,1N/氢氧化钾,0.1MpH调节pH6.5适量注射用水溶剂适量至体积适量至体积制备方法:1、取1.5mg曲贝替定,加入0.258mL0.1N磷酸溶液,搅拌使药物完全溶解;2、取0.06g磺丁基-β环糊精和40.8mg磷酸二氢钾加入4mL注射用水,搅拌使其溶解;3、将1中的溶液加入到2中,混合均匀,室温搅拌0.5~2h后,采用0.1M氢氧化钾溶液将溶液pH调节至6.5;4、室温搅拌继续0.5~2h,制备得到冻干前溶液;5、将冻干前溶液过滤,灌装半加塞后冷冻干燥。将上述冻干前溶液并进行冷冻干燥制备曲贝替定冻干包合物。考察外观、水分、复溶性、pH值(如表3所示),采用紫外分光光度法表征包合物的形成(详见说明书附图2),并检测冻干后杂质含量变化及在25℃加速条件下的放置稳定性(如表4所示)。表3冻干后制品外观、水分、复溶性和pH值外观水分复溶性pH值复溶后溶液白色饼状1.93%良好6.47澄清透明溶液表4杂质含量检测及放置稳定性结论:在pH6.5条件下,以10%的磺丁基-β环糊精为主体分子制备得到的曲贝替定冻干制剂外观、水分合格,pH值变化不大,产品复溶性好,冻干制剂杂质检测结果符合限度要求;紫外扫描图谱结果显示,冻干制品中药物紫外吸收峰降低,表明磺丁基-β环糊精与曲贝替定形成了包合物,曲贝替定位于磺丁基-β环糊精疏水空腔中;冻干后的包合物在加速条件下稳定性良好。说明包合物可以提高曲贝替定在冻干过程及长期放置过程中的稳定性。实施例3以磺丁基-β环糊精为主体分子制备曲贝替定包合物,其中磺丁基-β环糊精的浓度为3%,冻干前溶液处方及方法如下:组成作用批次规模6mL用量曲贝替定活性成分0.25mg/mL1.5mg磺丁基-β环糊精主体分子20mg/mL0.12g注射用水溶剂适量至体积适量至体积制备方法:1、取1.5mg曲贝替定,加少量的注射用水润湿;2、取0.12g磺丁基-β环糊精加入4mL注射用水,搅拌使其溶解;3、将1中的溶液加入到2中,混合均匀,室温搅拌0.5~2h,制备得到冻干前溶液;4、将冻干前溶液过滤,灌装半加塞后冷冻干燥。将上述冻干前溶液并进行冷冻干燥制备曲贝替定冻干包合物。考察外观、水分、复溶性、pH值(如表5所示),采用紫外分光光度法表征包合物的形成(详见说明书附图3),并检测冻干后杂质含量变化及在25℃加速条件下的放置稳定性(如表6所示)。表5冻干后制品外观、水分、复溶性和pH值外观水分复溶性pH值复溶后溶液白色饼状1.47%良好7.39澄清透明溶液表6杂质含量检测及放置稳定性结论:采用3%的磺丁基-β环糊精即可以增溶曲贝替定,且制备得到的曲贝替定冻干制品的外观、水分合格,pH值变化不大,产品复溶性好,冻干制剂杂质检测结果符合限度要求;紫外扫描图谱结果显示,冻干制品中药物紫外吸收峰降低,表明磺丁基-β环糊精与曲贝替定形成了包合物,曲贝替定位于磺丁基-β环糊精疏水空腔中;冻干后的包合物在加速条件下稳定性良好。说明包合物可以提高曲贝替定在冻干过程及长期放置过程中的稳定性。实施例4以羟丙基-β环糊精为主体分子制备曲贝替定包合物,其中羟丙基-β环糊精的浓度为30%,冻干前溶液处方及方法如下:制备方法:1、取1.5mg曲贝替定,加入0.12ml无水乙醇溶解药物;2、取1.8g羟丙基-β环糊精加入4mL注射用水,搅拌使其溶解;3、将1中的溶液加入到2中,混合均匀,室温搅拌0.5~2h,制备得到冻干前溶液;4、将冻干前溶液过滤,灌装半加塞后冷冻干燥。将上述冻干前溶液并进行冷冻干燥制备曲贝替定冻干包合物。考察外观、水分、复溶性、pH值(如表7所示),采用紫外分光光度法表征包合物的形成(详见说明书附图4),并检测冻干后杂质含量变化及在25℃加速条件下的放置稳定性(如表8所示)。表7冻干后制品外观、水分、复溶性和pH值外观水分复溶性pH值复溶后溶液白色饼状1.72%良好7.37澄清透明溶液表8杂质含量检测及放置稳定性结论:采用10%的羟丙基-β环糊精制备得到的曲贝替定冻干制品的外观、水分合格,pH值变化不大,产品复溶性好,冻干制剂杂质检测结果符合限度要求;紫外扫描图谱结果显示,冻干制品中药物紫外吸收峰降低,表明羟丙基-β环糊精与曲贝替定形成了包合物,曲贝替定位于羟丙基-β环糊精疏水空腔中;冻干后的包合物在加速条件下稳定性良好。说明包合物可以提高曲贝替定在冻干过程及长期放置过程中的稳定性。实施例5以二葡糖基-β环糊精为主体分子制备曲贝替定包合物,其中二葡糖基-β环糊精的浓度为40%,冻干前溶液处方及方法如下:组成作用批次规模6mL用量曲贝替定活性成分0.25mg/mL1.5mg二葡糖基-β环糊精主体分子300mg/mL1.8g无水乙醇溶剂20mg/mL0.12g注射用水溶剂适量至体积适量至体积制备方法:1、取1.5mg曲贝替定,加入0.12ml无水乙醇溶解药物;2、取1.8g二葡糖基-β环糊精加入4mL注射用水,搅拌使其溶解;3、将1中的溶液加入到2中,混合均匀,室温搅拌0.5~2h,制备得到冻干前溶液;4、将冻干前溶液过滤,灌装半加塞后冷冻干燥。将上述冻干前溶液并进行冷冻干燥制备曲贝替定冻干包合物。考察外观、水分、复溶性、pH值(如表9所示),采用紫外分光光度法表征包合物的形成(详见说明书附图5),并检测冻干后杂质含量变化及在25℃加速条件下的放置稳定性(如表10所示)。表9冻干后制品外观、水分、复溶性和pH值外观水分复溶性pH值复溶后溶液白色饼状1.54%良好7.38澄清透明溶液表10杂质含量检测及放置稳定性结论:采用40%的二葡糖基-β环糊精制备得到的曲贝替定冻干制品的外观、水分合格,pH值变化不大,产品复溶性好,冻干制剂杂质检测结果符合限度要求;紫外扫描图谱结果显示,冻干制品中药物紫外吸收峰降低,表明二葡糖基-β环糊精与曲贝替定形成了包合物,曲贝替定位于二葡糖基-β环糊精疏水空腔中;冻干后的包合物在加速条件下稳定性良好,说明包合物可以提高曲贝替定在冻干过程及长期放置过程中的稳定性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1